Method Article
Un método modificado para el cateterismo intratecal en ratas
En este artículo
Resumen
En este artículo, presentamos un método modificado para el cateterismo intratecal en ratas que representa un enfoque simple, conveniente y confiable para la administración repetitiva de medicamentos intratecal.
Resumen
El cateterismo intratecal se ha aplicado ampliamente en experimentos con animales, especialmente en aquellos sobre el dolor neuropático. Sin embargo, los métodos tradicionales todavía tienen varias limitaciones. Aunque algunos investigadores han intentado mejorar los métodos tradicionales, los métodos disponibles aún necesitan ser modificados. En este trabajo presentamos un método modificado para el cateterismo intratecal en ratas.
Este método utiliza un alambre de acero inoxidable de 20 cm de largo (0,2 mm de diámetro), un tubo de plástico PE10 de 15 cm de largo, una tapa de sellado de fabricación propia y una banda antialérgica de 0,3 cm × 0,5 cm. Nuestro método modificado para el cateterismo intratecal tiene varias ventajas. En primer lugar, la introducción de un alambre de acero inoxidable en el tubo de PE10 aumenta la elasticidad del tubo, mejora la tasa de éxito del cateterismo intratecal, reduce la cantidad de espacio necesario para la operación y minimiza el daño a los tejidos que rodean la columna lumbar. En segundo lugar, la longitud del tubo de PE10 se determina antes de la cirugía, y el tiempo de permanencia del catéter puede ser superior a una semana. En tercer lugar, el tubo de PE10 se fija mediante una sutura en forma de 8, 4 veces, lo que evita el movimiento y la retracción del tubo cuando el animal se mueve. En cuarto lugar, se utiliza una tapa de sellado de fabricación propia para sellar el tubo de PE10, lo que no solo evita la fuga de líquido cefalorraquídeo, sino que también reduce la necesidad de cortar repetidamente el tubo de PE10. Finalmente, el extremo extracorpóreo del tubo de PE10 se ata con una banda, lo que evita la retracción del tubo cuando el animal se mueve.
Este método puede aumentar la tasa de éxito del cateterismo en ratas, ya que aproximadamente el 80% de los tubos de PE10 permanecieron en su lugar incluso 28 días después de la cirugía. Por lo tanto, este método modificado puede representar un enfoque simple, conveniente y confiable para la administración repetitiva de medicamentos intratecal.
Introducción
El cateterismo intratecal (también conocido como cateterismo subaracnoideo) en ratas es un método que consiste en insertar un catéter en el espacio subaracnoideo a través del espacio intervertebral1. Los fármacos se inyectan directamente en el espacio subaracnoideo a través del catéter, lo que ayuda a los investigadores a investigar los efectos de los fármacos en la médula espinal sin tener en cuenta los efectos de los fármacos que penetran la barrera hematoencefálica 2,3. Además, el líquido cefalorraquídeo puede ser recolectado después de un cateterismo intratecal para investigar el microambiente del sistema nervioso central 4,5. El método utilizado actualmente para el cateterismo intratecal fue establecido por primera vez por Yaksh y Rudy6 en 1976, y desde entonces, ha sido ampliamente aplicado en experimentos con animales en los campos de la neurociencia, la anestesia y la analgesia, la regulación cardiovascular mediada por la médula espinal y, especialmente, el dolor neuropático 2,7. Sin embargo, este método aún tiene varias limitaciones, como una alta incidencia de daño medular, hemorragia subaracnoidea, disfunción sensitiva y motora postoperatoria, alta mortalidad postoperatoria y un alto riesgo de deterioro neurológico 4,5,8,9,10 . En un intento por superar estas limitaciones, Størkson et al. propusieron el cateterismo del espacio subaracnoideo a través de los espacios interlumbares en 199611, y se reportó una mayor tasa de éxito postquirúrgico. En particular, la fijación del catéter permanente sigue siendo un desafío en este método, y la retracción del catéter es común debido al movimiento del animal, lo que hace que la administración intratecal del medicamento sea inconveniente.
Debido a las limitaciones anteriores, algunos investigadores 12,13,14,15 han intentado mejorar las herramientas para la punción, los métodos de cateterismo y los métodos de fijación del catéter, pero los métodos disponibles aún necesitan ser modificados debido a la dificultad de cuantificar el diámetro de las perlas utilizadas, la necesidad de punciones repetidas y la corta longitud del catéter. etcétera.11
De acuerdo con el abordaje lumbar para el cateterismo intratecal1y la técnica de Seldinger para el cateterismo de la vena central16 , desarrollamos un método para el cateterismo intratecal en ratas que utiliza un alambre de acero inoxidable, una tapa de sellado de fabricación propia y una banda antialérgica para simplificar el método existente. A través de este método, el catéter puede insertarse fácilmente en el espacio subaracnoideo y fijarse de manera estable en la espalda de la rata, y se evita la necesidad de punciones repetidas para la administración repetida de medicamentos intratecal.
En este artículo, presentamos un método modificado que puede mejorar la tasa de éxito del cateterismo intratecal en ratas y representa un enfoque simple, conveniente y confiable para la administración repetitiva de medicamentos intratecal.
Protocolo
El cateterismo intratecal se llevó a cabo en estricta conformidad con las recomendaciones de las Directrices para el Cuidado y Uso de Animales de Laboratorio de los Institutos Nacionales de Salud, y el protocolo fue aprobado por el Comité de Ética de Animales de Experimentación, China (No. TJBH15523201). En el experimento se utilizaron ratas macho Sprague-Dawley (SD). Se tuvo cuidado de minimizar el dolor y las molestias de los animales.
1. Preparación de materiales e instrumentos
NOTA: La preparación de materiales e instrumentos es muy importante para el éxito del cateterismo intratecal.
- Prepare un tubo de PE10 de 15 cm de largo (la longitud se determina de acuerdo con la distancia entre la cabeza de la rata y el extremo de la cola), inserte un alambre de acero inoxidable de 20 cm de largo (0,2 mm de diámetro) con dos extremos pulidos en el tubo PE10 como soporte, y marque el tubo a 2 cm de un extremo para indicar la profundidad de inserción (como se marca con cruces negras en la Figura 1A, B).
- Corte la punta afilada de una aguja de 22 G y selle el extremo distal (Figura 1C).
- Corte un catéter epidural (1,0 mm de diámetro externo) en fragmentos de 1 cm. A continuación, inserte un fragmento en una aguja de 22 G sin punta afilada (Figura 1D) y selle el extremo distal del fragmento con un par de pinzas rectas calentadas. Este aparato se denomina tapón de sellado del tubo (Figura 1E).
- Prepare una banda antialérgica de 0,3 cm × 0,5 cm cortando una cinta de seda (1,25 cm × 9,1 m) con unas tijeras (Figura 1F).
2. Preparación para la cirugía
- Preparar los instrumentos para el cateterismo intratecal esterilizándolos antes de la cirugía. Los instrumentos utilizados para la cirugía son pinzas dentadas, tijeras, un aparato de sonda nasogástrica, un mango de bisturí y cuchillas # 10. (Figura 2).
- Sumerja el tubo de PE10 y el alambre guía en etanol al 75% para la esterilización durante aproximadamente 2 h.
3. Cirugía
- Anestesiar a la rata con isoflurano al 3% a un caudal de 3 L/min.
- Coloque la rata en la mesa de operaciones y observe el reflejo de retirada al pellizcar la pata trasera con pinzas. La ausencia de movimiento de las patas traseras en respuesta a la estimulación confirmó el éxito de la anestesia. Administrar analgesia adecuada mediante inyección intramuscular de 1 mg/kg de meloxicam antes del cateterismo intratecal.
- Retire el vello de la región de la columna lumbar de la espalda y el área entre dos orejas con una afeitadora.
- Coloque un tubo centrífugo (de 3 cm de diámetro) debajo del abdomen de la rata en la unión cintura-cadera para aumentar la flexión en la columna lumbar, dando más espacio para que la aguja y el catéter pasen a través de él.
- Esterilice los sitios quirúrgicos (el área sobre la región de la columna lumbar y el área entre dos orejas) con una solución de povidona yodada y luego con una solución de etanol tres veces. Cubra la rata con un apósito aséptico y exponga los sitios quirúrgicos. A continuación, lave el tubo de PE10 y la guía con solución salina normal antes de la cirugía.
NOTA: La cola no estaba cubierta para que se pudiera observar el movimiento de la cola durante el cateterismo intratecal. - Determine la ubicación del espacio intervertebral entre L5 y L6 ubicando la apófisis espinosa de L6 en el punto medio entre las crestas ilíacas bilaterales izquierda y derecha. Fije la piel con el pulgar izquierdo y el dedo índice izquierdo del operador, y luego haga una incisión en la línea media de 3-4 cm de largo justo por encima de la apófisis espinosa entre L4 y S1.
- Separe sin rojez los tejidos subcutáneos con unas tijeras. Localice de nuevo el espacio intervertebral entre L5 y L6 y haga una pequeña incisión (0,3 - 0,5 cm) a ambos lados de las apófisis dorsales L5 y L6.
- Pinza y levanta la apófisis dorsal L5 con un par de pinzas dentadas para expandir el espacio intervertebral. Luego, separe sin rodeos los músculos alrededor del cuerpo vertebral con un par de tijeras hasta que la parte superior de la apófisis dorsal L6 quede completamente expuesta.
NOTA: Se debe evitar la extirpación de cualquier parte del cuerpo vertebral y de los músculos, con el objetivo de minimizar el daño a los tejidos circundantes. - Cuando la apófisis dorsal L5 se levanta con un par de pinzas dentadas y el espacio intervertebral se expande con otro par de pinzas, limpie el espacio intervertebral L5-6 con una bola de algodón hasta que el área de la "V" invertida quede completamente expuesta.
- Perfore la columna vertebral con una aguja de 23 G en el área de la "V" invertida, justo debajo de la parte superior de la apófisis dorsal L6.
NOTA: Se observa un movimiento de la cola y/o un líquido transparente incoloro fluye desde el espacio subaracnoideo, lo que indica una punción exitosa en el espacio subaracnoideo. - Inserte con cuidado el tubo de PE10 que contiene alambre de acero inoxidable en el canal espinal en el sitio de punción, inclinándolo 30° hacia la cola. Ajuste el ángulo de inserción hasta que el tubo PE10 pueda insertarse con éxito sin resistencia (se observó un movimiento de la cola durante este proceso).
- Cuando el área marcada del tubo de PE10 llega al músculo posterior, se detiene el cateterismo.
- Retire lentamente el alambre de acero inoxidable del tubo de PE10. Se puede observar un movimiento de la cola.
NOTA: Se puede observar un movimiento de la cola y, después de retirar el cable, puede fluir un líquido transparente (o un líquido rojo claro) fuera del tubo. - A continuación, conecte el tubo de PE10 a una jeringa de 1 mL, a través de la cual se inyectan 20 μL de solución salina normal. Después de retirar la jeringa, la solución salina fluirá continuamente fuera del tubo de PE10, lo que indica que se ha insertado con éxito en el espacio subaracnoideo.
- Una vez que se confirme que el tubo PE10 no está obstruido, sutura los músculos de un lado del cuerpo vertebral con una sutura 4-0 y haga un nudo. A continuación, ata la sutura alrededor del tubo de PE10 y haz otro nudo. No corte la sutura; suturar los músculos del otro lado; Vuelva a atar la sutura al tubo de PE10, haga un tercer nudo y corte la sutura.
NOTA: Este proceso fija el tubo de PE10 con una sutura en forma de 8 para reducir la posibilidad de desplazamiento y retracción del tubo. - Haga una incisión de 0,5 cm de largo 1 cm por debajo del punto medio entre las orejas. Separe sin romos los tejidos subcutáneos con unas tijeras e inserte un tubo de sonda nasogástrica de metal hacia la cola hasta que la punta sea visible en la incisión lumbar.
- Inserte el extremo distal del tubo de PE10 en el tubo de sonda hasta que el tubo de PE10 salga por el otro extremo del tubo de sonda nasogástrica; A continuación, retire suavemente la sonda nasogástrica.
- Cuando se confirme que el tubo de PE10 vuelve a estar sin obstrucciones, sutura los músculos restantes alrededor de la incisión lumbar con una sutura 4-0, ate la sutura alrededor del tubo de PE10 y haga otro nudo para volver a fijar el tubo de PE10.
- Suturar la piel, evitando dañar el tubo de PE10. Luego, sutura la piel del cuello con una sutura 4-0, ata la sutura alrededor del tubo de PE10 y haz un nudo para fijar el tubo de PE10.
- Cuando se confirme que el tubo de PE10 vuelve a estar sin obstrucciones, selle el extremo extracorpóreo del tubo de PE10 con una tapa de sellado.
- Seque el tubo de PE10 con un trozo de pañuelo de papel y luego ate la banda antialérgica alrededor del tubo de PE10 varias veces para evitar la retracción del tubo de PE10 durante el movimiento de la rata.
4. Experimento de validación de lidocaína
- Después de la cirugía, regrese a la rata a su jaula (una por jaula) y vigílela de cerca durante la recuperación de la anestesia hasta que la rata recupere la conciencia.
- Una vez que la rata esté completamente despierta, retire la tapa de sellado e inyecte 20 μL de lidocaína al 2% en el tubo de PE10 a una tasa de 0,02 mL/s a través de una jeringa Hamilton, seguido de la inyección de 10 μL de solución salina normal.
- Selle el tubo PE10 con la tapa de sellado.
- Coloque la rata sobre una mesa y observe cuidadosamente. La presencia de parálisis de las extremidades posteriores después de una inyección intratecal de lidocaína (del tubo de PE10) indica un cateterismo exitoso (Figura 3). La parálisis de las extremidades posteriores suele durar aproximadamente 30 min10.
NOTA: Deje que la rata se recupere durante 5-7 días antes de los siguientes experimentos. - Vigile de cerca a la rata durante el período de recuperación hasta la recuperación completa de la función de las extremidades.
Resultados
Para la inyección intratecal, se cortó la punta extracorpórea del tubo de PE10 y el tubo de PE10 se selló con una tapa de sellado entre dos inyecciones de fármacos. En nuestro estudio piloto, la tasa de éxito del cateterismo intratecal fue de aproximadamente el 95% (19 de 20 ratas); El éxito se indicó mediante un movimiento de la cola y/o la liberación de un líquido transparente incoloro durante el procedimiento. Aproximadamente el 85 % de las trompas permanecieron en su lugar 7 días después de la cirugía, y aproximadamente el 80 % permanecieron en su lugar 28 días después de la cirugía. Las ratas se recuperaron poco después de la operación y no se observaron complicaciones dentro de los 7 días posteriores a la cirugía. El movimiento diario era normal y no se observó anormalidad conductual. Estos resultados indican que nuestro método es superior a los reportados previamente en cuanto a la tasa de éxito y la tasa de permanencia prolongada.
La parálisis completa de los miembros inferiores tras la inyección de lidocaína a través de catéteres indica un cateterismo intratecal exitoso15. La tasa de éxito del cateterismo intratecal se calcula dividiendo el número total de ratas por el número de ratas con cateterismo exitoso. Con nuestro método modificado, la tasa de éxito fue del 95%, superior a la tasa alcanzada con el método reportado por Hou et al. (88%)15. Esto se muestra en la Figura 4.
El tubo intratecal se monitorizó a los 2, 5 y 7 días después del cateterismo intratecal y se calculó la tasa de éxito del catéter permanente como el número de ratas con catéter permanente exitoso/número total de ratas × 100%. A los 2, 5 y 7 días después del cateterismo intratecal, la tasa de éxito del catéter permanente fue del 94%, 81% y 65%, respectivamente, en el estudio de Størkson et al.11. La tasa de éxito del catéter permanente a los 2, 5 y 7 días después del cateterismo intratecal fue del 95%, 90% y 85%, respectivamente, con nuestra técnica (Figura 5).

Figura 1. Materiales e instrumentos utilizados para el cateterismo intratecal. (A) Se preparó un tubo PE10 de 15 cm de largo, y el tubo se marcó a 2 cm de un extremo para indicar la profundidad de inserción. (B) Se insertó un alambre de acero inoxidable de 20 cm de largo con dos extremos pulidos en el tubo PE10 como soporte. (C) La punta afilada de la aguja 22G se cortó con un par de tijeras y el extremo distal se selló con un par de pinzas. (D) Se cortó un catéter epidural (1,0 mm de diámetro externo) en fragmentos de 1 cm, que luego se insertaron en la aguja 22G sin punta afilada. (E) El extremo distal del catéter epidural se selló con un par de pinzas rectas calentadas; A este aparato se le llamaba tapón de sellado del tubo. (F) Se preparó una banda antialérgica de 0,3 cm × 0,5 cm (cinta de seda, 1,25 cm × 9,1 m) con unas tijeras. Haga clic aquí para ver una versión más grande de esta figura.
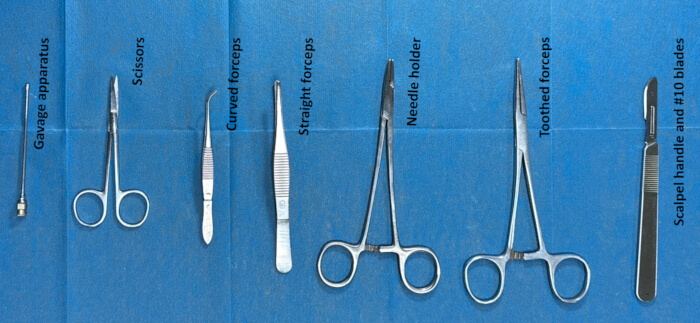
Figura 2. Preparación de instrumental para el cateterismo intratecal. Los instrumentos (como pinzas dentadas, tijeras, un aparato de sonda nasogástrica, un mango de bisturí y cuchillas #10) se esterilizaron con etanol durante aproximadamente 2 h y luego se lavaron con solución salina normal aproximadamente 30 min antes de la cirugía. Haga clic aquí para ver una versión más grande de esta figura.
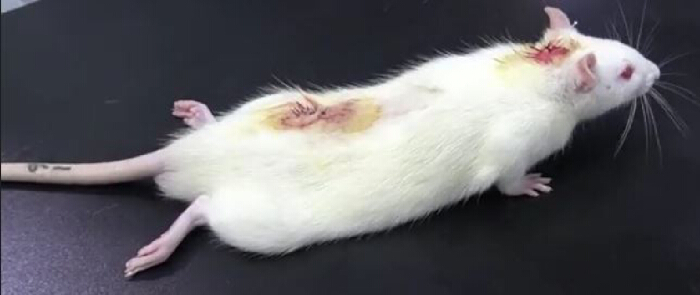
Figura 3. Resultados del experimento de validación de lidocaína tras el cateterismo intratecal. Después de la inyección intratecal de 20 μL de lidocaína al 2% seguida de la inyección de 10 μL de solución salina normal, la rata quedó temporalmente paralizada: la parálisis de las extremidades inferiores ocurrió dentro de los 30 s y desapareció 30 min después, lo que indica un cateterismo intratecal exitoso. Haga clic aquí para ver una versión más grande de esta figura.
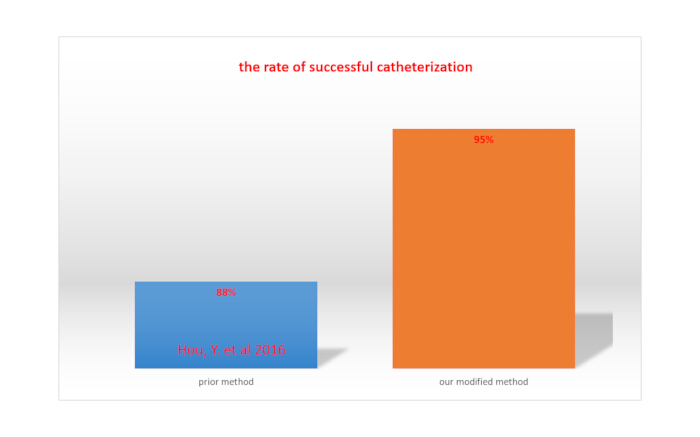
Figura 4. Comparación de la tasa de cateterismo exitoso entre nuestro método modificado y un método previamente reportado. Haga clic aquí para ver una versión más grande de esta figura.
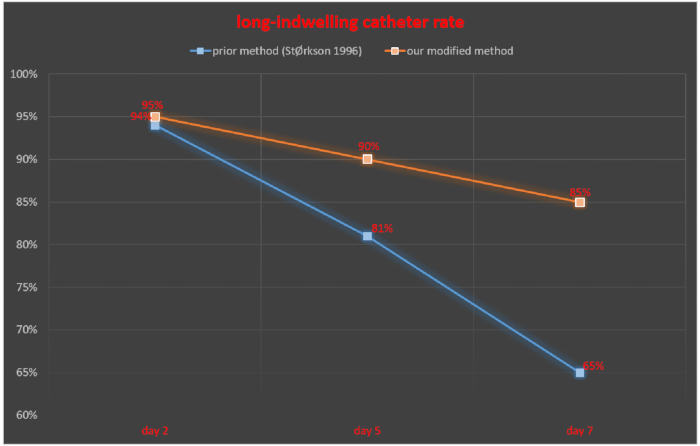
Figura 5. Comparación de la tasa de catéteres de larga permanencia entre nuestro método modificado y un método previamente informado. Haga clic aquí para ver una versión más grande de esta figura.
| Método modificado | Método previo | Ventajas del método modificado | Desventajas del método anterior | |
| Método de guía para la inserción | un alambre de acero inoxidable | Cánula guía (20G 0,9× 38 mm) | Aumenta la elasticidad del tubo, | La resistencia es difícil de sentir, lo que aumenta la dificultad de operación |
| Mejora la tasa de éxito del cateterismo intratecal | Daño a los tejidos debido a punciones repetidas | |||
| Reduce el requerimiento de espacio operativo | Un extremo del tubo se estira a 1,5 veces la longitud original, lo que hace que el diámetro de ambos extremos sea diferente | |||
| Minimiza el daño a los tejidos que rodean la columna lumbar | Susceptibilidad a la fuga de líquido cefalorraquídeo debido a que el diámetro de la cánula guía de 20G es 2 veces o más que el del tubo de PE10 estirado | |||
| Longitud del tubo PE10 | 15 cm | 14 o 28 cm | Fácil de determinar la longitud del tubo de PE10 independientemente de la duración de la permanencia del catéter | La duración de la permanencia del catéter es más corta para el tubo de PE10 más corto; susceptibilidad a caerse del cuerpo durante un tubo largo de PE10 |
| Método de fijación | Sutura "8" y 4 tiempos | 1 o 2 cuentas | Evita el movimiento y retracción del tubo durante las actividades con los animales | Diferencia en el diámetro del tubo en ambos extremos y susceptibilidad al desplazamiento del tubo de PE10 durante la fabricación del cordón |
| Método para el sellado de tubos | Gorra de fabricación propia | No | Previene la fuga de líquido cefalorraquídeo | Requisito de corte repetido del tubo PE10 |
| Evita el corte repetido del tubo PE10 | ||||
| Método para la prevención de la retracción | Banda antialérgica | 1 o 2 cuentas | Evita que el tubo se retraiga durante las actividades de los animales | Susceptibilidad a la retracción |
Tabla 1. Ventajas y desventajas del método modificado y de un método previamente informado.
Discusión
Hay varios consejos críticos para que este método modificado maximice la tasa de éxito del cateterismo intratecal. En primer lugar, se debe preparar un alambre de acero inoxidable de 20 cm de largo con dos extremos pulidos e insertarlo en el tubo de PE10 como soporte. En segundo lugar, el operador debe exponer completamente el área de la "V" invertida después de limpiar el espacio intervertebral L5-6 con una bola de algodón, y el espacio intervertebral debe expandirse con otra pinza mientras levanta la apófisis dorsal L5 con pinzas dentadas. En tercer lugar, el tubo de PE10 debe fijarse con una sutura en forma de 8 cuatro veces. Finalmente, el extremo extracorpóreo del tubo de PE10 debe atarse con una banda y sellarse con una tapa de fabricación propia.
La tasa de éxito del cateterismo intratecal y el daño a los tejidos alrededor de los cuerpos vertebrales pueden influir significativamente en la fiabilidad de los resultados experimentales15. Por lo tanto, mejorar la tasa de éxito tanto como sea posible y reducir el daño a los tejidos circundantes son cruciales para establecer modelos animales y experimentos relevantes1. En este método modificado, se inserta un alambre de acero inoxidable en el tubo de PE10 para guía, lo que aumenta la elasticidad del tubo y mejora la tasa de éxito del cateterismo intratecal. Además, la cantidad de espacio necesario para la operación se reduce con este método modificado, y el daño a los tejidos alrededor de la columna lumbar se minimiza porque los tejidos circundantes se separan sin rodeos, pero no se cortan. En comparación, en el método11 descrito anteriormente, se utiliza una cánula guía de 20 G para reducir la resistencia durante la punción, y a menudo es necesario repetir la punción, lo que puede lesionar los tejidos. Además, en el método descrito anteriormente, para reducir el diámetro del tubo de PE10, se sumerge en agua tibia (60 °C) y luego se estira en un extremo hasta aproximadamente el 150% de la longitud original, lo que puede no garantizar la consistencia del diámetro del tubo y, por lo tanto, puede causar fugas de líquido cefalorraquídeo porque el diámetro de la cánula guía de 20G es aproximadamente dos veces mayor o igual al del tubo de PE10 estirado. Además, en nuestro método, la función lumbar se conserva al máximo, lo que evita la influencia de la cirugía en los resultados de experimentos posteriores. Estos resultados son consistentes con los reportados por Xu et al2.
En el método11 descrito anteriormente, la longitud del tubo de PE10 es de aproximadamente 14 cm si el tubo se fija en el sitio alrededor del sitio de punción, pero el tiempo de permanencia del catéter suele ser inferior a 7 días en estas condiciones (o la rata retira el tubo del cuerpo). La longitud del tubo de PE10 es de aproximadamente 28 cm si el tubo está fijado en la parte posterior del cuello, que es significativamente más largo que el tubo de PE10 utilizado en nuestro método (15 cm). A pesar de que las perlas se formaron siguiendo el protocolo descrito por Størkson et al.11, algunas trompas fueron retiradas del cuerpo, y solo aproximadamente el 65% de las trompas seguían fijadas en su lugar a los 7 días después de la cirugía, lo que afectó significativamente los resultados de los experimentos posteriores. En nuestro método, el tubo de PE10 se fija con una sutura en forma de 8 4 veces, y el extremo extracorpóreo del tubo de PE10 se ata con una banda para reducir la posibilidad de desplazamiento y retracción. Siguiendo nuestro método, aproximadamente el 85% de las trompas permanecieron en su lugar a los 7 días después de la cirugía, y aproximadamente el 80% de las trompas permanecieron en su lugar a los 28 días después de la cirugía.
En el método11 previamente reportado, la punta extracorpórea del catéter intratecal debe cortarse para cada administración de fármaco. Sin embargo, la administración intratecal repetida de fármacos puede acortar el tiempo de permanencia del catéter, lo que dificulta la administración intratecal de fármacos. Por lo tanto, en nuestro método, se utiliza una tapa de fabricación propia para sellar el tubo PE10, que se esteriliza con etanol una vez al día. Esto no solo evita la fuga de líquido cefalorraquídeo, sino que también reduce la necesidad de cortar repetidamente el tubo de PE10 para la administración intratecal de fármacos, lo que garantiza la administración eficaz de los fármacos.
Las ventajas y desventajas del método modificado y del método informado anteriormente se resumen en la Tabla 1. En primer lugar, para el método modificado, el uso de alambre de acero inoxidable en el tubo de PE10 aumenta la elasticidad del tubo y mejora la tasa de éxito del cateterismo intratecal, se reduce la cantidad de espacio necesario para la operación y se minimiza el daño a los tejidos que rodean la columna lumbar. En el método descrito anteriormente, se inserta una cánula guía de 20G hasta que se siente resistencia, y a menudo es necesaria una punción repetida, lo que puede resultar en daño a los tejidos. Además, el tubo de PE10 en un extremo se estira hasta que su longitud alcanza aproximadamente el 150% de la longitud original, lo que puede causar fugas de líquido cefalorraquídeo porque el diámetro de la cánula guía de 20G es 2 veces mayor o igual al del tubo de PE10 estirado. En segundo lugar, en el método modificado, la longitud del tubo de PE10 se determina antes de la cirugía, y el tiempo de permanencia del catéter puede ser superior a una semana. En el método descrito anteriormente, la longitud del tubo de PE10 es de aproximadamente 14 cm si se fija en el sitio de punción, pero el tiempo de permanencia del catéter suele ser inferior a 7 días porque el tubo es susceptible de ser sacado del cuerpo por la rata; la longitud del tubo de PE10 es de aproximadamente 28 cm si se fija en la parte posterior del cuello, que es significativamente más larga que la longitud del tubo utilizada en nuestro método. En tercer lugar, en el método modificado, el tubo de PE10 se fija con una sutura en forma de 8 4 veces para evitar el movimiento y la retracción del tubo; se utiliza una tapa de fabricación propia para sellar el tubo de PE10, lo que no solo evita la fuga de líquido cefalorraquídeo, sino que también evita la necesidad de cortar repetidamente el tubo de PE10. En el método informado anteriormente, es difícil obtener cuentas con un diámetro constante, el desplazamiento del tubo de PE10 es común cuando se forman cuentas y, a menudo, es necesario cortar repetidamente el tubo de PE10. Finalmente, en el método modificado, el extremo extracorpóreo del tubo de PE10 se ata con una banda, lo que evita que el tubo se retraiga durante el movimiento. Sin embargo, en el método anterior, las perlas no pueden prevenir de manera confiable la retracción del tubo de PE10 porque es difícil obtener perlas con un diámetro constante.
En general, este método modificado para el cateterismo intratecal tiene las siguientes ventajas. En primer lugar, el uso de alambre de acero inoxidable en el tubo de PE10 aumenta la elasticidad del tubo y mejora la tasa de éxito del cateterismo intratecal, se reduce la cantidad de espacio necesario para la operación y se minimiza el daño a los tejidos que rodean la columna lumbar, lo que preserva la función lumbar en la mayor medida posible y evita la influencia de la cirugía en los resultados de experimentos posteriores. En segundo lugar, el tubo PE10 se fija con una sutura en forma de 8 4 veces, lo que evita el movimiento y la retracción del tubo durante el movimiento. En tercer lugar, se utiliza una tapa de sellado de fabricación propia para sellar el tubo de PE10, lo que no solo evita la fuga de líquido cefalorraquídeo, sino que también evita la necesidad de cortar repetidamente el tubo de PE10. El corte repetido del catéter puede acortarlo, lo que hace que la administración de medicamentos sea inconveniente. Finalmente, el extremo extracorpóreo del tubo de PE10 se ata con una banda antialérgica, lo que evita que el tubo se retraiga durante el movimiento.
Sin embargo, existen varias limitaciones en esta técnica de cateterismo intratecal modificado. Primero, después de la cirugía, las ratas deben alojarse por separado (una por jaula) para evitar daños en el extremo extracorpóreo del tubo de PE10. En segundo lugar, es necesaria la recuperación durante 5-7 días después de la inyección intratecal de lidocaína antes de los experimentos posteriores.
En conclusión, este método modificado para el cateterismo intratecal puede servir como una herramienta útil para la administración intratecal repetitiva de fármacos y representar una forma sencilla, cómoda y fiable de acortar la duración de los experimentos.
Divulgaciones
Los autores de este manuscrito declaran que no existen conflictos de intereses.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación Nacional de Ciencias Naturales (Nº 81971042) y de la Comisión de Salud del Distrito de Shanghái Hongkou (No. HKZK2020A06).
Materiales
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | Jiangxi Hongda Medical Equipment Co., Ltd | 1 cc | |
| 22 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 22G | |
| 23 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 23G | |
| 25 μL Hamilton Syringes | Shanghai Bolige Co.,Ltd | 0.31mm 25 μL | |
| 4-O MERSILK NON-ABSORBABLE SUTURE | ETHICON | SA83G | |
| 50 mL corning centrifuge tubes 3 cm diameter | 430820 | CORNING | |
| Epidural catheter and connector | Henan Tuoren Medical Device Co., Ltd | regular type | |
| Gavage apparatus | Shanghai Bolige Co.,Ltd | 8# | |
| PE-10 Mirco Medical Tubing | BB31695-PE/1 | Scientific Commodities, Inc | |
| Scalpel handle and #10 blades | Jiangsu Songxin Medical Equipment Co., Ltd | 125mm | |
| Scissors | Jiangsu Songxin Medical Equipment Co., Ltd | 100mm | |
| Sprague-Dawley (SD) rats | Shanghai BK/KY Biotechnology Co., Ltd | Male | |
| Stainless steel wire 0.2 mm diameter | Dongguan Jiazhi Metal Products Technology Co., Ltd. | 0.2mm × 1m | |
| Toothed forceps | Jiangsu Songxin Medical Equipment Co., Ltd | 18cm | |
| URGO silk tape | URGO | 1.25cm × 9.1m |
Referencias
- Kong, G., Huang, Z., Zhu, Q., Wan, Y. Comparison of two modified methods of intrathecal catheterization in rats. Exp Anim. 69 (2), 219-223 (2020).
- Xu, C. S., Sun, P., Lin, C. a new design puncture needle and a device of microcatheter protection for lumbar intrathecal catheterization in rats. Zhongguo Ying Yong Sheng Li Xue Za Zhi. 36 (3), 283-288 (2020).
- Yamamoto, G., et al. Neurosteroid dehydroepiandrosterone sulphate enhances pain transmission in rat spinal cord dorsal horn. Br J Anaesth. 123 (2), e215-e225 (2019).
- Mattioli, T. A., Sutak, M., Milne, B., Jhamandas, K., Cahill, C. M. Intrathecal catheterization influences tolerance to chronic morphine in rats. Anesth Analg. 114 (3), 690-693 (2012).
- Wang, B. C., Hillman, D. E., Li, D., Turndorf, H. Lumbar subarachnoid catheterization in rats. Pharmacol Biochem Behav. 38 (3), 685-688 (1991).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Martin, H., Kocher, L., Chery-Croze, S. Chronic lumbar intrathecal catheterization in the rat with reduced-length spinal compression. Physiol Behav. 33 (1), 159-161 (1984).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. J Neurosci Methods. 280, 36-46 (2017).
- Zhang, S. X., Huang, F., Gates, M., White, J., Holmberg, E. G. Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury. J Neurosci Methods. 191 (2), 201-207 (2010).
- Ohara, P. T. Long-term intrathecal catheterization in the rat. J Neurosci Methods. 110 (1-2), 81-89 (2001).
- StØrkson, R. V., KjØrsvik, A., TjØlsen, A., Hole, K. Lumbar catheterization of the spinal subarachnoid space in the rat. J Neurosci Methods. 65 (2), 167-172 (1996).
- Poon, Y. Y., Chang, A. Y., Ko, S. F., Chan, S. H. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat. Anesth Analg. 101 (1), table of contents 155-160 (2005).
- Xu, F., Li, T., Zhang, B. An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods. 183 (2), 114-118 (2009).
- Igawa, Y., Andersson, K. E., Post, C., Uvelius, B., Mattiasson, A. A rat model for investigation of spinal mechanisms in detrusor instability associated with infravesical outflow obstruction. Urol Res. 21 (4), 239-244 (1993).
- Hou, Y., et al. A modified procedure for lumbar intrathecal catheterization in rats. Neurol Res. 38 (8), 725-732 (2016).
- Farhadi, E., et al. Comparison of open and ultrasound-guided placement of central venous catheter in children weighing less than five kilograms; a randomized clinical trial. Acad Radiol. 30 (7), 1419-1425 (2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados