Method Article
Identificación guiada por bioensayos de productos naturales para el biocontrol mediante cromatografía en capa fina-Bioautografía directa
En este artículo
Resumen
Describimos el uso de cromatografía en capa fina, ensayo de bioautografía directa y cromatografía líquida-espectrometría de masas para identificar productos naturales microbianos que muestran antagonismo contra patógenos fúngicos utilizando el patógeno Sclerotinia sclerotiorum y aislados bioplaguicidas de Bacillus como sistema modelo.
Resumen
La cromatografía en capa fina-bioautografía directa (TLC-DB) es un bioensayo bien establecido que se utiliza para separar e identificar productos naturales (NP) que son antagónicos contra un patógeno objetivo. Es una opción rápida, económica y sencilla para el aislamiento e identificación de NP guiados por bioensayos que dependen de la separación por TLC junto con la aplicación directa de un patógeno objetivo para examinar la bioactividad. Por lo general, se utiliza para el análisis de extractos de plantas bioactivas, detectando actividad inhibitoria contra bacterias, hongos y enzimas. Dicho esto, tiene un gran potencial en el descubrimiento de NP bacterianas, particularmente para evaluar NP bacterianas contra patógenos agrícolas pertinentes, lo cual es valioso para descubrir y desarrollar nuevos biopesticidas para la industria agrícola. Además, es un protocolo sintonizable que podría aplicarse a otros patógenos objetivo o fuentes de NP en programas de investigación relacionados con el descubrimiento e identificación de compuestos bioactivos. En este trabajo se describe un sistema modelo para el descubrimiento e identificación de NPs bioplaguicidas utilizando TLC-DB con Bacillus spp. y el patógeno agrícola Sclerotinia sclerotiorum.
Introducción
Los patógenos agrícolas fúngicos causan pérdidas significativas en la calidad y el rendimiento de los cultivos en todo el mundo, lo que contribuye a los desafíos económicos y de suministro de un sistema mundial de producción de alimentos estable 1,2. El daño de los patógenos puede prevenirse mediante el mejoramiento de cultivares resistentes a la infección y el uso de sistemas integrados de manejo de cultivos, incluidas las rotaciones de cultivos y las prácticas de manejo de la tierra para suprimir la proliferación de patógenos 3,4. Aunque estos métodos reducen el daño a los cultivos, los pesticidas químicos generalmente se usan en conjunto para matar activamente las estructuras reproductivas de hongos en el campo y prevenir aún más el daño y la reducción del rendimiento. Aunque efectivo, el uso de plaguicidas químicos tiene muchos inconvenientes, incluido el daño a los ecosistemas circundantes, la disminución de la fertilidad del suelo, los riesgos asociados para la salud humana y el desarrollo de resistencia a patógenos, lo que hace que se requieran dosis más altas de pesticidas cada año 5,6,7.
Los productos de control de plagas y patógenos basados en microbios se han considerado durante mucho tiempo como posibles alternativas o complementos a los plaguicidas sintéticos. Desde principios de 1900, Bacillus thuringiensis ha sido ampliamente utilizado para controlar plagas y patógenos agrícolas como tratamiento de semillas, como pulverización foliar y en el tratamiento directo del suelo8. Dichos productos han sido denominados bioplaguicidas y se caracterizan como microorganismos naturales o bioquímicos que pueden matar, suprimir o reducir el vigor de una plaga o patógeno objetivo. Los bioplaguicidas pueden controlar el crecimiento de un patógeno a través de varios mecanismos, pero lo más común es que lo hagan a través de la secreción de metabolitos secundarios9. Los metabolitos secundarios, a menudo denominados productos naturales, no están involucrados en el metabolismo primario, pero se producen como una ventaja evolutiva para superar a otros microorganismos10.
Los bioplaguicidas ofrecen muchas ventajas sobre sus homólogos sintéticos. Presentan un riesgo de baja toxicidad para el medio ambiente, la fauna y los seres humanos en comparación con los productos sintéticos de control de plagas 9,10. Dado que la mayoría de los bioplaguicidas han existido naturalmente en el medio ambiente durante milenios, existen vías de biodegradación de los metabolitos microbianos en el medio ambiente, lo que limita la posibilidad de contaminación del suelo o del ecosistema y reduce los tiempos de residencia que contribuyen a que los plaguicidas sintéticos sean tan destructivos para el medio ambiente11. Además, muchos bioplaguicidas utilizados para mitigar la infección por patógenos también exhiben propiedades promotoras del crecimiento de las plantas, lo que puede aumentar la biodisponibilidad de nutrientes e inducir resistencia sistémica de las plantas12.
Lo más común es que los bioplaguicidas se apliquen en forma de inóculo microbiano y las NP sean secretadas por microorganismos vivos in situ12,13. En tal caso, identificar la fuente de la actividad de un bioplaguicida es de gran valor. De este modo, se obtiene información sobre el mecanismo de acción del biopesticida, se ayuda a construir un caso para la protección de un microorganismo con una patente y puede tener un impacto científico significativo si sus estructuras son novedosas. Sin embargo, lo más importante es que la identificación de la fuente bioactiva informa sobre las posibilidades de formulación de un producto bioplaguicida posterior. Si la NP en sí misma es activa, se puede utilizar el microorganismo como fábrica de biomoléculas para la producción de biopesticidas a gran escala. Además, muchas NP que se han explorado para el control biológico también tienen aplicaciones potenciales en la medicina humana, lo que las hace aún más valiosas económicamente8.
Los ensayos de cromatografía en capa fina-bioautografía directa (TLC-DB) son un método económico y sencillo para el aislamiento e identificación de metabolitos bioplaguidas guiados por bioactividad. Aunque la técnica se utiliza comúnmente para separar las pruebas de bioactividad de los fitoquímicos de los extractos crudos de plantas, también tiene un gran potencial para el análisis de extractos microbianos14. TLC proporciona una separación rápida y económica de NP en un extracto microbiano crudo, y después de recubrirlo con una suspensión de patógenos medios, las zonas que contienen metabolitos activos se visualizan fácilmente. Esas zonas pueden extraerse de la placa y extraerse para su análisis químico mediante cromatografía líquida de ultra alta resolución junto con espectrometría de masas (UPLC-MS) para identificar metabolitos conocidos. Los metabolitos que no coinciden con los compuestos previamente reportados pueden ser aislados en mayores cantidades a través de cromatografía líquida para someterse a estudios de elucidación de estructuras utilizando técnicas como la espectroscopia de resonancia magnética nuclear y la cristalografía de rayosX 15.
En este artículo se describe un sistema modelo para el descubrimiento e identificación de NPs bioplaguicidas utilizando TLC-DB con Bacillus spp. y el patógeno agrícola Sclerotinia sclerotiorum. La Figura 1 proporciona una descripción general esquemática del procedimiento TLC-DB.
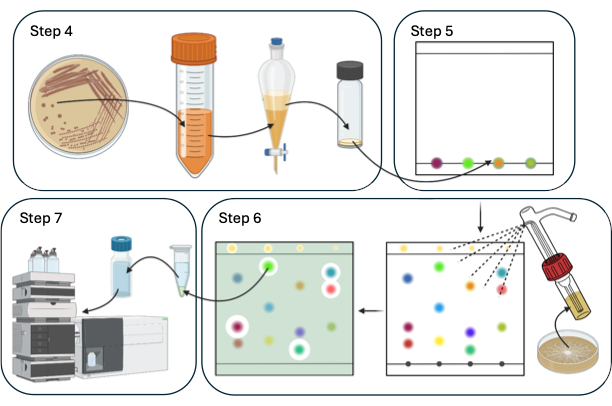
Figura 1: Resumen esquemático de los pasos 4-7 del procedimiento de TLC-DB. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
Los detalles de los reactivos y el equipo utilizado en este estudio se enumeran en la Tabla de Materiales.
1. Selección de los candidatos a biocontrol microbiano
- Mediante ensayos de placa de competición, seleccione aislados microbianos que muestren antagonismo contra el patógeno de interés.
NOTA: Se seleccionaron nueve aislados de Bacillus que exhibieron antagonismo contra S. sclerotiorum , incluyendo las especies de Bacillus atrophaeus, mojavensis y subtilis , para demostrar este protocolo.
2. Preparación de los medios
- Preparar agar patata dextrosa (PDA) disolviendo 39 g de medio por litro de agua.
- Prepare Pseudomonas F agar añadiendo 45 g de medio por litro de agua.
- Preparar caldo de patata dextrosa (PDB) con agar al 1% añadiendo 24 g de medio, y 0,24 g de agar por litro de agua.
- Prepare el caldo de levadura-glucosa-manganeso (YGM). Cree una solución tampón que consista en 2,5 g de KH2PO4 y 2,5 g de K2HPO4 en 100 ml de agua, y una solución salina que consista en 0,58 g de MnSO4. H20, 0,5 g de NaCl y 0,05 g de FeSO 4,7H20 en 100 mL de agua.
- A continuación, agregue 1 g de extracto de levadura, 1,25 g de dextrosa, 400 mL de agua, 5 mL de la solución tampón, 5 mL de la solución salina y 90 mL de agua para asegurarse de que las sales metálicas no precipiten en la solución.
- Esterilizar el medio en autoclave, verter el agar en placas de Petri de 100 x 15 mm y dejar enfriar todo a temperatura ambiente antes de usarlo.
3. Preparación de patógenos
- Cultivar cinco placas de Sclerotinia sclerotiorum en PDA (preparado en el paso 2.1) e incubar a 25 °C durante 3 días.
4. Preparación del extracto de producto natural
- Cultive cada aislado bacteriano en agar Pseudomonas F (preparado en el paso 2.2) y crezca hasta que se observen colonias individuales.
- Subcultive colonias bacterianas individuales en 25 mL de medio YGM en tubos de centrífuga o cultivo e incube agitando durante 3 días.
- Transfiera 5 mL de alícuotas de cada extracto a 1 L de YGM e incube en las mismas condiciones durante otros 3 días.
- Centrifugar cada cultivo a 3000 x g durante 15 min a 25 °C para granular las células.
- Decantar y lavar el sobrenadante tres veces con acetato de etilo para extraer los metabolitos del medio de cultivo.
- Combine y seque la capa de acetato de etilo de cada uno mediante evaporación rotativa.
- Vuelva a disolver el extracto en un mínimo de metanol, transfiéralo a un pequeño vial de centelleo y séquelo nuevamente por evaporación rotativa.
NOTA: Si el extracto se seca hasta convertirse en un material aceitoso o resinoso, liofililice el material para obtener un polvo seco que se pueda pesar con precisión.
5. Preparación de la placa TLC
- Prepara el plato TLC de 20 cm x 20 cm dibujando una línea a 2 cm de la parte inferior y a 2 cm de la parte superior del plato. En la línea inferior, coloque nueve puntos a 2 cm de distancia. Encima de la línea superior, coloque cuatro puntos a 4 cm de distancia.
- Disolver 5 mg de cada extracto en 15 μL de metanol y aplicar 5 μL de cada extracto en los nueve puntos marcados en la línea inferior con una pipeta. Deje que cada mancha de extracto se seque en la placa TLC y aplique otras 5 μL de alícuota en la misma mancha. Repita hasta que todo el material esté cargado en la placa TLC.
- Revele la placa TLC en un tanque de revelado utilizando una solución 1:2 de diclorometano y metanol hasta que el solvente alcance la línea marcada a 2 cm de la parte superior de la placa (aproximadamente 45 min).
- Una vez desarrollado, retire la placa TLC y aplique una serie de controles positivos en los cuatro puntos marcados sobre la línea de disolvente. Se utilizan cuatro concentraciones del mismo control. Para S. scl., 0,5 μg/mL, 5 μg/mL, 50 μg/mL y 500 μg/mL de higromicina B son controles positivos.
- Antes de que todo el solvente se evapore de la placa, colóquela en una caja de placa TLC esterilizada con etanol.
6. Ensayo de bioautografía directa
- Esterilizar en autoclave los materiales que se utilizarán en el ensayo (componentes de vidrio del pulverizador de cromatografía, espátula metálica, cuatro hojas de papel toalla, celulosa o papel de filtro, agua y medios) en un vaso de precipitados grande cubierto con papel de aluminio.
NOTA: Los materiales de papel (toalla de papel, papel de celulosa) deben envolverse en papel de aluminio para evitar que se mojen en el autoclave. - Conecte una fuente de aire, un manómetro y un rociador de cromatografía utilizando un tubo de PTFE esterilizado con etanol. Conecte un filtro HEPA entre el pulverizador de cromatografía y el manómetro.
- Recoja la estera micelial de las cinco placas de patógenos con la espátula de metal estéril en un tubo de centrífuga de 50 ml con una espátula estéril.
NOTA: Use un pequeño volumen de caldo líquido para ayudar a desalojar los micelios si es necesario, y transfiéralo con una pipeta estéril. - Agregue 25 mL de PDB modificado con agar y perlas de vidrio estéril al tubo de centrífuga de 50 mL y vórtice durante 5 min para romper la estera micelial.
- Transfiera la suspensión micelial a un rociador de cromatografía usando una jeringa estéril con una punta de aguja para asegurarse de que los trozos grandes de micelio no obstruyan el rociador de cromatografía.
- Coloque las placas TLC desarrolladas anteriormente sobre toallas de papel estériles en una campana de flujo laminar para reducir el contacto de las manos con la placa mientras aplica la suspensión de medios.
- Aumente la presión de aire a aproximadamente 4 bares y aplique tres capas de la suspensión a la placa TLC, permitiendo que la placa se seque completamente entre aplicaciones.
NOTA: Se encontró que tres capas es la cantidad óptima. Menos que esto, y el patógeno no tiene suficientes medios para crecer. Más que esto, el medio es demasiado espeso, lo que puede no permitir el contacto de patógenos con metabolitos activos. - Agregue 500 ml de agua estéril en una caja de plástico esterilizada y coloque hojas de celulosa dobladas esterilizadas o papel de filtro en cada lado para retener la humedad.
- Coloque la placa de ensayo completa en cuatro placas de Petri vacías en la caja.
- Incube el ensayo durante 3 días a 1 semana o hasta que una capa uniforme de micelio crezca uniformemente a través de la placa TLC, excepto alrededor de los controles positivos y la zona de inhibición (ZOI).
7. Análisis de espectrometría de masas por cromatografía líquida
- Tome una imagen del ensayo completado utilizando fotografía.
- Calcule el factor de retención para cada zona de inhibición dividiendo la distancia desde la línea inferior hasta la ZOI por la distancia desde la línea inferior hasta la línea superior.
- Raspe la sílice de las zonas de inhibición y colóquela en tubos de microcentrífuga.
- Agregue 500 μL de metanol a cada tubo y vórtice para extraer los metabolitos de la sílice.
- Centrifugar a 8.500 x g a 20 °C durante 10 min y transferir el sobrenadante a un vial pequeño.
- Evaporar hasta la sequedad por evaporación rotativa o bajo una corriente de nitrógeno.
- Vuelva a suspender el extracto en 50 μL de metanol en un vial de LC.
- Analizar los metabolitos en la zona de inhibición por LC-MS y compararlos con los metabolitos en el extracto crudo para determinar qué metabolitos en el extracto crudo son responsables de la inhibición del patógeno16.
- Utilizando el género y la especie del microorganismo fuente y las masas identificadas en la ZOI, busque en la bibliografía y en las bases de datos pertinentes, como Antibase y el Dictionary of Natural Products, para identificar los metabolitos.
Resultados
Tras la separación de los extractos microbianos por TLC, los metabolitos deben dispersarse verticalmente a lo largo de la placa TLC. Bajo luz visible, puede ser difícil ver metabolitos que no se absorben en el rango de luz visible. Por lo tanto, las imágenes bajo luz ultravioleta pueden ayudar a ver la separación de metabolitos, como se ve en la Figura 2A, B. Después del período de incubación, el patógeno debe parecer crecer uniformemente en toda la placa, excepto en los controles positivos y las zonas de inhibición donde residen los metabolitos activos, como se muestra en la Figura 2C.
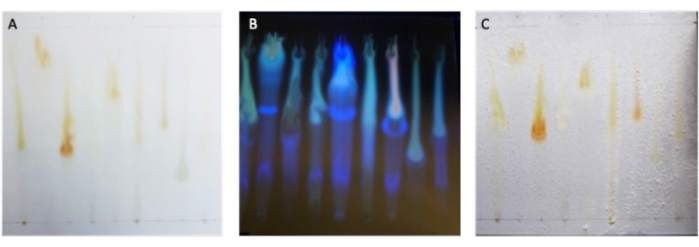
Figura 2: Separación de extractos microbianos por TLC. (A) Placa TLC desarrollada que contiene nueve extractos de Bacillus fotografiados bajo luz visible y (B) bajo luz ultravioleta de 320 nm antes de la aplicación de inóculo fúngico. (C) Ensayo de bioautografía completado con crecimiento de patógenos observado en toda la placa, excepto donde el crecimiento se inhibe alrededor de los controles positivos y ZOI de cada extracto. Haga clic aquí para ver una versión más grande de esta figura.
Los metabolitos extraídos de las zonas de inhibición se analizan mediante LC-MS y se comparan con el extracto crudo para determinar las NPs responsables del antagonismo contra el patógeno. Los metabolitos coincidentes deben tener el mismo tiempo de retención y las mismas especies de iones moleculares para que se consideren compatibles. Una vez identificados los metabolitos activos, el cultivo bacteriano puede cultivarse a granel para aislar metabolitos activos de interés para el estudio estructural o biológico.
Discusión
TLC-DB es una herramienta valiosa y bien establecida para la investigación de NP y una alternativa sencilla y económica a los métodos de aislamiento guiados por bioensayos en microplacas17. Requiere un tiempo y unos recursos materiales mínimos en comparación con los ensayos de microplacas, que requieren la separación de metabolitos mediante técnicas de cromatografía líquida. Es un ensayo muy versátil que puede utilizarse para detectar NPs antibacterianas, antifúngicas, antiparasitarias y antioxidantes, además de inhibidores enzimáticos 18,19,20,21,22,23. Aunque se utilizan más comúnmente para detectar e identificar fitoquímicos bioactivos, se puede aplicar el mismo método para las NP bacterianas que se explora en este protocolo18. Además, el protocolo se puede optimizar para su uso con una variedad de fuentes de NP y patógenos objetivo para ayudar a descubrir y evaluar nuevas NP bioactivas.
Los medios utilizados para el crecimiento bacteriano y el disolvente utilizado para la extracción pueden tener un gran impacto en los resultados del descubrimiento de productos naturales. Los medios utilizados en este protocolo están optimizados para bacterias que producen lipopéptidos cíclicos, incluidos Pseudomonas y Bacillus spp. Pero se deben considerar otros medios y fuentes de nutrientes si se exploran otros géneros. Se puede optar por completar la TLC-DB utilizando el mismo microorganismo cultivado en una variedad de medios para evaluar la amplitud total de la diversidad de metabolitos de un aislado o utilizar condiciones de crecimiento idénticas para una gama más amplia de aislados. La elección del disolvente de extracción también influye en los productos naturales detectados. En general, se entiende que la mayoría de las NP bioactivas tienen una polaridad baja a moderada, lo que hace que el acetato de etilo sea una opción adecuada debido a su bajo punto de ebullición, lo que hace que sea fácil de eliminar. Sin embargo, si también se desea examinar las fracciones polares y no polares, se pueden realizar extracciones múltiples con otros disolventes. Alternativamente, el extracto libre de células se puede liofilizar y usar en el ensayo para ver todos los metabolitos liberados en el medio. Sin embargo, a menudo será necesario cargar más material en la placa TLC para tener en cuenta los componentes de los medios secos en el material liofilizado. Del mismo modo, si este método se utiliza con un patógeno diferente, como el inóculo, se deben optimizar los medios utilizados y las condiciones de incubación para obtener las 5 placas de agar de micelio utilizadas para el ensayo TLC-DB.
La TLC-DB es ventajosa en comparación con la bioautografía de contacto e inmersión, ya que utiliza la capa más delgada de agar e inóculo, minimizando la dependencia de la difusión de metabolitos en la capa de agar, lo que puede permitir que cantidades más pequeñas de productos naturales induzcan la inhibición de patógenos17. Los hallazgos publicados anteriormente utilizando métodos bioautográficos de TLC han utilizado una suspensión de esporas del patógeno para completar el ensayo17. Aunque esto permite un control preciso sobre la concentración de la suspensión, puede ser extremadamente difícil y llevar mucho tiempo inducir la esporulación de ciertos hongos24. Esta modificación simplifica en gran medida el ensayo y permite completarlo utilizando patógenos fúngicos que son difíciles de esporular y que pueden haberse evitado previamente con este método.
La masa de extracto bacteriano utilizada en el ensayo puede afectar los resultados. Si se aplica muy poco extracto a la placa TLC, es posible que no se supere la concentración inhibitoria mínima de un compuesto activo y no se detecte la bioactividad. Como resultado, en algunos casos, y como se ve en la Figura 1 y la Figura 2, vale la pena sobrecargar la placa TLC, comprometiendo la separación para la capacidad de detectar fácilmente la actividad. Del mismo modo, la carga de patógenos rociada en la placa no debe ser demasiado baja, ya que no se aplicarán suficientes medios para apoyar el crecimiento de patógenos. Este método se puede ajustar fácilmente para adaptarse a una variedad de extractos bacterianos y patógenos, y las cantidades de extracto microbiano e inóculo descritas en el protocolo han garantizado que se pueda detectar la bioactividad de múltiples patógenos y extractos microbianos. Si no se observan zonas de inhibición al finalizar el ensayo, puede indicar una de las siguientes características. En primer lugar, es posible que los metabolitos activos no estén presentes en el extracto aplicado debido a que se utilizan medios incompatibles para el crecimiento bacteriano o debido a que la actividad de las bacterias no es el resultado de la producción de NP. Se puede completar un ensayo de difusión en disco con el extracto para confirmar o negar la existencia de NP activas en el extracto. Si el ensayo de difusión en disco no muestra supresión de patógenos, se pueden probar otros medios para determinar si otras condiciones producen NP bioactivas. Si el ensayo de difusión en disco indica que el extracto suprime el patógeno, entonces puede ser necesario aplicar una masa más grande del extracto bacteriano a la placa TLC, en cuyo caso se puede intentar otro ensayo.
La comparación de los metabolitos de la ZOI con el extracto crudo es esencial para identificar las NP activas. En el ensayo, los metabolitos del extracto crudo pueden ser metabolizados o modificados por el patógeno, lo que se puede observar a través de LC-MS. Por lo tanto, solo los metabolitos que se encuentran tanto en el extracto crudo como en la ZOI pueden considerarse como NP producidos por las bacterias en estudio. Si no se pueden correlacionar los metabolitos extraídos de la ZOI con los metabolitos del extracto crudo, se puede preparar una placa de TLC, como se describe en el paso 5. Sin completar el ensayo de bioautografía, extraiga los metabolitos de la placa TLC con el mismo tiempo de retención observado en el ensayo completado. Esto debería permitir una correlación más fácil entre los metabolitos de las ZOI y el extracto crudo, lo que provoca la supresión de patógenos.
Un inconveniente de TLC-DB es que la resolución de TLC es considerablemente menor que la que se logra cuando se utilizan técnicas tradicionales de detección de micropocillos, que requieren cromatografía líquida para la separación. Por lo tanto, es común que existan múltiples metabolitos en la zona de inhibición donde algunos metabolitos pueden no estar contribuyendo a la bioactividad. Este problema puede deberse a la práctica de sobrecargar la placa TLC para observar la bioactividad con mayor claridad. Se han publicado trabajos recientes utilizando TLC de alto rendimiento (HP-TLC), que mejora en gran medida la resolución y puede permitir la automatización del desarrollo de TLC que de otro modo sería imposible cuando se utiliza TLC convencional 14,21,22,23. Además, las placas se pueden desarrollar en una segunda dimensión (2D-TLC) para separar aún más los metabolitos con tiempos de retención similares. Dicho esto, hay que evaluar si el aumento del tiempo y el coste del material es un compromiso que merece la pena para aumentar la resolución obtenida de HP y 2D-TLC25.
Divulgaciones
La Dra. Susan Boyetchko falleció antes de la presentación de este trabajo (8 de febrero de 2023). Todos los demás autores han declarado no tener conflictos de intereses.
Agradecimientos
Agradecemos a Agriculture and Agri-Food Canada por la financiación que ha sido posible gracias a esta investigación (proyectos J-001843 y J-002021). Agradecemos a Brett van Heyningen por filmar el contenido de video para este protocolo. También nos gustaría agradecer a los antiguos estudiantes de posgrado (Jennifer Vacon y Mark Nabuurs) por sus conocimientos sobre los métodos descritos en este manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5-5 mL single channel Pipette | VWR | CA11020-004 | |
| 10 mL Thin Layer Chromatography Sprayer | VWR | KT422530-0010 | |
| 100 x 15 mm Petri plates | VWR | 89038-970 | |
| 100-1000 µL pipette tips | VWR | 76322-164 | |
| 100-1000 µL single channel pipette | VWR | 76169-240 | |
| 15 mL sterile centrifuge tubes | VWR | CA21008-918 | |
| 1 L glass bottle | Millipore Sigma | CLS13951L | Must be autoclave safe |
| 1 mL sterile syringe with needle | Thomas Scientific | 8935L75 | Detachable needle is recommended |
| 2 mL Microcentrifuge tube | VWR | 87003-298 | |
| 50 mL sterile centrifuge tubes | VWR | CA21008-940 | |
| 5 mL pipette tips | VWR | CA11020-008 | |
| 7 mL scintilation vials | VWR | 76538-962 | |
| 95% ethanol | Thermo Fisher Scientific | A412-500 | |
| Autoclave | Cole-Parmer | UZ-01850-34 | 8 L, 115 VAC |
| Bacteriological agar | VWR | 97064-336 | |
| bin | Thomas Scientific | 1216H91 | |
| D-Glucose | VWR | BDH9230-500G | |
| Dichloromethane ≥99.8% ACS | VWR | BDH1113-4LG | |
| Ethyl Acetate ≥99.8% ACS | VWR | BDH1123-4LG | |
| Filter paper | VWR | CA28297-846 | |
| Grinding Beads | VWR | 12621-148 | |
| Hygromycin B | VWR | CA80501-074 | |
| Iron Sulfate Heptahydrate | VWR | 97061-542 | |
| Laminar flow hood | CleanTech | 1000-6-A | |
| LC-MS | Waters | LITR10064178 | UPLC/MS/MS TQD system |
| Lyophilizer | Labconco | 700201000 | Temperature collector -50 °C |
| Manganese Sulfate Hydrate | VWR | CAAA10807-14 | |
| Methanol ≥99.8% ACS | VWR | BDH2018-5GLP | |
| Paper towel | VWR | 89402-824 | |
| Potato Dextrose Agar | VWR | CA90000-758 | |
| Potato Dextrose Broth | VWR | CA90003-494 | |
| Potsasium Phosphate Dibasic | VWR | 470302-246 | |
| Potsasium Phosphate Monobasic | VWR | 470302-252 | |
| Pressure Gauge 6mm Union Straight 0-10 bar (0-145 psi) | Tameson | F25U6 | |
| Pseudomonas F Agar | VWR | 90003-352 | Also known as Flo Agar |
| PTFE Tubing | Sigma Aldrich | 58697-U | 1/16 inch inner diameter |
| Sodium Chloride | VWR | BDH9286-500G | |
| Spatula | VWR | 82027-490 | |
| Sterile Inoculation loops with needle | VWR | 76534-512 | |
| Tinfoil | Thomas Scientific | 1086F24 | Can be purchased from supermarket |
| TLC Silica Gel 60 RP-18 F254S 25 Glass Plates 20 X 20 cm | Thomas Scientific | 1205Q12 | |
| Vacuum Pump | Labconco | 1472100 | 98 L/min |
| Vortex | VWR | 76549-928 | Must accomadate 15 mL and 50 mL centrifuge tubes |
| Whatman in-line HEPA-VENT | Millipore Sigma | WHA67235000 | 10 filters, 1/4 to 3/8 inch inlet/outlet |
| VWR | 97063-370 |
Referencias
- Fisher, M. C., et al. Emerging fungal threats to animal, plant and ecosystem health. Nature. 484 (7393), 186-194 (2012).
- Savary, S., et al. The global burden of pathogens and pests on major food crops. Nat Ecol Evol. 3 (3), 430-439 (2019).
- Lin, B. B. Resilience in agriculture through crop diversification: Adaptive management for environmental change. BioSci. 61 (3), 183-193 (2011).
- Piquerez, S. J., Harvey, S. E., Beynon, J. L., Ntoukakis, V. Improving crop disease resistance: Lessons from research on arabidopsis and tomato. Front Plant Sci. 5, 671(2014).
- Damalas, C., Koutroubas, S. Current status and recent developments in biopesticide use. Agriculture. 8 (1), 13(2018).
- Syed Ab Rahman, S. F., Singh, E., Pieterse, C. M. J., Schenk, P. M. Emerging microbial biocontrol strategies for plant pathogens. Plant Sci. 267, 102-111 (2018).
- Tudi, M., et al. Exposure routes and health risks associated with pesticide application. Toxics. 10 (6), 335(2022).
- Santos, E. N., et al. Bacillus thuringiensis: From biopesticides to anticancer agents. Biochimie. 192, 83-90 (2022).
- Kumar, J., Ramlal, A., Mallick, D., Mishra, V. An overview of some biopesticides and their importance in plant protection for commercial acceptance. Plants. 10 (6), 1185(2021).
- Marrone, P. Pesticidal natural products - status and future potential. Pest Manag Sci. 75 (9), 2325-2340 (2019).
- Ayilara, M. S., et al. Biopesticides as a promising alternative to synthetic pesticides: A case for microbial pesticides, phytopesticides, and nanobiopesticides. Front. Microbiol. 14, 1040901(2023).
- Abdelaziz, A. M., et al. Biocontrol of soil borne diseases by plant growth promoting rhizobacteria. Trop. Plant Pathol. 48 (2), 105-127 (2023).
- Zhao, Z., Liu, D., Ruan, L., Wang, T., Liang, Z. Antifungal mechanism of Bacillus amyloliquefaciens SC-B15 and its application in cereal mildewproof and grape preservation. Food Biosci. 56, 103287(2023).
- Jamshidi-Aidji, M., Dimkic, I., Ristivojevic, P., Stankovic, S., Morlock, G. Effect-directed screening of bacillus lipopeptide extracts via hyphenated high-performance thin-layer chromatography. J Chromatogr A. 1605, 460366(2019).
- Prichystal, J., Schug, K. A., Lemr, K., Novak, J., Havlicek, V. Structural analysis of natural products. Anal Chem. 88 (21), 10338-10346 (2016).
- De Souza, C. G., et al. Simultaneous quantification of lipopeptide isoforms by UPLC-MS in the fermentation broth from Bacillus subtilis CNPMS22. Anal Bioanal Chem. 410 (26), 6827-6836 (2018).
- Dewanjee, S., Gangopadhyay, M., Bhattacharya, N., Khanra, R., Dua, T. Bioautography and its scope in the field of natural product chemistry. J Pharm Anal. 5 (2), 75-84 (2015).
- Choma, I., Jesionek, W. TLC-direct bioautography as a high throughput method for detection of antimicrobials in plants. Chromatography. 2 (2), 225-238 (2015).
- Attia, R., et al. Thin-layer chromatography-bioautographic method for the detection of arginase inhibitors. J Sep Sci. 43 (12), 2477-2486 (2020).
- Legerska, B., Chmelova, D., Ondrejovic, M. TLC-bioautography as a fast and cheap screening method for the detection of alpha-chymotrypsin inhibitors in crude plant extracts. J Biotechnol. 313, 11-17 (2020).
- Agatonovic-Kustrin, S., Doyle, E., Gegechkori, V., Morton, D. W. High-performance thin-layer chromatography linked with (bio)assays and FTIR-ATR spectroscopy as a method for discovery and quantification of bioactive components in native Australian plants. J Pharm Biomed Anal. 184, 113208(2020).
- Hilaire, V., et al. New method for screening anti-leishmania compounds in plants extracts by HPTLC-bioautography. J Chromatogr B. 1188, 123061(2022).
- Stankovic, J., et al. HPTLC-direct bioautography-guided isolation of isogeranic acid as the main antibacterial constituent of Artemisia santonicum essential oil. J Serb Chem Soc. 84 (12), 1355-1365 (2019).
- Su, Y., Qi, Y., Cai, L. Induction of sporulation in plant pathogenic fungi. Mycology. 3, 195-200 (2012).
- Wedge, E., Nagle, D. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J Nat Prod. 63, 1050-1054 (2000).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados