Method Article
Идентификация натуральных продуктов для биоконтроля под контролем биопроб с помощью тонкослойной хроматографии - прямая биоавтография
В этой статье
Резюме
Описано использование тонкослойной хроматографии, прямого биоавтографического анализа и жидкостной хромато-масс-спектрометрии для идентификации микробных природных продуктов, проявляющих антагонизм по отношению к грибковым патогенам, с использованием патогена Sclerotinia sclerotiorum и биопестицидных изолятов Bacillus в качестве модельной системы.
Аннотация
Тонкослойная хроматография-прямая биоавтоазография (TLC-DB) — это хорошо зарекомендовавший себя биоанализ, используемый для выделения и идентификации натуральных продуктов (НЧ), которые являются антагонистами по отношению к целевому патогену. Это быстрый, недорогой и простой вариант выделения и идентификации НЧ под контролем биопробы, который зависит от разделения с помощью ТСХ в сочетании с непосредственным применением целевого патогена для изучения биологической активности. Обычно он используется для анализа биоактивных растительных экстрактов, обнаружения ингибирующей активности в отношении бактерий, грибков и ферментов. Тем не менее, он обладает большим потенциалом в открытии бактериальных НЧ, особенно для оценки бактериальных НЧ против соответствующих сельскохозяйственных патогенов, что ценно для открытия и разработки новых биопестицидов для сельскохозяйственной отрасли. Кроме того, это настраиваемый протокол, который может быть применен к другим патогенам-мишеням или источникам НЧ в исследовательских программах, связанных с открытием и идентификацией биологически активных соединений. В данной работе мы описываем модельную систему для обнаружения и идентификации НЧ-биопестицидов с использованием TLC-DB с Bacillus spp. и сельскохозяйственным патогеном Sclerotinia sclerotiorum.
Введение
Грибковые сельскохозяйственные патогены приводят к значительным потерям качества урожая и урожайности во всем мире, усугубляя экономические проблемы и проблемы предложения стабильной глобальной системы производства продовольствия 1,2. Повреждение патогенами можно предотвратить путем выведения сортов, устойчивых к инфекции, и использования интегрированных систем управления сельскохозяйственными культурами, включая севообороты и методы управления земельными ресурсами для подавления распространения патогенов 3,4. Хотя эти методы уменьшают ущерб сельскохозяйственным культурам, химические пестициды обычно используются в тандеме для активного уничтожения грибковых репродуктивных структур в поле и дальнейшего предотвращения повреждений и снижения урожайности. Несмотря на свою эффективность, использование химических пестицидов имеет много недостатков, включая ущерб окружающим экосистемам, снижение плодородия почвы, связанные с этим риски для здоровья человека и развитие устойчивости к патогенам, что приводит к тому, чтокаждый год требуются более высокие дозы пестицидов.
Продукты для борьбы с вредителями и патогенами на основе микробов долгое время считались потенциальными альтернативами или дополнением к синтетическим пестицидам. С начала 1900-х годов Bacillus thuringiensis широко используется для борьбы с сельскохозяйственными вредителями и патогенами в качестве обработки семян, в качестве опрыскивания листьев и при непосредственной обработке почвы8. Такие продукты были названы биопестицидами и характеризуются как природные микроорганизмы или биохимические вещества, которые могут убивать, подавлять или снижать энергию целевого вредителя или патогена. Биопестициды могут контролировать рост патогена с помощью различных механизмов, но чаще всего это происходит за счет секреции вторичных метаболитов. Вторичные метаболиты, часто называемые природными продуктами, не участвуют в первичном метаболизме, но образуются в качестве эволюционного преимущества, позволяющего вытеснить другие микроорганизмы.
Биопестициды имеют множество преимуществ по сравнению со своими синтетическими аналогами. Они представляют низкий риск токсичности для окружающей среды, животного мира и человека по сравнению с синтетическими продуктами для борьбы с вредителями 9,10. Поскольку большинство биопестицидов естественным образом существовали в окружающей среде на протяжении тысячелетий, пути биоразложения микробных метаболитов существуют в окружающей среде, ограничивая возможность загрязнения почвы или экосистемы и сокращая время пребывания, которое способствует тому, что синтетические пестицидынастолько разрушительны для окружающей среды. Кроме того, многие биопестициды, используемые для смягчения патогенной инфекции, также проявляют свойства, способствующие росту растений, что может повысить биодоступность питательных веществ и вызвать системную устойчивость растений12.
Чаще всего биопестициды применяются в виде микробного инокулюма, а НЧ выделяются живыми микроорганизмами in situ 12,13. В таком случае выявление источника активности биопестицида имеет большое значение. Это дает представление о механизме действия биопестицида, помогает обосновать защиту микроорганизма с помощью патента и может оказать значительное научное влияние, если их структура является новой. Однако наиболее важным является то, что идентификация биоактивного источника информирует о возможностях разработки рецептуры для последующего биопестицидного продукта. Если НЧ сам по себе активен, его можно использовать в качестве фабрики биомолекул для крупномасштабного производства биопестицидов. Кроме того, многие НЧ, которые были исследованы для биоконтроля, также имеют потенциальное применение в медицине человека, что делает их ещеболее экономически ценными8.
Анализы тонкослойной хроматографии и прямой биоавтографии (TLC-DB) являются недорогим и простым методом выделения и идентификации биопестицидцидных метаболитов под контролем биологической активности. Несмотря на то, что этот метод обычно используется для отделения тестирования биологической активности фитохимических веществ от сырых растительных экстрактов, он также обладает большим потенциалом для анализа микробныхэкстрактов. TLC обеспечивает быстрое и недорогое отделение НЧ в сыром микробном экстракте, а после покрытия суспензией возбудителя среды легко визуализируются зоны, содержащие активные метаболиты. Эти зоны могут быть соскоблены с пластины и извлечены для химического анализа с помощью ультравысокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией (UPLC-MS) для идентификации известных метаболитов. Метаболиты, которые не соответствуют ранее зарегистрированным соединениям, могут быть выделены в больших количествах с помощью жидкостной хроматографии для проведения исследований по выяснению структуры с использованием таких методов, как спектроскопия ядерного магнитного резонанса и рентгеновская кристаллография.
В данной статье описана модельная система для обнаружения и идентификации НЧ-биопестицидов с использованием TLC-DB с Bacillus spp. и сельскохозяйственным патогеном Sclerotinia sclerotiorum. На рисунке 1 представлен схематический обзор процедуры TLC-DB.
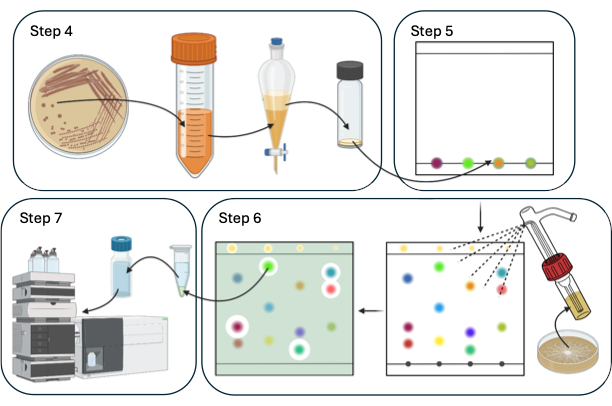
Рисунок 1: Схематический обзор шагов 4-7 процедуры TLC-DB. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Подробная информация о реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Выбор кандидатов на биоконтроль микроорганизмов
- С помощью тестов на конкурентных планшетах отбирают микробные изоляты, которые проявляют антагонизм по отношению к интересующему патогену.
Примечание: Для демонстрации этого протокола были отобраны девять изолятов Bacillus , которые проявляли антагонизм по отношению к S. sclerotiorum , включая виды Bacillus atrophaeus, mojavensis и subtilis .
2. Подготовка СМИ
- Готовят картофельный декстрозный агар (ППК), растворив 39 г среды на литр воды.
- Приготовьте Pseudomonas F agar, добавив 45 г среды на литр воды.
- Приготовьте картофельный отвар декстрозы (ПДБ) с 1% агаром, добавив 24 г среднего, и 0,24 г агара на литр воды.
- Приготовьте дрожжево-глюкозо-марганцевый (YGM) бульон. Создают буферный раствор, состоящий из 2,5 г KH2PO4 и 2,5 г K2HPO4 на 100 мл воды, и солевой раствор, состоящий из 0,58 г MnSO4. Н20, 0,5 г NaCl и 0,05 г FeSO4,7 Н20 на 100 мл воды.
- Далее добавьте 1 г дрожжевого экстракта, 1,25 г декстрозы, 400 мл воды, 5 мл буферного раствора, 5 мл раствора соли и 90 мл воды, чтобы соли металлов не выпали в осадок в растворе.
- Автоклав - стерилизуйте фильтрующий материал, разлейте агар в пластины Петри размером 100 х 15 мм и дайте всему остыть до комнатной температуры перед использованием.
3. Подготовка патогенов
- Культивируют пять планшетов Sclerotinia sclerotiorum на КПК (приготовленном на шаге 2.1) и инкубируют при 25 °C в течение 3 дней.
4. Приготовление экстракта натурального продукта
- Культивируйте каждый бактериальный изолят на Pseudomonas F Agar (приготовленном на шаге 2.2) и выращивайте до тех пор, пока не будут обнаружены отдельные колонии.
- Субкультивируют одиночные колонии бактерий в 25 мл среды YGM в центрифуге или культуральных пробирках и инкубируют с встряхиванием в течение 3 суток.
- Переложите по 5 мл аликвот каждого экстракта в 1 л YGM и инкубируйте в тех же условиях еще 3 дня.
- Центрифугируйте каждую культуру при 3000 x g в течение 15 мин при 25 °C для гранулирования клеток.
- Сцедите и промойте надосадочную жидкость трижды этилацетатом для извлечения метаболитов из питательной среды.
- Соедините и высушите слой этилацетата каждого из них с помощью ротационного испарения.
- Повторно растворите экстракт в минимальном количестве метанола, переложите его в небольшой сцинтилляционный флакон и снова высушите путем ротационного выпаривания.
ПРИМЕЧАНИЕ: Если экстракт высыхает до маслянистого или смолистого материала, лиофилизируйте материал, чтобы получить сухой порошок, который можно точно взвесить.
5. Подготовка пластин TLC
- Подготовьте тарелку размером 20 см х 20 см, проведя линию в 2 см от дна и в 2 см от верха тарелки. В нижней части расположите девять точек на расстоянии 2 см друг от друга. Над верхней линией поместите четыре точки на расстоянии 4 см друг от друга.
- Растворите 5 мг каждого экстракта в 15 μл метанола и нанесите 5 μL каждого экстракта на девять точек, отмеченных нижней линией, с помощью пипетки. Дайте каждому пятну экстракта высохнуть на пластине TLC и нанесите еще 5 мкл аликвоты на то же место. Повторяйте до тех пор, пока весь материал не будет загружен на пластину TLC.
- Проявите пластину TLC в резервуаре для проявки, используя раствор дихлорметана и метанола в соотношении 1:2 до тех пор, пока растворитель не достигнет линии, отмеченной на расстоянии 2 см от верхней части пластины (примерно 45 минут).
- После проявления снимите пластину TLC и нанесите ряд положительных регуляторов на четыре точки, отмеченные над линией растворителя. Используются четыре концентрации одного и того же контроля. Для S. scl. 0,5 мкг/мл, 5 мкг/мл, 50 мкг/мл и 500 мкг/мл гигромицина В являются положительными контрольными.
- Прежде чем весь растворитель испарится с пластины, поместите ее в стерилизованную этанолом коробку для пластин TLC.
6. Прямой биоавтографический анализ
- Автоклавируйте материалы, которые будут использоваться в анализе (стеклянные компоненты хроматографического распылителя, металлический шпатель, четыре листа бумажного полотенца, целлюлозную или фильтровальную бумагу, воду и фильтрующий материал) в большой стакан, покрытый фольгой.
ПРИМЕЧАНИЕ: Бумажные материалы (бумажное полотенце, целлюлозная бумага) должны быть завернуты в оловянную фольгу, чтобы избежать намокания в автоклаве. - Подключите источник воздуха, манометр и распылитель хроматографии с помощью стерилизованных этанолом трубок из ПТФЭ. Подсоедините фильтр HEPA между распылителем хроматографии и манометром.
- Соберите мицелиальный мат пяти планшетов с патогеном с помощью стерильного металлического шпателя в центрифужную пробирку объемом 50 мл с помощью стерильного шпателя.
ПРИМЕЧАНИЕ: При необходимости используйте небольшой объем жидкого бульона, чтобы помочь удалить мицелий, и перенесите его с помощью стерильной пипетки. - Добавьте 25 мл PDB, обогащенного агаром и стерильными стеклянными шариками, в центрифужную пробирку объемом 50 мл и делайте вихрь в течение 5 минут, чтобы разрушить мицелиальный мат.
- Перенесите мицелиальную суспензию в распылитель для хроматографии с помощью стерильного шприца с наконечником иглы, чтобы убедиться, что большие куски мицелия не забьют распылитель для хроматографии.
- Поместите ранее разработанные пластины TLC на стерильные бумажные полотенца в колпак с ламинарным потоком, чтобы уменьшить контакт рук с пластиной во время наложения суспензии носителя.
- Увеличьте давление воздуха примерно до 4 бар и нанесите три слоя суспензии на пластину TLC, позволяя пластине полностью высохнуть между нанесениями.
ПРИМЕЧАНИЕ: Три слоя были признаны оптимальным количеством. Меньше этого, и возбудителю не хватает сред для роста. Более того, среда слишком густая, что может не допустить контакта патогена с активными метаболитами. - Добавьте 500 мл стерильной воды в стерилизованную пластиковую коробку для тарелок и положите стерилизованные сложенные листы целлюлозы или фильтровальную бумагу с каждой стороны, чтобы удержать влагу.
- Поместите готовую пробирную пластину на четыре пустые чашки Петри в коробке.
- Инкубируйте анализ в течение от 3 дней до 1 недели или до тех пор, пока ровный слой мицелия не вырастет равномерно по всей пластине TLC, за исключением положительного контроля и зоны ингибирования (ZOIs).
7. Жидкостная хроматография, масс-спектрометрический анализ
- Сфотографируйте завершенный анализ с помощью фотографии.
- Рассчитайте коэффициент удержания для каждой зоны торможения, разделив расстояние от нижней линии до ZOI на расстояние от нижней линии до верхней линии.
- Соскребите диоксид кремния с зон торможения и поместите его в микроцентрифужные пробирки.
- Добавьте 500 μL метанола в каждую пробирку и сделайте вихрь, чтобы извлечь метаболиты из диоксида кремния.
- Центрифугируйте при давлении 8 500 x g при 20 °C в течение 10 минут и перелейте надосадочную жидкость в небольшой флакон.
- Выпарить до сухости путем ротационного выпаривания или под струей азота.
- Повторно суспендируйте экстракт в 50 мкл метанола во флаконе LC.
- Проанализируйте метаболиты в зоне ингибирования ЛХ-МС и сравните их с метаболитами в сыром экстракте, чтобы определить, какие метаболиты в сыром экстракте отвечают за ингибирование патогена16.
- Используя род и вид исходного микроорганизма и массы, идентифицированные в ZOI, выполните поиск в литературе и соответствующих базах данных, таких как Antibase и Dictionary of Natural Products, для идентификации метаболитов.
Результаты
После разделения микробных экстрактов с помощью ТСХ, метаболиты должны быть распределены вдоль пластины ТСХ вертикально. При видимом свете может быть трудно увидеть метаболиты, которые не поглощаются в видимом диапазоне света. Таким образом, визуализация в ультрафиолетовом свете может помочь увидеть разделение метаболитов, как видно на рисунке 2A, B. После инкубационного периода патоген должен казаться равномерно расти по всей пластине, за исключением положительного контроля и зон ингибирования, где находятся активные метаболиты, изображенные на рисунке 2C.
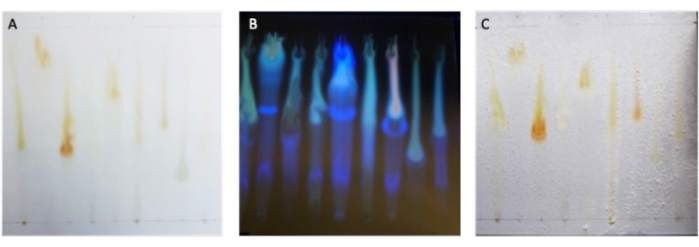
Рисунок 2: Разделение микробных экстрактов с помощью TLC. (A) Разработанный планшет TLC, содержащий девять экстрактов Bacillus , визуализированных в видимом свете, и (B) в ультрафиолетовом свете с длиной волны 320 нм перед применением грибкового инокулята. (C) Завершенный биоавтографический анализ с наблюдением роста патогена по всей пластине, за исключением тех случаев, когда рост подавляется вокруг положительного контроля, и ZOI каждого экстракта. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Метаболиты, выделенные из зон ингибирования, анализируют с помощью ЖХ-МС и сравнивают с сырым экстрактом для определения НЧ, ответственных за антагонизм по отношению к возбудителю. Совместимые метаболиты должны иметь одинаковое время удержания и молекулярные ионы, чтобы считаться совместимыми. После идентификации активных метаболитов бактериальную культуру можно выращивать в больших количествах для выделения активных метаболитов, представляющих интерес для структурной химии или биологических исследований.
Обсуждение
TLC-DB является ценным и хорошо зарекомендовавшим себя инструментом исследования НЧ, а также простой и недорогой альтернативой методам выделения под контролем биотестирования на микропланшетах17. Он требует минимальных временных и материальных ресурсов по сравнению с микропланшетными анализами, которые требуют разделения метаболитов с помощью методов жидкостной хроматографии. Это очень универсальный анализ, который может быть использован для обнаружения антибактериальных, противогрибковых, антипаразитарных и антиоксидантных НЧ в дополнение к ингибиторам ферментов 18,19,20,21,22,23. Несмотря на то, что наиболее часто он используется для обнаружения и идентификации биологически активных фитохимических веществ, тот же метод может быть применен для бактериальных НЧ, как описано в настоящем протоколе. Кроме того, протокол может быть оптимизирован для использования с различными источниками НЧ и целевыми патогенами, чтобы помочь в обнаружении и оценке новых биологически активных НЧ.
Среда, используемая для роста бактерий, и растворитель, используемый для экстракции, могут значительно повлиять на результаты разработки натуральных продуктов. Среда, используемая в этом протоколе, оптимизирована для бактерий, которые продуцируют циклические липопептиды, включая Pseudomonas и Bacillus spp. Но при изучении других родов следует учитывать другие среды и источники питательных веществ. Можно выбрать завершение TLC-DB с использованием одного и того же микроорганизма, выращенного в различных средах, для оценки всей широты разнообразия метаболитов одного изолята или использовать идентичные условия роста для более широкого спектра изолятов. Выбор растворителя для экстракции также влияет на обнаруживаемые натуральные продукты. Общеизвестно, что большинство биологически активных НЧ имеют низкую или умеренную полярность, что делает этилацетат подходящим выбором из-за его низкой температуры кипения, что облегчает его удаление. Однако, если вы хотите также исследовать полярные и неполярные фракции, можно провести многократную экстракцию с другими растворителями. В качестве альтернативы, бесклеточный экстракт может быть лиофилизирован и использован в анализе, чтобы увидеть, как все метаболиты высвобождаются в среду. Тем не менее, часто на пластину TLC необходимо загружать больше материала, чтобы учесть компоненты высушенной среды в лиофилизированном материале. Аналогичным образом, если этот метод используется с другим патогеном, таким как посевной материал, используемые среды и условия инкубации должны быть оптимизированы для получения 5 агаровых пластин мицелия, используемых для анализа TLC-DB.
TLC-DB имеет преимущество по сравнению с контактной и иммерсионной биоавтографией, поскольку в ней используется тончайший слой агара и инокулюма, сводя к минимуму зависимость от диффузии метаболитов в слой агара, что может позволить меньшему количеству натуральных продуктов индуцировать ингибирование патогенов17. Ранее опубликованные результаты с использованием биоавтографических методов TLC использовали споровую суспензию патогена для завершения анализа17. Несмотря на то, что это позволяет точно контролировать концентрацию суспензии, индуцирование спороношения некоторых грибовможет быть чрезвычайно сложным и трудоемким. Эта модификация значительно упрощает анализ и позволяет завершить анализ с использованием грибковых патогенов, которые трудно спорулировать и которых ранее можно было избежать при использовании этого метода.
Масса бактериального экстракта, используемого в анализе, может повлиять на результаты. Если на планшет TLC нанести слишком мало экстракта, возможно, что минимальная ингибирующая концентрация активного соединения не будет превышена, и биологическая активность не будет обнаружена. В результате, в некоторых случаях, как видно на рисунках 1 и 2, имеет смысл перегружать пластину TLC, что ставит под угрозу разделение для возможности легко обнаруживать активность. Аналогичным образом, патогенная нагрузка, распыляемая на пластину, не должна быть слишком низкой, так как не будет нанесено достаточно среды для поддержки роста патогена. Этот метод может быть легко настроен для работы с различными бактериальными экстрактами и патогенами, а количество микробного экстракта и инокулюма, указанное в протоколе, обеспечивает обнаружение биологической активности для нескольких патогенов и микробных экстрактов. Если по завершении анализа не наблюдается зон торможения, это может свидетельствовать об одном из следующих признаков. Во-первых, активные метаболиты могут отсутствовать в применяемом экстракте из-за использования несовместимых сред для роста бактерий или из-за того, что активность бактерий не является результатом производства НЧ. Дисковый диффузионный анализ экстракта может быть завершен для подтверждения или опровержения существования активных НЧ в экстракте. Если дисковый диффузионный анализ не показывает подавления патогенов, можно протестировать другие среды, чтобы определить, производят ли другие условия биоактивные НЧ. Если дисковый диффузионный анализ показывает, что экстракт подавляет патоген, то может потребоваться нанесение большего количества бактериального экстракта на планшет TLC, и в этом случае можно попытаться провести другой анализ.
Сравнение метаболитов в ZOI с сырым экстрактом имеет важное значение для идентификации активных НЧ. В этом анализе метаболиты из сырого экстракта могут метаболизироваться или модифицироваться патогеном, что может наблюдаться с помощью ЖХ-МС. Таким образом, только метаболиты, которые встречаются как в сыром экстракте, так и в ZOI, могут рассматриваться как НЧ, продуцируемые исследуемыми бактериями. Если невозможно соотнести метаболиты, извлеченные из ZOI, с метаболитами в сыром экстракте, можно приготовить планшет TLC, как описано на шаге 5. Не завершая биоавтографический анализ, извлеките метаболиты из пластины TLC в то же время удержания, которое наблюдалось в завершенном анализе. Это должно обеспечить более легкую корреляцию между метаболитами в ZOI и сырым экстрактом, вызывающим подавление патогенов.
Одним из недостатков TLC-DB является то, что разрешение TLC значительно меньше, чем при использовании традиционных методов скрининга микролунок, для разделения которых требуется жидкостная хроматография. Таким образом, множественные метаболиты обычно существуют в зоне ингибирования, где некоторые метаболиты могут не вносить вклад в биологическую активность. Эта проблема может быть вызвана практикой перегрузки планшета TLC для более четкого наблюдения за биологической активностью. Недавно были опубликованы работы с использованием высокопроизводительного TLC (HP-TLC), который значительно улучшает разрешение и может позволить автоматизировать разработку TLC, что в противном случае невозможно при использовании обычного TLC 14,21,22,23. Кроме того, пластины могут быть разработаны во втором измерении (2D-TLC) для дальнейшего разделения метаболитов с аналогичным временем удержания. При этом следует оценить, является ли увеличение затрат времени и материалов оправданным компромиссом для повышения разрешения, полученного от HP- и 2D-TLC25.
Раскрытие информации
Доктор Сьюзан Бойетчко скончалась до подачи этой работы (8 февраля 2023 года). Все остальные авторы заявили об отсутствии конфликта интересов.
Благодарности
Мы выражаем благодарность Министерству сельского хозяйства и продовольствия Канады за финансирование, благодаря которому это исследование стало возможным (проекты J-001843 и J-002021). Мы благодарим Бретта ван Хейнингена за съемку видеоконтента для этого протокола. Мы также хотели бы поблагодарить бывших аспирантов (Дженнифер Вакон и Марка Набуурса) за их понимание методов, описанных в этой рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.5-5 mL single channel Pipette | VWR | CA11020-004 | |
| 10 mL Thin Layer Chromatography Sprayer | VWR | KT422530-0010 | |
| 100 x 15 mm Petri plates | VWR | 89038-970 | |
| 100-1000 µL pipette tips | VWR | 76322-164 | |
| 100-1000 µL single channel pipette | VWR | 76169-240 | |
| 15 mL sterile centrifuge tubes | VWR | CA21008-918 | |
| 1 L glass bottle | Millipore Sigma | CLS13951L | Must be autoclave safe |
| 1 mL sterile syringe with needle | Thomas Scientific | 8935L75 | Detachable needle is recommended |
| 2 mL Microcentrifuge tube | VWR | 87003-298 | |
| 50 mL sterile centrifuge tubes | VWR | CA21008-940 | |
| 5 mL pipette tips | VWR | CA11020-008 | |
| 7 mL scintilation vials | VWR | 76538-962 | |
| 95% ethanol | Thermo Fisher Scientific | A412-500 | |
| Autoclave | Cole-Parmer | UZ-01850-34 | 8 L, 115 VAC |
| Bacteriological agar | VWR | 97064-336 | |
| bin | Thomas Scientific | 1216H91 | |
| D-Glucose | VWR | BDH9230-500G | |
| Dichloromethane ≥99.8% ACS | VWR | BDH1113-4LG | |
| Ethyl Acetate ≥99.8% ACS | VWR | BDH1123-4LG | |
| Filter paper | VWR | CA28297-846 | |
| Grinding Beads | VWR | 12621-148 | |
| Hygromycin B | VWR | CA80501-074 | |
| Iron Sulfate Heptahydrate | VWR | 97061-542 | |
| Laminar flow hood | CleanTech | 1000-6-A | |
| LC-MS | Waters | LITR10064178 | UPLC/MS/MS TQD system |
| Lyophilizer | Labconco | 700201000 | Temperature collector -50 °C |
| Manganese Sulfate Hydrate | VWR | CAAA10807-14 | |
| Methanol ≥99.8% ACS | VWR | BDH2018-5GLP | |
| Paper towel | VWR | 89402-824 | |
| Potato Dextrose Agar | VWR | CA90000-758 | |
| Potato Dextrose Broth | VWR | CA90003-494 | |
| Potsasium Phosphate Dibasic | VWR | 470302-246 | |
| Potsasium Phosphate Monobasic | VWR | 470302-252 | |
| Pressure Gauge 6mm Union Straight 0-10 bar (0-145 psi) | Tameson | F25U6 | |
| Pseudomonas F Agar | VWR | 90003-352 | Also known as Flo Agar |
| PTFE Tubing | Sigma Aldrich | 58697-U | 1/16 inch inner diameter |
| Sodium Chloride | VWR | BDH9286-500G | |
| Spatula | VWR | 82027-490 | |
| Sterile Inoculation loops with needle | VWR | 76534-512 | |
| Tinfoil | Thomas Scientific | 1086F24 | Can be purchased from supermarket |
| TLC Silica Gel 60 RP-18 F254S 25 Glass Plates 20 X 20 cm | Thomas Scientific | 1205Q12 | |
| Vacuum Pump | Labconco | 1472100 | 98 L/min |
| Vortex | VWR | 76549-928 | Must accomadate 15 mL and 50 mL centrifuge tubes |
| Whatman in-line HEPA-VENT | Millipore Sigma | WHA67235000 | 10 filters, 1/4 to 3/8 inch inlet/outlet |
| VWR | 97063-370 |
Ссылки
- Fisher, M. C., et al. Emerging fungal threats to animal, plant and ecosystem health. Nature. 484 (7393), 186-194 (2012).
- Savary, S., et al. The global burden of pathogens and pests on major food crops. Nat Ecol Evol. 3 (3), 430-439 (2019).
- Lin, B. B. Resilience in agriculture through crop diversification: Adaptive management for environmental change. BioSci. 61 (3), 183-193 (2011).
- Piquerez, S. J., Harvey, S. E., Beynon, J. L., Ntoukakis, V. Improving crop disease resistance: Lessons from research on arabidopsis and tomato. Front Plant Sci. 5, 671(2014).
- Damalas, C., Koutroubas, S. Current status and recent developments in biopesticide use. Agriculture. 8 (1), 13(2018).
- Syed Ab Rahman, S. F., Singh, E., Pieterse, C. M. J., Schenk, P. M. Emerging microbial biocontrol strategies for plant pathogens. Plant Sci. 267, 102-111 (2018).
- Tudi, M., et al. Exposure routes and health risks associated with pesticide application. Toxics. 10 (6), 335(2022).
- Santos, E. N., et al. Bacillus thuringiensis: From biopesticides to anticancer agents. Biochimie. 192, 83-90 (2022).
- Kumar, J., Ramlal, A., Mallick, D., Mishra, V. An overview of some biopesticides and their importance in plant protection for commercial acceptance. Plants. 10 (6), 1185(2021).
- Marrone, P. Pesticidal natural products - status and future potential. Pest Manag Sci. 75 (9), 2325-2340 (2019).
- Ayilara, M. S., et al. Biopesticides as a promising alternative to synthetic pesticides: A case for microbial pesticides, phytopesticides, and nanobiopesticides. Front. Microbiol. 14, 1040901(2023).
- Abdelaziz, A. M., et al. Biocontrol of soil borne diseases by plant growth promoting rhizobacteria. Trop. Plant Pathol. 48 (2), 105-127 (2023).
- Zhao, Z., Liu, D., Ruan, L., Wang, T., Liang, Z. Antifungal mechanism of Bacillus amyloliquefaciens SC-B15 and its application in cereal mildewproof and grape preservation. Food Biosci. 56, 103287(2023).
- Jamshidi-Aidji, M., Dimkic, I., Ristivojevic, P., Stankovic, S., Morlock, G. Effect-directed screening of bacillus lipopeptide extracts via hyphenated high-performance thin-layer chromatography. J Chromatogr A. 1605, 460366(2019).
- Prichystal, J., Schug, K. A., Lemr, K., Novak, J., Havlicek, V. Structural analysis of natural products. Anal Chem. 88 (21), 10338-10346 (2016).
- De Souza, C. G., et al. Simultaneous quantification of lipopeptide isoforms by UPLC-MS in the fermentation broth from Bacillus subtilis CNPMS22. Anal Bioanal Chem. 410 (26), 6827-6836 (2018).
- Dewanjee, S., Gangopadhyay, M., Bhattacharya, N., Khanra, R., Dua, T. Bioautography and its scope in the field of natural product chemistry. J Pharm Anal. 5 (2), 75-84 (2015).
- Choma, I., Jesionek, W. TLC-direct bioautography as a high throughput method for detection of antimicrobials in plants. Chromatography. 2 (2), 225-238 (2015).
- Attia, R., et al. Thin-layer chromatography-bioautographic method for the detection of arginase inhibitors. J Sep Sci. 43 (12), 2477-2486 (2020).
- Legerska, B., Chmelova, D., Ondrejovic, M. TLC-bioautography as a fast and cheap screening method for the detection of alpha-chymotrypsin inhibitors in crude plant extracts. J Biotechnol. 313, 11-17 (2020).
- Agatonovic-Kustrin, S., Doyle, E., Gegechkori, V., Morton, D. W. High-performance thin-layer chromatography linked with (bio)assays and FTIR-ATR spectroscopy as a method for discovery and quantification of bioactive components in native Australian plants. J Pharm Biomed Anal. 184, 113208(2020).
- Hilaire, V., et al. New method for screening anti-leishmania compounds in plants extracts by HPTLC-bioautography. J Chromatogr B. 1188, 123061(2022).
- Stankovic, J., et al. HPTLC-direct bioautography-guided isolation of isogeranic acid as the main antibacterial constituent of Artemisia santonicum essential oil. J Serb Chem Soc. 84 (12), 1355-1365 (2019).
- Su, Y., Qi, Y., Cai, L. Induction of sporulation in plant pathogenic fungi. Mycology. 3, 195-200 (2012).
- Wedge, E., Nagle, D. A new 2D-TLC bioautography method for the discovery of novel antifungal agents to control plant pathogens. J Nat Prod. 63, 1050-1054 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены