14.5 : Quotient de réaction
L'état d'une réaction réversible est estimé en évaluant son quotient réactionnel (Q). Pour une réaction réversible décrite par m A + n B ⇌ x C + y D, le quotient de la réaction est déduit directement à partir de la stœchiométrie de l'équation équilibrée comme
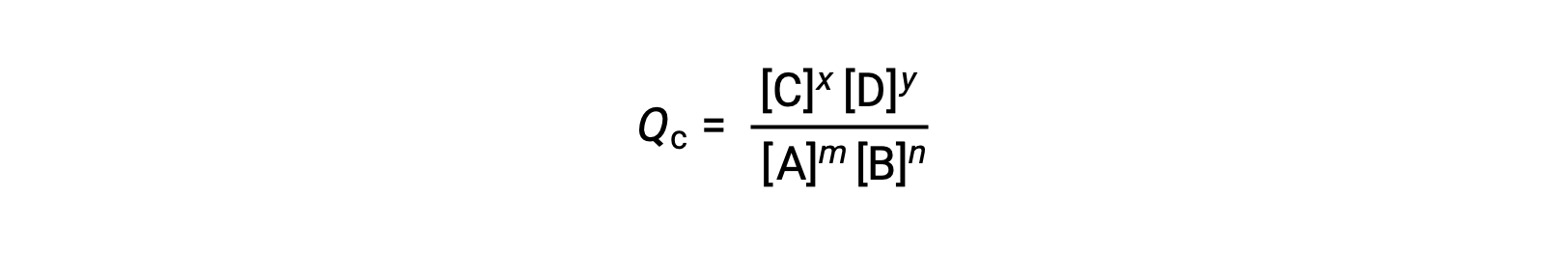
où l'indice c indique l'utilisation de concentrations molaires dans l'expression. Si les réactifs et les produits sont gazeux, un quotient réactionnel peut être déduit de la même façon en utilisant des pressions partielles :
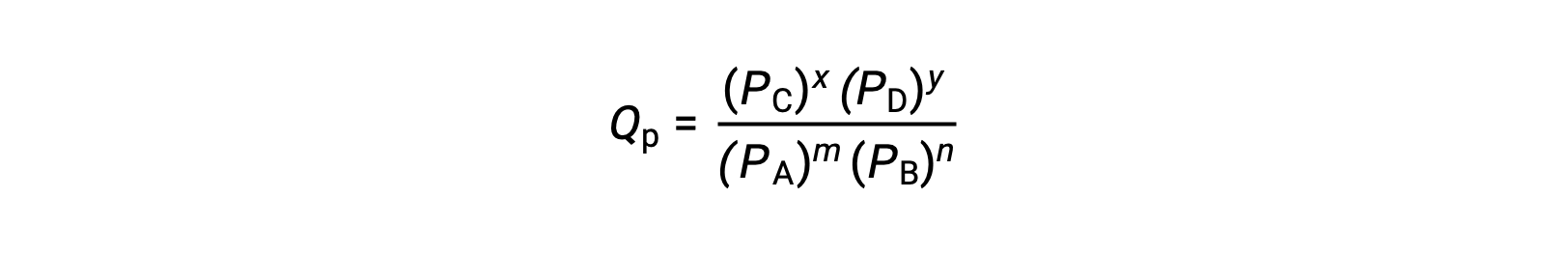
Notez que les équations du quotient réactionnel ci-dessus sont une simplification des expressions plus rigoureuses qui utilisent des valeurs relatives pour les concentrations et les pressions plutôt que des valeurs absolues. Ces valeurs relatives de la concentration et de la pression sont sans dimension (elles n'ont pas d'unités) ; par conséquent, les quotients réactionnels le sont aussi.
La valeur numérique de Q varie au fur et à mesure qu’une réaction se poursuit vers l’équilibre ; elle peut donc servir d’indicateur utile de l’état de la réaction. Pour illustrer ce point, considérez l'oxydation du dioxyde de soufre :
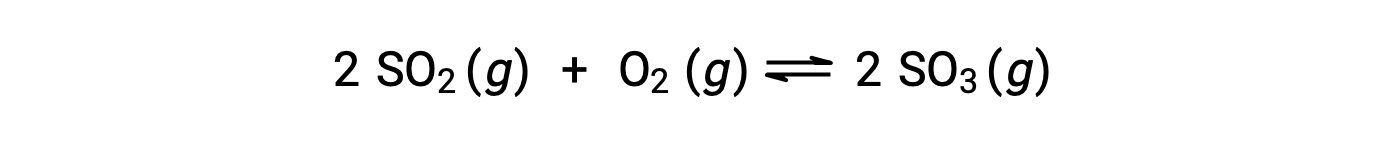
Deux scénarios expérimentaux différents sont possibles ici, l'un dans lequel cette réaction est initiée avec un mélange de réactifs seulement, SO2 et O2, et un autre qui commence avec seulement du produit, SO3. Pour la réaction qui commence par un mélange de réactifs uniquement, Q est initialement égal à zéro :
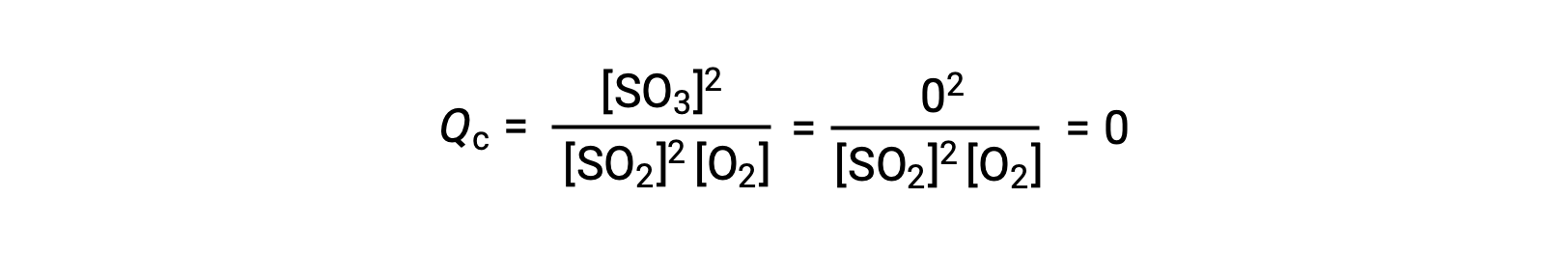
À mesure que la réaction se dirige vers l'équilibre dans le sens direct, les concentrations de réactifs diminuent (tout comme le dénominateur de Qc), la concentration du produit augmente (tout comme le numérateur de Qc) et le quotient de la réaction, par conséquent, augmente. Lorsque l'équilibre est atteint, les concentrations des réactifs et du produit restent constantes, tout comme la valeur de Qc.
Si la réaction commence avec seulement du produit présent, la valeur de Qc est initialement indéfinie (infiniment grande ou infinie) :
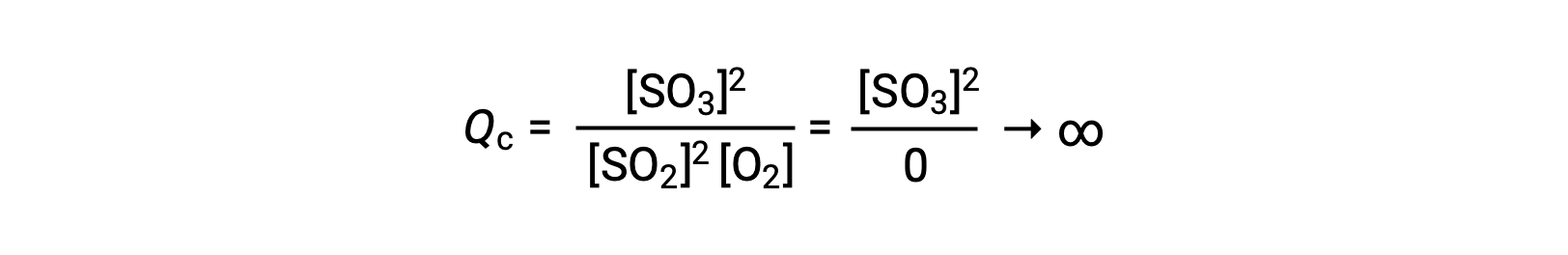
Dans ce cas, la réaction se poursuit vers l'équilibre dans la direction inverse. La concentration du produit et le numérateur de Qc diminuent avec le temps, les concentrations des réactifs et le dénominateur de Qc augmentent, et le quotient de la réaction diminue par conséquent jusqu'à ce qu'il devienne constant à l'équilibre. La valeur constante de Q qu'affiche un système à l’équilibre est appelée la constante d'équilibre, K :
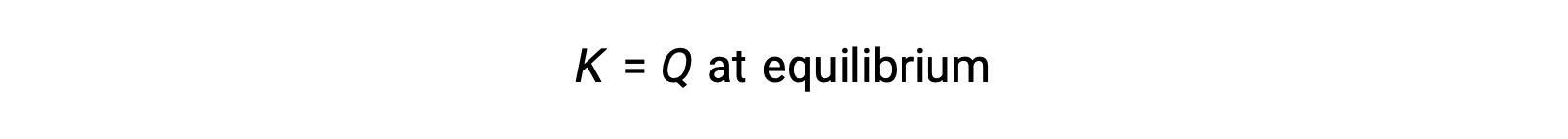
Évaluation d'un quotient réactionnel
Le dioxyde d'azote gazeux forme du tétraoxyde de diazote selon cette équation :
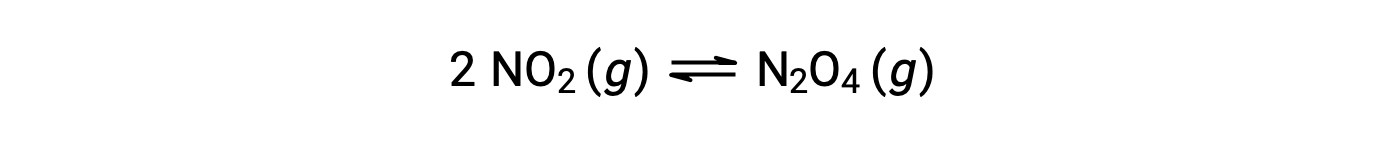
Lorsque 0,10 mol de NO2 est ajouté à une fiole de 1,0 L à 25 °C, la concentration change de sorte qu'à l'équilibre, [NO2] = 0,016 M et [N2O4] = 0,042 M. Avant la formation d'un produit, [NO2] = 0,10 M et [N2O4] = 0 M. Ainsi,
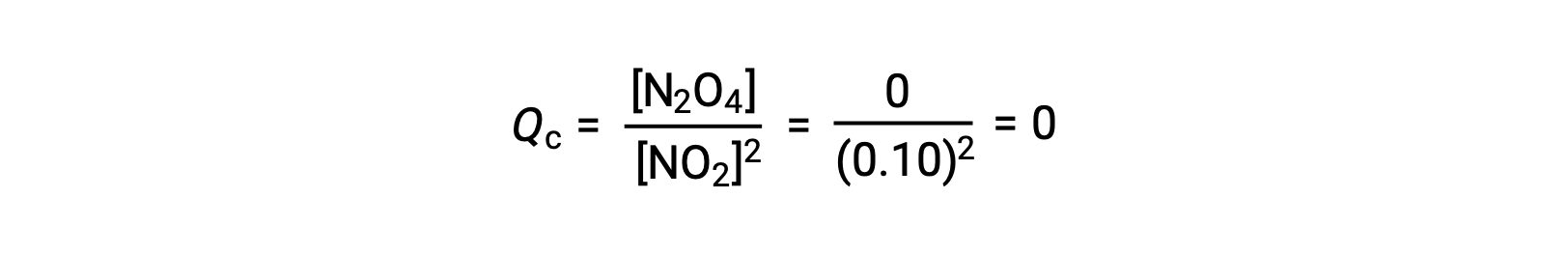
À l'équilibre,
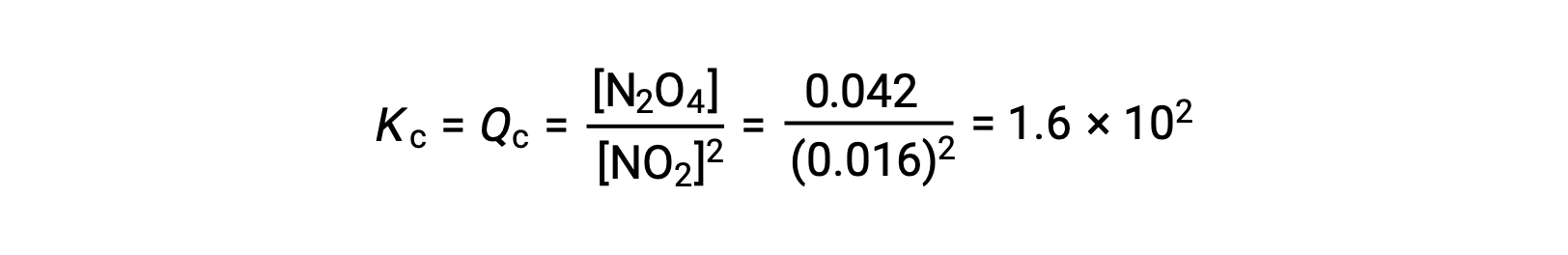
Ce texte a été adapté de Openstax, Chimie 2e, Section 13.2 Constantes d'équilibre.
Du chapitre 14:

Now Playing
14.5 : Quotient de réaction
Équilibre chimique
47.8K Vues

14.1 : Équilibre dynamique
Équilibre chimique
49.8K Vues

14.2 : La constante d'équilibre
Équilibre chimique
46.2K Vues

14.3 : Équilibre homogène pour les réactions gazeuses
Équilibre chimique
24.3K Vues

14.4 : Calcul de la constante d'équilibre
Équilibre chimique
30.6K Vues

14.6 : Calcul des concentrations d'équilibre
Équilibre chimique
47.2K Vues

14.7 : Principe de Le Châtelier : modification de la concentration
Équilibre chimique
57.1K Vues

14.8 : Principe de Le Châtelier : modification du volume (pression)
Équilibre chimique
33.8K Vues

14.9 : Principe de le Châtelier : modification de la température
Équilibre chimique
28.8K Vues

14.10 : Négliger le changement de concentration initiale
Équilibre chimique
45.7K Vues