Lo stato di una reazione reversibile viene convenientemente valutato valutando il suo quoziente di reazione (Q). Per una reazione reversibile descritta da m A + n B ⇌ x C + y D, il quoziente di reazione è derivato direttamente dalla stechiometria dell'equazione bilanciata come
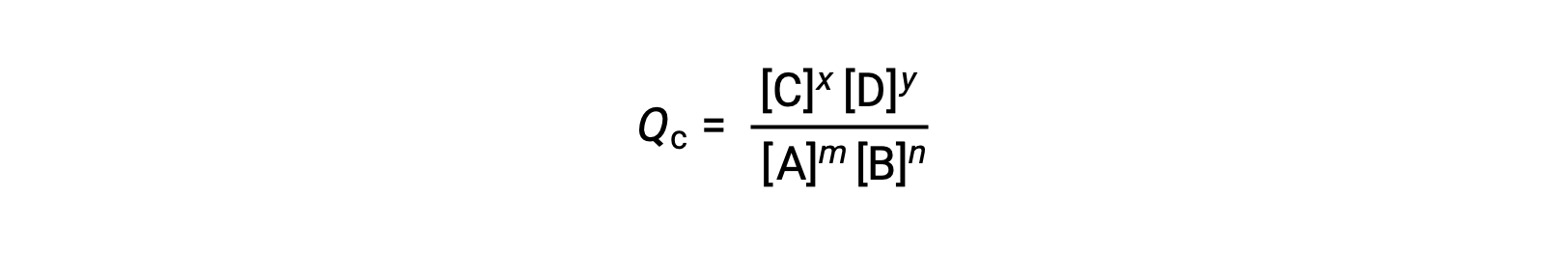
dove il pedice c denota l'uso di concentrazioni molare nell'espressione. Se i reagenti e i prodotti sono gassosi, un quoziente di reazione può essere derivato in modo simile utilizzando pressioni parziali:
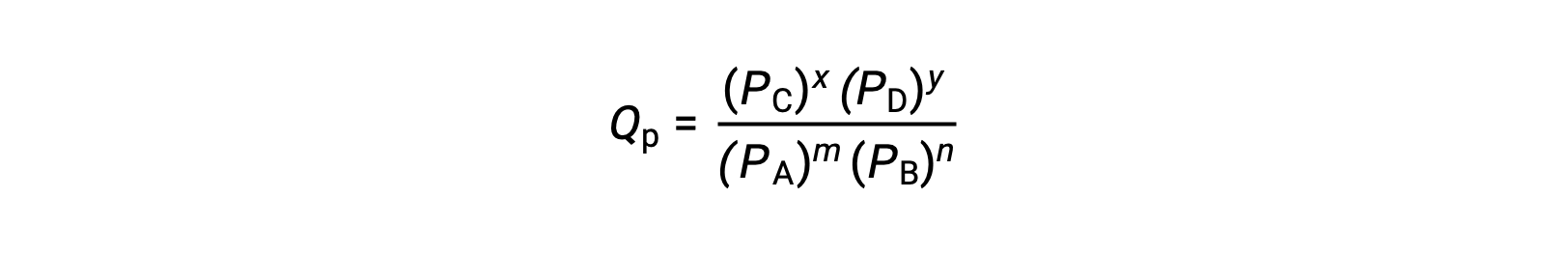
Si noti che le equazioni quozienti di reazione sopra sono una semplificazione di espressioni più rigorose che usano valori relativi per concentrazioni e pressioni piuttosto che valori assoluti. Questi valori relativi di concentrazione e pressione sono adimensionali (non hanno unità); di conseguenza, lo sono anche i quozienti di reazione.
Il valore numerico di Q varia man mano che una reazione procede verso l'equilibrio; pertanto, può servire come indicatore utile dello stato della reazione. Per illustrare questo punto, considera l'ossidazione dell'anidride solforosa:
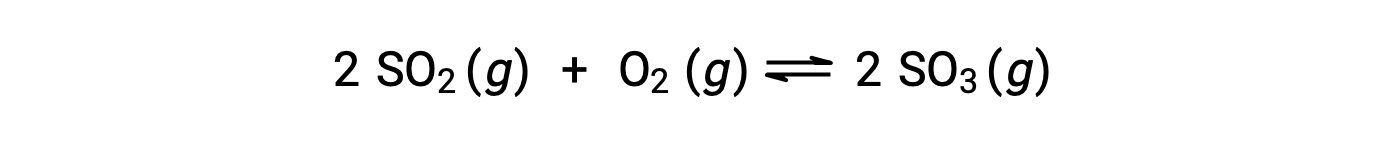
Qui sono possibili due diversi scenari sperimentali, uno in cui questa reazione viene iniziata solo con una miscela di reagenti, SO2 e O2e un altro che inizia con un solo prodotto, SO3. Per la reazione che inizia solo con una miscela di reagenti, Q è inizialmente uguale a zero:
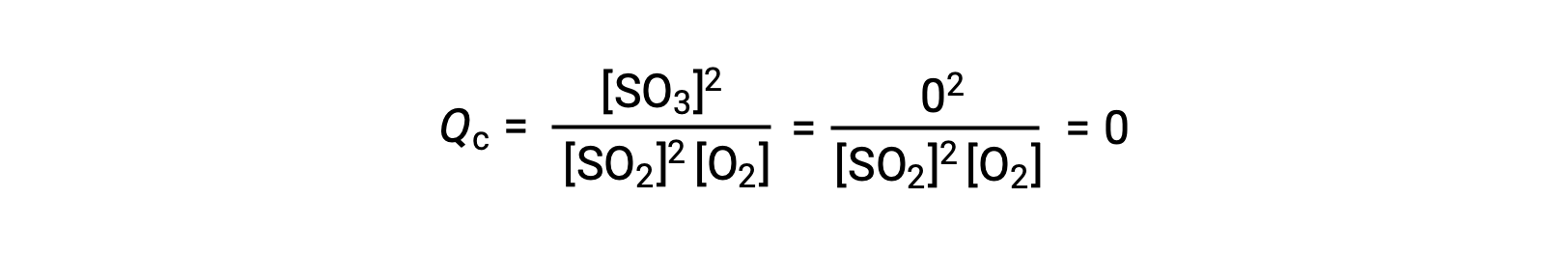
Man mano che la reazione procede verso l'equilibrio nella direzione in avanti, le concentrazioni reagenti diminuiscono (così come il denominatore di Qc), la concentrazione del prodotto aumenta (così come il numeratore di Qc), e il quoziente di reazione aumenta di conseguenza. Quando si raggiunge l'equilibrio, le concentrazioni di reagenti e prodotto rimangono costanti, così come il valore di Qc.
Se la reazione inizia con un solo prodotto presente, il valore di Qc è inizialmente indefinito (incommensurabilmente grande, o infinito):
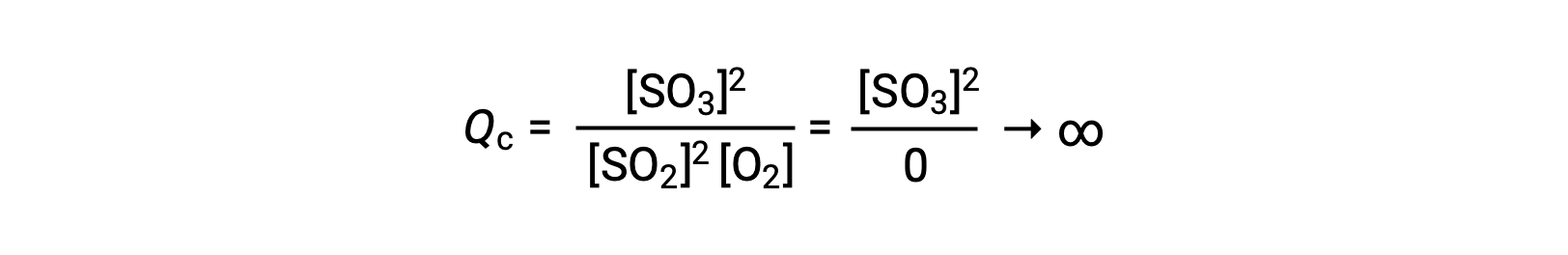
In questo caso, la reazione procede verso l'equilibrio nella direzione inversa. La concentrazione del prodotto e il numeratore di Qc diminuiscono con il tempo, le concentrazioni reagenti e il denominatore di Q caumentano, e il quoziente di reazione diminuisce di conseguenza fino a diventare costante all'equilibrio. Il valore costante di Q mostrato da un sistema all'equilibrio è chiamato costante di equilibrio, K:
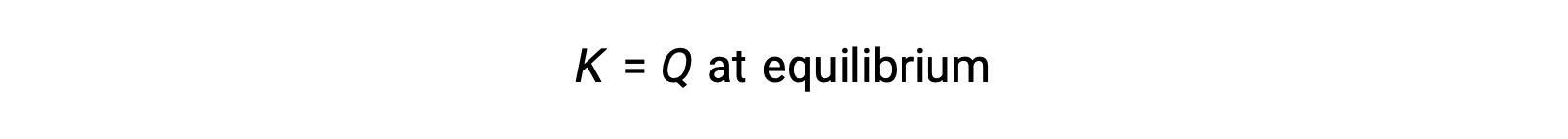
Valutazione di un quoziente di reazione
Il biossido di azoto gassoso forma tetrossido di dinitrogeno secondo questa equazione:
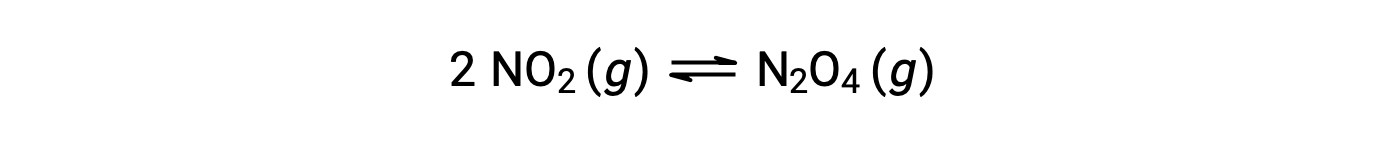
Quando 0,10 mol NO2 viene aggiunto a un pallone da 1,0-L a 25 °C, la concentrazione cambia in modo che all'equilibrio, [NO2] = 0,016 M e [N2O4] = 0,042 M. Prima della formazione di qualsiasi prodotto, [NO2] = 0,10 M e [N2O4] = 0 M. Così
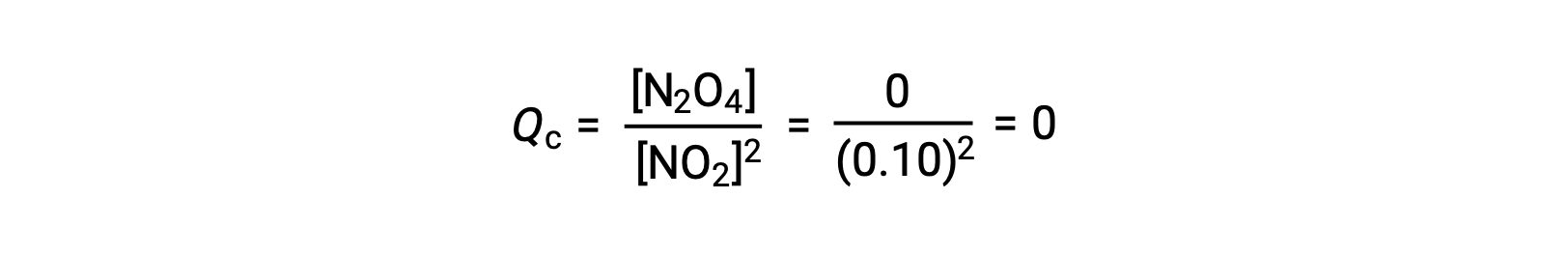
All'equilibrio,
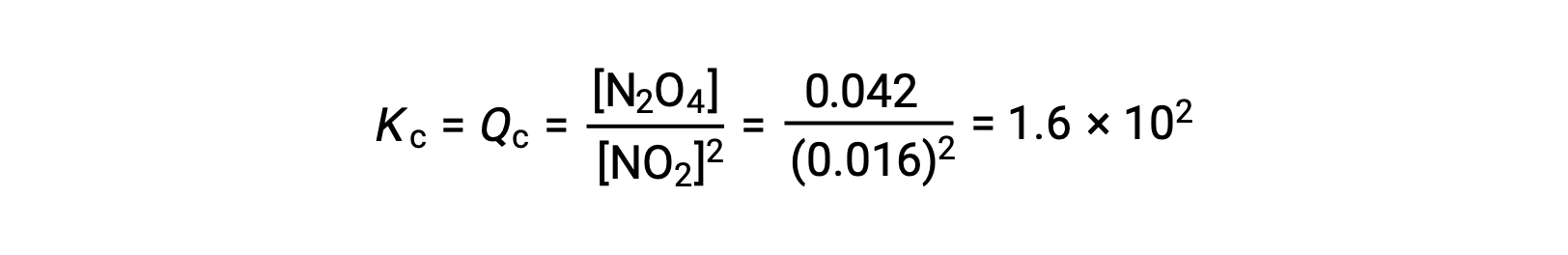
Questo testo è stato adattato da Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
Dal capitolo 14:

Now Playing
14.5 : Quoziente di reazione
Equilibrio chimico
47.5K Visualizzazioni

14.1 : Equilibrio dinamico
Equilibrio chimico
49.1K Visualizzazioni

14.2 : La costante di equilibrio
Equilibrio chimico
45.6K Visualizzazioni

14.3 : Equilibri per reazioni gassose e reazioni eterogenee
Equilibrio chimico
23.8K Visualizzazioni

14.4 : Calcolo della costante di equilibrio
Equilibrio chimico
30.3K Visualizzazioni

14.6 : Calcolo dell' equilibrio di concentrazione
Equilibrio chimico
46.5K Visualizzazioni

14.7 : Principio di Le Chatelier: cambiare la concentrazione
Equilibrio chimico
56.8K Visualizzazioni

14.8 : Principio di Le Chatelier: variazione del volume (pressione)
Equilibrio chimico
33.5K Visualizzazioni

14.9 : Principio di LeChatelier: cambiare la temperatura
Equilibrio chimico
28.6K Visualizzazioni

14.10 : La teoria del piccolo x
Equilibrio chimico
45.5K Visualizzazioni