Method Article
Encapsulation Cellulaire dans les hydrogels 3D pour l'ingénierie tissulaire
Dans cet article
Résumé
Nous présentons des protocoles pour les 3 dimensions (3D) d'encapsulation des cellules à l'intérieur des hydrogels synthétiques. La procédure d'encapsulation est décrite pour les deux méthodes couramment utilisées de réticulation (type Michael addition et la lumière à l'initiative gratuite mécanismes radicale), ainsi qu'un certain nombre de techniques pour évaluer le comportement des cellules encapsulées.
Résumé
L'encapsulation 3D de cellules dans des hydrogels représente une technique de plus en plus importante et populaire pour la culture de cellules et vers le développement de constructions pour l'ingénierie tissulaire. Cet environnement imite mieux ce que les cellules d'observer in vivo, par rapport à la culture de tissus standard, en raison des propriétés des tissus-like et un environnement 3D. Synthétique hydrogels polymères sont gonflé d'eau des réseaux qui peuvent être conçus pour être stables ou à dégrader par hydrolyse ou protéolyse que le nouveau tissu est déposé par des cellules encapsulées. Une grande variété de polymères ont été explorées pour ces applications, tels que le poly (éthylène glycol) et d'acide hyaluronique. Le plus souvent, le polymère est fonctionnalisé avec des groupes réactifs tels que méthacrylates ou d'acrylates capable de subir une réticulation par divers mécanismes. Dans la dernière décennie, beaucoup de progrès ont été réalisés dans l'ingénierie de ces microenvironnements - par exemple, via l'incorporation physique ou pendentif covalente de signaux biochimiques - pour améliorer la viabilité et le phénotype cellulaire direct, y compris la différenciation des cellules souches encapsulées (Burdick et al.).
Les méthodes suivantes pour l'encapsulation de cellules en 3D ont été optimisés dans nos laboratoires et d'autres afin de maximiser cytocompatibilité et minimiser le nombre d'étapes de traitement d'hydrogel. Dans les protocoles suivants (voir Figure 1 pour une illustration de la procédure), il est supposé que les polymères fonctionnalisés capable de subir une réticulation sont déjà dans la main; d'excellentes critiques de la chimie des polymères appliqués au domaine de l'ingénierie tissulaire peut être trouvée ailleurs (Burdick et al.) et ces méthodes sont compatibles avec une gamme de types de polymères. En outre, l'addition de Michael-type (voir Lutolf et al.) Et de la lumière à l'initiative des radicaux libres (voir Elisseeff et al.) Mécanismes axés sur ici ne constituent qu'une petite partie des techniques de réticulation signalés. Réticulation en mode mixte, dans lequel une partie des groupes réactifs est d'abord consommé par réticulation addition et suivi par un mécanisme radicalaire, est un autre paradigme couramment utilisé et puissant pour diriger le phénotype des cellules encapsulées (Khetan et al. Salinas et al.).
Protocole
Préparation A. Matériel et stérilisation
- Avant de matériaux d'encapsulation préparation, préparer une solution de 0,5% en poids du photoamorceur Irgacure 2959 (I2959) en tampon phosphate salin (PBS), en mélangeant et en incubant pendant plusieurs jours à 37 ° C. La solution peut alors être filtrée pour la stérilisation de seringues et stockés à température ambiante pendant une utilisation prolongée.
- Basé sur la composition souhaitée des gels d'être synthétisée, calculer (à l'aide d'un tableur comme Microsoft Excel) le poids de polymère et de réticulant nécessaire. Parce que un poids donné de polymère doit être dissous dans un volume défini au total pour atteindre une concentration souhaitée dans les hydrogels, le réticulant et des portions de la solution de polymère le volume du gel total doit également être déterminée en utilisant le tableur. Des calculs similaires devraient être faites le cas échéant parties pendantes (par exemple, un adhésif contenant RGD ou YGSR oligopeptide) doivent être incorporés avant réticulation.
- Peser la quantité requise de polymère et de réticulant et le placer dans des tubes Eppendorf. Ajuster la feuille de calcul en conséquence pour le poids réel du polymère obtenu. (Remarque: les volumes peuvent être modifiés afin de compenser la masse réelle de polymère et de réticulant obtenus).
- Préparer les moules de gel en utilisant une lame de rasoir pour couper les sommets hors des seringues stériles enveloppés séparément 1 mL à usage unique. Assurer une coupe à plat est fait pour les moules à être utilisé pour des gels photopatterned.
- Placer les moules seringue, des tubes Eppendorf (avec bouchons ouverts) et tout autre matériel nécessaire sous une source de lumière germicide (généralement intégré dans les armoires de sécurité biologique) et stériliser pendant 30 minutes.
Préparation des cellules B.
- Après stérilisation, ajouter le volume tampon stérile approprié (par les calculs sur tableur, tandis que le choix de la mémoire tampon peut varier, et un tampon PBS base faible telle que la triéthanolamine sont généralement utilisés pour la réticulation radicale et de type Michael libres, respectivement) au polymère et Eppendorf fraction pendentif (en option) d'être inclus (par exemple, de l'adhésif peptide) et le vortex de dissoudre (si vortex en dehors de la hotte stérile envelopper l'Eppendorf avec du parafilm).
- Ajouter le volume approprié de la solution de fraction de pendant à la solution de polymère et envelopper le joint avec du parafilm. Brièvement au vortex et incuber à 37 ° C à réagir (si possible, au sommet d'une plaque d'agitation rotatif) lors de la préparation cellulaire. Cela implique la réaction d'un thiol sur un peptide (via le groupe cystéine) à un acrylate ou méthacrylate de sorte que le peptide est inclus en tant que groupe pendentif en hydrogel finale.
- Trypsiniser et compter les cellules et les séparer en portions contenant le nombre approprié pour chaque ensemble de gels. Par exemple, pour un ensemble de trois gels 50 uL d'une densité de 10 millions de cellules / ml, 1,5 millions de cellules séparées dans un tube conique individuelle. Il est recommandé que pas plus de 4 gels être préparés dans un ensemble individuel en raison du calendrier de gélification (note: si la synthèse de plusieurs ensembles de gels, d'un seul Eppendorf contenant un volume adéquat de solution de polymère pour tous les jeux peuvent être préparés).
- Centrifuger les cellules.
- Alors que les cellules sont filer vers le bas
- Lumière initiée sans réticulation radicale: ajouter 0,5% I2959 solution à la solution de polymère égale à 10% du volume total des mis en gel (pour une concentration de l'initiateur finale de 0,05% en poids).
- Type Michael (ajout) de réticulation: ajoutez tampon pour le réticulant pour atteindre la solution de concentration appropriée.
- Pour réticulation séquentiel: ces gels intégrer les deux types de réticulation et nécessitent à la fois des étapes précédentes.
Formation d'hydrogel C.
- Aspirer le surnageant de la partie cellulaire centrifugé. Attendez de liquide pour régler après aspiration initiale et ré-aspiration pour enlever les médias autant que possible, sans perturber le culot cellulaire.
- Reprendre le culot cellulaire avec la solution de polymère jusqu'à cellules sont réparties uniformément. Minimiser la formation de bulles par lentement pipetage la solution de haut en bas (environ 10 cycles devrait être suffisante pour distribuer des cellules).
- Les hydrogels de réticulation
- Lumière initiée sans réticulation radicalaire: Aliquoter le volume approprié dans des moules bout de la seringue. Exposer les seringues à la lumière UV pour réticulation radicalaire (par exemple, une exposition de 10 minutes à 365 nm, 4 mW/cm2 lumière UV est commun pour les polymères fonctionnalisés acrylate). Cette étape doit être effectuée rapidement afin de minimiser la cellule de décantation avant d'exposition à la lumière UV.
- Type Michael (ajout) de réticulation: Utilisation d'un large orifice pointe de la pipette, ajouter le volume approprié de solution réticulant à la solution polymère / cellule, mis la pipette au volume désiré de gel individuels, une pipette la solution haut et bas pourhomogénéiser et aliquot dans les moules bout de la seringue. Cette étape doit être effectuée rapidement afin d'assurer une répartition homogène de cellules. Laisser 10-30 minutes (selon le système individuel) d'incubation dans la hotte de la culture de la réticulation.
- Réticulation séquentielle: Cela implique la réaction d'addition de type Michael d'abord, puis l'exposition à la lumière pendant la réticulation secondes. Seule une fraction des liaisons de réticulation théorique devrait être mis à réagir lors de la réticulation d'abord et ensuite un masque stérile doit être appliqué directement sur la surface du gel avant d'exposition à la lumière en utilisant une pince à épiler stérilisée. Un colorant fonctionnalisés (par exemple, la rhodamine méthacrylatée (MeRho) à une concentration finale dans le gel de 20 nM) peuvent également être ajoutés à la solution initiale pour visualiser les motifs, car il va incorporer préférentiellement dans les régions radicalement réticulé du gel (figure 2 ).
Culture cellulaire D. et analyse
- Après réticulation, les gels plonger dans les puits d'une plaque de culture de tissus contenant des milieux d'incubation et de l'analyse (voir les étapes ci-dessous).
- Les cellules peuvent être visualisées pour la morphologie par microscopie optique (figure 3; généralement, les hydrogels synthétisés sont transparentes) et de la viabilité en utilisant un kit de coloration fluorescente vivants / morts (Figures 3 et 4). Coloration pour cellulaires actine (par exemple, la rhodamine ou fluorescéine phalloïdine étiquetés) et des noyaux (par exemple, 4'-6-diamidino-2-phénylindole (DAPI)) peut être réalisée à l'aide de fixation et des procédures standard de perméabilisation (figure 4) avec la procédure suivante.
- Rincez les constructions 3X pendant 5 min avec du PBS.
- Fixer des gels par incubation dans une ml de formaldéhyde 4% pendant 30 min à température ambiante.
- Rincez les constructions 3X avec une solution de blocage contenant 3% (p / v) de BSA et 0,5% (p / v) de Tween dans le PBS.
- Perméabiliser la membrane de 0,25% (p / v) de Triton X dans la solution de blocage pendant 20 min.
- Rincez les constructions 3X avec une solution de blocage.
- Tache de F-actine avec 0,66 g / mL FITC ou rhodamine phalloïdine dans une solution de blocage pendant deux heures à température ambiante.
- Rincez 3x avec une solution de blocage.
- Tache noyaux cellulaires utilisant 0,4 ul / ml DAPI dans du PBS pendant 20 min.
- Rincer avec du PBS 3X.
- Visualisez les cellules en utilisant la microscopie à épifluorescence ou confocal.
- Prolifération des cellules dans des gels est communément évaluée en utilisant des analyses disponibles dans le commerce (par exemple, l'ADN total ou le contenu biochimique). PicoGreen est couramment utilisé et sensible d'acide nucléiques fluorescentes tache pour quantifier l'ADN double brin (Singer et al.). Les cellules peuvent également être comptés et normalisée à un nombre de contrôle initial en utilisant les méthodes de visualisation décrit dans l'étape 2.
- Sectionnement et coloration histologique peut aussi être utilisé pour visualiser les cellules et la matrice formée. Le protocole suivant pour la déshydratation et le sectionnement des hydrogels 3D peut être utilisée pour obtenir des tranches transversales sur des lames de verre:
- Fixation et la déshydratation
- Rincez 3X spécimen dans du PBS.
- Correction pour les 5 - 30 minutes dans du paraformaldéhyde 4%.
- Rincez 3X spécimen dans du PBS.
- Incuber l'échantillon dans EtOH à 25 ° C pendant 1 heure à chacune des catégories suivantes EtOH (v / v) sur les concentrations dans l'eau (dans l'ordre): 50%, 70%, 95%, 95%, 100% (A ce point, des échantillons peut être stockée pendant la nuit à 25 ° C).
- Compensation et d'infiltration
- Transfert à 100% Citrisolv pendant 1 heure à 25 ° C, suivie d'une heure à 65 ° C.
- Couper les échantillons en deux avec une lame de rasoir dans une boîte de Pétri de telle sorte que la section transversale de l'échantillon est exposé.
- Transfert à 01h01 mélange de Citrisolv / Micro-cut paraffine pendant 1 heure à 65 ° C.
- Transfert à 100% Micro-coupure de paraffine pendant 1 heure à 65 ° C.
- Transfert à 100% de micro-coupé paraffine nuit à 65 ° C.
- Transfert à 100% Micro-coupure de paraffine pendant 1-2 heures à 65 ° C.
- Embedding
- Spécimen Position dans pelable moule avec de la paraffine à 100%.
- Placer une petite quantité de cire dans le lit de la moisissure, et insérez les deux moitiés de l'échantillon avec la section transversale vers le bas.
- Appliquez dessus morceau de filtre
- Ajouter la cire supplémentaire pour plonger la pièce supérieure et laisser durcir pendant environ 10 minutes.
- Transfert inserts à 4 ° C pour permettre réfrigérateur spécimen à durcir nuit.
- Échantillon peut être la sectioned le jour suivant, généralement au micron d'épaisseur 5-10 par tranche en utilisant microtomes disponibles commercialement. Typiquement le moule pelable est monté à la verticale contre le stade microtome, et les commandes manuelles sont utilisées pour définir l'épaisseur de coupe, trancheuse et l'alignement de l'échantillon avec la lame.
- Extraction des ARN
L'expression des gènes peut également être évalués quantitativement (par exemple, via en temps réel la réaction en chaîne polymérase (PCR)). Le protocole d'extraction d'ARN à partir d'hydrogels 3D, dont un exemple est donné ci-dessous, est assez différent du cas beaucoup plus simples en 2D.- Étiqueter un certifié RNAse tube Eppendorf pour chaque hydrogel 3D et ajouter 500 uL Trizol ® réactif pour chaque tube.
- Utilisez un pilon (broyeur de tissus) à la main broyer les hydrogels jusqu'à ce qu'une solution claire soit obtenue. Assurez-broyeurs différents sont utilisés pour chaque condition.
- Vortex chaque Eppendorf pendant 20 secondes afin d'homogénéiser les échantillons.
- Incuber les échantillons à température ambiante pendant cinq minutes afin de permettre la dissociation complète des complexes nucléoprotéiques.
- Laisser refroidir sur des échantillons de glace pendant 20 min
- Ajouter 200 ul (par ml Trizol) chloroforme pour chaque échantillon et vortex.
- Incuber les échantillons à température ambiante pendant cinq minutes.
- Centrifuger les échantillons à 12000 xg à 4 ° C pendant 15 min.
- Transférer la phase aqueuse (clair couche supérieure) à de nouveaux tubes Eppendorf (en évitant la région interfaciale et inférieure rouge, phénol-chloroforme phase). ARN reste dans la phase aqueuse limpide.
- Techniques communes pour l'isolation de l'ARN et de stockage peut désormais être utilisé.
- Suite à l'extraction d'ARN, des kits disponibles dans le commerce pour la transcriptase inverse et la PCR en temps réel sont souvent utilisés avec quelques modifications (Elisseff et al. Strehin et al.).
- Fixation et la déshydratation
Les résultats représentatifs:
Voir les figures 2-4 (tel que référencé dans les protocoles ci-dessus) pour obtenir des résultats représentatifs de la visualisation d'hydrogels photopatterned et l'encapsulation des cellules à l'intérieur des gels.
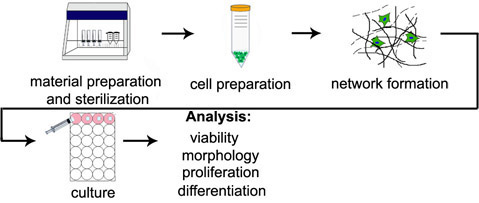
Figure 1. Vue d'ensemble de la procédure d'encapsulation 3D. Schéma étapes correspondent aux titres de section dans les protocoles par étapes.
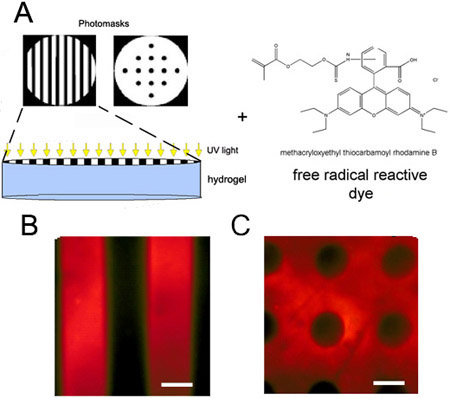
Figure 2. Hydrogel Photopatterned utilisant séquentielle de polymérisation par addition de type Michael, puis radicale. (A) Schéma de photopatterning d'un hydrogel partiellement réticulé avec incorporation d'un colorant réactif photo. (B) Cercle ou (C) masque de bandes film transparent à motifs hydrogels d'acide hyaluronique. Rhodamine méthacrylatée (MeRho) est constituée uniquement dans les régions du gel qui ont été exposés à la lumière. Barres d'échelle = 100 pm.
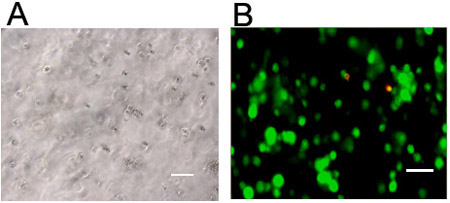
Figure 3. Visualisation des cellules dans des hydrogels 3D. Les cellules souches visualisés via (a) microscopie optique ou (b) direct (vert, calcéine AM) et morts (rouge, éthidium homodimère-1) coloration 24 heures suivant l'encapsulation moins 1 million de cellules / ml dans un hydrogel d'acide hyaluronique réticulé par une lumière initiée sans mécanisme radicalaire. Barres d'échelle = 100 pm.
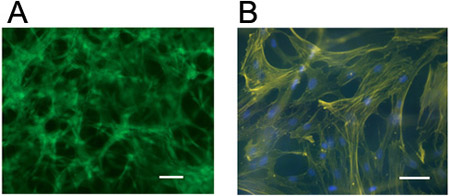
Figure 4. Visualisation des cellules dans des hydrogels 3D. hMSCs colorées pour (a) des cellules vivantes (calcéine AM) ou (b) l'actine cellulaire (rhodamine phalloïdine) et des noyaux (DAPI) cinq jours après l'encapsulation à 1 millions de cellules / ml dans un hydrogel d'acide hyaluronique réticulé par un mécanisme de type Michael ( en utilisant des peptides adhésives pendentif et bifonctionnels réticulants peptide protéolytique dégradable). Barres d'échelle = 100 pm.
Discussion
Les protocoles décrits représentent une méthode simple et puissant pour encapsuler des cellules au sein de l'hydrogel échafaudages de manière cytocompatible. Ces techniques sont particulièrement importantes car terminale différenciées et des cellules souches peuvent présenter un comportement nettement différent dans des microenvironnements 2D contre 3D. Même pour des approches thérapeutiques impliquant l'implantation de matériaux (par exemple, in situ de polymérisation radicalaire), l'encapsulation de cellules et l'analyse de la viabilité et la différenciation peut aider dans le processus de développement matériel. Le processus décrit séquentielle peut être utilisée pour manipuler l'environnement spatialement hydrogel, et le comportement en conséquence cellulaires (voir Khetan et al.).
Globalement, l'élément le plus critique des protocoles décrits est l'homogénéité de l'ensemble des solutions utilisées. En particulier, une attention particulière doit être prise pour assurer les cellules sont réparties uniformément dans la solution de prépolymère, et que la solution est bien mélangée par resuspension pipette après addition de la solution de réticulant. Avoir omis de veiller cela peut conduire à l'agglutination des cellules ou des variations locales de la structure de gel et de l'enflure.
Alors que les protocoles présentés ici portent essentiellement sur la procédure à suivre pour l'encapsulation des cellules, il est important de noter également que l'encapsulation peut nécessiter une certaine adaptation à des protocoles d'analyse qui sont généralement écrites pour l'ensemencement 2D. Plusieurs exemples ont été illustrés pour la visualisation et l'évaluation des cellules dans des hydrogels.
Remerciements
Ce travail a été soutenu par la National Science Foundation Fellowship Graduate Research au SK et des National Institutes of Health octroi R01EB008722.
matériels
| Name | Company | Catalog Number | Comments | |
| I2959 | Reagent | Ciba Specialty Chemicals | ||
| .2 M Triethanolamine Buffer | Reagent | Sigma-Aldrich | T0449 | |
| PBS | Reagent | Invitrogen | 14040-117 | 1x, sterile liquid |
| Live/Dead staining kit | Reagent | Invitrogen | L3224 | Includes live (Calcein AM) and dead (ethidium homodimer-1) probes |
| Phalloidin-FITC | Reagent | Sigma-Aldrich | P5282 | |
| Rhodamine Phalloidin | Reagent | Invitrogen | R415 | |
| DAPI | Reagent | Sigma-Aldrich | D9542 | |
| Methacryloxyethyl thiocarbamoyl rhodamine B (MeRho) | Reagent | Polysciences, Inc. | 23591 | |
| Bovine Serum Albumin | Reagent | Sigma-Aldrich | A7030 | |
| Tween 20 | Reagent | Sigma-Aldrich | P1379 | |
| Triton X-100 | Reagent | Sigma-Aldrich | T8787 | |
| Citrisolv | Reagent | Fisher Scientific | 22-143975 | |
| Micro-cut paraffin | Reagent | Polysciences, Inc. | 24202 | |
| Trizol reagent | Reagent | Invitrogen | 15596-026 | |
| 0.22 μm pore size nylon syringe filters | Equipment | Fisher Scientific | 09-719C | |
| 1 mL disposable syringes | Equipment | BD Biosciences | 309602 | Cut syringes at consistent height for UV exposure |
| Wide orifice pipette tips | Equipment | Sigma-Aldrich | P6800 | |
| Omnicure UV Spot Cure System with 365 nm filter | Equipment | EXFO | S1000 | |
| 254 nm germicidal UV light source | Equipment | Built into most biological safety cabinets |
Références
- Singer, V. L., Jones, L. J., Yue, S. T., Haugland, R. P. Characterization of PicoGreen reagent and development of a fluorescence-based solution assay for double-stranded DNA quantitation. Anal Biochem. 249, 228-238 (1997).
- Lutolf, M. P., Raeber, G. P., Zisch, A. H., Tirelli, N., Hubbell, J. A. Cell-Responsive Synthetic Hydrogels. Adv Mater. 15, 888-892 (2003).
- Elisseeff, J. H., Ruffner, M., Kim, T. G., Williams, C. Cellular Photoencapsulation in Hydrogels. Culture of Cells for Tissue Engineering. , (2006).
- Chung, C., Mesa, J., Miller, G. J., Randolph, M. A., Gill, T. J., Burdick, J. A. Effects of auricular chondrocyte expansion on neocartilage formation in photocrosslinked hyaluronic acid networks. Tissue Eng. 12, 2665-2773 (2006).
- Burdick, J. A., Vunjak-Novakovic, G. V. Engineered microenvironments for controlled stem cell differentiation. Tissue Eng. Part A. 15, 205-219 (2008).
- Salinas, C. N., Anseth, K. S. Mixed Mode Thiol-Acrylate Photopolymerization for the Synthesis of PEG-Peptide Hydrogels. Macromolecules. 41, 6019-6026 (2008).
- Kraehenbuehl, T. P., Ferreira, L. S., Zammaretti, P., Hubbell, J. A., Langer, R. Cell-responsive hydrogel for encapsulation of vascular cells. Biomaterials. 30, 4318-4324 (2009).
- Strehin, I. A., Elisseeff, H. J. Characterizing ECM Production by Cells Encapsulated in Hydrogels. Methods Mol Biol. 522, 1-14 (2009).
- Khetan, S., Katz, J. S., Burdick, J. A. Sequential crosslinking to control cellular spreading in 3-dimensional hydrogels. Soft Matter. 5, 1601-1606 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon