Method Article
Incapsulamento cellulare in idrogel 3D per l'ingegneria tissutale
In questo articolo
Riepilogo
Vi presentiamo i protocolli per le 3 dimensioni (3D) incapsulamento delle celle all'interno di idrogel sintetico. La procedura di incapsulamento viene delineato per due metodi comunemente usati di reticolazione (michael-tipo di addizione e di luce iniziata meccanismi di radicali liberi), come pure una serie di tecniche per la valutazione del comportamento delle cellule incapsulate.
Abstract
L'incapsulamento 3D di cellule all'interno idrogel rappresenta una tecnica sempre più importante e popolare per la coltura delle cellule e verso lo sviluppo di costrutti per l'ingegneria tissutale. Questo ambiente riproduce meglio ciò che osservare le cellule in vivo, rispetto alla cultura dei tessuti standard, a causa del tessuto simil-proprietà e ambiente 3D. Idrogel polimerici sintetici sono gonfi d'acqua le reti che possono essere progettati per essere stabili o di degradare tramite idrolisi o proteolisi come nuovo tessuto viene depositato dalle cellule incapsulate. Una vasta gamma di polimeri sono stati esplorati per queste applicazioni, come la poli (glicole etilenico) e acido ialuronico. Più comunemente, il polimero è funzionalizzato con gruppi reattivi come metacrilati o acrilati poter subire una reticolazione attraverso vari meccanismi. Negli ultimi dieci anni, molti progressi sono stati fatti nel campo dell'ingegneria questi microambienti - ad esempio, tramite l'incorporazione fisica o ciondolo covalente di segnali biochimici - fenotipo cellulare per migliorare la viabilità e diretto, tra cui la differenziazione delle cellule staminali incapsulate (Burdick et al.).
I seguenti metodi per l'incapsulamento 3D delle cellule sono stati ottimizzati nel nostro ed altri laboratori per massimizzare citocompatibilità e minimizzare il numero di fasi di lavorazione idrogel. Nei protocolli seguenti (vedi Figura 1 per l'illustrazione della procedura), si assume che i polimeri funzionalizzati in grado di subire reticolazione sono già in mano, ottime recensioni della chimica dei polimeri, applicato al campo della ingegneria dei tessuti possono essere trovati altrove (Burdick et al.) e questi metodi sono compatibili con una vasta gamma di tipi di polimeri. Inoltre, l'aggiunta Michael-tipo (vedi Lütolf et al.) E la luce iniziati radicali liberi (vedi Elisseeff et al.) Meccanismi concentrati qui costituiscono solo una piccola parte delle tecniche di reticolazione segnalati. Reticolazione modalità mista, in cui una parte di gruppi reattivi viene prima consumato da oltre reticolazione e seguita da un meccanismo radicale, è un altro paradigma comunemente utilizzati e potenti per dirigere il fenotipo delle cellule incapsulate (Khetan et al. Salinas et al.).
Protocollo
A. La preparazione dei materiali e sterilizzazione
- Prima di materiali di incapsulamento preparazione, preparare una soluzione 0,5% in peso del fotoiniziatore Irgacure 2959 (I2959) in tampone fosfato salino (PBS), mixando e incubazione per diversi giorni a 37 ° C. La soluzione può allora essere filtrati siringa per la sterilizzazione e conservati a temperatura ambiente per un utilizzo a lungo termine.
- Sulla base della composizione desiderata di gel da sintetizzare, calcolare (usando un foglio di calcolo come Microsoft Excel) il peso di polimero e reticolante necessario. Perché un dato peso di polimero deve essere sciolto in un determinato volume totale per ottenere una concentrazione desiderata in idrogel, il reticolante e porzioni soluzione di polimero del volume gel totale deve essere determinato anche utilizzando il foglio di calcolo. Calcoli simili dovrebbero essere eventuali frazioni di sospensione (ad esempio, un adesivo o RGD YGSR contenenti oligopeptide) devono essere inseriti prima di reticolazione.
- Pesare la quantità di polimero e reticolante e il luogo in tubi Eppendorf. Regolare il foglio di calcolo di conseguenza per il peso effettivo del polimero ottenuto. (Nota: i volumi possono essere modificati per compensare la massa effettiva del polimero reticolante e ottenuto).
- Preparare gli stampi gel utilizzando una lama di rasoio per tagliare le cime via di confezione singola sterile monouso siringhe da 1 ml. Garantire un taglio piatto è fatto per stampi da utilizzare per i gel photopatterned.
- Mettere gli stampi siringa, provette Eppendorf (con tappi aperto) e qualsiasi altro materiale necessario, sotto una fonte di luce germicida (tipicamente integrato in cappe di sicurezza biologica) e sterilizzare per 30 minuti.
B. Preparazione cellulare
- Dopo la sterilizzazione, aggiungere il giusto volume di tampone sterile (per calcoli di foglio di calcolo, mentre la scelta del buffer può variare, PBS e un buffer di base debole come trietanolammina sono tipicamente utilizzati per la reticolazione radicali liberi e michael-tipo, rispettivamente) alla Eppendorf polimero e (opzionalmente) porzione ciondolo da inserire (per esempio, adesivi peptide) e vortice di sciogliere (se al di fuori del vortex avvolgere la cappa sterile Eppendorf con parafilm).
- Aggiungere il volume appropriato di soluzione porzione pendant alla soluzione di polimeri e avvolgere il sigillo con parafilm. Mescolare brevemente nel vortex e incubare a 37 ° C a reagire (se possibile, in cima a un piatto mescolare rotante) durante la preparazione delle cellule. Questo implica la reazione di un tiolo su un peptide (via gruppo cisteina) ad un acrilato o metacrilato in modo che il peptide è incluso come un gruppo ciondolo in idrogel finale.
- Trypsinize e contare le cellule e si separano in porzioni contenenti il numero appropriato per ogni set di gel. Ad esempio, per una serie di tre da 50 microlitri gel ad una densità di 10 milioni di cellule / ml, 1,5 milioni separato le cellule in una provetta conica individuale. Si raccomanda di non più di 4 gel essere preparati in un set singolo a causa della tempistica di gelificazione (nota: se sintetizzare più set di gel, un singolo Eppendorf contenente un adeguato volume di soluzione polimerica per tutti i set possono essere preparati).
- Centrifugare le cellule.
- Mentre le cellule girano verso il basso
- Luce iniziata reticolazione radicali liberi: aggiungere 0,5% in peso I2959 soluzione alla soluzione di polimeri pari al 10% del volume totale di gel (per una concentrazione finale iniziatore dello 0,05% in peso).
- Michael-type (aggiunta) reticolazione: aggiungere buffer nel reticolante per ottenere la soluzione adeguata concentrazione.
- Per reticolazione sequenziali: questi gel incorporare entrambi i tipi di reticolazione e richiedono entrambi i passaggi precedenti.
C. Hydrogel Formazione
- Aspirare il surnatante dalla parte delle cellule centrifugato. Attendere il liquido di stabilirsi dopo l'aspirazione iniziale e ri-aspirare a rimuovere il supporto quanto più possibile senza disturbare il pellet.
- Risospendere il pellet cellulare con la soluzione di polimero fino cellule sono uniformemente distribuite. Minimizzare la formazione di bolle lentamente pipettaggio la soluzione su e giù (circa 10 cicli dovrebbe essere sufficiente per distribuire le cellule).
- Reticolazione idrogel
- Luce iniziata radicali liberi reticolazione: Distribuire il volume appropriato in stampi siringa. Esporre le siringhe ai raggi UV per la reticolazione radicale (ad esempio, una esposizione 10 minuti a 365 nm, 4 mW/cm2 luce UV è comune per i polimeri funzionalizzati acrilato). Questa operazione deve essere eseguita rapidamente per ridurre al minimo delle cellule assestamento prima dell'esposizione ai raggi UV.
- Michael-type (aggiunta) reticolazione: Utilizzando un ampio orifizio punta della pipetta, aggiungere il volume appropriato di soluzione reticolante al polimero / cella soluzione, impostare la pipetta per il volume desiderato gel individuali, pipetta la soluzione su e giù peromogeneizzare e aliquote in stampi pendere l'ago della siringa. Questa operazione deve essere eseguita rapidamente per garantire una distribuzione uniforme delle celle. Lasciare 10-30 minuti (a seconda del sistema individuale) di incubazione nel cappuccio cultura per reticolazione.
- Reticolazione sequenziale: si tratta di Michael-tipo di reazione di addizione e poi l'esposizione alla luce per la reticolazione secondo. Solo una frazione di legami crociati teorica dovrebbe essere reagito durante la reticolazione e poi una mascherina sterile deve essere applicato direttamente sulla superficie del gel prima di esposizione alla luce utilizzando una pinzetta sterilizzata. Un colorante funzionalizzati (ad esempio, rodamina methacrylated (MeRho) ad una concentrazione finale nel gel di 20 Nm) può anche essere aggiunto alla soluzione iniziale per visualizzare il modello, dato che incorporano preferenzialmente nelle regioni radicalmente reticolato del gel (Figura 2 ).
D. coltura cellulare e analisi
- A seguito di reticolazione, gel immergersi in pozzetti di una piastra di coltura di tessuti contenenti i media per l'incubazione e l'analisi (vedere i passaggi seguenti).
- Le celle possono essere visualizzati per la morfologia con microscopia ottica (figura 3, in genere, gli idrogel sintetizzati sono trasparenti) e la vitalità usando un fluorescente live / morti kit di colorazione (figure 3 e 4). Colorazione per cellulari actina (ad esempio, rodamina o marcate con fluoresceina falloidina) e nuclei (ad esempio, 4'-6-Diamidino-2-fenilindolo (DAPI)) possono essere eseguite utilizzando la fissazione e procedure standard permeabilizzazione (Figura 4) con la seguente procedura.
- Sciacquare costruisce 3X per 5 minuti con PBS.
- Fix gel mediante incubazione in 1 ml di formaldeide al 4% per 30 minuti a temperatura ambiente.
- Sciacquare costruisce 3X con una soluzione di blocco contenente il 3% (w / v) di BSA e 0,5% (w / v) Tween in PBS.
- Permeabilize membrana con 0,25% (w / v) Triton X nel bloccare la soluzione per 20 min.
- Sciacquare costruisce 3X con il blocco soluzione.
- Macchia di F-actina con 0,66 mg / ml FITC o rodamina falloidina nel bloccare una soluzione per due ore a temperatura ambiente.
- Sciacquare 3x con blocco soluzione.
- Macchia nuclei cellulari utilizzando 0,4 microlitri / ml DAPI in PBS per 20 min.
- Sciacquare 3X con PBS.
- Visualizzare le cellule usando la microscopia confocale o epifluorescente.
- Proliferazione di cellule all'interno di gel viene comunemente valutata mediante test disponibili in commercio (ad esempio, DNA totale o contenuti biochimici). PicoGreen è un uso comune e sensibile acidi nucleici colorante fluorescente per quantificare il DNA a doppia elica (Singer et al.). Le cellule possono anche essere contati e normalizzato ad un numero iniziale di controllo utilizzando i metodi di visualizzazione descritto al punto 2.
- Sezionamento istologici e colorazione può essere utilizzato anche per visualizzare cellule e formano matrice. Il protocollo seguito per la disidratazione e il sezionamento di idrogeli 3D possono essere utilizzate per ottenere sezioni trasversali su vetrini:
- Fissazione e la disidratazione
- Sciacquare campione 3 volte in PBS.
- Fix per 5 - 30 minuti in paraformaldeide 4%.
- Sciacquare campione 3 volte in PBS.
- Incubare campione in EtOH a 25 ° C per 1 ora a ciascuno dei seguenti EtOH (v / v) le concentrazioni in acqua (in ordine): 50%, 70%, 95%, 95%, 100% (A questo punto, i campioni può essere conservato durante la notte a 25 ° C).
- Compensazione e infiltrazione
- Trasferimento% Citrisolv 100 per 1 ora a 25 ° C, seguita da un'ora a 65 ° C.
- Tagliare a metà i campioni con una lametta in una piastra di Petri in modo tale che la sezione trasversale del campione è esposto.
- Trasferimento in miscela 1:1 di Citrisolv / Micro-taglio di paraffina per 1 ora a 65 ° C.
- Trasferimento al 100% Micro-taglio di paraffina per 1 ora a 65 ° C.
- Trasferimento al 100% Micro-taglio paraffina notte a 65 ° C.
- Trasferimento al 100% Micro-taglio di paraffina per 1-2 ore a 65 ° C.
- Incorporare
- Posizione nel campione peel-away stampo con il 100% paraffina.
- Mettete una piccola quantità di cera a letto stampo, e inserire le due metà del campione con la sezione rivolta verso il basso.
- Applicare top pezzo filtro
- Aggiungi cera aggiuntive per immergere il pezzo superiore e lasciare indurire per circa 10 minuti.
- Trasferimento inserti frigorifero a 4 ° C per consentire provino per indurire durante la notte.
- Campione può essere sezioneed il giorno seguente, di solito a spessore micron 5-10 per fetta utilizzando microtomi disponibili in commercio. In genere il peel-away stampo è montato verticalmente contro il palco microtomo e controlli manuali consentono di impostare lo spessore della sezione, affettatrice e l'allineamento del campione con la lama.
- Estrazione di RNA
L'espressione genica può anche essere valutata quantitativamente (ad esempio tramite real-time polymerase chain reaction (PCR)). Il protocollo per l'estrazione di RNA da idrogel 3D, un esempio è riportato di seguito, è molto diverso dal caso più semplice 2D.- Etichettare un certificato RNasi libero provetta Eppendorf per ogni idrogel 3D e aggiungere 500 microlitri Trizol ® reagente ad ogni provetta.
- Utilizzare un pestello (grinder tessuto) per macinare manualmente l'idrogel fino a quando una soluzione limpida ottenuta. Smerigliatrici garantire diversi sono utilizzati per ogni condizione.
- Vortex ogni Eppendorf per 20 secondi per omogeneizzare i campioni.
- Incubare i campioni a temperatura ambiente per cinque minuti per consentire completa dissociazione dei complessi nucleoproteina.
- Refrigerare i campioni in ghiaccio per 20 minuti
- Aggiungere 200 ul (per mL Trizol) cloroformio per ogni campione e vortice.
- Incubare i campioni a temperatura ambiente per cinque minuti.
- Centrifugare i campioni a 12000 xga 4 ° C per 15 min.
- Trasferire la fase acquosa (chiaro strato superiore) a nuovi tubi Eppendorf (evitando regione interfacciale e inferiore rosso, fenolo-cloroformio fase). RNA rimane nella fase acquosa limpida.
- Tecniche comuni per l'isolamento di RNA e storage possono ora essere utilizzati.
- Dopo l'estrazione di RNA, i kit disponibili in commercio per la trascrittasi inversa e PCR in tempo reale sono spesso utilizzati con alcune modifiche (Elisseff et al. Strehin et al.).
- Fissazione e la disidratazione
Rappresentante dei risultati:
Si vedano le figure 2-4 (come indicato nei protocolli di cui sopra) per ottenere risultati rappresentativi della visualizzazione di idrogel photopatterned e incapsulamento di cellule all'interno gel.
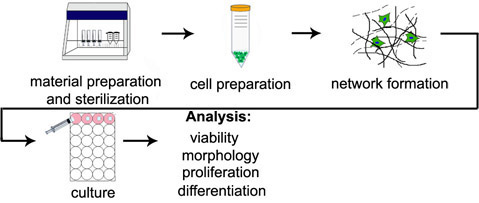
Figura 1. Panoramica della procedura di incapsulamento 3D. Passi diagramma corrispondono ai titoli delle sezioni dei protocolli graduale.
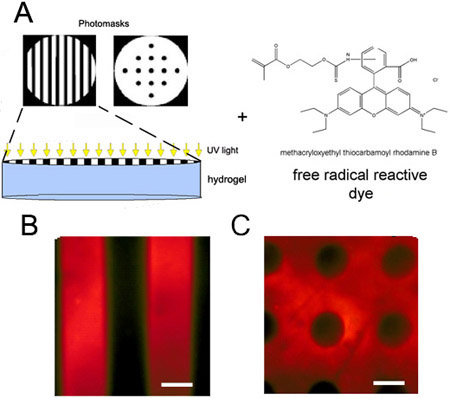
Figura 2. Photopatterned idrogel con Michael sequenziale di tipo polimerizzazione per addizione poi radicale. (A) Schema di photopatterning di un idrogel parzialmente reticolato con l'incorporazione di un colorante reattivo foto. (B) Circle o (C) maschera di trasparenza striscia film di fantasia idrogel di acido ialuronico. Rodamina Methacrylated (MeRho) è incorporato soltanto nelle regioni del gel che sono stati esposti alla luce. Barre di scala = 100 micron.
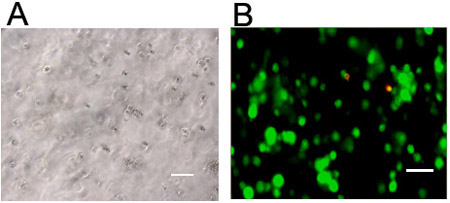
Figura 3. Visualizzazione di cellule in idrogel 3D. Le cellule staminali visualizzati tramite (a) microscopia ottica o (b) dal vivo (verde, calceina AM) e morti (rossi, etidio omodimero-1) colorazione 24 ore dopo l'incapsulamento a 1 milione di cellule / ml in un idrogel di acido ialuronico reticolato con il semaforo iniziato meccanismo radicali liberi. Barre di scala = 100 micron.
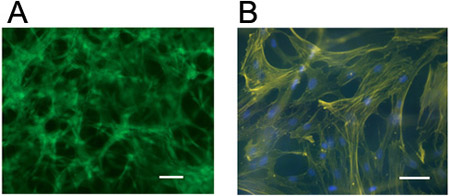
Figura 4. Visualizzazione di cellule in idrogel 3D. hMSCs macchiato per (a) cellule vive (calceina AM) o (b) cellulari actina (rodamina falloidina) e nuclei (DAPI) cinque giorni dopo l'incapsulamento a 1 milione di cellule / ml in un idrogel di acido ialuronico reticolato attraverso un meccanismo di tipo Michael ( utilizzando peptidi adesivi pendente e bifunzionali reticolanti peptide proteoliticamente degradabili). Barre di scala = 100 micron.
Discussione
I protocolli descritti rappresentano un metodo semplice ed efficace per incapsulare le cellule all'interno di ponteggi idrogel in modo cytocompatible. Tali tecniche sono particolarmente importanti poiché terminalmente differenziate e le cellule staminali possono manifestare un comportamento marcatamente diverso in microambienti 2D vs 3D. Anche per approcci terapeutici che coinvolgono l'impianto di materiali (ad esempio, a polimerizzazione in situ radicale), l'incapsulamento delle cellule e di analisi per la vitalità e la differenziazione può aiutare nel processo di sviluppo materiale. Il processo descritto sequenziale può essere usato per manipolare l'ambiente spazialmente idrogel, e di conseguenza il comportamento cellulare (vedi Khetan et al.).
In generale, l'elemento più critico dei protocolli descritto è l'omogeneità di tutte le soluzioni utilizzate. In particolare, particolare attenzione deve essere adottate per garantire le cellule siano uniformemente distribuite nella soluzione prepolimero, e che la soluzione è ben mixato da risospensione pipetta seguente aggiunta della soluzione di reticolante. Non riuscire a garantire questo può portare ad aggregazione di cellule o di variazioni locali della struttura del gel e gonfiore.
Mentre i protocolli qui presentati si concentrano principalmente sulla procedura per le cellule incapsulamento, è importante notare anche che l'incapsulamento può richiedere alcuni aggiustamenti per protocolli di analisi che in genere sono scritti per la semina 2D. Numerosi esempi sono stati illustrati per la visualizzazione e la valutazione delle cellule in idrogel.
Riconoscimenti
Questo lavoro è stato supportato da una borsa di studio Fondazione Nazionale della Scienza Graduate Research di SK e National Institutes of Heath concedere R01EB008722.
Materiali
| Name | Company | Catalog Number | Comments | |
| I2959 | Reagent | Ciba Specialty Chemicals | ||
| .2 M Triethanolamine Buffer | Reagent | Sigma-Aldrich | T0449 | |
| PBS | Reagent | Invitrogen | 14040-117 | 1x, sterile liquid |
| Live/Dead staining kit | Reagent | Invitrogen | L3224 | Includes live (Calcein AM) and dead (ethidium homodimer-1) probes |
| Phalloidin-FITC | Reagent | Sigma-Aldrich | P5282 | |
| Rhodamine Phalloidin | Reagent | Invitrogen | R415 | |
| DAPI | Reagent | Sigma-Aldrich | D9542 | |
| Methacryloxyethyl thiocarbamoyl rhodamine B (MeRho) | Reagent | Polysciences, Inc. | 23591 | |
| Bovine Serum Albumin | Reagent | Sigma-Aldrich | A7030 | |
| Tween 20 | Reagent | Sigma-Aldrich | P1379 | |
| Triton X-100 | Reagent | Sigma-Aldrich | T8787 | |
| Citrisolv | Reagent | Fisher Scientific | 22-143975 | |
| Micro-cut paraffin | Reagent | Polysciences, Inc. | 24202 | |
| Trizol reagent | Reagent | Invitrogen | 15596-026 | |
| 0.22 μm pore size nylon syringe filters | Equipment | Fisher Scientific | 09-719C | |
| 1 mL disposable syringes | Equipment | BD Biosciences | 309602 | Cut syringes at consistent height for UV exposure |
| Wide orifice pipette tips | Equipment | Sigma-Aldrich | P6800 | |
| Omnicure UV Spot Cure System with 365 nm filter | Equipment | EXFO | S1000 | |
| 254 nm germicidal UV light source | Equipment | Built into most biological safety cabinets |
Riferimenti
- Singer, V. L., Jones, L. J., Yue, S. T., Haugland, R. P. Characterization of PicoGreen reagent and development of a fluorescence-based solution assay for double-stranded DNA quantitation. Anal Biochem. 249, 228-238 (1997).
- Lutolf, M. P., Raeber, G. P., Zisch, A. H., Tirelli, N., Hubbell, J. A. Cell-Responsive Synthetic Hydrogels. Adv Mater. 15, 888-892 (2003).
- Elisseeff, J. H., Ruffner, M., Kim, T. G., Williams, C. Cellular Photoencapsulation in Hydrogels. Culture of Cells for Tissue Engineering. , (2006).
- Chung, C., Mesa, J., Miller, G. J., Randolph, M. A., Gill, T. J., Burdick, J. A. Effects of auricular chondrocyte expansion on neocartilage formation in photocrosslinked hyaluronic acid networks. Tissue Eng. 12, 2665-2773 (2006).
- Burdick, J. A., Vunjak-Novakovic, G. V. Engineered microenvironments for controlled stem cell differentiation. Tissue Eng. Part A. 15, 205-219 (2008).
- Salinas, C. N., Anseth, K. S. Mixed Mode Thiol-Acrylate Photopolymerization for the Synthesis of PEG-Peptide Hydrogels. Macromolecules. 41, 6019-6026 (2008).
- Kraehenbuehl, T. P., Ferreira, L. S., Zammaretti, P., Hubbell, J. A., Langer, R. Cell-responsive hydrogel for encapsulation of vascular cells. Biomaterials. 30, 4318-4324 (2009).
- Strehin, I. A., Elisseeff, H. J. Characterizing ECM Production by Cells Encapsulated in Hydrogels. Methods Mol Biol. 522, 1-14 (2009).
- Khetan, S., Katz, J. S., Burdick, J. A. Sequential crosslinking to control cellular spreading in 3-dimensional hydrogels. Soft Matter. 5, 1601-1606 (2009).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon