Method Article
L'utilisation de cellules souches humaines périvasculaires pour la régénération osseuse
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les cellules souches périvasculaires (CSP) sont une classe de cellules souches roman pour la régénération tissulaire du squelette similaire aux cellules souches mésenchymateuses (CSM). CSP peuvent être isolés par FACS (fluorescence tri cellulaire activé) à partir de tissu adipeux prélevés lors des procédures de liposuccion standard, puis combiné avec un ostéoinducteur échafaudage pour atteindre la formation osseuse In vivo.
Résumé
Les cellules souches périvasculaires (CSP) peuvent être isolés en nombre suffisant à partir de tissus à des fins multiples de l'ingénierie tissulaire osseuse 1-3. CSP sont une population FACS-triés de «péricytes» (CD146 + CD34-CD45-) et des cellules adventice »(CD146-CD34 + CD45-), dont chacun nous l'avons déjà signalé pour avoir des propriétés de cellules souches mésenchymateuses. CSP, comme MSC, sont capables de subir une différenciation ostéogénique, ainsi que sécrètent pro-ostéogénique 1,2 cytokines. Dans le présent protocole, nous démontrons l'osteogenicity de CSP dans plusieurs modèles animaux, y compris une implantation poche musculaire dans SCID (immunodéficience combiné sévère) des souris, une souris SCID défauts crânienne et un défaut segmentaire du fémur (DSE) chez des rats athymiques. Le modèle poche cuisse musculaire est utilisé pour évaluer la formation d'os ectopique. Défauts crânienne sont centrées sur l'os pariétal et standard sont de 4 mm de diamètre (taille critique) 8. DSE sont bicorticale et sont stabilisées avecun bar en polyéthylène et K-fils 4. Le DSE décrit est aussi un défaut de taille critique, ce qui ne modifie pas significativement guérir ses 4 propre. En revanche, si les cellules souches ou des facteurs de croissance sont ajoutés à la site de la lésion, la régénération osseuse significative ne peut être apprécié. L'objectif global de xénogreffe CFP est de démontrer la capacité ostéogénique de ce type de cellule à la fois extra-utérines et orthotopique modèles de régénération osseuse.
Protocole
1. Périvasculaire Isolement de cellules souches
Cette opération est décrite en détail dans l'article «purification de cellules souches périvasculaires de tissu adipeux humain blanc" à côté, par M. Corselli et al.
2. Création d'échafaudage
- Les échafaudages sont fabriqués sur mesure selon le protocole précédemment publié à partir de poly (lactique-co-acide glycolique) (PLGA, Burmingham Polymer) avec revêtement d'hydroxyapatite 4-6. Apatite revêtues échafaudages PLGA sont fabriqués de 85/15 PLGA par coulée en solvant et un processus de lessivage particulaire. Les échafaudages sont créés dans une forme sphérique (2 mm de diamètre) pour l'implantation poche musculaire, une forme discoïde (4 mm de diamètre) pour l'implantation crânienne, ou cylindrique (4 mm de diamètre, 6 mm de longueur) pour fémorales défauts segmentaires.
- En bref, PLGA / chloroforme solutions mélangé avec du saccharose (rapport polymère / sucrose 5/95, w / w) sont coulés dans un moule de diamètre téflon de 200 à 300 um à créer les contre-mesuretruct. Après lyophilisation nuit, échafaudages sont retiré du moule en Téflon et immergé dans ddH 2 O pour dissoudre le saccharose. Les échafaudages sont désinfectés par immersion dans de l'éthanol 70% pendant 30 min, suivie de trois rinçages de ddH 2 O.
- Pour le revêtement d'apatite, un corps simulée solution fluide (SBF) est préparé par dissolution de CaCl 2 de manière séquentielle, de MgCl2 • 6H 2 O, NaHCO 3, et K 2 HPO 4 • 3H 2 O dans ddH 2 O. PH de la solution est abaissée à 6 par ajout d'acide chlorhydrique 1M pour augmenter la solubilité. Na 2 SO 4, KCl, NaCl et sont ajoutés et le pH final est ajusté à 6,5 (SBF 1).
- Mg 2 + et HCO 3 - libre SBF (SBF 2) est préparé par addition de CaCl 2 et K 2 HPO 4 • 3H 2 O dans ddH 2 O et le pH est abaissé à 6. KCl et NaCl sont ajoutés et le pH final est ajusté à 6,8. Toutes les solutions sont stériles filtré à travers un membr de 0,22 um PSEane (Nalgene). Immédiatement avant le processus de revêtement, les échafaudages séchées PLGA sont soumis à décharge luminescente de gravure par plasma d'argon (Harrick scientifique) pour améliorer le mouillage et l'uniformité du revêtement.
- Échafaudages gravées sont ensuite incubés dans le SBF 1 pour 12 h et changé de Mg 2 + et HCO 3 - libre SBF 2 pour un autre 12 h à 37 ° C sous agitation douce. Échafaudages revêtus sont lavés avec ddH 2 O pour enlever l'excès d'ions et lyophilisé avant de poursuivre des études.
3. L'implantation du modèle musculaire Pouch
- 100 ul d'une suspension de la CFP dans du PBS (tampon phosphate salin) sont délicatement déposés sur le sphérique PLGA basée sur implant immédiatement avant l'implantation. Cellules ont été pré-marquée par insertion lentivirale de luciole luciférase, de manière à permettre au poste d'implantation in vivo de suivi. La densité cellulaire est de 2,5 x 10 5 par implant.
- SCID (sévère immunodéprimé combiné) chez la souris sont utilisés à 6 semaines d'âge. Les animaux sont anesthetized par inhalation d'isoflurane et une prémédication par la buprénorphine (Bedford Labs). Après la préparation Bétadine standard, incisions bilatérales dans les membres postérieurs sont faits (longitudinale et 2 mm de longueur).
- Les poches sont coupées dans les muscles biceps fémoral par dissection parallèle à l'axe de la fibre musculaire de long. Pour chaque souris, l'implant à base de PLGA avec PSC est inséré, et le fascia du muscle est suturé avec 5-0 Vicryl (Ethicon).
- La peau est ensuite fermé avec 5-0 Vicryl dans un modèle sous-cutanée. Les animaux sont traités en post-opératoire avec la buprénorphine pendant 48 heures et le TMP / SMX (triméthoprime / sulfaméthoxazole; Qualitest) pendant 10 jours.
4. L'implantation des défauts crânienne modèle
- Après anesthésie à l'isoflurane des souris SCID (12-14 semaines), les cheveux est tondue et la peau désinfectée avec de la Bétadine par protocole.
- Une incision cutanée de 8 mm se fait le long de la suture sagittale médiane de la voûte de la souris. Ensuite, le vêlagearial périoste est délicatement enlevé par Q-tip application.
- Ensuite, en utilisant diamantés bits de trépan dans un forage en haute-vitesse dentaire, un défaut de 4 mm d'os pariétal est créé. Le défaut est de pleine épaisseur - mais l'on prend soin de ne pas blesser la dure-mère sous-jacente.
- Le sur-mesure PLGA basée sur l'implant avec les CSP greffées est ensuite placé en douceur dans le site de la lésion. La densité cellulaire est de 2,5 x 10 5 par implant. Enfin, la peau est suturée avec 6-0 Vicryl. Les animaux sont traités en post-opératoire avec la buprénorphine pendant 48 heures et TMP / SMX pendant 10 jours.
5. Le fémur Implantation segmentaire modèle de défaut
- Rats athymiques (12-14 semaines) sont anesthésiés sous inhalation d'isoflurane. Le fémur est nettoyée et préparée selon le protocole standard avec de la Bétadine (Figure 1).
- Une incision de 27 à 30 mm longitudinale est faite sur la face antéro-externe du fémur. La diaphyse fémorale est ensuite exposée en séparant le lat vastuseralis et les biceps fémoral muscles (figure 2).
- Afin de maximiser la cohérence de la régénération osseuse, le périoste recouvrant le défaut du fémur est complètement enlevée avec la résection du segment fémoral.
- Une plaque de polyéthylène (longueur, 23 mm, largeur de 4 mm, hauteur, 4 mm) est placé sur la surface antéro-latérale du fémur. La plaque contient six trous pré-percés pour recevoir 0,9 mm de diamètre filetées de Kirschner (Zimmer). Prenant la plaque, comme un modèle, six broches de Kirschner filetées sont percés à travers la plaque et les deux corticales (Figure 3).
- Ensuite, avec une lame de scie oscillante de petite taille (Stryker, MI), un de 6 mm à mi-diaphysaire défaut est créé. Défauts segmentaires sont ensuite traités par l'insertion d'implants à base de PLGA qui ont été chargés avec des cellules selon le protocole (figure 4).
- Le muscle sus-jacente et le fascia sont fermées par 4-0 Vicryl résorbables pour fixer l'implant en place, et la peau est suturée.
6. Des évaluations in vivo
- Évaluations radiographiques sont effectués de manière longitudinale à la fois par haute résolution et haute résolution XR μCT (micro tomodensitométrie) l'analyse. Pour une analyse μCT (Skyscan 1172F), les images sont numérisées à une résolution de 19.73 pm (100 kV et 100 mA source de rayonnement, en utilisant un filtre en aluminium de 0,5 mm). Les images sont analysées à l'aide DataViewer, Recon, CTAN, et des logiciels CTVol.
- Imagerie par bioluminescence est également faite d'une manière série d'évaluer la prise de greffe de cellules, la viabilité, la prolifération et la migration d'exclure de l'implant. Imagerie par bioluminescence est effectuée en utilisant un dispositif de IVIS Lumina II (Caliper Life Sciences). Sorties de lumière sont quantifiés à l'aide du logiciel Image habitable (Xenogen). De sortie totale de la lumière est enregistré dans photons / seconde / cm ² / stéradian.
- L'analyse histologique et histomorphométrique est réalisée post-mortem. Les taches courantes employées comprennent le trichrome de Masson, le bleu d'aniline, pentachrome, et Picrosirius rouge. L'analyse histomorphométrique est réalisée facilement avec soit le bleu d'aniline ou de taches pentachrome, dans lequel apparaît ostéoïde bleu foncé et jaune, respectivement. Pixels par champ à haute puissance sont calculées en utilisant l'outil Baguette magique dans Adobe Photoshop.
7. Les résultats représentatifs
Comme les deux défauts crânienne et fémorale sont essentiels entreprises, pas de guérison important doit être prévu sans traitement avec des facteurs de croissance ou de cellules souches exogènes.
En termes de manoeuvres chirurgicales, la dissection poche musculaire devrait être le long des plans aponévrotiques et donc peu de saignements doivent être rencontrés. Même si le modèle poche musculaire est effectuée bilatéralement, la souris doit être marcher avec facilité le premier jour postopératoire 1. Pour le défaut crânienne, des saignements est rencontrée, mais peut être imbibé d'un Q-tip. Un soin extrême doit être pris de ne pas blesser la dure-mère sous-jacente - car cela perturberaitavec la guérison normale. Pour le modèle DSE, on prend soin de ne pas léser les vaisseaux sanguins principaux afin de ne pas causer le saignement excessif ou le nerf fémoral pour prévenir des dommages neurologiques. Broches de Kirschner sont percés avec une légère pression de manière à ne pas endommager l'os cortical dans le processus.

Figure 1. La préparation préopératoire pour défaut segmentaire du fémur (DSE) chez des rats athymiques. Des rats mâles (12-14 semaines) sont anesthésiés sous inhalation d'isoflurane. Le fémur est nettoyée et préparée selon le protocole standard avec de la Bétadine.

Figure 2. Exposition chirurgicale pour fémur défauts (DSE) la création segmentaire. Une incision longitudinale 27-30 mm est faite sur la face antéro-externe du fémur. La face latérale de la diaphyse fémorale est ensuite exposée en séparant le vastus lateraliset biceps crural. muscles
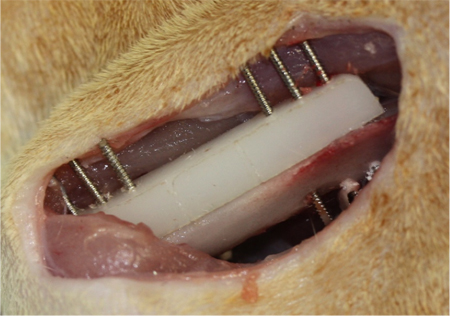
Figure 3. Fixation pour fémur défauts (DSE) la création segmentaire. Une plaque de polyéthylène (longueur, 23 mm, largeur de 4 mm, hauteur, 4 mm) est placé sur la surface antéro-latérale du fémur. La plaque contient six trous pré-percés pour recevoir 0,9 mm de diamètre filetées des broches de Kirschner. Prenant la plaque, comme un modèle, six broches de Kirschner filetées sont percés à travers la plaque et les deux corticales. Ensuite, un de 6 mm à mi-diaphysaire défaut est créé. Une fois que ceci est effectué, un échafaudage sur mesure est directement inséré, qui correspond exactement à l'emplacement de défaut (non représenté).

Figure 4. Exemple de défaut crânienne postopératoire. A 4 mm, une anomalie circulaire crânienne est créé dans l'os pariétal droit chez des souris athymiques. Imagée est ici un site de défaut implantés avecCSP à 8 semaines post-opératoires. A noter la présence d'un nouvel os dans le site de la lésion.
Discussion
L'isolement des CSP est bien décrit par ailleurs 1-3, y compris une publication JoVE soumis séparément traitant spécifiquement protocoles d'isolement de la CFP et les méthodes. L'objectif spécifique de cet article est de décrire et démontrer 3 protocoles pour la CFP en application in vivo de la formation osseuse / régénération. La pochette de souris SCID muscle est un modèle couramment décrit pour la formation osseuse ectopique humaine 7. Des différences importantes existent entre les extra-utérines et orthotopique (défaut) pour les modèles des os, y compris l'interaction avec l'hôte paracrine formation de cellules osseuses 8 ainsi que l'abondance des facteurs de signalisation ostéogéniques présents dans le microenvironnement défaut squelettique. Deux défauts sont présentés ici, un defect8 crânienne et fémorale défaut segmentaire 4. Les deux sont bien documentés pour être critique de taille (c.-à-pas guérir de leur propre).
Des différences intéressantes existent entre les défauts crânienne et fémorale. La première, lacellulaire: interaction entre les cellules et les cellules CSP xénogreffées endogènes est très différente. En termes d'un défaut crânienne, CSP interagir avec la dure-mère sous-jacente (la couche la plus externe des méninges), ainsi que les ostéoblastes et les cellules périostiques circonscrivant le site du défaut. Il est important, l'interaction entre les cellules implantées et les ostéoblastes qui entourent 8, ou des cellules implantées et qui sous-tend-mère (Levi et al., Sous presse) sont essentiels pour les cellules souches normales médiation ostéogenèse de procéder. En ce qui concerne le défaut de fémur segmentaire (DSE), les CSP xénogreffées sont exposés à une cellule très différente et de l'environnement de cytokines. Par exemple, le site DSE est composé de cellules de moelle et d'accompagnement des souches mésenchymateuses, ainsi que l'endoste, le périoste et des os longs des ostéoblastes. Théoriquement, chaque cellule a sa propre réaction à la blessure, et chaque cellule peut avoir: les interactions des cellules avec des xénogreffes de la CFP.
Autres différences claires existent entre crânienneet les défauts du fémur. Les os crânienne forment d'abord par ossification intramembranaire, tandis que les os longs former à travers un intermédiaire du cartilage (ossification endochondrale). En outre, le processus de réparation post-traumatique a également reproduit ces origines développementales. Poste-DSE, la formation de cal cartilage est observée, alors qu'aucune intermédiaire du cartilage est formé dans un défaut osseux pariétal. Enfin, l'origine embryonnaire du crâne peut différer de celle des os longs. La majorité du crâne (y compris les cellules périvasculaires - péricytes - dans la région de la tête entière) est dérivé de la crête neurale (mesectoderm), tandis que le squelette appendiculaire est de dérivation mésoderme paraxial 9. Toutes ces différences peuvent entraîner des différences importantes en termes de réparation osseuse médiée par la CFP.
L'utilisation de CSP a plusieurs avantages par rapport traditionnelles tissu adipeux cellules stromales (ASCS). CSP ne nécessitent pas de culture et sont un whi cellules purifiées de la populationch ne comprennent pas les autres cellules stromales qui ne participent pas au - et peut même réguler négativement - la différenciation ostéogénique, comme les cellules endothéliales 10. En revanche, par exemple, des analyses clonales de CSA montrent que seule une sous-population sont capables de subir une différenciation ostéogénique in vitro 11. En fin de compte, les efforts du squelette de l'ingénierie tissulaire sera probablement incorporer une cellule souche osteocompetent (tels que les CSP) avec facteurs de croissance exogènes et un échafaudage ostéoconducteur (tels que HA-PLGA utilisé dans les méthodes actuelles) de manière à mieux guérir les défauts squelettiques.
Déclarations de divulgation
KT, BP, et CS sont des inventeurs de périvasculaires de cellules souches liées à des brevets déposés à l'UCLA. Drs. KT, et CS sont les fondateurs de cicatrice Laboratories Inc, qui sous-licences périvasculaires de cellules souches liées à des brevets de l'UC Regents. Dr Chia Soo est également un officier des laboratoires cicatrice, Inc
Remerciements
Ce travail a été soutenu par le CIRM Prix Early recherche translationnelle II TR2-01821, NIH / NIDCR (subventions R21 DE0177711 et RO1 DE01607), UC subvention à la découverte 07-10677, AWJ et RKS ont T32 bourses de formation des prix (5T32DE007296-14), jnz a une bourse de formation CIRM (TG2-01169).
Références
- Crisan, M. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell Stem Cell. 3, 01-13 (2008).
- Chen, C. W. Perivascular multi-lineage progenitor cells in human organs: regenerative units, cytokine sources or both. Cytokine Growth Factor Rev. 20, 429-434 (2009).
- Corselli, M., Chen, C. W., Crisan, M., Lazzari, L., Peault, B. Perivascular ancestors of adult multipotent stem cells. Arterioscler. Thromb Vasc. Biol. 30, 1104-1104 (2010).
- Zara, J. Nell-1 enhances bone regeneration in a rat critical sized femoral segmental defect model. Plast. Reconstr. Surg. , Forthcoming (2010).
- James, A. W. Deleterious Effects of Freezing on Osteogenic Differentiation of Human Adipose-Derived Stromal Cells In Vitro and In Vivo. Stem Cells Dev. 20, 427-439 (2011).
- Lee, M., Chen, T. T., Iruela-Arispeb, M. L., Wu, B. M., Dunn, J. C. Y. Modulation of protein delivery from modular polymer scaffolds. Biomaterials. 28, 1862-1870 (2007).
- Aghaloo, T. A study of the role of nell-1 gene modified goat bone marrow stromal cells in promoting new bone formation. Mol. Ther. 15, 1872-1880 (2007).
- Levi, B. Human Adipose-Derived Stromal Cells Stimulate Autogenous Skeletal Repair via Paracrine Hedgehog Signaling with Calvarial Osteoblasts. Stem Cells Dev. 20, 243-257 (2011).
- Leucht, P. Embryonic origin and Hox status determine progenitor cell fate during adult bone regeneration. Development. 135, 2845-2854 (2008).
- Rajashekhar, G. IFATS collection: Adipose stromal cell differentiation is reduced by endothelial cell contact and paracrine communication: role of canonical Wnt signaling. Stem Cells. 26, 2674-2681 (2008).
- Zuk, P. A. Human adipose tissue is a source of multipotent stem cells. Mol Biol Cell. 13, 4279-4295 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon