Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation de Synaptoneurosomes de Mouse Cortex en utilisant un gradient de densité discontinu de Percoll-sucrose
Dans cet article
Résumé
Une méthode pour préparer translation active, synaptoneurosomes intacte (SNS) de la souris cortex cérébral est décrite. La méthode utilise un gradient de densité discontinu de Percoll-sucrose permettant la préparation rapide de SNS active.
Résumé
Synaptoneurosomes (SNS) sont obtenus après homogénéisation et fractionnement de cortex cérébral de la souris. Ils sont refermés vésicules ou des terminaux isolés que rompre avec terminaisons axonales lorsque le tissu cortical est homogénéisé. Le SNS conserver des caractéristiques pré-et post-synaptiques, ce qui les rend utiles dans l'étude de la transmission synaptique. Ils conservent la machinerie moléculaire utilisée dans la signalisation neuronale et sont capables d'absorption, le stockage et la libération de neurotransmetteurs.
La production et l'isolement de SNS active peut être problématique médias utilisant comme Ficoll, qui peuvent être cytotoxiques et nécessitent une centrifugation prolongée due à haute densité, et la filtration et des méthodes de centrifugation, ce qui peut entraîner une faible activité en raison de dommages mécaniques de la SNS. Cependant, l'utilisation des gradients de densité discontinu de Percoll-sucrose pour isoler SN fournit une méthode rapide pour produire de bons rendements de SNS translation active. La méthode du gradient Percoll-sucrose est rapide et en douceur car il emploie des conditions isotoniques, a fait tourner la centrifugation moins nombreux et plus courts et évite les étapes de centrifugation que les SRS granulés et causer des dommages mécaniques.
Protocole
1. Les préparatifs 1-4
- Préparer tampon de 500 mL de milieu de gradient (GM) en mélangeant 50 ml d'une suspension de 2,5 M de saccharose, 2,5 mL d'un 1M Tris-HCl, pH 7,5 stock, et 0,1 mL d'une EDTA 0,5 M, pH 8,0 milli-actions avec Q eau au volume. Filtre stériliser la solution, et de stocker aliquot congelé.
- Préparer un stock de 1000x de tétrodotoxine (TTX) en faisant une solution à 1 mM dans milli-Q H 2 O. Des aliquotes de TTX peuvent être stockés à -20 ° C.
- Préparer tampon de stimulation 10x en faisant une solution de Tris 100 mM (pH 7,5), 5 mM Na 2 HPO 4, 4 mM de KH 2 PO 4, 40 mM NaHCO 3, et 800 mM de NaCl dans l'eau milli-Q. Stock peut être conservé à 4 ° C.
- Pré-cool centrifugeuses à 4 ° C.
- Préparer une solution stock de isosmotique Percoll (SIP) en ajoutant 9 volumes de Percoll (18 ml) à 1 volume de 2,5 M de saccharose (2 ml) dans de l'eau milli-Q et bien mélanger.
- Préparer les 3, 10, 15, et les couches de gradient de 23% en additionnant les montants respectifs de la SIP à GM de tampon et de mélange de chaque:
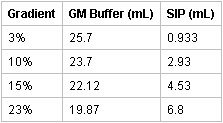
- Verser couches de gradient par pipetage 2 ml de chacun des 23, 15, 10, et 3% des solutions de Percoll isosmotique dans les tubes avec des bouchons centrifugeuse Beckman utilisant un P1000 Gilson Pipetman. L'interface entre les couches doivent être clairement perceptible sans mélange des couches. Stocker les gradients à 4 ° C pendant au moins 20 min avant utilisation. Les gradients peuvent être stockées pendant jusqu'à 24 heures le même jour bien que l'utilisation est recommandée. [Le personnel de laboratoire inexpérimentés peuvent pratiquer des gradients de la préparation en ajoutant du colorant bleu pour les solutions isomotic Percoll pour la visualisation des interfaces couche.]
2. Une dissection de souris
- S'assurer que toutes élevage de souris et de l'euthanasie procédures sont exécutées conformément aux directives du NIH et de l'Université. Euthanasier les chiots (âge P13 à P21) par asphyxie de dioxyde de carbone ou par une méthode approuvée par le protocole d'animaux.
- Pin de la souris sur une planche de dissection et de pulvérisation à l'arrière du cou et la tête avec de l'éthanol. En utilisant une paire de ciseaux pointus couper à travers la moelle épinière à la base du crâne, enlever la peau du haut du crâne, le crâne coupé latéralement entre l'os pariétal et l'os interpariétales ou entre le cerveau et les régions du cortex. Ensuite, couper le crâne de la base du nez (long de la suture sagittale), retirer soigneusement les os pariétal douce en tirant chaque hémisphère sur le côté et retirer le cortex avec une spatule. Insérer la spatule dans le cerveau au-dessus du cervelet et le cortex évider et le placer dans tampon glacé GM. Procéder immédiatement à l'étape d'homogénéisation. Ne laissez pas les cortex s'asseoir dans tampon glacé pour très longtemps que ce sera nuire à la formation des SNS.
3. Préparation de l'homogénat et SN 1-4
- Rincez le cortex dans glacée GM tampon et de transfert à deux corticales à un Dounce verre homogénéisateur contenant 5 ml de tampon froid GM.
- Homogénéisé doucement le cortex avec des coups de 5-10 au pilon en vrac (pilon "A"), suivi par des traits de 5-10 au pilon serrés (pilon "B"). Strokes devrait être rapide, mais assez lentement pour ne pas provoquer des bulles d'air. Une photo de l'homogénat après homogénéisation est dans le schéma 1. Le nombre de coups peut varier dépendant de l'homogénéisateur individuelles et pilons qui l'accompagne. Lorsque vous avez terminé les gradients devrait donner une forte bande SN, sinon, ajuster le nombre de coups.
- Transférer le broyat à une conique 15 ml et centrifuger à 1000xg pendant 10 min à 4 ° C dans un rotor swing (Allegra 6KR centrifugeuse) afin de culot cellulaire des débris et des noyaux. Une image de l'homogénat filé est dans le schéma 1.
- Couche 2 ml du surnageant par gradient de Percoll-sucrose, le plafond du tube, et centrifuger à 32 500 xg pendant 5 min à 4 ° C dans un rotor à angle fixe (Beckman J2-21 centrifugeuse, JA-17 du rotor) en utilisant des adaptateurs appropriés ( Voir le tableau Réactifs et équipement).
- Pipette et jeter la solution ci-dessus la bande SN utilisant une pipette Pasteur en verre. Pipette hors du groupe SN à l'interface% 15/23, transfert à une forme conique et de stocker sur la glace. Chaque dégradé ou une corticale va produire 0,9 à 1,1 ml de SN.
- Ajuster la concentration en sel de la SNS en ajoutant un dixième volume de tampon de stimulation 10x, ajouter 1000x CaCl 2 à une concentration finale de 12 nM, et ajouter 1 mM TTX achat d'actions à une concentration finale de 1 uM à supprimer une excitation non spécifiques. (Addition de CaCl 2 est facultative si elle va interférer avec les applications SN en aval).
- Déterminer la concentration en protéines de la SNS en utilisant le kit Micro BCA Protein Assay. (Le dosage des protéines Bradford n'est pas recommandée en raison de l'inférence à partir du Percoll.)
- SN peut être utilisé directement et rapidement pour la protéine traduction des études. Pour d'autres applications SN lysat peut être nettoyé ou concentré en utilisant l'Pierce SDS-PAGE de préparation d'échantillons Kit.
4. Les résultats représentatifs:
Lorsque la souris du cortex a été homogénéisé et séparé sur discontinu Percoll-sucrose dégradés (Schéma 1), 6 bandes ou des fractions ont été observés (figure 1). Il a été précédemment montré pour le rat cortex cérébral 3,5 que les constituants des bandes de haut poids moléculaire ont été brisées et des membranes de la myéline et que le matériel granulé contient des mitochondries ou des organelles (tableau 1). Les 23% / 15% d'interface (bande 5) contenait le SNS enrichi.
La bande à 23% de l'interface / 15%, contenant SN intacte, a été enlevé et examiné par microscopie électronique (EM), comme décrit précédemment. 2,6 ME a montré la présence de vésicules synaptiques et intacte la préservation des éléments pré-et postsynaptiques (figure 2). L'isolement des compartiments pré-et post-synaptiques est important d'examiner de signalisation et de la synthèse des protéines, qui se produit dans les deux compartiments. 7-13 Le gradient de Percoll-sucrose est une purification brut ainsi que nous avons vu mineures cellulaire, la contamination nucléaire et des organites dans la fraction SN, mais le la séparation globale a été bonne.
Lorsqu'ils sont examinés par Western blot, les fractions de Percoll contenait les marqueurs protéiques s'attend à une augmentation de la pureté synaptique dans la bande de SN (figure 3, tableau 2). Marqueurs synaptiques et neuronales ont été maintenus dans la bande enrichi SN (bande 5), mais l'abondance des autres marqueurs a été significativement réduit. En particulier, la présence de la GFAP, un marqueur des cellules astrocytaires et néoplasiques d'origine gliale, et Lamin-B1, un marqueur nucléaire, ont été négligeables, alors que les marqueurs structurels et synaptiques ont été maintenus ou améliorés. En outre, il a été rétention des marqueurs pour les organelles, comme la mitochondrie et de Golgi, qui jouent un rôle dans la synthèse protéique.
Les rendements typiques de la bande 250-500 ng SN ont été de protéines par ul, tel que déterminé par un dosage de protéines BCA. L'activité du SNS a été déterminée par la quantité de synthèse protéique de novo présenter comme surveillé par [35S]-Met incorporation (figure 4). 2 activité basale translationnelle a été augmenté 1,56 fois quand SN ont été stimulées avec 50 uM glutamate/10 uM de glycine (Glu) ou 5,12 fois quand il est activé avec l'inhibiteur de la juglone Pin1. L'inhibition de Pin1 est connu pour entraîner dans la synthèse de protéine accrue. 2 pour confirmer que l'augmentation de [35S]-Met était due à l'incorporation synthèse protéique de novo, nous avons ajouté 40 anisomycine uM, un inhibiteur de la synthèse des protéines, et a vu une diminution marquée de l'incorporation en présence et en absence de Glu par rapport aux niveaux de base. Aussi, lors de l'addition de 2% de Triton-X 100, ce qui perturbe l'intégrité de la SNS, la traduction a été basale diminué de 75%. 2 En outre, lorsque l'on examine les bandes (B4-B6) qui a montré l'enrichissement marqueur le plus synaptique, Le SNS ou de la bande 5 était la plus forte activité de synthèse protéique de novo (figure 5). Ainsi, le discontinu de Percoll-sucrose gradients produire rapidement une très active et enrichie SN bande qui peut être utilisée pour étudier la traduction des protéines.
La procédure de gradient discontinu de Percoll-sucrose est plus avantageuse que d'autres méthodes, car les dommages mécaniques est causée par des conditions plus sévères. Par rapport à la méthode de filtration, dans lequel effacé homogénat cortical est passé à travers une série de filtres qui diminuent en taille, la méthode 3,14-15 Percoll formes plus SN avec une plus grande activité. Comme le montre la figure 6, lorsque une aliquote de SNS préparé par la méthode de filtration a été passée sur un gradient Percoll-sucrose il ya beaucoup moins de SN à l'interface% 15/23 et une plus grande quantité de membranes cassé. Lorsque la synthèse protéique de novo a été mesurée par l'incorporation S35-rencontre, le SNS préparé par la méthode de filtration ont été beaucoup moins actif (figure 7). Afin de maximiser l'activité traductionnelle, nous utilisons des souris qui sont entre l'âge de P14 et P18. SN peuvent être préparés à partir de souris adultes, mais nous avons observé significativement augmenté l'activité traductionnelle avec SN préparé à partir de souris juvénile (figure 8).

Tableau 1. Constituants des bandes du discontinu de Percoll-gradient fractionnements du cortex de souris homogénéisé. 3,5
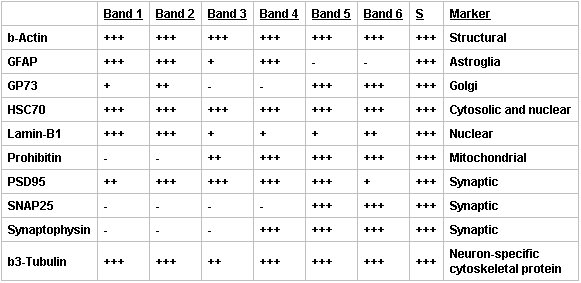
Tableau 2. Résumé de l'analyse des boulons Ouest du discontinu Percoll-sucrose constituants bande de dégradé. Concentrations de protéines relative pour chacune des fractions bande isolée en utilisant un Percol discontinuL-saccharose gradient ont été déterminées par Western blot. Aucune protéine présente (-), 0 ≥ 0,2 (+), 0,2 ≥ 0,8 (++), ou> 0,8 fois (+++) = supérieur protéine présente dans le représentant surnageant (S, centrifugé cortex homogénat), de n 3.
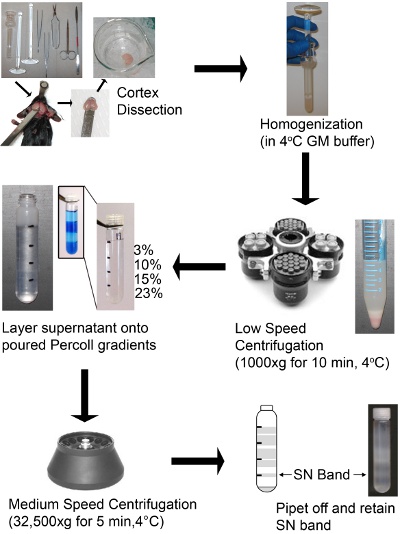
Schéma 1: Schéma d'une préparation de SN utilisant un gradient de densité discontinu de Percoll-sucrose cortex cérébral de souris ont été disséqués, homogénéisés et centrifugés à faible vitesse pour enlever non homogénéisé tissus, cellules, organites entiers, tels que des noyaux et des membranes.. Le gradient discontinu doivent être clairement définies couches. La photo en médaillon montre un exemple des couches, qui ont été teints bleus à titre indicatif seulement afin de visualiser les couches. Le surnageant est posée au sommet d'une discontinuité du gradient Percoll-sucrose et centrifugés à vitesse moyenne. Le groupe SN est ensuite récupéré à partir du gradient et est prêt à utiliser.
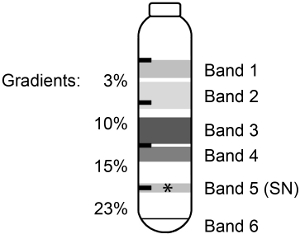
Figure 1. Fractionnement sur un homogénat discontinu de Percoll-sucrose dégradé. Souris cortex a été homogénéisé et séparé sur un discontinu de Percoll-sucrose gradient donnant lieu à 6 bandes ou des fractions. Le purifiée, actif SN (*) ont été trouvés dans la bande 5.

Figure 2. Les préparations SN donnent un mélange hétérogène de SNS qui conservent des éléments pré-et postsynaptiques. Une micrographie électronique d'une préparation SN préparé à partir de souris C57BL / 6 (âge P13 à P21) a été réalisée comme décrit précédemment et montre avec SN conservé des éléments pré-et postsynaptiques. 2 , 6 points rouges flèches pour les densités post-synaptiques. La barre d'échelle est de 1 um.
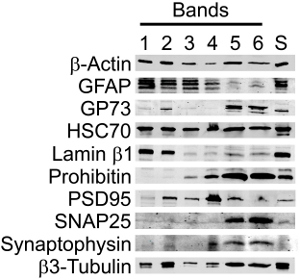
Figure 3. Analyses par Western blot des préparatifs SN a montré que des marqueurs synaptiques et neuronales ont été maintenues dans le SNS purifié (bande 5), mais l'abondance des autres marqueurs a été significativement réduit. Immunoblots de surnageant (S, centrifugé homogénat cortical) et les bandes 1-6 de une discontinus gradient Percoll-sucrose ont été sondées pour β-actine (structurelle, le contrôle du chargement), la GFAP (astrocytes), GP73 (Golgi), HSC70 (cytoplasmiques et nucléaires), Lamin-B1 (nucléaire), Prohibitin (mitochondrial), PSD95 (densité post-synaptique ), SNAP25 (synaptique), la synaptophysine (synaptique) et β3-tubuline (neurone-spécifique). Les bandes ont été visualisées en utilisant une tempête 860 Phosphorimager, représentatif de n = 3.
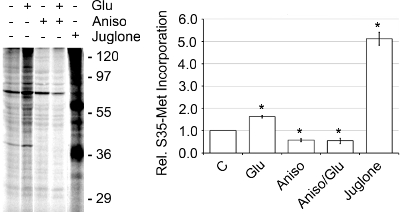
Figure 4. SNS sont actifs et présentent la synthèse protéique de novo via [35S]-Met constitution. SN ont été pré-équilibrée à 37 ° C pendant 10 min. Puis la SNS ont été traités ou prétraités pendant 15 min avec 40 uM anisomycine ou 1 uM juglone à 37 ° C suivie d'une addition de [35S]-Met, 20 pl Express Pro label Mix S35 Tag facile, plus ou moins Glu à 37 ° C pendant 30 min. Les échantillons ont été préparés en utilisant l'Pierce SDS-PAGE de préparation d'échantillons Kit, sur un gel de polyacrylamide 15%, séché et quantifiée en utilisant un Dynamique Moléculaire Tempête 860 phosphorimager, représentatif de n = 3, ± SEM.
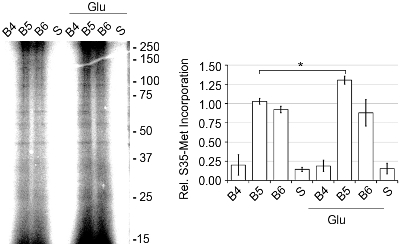
Figure 5. La bande 5 du discontinu de Percoll-sucrose gradient contenait les plus hauts niveaux de synthèse protéique de novo. Bandes 4, 5 et 6 et le surnageant (S, centrifugé homogénat cortical) ont été pré-équilibrée à 37 ° C pendant 10 min. Ensuite, [35S]-Met, Mix Pro Label express S35 Tag facile, a été ajouté, plus ou moins Glu à 37 ° C pendant 30 min. Les échantillons ont été préparés en utilisant l'Pierce SDS-PAGE de préparation d'échantillons Kit, sur un gel de polyacrylamide 15%, séché et quantifiée en utilisant un Dynamique Moléculaire Tempête 860 phosphorimager, représentatif de n = 3, ± SEM.

Figure 6. SN préparés à partir d'une méthode de filtration des membranes contiennent plus de cassé et SN moins entier que SN préparé à partir de la méthode du gradient Percoll-sucrose discontinu. SN ont été préparés par le passage du cortex homogénéisée par une série de filtres avec la diminution de la taille des pores, comme décrit précédemment. 3,14-15 Une aliquote de la SNS préparé par la méthode de filtration a été centrifugé pendant une discontinu Percoll-sucrose gradient et comparée à un montant équivalent de matériel en utilisant la méthode du gradient discontinu de Percoll-sucrose.
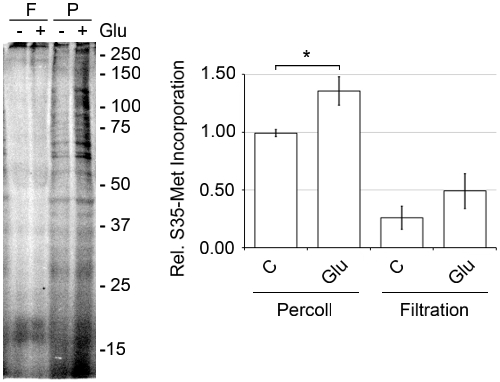
Figure 7. SN préparés à partir d'une méthode de filtration contiennent moins de novo activité de synthèse de protéines que le SN préparés BOFm la méthode du gradient discontinu de Percoll-sucrose. SN ont été préparés par le passage du cortex homogénéisée par une série de filtres avec des pores diminue comme décrit précédemment, 3,14-15 et par les méthodes de gradient discontinu de Percoll-sucrose. SN des deux préparations ont été pré-équilibrée à 37 ° C pendant 10 min. Ensuite, [35S]-Met, Mix Pro Label express S35 Tag facile, a été ajouté, plus ou moins Glu à 37 ° C pendant 30 min. Les échantillons ont été préparés en utilisant l'Pierce SDS-PAGE de préparation d'échantillons Kit, sur un gel de polyacrylamide 15%, séché et quantifiée en utilisant un Dynamique Moléculaire Tempête 860 phosphorimager, représentatif de n = 3, ± SEM.

Figure 8. SN de jeunes souris (P14) ont une plus grande activité translationnelle que les anciennes souris (P85). SN ont été préparés à partir de différentes souris âgées utilisant la méthode du gradient discontinu de Percoll-sucrose, pré-équilibrée à 37 ° C pendant 10 min, traitées ou non traitées avec Glu dans le présence de [35S]-Met (Express Pro label Mix S35 Tag facile) pendant 30 min, snap congelés, et plus tard nettoyé avec le SDS-PAGE Pierce Prep Kit échantillon. Le SNS ont ensuite été exécutés sur un 12% gel SDS-polyacrylamide, séché et imagé sur une tempête de dynamique moléculaire 860 phosphorimager, représentatif de n = 3, ± SEM. SN du P14 souris ont été au moins 3 fois plus actif que P85 souris.
Discussion
La préparation gradient discontinu de Percoll-sucrose décrite ici est une méthode rapide et fiable d'isoler actifs SN, qui peut être utilisé dans une variété d'expériences de la transmission synaptique. Cette méthode de gradient, qui est basé sur la méthode développée par Dunkley et al., 3,4 est une procédure cerveau subcellulaire fractionnement qui isole à la fois pré-et post-synaptiques à la membrane des vésicules dérivées qui sont associés à un autre. Sans autre purification d...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous tenons à remercier BK août de l'Université de Wisconsin-Madison Facilité microscope électronique pour la microscopie électronique. Ce travail a été soutenu par des subventions du NIH R01-DA026067 et P30-HD03352 (pour la JSM).
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires (optionnel) |
|---|---|---|---|
| Kit Micro BCA Protein Assay | Pierce | 23235 | |
| CaCl 2 | Fisher | C79-500 | |
| Gaz CO 2 | Airgas (UW-MDS) | CD 50 | |
| EDTA | RPI | E57020 | |
| EtOH | Fisher | A407SK-4 | |
| HCl | Fisher | A142-212 | |
| Percoll | GE Healthcare | 17-0891-01 | |
| KH 2 PO 4 | Fisher | P285-500 | |
| PierceSDS-PAGE de préparation d'échantillons Kit | Pierce | 89888 | |
| NaCl | RPI | S23020 | |
| NaHCO 3 | Fisher | BP328-500 | |
| Na 2 PHO 4 | Fisher | S381-500 | |
| Saccharose | RPI | S24060 | |
| Tris Base | RPI | T60040 | |
| Tetrodotoxine | Sigma | T5651 | |
| Express Pro label Mix S35 Tag Facile | Perkin Elmer | NEG772 | |
| Équipement | Société | Numéro de catalogue | Commentaires (optionnel) |
| Des outils de dissection | |||
| Dounce homogénéisateur, 7 ml (livré avec deux pilons en verre étiqueté «A» et «B») | Wheaton | ||
| P1000 Gilson Pipetman | Gilson | F123602 | |
| Allegra 6KR Centrifugeuse | Beckman Coulter | 366830 | |
| GH 3.8 Rotor, rotor swing | Beckman Coulter | 360581 | |
| Beckman J2-21 Centrifugeuse | Beckman | ||
| Beckman tubes avec des bouchons | Beckman | 355672 | |
| Blanc adaptateurs fortifiée | Beckman | 342327 | |
| Bleu adaptateurs fortifiée | Beckman | ||
| JA-17 Rotor, Rotor angulaire | Beckman | 369691 |
Table des anticorps utilisés pour Western blot:
| Nom de l'anticorps | Société | Numéro de catalogue | Espèce Hôte | Facteur de dilution |
|---|---|---|---|---|
| β-actine | Sigma | A5441 | la souris | 1:2000 |
| GFAP | Santa Cruz | sc-65343 | la souris | 1:200 |
| GP73 | Santa Cruz | Sc-134509 | lapin | 1:200 |
| HSC70 | Santa Cruz | SC-7298 | la souris | 1:200 |
| Laminβ | Santa Cruz | Sc-6261 | de chèvre | 1:200 |
| Prohibitin | Santa Cruz | sc-28259 | lapin | 1:200 |
| PSD95 | Millipore | MAB1596 | la souris | 5 ug / uL |
| SNAP25 | Abcam | ab5666-100 | lapin | 1:2000 |
| Synaptophysine | Millipore | MAB368 | la souris | 1:500 |
| β-3-tubuline | Santa Cruz | sc-80016 | la souris | 1:200 |
Références
- Westmark, C. J., Malter, J. S. FMRP mediates mGluR5-dependent translation of amyloid precursor protein. PLoS Biol. 5, e52-e52 (2007).
- Westmark, P. R., Westmark, C. J., Wang, S., Levenson, J., O'Riordan, K. J., Burger, C., Malter, J. S. Pin1 and PKMzeta sequentially control dendritic protein synthesis. Sci Signal. 3, ra18-ra18 (2010).
- Dunkley, P. R., Heath, J. W., Harrison, S. M., Jarvie, P. E., Glenfield, P. J., Rostas, J. A. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: Homogeneity and morphology of subcellular fractions. Brain Res. 441, 59-71 (1988).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nat. Protoc. 3, 1718-1728 (2008).
- Hollingsworth, E. B., McNeal, E. T., Burton, J. L., Williams, R. J., Daly, J. W., Creveling, C. R. Biochemical characterization of a filtered synaptoneurosome preparation from guinea pig cerebral cortex: cyclic adenosine 3':5'-monophosphate-generating systems, receptors, and enzymes. J. Neurosci. 5, 2240-2253 (1985).
- Yi, H., Leunissen, J., Shi, G., Gutekunst, C., Hersch, S. A novel procedure for pre-embedding double immunogold-silver labeling at the ultrastructural level. J. Histochem. Cytochem. 49, 279-284 (2001).
- Akins, M. R., Berk-Rauch, H. E., Fallon, J. R. Presynaptic translation: stepping out of the postsynaptic shadow. Front. Neural Circuits. 3, (2009).
- Jin, I., Kandel, E. R., Hawkins, R. D. Whereas short-term facilitation is presynaptic, intermediate-term facilitation involves both presynaptic and postsynaptic protein kinases and protein synthesis. Learn. Mem. 18, 96-102 (2011).
- Lyles, V., Zhao, Y., Martin, K. C. Synapse formation and mRNA localization in cultured Aplysia neurons. Neuron. 49, 349-356 (2006).
- Wagatsuma, A., Azami, S., Sakura, M., Hatakeyama, D., Aonuma, H., Ito, E. De Novo synthesis of CREB in a presynaptic neuron is required for synaptic enhancement involved in memory consolidation. J. Neurosci. Res. 84, 954-9560 (2006).
- Sutton, M. A., Schuman, E. M. Local translational control in dendrites and its role in long-term synaptic plasticity. J. Neurobiol. 64, 116-131 (2005).
- Li, K. -. W., Hornshaw, M. P., Van der Schors, R. C., Watson, R., Tate, S., Casetta, B., Jimenez, C. R. Proteomics analysis of rat brain postsynaptic density: implications of the diverse protein functional groups for the integration of synaptic physiology. J. Biol. Chem. 279, 987-1002 (2004).
- Peng, J., Kim, M. J., Cheng, D., Duong, D. M., Gygi, S. P., Sheng, M. Semi-quantitative proteomic analysis of rat forebrain postsynaptic density fractions by mass spectrometry. J. Biol. Chem. 279, 21003-21011 (2004).
- Kim, S. H., Fraser, P. E., Westaway, D., St. George-Hyslop, P. H. Group II metabotropic glutamate receptor stimulation triggers production and release of Alzheimer's amyloid β42 from isolated intact nerve terminals. J. Neurosci. 30, 3870-3875 (2010).
- Weiler, I. J., Greenough, W. T. Potassium ion stimulation triggers protein translation in synaptoneurosomal poiyribosomes. Mol. Cell. Neurosci. 2, 305-314 (1993).
- Billard, J. M. Ageing, hippocampal synaptic activity and magnesium. Magnes Res. 19, 199-215 (2006).
- Murphy, G. G., Fedorov, N. B., Giese, K. P., Ohno, M., Friedman, E., Chen, R., Silva, A. J. Increased neuronal excitability, synaptic plasticity, and learning in aged Kvbeta1.1 knockout mice. Curr. Biol. 14, 1907-1915 (2004).
- Norris, C. M., Halpain, S., Foster, T. C. Reversal of Age-Related Alterations in Synaptic Plasticity by Blockade of L-Type Ca21 Channels. J. Neurosci. 18, 3171-3179 (1998).
- Sallert, M., Malkki, H., Segersträlea, M., Tairaa, T., Lauri, S. E. Effects of the kainate receptor agonist ATPA on glutamatergic synaptic transmission and plasticity during early postnatal development. Neuropharm. 52, 1354-1365 (2007).
- Quinlan, E. M., Philpot, B. D., Huganir, R. L., Bear, M. F. Rapid, experience-dependent expression of synaptic NMDA receptors in visual cortex in vivo. Nat. Neurosci. 2, 357-35 (1999).
- Scheetz, A. J., Nairn, A. C., Constantine-Patton, M. NMDA receptor-mediated control of proteins synthesis at developing synapses. Nat. Neurosci. 3, 211-216 (2000).
- Villasana, L. E., Klann, E., Tejada-Simon, M. V. Rapid isolation of synaptoneurosomes and postsynaptic densities from adult mouse hippocampus. J. Neurosci. Methods. 158, 30-36 (2006).
- Weiler, I. J., Greenough, W. T. Metabotropic glutamate receptors trigger postsynaptic protein synthesis. Proc. Natl. Acad. Sci. U.S.A. 90, 7168-7171 (1993).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron microscopic study of cell fragments derived by homogenization and centrifugation. J. Anat. 96, 79-88 (1962).
- Gylys, K. H., Fein, J. A., Yang, F., Cole, G. M. Enrichment of Presynaptic and Postsynaptic Markers by Size-Based Gating Analysis of Synaptosome Preparations From Rat and Human Cortex. Cytometry A. 60, 90-96 (2004).
- Hajós, F. An improved method for the preparation of synaptosomal fractions in high purity. Brain Res. 93, 485-489 (1975).
- Bai, F., Witzmann, F. A. Synaptosome Proteomics. Subcell. Biochem. 43, 77-98 (2007).
- Rao, A., Steward, O. Evidence that protein constituents of postsynaptic membrane specializations are locally synthesized: analysis of proteins synthesized within synaptosomes. J Neurosci. 11, 2881-2895 (1991).
- Pertoft, H., Laurent, T. C., Catsimpoolas, N. Isopycnic separation of cells and cell organelles by centrifugation and modified colloidal silica gradients. Methods of Cell Separation. , 25-65 (1977).
- Ramarao, C. S., Acharya, S. R., Krishnan, K. S., Kenkare, U. W. High affinity uptake of L-glutamate and γ-aminobutyric acid in Drosophila melanogaster. J. Biosci. 11, 119-135 (1987).
- Munteanu, L. S., Dinu, A. Fractionation of granulocytes from whole human blood by centrifugation. Practical hints. Romanian J. Biophys. 14, 53-58 (2004).
- Vlasselaer, P., Van Palathumpat, V. Cell separation composition, kit and method. US patent. , (1997).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon