È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione di Synaptoneurosomes da mouse Cortex con un discontinuo di Percoll-Saccarosio gradiente di densità
In questo articolo
Riepilogo
Un metodo per preparare traduzionali attivo, synaptoneurosomes intatto (SN) da topo corteccia cerebrale è descritto. Il metodo utilizza un discontinuo di Percoll-saccarosio gradiente di densità che permette per la preparazione veloce di SN attivo.
Abstract
Synaptoneurosomes (SN) si ottengono dopo omogeneizzazione e frazionamento della corteccia cerebrale del mouse. Sono risigillati vescicole o terminali isolati che rompere con terminali dell'assone quando il tessuto corticale è omogeneizzato. La SN mantengono caratteristiche di pre-e post-sinaptici, che li rende utili per lo studio della trasmissione sinaptica. Essi conservano le macchine molecolari utilizzati nella segnalazione neuronale e sono capaci di captazione, stoccaggio, e il rilascio di neurotrasmettitori.
La produzione e l'isolamento di SN attivo può essere problematico media usando come Ficoll, che possono essere citotossici e richiedono estese a causa di centrifugazione ad alta densità, e la filtrazione e metodi di centrifugazione, che può portare a bassa attività a causa di danni meccanici del SN. Tuttavia, l'uso discontinuo di Percoll-saccarosio gradienti di densità per isolare SN offre un metodo rapido per produrre buone rese di SN traduzionali attivo. Il Percoll-saccarosio metodo del gradiente è veloce e gentile come impiega condizioni isotoniche, ha un minor numero di giri centrifugazione e più brevi ed evita le fasi di centrifugazione che SN pellet e provocare danni meccanici.
Protocollo
1. Preparativi 1-4
- Preparare 500 mL di tampone di media pendenza (GM) mescolando 50 mL di una sospensione saccarosio 2,5 M, 2,5 mL di una 1M Tris-HCl, pH7.5 stock, e 0,1 mL di una m 0,5 EDTA, pH 8,0 stock con millisecondi Q acqua al volume. Filtro sterilizzare la soluzione, aliquota e conservare congelati.
- Preparare uno stock 1000x di tetrodotossina (TTX) facendo una soluzione 1 mM in milli-Q H 2 O. Aliquote di TTX possono essere conservati a -20 ° C.
- Preparare Buffer 10x stimolazione facendo una soluzione di 100 mM Tris (pH 7,5), 5 mM Na 2 HPO 4, 4 mM KH 2 PO 4, 40 mM NaHCO 3, e 800 mM NaCl in acqua Milli-Q. Magazzino può essere conservato a 4 ° C.
- Pre-cool centrifughe a 4 ° C.
- Preparare una soluzione stock di Isosmotic Percoll (SIP) con l'aggiunta di 9 volumi di Percoll (18 ml) a 1 volume di 2,5 M saccarosio (2 ml) in milli-Q acqua e mescolare bene.
- Preparare il 3, 10, 15, e gli strati pendenza del 23% sommando i rispettivi importi di SIP per GM buffer e mescolando ogni:
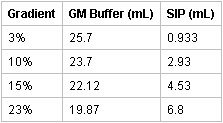
- Versare strati gradiente pipettando 2 ml ciascuno dei 23, 15, 10, e il 3% Percoll isosmotic soluzioni in provette per centrifuga della Beckman con tappi utilizzando un Gilson Pipetman P1000. L'interfaccia tra gli strati devono essere chiaramente individuabili senza miscelazione degli strati. Conservare i gradienti a 4 ° C per almeno 20 minuti prima dell'uso. I gradienti possono essere memorizzati fino a 24 ore anche se l'uso stesso giorno è raccomandato. [Personale di laboratorio inesperti possono praticare gradienti preparazione con l'aggiunta di colorante blu per le soluzioni isomotic Percoll per la visualizzazione delle interfacce strato.]
2. Dissezione del mouse 1
- Garantire che tutti allevamento del mouse e l'eutanasia procedure sono eseguite in conformità con le linee guida NIH e Università. Euthanize cuccioli (età P13 a P21) per asfissia di anidride carbonica o con un metodo approvato nel protocollo animale.
- Pin il mouse in una tavola dissezione e spruzzare la parte posteriore del collo e della testa con etanolo. Utilizzando un paio di forbici affilate tagliare il midollo spinale alla base del cranio, togliere la pelle dalla parte superiore del cranio, tagliare il cranio lateralmente tra l'osso parietale e l'osso interparietale o tra il cervello e le regioni della corteccia. Poi tagliare il cranio dalla base al naso (lungo la sutura sagittale), rimuovere con attenzione l'osso parietale morbido tirando ogni emisfero di lato e togliere la corteccia con una spatola. Inserire la spatola nel cervello di sopra del cervelletto e poi raccogliere la corteccia e metterlo nella gelida tampone GM. Procedere immediatamente alla fase di omogeneizzazione. Non lasciate che le cortecce siedono in ghiacciato tampone per molto tempo come questo influenzerà negativamente la formazione di SN.
3. Preparazione dell'omogeneizzato e SN 1-4
- Sciacquare le cortecce in gelida tampone GM e trasferire due cortecce in un bicchiere Dounce omogeneizzatore contenente 5 ml di tampone a freddo GM.
- Delicatamente omogeneizzato le cortecce con 5-10 colpi del pestello sciolti (pestello "A"), seguito da 5-10 colpi del pestello stretto (pestello "B"). Strokes dovrebbe essere rapido ma abbastanza lento non causare bolle d'aria. Un'immagine del omogenato dopo omogeneizzazione è in Schema 1. Il numero di colpi sarà variare a seconda del omogeneizzatore individuale e pestelli di accompagnamento. Al termine i gradienti dovrebbe dare una band forte SN, in caso contrario, regolare il numero di colpi.
- Trasferire l'omogeneizzato a 15 ml conica e centrifugare a 1000xg per 10 minuti a 4 ° C in un rotore oscillante (Allegra 6KR centrifuga) a pellet detriti cellulari e nuclei. Un'immagine del omogeneizzato filato è in Schema 1.
- Layer 2 mL del supernatante per gradiente di Percoll-saccarosio, cap i tubi, e centrifugare a 32500 xg per 5 minuti a 4 ° C in un rotore ad angolo fisso (Beckman J2-21 centrifuga, rotore JA-17) con opportuni adattatori ( Vedi Tabella Reagenti e apparecchiature).
- Pipetta fuori e scartare la soluzione al di sopra della banda SN utilizzando una pipetta Pasteur di vetro. Pipetta fuori la band SN a livello di interfaccia% 15/23, trasferimento in un cono e memorizzare sul ghiaccio. Ogni pendenza o una corteccia produce 0,9-1,1 mL di SN.
- Regolare la concentrazione di sale della SN con l'aggiunta di un decimo del volume di tampone stimolazione 10x, aggiungere 1000x CaCl 2 ad una concentrazione finale di 12 nM, e aggiungere 1 magazzino mM TTX ad una concentrazione finale di 1 mM di sopprimere l'eccitazione non specifici. (Aggiunta di CaCl 2 è facoltativo, se essa possa interferire con le applicazioni a valle SN).
- Determinare la concentrazione di proteine del SN con il Micro BCA Protein Assay Kit. (Il test proteina Bradford non è raccomandato a causa di inferenza dalla Percoll.)
- SN può essere utilizzato direttamente e velocemente per le proteine traduzionizione degli studi. Per altre applicazioni SN lisato possono essere ripulite o concentrati con l'SDS-PAGE Pierce Kit Sample Prep.
4. Rappresentante dei risultati:
Quando il mouse corteccia è stata omogeneizzata e separato in discontinuo di Percoll-saccarosio gradienti (Schema 1), 6 bande o le frazioni sono state osservate (Figura 1). E 'stato precedentemente mostrato per 3,5 corteccia cerebrale di ratto che i componenti delle bande ad alto peso molecolare sono state rotte membrana e mielina e che il materiale contenuto pellet mitocondri o organelli (Tabella 1). Il 23% / 15% di interfaccia (Band 5) conteneva il SN arricchito.
La band al 23% / 15% di interfaccia, contenenti SN intatto, è stato rimosso ed esaminato al microscopio elettronico (EM), come descritto in precedenza. 2,6 EM ha mostrato la presenza di vescicole sinaptiche intatto e la conservazione di elementi presinaptici e postsinaptici (Figura 2). Isolamento dei vani di pre-e post-sinaptici è importante per l'esame di segnalazione e di sintesi delle proteine, che si verifica in entrambi i comparti. 7-13 Il gradiente di Percoll-saccarosio è una purificazione grezzo quindi abbiamo visto minori cellulare, contaminazione nucleare e degli organelli nella frazione SN, ma la separazione è stata buona.
Quando esaminati da Western Blot, le frazioni di Percoll contenuti i marcatori proteici previsto con un aumento di purezza sinaptica nella banda SN (Figura 3, Tabella 2). Marcatori sinaptica e neuronale sono stati mantenuti nella banda arricchita SN (Band 5), ma l'abbondanza di altri marcatori è risultata significativamente ridotta. In particolare, la presenza di GFAP, un marker per le cellule astrociti e neoplastiche di origine gliale, e Lamin-B1, un marcatore nucleare, sono state trascurabili, mentre gli indicatori strutturali e synaptic sono state mantenute o migliorate. Inoltre, vi era la conservazione dei marcatori per organelli, come i mitocondri e Golgi, che svolgono un ruolo nella sintesi proteica.
Le rese per la band SN erano 250-500 ng di proteine per microlitri, come determinato dal dosaggio delle proteine BCA. L'attività della Scuola Normale Superiore è stata determinata dalla quantità di de novo sintesi proteica presente come monitorato da [35S]-Met incorporazione (Figura 4) 2. Translazionali attività basale era 1,56 volte maggiore quando SN sono state stimolate con 50 microM glutamate/10 mM glicina (Glu) o 5,12 volte quando viene attivato con l'inibitore juglone Pin1. Inibizione Pin1 è noto per provocare la sintesi proteica aumentata. 2 Per confermare che l'aumento di [35S]-Met incorporazione era dovuto a de novo sintesi proteica, abbiamo aggiunto 40 anisomycin mM, un inibitore della sintesi delle proteine, e ha visto una notevole diminuzione incorporazione in presenza e in assenza di Glu rispetto ai livelli basali. Inoltre, dopo l'aggiunta del 2% Triton X-100, che interrompe l'integrità del SN, la traduzione basale è stata ridotta del 75%. 2 Inoltre, nell'esaminare le bande (B4-B6) che ha mostrato l'arricchimento marcatore più sinaptica, il SN o Band 5 ha avuto il maggiore attività per la sintesi proteica de novo (Figura 5). Così, il discontinuo di Percoll-saccarosio gradienti rapidamente produrre una molto attivi e arricchito banda SN che può essere utilizzato per lo studio di traduzione delle proteine.
Il discontinuo di Percoll-saccarosio procedura di gradiente è più vantaggioso rispetto ad altri metodi, perché i danni meccanici è causato da condizioni più severe. Rispetto al metodo di filtraggio, in cui cancellato omogenato corticale viene fatta passare attraverso una serie di filtri che riducono nelle dimensioni, 3,14-15 il metodo Percoll forme più SN con maggiore attività. Come si vede in figura 6, quando un aliquota di SN preparato con il metodo di filtraggio è stata approvata nel corso di un gradiente di Percoll-saccarosio ci sono SN molto meno a livello di interfaccia 15/23% e una maggiore quantità di membrane rotte. Quando de novo sintesi delle proteine è stata misurata mediante incorporazione S35-ha incontrato, il SN preparato con il metodo di filtraggio erano molto meno attivi (Figura 7). Per massimizzare l'attività traslazionale usiamo topi che sono tra l'età P14 e P18. SN possono essere preparati da topi adulti, ma abbiamo osservato un significativo aumento dell'attività traslazionale con SN preparati da giovani topi (Figura 8).

Tabella 1. Componenti della band dal gradiente discontinuo di Percoll-frazionamento della corteccia del mouse omogeneizzato. 3,5
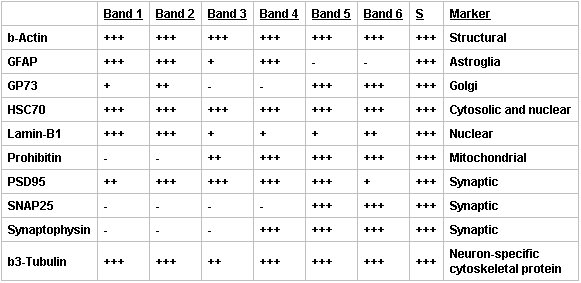
Tabella 2. Sintesi delle analisi bullone occidentale dei costituenti gradiente discontinuo di Percoll-saccarosio band. Concentrazioni di proteine relativa per ciascuna delle frazioni isolate banda utilizzando un Percol discontinuol-gradiente di saccarosio sono stati determinati mediante Western blot. Nessun proteina presente (-), 0 ≥ 0,2 (+), 0,2 ≥ 0,8 (++), o> 0,8 volte (+++) = maggiore di proteina presente nel supernatante (S, centrifugati corteccia omogenato), rappresentante di n 3.
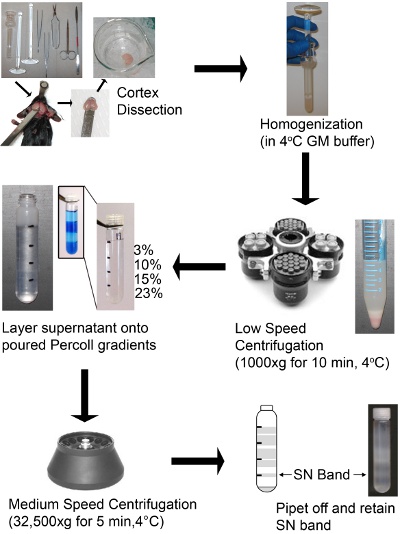
Schema 1: Schema di un preparato SN utilizzando un discontinuo di Percoll-saccarosio gradiente di densità corteccia cerebrale del mouse sono stati sezionati, omogeneizzati, e centrifugati a bassa velocità per rimuovere non omogeneizzato tessuti, cellule, organelli integrali come nuclei e membrane.. Il gradiente discontinuo deve avere chiaramente definiti strati. L'immagine inserto mostra un esempio degli strati, che sono stati tinti di azzurro ha scopi puramente illustrativi per visualizzare gli strati. Il supernatante è stratificato sulla cima di un discontinuo gradiente di Percoll-saccarosio e centrifugati a velocità media. La band SN è poi recuperato dal gradiente ed è pronto all'uso.
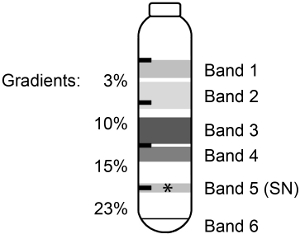
Figura 1. Frazionamento omogenato in un discontinuo di Percoll-saccarosio gradiente. Topo corteccia è stata omogeneizzata e separati su un discontinuo di Percoll-saccarosio gradiente dando luogo a 6 bande o frazioni. L', attivo puro SN (*) sono stati trovati in banda 5.

Figura 2. Preparati SN dare un mix eterogeneo di SN che conservano elementi presinaptici e postsinaptici. Un microscopio elettronico di una preparazione SN preparato da C57BL / 6 topi (età P13 a P21) è stata eseguita come descritto in precedenza e mostra SN con conservato elementi presinaptici e postsinaptici 2. , 6 punti Red frecce per post-sinaptico densità. Barra di scala è di 1 micron.
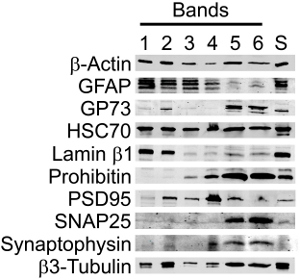
Figura 3. Analisi Western blot di preparati SN ha dimostrato che i marcatori sinaptica e neuronale sono stati mantenuti nel SN purificato (banda 5), ma l'abbondanza di altri marcatori è risultata significativamente ridotta. Immunoblot di surnatante (S, centrifugati omogenato corticale) e Bande 1-6 di uno discontinuo gradiente di Percoll-saccarosio sono stati sondati per la β-actina (strutturale, controllo di carico), GFAP (astrociti), GP73 (Golgi), HSC70 (citoplasmatica e nucleare), Lamin-B1 (nucleare), Prohibitin (mitocondriale), PSD95 (densità postsinaptica ), SNAP25 (sinapsi), sinaptofisina (sinapsi) e β3-tubulina (neurone-specifico). Le bande sono state visualizzate con un 860 Phosphorimager Tempesta, rappresentante di n = 3.
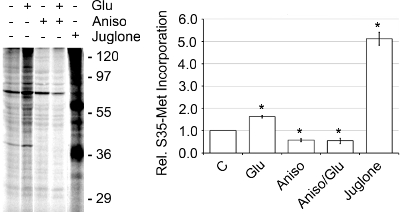
Figura 4. SN sono attivi e mostrano de novo sintesi proteica tramite [35S]-Met incorporazione. SN sono stati pre-equilibrati a 37 ° C per 10 min. Poi i SN sono stati pre-trattati o non trattati per 15 min con 40 anisomycin mM o 1 juglone mM a 37 ° C seguita da aggiunta di [35S]-Met, 20 l espresso Label Pro Mix S35 Etichetta Facile, più o meno Glu a 37 ° C per 30 min. I campioni sono stati preparati con la SDS-PAGE Pierce Kit Sample Prep, eseguito su un gel di poliacrilammide al 15%, asciugato e quantificato utilizzando una dinamica molecolare Tempesta 860 phosphorimager, rappresentante di n = 3, ± SEM.
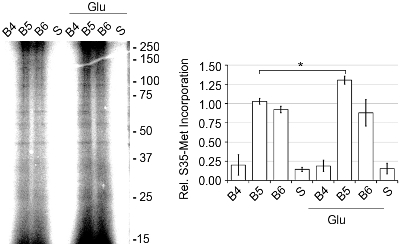
Figura 5. Banda 5 dal discontinuo di Percoll-saccarosio gradiente contenuti i massimi livelli di de novo sintesi proteica. Bande 4, 5 e 6 e il surnatante (S, centrifugati omogenato corticale) sono stati pre-equilibrati a 37 ° C per 10 min. Poi, [35S]-Met, Check Mix Label Pro S35 Tag Facile, è stata aggiunta, più o meno Glu a 37 ° C per 30 min. I campioni sono stati preparati con la SDS-PAGE Pierce Kit Sample Prep, eseguito su un gel di poliacrilammide al 15%, asciugato e quantificato utilizzando una dinamica molecolare Tempesta 860 phosphorimager, rappresentante di n = 3, ± SEM.

Figura 6. SN preparato da un metodo di filtraggio contenere le membrane più rotto e SN meno tutto quello SN preparato dal discontinuo di Percoll-saccarosio metodo del gradiente. SN sono stati preparati da corteccia omogeneizzato passando attraverso una serie di filtri con il diminuire delle dimensioni dei pori, come descritto in precedenza. 3,14-15 Un'aliquota del SN preparato con il metodo di filtraggio è stato centrifugato per un discontinuo di Percoll-saccarosio gradiente e rispetto ad un importo equivalente di materiale con il discontinuo di Percoll-saccarosio metodo del gradiente.
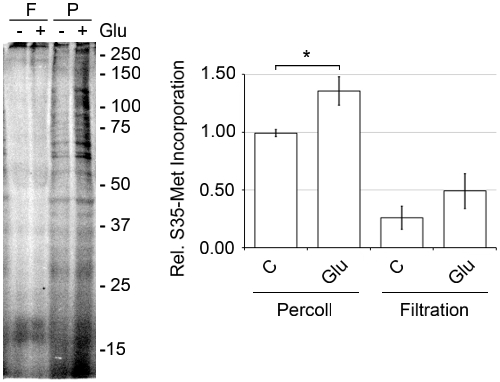
Figura 7. SN preparato da un metodo di filtraggio contengono meno proteine de novo sintesi delle attività di SN preparato from il discontinuo di Percoll-saccarosio metodo del gradiente. SN sono stati preparati da corteccia omogeneizzato passando attraverso una serie di filtri con il diminuire delle dimensioni dei pori come descritto in precedenza, 3,14-15 e dal discontinuo di Percoll-saccarosio metodi di gradiente. SN di entrambe le preparazioni sono state pre-equilibrati a 37 ° C per 10 min. Poi, [35S]-Met, Check Mix Label Pro S35 Tag Facile, è stata aggiunta, più o meno Glu a 37 ° C per 30 min. I campioni sono stati preparati con la SDS-PAGE Pierce Kit Sample Prep, eseguito su un gel di poliacrilammide al 15%, asciugato e quantificato utilizzando una dinamica molecolare Tempesta 860 phosphorimager, rappresentante di n = 3, ± SEM.

Figura 8. SN più giovani topi (P14) hanno una maggiore attività traslazionale rispetto ai vecchi topi (P85). SN sono state preparate da diversi topi anziani con il discontinuo di Percoll-saccarosio metodo del gradiente, preequilibrated a 37 ° C per 10 minuti, trattati o non trattati con Glu nel presenza di [35S]-Met (Express Label Pro Mix S35 Etichetta facile) per 30 min, scatto congelato, e poi ripulite con la SDS-PAGE Kit Sample Prep Pierce. I SN sono state poi eseguite su un SDS-poliacrilammide gel 12%, asciugato e ripreso su un Molecular Dynamics Tempesta 860 phosphorimager, rappresentante di n = 3, ± SEM. SN da P14 topi sono stati almeno 3 volte più attivo del P85 topi.
Discussione
Il discontinuo di Percoll-saccarosio preparazione pendenza qui descritto è un processo rapido, metodo affidabile per isolare attivo SN, che può essere utilizzato in una varietà di esperimenti di trasmissione sinaptica. Questo metodo del gradiente, che si basa sul metodo sviluppato da Dunkley et al. 3,4 è una procedura di frazionamento subcellulare del cervello che isola pre e post-sinaptici di membrana derivata vescicole che sono associati tra loro. Senza ulteriore purificazione queste SN sono compatibili...
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
Vorremmo ringraziare BK agosto presso la University of Wisconsin-Madison strumento microscopio elettronico per la microscopia elettronica. Questo lavoro è stato sostenuto da NIH R01-DA026067 e P30-HD03352 (a JSM).
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti (opzionale) |
|---|---|---|---|
| Micro BCA Protein Assay Kit | Perforare | 23235 | |
| CaCl 2 | Pescatore | C79-500 | |
| Gas CO 2 | Airgas (UW-MDS) | CD 50 | |
| EDTA | RPI | E57020 | |
| EtOH | Pescatore | A407SK-4 | |
| HCl | Pescatore | A142-212 | |
| Percoll | GE Healthcare | 17-0891-01 | |
| KH 2 PO 4 | Pescatore | P285-500 | |
| PierceSDS-PAGE kit di preparazione del campione | Perforare | 89888 | |
| NaCl | RPI | S23020 | |
| NaHCO 3 | Pescatore | BP328-500 | |
| Na 2 PHO 4 | Pescatore | S381-500 | |
| Saccarosio | RPI | S24060 | |
| Tris Base | RPI | T60040 | |
| Tetrodotossina | Sigma | T5651 | |
| Esprimere Label Pro Mix S35 Tag Facile | Perkin Elmer | NEG772 | |
| Attrezzatura | Azienda | Numero di catalogo | Commenti (opzionale) |
| Strumenti di dissezione | |||
| Dounce omogeneizzatore, 7 ml (vetro viene fornito con due pestelli etichetta "A" e "B") | Wheaton | ||
| P1000 Gilson Pipetman | Gilson | F123602 | |
| Allegra 6KR Centrifuga | Beckman Coulter | 366830 | |
| GH 3,8 rotore, rotore oscillante | Beckman Coulter | 360581 | |
| Beckman J2-21 Centrifuga | Beckman | ||
| Beckman tubi con tappi | Beckman | 355672 | |
| Bianco adattatori murata | Beckman | 342327 | |
| Blu adattatori murata | Beckman | ||
| JA-17 Rotor, Rotore ad angolo fisso | Beckman | 369691 |
Tabella di anticorpi utilizzati per Western blot:
| Nome di anticorpi | Azienda | Numero di catalogo | Specie Host | Fattore di diluizione |
|---|---|---|---|---|
| β-Actina | Sigma | A5441 | mouse | 1:2000 |
| GFAP | Santa Cruz | sc-65343 | mouse | 1:200 |
| GP73 | Santa Cruz | Sc-134509 | coniglio | 1:200 |
| HSC70 | Santa Cruz | sc-7298 | mouse | 1:200 |
| Laminβ | Santa Cruz | Sc-6261 | capra | 1:200 |
| Prohibitin | Santa Cruz | sc-28259 | coniglio | 1:200 |
| PSD95 | Millipore | MAB1596 | mouse | 5 mcg / mL |
| SNAP25 | AbCam | ab5666-100 | coniglio | 1:2000 |
| Sinaptofisina | Millipore | MAB368 | mouse | 1:500 |
| β-3-tubulina | Santa Cruz | sc-80016 | mouse | 1:200 |
Riferimenti
- Westmark, C. J., Malter, J. S. FMRP mediates mGluR5-dependent translation of amyloid precursor protein. PLoS Biol. 5, e52-e52 (2007).
- Westmark, P. R., Westmark, C. J., Wang, S., Levenson, J., O'Riordan, K. J., Burger, C., Malter, J. S. Pin1 and PKMzeta sequentially control dendritic protein synthesis. Sci Signal. 3, ra18-ra18 (2010).
- Dunkley, P. R., Heath, J. W., Harrison, S. M., Jarvie, P. E., Glenfield, P. J., Rostas, J. A. A rapid Percoll gradient procedure for isolation of synaptosomes directly from an S1 fraction: Homogeneity and morphology of subcellular fractions. Brain Res. 441, 59-71 (1988).
- Dunkley, P. R., Jarvie, P. E., Robinson, P. J. A rapid Percoll gradient procedure for preparation of synaptosomes. Nat. Protoc. 3, 1718-1728 (2008).
- Hollingsworth, E. B., McNeal, E. T., Burton, J. L., Williams, R. J., Daly, J. W., Creveling, C. R. Biochemical characterization of a filtered synaptoneurosome preparation from guinea pig cerebral cortex: cyclic adenosine 3':5'-monophosphate-generating systems, receptors, and enzymes. J. Neurosci. 5, 2240-2253 (1985).
- Yi, H., Leunissen, J., Shi, G., Gutekunst, C., Hersch, S. A novel procedure for pre-embedding double immunogold-silver labeling at the ultrastructural level. J. Histochem. Cytochem. 49, 279-284 (2001).
- Akins, M. R., Berk-Rauch, H. E., Fallon, J. R. Presynaptic translation: stepping out of the postsynaptic shadow. Front. Neural Circuits. 3, (2009).
- Jin, I., Kandel, E. R., Hawkins, R. D. Whereas short-term facilitation is presynaptic, intermediate-term facilitation involves both presynaptic and postsynaptic protein kinases and protein synthesis. Learn. Mem. 18, 96-102 (2011).
- Lyles, V., Zhao, Y., Martin, K. C. Synapse formation and mRNA localization in cultured Aplysia neurons. Neuron. 49, 349-356 (2006).
- Wagatsuma, A., Azami, S., Sakura, M., Hatakeyama, D., Aonuma, H., Ito, E. De Novo synthesis of CREB in a presynaptic neuron is required for synaptic enhancement involved in memory consolidation. J. Neurosci. Res. 84, 954-9560 (2006).
- Sutton, M. A., Schuman, E. M. Local translational control in dendrites and its role in long-term synaptic plasticity. J. Neurobiol. 64, 116-131 (2005).
- Li, K. -. W., Hornshaw, M. P., Van der Schors, R. C., Watson, R., Tate, S., Casetta, B., Jimenez, C. R. Proteomics analysis of rat brain postsynaptic density: implications of the diverse protein functional groups for the integration of synaptic physiology. J. Biol. Chem. 279, 987-1002 (2004).
- Peng, J., Kim, M. J., Cheng, D., Duong, D. M., Gygi, S. P., Sheng, M. Semi-quantitative proteomic analysis of rat forebrain postsynaptic density fractions by mass spectrometry. J. Biol. Chem. 279, 21003-21011 (2004).
- Kim, S. H., Fraser, P. E., Westaway, D., St. George-Hyslop, P. H. Group II metabotropic glutamate receptor stimulation triggers production and release of Alzheimer's amyloid β42 from isolated intact nerve terminals. J. Neurosci. 30, 3870-3875 (2010).
- Weiler, I. J., Greenough, W. T. Potassium ion stimulation triggers protein translation in synaptoneurosomal poiyribosomes. Mol. Cell. Neurosci. 2, 305-314 (1993).
- Billard, J. M. Ageing, hippocampal synaptic activity and magnesium. Magnes Res. 19, 199-215 (2006).
- Murphy, G. G., Fedorov, N. B., Giese, K. P., Ohno, M., Friedman, E., Chen, R., Silva, A. J. Increased neuronal excitability, synaptic plasticity, and learning in aged Kvbeta1.1 knockout mice. Curr. Biol. 14, 1907-1915 (2004).
- Norris, C. M., Halpain, S., Foster, T. C. Reversal of Age-Related Alterations in Synaptic Plasticity by Blockade of L-Type Ca21 Channels. J. Neurosci. 18, 3171-3179 (1998).
- Sallert, M., Malkki, H., Segersträlea, M., Tairaa, T., Lauri, S. E. Effects of the kainate receptor agonist ATPA on glutamatergic synaptic transmission and plasticity during early postnatal development. Neuropharm. 52, 1354-1365 (2007).
- Quinlan, E. M., Philpot, B. D., Huganir, R. L., Bear, M. F. Rapid, experience-dependent expression of synaptic NMDA receptors in visual cortex in vivo. Nat. Neurosci. 2, 357-35 (1999).
- Scheetz, A. J., Nairn, A. C., Constantine-Patton, M. NMDA receptor-mediated control of proteins synthesis at developing synapses. Nat. Neurosci. 3, 211-216 (2000).
- Villasana, L. E., Klann, E., Tejada-Simon, M. V. Rapid isolation of synaptoneurosomes and postsynaptic densities from adult mouse hippocampus. J. Neurosci. Methods. 158, 30-36 (2006).
- Weiler, I. J., Greenough, W. T. Metabotropic glutamate receptors trigger postsynaptic protein synthesis. Proc. Natl. Acad. Sci. U.S.A. 90, 7168-7171 (1993).
- Gray, E. G., Whittaker, V. P. The isolation of nerve endings from brain: An electron microscopic study of cell fragments derived by homogenization and centrifugation. J. Anat. 96, 79-88 (1962).
- Gylys, K. H., Fein, J. A., Yang, F., Cole, G. M. Enrichment of Presynaptic and Postsynaptic Markers by Size-Based Gating Analysis of Synaptosome Preparations From Rat and Human Cortex. Cytometry A. 60, 90-96 (2004).
- Hajós, F. An improved method for the preparation of synaptosomal fractions in high purity. Brain Res. 93, 485-489 (1975).
- Bai, F., Witzmann, F. A. Synaptosome Proteomics. Subcell. Biochem. 43, 77-98 (2007).
- Rao, A., Steward, O. Evidence that protein constituents of postsynaptic membrane specializations are locally synthesized: analysis of proteins synthesized within synaptosomes. J Neurosci. 11, 2881-2895 (1991).
- Pertoft, H., Laurent, T. C., Catsimpoolas, N. Isopycnic separation of cells and cell organelles by centrifugation and modified colloidal silica gradients. Methods of Cell Separation. , 25-65 (1977).
- Ramarao, C. S., Acharya, S. R., Krishnan, K. S., Kenkare, U. W. High affinity uptake of L-glutamate and γ-aminobutyric acid in Drosophila melanogaster. J. Biosci. 11, 119-135 (1987).
- Munteanu, L. S., Dinu, A. Fractionation of granulocytes from whole human blood by centrifugation. Practical hints. Romanian J. Biophys. 14, 53-58 (2004).
- Vlasselaer, P., Van Palathumpat, V. Cell separation composition, kit and method. US patent. , (1997).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon