Method Article
Skeletal Muscle dimorphisme des sexes de la protéomique
Dans cet article
Résumé
Un ensemble straight-forward de méthodes pour isoler et déterminer l'identité des protéines les plus abondantes ont exprimé dans le muscle squelettique. Environ 800 places sont discernées sur un gel à deux dimensions à partir de 10 mg de muscle, ce qui permet pour la détermination du sexe d'expression de protéines spécifiques. Ces méthodes donnent des résultats équivalents dans la plupart des tissus.
Résumé
Contraction de brut dans le muscle squelettique est principalement déterminée par un nombre relativement faible de protéines contractiles, cependant ce tissu est également remarquable capacité d'adaptation aux facteurs environnementaux tels que l'hypertrophie 1 par des exercices de résistance et de l'atrophie par désuétude. Elle a ainsi des expositions de remodelage et d'adaptations à des stresseurs (chaleur, l'ischémie, les métaux lourds, etc.) 2,3. Les dommages peuvent se produire au muscle par une force musculaire exerçant tout en allongeant, le 4 dite de contraction excentrique. Les protéines contractiles peuvent être endommagées dans ces efforts et ont besoin d'être réparé, dégradé et / ou resynthétisé; ces fonctions ne font pas partie des protéines contractiles, mais d'autres protéines beaucoup moins abondant dans la cellule. Pour déterminer ce sous-ensemble de protéines est impliquée dans l'amélioration de ce type de dommages, un protéome global doit être établi avant l'exercice 5, puis suivis à la suite de l'exercice pour déterminer le différentiell'expression des protéines et ainsi mettre en évidence de protéines candidates dans les adaptations à des dommages et de sa réparation. Par ailleurs, la plupart des études sur les muscles squelettiques ont été menées sur le mâle de l'espèce et donc ne peuvent pas être représentatifs des muscles féminins.
Dans cet article nous présentons une méthode pour extraire les protéines des muscles reproductible masculins et féminins, et les séparer par électrophorèse sur gel à deux dimensions suivie par imagerie de haute résolution numérique 6. Ceci fournit un protocole pour les taches (et des protéines par la suite identifié) qui montrent une réduction statistiquement significative (p <0,05) deux fois augmenter ou diminuer, apparaissent ou disparaissent de l'état du contrôle. Ces derniers sont ensuite excisés, digérés à la trypsine et séparés par chromatographie liquide à haute pression couplée à un spectromètre de masse (LC / MS) pour l'identification des protéines (LC / MS / MS) 5. Cette méthodologie (figure 1) peut être utilisé sur de nombreux tissus, avec peu ou aucune modification (foie, cerveau, entendret etc.).
Protocole
1. La préparation des échantillons
- Utilisez frais, tissus congelés ou flash-RNAlater-traitée chez la souris comme matériel de départ. Blot l'écart aucun conservateur excédent avec un Kimwipe avant de procéder.
- Retirez tous les tendons et le fascia qui entoure le muscle et émincer le tissu avec une seule lame de rasoir tranchant pendant 2 min sur les plaques de verre refroidi dans une chambre froide (4 ° C) jusqu'à ce que le tissu est bien hachée ou en poudre. Recueillir l'échantillon dans un tube pré-pesé microcentrifugeuse et déterminer le poids du tissu. N'utilisez pas plus de 10 mg de tissu que votre matériel de départ.
- Ajouter 45 uL de tampon d'extraction (8 M d'urée, 50 mM DTT, CHAPS 4%, 0,2% des ampholytes porteuse 5 / 8, 0,0002% bleu de bromophénol) pour 1 mg de tissu hachée, à température ambiante. Si le volume est supérieur à 350 uL, ajouter 350 uL d'abord et homogénéiser (étape 1.4), puis ajouter le reste de la mémoire tampon pour minimiser les éclaboussures.
- Homogénéiser le tissu sept fois avec un pilon motorisés (Kontes Corp) pendant 15 secondes à4 ° C, avec deux minutes de refroidissement sur la glace entre chaque homogénéisation.
- Centrifuger les échantillons à 15600 xg pendant 30 minutes à 4 ° C. Enregistrer le surnageant et mesurer son volume. Les débris culot cellulaire est jeté.
- Précipiter les protéines dans le surnageant avec glacée de qualité réactif d'acétone (3 fois v: rapport V). Vortex les tubes pendant 15 secondes. Centrifuger pendant 15 600 xg pendant 10 secondes pour former des boulettes, et remettre en suspension dans un tampon d'extraction avec le moteur Kontes et tiges polypropylène agitation (BioSpec Prod)
- Répétez 1,6 étape.
- Soit procéder à l'estimation concentration en protéines des échantillons ou les stocker à -20 ° C.
2. Estimation de la concentration de protéines
Utilisez le dosage de Lowry 7 ou le dosage BCA 8 (Pierce); objectif pour environ 4,5 mg -1 ml.
3. Focalisation isoélectrique
- Retirez une bande ReadyStrip IPG (11 cm, pH 5-8, Bio-Rad)de -20 ° C et le laisser se stabiliser à la température ambiante pendant 10-15 min.
- Vortex de l'échantillon et la pipette de 600 à 800 mg (volume total 200 pi) de l'échantillon de protéines dans une ligne droite sur le bord arrière d'un canal dans le plateau de réhydratation de l'échantillon, en laissant environ 1 cm à chaque extrémité.
- En utilisant une pince, retirez le couvercle en plastique de la bande de GPI - assurez-vous de traiter seulement les extrémités de la bande et éviter tout contact avec le gel. Notez la fin de la bande de base et le positionner sur le côté gauche du bac. Placez la bande de gel IPG vers le bas sur le dessus de l'échantillon, éviter les bulles piégeage dessous. Permettez-lui de se réhydrater pendant une heure.
- Superposition avec 2,5 mL d'huile minérale (BioRad). Couvrir le bac avec le couvercle, et laisser réhydrater une nuit à température ambiante.
- Placez une mèche de papier aux deux extrémités de la chaîne Bac concentrant et humide chacun avec 10 uL d'eau Millipore.
- Sortez IPG bande et tenir verticalement pendant environ 10 secondes de la vidange de l'huile. Éponger la matière plastique BACKing avec un Kimwipe.
- Placez le côté bande de gel IPG bas et avec la fin de base pour la gauche dans la barre de focalisation. Couvrir la bande avec 2,5 mL d'huile minérale.
- Placez le bac dans la cellule PROTEAN IEF (Bio-Rad) et le programme d'un protocole en 3 étapes (tableau 1) à la température de cellule par défaut de 20 ° C, un courant maximal de 50 mA / bande, et pas le temps de réhydratation.
Tension Temps Volt-Hrs Rampe Etape 1 250 20 min Linéaire Etape 2 8000 2,5 heures Linéaire Etape 3 8000 40000 Rapide Total des 6,5 h 40000 Tableau 1. Trois étapes du protocole d'PROTEAN IEF cellule pour 11 cm IPG strips.
- Prenez les bandes IPG hors de la cellule en utilisant une pince IEF. Blot le support plastique avec un Kimwipe et placer le côté bande de gel IPG dans un bac de réhydratation propre. Vous pouvez couvrir le plateau de réhydratation et l'envelopper d'une pellicule plastique et conserver à - 80 ° C ou procéder.
4. Électrophorèse sur gel de polyacrylamide SDS
- Transfert de la bande (côté gel) dans un bac de 11 cm d'équilibration.
- Ajouter 4 mL de tampon de réduction (6 M d'urée, 2% SDS, 0,05 M Tris / HCl pH 8,8, glycérol 20%, 2% TNT) pour le canal et équilibrer la bande pendant 10 min avec agitation légère.
- Retirer le tampon de réduction, ajouter 4 ml de tampon d'alkylation (6 M d'urée, 2% SDS, 0,05 M Tris / HCl pH 8,8, glycérol 20%, 2,5% iodoacétamide) et équilibrer la bande pendant 10 minutes avec agitation légère.
- Rincer la bande IPG en plongeant le STRIbrièvement p 1 x tampon SDS course (Tris 25 mM, glycine 192 mM, SDS 0,1%, pH 8,2).
- Lay le côté gel de la bande de monter sur la plaque arrière de la 11 cm Critère préfabriqués 10,5% -14% de Tris-HCl gel de polyacrylamide SDS (Bio-Rad) et poussez-le délicatement dans le de sorte qu'il fasse plein contact avec le gel SDS; Assurez-vous pas de bulles sont emprisonnées entre les deux surfaces de gel.
- Superposition la bande IPG avec 1 ml de solution fondue d'agarose (0,5% d'agarose, Tris 25 mM, glycine 192 mM, SDS 0,1%, bleu de bromophénol) et de laisser l'agarose solidifier pendant 5 minutes.
- Charge 5 pi de marqueur protéique de 10 à 225 kDa (USB, P / N: 76740) dans le seul puits que les normes de poids moléculaire.
- Exécutez le gel dans du tampon SDS (Tris 25 mM, glycine 192 mM, SDS 0,1%, pH 8,2) à 200 V à température ambiante ou dans une chambre froide (4 ° C) en utilisant le bleu de bromophénol migrations devant colorant pour suivre l'électrophorèse.
- Retirer le gel de la fonte en plastique et aux taches nuit en secouant doucement dans Coomassie Brilliant BlueR-250 tache (45,5% de méthanol, de 45,5% dH2O, 9,0% d'acide acétique, 0,25% bleu de Coomassie R-250).
- Agiter le gel dans une solution de Décolorer (45,5% de méthanol, de 45,5% dH 2 O, 9,0% d'acide acétique) à deux reprises pour 3 heures chacune et Décolorer 2 (5% de méthanol, 90% dH 2 O, 5% d'acide acétique) pendant la nuit. Stocker le gel dans l'acide acétique 7% pour l'analyse.
5. Gel d'imagerie et d'analyse
- Capturez des images des gels à l'aide du logiciel Quantity One qui exploite le système d'imagerie VersaDoc (BioRad). Cultures des zones d'image de manière uniforme pour tous les gels dans votre expérience.
- Chargez les images recadrées sur l'PDQuest 8.0 logiciel pour créer un ensemble expérience. Suivez l'assistant de configuration des essais pour définir les paramètres de détection de l'angle et la place correspondant à travers le gel. Inspectez et affiner l'endroit correspondant résultats manuellement si nécessaire.
- Effectuer une analyse quantitative et statistique des gels de protéines pour détecter les points correspondant aux two fois ou plus de différence statistiquement significative de l'expression entre les deux groupes de gel. Créer une analyse exposée avec ces taches d'intérêt et les couper à l'aide d'un cutter place EXQuest (BioRad) pour la digestion de la trypsine et l'identification des protéines par LC-MS-base.
6. En-gel digestion tryptique
Pour cette étape, une Pierce modifiés en gel digestion trypsique Kit (# 89871X, Pierce) est un protocole utilisé.
- Ajouter 200 ul de solution de décoloration (25 mM de bicarbonate d'ammonium, de l'acétonitrile 50%) pour les bouchons de gel. Vortex et laisser incuber les échantillons à 37 ° C pendant 30 minutes avec agitation. Soigneusement enlever et jeter la solution.
- Répétez l'étape 6.1.
- Ajouter 30 uL de tampon réduisant fraîchement préparés (50 mM Tris [2-carboxyéthyl] phosphine, 22,5 mM de bicarbonate d'ammonium) pour les tubes contenant les fiches de gel et incuber à 60 ° C pendant 10 minutes.
- Laisser les échantillons refroidir, puis retirez et jetez le tampon de réduction.
- Ajouter 30 uL de tampon d'alkylation (100 iodoacétamide mM, 20 mM de bicarbonate d'ammonium, préparée immédiatement avant utilisation en papillote tubes. Incuber les échantillons dans l'obscurité à température ambiante pendant 1 heure.
- Retirez et jetez le tampon d'alkylation. Lavez les bouchons de gel en ajoutant 200 uL de solution de décoloration à chaque tube. Incuber les échantillons à 37 ° C pendant 15 minutes.
- Enlevez et jetez la solution de décoloration et répéter le lavage.
- Ajouter 50 uL d'acétonitrile pour les bouchons de gel et les incuber pendant 10 minutes à température ambiante pour leur permettre de réduire à sec, puis retirez délicatement l'acétonitrile.
- Répétez 6,8 étape une fois de plus. Morceaux de gel devrait ressembler blanches et petites.
- Laisser des morceaux de gel à sécher dans un concentrateur Centrivap (Labconco, modèle EX1245) pendant 10 minutes.
- Swell les morceaux de gel en ajoutant 10 ul de solution de trypsine activée (10 trypsine ng / uL, 25 mM de bicarbonate d'ammonium). Incuber à température ambiante pendant 15 minutes.
- Ajouter 25 uL de tampon de digestion (25 mM de bicarbonate d'ammonium) pour les tubes. Incuber les échantillons à température ambiante pendant la nuit avec agitation.
- Soniquer les échantillons pendant 10 minutes (Branson, modèle sonicateur de bain 2510) et les spin-down avant de retirer le surnageant dans un nouveau tube. Enregistrer le surnageant.
- Afin d'extraire des peptides, ajouter 10 ul d'acide formique 0,1% et incuber pendant 5 minutes à température ambiante sous agitation. Soniquer les échantillons pendant 10 minutes, recueillir le surnageant et de combiner avec le surnageant enregistré à l'étape 6.13.
7. Dessalage Microscale des extraits peptidiques
- Retirer du bicarbonate d'ammonium et autres sels dans les extraits peptidiques avec l'aide de PepClean C-18 colonnes de centrifugation (ThermoFisher) selon les instructions du fabricant.
- Peptides Eluer deux fois avec 20 uL d'acétonitrile 70%, évaporer les échantillons secs par centrifugation dans le concentrateur Centrivap pendant 1 heure et resuspendreles peptides dans 10 uL d'acide formique 0,1% pour l'analyse de la SEP.
8. Identification de protéines par HPLC-spectrométrie de masse couplée
- Séparé 5 uL du mélange peptidique sur un chromatographe en phase liquide à haute performance (CLHP) en 40 minutes, en utilisant un gradient linéaire d'acétonitrile 2-50% d'acide formique 0,2% sur un Pepswift monolithiques PS-DVB colonne (Dionex) couplé à un Nanospray j'ai source sur un spectromètre de masse à trappe ionique (LCQ Deca XP Max, Thermo Fisher Scientific) à un débit de 400 Nl / min à la pointe.
- Détecter les signaux peptidiques MS1 entre 400 - 1400 m / z et de permettre pour les 3 pics d'ions les plus intenses d'être isolé pour MS2 séquençage par CID avec l'exclusion dynamique.
- Pour l'identification des protéines, l'analyse des résultats peptide via une recherche SEQUEST souris base de données de référence (BioWorks logiciels, Thermo-Fisher Scientific) avec une modification cystéine alkylés statiques et dynamiques pour les modifications de phosphorylation (sérine, la thréonine, la tyrosine), méthylationtion (histidine), l'oxydation (méthionine), ADP-ribosylation (arginine), et l'acétylation N-terminale. Appliquer conservatrice des critères d'appariement (par exemple, tolérance peptide fixé à 2 UMA et la tolérance 1,00 fragment, protéines contiennent au moins 2 peptides passant une Xcorr vs l'état de charge du filtre [z = 1 / x = 1,5, z = 2 / x = 2,00, z = 3 / x = 2,50, z = 4 / x = 3,00] et une probabilité de p <0,05) 5 et inspecter manuellement les spectres MS pour l'identification des protéines confiant.
9. Les résultats représentatifs:
Mâle et femelle non exercées, murin muscle squelettique (biceps brachial) a été extrait et séparé en une carte en deux dimensions 5, le premier niveau du muscle comparative du protéome (figure 2). Une fois visualisées en utilisant à haute résolution de l'imagerie numérique; environ 800 spots de protéines ont été détectées dans chaque. En utilisant la carte masculine protéome comme une référence, il est clair qu'il existe de nombreuses taches qui changent en abondance dans le protéome des femmes. Les intensités d'accompagnement sont des mesures de la variation des montants des protéines (figure 3). L'identité des spots protéiques qui changent plus de deux fois (vers le haut ou le bas) et sont statistiquement significatifs (p <0,05) avec un n = 5 souris, sont déterminées par analyse des séquences d'acides aminés en utilisant la spectrométrie de masse de liquide chromatographie couplée. Ces résultats montrent que les femelles montrent une diminution de l'abondance dans les enzymes du sucre métabolisme énergétique et dans l'enzyme créatine kinase (CK) isoformes, un système d'énergie différentes approvisionnement dans les muscles. Les humains et les animaux d'affichage plus élevée des hommes les taux sériques de CK au repos et après l'exercice 9,10, mais les taux sériques de CK ne sont pas nécessairement en corrélation avec la quantité de perturbation myofibrillaire 11,12. Ce dimorphisme entre les sexes dans l'abondance cellulaire de la CK dans le muscle du biceps brachial murin est un roman finding5 et peuvent répondre aux différents physiologiquement les taux sériques de CK.
Chiffres:
g1.jpg "/>
Figure 1. Un schéma d'ensemble du protocole de protéomique comparative. Le protocole est subdivisé en trois groupes: préparation d'échantillons, l'analyse de l'échantillon, et l'identification des protéines. Les extrémités de chacun de ces trois groupes de protocoles sont aussi des lieux raisonnables pause, bien que les meilleurs résultats sont engrangés si le protocole global est effectué sans s'arrêter.
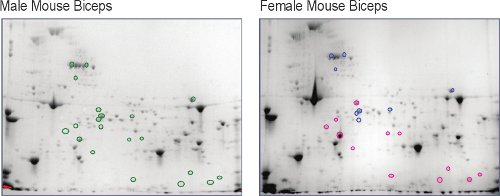
Figure 2. Comparaison des femelles protéines murines biceps brachial taches relatives à l'identique dans les taches biceps brachial masculin (cercles verts o). Spots qui a augmenté supérieur ou égal à deux fois chez les femelles sont encerclés rouge (o) et ceux qui ont diminué inférieur ou égal à deux fois sont encerclés bleu (o).

Figure 3: Analyse de l'intensité Gel Spot:. Axe X, les femmespré-exercice (contrôle, n = 5); axe Y, seule femme du groupe épisode 0 h point dans le temps (n = 5). La ligne de régression: coefficient de corrélation = 0,919; pente = 0,976; l'origine = -0,0293. Spots-dessus de la ligne rouge et en dessous de la ligne bleue changer plus de + / - deux fois.
Discussion
La méthode LC / MS protéomique présenté ici est un protocole plus fiable et reproductible pour une analyse rapide du premier niveau du protéome du muscle squelettique. Il permet une comparaison relativement utile de la spécificité des sexes. Protéines de faible abondance, il faudrait un fractionnement de l'échantillon de muscle pour enlever autant de protéines contractiles que possible, augmentant ainsi les protéines de faible abondance. Adapter le profil du protéome peut être accompli avec des bandes de pH différents IPG large et suppléants des gels de gradient de pourcentage si désiré. Plus sensible taches fluorescentes existent, mais nous recommandons à chaque laboratoire de déterminer la linéarité de ces taches dans votre système. Pour une analyse plus rigoureuse de l'expression des protéines du système DIGE (bidimensionnelle en gel d'électrophorèse, GE Healthcare Life Sciences) peut être utilisé, cependant cela ajoute un niveau de complexité de la méthodologie. En outre, le protocole décrit ici peut être utilisé avec la plupart des animauxtissus mal pour lequel un génome a été séquencé, ainsi que le séquençage de novo d'une protéine à partir de n'importe quelle source, tant il peut être résolu sur un gel à deux dimensions, depuis les fragments qui se chevauchent enzymatiques peuvent être générés en utilisant les enzymes de haute pureté en plus à la trypsine. Des échantillons provenant de sources autres tissus peuvent exiger certaines modifications dans la méthodologie d'extraction, surtout si la recherche de protéines membranaires et hydrophobes, cependant, nous avons eu de bons résultats en utilisant ce protocole avec les cardiaques, hépatiques, rénaux et les tissus du cerveau. Autres modifications post-traductionnelles peuvent être détectées en modifiant les critères spectre de masse de bases de données de recherche. En somme, nous avons présenté un protocole assez détaillé pour l'analyse initiale de profilage protéome.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions Yutian Gan pour l'utilisation de la figure 3. Ce travail a été soutenu par la National Science Foundation 0420971; Smith College Blakeslee, Wilens et des fonds de Holmes, et le Howard Hughes Medical Institute.
matériels
| Name | Company | Catalog Number | Comments | |
| Nom du réactif | Tapez | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|---|
| PepClean C-18 Spin Colonnes | Consommables | ThermoFisher Scientifique | PI-89870 | |
| Monolithiques Pepswift colonne (100um x 5 cm) | Consommables | Dionex | 162348 | |
| Critère préfabriqués 10,5% -14% SDS Tris-HCl des gels de polyacrylamide | Consommables | BioRad | 345-0106 | |
| Readystrip bandes IPG | Consommables | BioRad | PH variable gammes | |
| L'acide acétique | Réactif | Fisher Scientific | A465-1 | |
| L'acétone | Réactif | Pharmco | 329000 | |
| Acétonitrile | Réactif | Fisher Scientific | A955 | |
| Unegarose | Réactif | BioRad | 163-2111 | Revêtement solution |
| Bicarbonate d'ammonium | Réactif | Fluka | 40867 | |
| Bleu de bromophénol | Réactif | Fisher Scientific | BP114 | |
| Bio-Lyte Ampholytes | Réactif | BioRad | PH variable gammes | |
| CHAPS | Réactif | USB | 13361 | |
| Commassie bleu R-250 | Réactif | ThermoFisher Scientifique | 20278 | |
| Dithiothréitol (DTT) | Réactif | USB | 15395 | |
| L'acide formique | Réactif | ThermoFisher Scientifique | 28905 | |
| Glycérol | Réactif | Sigma-Aldrich | G6279 | |
| Glycine | Réactif | USB | 16407 | |
| Iodoacétamide | Réactif | Sigma-Aldrich | I6125 | |
| Méthanol | Réactif | Fisher Scientific | A452 | |
| D'huile minérale | Réactif | BioRad | 163-2129 | |
| Dodécyl sulfate de sodium | Réactif | Sigma-Aldrich | L6026 | |
| Tris base | Réactif | Sigma-Aldrich | 93349 | |
| Tris [2-carboexyethyl] phosphine | Réactif | ThermoFisher Scientifique | 77720 | |
| Trypsine endoprotéinase, TPCK traités, le grade MS | Réactif | Pierce | 90055 | modifiés |
| L'urée | Réactif | USB | 75826 | |
| Eau | Réactif | Burdick & Jackson | 365 | |
| Concentrateur Centrivap | Tool | Labconco | ||
| Cutter place Exquest | Outil | BioRad | ||
| LCQ Deca XP Max ions spectromètre de masse piège | Outil | ThermoFisher Scientifique | ||
| Motorisé pilon | Outil | Kontes Corp | ||
| Polypropylène remuant | Outil | BioSpec Prod | ||
| tiges | ||||
| PROTEAN IEF cellulaire | Outil | BioRad | ||
| Sonicator | Outil | Branson | ||
| Arpenteur plus HPLC système de | Outil | ThermoFisher Scientifique | ||
| VersaDoc imagerie système de | Outil | BioRad |
Références
- Fehrenbach, E., Mooren, F. C., Völker, K. . Molecular and Cellular Exercise Physiology. , 199-217 (2005).
- Mooren, F. C., Mooren, F. C., Völker, K. The Cell. Molecular and Cellular Exercise Physiology. , 3-18 (2005).
- Thompson, H. S., Clarkson, P. M., Scordilis, S. P. The repeated bout effect and heat shock proteins: intra-muscular HSP27 and HSP70 expression following two bouts of eccentric exercise in humans. Acta. Physiol. Scand. 174, 47-56 (2002).
- McHugh, M. P. Recent advances in the understanding of the repeated bout effect: the protective effect against muscle damage from a single bout of eccentric exercise. Scand. J. Med. Sci. Sports. 13, 88-97 (2003).
- Metskas, L. A., Kulp, M., Scordilis, S. P. Gender Dimorphism in the Exercise-Naïve Murine Skeletal Muscle Proteome. Cell Molec. Biol. Lett. 15, 507-516 (2010).
- Lopez, J. L. Two-dimensional electrophoresis in proteome expression analysis. J. Chromatogr. B. 849, 190-202 (2007).
- Lowry, O. H., Rosenburg, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. J. Biol. Chem. 193, 265-275 (1951).
- Smith, P. K., Krohn, R. I., Hermanson, G. T., Mallia, A. K., Gartner, F. H., Provenzano, M. D., Fujimoto, E. K., Goeke, N. M., Olson, B. J., Klenk, D. C. Measurement of Protein Using Bicinchoninic Acid. Anal. Biochem. 150, 76-85 (1985).
- Norton, J. P., Clarkson, P. M., Graves, J. E., Litchfield, P. L., Kirwan, J. Serum creatine kinase activity and body composition in males and females. Hum. Biol. 57, 591-598 (1985).
- Amelink, G. J., Kamp, H. H., Bär, P. R. Creatine kinase isoenzyme profiles after exercise in the rat: sex-linked differences in leakage of CK-MM. Pflügers. Arch. 412, 417-421 (1988).
- Kendall, B., Eston, R. Exercise-induced muscle damage and the potential protective role of estrogen. Sports Med. 32 (2), 103-123 (2002).
- Tiidus, P. M. Can oestrogen influence skeletal muscle damage, inflammation, and repair?. Br. J. Sports Med. 39, 251-253 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon