Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'utilisation de l'infrarouge thermique imagerie pour la détection retardée Douleurs musculaires Apparition
Dans cet article
Résumé
Le but de cette enquête était d'évaluer si l'aide d'une caméra infra-rouge thermique est un outil valide pour la détection et la quantification des douleurs musculaires après l'exercice.
Résumé
Retard courbatures (DOMS), aussi connu comme les dommages musculaires induits par l'exercice (EIMD), est couramment rencontrés chez les individus qui ont été physiquement inactifs pendant des périodes prolongées de temps, et commencer par un match inattendu de l'exercice 1-4, mais peut aussi surviennent dans les athlètes qui s'entraînent au-delà de leurs limites normales de la formation 5. Les symptômes associés à ce douloureux phénomène peut varier de légère sensibilité musculaire, des douleurs invalidantes graves 1,3,5. L'intensité de ces symptômes et l'inconfort lié augmente dans les premières 24 heures suivant la fin de l'exercice, et des pics entre 24 à 72 heures après l'exercice de 1,3. Pour cette raison, Doms est l'une des formes les plus courantes de blessures récurrentes des sports qui peuvent affecter la performance d'un individu, et de devenir intimidant pour 1,4 nombreuses.
Pour les trois dernières décennies, le phénomène DOMS a acquis une quantité considérabled'intérêt parmi les chercheurs et les spécialistes en physiologie de l'exercice, le sport et la réhabilitation des champs 6. Il ya eu une série d'études publiées enquête sur cet événement douloureux en ce qui concerne ses mécanismes sous-jacents, les interventions de traitement, et les stratégies préventives 1-5,7-12. Cependant, il est évident d'après la littérature que les DOMS n'est pas facile de quantifier la pathologie, comme il ya une quantité étendue de la variabilité entre les outils de mesure et les méthodes utilisées pour quantifier cette condition 6. Il est évident qu'aucun accord n'a été faite sur une meilleure mesure de l'évaluation des courbatures, ce qui rend difficile de vérifier si une intervention spécifique est vraiment utile pour diminuer les symptômes associés à ce type de douleur ou non. Ainsi, les DOM peut être considéré comme quelque peu ambiguë, parce que de nombreuses études sur la mesure de la douleur dépend en utilisant une échelle visuelle analogique (EVA) 10,13-15, qui est un élément subjectif plutôt que d'une mesure objective. Même si l'aiguilleDes biopsies du muscle, et les taux sanguins de protéines myofibre pourrait être considéré comme un étalon-or à près de 6, de grandes variations dans certaines de ces protéines du sang ont été documentés 6,16, en plus des risques élevés, parfois associée à des techniques invasives.
Par conséquent, dans l'enquête actuelle, nous avons testé une infra-rouge thermique technique d'imagerie (IR) de la peau au-dessus des muscles exercés à détecter les douleurs musculaires associées. Thermographie infrarouge a été utilisée, et trouvé le succès dans la détection des différents types de maladies et d'infections depuis les années 1950 17. Mais, étonnamment, à proximité de rien n'a été fait sur les DOM et les changements de température de la peau. Le but principal de cette enquête était d'examiner les changements dans DOMS en utilisant cette technique sûre et non invasive.
Protocole
1. L'exercice
- Le muscle de l'intérêt pour cette expérience a été des fléchisseurs du coude (biceps brachial).
- La force musculaire était mesurée pour chaque participant d'être en mesure de donner à chacun une résistance suffisante. Cela a été déterminé en testant à chaque participant pour leur résistance maximale (RM).
- Pour tester la RM, nous avons utilisé un dispositif de jauge de contrainte interfacé avec un ordinateur via un BIOPAC (DA-100C) module amplificateur bioélectrique (BIOPAC Systems, Goleta, CA) pour mesurer la force musculaire. Le module a été connecté à un MP-100 à l'échantillonnage analogique convertisseur numérique à une fréquence de 1000 hertz par seconde, et à une résolution de 24 bits (fig. 10).
- Le dispositif de jauge de contrainte a été fixée à un banc à un angle de 45 °. Les sujets ont été invités à s'asseoir derrière l'appareil et de poser les coudes sur la zone matelassée, de sorte que la force de l'effort est à travers leurs poignets. Ce fut la meilleure façon d'assurer que le sujet ne serat de recruter n'importe quel autre muscle du biceps que (fig. 11).
- Force a été déterminé à 3 reprises à chaque contraction étant de 3 secondes dans la durée avec environ 45 secondes séparant les contractions. La moyenne des 3 mesures a été la RM.
- Après la détermination de la RM pour le muscle biceps de chaque participant, la séance d'exercice destiné a été réalisé avec 35% de leurs RM.
- Tous les sujets ont subi le même exercice en utilisant des haltères appropriée pondérée d'induire la douleur musculaire (DOMS). Ceci a été réalisé en faisant 4 séries de 25 répétitions de boucles de concentration du biceps, assis sur une chaise, et avec les coudes en charge sur leurs cuisses (fig. 12).
- Chaque sujet a reçu une deuxième période de repos 90 entre chaque série. Sujets soit fait le jeu complet de 25 répétitions, ou ont reçu l'ordre d'arrêter si elles n'ont pas cessé de contrôler le poids pendant l'exercice.
2. Infra-Red CaPréparation mera & Setup
- La salle où l'imagerie infra-rouge a lieu a été fixé à une température constante afin de minimiser tout biais externes à partir des différences de température ambiante, ce qui pourrait conduire à de fausses lectures thermique. Aux fins de cette expérience nous avions une chambre à température contrôlée qui a été maintenue à environ 23 ° C (+ / - 0,5 ° C).
- La caméra a été fixée à une distance de 1 mètre de distance, et à un angle perpendiculaire à la peau étant mesurée (Fig. 9a) *.
- Après la distance requise a été mis en place, les sujets ont été avisés de rester immobile jusqu'à ce que l'image a été prise. Cela ne devrait pas prendre plus de quelques secondes, mais il est très critique pour minimiser le mouvement pour assurer l'exactitude de l'image prise.
- Il est préférable que la chambre a peinture de couleur foncée, plutôt que des couleurs plus claires, afin de minimiser toute interférence infra-rouge.
- L'éclairage est également critique lorsqu'il s'agit d'images infra-rouge, BECAutiliser une source de lumière qui émettent des ondes infra-rouges, comme un éclairage fluorescent ou tungstène pourrait donner de fausses lectures élevé. La meilleure option serait d'éclairage d'une salle équipée d'uniformes feux à LED, lampes LED que difficilement produire aucune interférence infra-rouge (fig. 9b) *.
* Une série de tests ont été effectués dans nos laboratoires utilisant le FLIR Caméra IR 660 (fig. 8), où nous avons comparé les images de la peau à des angles différents (0 (perpendiculaire), 15, 30, 45 et 60 degrés), et à des distances différentes (1, 2 et 5 mètres) de la peau, pour détecter avec précision la température de la peau. Toutes les images ont été comparées à des thermocouples calibrés, et la meilleure corrélation entre les images et les lectures des thermocouples a été à un angle perpendiculaire et à une distance de 1 mètre de distance de la peau (r = 0,93). Les différents angles et les distances a causé une perte de pixélisation, et une diminution de la corrélation globale entre les images et les lectures des thermocouples.
3. Image Acquirement
- Aux fins de cette expérience, l'image du muscle exercé a été prise avant l'exercice, et à 24, et 48 heures après l'exercice.
- La chaleur du corps à partir de sources autres que la cible pourrait perturber l'image thermique et donner de fausses lectures. Pour cette raison, personne ne devrait être debout à côté ou derrière la cible.
- Dans cette enquête, des photos des deux bras exercés et non exercés ont été prises à des fins de comparaison. Nous avons exercé l'un des bras, comme cela a été mentionné précédemment, et l'autre bras a été utilisé comme contrôle (fig. 4 et 5).
- Nombre d'images de la caméra IR ont été enregistrés immédiatement sur une feuille séparée, car il pourrait être difficile d'identifier quelle image appartient à qui.
4. Image Processing & Analyses
- Les images acquises IR ont été traitées en utilisant le "ThermoVision ExaminIR" Version du logiciel: 1.10.2.
- Après avoir sélectionné l'image nécessaire pourr analyse, quatre régions d'intérêt ont été identifiés sur l'image acquise sur le bras en utilisant des boîtes statistiques sur l'interface du logiciel (Fig.6).
- Quand les régions nécessaires à travers le bras ont été localisés, le logiciel affiche les moyens et les écarts-types des températures pour chacune des régions sélectionnées. Nous pouvons alors comparer les deux croisées de chaque région individuelle ou d'obtenir une température moyenne de la totalité du bras (fig. 7).
5. Échelle visuelle analogique et d'analyse de sang
- Une échelle visuelle analogique (EVA) a été utilisé pour évaluer la douleur subjective du bras. L'échelle a eu un de 10 cm (100mm) longue ligne marquée «aucune douleur» à une extrémité, et «extrêmement douloureux» à l'extrémité opposée. Chaque participant a été réalisé pour faire une marque sur la ligne de 10 cm pour indiquer leur réponse à la douleur.
- Le SAV ont été administrés à des sujets avant l'exercice, 24 heures après l'exercice, et à 48 heures.
- Le sang périphérique a été colsélectionné des sujets pour mesurer les niveaux de concentration de myoglobine dans le sang.
- Le sang était prélevé dans la veine du coude sujets avant l'exercice, 30 minutes après l'exercice était terminé, et à 48 heures.
- Le sang a été centrifugé à 4000 rpm pendant 10 min pour séparer le sérum à partir des cellules. Les échantillons ont ensuite été stockés à -80 ° C jusqu'à ce que les analyses de la myoglobine a été fait.
- La myoglobine a été mesurée en utilisant un TOSOH «AIA-360" Analyseur automatisé dosage immuno-enzymatique (TOSOH Corp, Tokyo, Japon). Les trousses de dosage de myoglobine (Myo 025297, ST AIA-PACK myoglobine) ont été utilisés selon les instructions du fabricant.
6. Les résultats représentatifs
Les résultats des images thermiques prises IR au cours de cette enquête sont clairement représentés dans la figure 1. Images prises lors de la 3 périodes (pré-exercice, 24 heures post-exercice, et 48 heures post-exercice) pour les bras exercés sur les 41 sujets, a montréune augmentation notable de la température sur deux jours (24 heures post-exercice) par rapport aux températures pré-exercice, et les températures prises à 48 heures. Comme le montre la figure 1, la température moyenne de la peau était 32,80 + / - 1,03 ° C pour le jour 1 (pré-exercice), et 33,96 + / - 1,46 ° C pour le jour 2 (24 heures post-exercice), et 32,82 + / - 1,29 pour les trois jours (48 heures post-exercice). Cette différence de température de la peau du jour 1 au jour 2 a été significative (ANOVA p <0,01).
Toutefois, pour le bras non exercé, les changements parmi les trois périodes de temps ne sont pas évidentes. La figure 1 montre que la température moyenne de la peau était 33,08 + / - 0,83 ° C pour le jour 1 (pré-exercice), et 32,79 + / - 1,42 ° C pour le jour 2 (24 heures post-exercice), et 33,17 + / - 0,95 pour le jour 3 (48 heures post-exercice). Cette différence de température de la peau sur les 3 jours n'était pas significative (ANOVA p = 0,38).
Les résultats des relevés des douleurs de l'EVA sont présentés dans la figure 2. Comme vu dans la figureUre 2, la douleur avait rapporté une augmentation spectaculaire des jours 2 et 3. Les niveaux de douleur du muscle exercé augmenté, passant de 3,6 + / - 6,1 le jour 1, à 36,3 + / - 22,8 le jour 2, et de 37,5 + / - 25,3 le jour 3. Cette hausse du jour 1 a été significative (ANOVA p <0,01).
Les résultats des niveaux de concentration de myoglobine sont présentés dans la figure 3. Comme on le voit sur cette figure, il n'y avait pratiquement aucun changement entre les deux concentrations de myoglobine le jour 1 (pré, & 30 minutes après l'exercice). Mais le jour 3, l'augmentation de la myoglobine était très grande. Cette augmentation au jour 3 était d'environ 147 nanogrammes par millilitre (ng / ml) de sang par rapport aux 2 premières concentrations au jour 1. Les concentrations de myoglobine ont été 30,12 + / - 7,66 ng / mL au départ, 31,66 + / - 11,89 ng / ml 30 minutes après l'exercice, et 178,96 + / - 249,51 ng / ml au jour 3. Cette augmentation sur trois jours était hautement significative (ANOVA p <0,01).
Une analyse de corrélation a été faite entre la température de la peauobtenu à partir des images IR, et les niveaux de l'EVA douleur. On a constaté qu'il y avait une corrélation importante entre les lectures VAS le jour 2, et la mesure de la température de peau sur deux jours. Cette corrélation était significative (r = 0,312, p <0,05). Cependant, il n'y avait pas de corrélation évidente entre les lectures VAS et les températures de peau le jour 3. Cette corrélation a été négligeable (r = 0,047, p = 0,77).
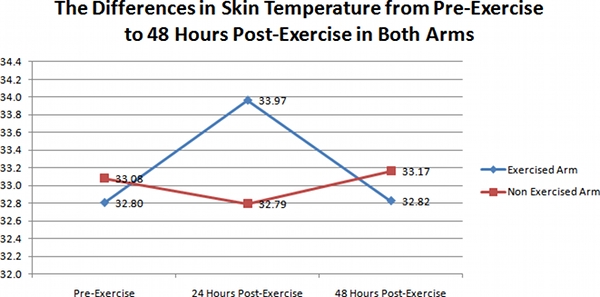
Figure 1. Un graphique représentant les différences de température de la peau dans les bras exercées (diamants), et non exercés bras (carrés) des 41 sujets au cours de la période de 3 jours.
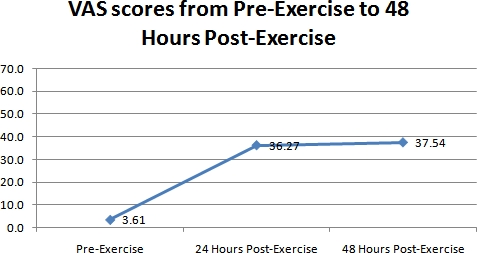
Figure 2. Un graphique représentant les différences dans la douleur musculaire perçue mesurée à l'EVA au cours de la période 3 jours pour tous les 41 sujets.
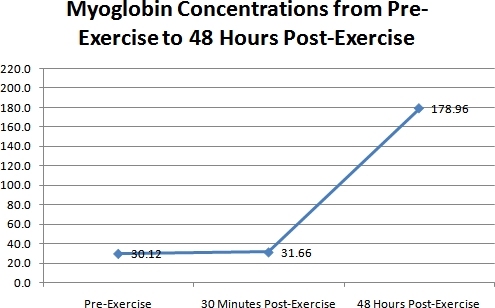
Figure 3. Un graphique représentant les différences dans les concentrations de myoglobine pour tous les 41 sujets au cours des 3 périodes de temps.
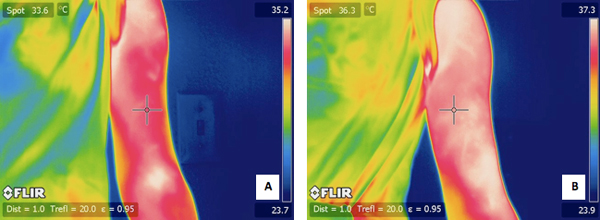
Figure 4. A) une image typique IR du bras exercé un sujet avant l'exercice. B) une image infrarouge de la même bras sujets 24 heures après l'exercice.
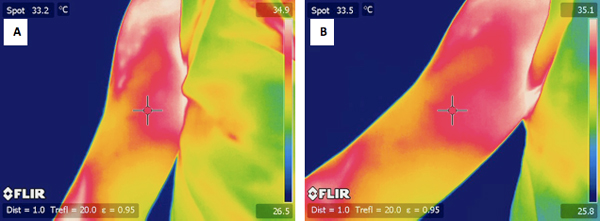
Figure 5. A) une image typique de l'ONU-IR a exercé un sujet bras avant l'exercice. B) une image infrarouge de la même bras sujets 24 heures après l'exercice.
Figure 6. Une illustration des 4 régions d'intérêt pour l'analyse des therml'image du bras al.
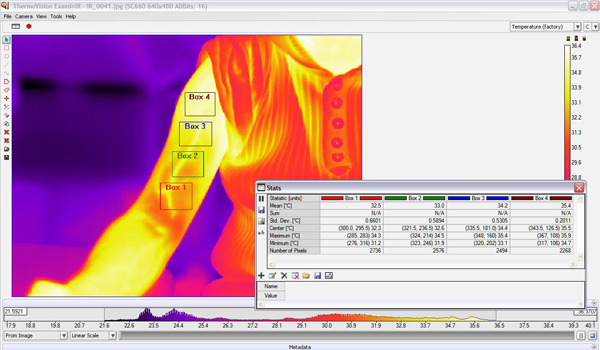
Figure 7. Interface logicielle pour la "ExaminIR ThermoVision" montrant les quatre boîtes d'intérêt sur une image infrarouge d'un bras exercés. On trouvera également les interprétations statistiques pour chaque boîte.

Figure 8. La caméra infrarouge thermique utilisé pour cette enquête (FLIR 660).

Figure 9. A) La configuration de la caméra IR à 1 mètre du bras sujets. B) Les lumières DEL utilisés dans le laboratoire où les images ont été prises.

Figure 10. A) Les modules BIOPAC utilisé pour mesurer la force musculaire. B) Le dispositif de jauge de contrainte fixée à un 45 ° banc d'angle et accroché au système BIOPAC.
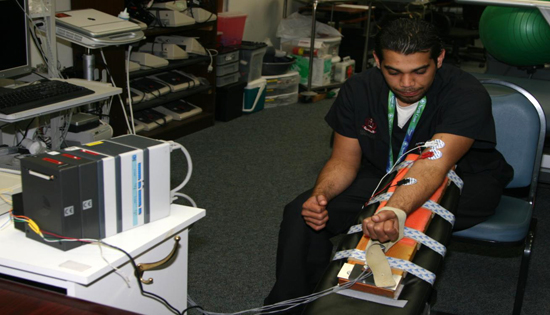
Figure 11. Un sujet typique exerçant une force sur le dispositif de jauge de contrainte.
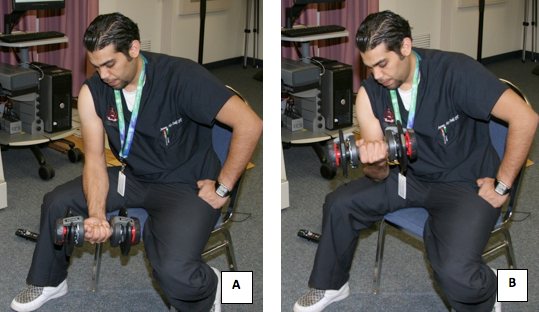
Figure 12. Un sujet subissant le protocole d'exercice pour induire la douleur musculaire.
Discussion
L'objectif principal de cette enquête était d'évaluer l'utilité de l'imagerie infrarouge thermique pour détecter et mesurer les douleurs musculaires après un exercice intense, et nos résultats suggèrent que l'imagerie infrarouge pourrait être une technique valable pour DOMS détecter, surtout dans les premières 24 heures de l'exercice. Cela n'est pas surprenant, comme Pennes 18 a fourni un modèle très détaillé du flux de chaleur à partir de muscle à la peau dans les...
Déclarations de divulgation
Pas de conflits d'intérêts déclarés.
Remerciements
Nous tenons à reconnaître un contrat (WS1763368) de Pfizer Pharmaceuticals pour le soutenir dans ce travail. Nous tenons également à remercier les Ministère saoudien de l'Enseignement Supérieur (MOHE) pour leur soutien.
matériels
| Name | Company | Catalog Number | Comments |
| Nom de l'appareil | Société | Numéro de catalogue | Commentaires |
| Caméra infra-rouge thermique | FLIR | FLIR SC660 | |
| Logiciel d'analyse thermique infra-rouge | ThermoVision ExaminIR | Software Version 1.10.2 | |
| Module amplificateur Bioelectric | BIOPAC | DA100C | Le DA100C fournit les réglages de gain variable, et des références de tension réglable. |
| Convertisseur Analogique Numérique Module | BIOPAC | MP100 | |
| Analyseur automatisé dosage immuno-enzymatique | TOSOH | AIA -360 | Ce dispositif a été utilisé pour analyser les échantillons de sang, et d'obtenir les lectures myoglobine. |
Références
- Cheung, K., Hume, P. A., Maxwell, L. Delayed Onset Muscle Soreness: Treatment strategies and Performance Factors. Sports. Med. 33, 145-164 (2003).
- MacIntyre, D. L., Reid, W. D., McKenzie, D. C. Delayed Muscle Soreness: The Inflammatory Response to Muscle Injury and its Clinical Implications. Sports. Med. 20, 24-40 (1995).
- Armstrong, R. B. Mechanisms of exercise-induced delayed onset muscular soreness: a brief review. Medicine and Science in Sports and Exercise. 16, 529-538 (1984).
- Howatson, G., Someren, K. A. V. The Prevention and Treatment of Exercise-Induced Muscle Damage. Sports. Med. 38, 483-503 (2008).
- Petrofsky, J. Comparison of Different Heat Modalities for Treating Delayed-Onset Muscle Soreness in People with Diabetes. Diabetes Technology & Therapeutics. 13, 645-655 (2011).
- Warren, G. L., Lowe, D. A., Armstrong, R. B. Measurement Tools Used in the Study of Eccentric Contraction-Induced Injury. Sports. Med. 27, 43-59 (1999).
- Hilbert, J. E., Sforzo, G. A., Swensen, T. The Effects of Massage on Delayed Onset Muscle Soreness. Br. J. Sports. Med. 37, 72-75 (2003).
- Symons, T. B., Clasey, J. L., Gater, D. R., Yates, J. W. Effects of Deap Heat as a Preventative Mechanism on Delayed Onset Muscle Soreness. Journal of Strength and Conditioning Research. 18, 155-161 (2004).
- Vaile, J. M., Gill, N. D., Blazevich, A. J. The Effect of Contrast Water Therapy on Symptoms of Delayed Onset Muscle Soreness. Journal of Strength and Conditioning Research. 21, 697-702 (2007).
- Stone, M. B., Merrick, M. A., Ingersoll, C. D., Edwards, J. E. Preliminary Comparison of Bromelain and Ibuprofen for Delayed Onset Muscle Soreness Management. Clinical Journal of Sports Medicine. 12, 373-378 (2002).
- Barlas, P. Managing Delayed-Onset Muscle Soreness: Lack of Effect of Selected Oral Systemic Analgesics. Arch. Phys. Med. Rehabil. 81, 966-972 (2000).
- Jackman, S. R., Witard, O. C., Jeukendrup, A. E., Tipton, K. D. Branched-Chain Amino Acid Ingestion Can Ameliorate Soreness from Eccentric Exercise. Medicine & Science in Sports & Exercise. 42, 962-970 (2010).
- Law, F. r. e. y., A, L. Massage Reduces Pain Perception and Hyperalgesia in Experimental Muscle Pain: A Randomized, Controlled Trial. The Journal of Pain. 9, 714-721 (2008).
- Vaile, J., Halson, S., Gill, N., Dawson, B. Effect of hydrotherapy on the signs and symptoms of delayed onset muscle soreness. European Journal of Applied Physiology. 102, 447-455 (2007).
- Vinck, E., Cagnie, B., Coorevits, P., Vanderstraeten, G., Cambier, D. Pain reduction by infrared light-emitting diode irradiation: a pilot study on experimentally induced delayed-onset muscle soreness in humans. Lasers in Medical Science. 21, 11-18 (2006).
- Clarkson, P. M., Ebbeling, C. Investigation of Serum Creatine Kinase Variability after Muscle-Damaging Exercise. Clin. Sci. 75, 257-261 (1988).
- Jiang, L. J. A perspective on medical infrared imaging. Journal of Medical Engineering & Technology. 29, 257-267 (2005).
- Pennes, H. H. Analysis of Tissue and Arterial Blood Temperatures in the Resting Human Forearm. J. Appl. Physiol. 1, 93-122 (1948).
- Ivanitsky, G. R., Khizhnyak, E. P., Deev, A. A., Khizhnyak, L. N. Thermal imaging in medicine: A comparative study of infrared systems operating in wavelength ranges of 3–5 and 8-12 μm as applied to diagnosis. Doklady Biochemistry and Biophysics. 407, 59-63 (2006).
- Herman, C., Cetingul, M. P. Quantitative Visualization and Detection of Skin Cancer Using Dynamic Thermal Imaging. J. Vis. Exp. (51), e2679-e2679 (2011).
- Wang, J. Evaluation of the diagnostic performance of infrared imaging of the breast: a preliminary study. BioMedical Engineering OnLine. 9, 3-3 (2010).
- Murray, A. K. Noninvasive imaging techniques in the assessment of scleroderma spectrum disorders. Arthritis & Rheumatism. 61, 1103-1111 (2009).
- Zaproudina, N., Ming, Z., Hanninen, O. O. P. Plantar Infrared Thermography Measurements and Low Back Pain Intensity. Journal of Manipulative and Physiological Therapeutics. 29, 219-223 (2006).
- Kim, Y. -. C., Bahk, J. -. H., Lee, S. -. C., Lee, Y. -. W. Infrared Thermographic Imaging in the Assessment of Successful Block on Lumbar Sympathetic Ganglion. Yonsei Medical Journal. 44, 119-124 (2003).
- Brancaccio, P., Lippi, G., Maffulli, N. Biochemical markers of muscular damage. Clinical Chemistry and Laboratory Medicine. 48, 757-767 (2010).
- Neubauer, O., König, D., Wagner, K. -. H. Recovery after an Ironman triathlon: sustained inflammatory responses and muscular stress. European Journal of Applied Physiology. 104, 417-426 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon