Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
D'enregistrement optique de l'activité neuronale supraliminaire avec une résolution à cellule unique et un seul pic
Dans cet article
Résumé
Comprendre le fonctionnement du système nerveux des vertébrés centrale nécessite des enregistrements de neurones de nombreuses fonctions corticales se pose parce que le niveau des populations de neurones. Nous décrivons ici une méthode optique pour enregistrer l'activité neuronale supraliminaire avec une résolution à cellule unique et une seule pointe, tergiversé au hasard analyse à l'accès. Cette méthode enregistre les signaux somatiques calcium de fluorescence jusqu'à 100 neurones avec une haute résolution temporelle. Un algorithme du maximum de vraisemblance deconvolves l'activité neurale sous-jacente supraliminaire de signaux somatiques les calcium par fluorescence. Cette méthode permet de détecter de manière fiable les pointes avec une efficacité de détection élevé et un faible taux de faux positifs et peut être utilisé pour étudier les populations de neurones In vitro Et In vivo.
Résumé
Signalisation de l'information dans le système nerveux central des vertébrés est souvent effectué par des populations de neurones plutôt que des neurones individuels. La propagation de l'activité de dopage supraliminaire implique populations de neurones. Les études empiriques portant sur la fonction corticale directement nécessitent donc des enregistrements de populations de neurones avec une résolution élevée. Nous décrivons ici une méthode optique et un algorithme de déconvolution pour enregistrer l'activité neuronale à partir de 100 neurones avec une résolution à cellule unique et un seul pic. Cette méthode repose sur la détection des élévations transitoires de la concentration intracellulaire de calcium somatique associée avec des pointes supraliminaire électriques (potentiels d'action) dans les neurones corticaux. Haute résolution temporelle des enregistrements optiques est obtenue par une technique de balayage à accès aléatoire rapide à l'aide de déflecteurs acousto-optiques (OD) 1. Excitation à deux photons des résultats de calcium colorant sensible à haute résolution spatiale en tis cerveau opaquespoursuivre 2. Reconstruction des pics de fluorescence des enregistrements de calcium est obtenu par un procédé du maximum de vraisemblance. Simultanée des enregistrements électrophysiologiques et optiques montrent que notre méthode permet de détecter de manière fiable les pointes (> 97% d'efficacité de détection de crête), a un faible taux de faux pic de détection positive (<0,003 pointes / s), et une grande précision temporelle (environ 3 ms) 3. Cette méthode optique de détection de crête peut être utilisé pour enregistrer l'activité neuronale in vitro et chez les animaux anesthésiés in vivo 3,4.
Protocole
1. Montage optique (Figure 1)
- Pour excitation à deux photons d'un système laser infrarouge pulsé avec des impulsions femtosecondes est utilisé. Un laser haute puissance de sortie (dans certains cas> 2W à 890 nm de longueur d'onde) est nécessaire pour compenser les pertes importantes introduites par les composants optiques du système.
- Un système prechirper constitué de deux prismes confère une dispersion négative de vitesse de groupe (GVD) sur les impulsions laser avant les déflecteurs acousto-optiques (OD) pour compenser la dispersion temporelle introduite par le OD 1.
- OD avec deux grands orifices (10 mm pour un objectif à immersion d'eau avec 40x NA 0,8) dévier le faisceau laser en deux dimensions.
- Un réseau de diffraction réfléchissant avec 100 bois / mm est placée 13 cm derrière les OD pour compenser la dispersion spatiale introduite par OD en utilisant des impulsions laser courtes.
- Le faisceau laser est dirigé par deux télescopes de relais dans le port de l'appareil d'un montant microscope.
- Iris sont placés à intervalles réguliers pour l'alignement des composants optiques.
- Un séparateur de faisceau dichroïque à l'avant de l'objectif transmet la lumière d'excitation infrarouge et de l'échantillon reflète la lumière de fluorescence de l'échantillon vers un détecteur.
- Détecteurs Epi-et transfluorescence (photomultiplicateurs, PMT) recueillir signal de fluorescence à travers l'objectif et - le cas échéant - à travers le condenseur.
- Filtres en verre de couleur (BG-39, 3-5 mm) sont placés en face des détecteurs pour empêcher la lumière d'excitation d'atteindre les détecteurs.
- Les angles de déviation AOD sont commandés par un ordinateur équipé d'une carte numérique-analogique du convertisseur (156,25 fréquence d'horloge kHz), ce qui entraîne à son tour oscillateurs commandés en tension.
- Le signal des photomultiplicateurs est transmis à travers un filtre passe-bas Butterworth (fréquence de coupure de 100 kHz) et numérisé par un convertisseur analogique-numérique (156,25 kHz fréquence d'horloge) avant d'être stockés dansun ordinateur pour analyse.
- L'alignement et le bruit électrique sont testés par l'enregistrement de la répartition des signaux de fluorescence avec et sans lumière laser, à haute et à faible gain des photomultiplicateurs, ainsi qu'avec et sans indicateur. Le scanner est correctement configuré et protégé lorsque la largeur de la distribution des signaux de fluorescence à gain élevé et avec l'indicateur est beaucoup plus grande que les largeurs des autres distributions de signaux de fluorescence (Fig. 2).
2. Les procédures expérimentales
- Dithered aléatoire analyse à l'accès repose sur la détection de l'augmentation de calcium intracellulaire dans. Un grand nombre de neurones peuvent être colorées par injection d'un bolus de la forme ester d'un indicateur de calcium (par exemple l'Oregon Green 488 BAPTA-1 AM) dans le tissu neural 5.
- Plusieurs emplacements de chaque neurone soma sont enregistrés, chacun pour un court laps de temps ("dithering", de 4 emplacements, 6,4 microsecondes pour chaque emplacement temps d'enregistrement = 25,6 ms pour le courrierhaque neurone dans chaque cycle, Fig. 3C). Pour sélectionner les neurones d'intérêt d'une image complète constituée de 256x256 pixels est acquis (Fig. 3A). Le centre de chaque neurone soma à enregistrer est sélectionné manuellement à l'intérieur de cette image. Le logiciel de contrôle ajoute automatiquement trois points à une distance de 2 um autour de ce centre.
- Dans chaque cycle, le signal de fluorescence est enregistrée à partir de chacune des 40 neurones (Fig. 3B). Ce processus est répété pendant toute la durée d'un enregistrement (5 enregistrement seconde = 3255 cycles, 1 cycle = 1,536 ms).
3. Outils logiciels en ligne pour maximiser l'efficacité de détection de crête
- Spike de détection de signaux de fluorescence calcium somatiques s'appuie sur un rapport signal-sur-bruit (S / B) des signaux de fluorescence calcium somatiques les. Un haut S / N peut être obtenue en augmentant l'intensité d'excitation. Intensité d'excitation, cependant, ne peut être augmentée jusqu'à une certaine limite en raison de photovieillissement. Détection de pic est élevé dans un très petit window des intensités d'excitation que lorsque les signaux de fluorescence ont une grande S / N, mais seulement photovieillissement on observe très peu 3. Afin d'assurer que les signaux enregistrés sont dans la fenêtre du pic de détection élevé pendant les enregistrements, nous surveillons le taux de photons (voir l'équation 3.2) et le déclin de fluorescence de base en utilisant l'analyse en ligne.
- Taux approximatif de photons par neurone est calculée à partir d'une fenêtre de temps (100-200 ms) du bruit de fond. Taux nombre de photons (λ N) et de photons (λ = λ N / At) est calculée à partir des valeurs de fluorescence en ajustant la distribution (σ) de la fluorescence change par rapport à l'équation suivante:
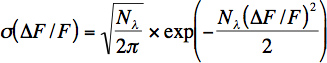
L'équation représente la distribution de Poisson pour le bruit de grenaille de photons avec un changement de variable de changement de fluorescence relative: AF / F = (G * N λ (t)-N-G * lambda;, 0) / G * N λ, 0 où G représente le gain cumulé de photomultiplicateur et tous les autres composants électroniques. Notez que cette équation ne détermine pas correctement le nombre de photons détectés pour enregistrements in vivo, car il ya d'autres sources de bruit (artéfacts de mouvement), en plus de bruit de grenaille photonique. Néanmoins, cette équation est utile pour les enregistrements in vivo pour estimer le bruit.
- De fluorescence de base est calculée à partir de la même fenêtre temporelle et tracée en fonction du temps ou des essais. La baisse moyenne du niveau de référence est maintenue en dessous de 0,0002 / s en ajustant la puissance laser en raison de détection de crête diminue rapidement en cas de dépassement de cette limite.
- Toutes les 10-20 minutes les positions Somata neurones sont encore vérifiées par l'acquisition d'une image complète. Si nécessaire, les emplacements d'enregistrement sont réglés. Les emplacements peuvent être ajustés pour tous les neurones à la fois, ou pour les neurones individuels.
4. La reconstrucn des cadencements de pointe des signaux de fluorescence (déconvolution)
- Les signaux de fluorescence résultant de l'activité neuronale souvent Additionnez dans le temps, car le déclin des transitoires calciques est longue (plusieurs centaines de millisecondes). Une méthode de déconvolution reconstruit horaires crampons et pointes de signaux de fluorescence.
- Pour déterminer le train le plus probable pic de la base du signal de fluorescence enregistrée, comparer les différents modèles. Ici, nous avons utilisé un algorithme génétique pour déterminer le modèle - et donc le train et les horaires pic pointe - avec le maximum de vraisemblance.
- Dans les populations non homogènes de neurones, le pic-évoqué signal calcique peut varier entre les neurones. Pour une analyse non supervisée des ensembles de données, nous avons conçu un algorithme qui prend en compte la variation du signal calcique transitoire évoquée par de neurone en neurone.
- Afin d'éviter un grand nombre de faux positifs, il est utile de se contracter l'amplitude autorisée et temps de déclin constant de la modèle du signal calcique pic-évoquée. La distribution conjointe de l'amplitude et le temps de déclin constant de la seule pointe transitoires calciques évoqués sont enregistrés dans une série distincte d'expériences du même type de neurones dans les mêmes conditions expérimentales utilisant simultanément des enregistrements électrophysiologiques et optiques.
- Pour tenir compte des changements de base lents et de réduire les coûts de calcul de déconvolution, des enregistrements plus longs sont divisés en plusieurs traces plus courtes de 1-5 secondes.
- Pour chaque neurone et chaque enregistrement, l'algorithme de déconvolution peut tester un grand nombre de modèles (jusqu'à un million de modèles différents ou plus). Pour accélérer déconvolution, une expérience est une déconvolution sur un maximum de 10 ordinateurs différents en parallèle.
- Après déconvolution, les données pic est analysé et contrôlé. Un histogramme en temps péri-stimulus, probabilité pointe, et cadence de tir (moyenne pic par les neurones) sont calculés de manière automatisée.
5.Les résultats représentatifs
Succès dépend de détection de crête sur un rapport signal sur bruit des signaux de fluorescence enregistrées calcium somatiques. Tout simplement en utilisant les taux d'excitation élevées (laser haute puissance) peut se traduire par un impact négatif de photoeffects sur du matériel biologique (photovieillissement). Dans le photovieillissement balayage tramé à accès aléatoire se manifeste par une diminution de la fluorescence de base et diminue des signaux calciques évoquées pic-fluorescence. La diminution du signal de pic-évoqués peuvent rapidement entraîner une défaillance de détecter des pics. Il ya seulement une très petite fenêtre de l'intensité d'excitation où la détection de signaux de fluorescence pic est élevé. Sur l'extrémité supérieure de cette fenêtre est limitée par le photovieillissement, à l'extrémité inférieure des signaux de fluorescence ont un faible rapport signal-sur-bruit. Pour les neurones corticaux en tranches aiguës, nous utilisons la puissance du laser qui entraîne des taux de photons d'environ 400,000-1,500,000 photons / s lors de l'enregistrement à environ 100 um sous la surface de la tranche. Lorsque vous utilisez une grandeAffinité indicateur - ici Oregon Green 488 BAPTA - 1 - ce signal est suffisante pour détecter des pics individuels. Fig. 3E montre un exemple d'un signal de fluorescence enregistrées à une cadence d'excitation très faible, un exemple d'un enregistrement dans la fenêtre de détection, et l'autre à taux d'excitation très élevée.
Par rapport à d'autres techniques pour enregistrer l'activité neuronale avec une résolution à cellule unique et une seule pointe, tergiversé au hasard analyse à l'accès est possible d'enregistrer à partir d'un plus grand nombre de neurones de la même population locale, et est moins invasive, par exemple par rapport à tétrode / multiélectrodes enregistrements . Ainsi tramage aléatoire analyse à l'accès peut être utilisé pour enregistrer l'activité neuronale de nombreux neurones pour mesurer l'information mutuelle signalée par l'activité supraliminaire 6 (figure 4A), les modifications de l'activité neuronale dans une population de neurones (plasticité corticale), et la propagation de l'activité supraliminaire dans les populations de neurones 14 (figure 4B)
alt = "Figure 1" src = "/ files/ftp_upload/4052/4052fig1.jpg" />
Figure 1. Conception optique de la configuration tramée-analyse à l'accès aléatoire.
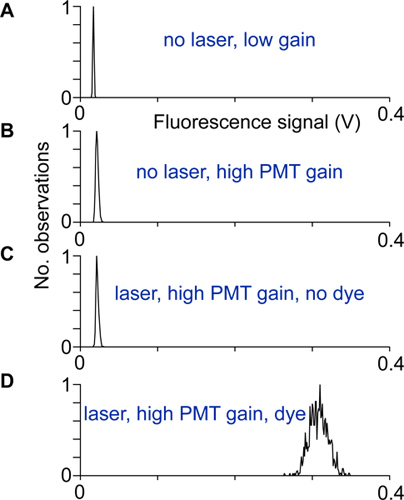
Figure 2 Alignement et des essais:. Distributions de signaux de fluorescence enregistrés dans des conditions différentes. A) de lumière laser et le gain de photomultiplicateur n bas, B) avec un gain plus élevé PMT, mais pas de lumière laser, la répartition est plus large à cause du courant photomultiplicateur sombre. C) Avec le laser et enregistré au gain du PMT élevé. Une différence entre les distributions indiquées dans B et cette distribution semble indiquer que la lumière d'excitation atteint les détecteurs PMT. D) La distribution des signaux de fluorescence enregistrés à gain élevé de neurone soma. Si aucune autre source de bruit contribue, cette répartition découle de photons coup-que du bruit.
. Jpg "/>
Figure 3 Une image) d'image maximale de fluorescence pour détecter et sélectionner des positions Somata neurones, B) de balayage vers l'un des cycles, C) Illustration du principe de tramage;. Dans chaque Soma (cercle) sont enregistrées plusieurs endroits avant de déplacer le faisceau à l'autre soma, D) Illustration de la sortie de la D deux / A canaux. Pour chaque neurone soma, signal de fluorescence est enregistrée à partir de 4 points différents dans chaque soma (S1-S4). L'emplacement de chaque point est donnée par sa position x et y. La positions x et y pour tous les spots et tous les neurones sont envoyées au convertisseur numérique-analogique d'une manière séquentielle. Alors que le faisceau est déplacé entre deux corps cellulaires des neurones, aucun signal n'est acquis (blanc). E) Exemples de signaux de fluorescence. Noter que chaque exemple montre la réponse à une pointe (telle que mesurée avec électrophysiologique cellule attenante enregistrement).
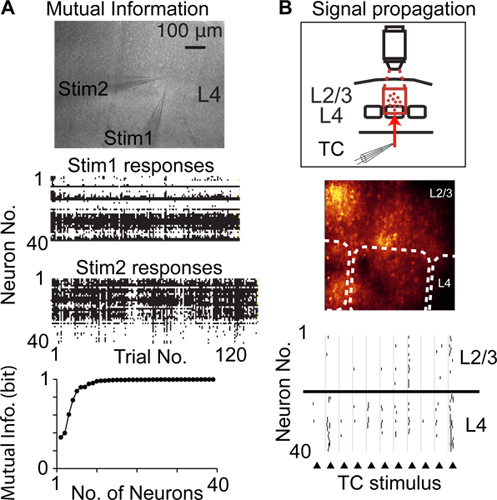
Figure 4. Etudier cortical en utilisant la fonction de tramage aléatoire analyse à l'accès. A) Mesure de l'information mutuelle signalée par des populations de neurones. L'image du haut montre microphotographie d'une coupe de cerveau aiguë et deux pipettes de stimulation placés dans la même colonne corticale dans la couche 4 (L4). Centre de graphiques montrent des réponses de neurones pour chaque répétition d'un stimulus. Graphique du bas montre l'information mutuelle de Shannon signalée par la population enregistrée de neurones. Propagation de mesure B) de l'activité supraliminaire enrichissement (de propagation du signal) entre les populations de neurones corticaux. Graphique ci-dessus illustre la conception expérimentale, l'image du centre montre l'image de fluorescence, lignes pointillées indiquent les limites baril, graphique inférieur montre des pics détectés en réponse à une stimulation électrique des fibres thalamo-corticales (triangles).
Discussion
Dithered à accès aléatoire balayage détecte indirectement l'activité supraliminaire dopage de l'augmentation de calcium intracellulaire somatique associée à chaque pic dans un corps cellulaires des neurones. Les augmentations du calcium intracellulaire sont détectés par des colorants fluorescents de calcium. Les limites de tramage aléatoire analyse à l'accès proviennent en grande partie de la limité de signal sur bruit des signaux de fluorescence de calcium. Le rapport signal-à-bruit est limit?...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous remercions le Dr Randy Chitwood pour la lecture critique du manuscrit. Ce travail a été soutenu par la Fondation Whitehall et la Alfred P. Sloan Foundation accorde à HJK.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires (optionnel) |
| Les composants optiques sont répertoriés dans l'ordre, en commençant par le laser | |||
| Titan: Saphir Laser | Coherent Inc | Chameleon Ultra 2 | Haute puissance de sortie recommandée (> 2 W à 900 nm) |
| Lentille achromatique f = 30 mm | Laboratoires Thor | AC254-030-B | Anti-reflet (AR) 650-1050 nm revêtement pour |
| Lentille achromatique f = 100 mm | Laboratoires Thor | AC254-100-B | AR 650-1050 nm |
| Objectif f = 75 mm | Laboratoires Thor | LA1608-B | AR 650-1050 nm |
| Objectif f = 175 mm | Laboratoires Thor | LA1229-B | AR 650-1050 nm |
| Lentille achromatique f = 300 mm | Laboratoires Thor | AC254-300-B | AR 650-1050 nm |
| Lentille achromatique f = 100 mm | Laboratoires Thor | AC254-100-B | AR 650-1050 nm |
| Lentille achromatique f = 100 mm | Laboratoires Thor | AC254-100-B | AR 650-1050 nm |
| Déflecteurs acousto-optiques | Intraaction Corp | ATD 6510CD2 | |
| Réseau de diffraction réfléchissant | Newport | 53-011R | 100 traits / mm pour OD avec 65 MHz de bande passante et de l'angle de balayage de 45 mrad |
| 21,6 mm Brewster prismes | Lambda Optics Research Inc | IBP21.6SF10 | |
| Verre coloré | Schott | BG-39 | |
| Miroir dichroïque | Chroma Technology Corp | Z532RDC | |
| Modules photomultiplicateurs | Hamamatsu | H9305-03 | |
| DAC-ADC conseil d'administration | National Instruments | PCI-6115 | |
| Oregon Green 488 BAPTA-une heures | Invitrogen | O-6807 |
Références
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon