É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A gravação ótica da atividade neural supraliminares com resolução de uma única célula e um único pico
Neste Artigo
Resumo
A compreensão da função do sistema nervoso central, dos vertebrados requer gravações de muitos neurónios porque a função cortical surge no nível de populações de neurónios. Aqui nós descrevemos um método óptico para registrar a atividade neural supraliminares com resolução de uma única célula e um único ponto, pontilhado de acesso aleatório de digitalização. Este método registra somáticas fluorescência sinais de cálcio de até 100 neurônios com alta resolução temporal. Um algoritmo de máxima verosimilhança deconvolves a actividade neural subjacente supraliminares a partir dos sinais de cálcio somáticas de fluorescência. Este método fiável detecta picos com elevada eficiência de detecção e uma baixa taxa de falsos positivos e pode ser usado para estudar as populações neuronais In vitro E In vivo.
Resumo
Sinalização de informação no sistema central nervoso dos vertebrados é frequentemente realizado por populações de neurónios, em vez de neurónios individuais. Também propagação da atividade spiking supraliminares envolve populações de neurônios. Estudos empíricos que abordam função cortical diretamente, portanto, exigem gravações de populações de neurônios com alta resolução. Aqui nós descrevemos um método óptico e um algoritmo de deconvolução para gravar a atividade neural de até 100 neurônios com resolução de uma única célula e um único ponto. Este método baseia-se na detecção de aumentos transientes na concentração de cálcio intracelular associada com picos somática supraliminares eléctricos (potenciais de acção) em neurónios corticais. Alta resolução temporal das gravações ópticas é conseguido através de um método rápido de acesso aleatório utilizando acústico-ópticos deflectores (EOA) 1. Dois fotões de excitação dos resultados de cálcio sensíveis corante em alta resolução espacial em tis cerebrais opacosprocessar 2. Reconstrução de picos de fluorescência das gravações de cálcio é conseguida por um método de máxima verosimilhança. Simultâneas gravações electrofisiológicos e óptica indicam que o nosso método fiável detecta pontos (> 97% de eficiência de detecção de pico), tem uma baixa taxa de falso positivo de detecção de pico (<0,003 espigas / s), e um de alta precisão temporal (cerca de 3 ms) 3. Este método de detecção óptica pico pode ser utilizado para registar a actividade neural in vitro e em animais anestesiados in vivo 3,4.
Protocolo
1. Configuração óptica (Figura 1)
- Por dois fótons de excitação de um sistema de laser infravermelho pulsado com pulsos de femtossegundos é usado. Um laser de alta potência de saída (em alguns casos> 2W em 890 nm de comprimento de onda) é necessária para compensar as perdas de grandes introduzidos pelos componentes ópticos do sistema.
- Um sistema prechirper consistindo de dois prismas transmite uma dispersão da velocidade de grupo negativo (GVD) sobre os pulsos de laser antes de os deflectores acústico-ópticos (EOA), para compensar a dispersão temporal introduzido pelo EOA 1.
- Dois EOA com aberturas grandes (de 10 mm para um objectivo de 40x de imersão em água com NA 0,8) desviar o feixe de laser em duas dimensões.
- A grade de difração reflexivo com 100 bosques / mm é colocado 13 centímetros atrás dos EOA para compensar a dispersão espacial introduzida pela EOA ao usar pulsos de laser.
- O feixe de laser é dirigido com dois telescópios de retransmissão para a porta da câmara de uma posição vertical microscopiape.
- Íris são colocadas a intervalos regulares, para o alinhamento dos componentes ópticos.
- Um divisor de feixe dicróico em frente da objectiva transmite a luz de excitação para a amostra de infravermelhos e reflecte a luz de fluorescência da amostra a um detector.
- Detectores de Epi e transfluorescence (fotomultiplicadores, PMT) coletar sinal de fluorescência através da objetiva e - se for o caso - através do condensador.
- Filtros de vidro de cor (BG-39, 3-5 mm) são colocados em frente dos detectores para evitar que a luz de excitação atingir os detectores.
- Os ângulos de deflexão AOD são controlados por um computador equipado com uma placa de digital-analógico conversor (156,25 kHz taxa de relógio), o qual por sua vez conduz a tensão osciladores controlados.
- O sinal dos fotomultiplicadores é retransmitido através de um filtro passa-Butterworth filtro (frequência de corte de 100 kHz) e digitalizado por um conversor analógico-digital do conversor (156,25 clock kHz), antes de ser armazenado emum computador para análise.
- Alinhamento e ruído eléctrico são testadas através da gravação da distribuição de sinais de fluorescência com, e sem luz laser, com um ganho baixo e elevado dos fotomultiplicadores, bem como com e sem indicador. O scanner está correctamente configurar e blindado quando a largura da distribuição dos sinais de fluorescência de alto ganho e de indicador é muito maior do que as larguras das outras distribuições de sinais de fluorescência (Fig. 2).
2. Procedimentos experimentais
- Digitalização de acesso aleatório Rasterizado depende de detecção de aumentos intracelulares em cálcio. Um grande número de neurónios podem ser coradas utilizando injecção de bolus de éster sob a forma de um indicador de cálcio (por exemplo, verde Oregon 488 BAPTA-1 AM) no tecido neural 5.
- Vários locais de cada neurônio soma são registrados, cada um para um curto período de tempo ("dithering", 4 locais, 6,4 mS para cada local = 25,6 mS de tempo de gravação para each neurónios em cada ciclo, Fig. 3C). Para seleccionar os neurónios de interesse de um quadro completo que consiste em 256x256 pixels é adquirida (Fig. 3A). O centro de cada neurónio soma a ser gravada é seleccionada manualmente dentro desta imagem. O software de controle adiciona automaticamente três pontos em 2 mM distância em torno deste centro.
- Em cada ciclo, o sinal de fluorescência é registada a partir de cada um dos 40 neurónios (Fig. 3B). Este processo é repetido durante todo o período de uma gravação (5 de gravação segundo = 3255 ciclos, 1 ciclo = 1,536 ms).
3. On-line ferramentas de software para maximizar a eficiência de detecção pico
- Detecção de pico de sinais de fluorescência de cálcio somáticas depende de uma alta relação sinal-ruído (S / N) do sinal de fluorescência do cálcio somáticas. Um elevado S / N pode ser conseguido através do aumento da intensidade de excitação. Intensidade de excitação, no entanto, só pode ser aumentada até um certo limite, por causa de fotodanos. Detecção espiga é elevada dentro de uma muito pequena window de intensidades de excitação único, onde os sinais de fluorescência têm uma elevada S / N, mas apenas muito pouco fotodano é observado 3. A fim de assegurar que os sinais são gravados dentro da janela de detecção pico elevado durante gravações monitoramos taxa de fotões (ver equação 3.2) e declínio da linha de base de fluorescência utilizando a análise em linha.
- Taxa de fótons aproximado por neurônio é calculado a partir de uma janela de tempo curto (100-200 ms) de ruído de linha de base. Número de fótons (N λ) e taxa de fotões (λ λ = N / At) é calculado a partir dos valores de fluorescência através do ajuste da distribuição (σ) de alterações de fluorescência em relação com a seguinte equação:
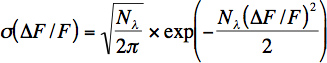
Esta equação representa a distribuição de Poisson para o ruído tiro fóton com uma mudança de variável para a mudança de fluorescência relativa: Af / F = (G * N λ (t)-G * N & lambda;, 0) / G * N λ, 0 em que G representa o ganho acumulado de fotomultiplicador e todos os outros componentes electrónicos. Note-se que esta equação não determinar correctamente o número de fotões detectados para gravações em in vivo porque existem outras fontes de ruído (artefactos de movimento), além de ruído de disparo de fotões. No entanto, esta equação é útil para em gravações in vivo para estimar o ruído.
- Linha de base de fluorescência é calculada a partir da janela ao mesmo tempo e representada graficamente como uma função do tempo, ou ensaios. A redução média da linha de base é mantida abaixo de 0,0002 / s, ajustando a força do laser, pois a detecção pico rapidamente diminui quando superior a este limite.
- Cada 10-20 minutos as posições somata neurônios são verificados por novamente a aquisição de uma imagem full frame. Se necessário, os locais de gravação são ajustados. Localizações pode ser ajustado por todos os neurónios de uma só vez, ou de neurónios individuais.
4. Reconstruction de horários espiga de sinais de fluorescência (deconvolução)
- Os sinais de fluorescência resultantes da actividade neural frequentemente somam no tempo por causa da deterioração dos transientes de cálcio é longo (várias centenas de milisegundos). Um método de deconvolução reconstrói horários espiga e espiga de sinais de fluorescência.
- Para determinar o mais provável trem espiga subjacente ao sinal de fluorescência registada, modelos diferentes são comparados. Aqui nós usamos um algoritmo genético para determinar o modelo - e, assim, o trem espiga e horários Spike - com a máxima verossimilhança.
- Em populações heterogêneas de neurônios, o ponto-evocado sinal de cálcio pode variar entre os neurônios. Para a análise de conjuntos de dados sem supervisão nós projetamos um algoritmo que leva em conta a variação do sinal de cálcio pico evocadas a partir de neurônio para neurônio.
- Para evitar um grande número de detecções de falsos positivos é útil para constringir a amplitude permitida e tempo de decaimento constante da modelo do sinal de cálcio ponto-evocado. A distribuição conjunta do tempo e amplitude constante de decaimento de uma única espiga transientes de cálcio evocadas são registadas numa série separada de experiências a partir do mesmo tipo de neurónios nas mesmas condições experimentais, utilizando gravações simultâneas electrofisiológicos e óptica.
- Para ter em conta as alterações de linha de base lentos e para reduzir os custos computacionais do deconvolving, gravações mais longas são divididos em vários traços curtos de 1-5 segundos.
- Para cada neurónio e cada gravação, o algoritmo de desconvolução pode testar um grande número de modelos (até 1.000.000 modelos diferentes ou mais). Para acelerar deconvolução, um experimento é deconvolved em até 10 computadores diferentes em paralelo.
- Depois de desconvolução, o espigão de dados é analisado e inspeccionado. Um histograma tempo peri-estímulo, a probabilidade de espiga, e taxa de disparo (pico médio por neurónios) são calculadas de uma forma automatizada.
5.Resultados representativos
Sucesso espiga dobradiças de detecção de uma relação sinal-para-ruído elevado de fluorescência registados os sinais de cálcio somáticas. Simplesmente usando taxas de excitação elevados (laser de alta potência) pode resultar em um impacto adverso de photoeffects em material biológico (fotoenvelhecimento). Em photodamage digitalização pontilhada de acesso aleatório se manifesta como uma diminuição de fluorescência basal e diminui os sinais de cálcio ponto-evocados fluorescência. A diminuição do sinal pico-evoked pode rapidamente resultar em falha para detectar picos. Existe apenas uma pequena janela de intensidade de excitação em que a detecção de pico de sinais de fluorescência é elevada. Na extremidade superior desta janela é limitada por fotodano, na extremidade inferior dos sinais de fluorescência têm uma relação sinal-para-ruído baixo. Para neurônios corticais em fatias agudas usamos potência do laser, resultando em taxas de fótons de cerca de 400,000-1,500,000 fótons / s ao gravar em cerca de 100 fim abaixo da superfície da fatia. Quando se utiliza um elevadoAfinidade indicador - aqui Oregon Verde 488 BAPTA - 1 - este sinal é suficiente para detectar picos individuais. Fig. 3E mostra um exemplo de um sinal de fluorescência registada a taxa de excitação muito baixo, um exemplo de uma gravação de detecção dentro da janela, e uma a uma taxa muito elevada de excitação.
Comparado com outras técnicas para gravar a atividade neural com a resolução de uma única célula e único ponto, pontilhado de acesso aleatório verificação pode gravar a partir de um número maior de neurônios da população, mesmo local, e é menos invasiva, por exemplo, em comparação com tetrode / multielectrode gravações . Assim, pontilhada de digitalização de acesso aleatório pode ser usada para gravar a atividade neural de muitos neurônios para medir a informação mútua sinalizado por supraliminares atividade 6 (Fig. 4A), as mudanças de atividade neural em uma população de neurônios (plasticidade cortical) e propagação da atividade supraliminares através de populações de neurónios 14 (Fig. 4B)
alt = "Figura 1" src = "files/ftp_upload/4052/4052fig1.jpg /" />
Figura 1. Desenho óptico da configuração de digitalização-pontilhada de acesso aleatório.
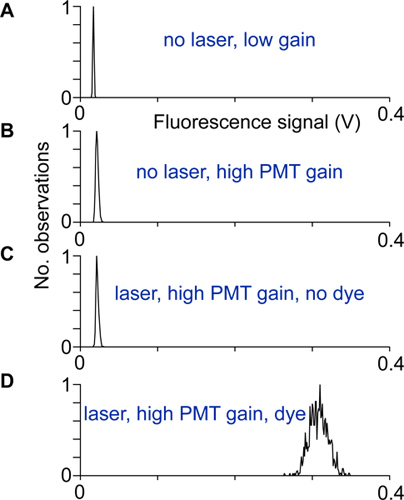
Figura 2 alinhamento e testes:. Distribuição de sinais de fluorescência gravados em diferentes condições. A) Sem luz laser e ganho fotomultiplicador baixo, B) Na maior ganho de PMT, mas nenhuma luz laser, a distribuição é maior, devido à corrente escura fotomultiplicador. C) Com o laser e gravado no ganho PMT alta. A diferença entre as distribuições mostradas em B e esta distribuição poderia indicar que a luz de excitação atinge os detectores PMT. D) A distribuição de sinais de fluorescência gravado em alto ganho de neurônio somata. Se nenhuma fonte de ruído outros contributos, esta distribuição surge de fóton tiro ruído apenas.
. Jpg "/>
Figura 3 A) imagem de quadros total de fluorescência para detectar e seleccionar posições somata neuronais, B) Verificação de percurso de um ciclo, C) Ilustração do princípio pontilhado,. Em cada (círculo) soma vários locais são registadas antes de mover o feixe para o próximo soma, D) Ilustração da saída do D two / A canais. Para cada soma neuronal, o sinal de fluorescência é registada a partir de quatro pontos diferentes em cada soma (S1-S4). A localização de cada ponto é dado por suas posições x e y. A x e y para todas as posições de pontos e todos os neurónios são enviados para o conversor digital-para-analógico de uma forma sequencial. Enquanto que o feixe se move entre dois somata neurónio, nenhum sinal é adquirido (em branco). E) Os exemplos de sinais de fluorescência. Note-se que cada um dos exemplos mostra a resposta a um espigão (como medido com gravação de células-inscritos electrofisiológico).
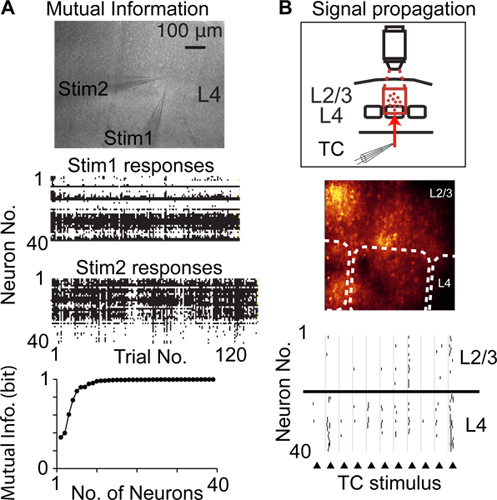
Figura 4. Estudar cortifunção de cal usando varredura de acesso aleatório pontilhada. A) Medir a informação mútua sinalizado por populações de neurónios. Imagem superior mostra microfotografia de uma fatia cerebral aguda e duas pipetas de estimulação colocados na mesma coluna cortical na camada 4 (L4). Centro gráficos mostram respostas neurais para cada repetição de um estímulo. Gráfico inferior mostra informações mútua de Shannon sinalizado pela população registrada de neurônios. B) a propagação de medição da atividade supraliminares spiking (propagação do sinal) entre populações de neurônios corticais. Gráfico superior ilustra design experimental, imagem central mostra imagem de fluorescência, as linhas tracejadas indicam fronteiras barril, menor gráfico mostra picos detectados em resposta à estimulação elétrica de fibras talamocorticais (triângulos).
Discussão
Digitalização de acesso aleatório Rasterizado indiretamente detecta atividade supraliminares spiking dos aumentos do cálcio intracelular somática associada a cada ponto em um somata neurônio. Os aumentos na concentração de cálcio intracelular são detectados por corantes fluorescentes de cálcio. As limitações da digitalização de acesso aleatório pontilhada surgem em grande parte a partir da relação de sinal-para-ruído limitado de sinais de fluorescência de cálcio. A razão sinal-para-ruído é, por s...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Agradecemos ao Dr. Randy Chitwood pela leitura crítica do manuscrito. Este trabalho foi financiado pela Fundação de Whitehall e Alfred P. Sloan Foundation subsídios para HJK.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários (opcional) |
| Os componentes ópticos são listados em ordem, a partir do laser | |||
| Titã: Safira Laser | Coerente Inc. | Chameleon Ultra 2 | Alta potência de saída recomendada (> 2W a 900 nm) |
| Lente acromática f = 30 mm | Thor laboratórios | AC254-030-B | Revestimento anti-reflexo (AR) para 650-1050 nm |
| Lente acromática f = 100 mm | Thor laboratórios | AC254-100-B | AR 650-1050 nm |
| Lente F = 75 mm | Thor laboratórios | LA1608-B | AR 650-1050 nm |
| Lente F = 175 milímetros | Thor laboratórios | LA1229-B | AR 650-1050 nm |
| Lente acromática f = 300 mm | Thor laboratórios | AC254-300-B | AR 650-1050 nm |
| Lente acromática f = 100 mm | Thor laboratórios | AC254-100-B | AR 650-1050 nm |
| Lente acromática f = 100 mm | Thor laboratórios | AC254-100-B | AR 650-1050 nm |
| Acústico-ópticos defletores | Intraaction Corp | ATD 6510CD2 | |
| Grade de difração reflexivo | Newport | 53-011R | 100 ranhuras / mm para EOA com 65 MHz de largura de banda e ângulo de leitura de 45 mrad |
| 21,6 milímetros Brewster prismas | Lambda de Pesquisa Óptica Inc. | IBP21.6SF10 | |
| Vidro colorido | Schott | BG-39 | |
| Espelho dicróico | Chroma Technology Corp | Z532RDC | |
| Módulos fotomultiplicadores | Hamamatsu | H9305-03 | |
| DAC-ADC bordo | National Instruments | PCI-6115 | |
| Verde Oregon 488 BAPTA-1 AM | Invitrogen | O-6807 |
Referências
- Iyer, V., Hoogland, T. M., Saggau, P. Fast functional imaging of single neurons using random-access multiphoton (RAMP) microscopy. J. Neurophysiol. 95, 535-545 (2006).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248, 73 (1990).
- Ranganathan, G. N., Koester, H. J. Optical recording of neuronal spiking activity from unbiased populations of neurons with high spike detection efficiency and high temporal precision. J. Neurophysiol. 104, 1812-1824 (2010).
- Grewe, B. F., Langer, D., Kasper, H., Kampa, B. M., Helmchen, F. High-speed in vivo calcium imaging reveals neuronal network activity with near-millisecond precision. Nat. Methods. 7, 399-405 (2010).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc. Natl. Acad. Sci. U.S.A. 100, 7319-7324 (2003).
- Pita-Almenar, J. D., Ranganathan, G. N., Koester, H. J. Impact of cortical plasticity on information signaled by populations of neurons in the cerebral cortex. J. Neurophysiol. 106, 1118-1124 (2011).
- Kerr, J. N., Greenberg, D., Helmchen, F. Imaging input and output of neocortical networks in vivo. Proc. Natl. Acad. Sci. U.S.A. 102, 14063-14068 (2005).
- Lin, B. J., Chen, T. W., Schild, D. Cell type-specific relationships between spiking and [Ca2+]i in neurons of the Xenopus tadpole olfactory bulb. J. Physiol. 582, 163-175 (2007).
- Zeng, S., Lv, X., Zhan, C., Chen, W. R. Simultaneous compensation for spatial and temporal dispersion of acousto-optical deflectors for two-dimensional scanning with a single prism. Opt. Lett. 31, 1091-1093 (2006).
- Otsu, Y., Bormuth, V., Wong, J., Mathieu, B. Optical monitoring of neuronal activity at high frame rate with a digital random-access multiphoton (RAMP) microscope. J. Neurosci. Methods. 173, 259-270 (2008).
- Vogelstein, J. T., Watson, B. O., Packer, A. M., Yuste, R. Spike inference from calcium imaging using sequential Monte Carlo methods. Biophys. J. 97, 636-655 (2009).
- Yaksi, E., Friedrich, R. W. Reconstruction of firing rate changes across neuronal populations by temporally deconvolved Ca2+ imaging. Nat. Methods. 3, 377-383 (2006).
- Hendel, T., Mank, M., Schnell, B., Griesbeck, O. Fluorescence changes of genetic calcium indicators and OGB-1 correlated with neural activity and calcium in vivo and in vitro. J. Neurosci. 28, 7399-7411 (2008).
- Ranganathan, G. N., Koester, H. J. Correlations decrease with propagation of spiking activity in the mouse barrel cortex. Front Neural Circuits. 5, 8 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados