Method Article
Évaluation de la mécanique de l'appareil respiratoire chez les souris en utilisant la technique d'oscillation forcée
Dans cet article
Résumé
Le présent protocole fournit une description étape par étape détaillée des procédures nécessaires à l'exécution des mesures de la mécanique du système respiratoire, ainsi que l'évaluation de la réactivité bronchique à la métacholine inhalée chez des souris en utilisant la technique d'oscillation forcée (flexiVent; SCIREQ Inc, Montréal, Qc , Canada).
Résumé
La technique d'oscillation forcée (OFT) est un outil puissant, intégrée et translationnelle permettant l'évaluation expérimentale de la fonction pulmonaire chez la souris d'une manière globale, détaillée, précise et reproductible. Il fournit des mesures de la mécanique du système respiratoire à travers l'analyse des signaux de pression et le volume acquis en réaction aux prédéfini, de faible amplitude, oscillant air formes d'ondes, qui sont généralement appliquées à l'ouverture des voies aériennes du sujet. Les présentes détails du protocole décrit les étapes nécessaires à l'exécution adéquate des mesures d'oscillations forcées dans des souris en utilisant un ventilateur de piston commandé par ordinateur (flexiVent; SCIREQ Inc, Montréal, Qc, Canada). La description est divisée en quatre parties: les étapes préparatoires, ventilation mécanique, la mesure de la fonction pulmonaire et l'analyse des données. Il inclut également des détails sur la façon d'évaluer la réactivité bronchique à la métacholine inhalée chez des souris anesthésiées, une application courante de cette technique qui s'étend également à d'autres résultats et diverses pathologies pulmonaires. Les mesures obtenues chez des souris naïves, ainsi que d'un modèle axé sur le stress oxydatif de dommages des voies respiratoires sont présentés pour illustrer comment cet outil peut contribuer à une meilleure caractérisation et la compréhension des changements physiologiques étudiés ou des modèles de maladies ainsi que pour des applications dans de nouveaux domaines de recherche.
Introduction
Caractérisation adéquate des propriétés mécaniques des poumons chez les petits animaux est devenue indispensable depuis l'éclosion de modèles murins en sciences respiratoires. Quand elle est réalisée en utilisant la technique d'oscillation forcée (OFT), une technique également utilisée chez l'homme, ces mesures fournissent une approche puissante, intégrée et translationnelle pour étudier les changements physiologiques significatifs. FOT mesures sont généralement obtenus par l'analyse de signaux de pression et de volume acquis, en réaction à une prédéfini, de faible amplitude, forme d'onde oscillatoire flux d'air (également dénommé perturbation ou de signal d'entrée) appliquée à l'ouverture des voies respiratoires du sujet 1. Dans sa forme la plus simple, une perturbation OFT serait une seule forme d'onde sinusoïdale à une fréquence bien définie. Perturbations plus complexes se composent généralement d'une superposition d'une sélection de spécifique (premiers entre eux) des formes d'onde fréquence couvrant un large spectre. La décomposition de la multi-fréquencesignaux d'entrée et de sortie en leurs constituants en utilisant la transformée de Fourier permet de calculer respiratoire impédance d'entrée de système (Zrs), c'est à dire la fonction de transfert entre l'entrée et les signaux de sortie, à toutes les fréquences incluses dans la perturbation 2. Par conséquent, l'OFT permet l'évaluation simultanée de la mécanique respiratoire sur une gamme de fréquences dans une seule 2 de manœuvre. Modèles mathématiques avancés de montage (par exemple la phase Modèle Constant 3) aux données d'impédance permettent alors un partitionnement de la réponse en voies respiratoires (central et périphérique) et paramètres dépendants de tissus du parenchyme pulmonaire 1, 3. Parce que de nombreux facteurs influent sur la réponse physiologique (par exemple, la fréquence respiratoire, volume courant, le volume du poumon, des voies respiratoires supérieures, les efforts de respiration spontanée, le calendrier des mesures) sont contrôlés et étalonnés par le système de mesure et les procédures expérimentales, 1 la technique est capcapable de générer des mesures précises et reproductibles à condition qu'elle soit effectuée correctement. L'objectif de cet article est de fournir une description chronologique détaillée de la procédure nécessaire pour exécuter de telles mesures chez la souris. Le protocole se compose de quatre parties: les étapes préparatoires (réactifs, du matériel et des sujets), la ventilation mécanique, la mesure de la fonction pulmonaire et l'analyse des données. Exemples de résultats représentatifs de la mécanique du système respiratoire générés à l'aide d'un ventilateur de piston commandé par ordinateur (flexiVent, SCIREQ Inc, Montréal, Qc, Canada) sont prévus. Ceux-ci ont été obtenus à partir de souris naïves, ainsi que d'un modèle axé sur le stress oxydatif de dommages des voies respiratoires caractérisée par une inflammation des voies respiratoires, lésions des cellules épithéliales et une augmentation de la réactivité bronchique à la méthacholine inhalation d'aérosol 4. Bien que ce protocole est souvent utilisé pour évaluer la réactivité bronchique à la métacholine inhalée, elle s'étend à d'autres résultats et various pathologies comme l'asthme, la maladie pulmonaire obstructive chronique (COPD), l'emphysème, la fibrose pulmonaire, la lésion pulmonaire ainsi que pour le modèle de souris transgéniques de pathologies similaires à la maladie humaine. Les résultats des recherches à l'aide de cet outil peut contribuer à une meilleure caractérisation et la compréhension des changements physiologiques ou des modèles de la maladie ainsi que de l'expansion dans de nouveaux domaines de recherche.
Protocole
Les procédures décrites ci-dessous ont été approuvés par le Comité de protection des animaux institutionnelle Université McGill en conformité avec les lignes directrices du Conseil canadien de protection des animaux (CCPA).
1. Les étapes préparatoires
- Solutions:
- Methacholine: Préparer une solution stock à 50 mg / ml et faire des dilutions en série (1:1) en fonction des concentrations à tester 5. Laisser les solutions pour atteindre la température ambiante avant de nébulisation 5.
- Agents anesthésiques: Différents schémas ont été rapportés dans la littérature dans diverses souches de souris (Tableau 1). Remarque: Régime 1 a été utilisé dans le cadre du présent protocole.
- Equipement: Le présent protocole s'applique à l'une des deux générations flexiVent pris en charge par le logiciel flexiWare 7. Les fonctions du logiciel sont regroupées en trois modules: une étude de définition et de planification, expérimentation Session et de l'examen et de rapports.
- Allumez le système (flexiVent FX seulement) et / ou de lancer le logiciel.
- Lors de la première séance d'expérimentation ou à tout moment avant, ouvrez la définition de l'étude et le module de planification de prédéfinir la structure de l'étude.
- Cliquez sur le bouton Créer une nouvelle d'étude et suivez l'assistant pour créer une étude, un aperçu du protocole et de définir les groupes expérimentaux et les sujets à étudier.
- Initier une séance d'expérimentation en ouvrant le module de session d'expérimentation et après la séquence de démarrage pour l'étude et la sélection de modèle.
- Attribuer un sujet sur le site de mesure et confirmer son poids.
- Procéder à l'étalonnage du système en suivant les étapes décrites dans le logiciel d'exploitation. Vous serez invité à un moment de fixer la canule doit être utilisé (étape 1.3.3) pour le Y-tube pour l'étalonnage.
- Étape critique. REPEAt étape 1.2.6 si les valeurs de calibrage obtenues sont en dehors de la plage acceptable. (Reportez-vous à la flexiVent FX ou notice flexiWare 7 pour les plages acceptables propres modules de valeurs d'étalonnage).
- Annuler invite à démarrer la ventilation et l'enregistrement de données à moins prêt à commencer l'expérience. Ceux-ci peuvent être lancées à une date ultérieure.
- Sujets:
- Anesthésier le sujet en utilisant des doses appropriées des agents anesthésiques (tableau 1).
- Vérifiez que le sujet a atteint un niveau chirurgical de l'anesthésie. Le sujet doit montrer aucune réaction à un pincement de l'orteil et sa respiration doit être régulière et pas travaillé.
- Effectuer une trachéotomie et cathétériser la trachée.
- Placez l'animal sur son dos et de fournir une source de chaleur (température couverture chauffante contrôlée ou une lampe avec une ampoule de 60 watts situés à environ 45 cm de la souris afin d'éviter un échauffement excessif).
- E Cleane région de la gorge à l'alcool et à exposer la trachée en faisant une incision de la peau et à séparer en douceur la glande sous-maxillaire et la couche musculaire recouvrant.
- Soulever légèrement la trachée à l'aide d'une paire de micro-pinces et passer une suture en dessous.
- Couper entre deux anneaux de cartilage le plus proche du larynx à faire une petite incision dans la trachée sans sectionnement elle.
- Insérez la canule préalablement étalonné dans l'incision et avancer doucement dans la trachée de la longueur d'environ 5 anneaux. Remarque: Les présentes expériences ont été réalisées à l'aide de 1,2 cm de long métalliques de 18 canule de jauge.
- Étape critique. Sécurisez la canule en place avec la suture. La fixation doit former un joint étanche autour de la canule.
2. Ventilation mécanique
- Apportez l'animal à proximité du ventilateur.
- Démarrer une ventilation mécanique en sélectionnant un prédéfiniou un profilé de ventilation personnalisée dans le menu fixe de ventilation.
- Branchez l'animal pour le ventilateur via le Y-tube.
- Étape critique. Align l'animal au ventilateur et faire en sorte que la canule trachéale est au même niveau que le ventilateur pour éviter une occlusion possible canule trachéale ou torsion.
- Étape critique. Exécuter une perturbation profonde de l'inflation en double-cliquant sur le nom de la perturbation de vérifier l'insertion de la canule et d'attachement. En l'absence d'une fuite, le système devrait être capable de tenir une pression de 30 cmH 2 O sur un délai de 3 secondes sans déplacement de volume excessive (Figure 1). Le volume enregistré et traces de pression devraient également être lisse, sans aucun signe de décalage ou de déformation que ceux-ci pourraient indiquer une obstruction canule ou égarement.
- Si nécessaire, connectez capteurs de signes vitaux de la fréquence cardiaque et la surveillance de la température du corps. L'enregistrement des données peut être lancée either manuellement ou automatiquement via un script.
3. Mesures de la fonction pulmonaire
Des mesures ou des commandes (par exemple activation du nébuliseur, des marqueurs d'événements) peuvent être automatisées en utilisant des scripts prédéfinis ou personnalisés pour un processus expérimental très contrôlée et reproductible (Figure 2). Six familles de perturbations donnant lieu à un certain nombre de paramètres peuvent être utilisés pour décrire l'objet respiratoires mécanique du système au départ et suite à une faute donnée (tableau 2).
- Étape critique. Lorsque vous êtes prêt à commencer à prendre des mesures, exécutez une inflation profonde de recruter des zones pulmonaires fermés et normaliser poumon historique de volume.
- Étape critique. Vérifier l'absence d'efforts inspiratoires spontanés en exécutant une mesure de test (par exemple PVS-P ou PV-V). Observez les traces du signal de pression dans la vue de dataset sélectionné. Avec des courbes PV par étapes,plateaux de pression doit être bien défini, sans déviations vers le bas. Un mouvement à la baisse de la pression indiquerait un effort inspiratoire de l'animal (Figure 3).
- Lancer le script sélectionné en double-cliquant sur son titre. Les scripts utilisés dans la présente étude généralement inclus pour les mesures:
- Une séquence de mesures de référence en triple.
- Activation du nébuliseur pour l'évaluation de la réactivité bronchique à la métacholine inhalée. Remarque: Lorsque vous êtes invité par le système, charger environ 100 pi d'une solution saline ou d'une solution de méthacholine dans le nébuliseur. Nébulisation démarre et s'arrête automatiquement.
- Une séquence de mesures rapprochées (toutes les 10-15 secondes) pendant une période d'environ 3 min après l'activation du nébuliseur.
- Une invite à effectuer un autre défi et répéter une séquence de mesures. Remarque: Le séchage à l'intérieur de la monture nébuliseur avec un écouvillon en bntre défis peuvent aider à prévenir la condensation des gouttelettes ou des bâtiments dans la ligne inspiratoire.
- A la fin de l'expérience, arrêter la ventilation et détacher le sujet.
- Basculer vers le prochain sujet dans le logiciel d'exploitation et confirmer son poids.
- Étape critique. Rincez et séchez nébuliseur, adaptateur, Y-tube et canule entre les sujets.
- Répéter les étapes 1.2.6 à 3.6.
- A la fin de la journée, fermer la session expérimentale. N'oubliez pas de rincer et sécher nébuliseur, adaptateur, Y-tube et canule et pour nettoyer la valve expiratoire du système avant de quitter le laboratoire en suivant les instructions du fabricant.
4. Analyse des données
Le logiciel calcule et affiche automatiquement les paramètres associés à une perturbation. Il fournit également un coefficient de détermination (COD) qui reflète l'ajustement du modèle mathématique aux données. Chaque jeu de données avec une isolationCOD FFICIENT est étiqueté comme exclu par le logiciel. Examen des sessions expérimentales, les données de réanalyse et la création de scénarios d'exportation sont effectuées dans le module d'examen et de rapports du logiciel.
- Ouvrez le module d'examen et de rapports et créer un scénario d'exportation, en prenant soin d'inclure uniquement les ensembles de données ayant un COD suffisante.
- Exporter en tant que paramètres nécessaires, courbe de pression ou de débit-volume, les signaux d'ensembles de données brutes ou soumis des informations à un tableur (voir le tableau 3).
- Les mesures moyennes de référence pour chaque paramètre et l'intrigue toutes les mesures en fonction du temps (voir Figure 4). Vous pouvez alors choisir de calculer l'aire sous la courbe, d'analyser le profil général des courbes ou d'effectuer une analyse statistique.
- Pour exprimer voies respiratoires résultats de réactivité en fonction de la concentration de méthacholine, de déterminer pour chaque sujet, paramètre et l'état expérimental soit un particulierPoint (par exemple pic) ou un moment précis après chaque provocation à la méthacholine. Calculer des moyennes de groupe et les résultats de l'intrigue rapport ou pour chaque condition expérimentale (tableau 4, figure 5).
- Vous pouvez également envisager de calculer la concentration produisant un doublement de la valeur de référence du paramètre donné (PC 200; figure 5C), l'application d'une normalisation (par exemple% de base) ou d'effectuer une analyse statistique.
Résultats
Le système respiratoire mécanique mesures. Tableau 4 montre des résultats typiques de naïfs souris A / J obtenus au départ et une bronchoconstriction induite par la méthacholine suivante (12,5 mg / ml) en utilisant l'une des deux générations flexiVent pris en charge par le logiciel flexiWare 7. Mécanique de l'appareil respiratoire, soit dans des conditions de poitrine fermées, ont été évalués par des perturbations de la fréquence d'oscillation familles forcées simples et à large bande en alternance de manière rapprochées (snapshot-150, Quick Prime-3, respectivement). Depuis ventilation est en pause pendant les mesures, le Quick Prime-3, qui couvre une gamme de fréquence similaire à celle du premier-8, mais a une durée plus courte (3 vs 8 sec), a été choisi afin de raccourcir la période d'apnée, de minimiser l'effet de la perturbation sur les gaz du sang et de fournir une meilleure résolution de la réponse. Les paramètres associés à chaque perturbation ont été calculés automatically par le logiciel d'exploitation. Résultats montrent que les deux générations du système flexiVent produites mesures équivalentes de la mécanique respiratoire.
Site de la réponse du poumon. Distinguer le site de la réponse du poumon permet au chercheur de cerner davantage les régions touchées ainsi que d'identifier les points d'intervention potentiels pharmacologique 6. Par exemple, naïfs souris A / J montrent une augmentation de la résistance de référence lorsque la pression expiratoire contre laquelle les mesures sont effectuées est augmentée de 3 à 9 cm H 2 O (figure 6A, instantané-150). Dans le présent exemple, l'utilisation de mesures de FOT haut débit (Quick Prime-3) a fourni des détails à clarifier la base de la variation de la résistance: Le changement de pression en fin d'expiration a entraîné une diminution de la résistance des voies aériennes (R N) compatible avec l' effets bronchodilatateurs d'un volume pulmonaire supérieur et de la presse d'inflation plusure (figure 6D) et une augmentation de l'amortissement de tissu (G, figure 6E), un paramètre étroitement liée à la résistance des tissus qui reflète la viscoélasticité du tissu et éventuellement la résistance des petites voies aériennes 7. Ce dernier est connu pour augmenter avec le volume pulmonaire augmente.
hyperréactivité bronchique. Après une exposition de chlore gazeux, la réactivité bronchique à la métacholine inhalée augmente par rapport à l'exposition de l'air dans des souris Balb / c à la suite de voies dommages 4 (Figure 2). Le chlore est connu pour induire un stress oxydatif, conduisant à la destruction des cellules structurelles dans les voies respiratoires, en particulier les cellules épithéliales, et induisant le recrutement de cellules inflammatoires. Comme représenté sur la figure 5, les changements dans les paramètres décrivant la mécanique du système respiratoire peuvent être vus en réponse à des défis croissants à la méthacholine. En comparaison avec les souris exposées à l'air, les souris exposées à des chlorationgaz ne s'affiche plus réponses maximales à tous les paramètres FOT (figure 5A, 5B, 5D-5F) ainsi que d'un déplacement vers la gauche statistiquement significative de la courbe concentration-réponse exemplifié par une réduction de la concentration de méthacholine nécessaire pour provoquer un doublement de la résistance et elastance (PC 200; figure 5C). Ces résultats illustrent, respectivement, l'hyperréactivité bronchique et l'hypersensibilité à la méthacholine après une exposition par inhalation de gaz de chlore.
Autres mesures. En plus de l'OFT, le système flexiVent peut également être utilisé pour recueillir d'autres types de 8-10 de la fonction pulmonaire ou cardio-vasculaires 11 mesures. Figure 7 affiche un pas à pas, la pression axée sur la courbe pression-volume représentant dans naïfs A / J souris dans des conditions de base . La partie supérieure du membre de dégonflage de la courbe est adaptée à l'équation Salazar-Knowles 12 sup> et les paramètres sont calculés automatiquement par le logiciel.
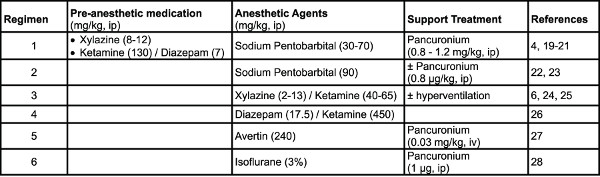
Tableau 1. Des exemples de schémas anesthésiques utilisés chez la souris. Cliquez ici pour agrandir le tableau .
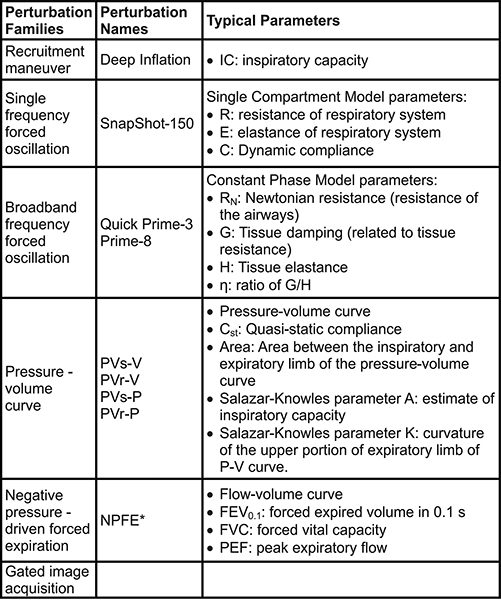
Tableau 2. Perturbations utilisés pour les mesures de la fonction pulmonaire chez la souris. * Extension nécessaire au système. Le sujet doit également être dans une chambre de plethysmograph fermé pendant les mesures.Lank "> Cliquez ici pour agrandir l'table.
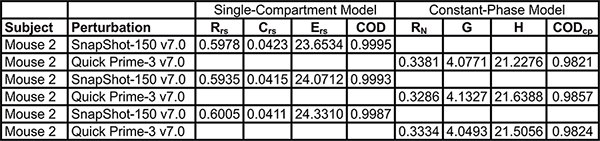
Tableau 3. Exemple de paramètres exportés de la fréquence contraint les familles de perturbation d'oscillation simples et à large bande. Cliquez ici pour agrandir le tableau .
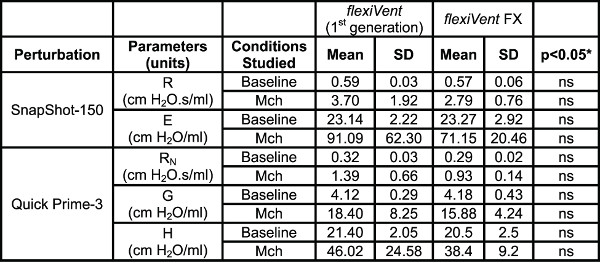
Tableau 4. Comparaison du système. Comparaison des paramètres de la mécanique du poumon recueillies en utilisant les deux générations du système flexiVent exploités par des logiciels flexiWare 7. Les résultats ont été générés dans naïfs souris A / J (n = 5 / groupe) au départ et la bronchoconstriction induite par la méthacholine suivante (SMI 12,5 mg / ml). * Les groupes ont été comparées en utilisant une analyse de variance à deux voies pour les mesures répétées et le journal 10 des réponses individuelles à l'homogénéité des variances (GraphPad Prism, la version 5.03; GraphPad Software, San Diego, USA).
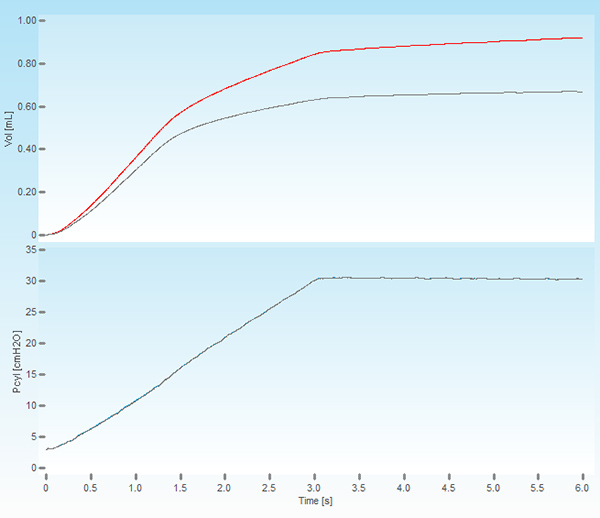
Figure 1. Capture d'écran d'une inflation du poumon profond. Le panneau supérieur montre le volume déplacé par le piston du ventilateur (trace rouge) et le volume livré au sujet (gris trace). Le panneau inférieur affiche la pression dans le cylindre et portant à une pression réglée de 30 cmH 2 O, sur une période de 3 secondes et maintenue constante pendant la même période de temps.
172/50172fig2.jpg "alt =" Figure 2 "/>
Figure 2. Exemple d'un script typique utilisée pour évaluer la mécanique du système respiratoire au départ.
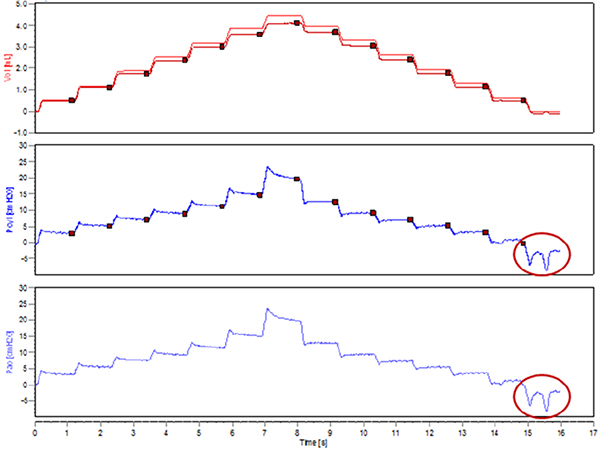
Figure 3. Efforts inspiratoires spontanés au cours de l'exécution d'une courbe pression-volume par paliers.
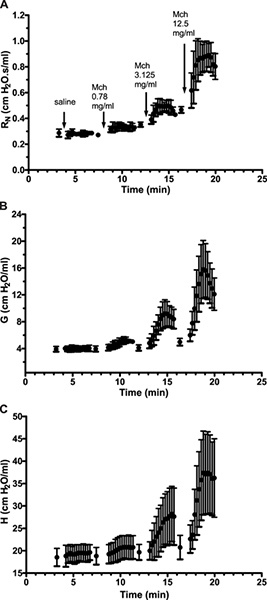
Figure 4. Time-cours suivant de réponse des défis croissants à la méthacholine inhalés. Résultats sont exprimés comme la moyenne (± écart-type) d'un groupe de 5 naïfs spontanément hyperréactives souris A / J. Cliquez ici pour agrandir la figure .
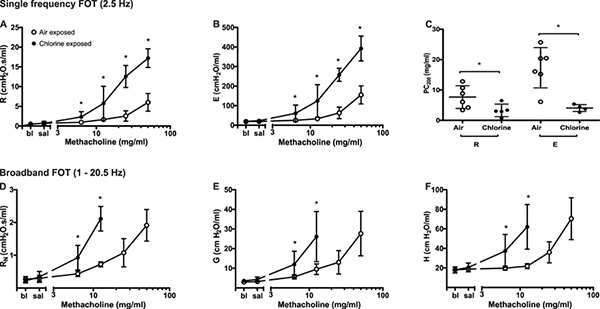
Figure 5. Les changements dans la mécanique du système respiratoire suite à des défis croissants à la méthacholine en chlore et souris Balb / c exposées à l'air. Valeur maximale a été identifié pour chaque paramètre dans chaque sujet et des conditions expérimentales. Les moyennes des groupes ont ensuite été calculées (moyenne ± écart-type, n = 4-6). Les différences entre les groupes ont été évalués par analyse de variance en utilisant le log 10 des réponses individuelles à l'homogénéité des variances. La concentration de méthacholine produire un doublement de la ligne de base (PC 200) a été obtenu en ajustant un polynôme du second degré de courbes dose-réponse individuelles et l'interpolation de la courbe ajustée. Les points de données sont manquantes dans D, E et F chez les souris exposées au chloreaux deux concentrations les plus élevées de méthacholine en raison de coefficients insuffisamment élevés de détermination reflétant un mauvais ajustement du modèle mathématique aux données. Cliquez ici pour agrandir la figure .
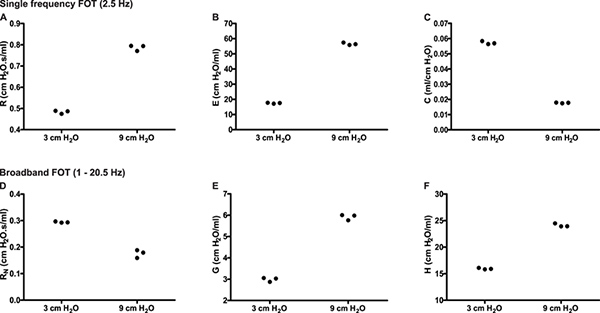
Figure 6. Partitionnement de la réponse respiratoire en voies respiratoires et la mécanique des tissus pulmonaires. Trace expérimentale d'une naïve souris A / J illustrant une seule fréquence (2,5 Hz) et le haut débit (1-20.5Hz) contraints mesures d'oscillation mécanique respiratoire en triple exemplaire, à deux pressions expiratoires finaux différents (3 & 9 cmH 2 O). Cliquez ici pour agrandir la figure .
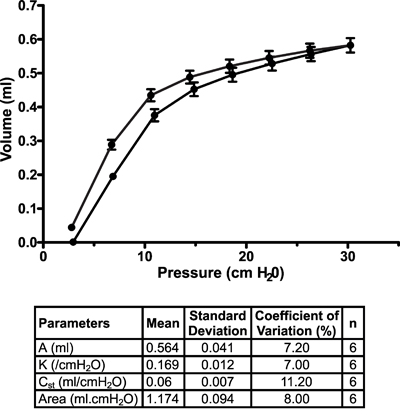
Figure 7. Courbe pression-volume dans naïfs A / J souris dans des conditions de base. Courbes pression-volume ont été générées par une perturbation de pression entraînée par étapes (PV-P) pour s'assurer que chaque poumons de souris ont été gonflés à la même pression, indépendamment de leur état. Salazar-Knowles paramètres de l'équation extraites à partir des courbes pression-volume individuels ont également été signalés en moyenne et dans un format de tableau. Les résultats sont exprimés en moyenne ± écart-type (n = 6).
Discussion
L'étude continue de dysfonctionnement des voies aériennes en ce qui concerne l'asthme et d'autres troubles pulmonaires demeure primordiale à la compréhension des mécanismes sous-jacents de la maladie et le développement d'options de traitement. L'utilisation de la souris pour modéliser les maladies des voies respiratoires a été essentielle pour gagner la compréhension dans ces mécanismes de la maladie. Lorsque l'on considère un dysfonctionnement des voies respiratoires évaluer dans un sujet aussi petit qu'une souris, disposer d'outils fiables et précis permettant de mesurer la fonction pulmonaire est critique. En outre, avoir des outils capables de fournir des indications sur l'emplacement d'un dysfonctionnement des voies aériennes ou de l'effet thérapeutique est inestimable. La technique FOT combine toutes ces caractéristiques et offre une approche puissante, intégrée et translationnelle pour évaluer les changements physiologiques.
Afin de réussir avec ce type de mesure chez la souris, une attention particulière devrait être accordée aux quelques étapes, à savoir l'étalonnage du système, la résistance de la ca endotrachéalennula, du type de nébuliseur (ainsi que ses paramètres de fonctionnement), le positionnement de l'animal et la normalisation de poumon historique de volume. En outre, il est impératif afin d'obtenir des ensembles de données valides que le système respiratoire du sujet reste passive pendant les mesures. Ceci peut être réalisé par l'administration d'un agent paralysant musculaire, travailler à un plan d'anesthésie profonde ou par hyperventilation le sujet pour induire l'apnée (voir tableau 1). Les enquêteurs peuvent commencer par la maîtrise du système et son logiciel d'exploitation, le cas échéant, avec les charges d'essai, tout en acquérant les compétences nécessaires pour les mesures chez la souris. Il serait alors logique pour générer des résultats reproductibles chez les animaux naïfs avant de passer à des modèles de maladies ou les souris traitées. Depuis une proportion importante des modèles de maladies respiratoires dans la recherche implique d'exposer les animaux à des agents tels que les allergènes, de toxines, les polluants, la fumée de cigarette ou des gaz, de la variabilité dans les résultats obtenus avec les mesureurst technique décrite dans cet article pourrait donc être influencée par la procédure d'exposition utilisé. Standardisation des processus expérimentaux clés (par exemple, en utilisant une exposition contrôlée par ordinateur et les systèmes de mesure 6, 13, 14) pourrait avoir un impact significatif dans la réduction de la variabilité.
Exemples présentés dans cet article représentent une sélection des résultats typiques de naïfs et de chlore-exposée expériences sur des souris tout en soulignant les points forts ainsi que les limites de la technique. Comme on peut le voir par exemple dans la figure 6, la technique est capable de générer des mesures de la fonction pulmonaire reproductibles. Alors que les valeurs similaires de résistance de base ont été signalés entre les souches de souris, les différences de elastance ont toutefois été observées 15. D'importants changements sont également à prévoir entre le nourrisson et souris adultes 16. Comme pour d'autres dans l'évaluation physiologique in vivo, des résultats de haute précision, tels que eose généré par l'OFT, venez avec une concession à l'état naturel des sujets. Ce principe, qui est désigné comme le principe d'incertitude de phénotypage 1, s'applique au présent protocole en ce sens que des mesures doivent être prises dans anesthésié, trachéotomie (ou intubés par voie orale) et ventilés mécaniquement sujets. Une autre limitation de la technique est observable dans la figure 5D-5F où les données ne sont pas disponibles sur les concentrations les plus élevées pour le groupe chlore exposée parce que l'ajustement de la phase du modèle constant aux données est mauvaise au-dessus des niveaux modérés de bronchoconstriction. Toutefois, les animaux sévèrement bronchoconstriction pourraient être évalués en analysant directement Zrs 15, ou en utilisant un logiciel tiers de post-analyse partie à s'adapter à des modèles mathématiques plus complexes, par exemple en tenant compte de l'hétérogénéité de la fonction mécanique 17. Jeux de données exclus peuvent également être observés si les voies respiratoires de l'animal ne sont pas suffisamment passive ou si la résistance de la canule est trop élevée. En règle générale, la résistance de la canule ne doit pas dépasser la résistance de l'animal à l'inclusion. Travailler avec une canule de plus grand diamètre intérieur et / ou de courte durée permettra de réduire la résistance canule. Enfin, la manifestation présente des mesures FOT chez la souris peut être perçu comme une méthode fastidieuse et donc moins efficace ou moins applicable aux études longitudinales par rapport à des techniques moins invasives. Mais ces derniers sont associés à une grande incertitude quant à la base de leurs résultats et sont considérés par beaucoup comme étant défectueux 1. Mesures invasives répétées sont possibles chez les animaux intubés par voie orale, bien que techniquement plus difficile 17.
A partir des exemples fournis, les résultats ont démontré l'équivalence des deux générations du système flexiVent à produire des mesures de la mécanique des voies respiratoires, ainsi que des voies respiratoires hyperreactivité et l'hypersensibilité à la métacholine inhalée suite chlore-exposition chez la souris. Lorsqu'il est utilisé pour caractériser ou comprendre les changements physiologiques ou des modèles de la maladie, l'aspect détaillées de mesure liée à la technique peut contribuer à étendre l'état actuel des connaissances.
Déclarations de divulgation
AR, LF, TFS sont employés par SCIREQ scientifiques respiratoires Equipment Inc. TFS possède également des stocks.
Le libre accès à cet article est sponsorisé par SCIREQ Scientific Respiratory Equipment, Inc.
Remerciements
TKMcG est soutenu par une bourse de la Société canadienne de thoracologie.
CONTRIBUTION DES AUTEURS
Tous les auteurs ont participé à la conception du manuscrit. En outre, TKMcG a initié le projet, a recueilli les résultats expérimentaux, ont contribué à la rédaction du manuscrit et son examen critique. AR recueilli et analysé les résultats expérimentaux, a rédigé le manuscrit et a contribué à son examen critique. LF recueillies résultats expérimentaux et a contribué à l'examen critique du manuscrit. TFS et JGM contribué à l'examen critique du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Acetyl-β-methylcholine chloride | Sigma-Aldrich | A-2251 | Methacholine |
| Micro-Adson forceps, serrated 12 cm | Fine Science Tools | 11018-12 | |
| Moria MC31 forceps, serrated-curved | Fine Science Tools | 11370-31 | |
| Iris scissors-tough cut, straight 11.5 cm | Fine Science Tools | 14058-11 | |
| Spring scissors-2.5 mm blades, straight | Fine Science Tools | 15000-08 | |
| Non-sterile blunt needle (18g x ½") | Brico Medical Supplies Inc. | BN1805 | Endotracheal cannula |
| Non-sterile 5-0 silk suture | Seraflex | IDI58000 | |
| Phosphate buffered solution | Gibco | 14190-144 | |
| 15 ml conical tubes | Starstedt | SS-4001 | |
| 1 ml TB syringes | Becton Dickinson | 309626 | |
| 200 μl filter tips | Biosphere | 70.760.211 | |
| EQUIPMENT | |||
| flexiVent FX |  SCIREQ Inc. SCIREQ Inc. | sales@scireq.com | www.scireq.com |
| Aerogen Aeroneb nebulizer |  SCIREQ Inc. SCIREQ Inc. | sales@scireq.com | www.scireq.com |
Références
- Bates, J. H. T., Irvin, C. G. Measuring lung function in mice: the phenotyping uncertainty principle. J. Appl. Physiol. 94, 1297-1306 (2003).
- Bates, J. H. T. . Lung mechanics. An inverse modeling approach. , (2009).
- Hantos, Z., Daroczy, B., Suki, B., Nagy, S., Fredberg, J. J. Input impedance and peripheral inhomogeneity in dog lungs. J. Appl. Physiol. 72, 168-178 (1992).
- McGovern, T. K., et al. Dimethylthiourea protects against chlorine induced changes in airway function in a murine model of irritant induced asthma. Respir. Res. 11, 138 (2010).
- Hayes, R. D., Beach, J. R., Rutherford, D. M., Sim, M. R. Stability of methacholine chloride solutions under different storage conditions over a 9 month period. Eur. Respir. J. 11, 946-948 (1998).
- North, M. L., et al. Augmentation of arginase 1 expression by exposure to air pollution exacerbates the airways hyperresponsiveness in murine models of asthma. Respir. Res. 12, (2011).
- Siddiqui, S., et al. Site of allergic airway narrowing and the influence of exogenous surfactant in the brown norway rat. PloS ONE. 7, e29381 (2012).
- Cohen, J. C., Lundblad, L. K. A., Bates, J. H. T., Levitzky, M., Larson, J. E. The "Goldilocks Effect" in cystic fibrosis: identification of a lung phenotype in the cftr knockout and heterozygous mouse. BMC Genetics. 5, 21 (2004).
- Shalaby, K. H., Gold, L. G., Schuessler, T. F., Martin, J. G., Robichaud, A. Combined forced oscillation and forced expiration measurements in mice for the assessment of airway hyperresponsiveness. Respir Res. 11, 82 (2010).
- Thiesse, J., et al. Lung structure phenotype variation in inbred mouse strains revealed through in vivo micro-CT imaging. J. Appl. Physiol. 109, 1960-1968 (2010).
- Amatullah, H., et al. Comparative cardiopulmonary effects of size-fractionated airborne particulate matter. Inhalation Toxicology. 24, 161-171 (2012).
- Salazar, E., Knowles, J. H. An analysis of pressure-volume characteristics of the lungs. J. Appl. Physiol. 19, 97-104 (1963).
- Balakrishna, S., et al. Environmentally persistent free radicals induce airway hyperresponsiveness in neonatal rat lungs. Particle Fibre Tox. 8, 11 (2011).
- Fahmy, B., et al. In vitro and in vivo assessment of pulmonary risk associated with exposure to combustion generated fine particles. Environ. Toxicol. Pharmacol. 29, 173 (2010).
- Duguet, A., et al. Bronchial responsiveness among inbred mouse strains. Role of airway smooth-muscle shortening velocity. Am. J. Respir. Crit. Care Med. 161, 839-848 (2000).
- Bozanich, E. M., et al. Developmental changes in airway and tissue mechanics in mice. J. Appl. Physiol. 99, 108-113 (2005).
- Schwartz, B. L., et al. Effects of central airway shunting on the mechanical impedance of the mouse lung. Ann. Biomed. Eng. 39, 497-507 (2011).
- De Vleeschauwer, S. I., et al. Repeated invasive lung function measurements in intubated mice: an approach for longitudinal lung research. Lab Anim. 45, 81-89 (2011).
- Takubo, Y., et al. α1-Antitrypsin determines the pattern of emphysema and function in tobacco smoke-exposed mice. Am. J. Respir. Crit. Care Med. 166, 1596-1603 (2002).
- Salerno, F. G., et al. Effect of PEEP on induced constriction is enhanced in decorin-deficient mice. Am. J. Physiol. Lung Cell Mol. Physiol. 293, L1111-L1117 (2007).
- Therien, A. G., et al. Adenovirus IL-13-induced airway disease in mice. Am. J. Respir. Cell. Mol. Biol. 39, 26-35 (2008).
- Bates, J. H. T., Cojocaru, A., Lundblad, L. K. A. Bronchodilatory effect of deep inspiration on the dynamics of bronchoconstriction in mice. J. Appl. Physiol. 103, 1696-1705 (2007).
- Wagers, S. S., et al. Intrinsic and antigen-induced airway hyperresponsiveness are the result of diverse physiological mechanisms. J. Appl. Physiol. 102, 221-230 (2007).
- Collins, R. A., Sly, P. D., Turner, D. J., Herbert, C., Kumar, R. K. Site of inflammation influences site of hyperresponsiveness in experimental asthma. Respir. Physiol. Neurobiol. 139, 51-61 (2003).
- Bishai, J. M., Mitzner, W. Effect of severe calorie restriction on the lung in two strains of mice. Am. J. Physiol. Lung Cell Mol. Physiol. 295, L356-L362 (2008).
- Song, W., et al. Postexposure administration of β2-agonist decreases chlorine-induced airway hyperreactivity in mice. Am. J. Respir. Crit. Care Med. 45, 88-94 (2011).
- Hirota, J. A., Ellis, R., Inman, M. D. Regional differences in the pattern of airway remodeling following chronic allergen exposure in mice. Respir. Res. 7, 120 (2006).
- Llop-Guevara, A., et al. In vivo-to-in silico iterations to investigate aeroallergen-host interactions. PloS ONE. 3, e2426 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon