Method Article
Une procédure de dépistage chimique pour les glucocorticoïdes de signalisation avec un système de Reporter poisson zèbre Larve luciférase
Dans cet article
Résumé
Nous décrivons la procédure et l'analyse des données d'un système de criblage chimique pour glucocorticoïdes signalisation de l'hormone du stress en utilisant des larves de poisson zèbre: le Responsive essai glucocorticoïdes in vivo poisson zèbre luciférase activité (grizly). Le test sensible et spécifique détecte effets sur la signalisation des glucocorticoïdes par des composés qui nécessitent métabolisation ou affectent la production de glucocorticoïdes endogènes.
Résumé
Glucocorticoïdes hormones de stress et leurs dérivés artificiels sont largement utilisés des médicaments pour traiter l'inflammation, mais le traitement à long terme par des glucocorticoïdes peuvent entraîner des effets secondaires graves. Les systèmes d'essai sont nécessaires à la recherche de nouveaux composés qui influencent la signalisation des glucocorticoïdes in vivo ou pour déterminer les effets indésirables des composés sur la voie de signalisation des glucocorticoïdes. Nous avons mis en place un test de poisson zèbre transgénique qui permet la mesure de l'activité de signalisation des glucocorticoïdes in vivo et en temps réel, l'analyse grizly (glucocorticoïdes sensible in vivo poisson zèbre luciférase activité). Le dosage à base de luciférase détecte effets sur la signalisation des glucocorticoïdes avec une grande sensibilité et spécificité, y compris les effets de composés qui nécessitent métabolisation ou affectent la production de glucocorticoïdes endogènes. Nous présentons ici un protocole détaillé pour la réalisation d'écrans chimiques avec ce dosage. Nous décrivons l'acquisition de données, la normalisation, etanalyse, en plaçant l'accent sur le contrôle de la qualité et de visualisation de données. Le test fournit une lecture simple, résolue dans le temps, et quantitative. Il peut être utilisé comme une plate-forme autonome, mais est également facile à intégrer dans les flux de travail de criblage à haut débit. Il permet en outre de nombreuses applications au-delà de criblage chimique, telles que la surveillance de l'environnement des perturbateurs endocriniens ou recherche sur le stress.
Introduction
Les glucocorticoïdes (GCS) sont des hormones stéroïdes produites par les glandes surrénales qui jouent un rôle important au cours de la réponse au stress et à la régulation du métabolisme 1. GC lier les récepteurs glucocorticoïdes cytoplasmiques (GRS) de la superfamille des récepteurs nucléaires qui, lors de la liaison, la translocation dans le noyau 2. Ici, ils peuvent par exemple réprimer la transcription en interférant avec d'autres facteurs de transcription (de transrépression) ou activer la transcription des gènes par des éléments de réponse aux glucocorticoïdes (grès, transactivation). En raison de leurs propriétés anti-inflammatoires, les GC à la fois naturels et artificiels sont largement utilisés médicaments dans le traitement de nombreuses maladies telles que l'asthme ou l'arthrite 3. Toutefois, en particulier l'utilisation à long terme de GC peut conduire à des effets secondaires graves, y compris le diabète et le glaucome 4. Par conséquent, de nouveaux composés ciblant la signalisation avec l'efficacité du traitement potentiellement plus bénéfique et la tolérabilité GC sont très recherchés à l'arrièreer. Surtout, les effets observés ligand dans les cellules cultivées peuvent différer de celles observées in vivo 5. De tels effets peuvent fausser les résultats obtenus avec la culture de cellules classique à base des essais de criblage pharmaceutique. Chimique criblage in vivo comme activée par le modèle de poisson zèbre est récemment entré en discussion, car elle permet la détermination des effets non détectables en culture cellulaire 6,7.
Voies de signalisation hormonales peuvent également être affectés par les polluants environnementaux. Dits perturbateurs endocriniens (PE) affectent divers processus d'hormones réglementé 8. Ainsi, la reproduction et de la différenciation sexuelle d'organismes aquatiques peuvent être modulées par des substances ayant des activités semblables à l'œstrogène. Récemment, des inquiétudes ont été soulevées que les troubles métaboliques peuvent être liés aux perturbateurs endocriniens dans l'environnement 9. Une voie visé par cette "perturbation métabolique" est la voie des glucocorticoïdes, qui a également été impliqué dans la xénotransplantationbiotiques effets sur le développement et la fonction immunitaire 10,11. Cependant, par rapport à la grande quantité d'informations disponibles sur les composés interférant avec stéroïdes sexuels action des hormones, on sait relativement peu sur les effets de perturbation du système endocrinien médiation par le GR. Par conséquent, il faut des outils qui permettent la surveillance des effets des polluants sur la signalisation de GC in vivo.
Le poisson zèbre a longtemps été un modèle populaire en biologie du développement et a plus récemment attiré des chercheurs d'autres domaines, y compris l'endocrinologie 12. En comparaison avec d'autres poissons téléostéens, le système de signalisation de GC de poisson-zèbre est plus semblable à celle des mammifères, puisque le génome du poisson zèbre ne contient qu'un seul gène GR par opposition aux récepteurs dupliqués dans de nombreuses autres espèces de poisson de 13 à 15. En outre, l'axe hypothalamo-hypophyso-surrénalien est déjà fonctionnel dans 5 jours vieux larves de poisson zèbre, qui augmentent la production de GC endogène en réponse à des facteurs de stress 14,16-18.
Récemment, nous avons généré une lignée transgénique du poisson zèbre, GRE: Luc, ce qui permet la surveillance de l'activité de signalisation de GC in vivo et en temps réel 18. La ligne porte un gène rapporteur luciférase construction sous le contrôle d'une boîte TATA promoteur minimal et quatre GRE concatemerized (figure 1a). GC bioluminescence induite peut être mesurée à partir seul GRE: Luc larves dans des plaques à 96 puits de la microplaque in vivo sur des périodes de temps prolongées. Ce test de grizly (pour "glucocorticoïdes sensible in vivo poisson zèbre luciférase activité") peut être utilisé dans un certain nombre de domaines de recherche différents, tels que la recherche de stress, surveillance de l'environnement, et les écrans pharmacologiques 18. Nous avons pu détecter l'augmentation endogène de cortisol après un stress osmotique de larves unique et pourrions suivre la maturation de la réponse au cours du développement. En outre, nous pourrions surveiller les effets sur la signalisation de GC de organostanniquess qui nécessitent métabolisation par la larve. Surtout, la ligne a été en mesure de détecter ces effets à des concentrations dans l'environnement. Enfin, dans un écran de pilote du dosage sensible et spécifique détectée composés ayant une activité de GC à partir d'une bibliothèque de produits chimiques, y compris un composé qui stimule la production de cortisol endogène chez les larves. Ici, nous décrivons un protocole détaillé pour les écrans chimiques en utilisant le test grizly.
Protocole
Une. Préparer la dilution de travail de la bibliothèque chimique
Prédiluer les composés de la bibliothèque de médicaments à tester (par exemple, la FDA a approuvé la drogue, ENZO Life Science) en E3 (mM de NaCl 5 mM, KCl 0,17, 0,33 mM de CaCl 2) avec un poste de manipulation de liquide robotisé (par exemple Multiprobe II, 8 aiguilles avec adaptateur de pointe d'élimination, PerkinElmer). Des concentrations appropriées sont par exemple 40 pg / ml dans le DMSO à 3%, mais cela dépend du type de bibliothèque utilisée. Les paramètres Multiprobe II correspondant aux étapes décrites ci-dessous sont indiqués dans le tableau 1. Le protocole décrit dans le tableau permet la préparation de quatre plaques d'aliquotes en parallèle.
- Pipette 10 aliquotes de la bibliothèque de supports (2 mg / ml dans le DMSO) dans des plaques à puits profonds (par exemple, plaque de 96 puits de stockage, ronde Eh bien, 0,8 ml, ABgene). Les colonnes 1 et 12 doivent être laissés vides - ceux-ci reçoivent les contrôles positifs et négatifs au sein de la plaque. i> Distribuer 490 ul de l'E3 avec 1% de DMSO dans les aliquotes préparés de la bibliothèque avec le Multiprobe II. La dilution est effectuée avec des aiguilles fixes sans conseils d'élimination.
- Ajouter 10 ul de DMSO dans la colonne 1 et 10 pi d'une solution 5 mM de dexaméthasone (dans du DMSO) à la colonne 12 en tant que contrôles au sein de la plaque. La concentration de DMSO dans tous les puits est à présent de 3%, la concentration de la dexaméthasone dans les puits de contrôle positif est de 100 uM dans E3 / 3% de DMSO.
- Sceller la plaque avec résistant DMSO feuilles d'étanchéité adhésives. Stocker les plaques à -80 ° C jusqu'à utilisation.
2. Elevage de poissons Reporter
Recueillir des embryons de reproduction naturelle des accouplements de groupe entre GRE: poissons Luc transgénique. Levez embryons (pas plus de 60) dans 9 cm des boîtes de Pétri contenant du milieu E3 additionné de 1 mg / ml de bleu de méthylène fongicide jusqu'à 4 jours après la fécondation (DPF) dans un incubateur à 28 ° C. Changer le milieu E3 régulièrement.
titre "> 3. Préparation de la luciférase moyenne (E3L)Préparer une solution aqueuse luciférine du stock de 50 mM en ajoutant dH 2 O dans le flacon contenant la poudre de luciférine. Cette solution stock peut être conservé à -80 ° C pendant plusieurs mois. Diluer la luciférine actions dans le milieu E3 à une concentration finale de 0,5 mM pour obtenir milieu E3L.
4. Distribuer larves en plaques à 96 puits
- Préparer une conseils ml de pipette à large trou en coupant environ 5 mm de la pointe et brièvement enflammé les bords tranchants.
- Piscine larves de plusieurs croisements en les versant avec précaution dans les boîtes de Pétri dans un bécher. Récolte environ 50 larves à la fois en les versant doucement sur un tamis (taille de pore de diamètre 0,25 mm) et placer immédiatement le tamis dans une petite boîte de Pétri (diamètre 5,5 cm) remplie avec du milieu E3L.
- Avec une pointe de pipette alésage large, transférer 225 pi de milieu contenant une larve chacun des puits d'une blanchePlaque de 96 puits (OptiPlate, PerkinElmer).
- Sceller les plaques avec des feuilles d'étanchéité adhésif (par exemple TopSeal-A, PerkinElmer) et incuber à 28 ° C pendant la nuit. Cette pré-incubation empêche l'enregistrement des changements transitoires de la bioluminescence immédiatement après l'addition de luciférine, un phénomène qui se produit également dans des cellules cultivées 19.
5. Traitement de la toxicomanie
- Retirer la plaque contenant la dilution de travail de la bibliothèque de l'-80 ° C congélateur environ 4 heures avant de l'utiliser. Vortexer doucement la plaque et la faire tourner dans une centrifugeuse pour collecter le liquide au bas de la plaque brièvement.
- Retirer feuilles adhésives d'étanchéité des plaques de larves.
- Avec un dispositif de pipetage à 96 canaux à commande manuelle (par exemple, liquidateur, Steinbrenner) pipette la solution de drogue de haut en bas 3 fois. Puis aliquote de 25 ul de la dilution de travail de la bibliothèque chimique dans les puits contenant les larves (à l'exemple ci-dessus, cettese traduit par une concentration finale de 4 ug / ml dans E3 avec 0,3% de DMSO). Préparer 10 (minimum: 5) plaques de réplique de larves par boîte bibliothèque.
- Sceller les plaques avec les feuilles d'étanchéité adhésifs et étiqueter chaque plaque avec une étiquette code à barres.
6. Luminescence enregistrement
- Mettez les plaques contenant les larves dans les unités d'empilage d'un lecteur de bioluminescence EnVision avec une sensibilité accrue de luminescence (PerkinElmer). Vous pouvez également utiliser un système d'incubateur robotisée tels que ceux utilisés pour les systèmes de dépistage de culture de cellules de mammifères en combinaison avec le lecteur.
- bioluminescence d'enregistrement pendant deux jours à l'aide de paramètres du lecteur analogues à ceux décrits dans le tableau 2 pour le lecteur EnVision. Adapter le nombre de répétitions de l'essai pour le nombre de plaques dans la course pour correspondre à la durée de fonctionnement requis.
- Après la fin de la course, vérifier les plaques de la présence de larves mortes pour évaluer la toxicité générale de l'échantillonles plaies.
7. Analyse des données
Tout l'analyse des données est réalisée dans l'environnement de programmation statistique R en utilisant des scripts.
- Calcul ASC
Afin d'identifier des composés d'activation de signalisation indépendamment de leurs propriétés cinétiques GC, déterminer l'aire sous la courbe (ASC) des traces de luminescence enregistrés (bioluminescence des chiffres bruts en fonction du temps) que le paramètre de dépistage. ASC sont estimés avec la règle du trapèze (voir les figures 2a et a '). - Normalisation
Connectez-vous transformer les valeurs de l'ASC afin d'assurer une normalité plus élevé des données (figures 2b et b '). Puis normaliser les journaux transformé les valeurs d'AUC pour chaque plaque bibliothèque avec la méthode Z-score robuste (voir 20). Cette normalisation résulte en des valeurs représentant le nombre d'écarts types à partir de la médiane de tous les points de données. De cette manière,des erreurs systématiques, tels que la variabilité inter-exécution, sont retirées des données. Les données peuvent maintenant être visualisées en traçant la robuste Z-score moyen des répliques pour chaque puits (figures 2c et c '). - indicateurs de qualité
- Heatmap
Afin de visualiser les effets de plaque liées, tracer les données de chaque plaque comme une carte thermique, par exemple en utilisant la fonction de heatmap.2 du paquet de GPLOT 21. De cette manière, les effets de bord ou composé report peuvent être facilement détectées (par exemple comparer la figure 3a avec 3b). Exclure plaques sous-optimales de l'analyse. - Courbe ROC
Pour déterminer la sensibilité et la spécificité du test, calculer un receiver operating characteristic (ROC), par exemple avec l'aide de l'ensemble de bioconductor ROC 22 en utilisant les valeurs des Z-scores déterminés à 7,2 (figure 3c). Par la suite, déterminer l'ASC de ce curve. Une valeur proche de 1 ASC est un gage de sensibilité et la spécificité du test.
- Heatmap
- Hit identification
Pour optimiser la valeur limite pour l'identification des composés actifs, déterminer l'indice de Youden. Pour calculer l'indice, il faut soustraire le taux de vrais positifs estimée (TPR) à partir du taux de faux positifs (FPR) de la courbe ROC pour augmenter Z-scores valeurs seuil robustes. Prenez le robuste Z-score de l'indice de Youden plus élevé (TPR moins FPR) comme le point de coupure. La TPR / FPR peut être estimée par la détection de puits témoins positifs ou des substances actives connues au sein de la bibliothèque. Lorsque vous utilisez le contrôle positif puits s'assurer qu'ils correspondent à la force de succès attendu.
8. Un nouvel essai
- Réévaluer les composés de vie positifs en traitant les larves avec des dilutions en série des composés obtenus à partir d'un fournisseur différent, en utilisant le même enregistrement mis en place décrite ci-dessus. Les vrais résultats devraient induire une luminescencelso dans cet essai, idéalement d'une manière dépendante de la dose.
Résultats
Dans une publication précédente 18, nous avons criblé une bibliothèque de 640 médicaments approuvés par la FDA dans un écran de pilote pour évaluer la performance de l'essai grizly. Cette bibliothèque contient 12 bona fide GC, permettant ainsi de déterminer les mesures de qualité pour la sensibilité et la spécificité du test.
La figure 2 montre des exemples typiques de l'analyse des données brutes et la normalisation prise depuis cet écran. Un résultat typique à partir d'un contrôle de la dexaméthasone et est représenté sur la figure 2a, illustrant les informations temporelles fournies par les données. Un pic de bioluminescence qui se produit à environ 12 heures après le traitement diminue lentement au cours de la suite de 36 h de mesure. Figure 2a 'met en évidence l'approximation de la valeur AUC moyen de la méthode trapézoïdale. Ce calcul est effectué pour tous les puits et chaque répétition technique. Le résultat de la transformation logarithmique est représenté sur les figures 2b </ Strong> et b '. Voici la moyenne des contrôles positifs sont tracés dans un complot de QQ normal. Identifiant transformation conduit à un plus grand rapprochement des points de données à des valeurs théoriques normalement distribuées indiquées par les diagonales rouges. Une transformation d'atteindre la normalité des données augmente la puissance statistique des analyses ultérieures. Enfin, les figures 2c et 2c 'montrent l'effet de robuste Z-score normalisation sur la variabilité de plaque à plaque: Les différentes valeurs de référence obtenues avec différentes plaques (figure 2c) sont normalisés dans l'intrigue robuste Z-score à la figure 2c.
Les valeurs des Z-scores robustes peuvent être utilisés pour identifier les erreurs systématiques dans les données en visualisant la distribution des résultats à travers les plaques. Figure 3a montre un exemple d'une carte thermique d'une plaque bibliothèque, dans laquelle le solide Z-score values sont tracées code couleur dans les positions de puits. On identifie facilement la colonne 12 avec les contrôles positifs dans la plaque. Composés de la banque de pointage positifs sont observés dans F8 et ainsi, bien que plus faible, E2. Figure 3b montre une plaque dans laquelle une erreur systématique est présent. On observe une série de composés avec des valeurs décroissantes Z-score dans les rangées A et E sur plusieurs colonnes. Aucun des composés dans ces puits a été testé positif dans la ré-essai. Etant donné que les puits avec cette activité de test Grizly décroissante sont placés le long du trajet du robot de pipetage prend aliquotage lorsque les plaques de la bibliothèque, ce modèle est indicative d'un transfert à un composé de positif pendant le processus de pipetage automatique.
Le robuste Z-score normalisation ainsi que la présence de GC connus dans la bibliothèque nous a également permis de calculer un récepteur fonctionnant (ROC) courbe caractéristique pour l'écran 18. Figure 3c montre un graphique de la estiaccouplés taux de vrais positifs contre le taux de faux positifs estimé pour les différents Z-scores valeurs seuil robustes. Le taux de vrais positifs estimé est défini comme le pourcentage de vrais résultats positifs (en l'occurrence, les glucocorticoïdes connus présents dans la bibliothèque) qui se trouvent à un Z-score valeur de coupure robuste donnée. Le taux de faux positifs estimé correspondant indique le pourcentage de composés non-positifs frappé à cette valeur seuil. L'AUC de cette courbe est de 0,95, ce qui indique une haute sensibilité et la spécificité de l'écran et une excellente performance du test. La courbe AUC a également été utilisé pour estimer la valeur de seuil optimal pour l'identification de toucher de calcul de l'indice de Youden pour différents Z-scores solides. Nous avons identifié le robuste Z-score de 1,49 comme ayant l'indice le plus élevé Youden. Cette valeur seuil est indiqué sur la figure 2c 'comme une ligne noire séparant les résultats de la majeure partie des composés.
Dans notre écran18, nous avons été en mesure d'identifier GC presque tous connus présents dans la bibliothèque. Seulement trois des 12 GC de bonne foi n'ont pas été détectés. Dans le cas de l'acétate de mélengestrol, il s'agissait d'un résultat négatif faux, car ce composé a été testé positif dans la ré-essai, à une concentration plus élevée que celle utilisée dans la bibliothèque. Les deux autres GC étaient négatifs aussi dans le re-test. Corticostérone est le principal GC chez les rongeurs, mais pas chez les poissons ou les humains 1, tandis que la prednisone promédicament pourrait pas être ainsi transformé par métabolisme par le système larvaire. Il est intéressant, également deux médicaments non annotées comme CG ont été identifiés dans l'écran, dont on ne pouvait pas être confirmée dans le re-test (spironolactone, un antagoniste du récepteur minéralocorticoïde). L'autre composé, la prégnénolone, est un précurseur dans la biosynthèse des stéroïdes, qui est converti en cortisol par la glande surrénale. En effet, le traitement par la prégnénolone stimule la production de cortisol chez les larves 18. Tous ces résultats confirment la grande performance de l'essai: un seul faux négatif et un composé de faux positifs ont été parmi les résultats de l'écran principal, et 10 des 11 composés confirmés avec signalisation de GC activité de stimulation ont été déjà identifiée dans l'écran principal.
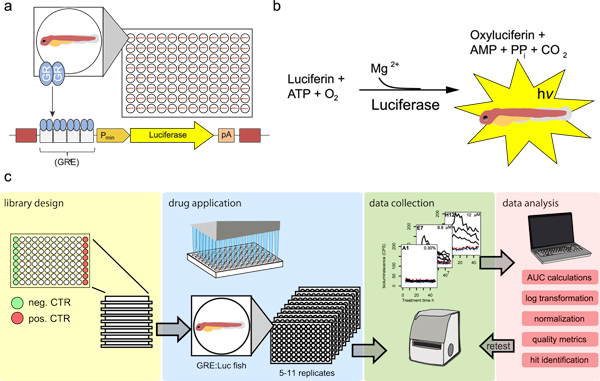
Figure 1. Principe général de l'essai et le flux de travail de la procédure de dépistage. A) Schéma de l'essai grizly construction de rapporteur. Luciférase (jaune) l'expression est contrôlée par un promoteur minimal (P min, orange) et quatre éléments GRE concatemerized ((GRE) 4, blanc), qui sont liés par des homodimères GR activés par des ligands (GR, bleu). Les cases rouges indiquent les sites de transposase Tol2 qui facilitent l'intégration de la construction dans le génome. La boîte rose représente un site de polyadénylation (pA). Larves transgénique portant ce contextestruct sont placés dans des plaques opaques à 96 puits de la microplaque pour les mesures de bioluminescence. b) Schéma de la réaction de la luciférase. La luciférase catalyse l'oxydation de la luciférine à oxyluciférine, ce qui conduit à l'émission de lumière (de hv). La réaction nécessite également de l'ATP et de Mg 2 +, qui est fourni par la larve. PP i, pyrophosphate. C) Flux de travail de l'écran. Travail d'dilutions sont préparées à partir d'une bibliothèque approuvé par la FDA des médicaments plaques à 96 puits, une colonne contenant un négatif dans la plaque de contrôle (DMSO seulement, vert) et une colonne contenant un contrôle positif (dexaméthasone, rouge) (conception bibliothèque). GRE: larves Luc sont répartis dans des plaques 96 puits (5-11 répétitions) et traitée avec les composés de la banque (application de la drogue). traces de bioluminescence sont enregistrés avec un lecteur de bioluminescence pour deux jours (collecte de données). traces de bioluminescence sont intégrés (calculs AUC), une transformation logarithmique et robuste Z-score normalisé (normalition). Les données normalisées sont utilisées pour déterminer des métriques de qualité et pour l'identification de toucher (analyse de données). Résultats choisis sont testés de nouveau pour l'activité dépendante de la dose dans l'essai (retest). Cliquez ici pour agrandir la figure .
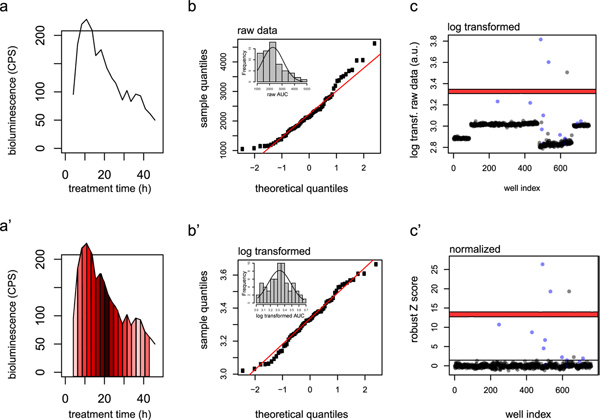
Figure 2. L'analyse des données illustré par les données d'un écran d'un approuvé par la FDA bibliothèque de médicaments. a) trace représentative d'un contrôle positif bien. a ') L'aire sous la courbe (AUC) est calculée selon la règle du trapèze. Les trapèzes utilisés pour le calcul sont présentés dans différentes nuances de rouge. B) QQ plot normale des valeurs premières de l'ASC de puits de contrôle positif (axe des y) vs une population axe x standard normal () avant transformation logarithmique. B ' ) QQ plot normale des valeurs de l'ASC après transformation logarithmique. Une distribution normale est indiquée par la linéarité des points de données de transformation logarithmique. C) Terrain de transformation logarithmique des données brutes pour tous les composés testés dans l'écran. Bleu, de bonne foi glucocorticoïdes;. Gris, tous les autres composés c ') Terrain de données d'écran après robuste Z-score normalisation. Les erreurs systématiques tels que les variations inter-plaques ont été retirées des données. Les lignes rouges indiquent la moyenne ± sem des contrôles positifs au sein de la plaque. La ligne noire: frapper valeur de coupure identification tel que déterminé par Youden indice optimisation (Figure 3). Reproduit avec la permission de 14, 2012 ACS. Cliquez ici pour agrandir la figure .
0439fig3.jpg "/>
Résultats Figure 3. D'écran. a) Zone de jeu de résultats à l'écran. Valeurs des Z-scores solides de composés de la banque sont tracées dans les positions respectives ainsi. Les contrôles positifs dans la colonne 12 ainsi que les deux composés de vie dans les puits positifs F8 et E2 sont visibles. B) Zone de jeu d'une plaque montrant report d'un composé positive au cours de la préparation de bibliothèque avec un robot de pipetage. Un gradient d'activité est visible le long du trajet de pipetage pris par le robot. C) Récepteur d'exploitation ROC) la courbe caractéristique (pour l'écran. Les taux réels estimés positifs (axe des y gauche) et taux de faux positifs (axe des x) sont tracées pour des valeurs croissantes de coupure des Z-scores robustes (code couleur, l'axe y de droite). La valeur AUC de la courbe obtenue est proche de 1, ce qui indique une bonne performance du test. Composés reproduit avec la permission de 14, 2012 ACS. D) Tableau montrant actif (Yellow) ou inactif (bleu) dans l'écran principal (prim.) ou dans le retest. glucocorticoïdes de bonne foi n'ont pas toujours été à nouveau testés (blanc). Redessiné avec la permission de 14, 2012 ACS. Cliquez ici pour agrandir la figure .
| Paramètres généraux: | |||
| Etape 1.1 | |||
| Procédure | Type: | liquide unique | |
| Mode: | éteindre | ||
| dispense par aspiration: | 1 | ||
| optimiser la vitesse: | Oui | ||
| entrefers système: | 10 pl | ||
| transports: | 0 | ||
| Rincer / Wash | Aucun | ||
| Aspirer | Type d'établissement | Valeur | remarques |
| Position | B7, B10, B13, B16 | ||
| Aspirer Vol. | 10 pl | ||
| Vitesse | 200 pl / s | ||
| Suivi liquide | 60% | ||
| Aspirer Hauteur | Labware défaut | 22.28 | |
| Dispenser | Type d'établissement | Valeur | remarques |
| Positions | D7, D10, D13, D16 | ||
| Distribuer Vol. | 10 pl | ||
| Vitesse | 200 pl / s | ||
| Suivi liquide | 100 pl | ||
| Distribuer Hauteur | Labware défaut | 17.01 | |
| Etape 1.2 | |||
| Procédure | Type: | réactif | |
| Mode: | déchets | ||
| dispense par aspiration: | 3 | ||
| optimiser la vitesse: | Oui | ||
| entrefers système: | 15 pi | ||
| transports: | 0 | ||
| Rincer / Wash | Aucun | ||
| Aspirer | Type d'établissement | Valeur | remarques |
| Position | A4 | ||
| Aspirer Vol. | 3 x 490 pi | ||
| Surverses | 15 et 0 | ||
| Vitesse | 200 pl / s | ||
| Suivi liquide | 400% | ||
| Aspirer Hauteur | Surface du liquide | ||
| Dispenser | Type de s ise | Valeur | remarques |
| Position | D7, D10, D13, D16 | ||
| Distribuer Vol. | 490 pi | ||
| Surverses | 15 et 0 | ||
| Vitesse | 200 pl / s | ||
| Suivi liquide | 100% | ||
| Distribuer Hauteur | Labware défaut | 17.01 | |
Tableau 1. Réglages pour Multiprobe II. L'protocole dans le tableau 1 décrit la préparation de 4 plaques (chacune 96 puits). Les plaques sont situées sur des adaptateurs de plaque dans la zone de travail à des positions spécifiées par le robot (par exemple, B7, B10, B13, B16).
1 "fo: keep-together.within page =" always "> Paramètres généraux: Nombre de répétitions de l'essai dépend de la longueur de la course Nombre de plaques illimité Contrôle de la température 28 ° C Protocole Calculs US Lum 96 (cps) lire Mesure du temps 2,5 sec correction de diaphonie Distance entre la plaque et le détecteur 0 mm Glow (CT2) facteur de correction 0% contenu »> Tableau 2. paramètres de Envision utilisés pour l'écran.Discussion
Nous présentons ici le flux de travail et l'analyse de données pour un écran chimique mesurer l'activité de GC in vivo en utilisant le test de grizly 18. Le test a des caractéristiques de contrôle de la qualité et des mesures de rendement qui sont comparables avec des écrans à base de cellules classiques, un avantage important pour son utilisation dans des contextes à haut débit. En outre, cependant, le test in vivo détecte également des composés qui ne sont pas accessibles aux écrans in vitro. Ceci est illustré par la présence de la prégnénolone de prohormone parmi les résultats. Ainsi, le dosage grizly étend le champ d'écrans destinés à l'activité de signalisation de GC.
L'importance de la détection des effets in vivo avec notre test est également illustré par les résultats que nous avons obtenus avec l'polluants organostanniques DBT et TBT 18. DBT, mais pas OTC, a été montré pour inhiber la signalisation en GC dans la culture de cellules de mammifères, et on observe la même dans les cultures de cellules de poisson zèbre exprimerment le GRE: Luc journaliste. Fait important, toutefois, dans le dosage Grizly, OTC a montré une activité inhibitrice sur la voie de GC, comme il peut être converti en DBT par le métabolisme des larves. Cette inhibition a déjà été observée à des concentrations dans l'environnement de TBT. Ces résultats illustrent le potentiel du dosage Grizly à détecter des effets de composés à base de inter-organes de diaphonie et métaboliques des modifications des composés à l'animal vivant. Ils mettent également en évidence le potentiel du test grizly surveillance de l'environnement de l'application. Ainsi, les effets perturbateurs endocriniens peuvent être étudiées au niveau de la signalisation du récepteur, où le dispositif disruptif interfère avec l'activité de signalisation de GC induite par un agoniste de GR tel que la dexaméthasone. Une autre possibilité est d'étudier les effets de composés sur la synthèse de prégnénolone GC-stimulé. La qualité à haut débit de l'essai doit permettre le criblage rapide des bibliothèques d'échantillons de l'environnement.
L'utilisation de la luciférase comme argène eporter permet une gamme dynamique élevée de détection de l'activité de signalisation 23. En effet, la sensibilité du test permet de détecter osmotique production de GC induite par le stress de larves unique 18. La haute résolution temporelle obtenue avec le rapporteur de la luciférase nous permet de suivre les activités de signalisation au cours du temps, ce qui permet d'analyser la cinétique des données.
Un inconvénient potentiel pour certaines applications est l'aptitude limitée à la surveillance spatiale de ce système rapporteur. Systèmes rapporteurs fluorescents pourraient être mieux adaptés pour les tests qui nécessitent une surveillance de certaines régions de la larve. Cependant, de tels dosages peuvent souffrir de sensibilités plus faibles en raison des effets de fond provoqués par la lumière d'excitation, ce qui pose également des limites à la détection de composés fluorescents. En outre, ils peuvent fournir une résolution inférieure en raison de la cinétique de la stabilité généralement supérieure de 23 protéines fluorescentes.En outre, ils présentent des défis en termes de matériel d'imagerie, l'analyse des données et le stockage de données qui pourraient limiter leur utilisation à des laboratoires de recherche plus petits.
La mise en place de l'essai grizly comme un test basé sur microplaque permet une intégration facile dans les workflows de dépistage typiques. Le dosage est facilement applicable également dans les petits laboratoires de recherche en raison de sa manipulation simple et l'analyse des données. Dans le même temps, il permet d'une part importante de l'automatisation, par exemple automatisée application du médicament par pipetage ou la distribution automatique des robots d'embryons d'embryons par des dispositifs de tri 24,25. La lecture simple ne nécessite pas de microscopes automatisés de dépistage ou des logiciels d'analyse d'image sophistiqué, mais fournit un riche ensemble de données sur les aspects temporels et quantitatifs de la voie de signalisation de l'étude.
En résumé, nous présentons un protocole étape par étape pour un test de criblage chimique relativement peu coûteux, robuste et facile à manipuler pour GCsignalisation de l'activité in vivo et en temps réel. Le test permet de déterminer in vivo les effets des composés sur la GC signalisation non détectable dans la culture de cellules sur la base des dosages. Parmi les nombreuses applications pour l'analyse sont par exemple la détermination des effets génétiques sur la signalisation des glucocorticoïdes, le suivi environnemental des effets des perturbateurs endocriniens sur la synthèse des glucocorticoïdes et de l'activité de signalisation, et le criblage de composés pour des effets indésirables sur la signalisation de GC ou de roman dans modulateurs in vivo de cette voie de signalisation importante.
Déclarations de divulgation
Nous n'avons rien à communiquer.
Remerciements
Nous remercions S. Burkhart, C. Hofmann et Simone Gräßle pour une excellente assistance technique et nous sommes reconnaissants à M. Ferg de l'aide à l'analyse des données. Nous remercions également S. Rastegar des commentaires critiques sur le manuscrit. Nous reconnaissons le financement par le Studienstiftung des deutschen Volkes (à MW), la DFG (DI913/4-1) et les Biointerfaces Programme Helmholtz à KIT.
matériels
| Name | Company | Catalog Number | Comments |
| Buffer composition + reagents | |||
| Dimethyl sulphoxide (DMSO) | Carl Roth GmbH Co KG | A994.2 | |
| FDA approved drug library | Enzo Life Sciences | BML-2841-0100 | |
| Luciferin | Biosynth | L-8220 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Methylene Blue | Sigma-Aldrich | M9140 | |
| E3 | N/A | N/A | 5 mM NaCl, 0.17 mM KCl, 0.33 mM CaCl2 |
| Instruments | |||
| Multiprobe II | PerkinElmer | 8 channel, equipped with disposable tip adaptor | |
| Liquidator 96 | Steinbrenner Laborsysteme | hand-operated 96-channel pipette | |
| EnVision XCite Multilabel Plate Reader | PerkinElmer | Equipped with stacker automation, temperature control, barcode reader and enhanced luminescence detector | |
| Plasticware + consumables | |||
| 96-Well Storage Plate | ABgene | AB-0765 | round well, 0.8 ml |
| Cover films, | ratiolab | 6018412 | self adhesive, DMSO resistent |
| Pipette tips | Steinbrenner Laborsysteme | LRF-200L | for liquidator 96, 200 μl, low retention |
| TopSeal-A | PerkinElmer | 6005185 | |
| OptiPlate-96 | PerkinElmer | 6005299 | white opaque 96-well microplate |
| Barcode Labels | PerkinElmer | 1608182 | |
| filtered polypropylene IsoTip pipette tips | Corning | S058.4809 | |
| Animals | |||
| GRE:Luc fish | N/A | ZDB-TGCONSTRCT-120920-1 | available at the European Zebrafish Resource Centre EZRC, Karlsruhe |
Références
- Norris, D. O. Vertebrate Endocrinology. , 4, Elsevier Academic Press. (2007).
- Kassel, O., Herrlich, P. Crosstalk between the glucocorticoid receptor and other transcription factors: molecular aspects. Mol Cell Endocrinol. 275, 13-29 (2007).
- Baschant, U., Tuckermann, J. The role of the glucocorticoid receptor in inflammation and immunity. J Steroid Biochem Mol Biol. 120, 69-75 (2010).
- Schacke, H., Docke, W. D., Asadullah, K. Mechanisms involved in the side effects of glucocorticoids. Pharmacol Ther. 96, 23-43 (2002).
- De Bosscher, K. Selective Glucocorticoid Receptor modulators. J Steroid Biochem Mol Biol. 120, 96-104 (2010).
- Kaufman, C. K., White, R. M., Zon, L. Chemical genetic screening in the zebrafish embryo. Nat Protoc. 4, 1422-1432 (2009).
- Peal, D. S., Peterson, R. T., Milan, D. Small molecule screening in zebrafish. J Cardiovasc Transl Res. 3, 454-460 (2010).
- Casals-Casas, C., Desvergne, B. Endocrine disruptors: from endocrine to metabolic disruption. Annu Rev Physiol. 73, 135-162 (2011).
- Grun, F., Blumberg, B. Minireview: the case for obesogens. Mol Endocrinol. 23, 1127-1134 (2009).
- Odermatt, A., Gumy, C., Atanasov, A. G., Dzyakanchuk, A. A. Disruption of glucocorticoid action by environmental chemicals: potential mechanisms and relevance. J Steroid Biochem Mol Biol. 102, 222-231 (2006).
- Odermatt, A., Gumy, C. Glucocorticoid and mineralocorticoid action: why should we consider influences by environmental chemicals. Biochem Pharmacol. 76, 1184-1193 (2008).
- Lohr, H., Hammerschmidt, M. Zebrafish in endocrine systems: recent advances and implications for human disease. Annu Rev Physiol. 73, 183-211 (2011).
- Schaaf, M. J. Discovery of a functional glucocorticoid receptor beta-isoform in zebrafish. Endocrinology. 149, 1591-1599 (2008).
- Schaaf, M. J., Chatzopoulou, A., Spaink, H. P. The zebrafish as a model system for glucocorticoid receptor research. Comp Biochem Physiol A Mol Integr Physiol. 153, 75-82 (2009).
- Alsop, D., Vijayan, M. The zebrafish stress axis: molecular fallout from the teleost-specific genome duplication event. Gen Comp Endocrinol. 161, 62-66 (2009).
- Alsop, D., Vijayan, M. M. Molecular programming of the corticosteroid stress axis during zebrafish development. Comp Biochem Physiol A Mol Integr Physiol. 153, 49-54 (2009).
- Schoonheim, P. J., Chatzopoulou, A., Schaaf, M. J. The zebrafish as an in vivo model system for glucocorticoid resistance. Steroids. 75, 918-925 (2010).
- Weger, B. D., Weger, M., Nusser, M., Brenner-Weiss, G., Dickmeis, T. A Chemical Screening System for Glucocorticoid Stress Hormone Signaling in an Intact Vertebrate. ACS Chem Biol. 7, (2012).
- Hirota, T. A chemical biology approach reveals period shortening of the mammalian circadian clock by specific inhibition of GSK-3beta. Proc Natl Acad Sci U S A. 105, 20746-20751 (2008).
- Birmingham, A. Statistical methods for analysis of high-throughput RNA interference screens. Nat Methods. 6, 569-575 (2009).
- Warnes, G. R., Bolker, B., Bonebakker, L., Gentleman, R., Liaw, W. H. A. gplots: Various R programming tools for plotting data. 2.11.0, (2012).
- Carey, V., Redestig, H. ROC: utilities for ROC, with uarray focus. , Boston, MA, USA. (2013).
- Fan, F., Wood, K. V. Bioluminescent assays for high-throughput screening. Assay Drug Dev Technol. 5, 127-136 (2007).
- Graf, S. F., Hotzel, S., Liebel, U., Stemmer, A., Knapp, H. F. Image-based fluidic sorting system for automated Zebrafish egg sorting into multiwell plates. J Lab Autom. 16, 105-111 (2011).
- Letamendia, A. Development and validation of an automated high-throughput system for zebrafish in vivo screenings. PLoS ONE. 7, e36690(2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon