Method Article
4D imagerie multimodalité des
Dans cet article
Résumé
Imagerie multi-modalité est une approche intéressante pour l'étude de la colonisation bactérienne dans les petits modèles animaux. Ce protocole décrit l'infection de souris avec bioluminescentes Citrobacter rodentium Et le suivi longitudinal de la colonisation bactérienne en utilisant composite diffuse la lumière tomographie d'imagerie 3D avec l'imagerie μCT pour créer un film 4D C. rodentium Infection.
Résumé
Ce protocole décrit les étapes nécessaires à suivre longitudinalement une infection bactérienne bioluminescence utilisant la lumière composite tomographie d'imagerie diffuse 3D avec μCT intégré (DLIT-μCT) et l'utilisation ultérieure de ces données pour générer une dimensions (4D) film du cycle d'infection quatre. Pour développer les films d'infection 4D et de valider l'imagerie DLIT-μCT pour des études d'infection bactérienne à l'aide d'un spectre CT SIIV, nous avons utilisé l'infection par bioluminescence C. rodentium, ce qui provoque l'auto-limitation de la colite chez la souris. Dans ce protocole, nous décrivons l'infection de souris avec bioluminescente C. rodentium et la surveillance non invasive de la colonisation par le quotidien imagerie DLIT-μCT et le dénombrement des bactéries dans les excréments pendant 8 jours.
L'utilisation du spectre SIIV CT facilite la co-registration transparente des balayages optiques et μCT en utilisant une seule plate-forme d'imagerie. Le μCT modalité à faible dose permet l'imagerie de sourisà plusieurs moments au cours de l'infection, en fournissant la localisation anatomique détaillée de foyers bactérien de bioluminescence en 3D sans causer d'effets secondaires du rayonnement cumulatif. Surtout, les films 4D de souris infectées constituent un outil analytique puissant pour surveiller la dynamique de colonisation bactérienne in vivo.
Introduction
Les petits modèles animaux, en particulier ceux des souris en utilisant, sont couramment utilisées pour étudier la pathogenèse bactérienne ou pour tester des stratégies d'intervention pour les infections, comme les antibiotiques, les probiotiques, les prébiotiques et les vaccins 1-7. Les principales lectures expérimentales de petites infections d'origine animale sont la charge de pathogènes, la localisation spatiale et temporelle de l'infection, et les changements de la réponse immunitaire de l'organisme infecté. Imagerie optique in vivo est un outil précieux pour la recherche sur les maladies infectieuses et peuvent être utilisés pour surveiller multiple lectures expérimentales grâce à l'utilisation de gènes rapporteurs (protéines fluorescentes, la luciférase, la bêta-lactamase, etc), des colorants fluorescents, des nanoparticules ou des sondes chimiluminescentes cible à une protéine, un processus biologique, ou d'un microorganisme 6.
l'imagerie par bioluminescence (BLI) est une modalité d'imagerie optique utilisé pour surveiller la colonisation de petits animaux comme les souris et les rats, par les bac pathogèneria 3,6,8,9. Les souris sont infectées par des bactéries recombinantes exprimant une luciférase, comme l'opéron lux CDABE de Photorhabdus luminescens. Ces bactéries peuvent alors être détectés par leur production de lumière à l'aide d'un capteur CCD sur la base dans le système d'imagerie in vivo 3,6,9. Surtout, seuls les micro-organismes sont métaboliquement actifs bioluminescence (BL), ce qui signifie que des cellules bactériennes viables sont détectés par cette méthode 10,11. Utilisation 2D BLI, l'emplacement de la source BL est déduit à partir de la surface de l'animal, où le signal est émis 8. La localisation anatomique exacte de la BL foyers in vivo doit être déterminée par l'analyse ex vivo des organes 3,6,9 En revanche, composite 3D diffuse la lumière d'imagerie de tomographie (DLIT) peut être utilisée pour compiler une reconstruction 3D quantitative de la BL source 12. DLIT est effectuée par la collecte des images prises à l'aide BL-filtres optiques passe-bande étroits définis etensuite les entrer dans une tomographie optique 3D algorithme de reconstruction diffuse 1,7,12,13.
Actuellement, l'imagerie multi-modalité est la seule méthode disponible pour obtenir la vraie localisation anatomique non-invasive de foyers bioluminescence in vivo sans la nécessité d'une analyse ex vivo. Récemment, nous avons utilisé une combinaison de DLIT co-enregistré avec l'imagerie μCT pour évaluer Citrobacter rodentium (C. rodentium) Les dynamique de colonisation après le traitement prophylactique par une bactérie probiotique 7. C. rodentium est un agent pathogène entérique spécifique murin utilisé pour modéliser l'infection humaine par entéropathogènes et enterhemorrhagic Escherichia coli 14. C. infection rodentium provoque la colite, généralement associée à une légère perte de poids, diarrhée, polarisée réponse immunitaire Th1 et les altérations pathologiques distincts, y compris l'hyperplasie des cryptes du côlon et attachant et effaçant lésion formatile 14. En plus de cela, C. pathogenèse de rodentium a été soigneusement étudiée par BLI et de sa dynamique de colonisation chez les souris C57BL/6J sont bien documentés, faisant de cette bactérie un modèle de micro-organisme idéal pour une utilisation avec la multi-modalité d'imagerie 3,4,7.
Ce protocole est le premier à décrire une méthodologie pour l'imagerie DLIT-μCT intégrée d'une infection bactérienne à l'aide d'une seule plate-forme multimodale d'imagerie, le SIIV Spectrum CT, et la génération d'un film 4D montrant la véritable dynamique de cette infection non invasive.
Protocole
1. Souris Préparation
- Achat ou reproduire assez 18-20 g souris C57BL/6J nécessaires à l'étude.
- Si les souris sont achetés auprès d'un fournisseur externe, après le transport vers l'établissement, habituer souris pour 1 semaine sur la nourriture autoclave et l'eau pour stabiliser le microbiote intestinal.
- Peser, encoche oreille, et séparer le nombre requis de souris par cage.
- Le jour avant l'infection, avant d'effectuer une anesthésie, vérifier qu'il ya suffisamment d'oxygène et d'isoflurane pendant toute la durée de la procédure. Si nécessaire, ajouter plus isofluorane ou remplacer la bouteille d'oxygène. Par la suite, vérifier le poids des charognards anesthésiques, si elles ont gagné plus de 50 g depuis leur première utilisation, jetez-les et remplacez-le par des charognards frais.
- Souris anesthésier l'aide de 3% isofluorane au-8 XGI Anesthésie système et épiler à l'aide VEET pendant 7 min.
- Remarques:
- Épilation complète est essentielle, en particulier danssouris noires comme la mélanine dans la fourrure atténue considérablement le signal de bioluminescence 3,15.
- Epilation des souris dure habituellement 8-10 jours avant la fourrure commence à repousser. Pour effectuer l'imagerie multimodalité 4D sur de longues périodes, épiler souris lorsque cela est nécessaire pour que la zone d'intérêt est nue pour les séances d'imagerie.
- Les souris sont logées dans un niveau de biosécurité 2 (BSL-2) installation de confinement.
2. Préparation de la cellule bactérienne
- Préparer suffisamment Luria Burtani bouillon et gélose additionné de kanamycine [50 pg ml -1] requis pour l'étude et conserver à 4 ° C jusqu'à ce que nécessaire.
- La veille de l'infection décongeler un cryovial de C. souche rodentium ICC180 et immédiatement ajouter un cryobead à 15 bouillon LB ml additionné de kanamycine [50 pg ml -1] et de la culture nuit à 220 rpm, 37 ° C. Comme un contrôle de contamination moyen, préparer un montant supplémentairenon inoculé bouillon LB 15 ml additionné de kanamycine [50 pg ml -1] et de la culture à 220 rpm, 37 ° C.
- Le lendemain matin (~ 16 h), vérifiez le milieu de la turbidité comme un signe de la croissance bactérienne. Si le contrôle est clair, transférer la culture ICC180 à un tube falcon et centrifuger à 4000 rpm. Par la suite, laver le culot bactérien dans du PBS. Puis remettre en suspension dans 1,5 ml de PBS (1/10 ème du volume initial de LB additionné de kanamycine) et bien mélanger pour créer l'inoculum bactérien.
- Pour vérifier que ICC180 a été cultivée correctement et est bioluminescence avant l'infection des souris, l'image de l'inoculum dans le SIIV Spectrum CT utilisant BLI et le réglage automatique de l'assistant Living 4.3.1 image comme décrit précédemment 1.
Remarque:- Strain ICC180 est un dérivé de bioluminescence de type sauvage C. rodentium ICC169 2. Cette souche bactérienne a l'opéron lux CDABE y compris un Kgène de résistance anamycin inséré dans un pseudogène de xylE dans le chromosome 2.
- Effectuer tous culture bactérienne en utilisant des techniques d'asepsie standard et, si nécessaire, soit acheter des consommables / réactifs stériles ou autoclave avant utilisation.
- Dans l'étape 2.4, la lecture de bioluminescence (p / s / cm 2 / sr) peuvent être utilisés pour estimer le nombre de bactéries avant que l'infection de souris.
3. L'infection de souris avec bioluminescentes C. rodentium et de l'évaluation de la colonisation bactérienne
- Avant d'infection, vérifiez que l'oxygène est suffisante et l'isoflurane pendant toute la durée de la procédure. Si nécessaire, ajouter plus isofluorane ou remplacer la bouteille d'oxygène. Par la suite, vérifier le poids des charognards anesthésiques, si elles ont gagné plus de 50 g depuis leur première utilisation, jetez-les et remplacez-le par des charognards frais.
- Souris anesthésier avec 3% isofluorane l'aide d'un XGI-8 anesthéSystem SIA pour fournir retenue humaine.
- Mélanger l'inoculum bactérien à fond et tirer 0,2 ml (environ 5 x 10 9 ufc ICC180) dans la seringue.
- Retirer les souris du système d'anesthésie un à la fois et leur nuque en tenant fermement la peau derrière le cou avec le pouce et l'index.
- Enfoncez l'aiguille gavage vers le toit de la bouche, sur la langue et l'œsophage et injecter l'inoculum bactérien dans l'estomac.
- Après gavage des souris, surveiller leur démarche et la respiration des signes de détresse qui peut être un signe que l'inoculum bactérien a été livré dans les poumons. Euthanasier les souris qui ont été inoculées dans les poumons.
- Souris non infectées par gavage avec 200 pi de PBS comme un contrôle du véhicule, tels que décrits dans les étapes 3.1-3.6.
- Pour confirmer que le gavage oral a été effectuée correctement, images souris infectés et fantaisie dans le SIIV Spectrum CT utilisant BLI et le réglage automatique de la VieAssistant 4.3.1 image comme décrit précédemment 1.
- Déterminer le nombre de bactéries viables dans l'inoculum par dilution en série dans du PBS et de repérer en trois exemplaires sur gélose LB additionné de kanamycine [50 pg ml -1].
- Calculer le nombre de ICC180 ufc / ml en trouvant une dilution où il ya environ colonies 5-50 et compter le nombre de colonies de chaque point à la dilution et d'enregistrer la dilution que les colonies ont été comptées sur. Par la suite, calculer le nombre moyen de ufc (les trois points) et multiplier cette valeur par le facteur de dilution 50 (chaque place est de 20 pi de la ml échantillon initial 1) et la dilution des colonies ont été comptées sur, donnant ufc / ml.
- Surveiller colonisation des souris quotidiens en recueillant des excréments de chaque souris dans un tube Eppendorf de pré-taré (pesées sur une balance fine) et diluer 1/10 dans du PBS par rapport au poids de l'échantillon (0,1 g ml -1).
- Déterminer le nombre de bactéries viables dansles selles par dilution en série dans du PBS et de repérer en trois exemplaires sur gélose LB additionné de kanamycine [50 pg ml -1].
- Calculer le nombre de bactéries viables par gramme de fèces en suivant l'étape 3.9, puis multiplier le nombre d'UFC / ml par le facteur de dilution fécale dans PBS (étape 3.10) de 0,1 g ml -1 pour donner ufc / g.
- Pour déterminer que les souris ont été inoculées avec une culture pure ICC180 et que toutes les colonies sont bioluminescentes. Prenez les plaques d'agar de l'étape 3.8, d'évaluer la morphologie de la colonie bactérienne soit à l'oeil ou choisir une colonie représentant de la plaque et d'analyser par microscopie optique. Si nécessaire, l'identification bactérienne peut être réalisée par déformation colonie PCR spécifique pour évaluer la pureté de la culture. Par la suite, l'image des plaques dans le SIIV Spectrum CT utilisant BLI comme décrit dans l'étape 3.7 et vérifier que 100% des colonies sur la plaque sont bioluminescentes.
Remarques:- Dans l'étape 3.4, lors de l'insertion de l'aiguille gavageSi vous sentez une résistance ne pas forcer l'aiguille gavage, car cela provoque l'inoculum d'aller dans les poumons. Au lieu de cela, ré-insérer l'aiguille et essayez à nouveau doucement.
- Étape 3.1 est facultative et peut être orale souris gavées sans anesthésie en fonction de la politique de bien-être animal instituts.
- Tabourets doivent être étalées le jour où elles sont collectées. C. rodentium va croître même si elle est laissée à 4 ° C pendant la nuit dans du PBS et entraînera la quantification de l'UFC / g selles d'être incorrects.
4. Lumière diffuse tomographie Daily Composite 3D Imaging avec μCT Imaging (DLIT-μCT) des souris infectées
considérations de bien-être animal: DLIT-μCT implique imagerie optique DLIT intégré avec un système rapide, faible dose de rayonnement μCT scan (~ 23 mGy pour un balayage de deux souris, ~ 53 mGy pour un seul balayage de la souris) d'un animal immobilisé. Cette dose s'accumule à chaque séance d'imagerie, de sorte que l'objectif est de maintenir la dose de low que possible (et toujours bien en dessous de la LD 50/30) tout en réalisant l'étude. Dans certains cas, s'il n'y a aucun signe d'infection par un balayage BLI conventionnelle de la souris, le scan μCT peut être évitée afin de réduire davantage la dose. Même si la dose est maintenue aussi faible que possible, dans les études prolongées s'il ya une préoccupation au sujet de l'exposition aux radiations, les souris seront abattus dès les premiers signes de symptômes néfastes ou à la fin de la période d'imagerie μCT.
- Avant d'imagerie, initialiser le SIIV Spectrum CT et vérifier que les verrous de sécurité à rayons X fonctionnent et que la scène est chauffée à la bonne température (37 ° C) pour l'imagerie. Par la suite, vérifier le niveau de isoflourane dans le système d'anesthésie et le poids des charognards anesthésiques. Si nécessaire, ajouter plus isofluorane et si les charognards ont gagné plus de 50 g depuis leur première utilisation, jetez-les et remplacez-le par des charognards frais.
- Mettre en place le spectre CT afin que les paramètres d'imagerieexécuter la fonction d'exposition automatique dans Living 4.3.1 de l'image sont optimisés pour l'imagerie luciférase bactérienne. Choisissez Edition> Préférences> Acquisition et Auto fenêtre d'exposition. Ensuite, sélectionnez> Valeurs Plage> Exp. Temps (secondes) et régler le> Max. à 300. Enfin, sélectionnez> Target Count (minimum)> luminescent et mettre à 10000 points.
- Insérez une plate-forme d'imagerie de la souris dans le spectre CT et d'aplomb dans l'anesthésie.
- Mettez le verrouillage de sécurité à rayons X et initialiser les SIIV.
- Une fois le spectre SIIV CT a été initialisé, anesthésier les souris avec 3% isofluorane l'aide d'un système d'anesthésie XGI-8 de fournir retenue humaine.
- Pour déterminer s'il est nécessaire d'effectuer une analyse DLIT-μCT, pré-image des souris en utilisant BLI comme décrit précédemment 1, en une plate-forme d'imagerie de la souris. Si un signal robuste est obtenu de la souris est adapté pour l'imagerie DLIT. Laissez la souris anesthésiée dans une souris imagerie platform après le scan BLI prêt pour DLIT-μCT.
- Utilisez l'Assistant de l'imagerie dans l'image vivante logiciel 4.3.1 pour mettre en place la numérisation DLIT-μCT. L'Assistant d'imagerie détermine automatiquement le champ de vision, temps d'exposition, F-stop et binning pour le DLIT et le champ de vision, temps d'exposition, jeux de filtres et binning pour l'imagerie μCT à donner le meilleur rapport signal sur bruit. Lorsque vous êtes invité par l'Assistant d'imagerie, ne comporter que le 560, 580, 600 et 620 filtres d'émission nm et sélectionnez l'un balayage μCT de la souris. Ensuite, cliquez> Acquisition de commencer la imagerie.
- Retour de la souris anesthésiée dans sa cage après l'imagerie, retirez la seule plate-forme d'imagerie de la souris à partir du spectre CT et désinfecter en utilisant 1% Tri-gène. Si nécessaire, remplacer la garniture de mousse que la souris est positionné de manière à minimiser le risque de contamination croisée entre les souris.
- souris d'image quotidiens jusqu'à 8 jours après l'infection (PI) à l'aide DLIT-μCT, comme décrit dans les étapes 4.1-4.8, pour générer les données d'imagerie longitudinales nécessaires pour faire un 4D moVie de l'infection.
Remarque:- Dans l'étape 4.7, nous recommandons l'utilisation des filtres d'émission 560-620 nm à l'image bioluminescence bactérienne. Bien que le pic de bioluminescence bactérienne est d'environ 485 nm, par des optiques de tissus (l'atténuation significative des photons bleus / verts par du tissu murin), il est important d'utiliser les photons rouge / orange pour les reconstructions 3D car ils facilitent le calcul de la profondeur du signal .
- Les réglages de l'exposition «auto» dans la vie 4.3.1 image pour DLIT doivent être ajustés pour optimiser la quantité de photons captés et le temps d'imagerie maximale utilisée pour chaque filtre.
- Il est seulement nécessaire d'effectuer l'imagerie pré-BLI décrite dans l'étape 4.6 lorsque le chercheur n'est pas sûr qu'il y ait un signal de bioluminescence détectable, par exemple lors de l'utilisation d'un nouveau modèle d'infection.
5. Reconstruction 3D de DLIT-μCT des données d'imagerie
- Ouvert image vivante logiciel 4.3.1 et sélectionnez>; Recherchez et ouvrez le dossier contenant les fichiers DLIT-μCT.
- Ouvrez le fichier DLIT-μCT dans le Salon Image Browser, par exemple C. rodentium Jour 1 PI en cliquant sur Load.
- Dans la palette d'outils select> Topographie de la surface> de la souris Nude, ajuster le seuil, puis cliquez sur> Générer surface. Si la reconstruction de surface a réussi un contour de la surface sera affiché dans la fenêtre de visualisation 3D.
- Pour consulter l'analyse de μCT rendu dans la fenêtre de vue 3D, masquer le contour de la surface (Cliquez> outils optiques 3D et décochez> Affichage objet surface), ou diminuer l'opacité de la surface (Cliquez> outils optiques 3D et réglez le curseur d'opacité>).
- Pour fournir la localisation anatomique détaillée de la reconstruction DLIT 3D, il est nécessaire de modifier les données volumétriques en 3D (balayage μCT) de sorte que seul squelette de la souris est visible et qu'il a le contraste optimal. Cliquez sur> Outils de multimodalité et l'histogramme 3D select> logarithmique, Gradient éclairage, la qualité et Denoise. Enfin, réglez le curseur histogramme à droite et à regarder les données volumétriques changement contraste 3D. Continuez à ajuster les données jusqu'à ce que les os sont clairement visibles. Si vous le souhaitez, changer la couleur des points de fonction de transfert sur l'histogramme.
- Ensuite, sélectionnez> DLIT reconstruction 3D dans la palette d'outils et assurez-vous que seuls les 560, 580, 600 et 620 nm de jeux de filtres, qui sont nécessaires pour l'imagerie luciférase bactérienne in vivo, ont été sélectionnés. Cliquez sur> Démarrer. Le Preview menu Fenêtre données s'affiche maintenant montrant les signaux BL spectre filtré de la souris qui a été reproduite en 2D. Ces signaux sont automatiquement seuillées par le logiciel, mais peuvent être ajustés manuellement si nécessaire en utilisant les onglets au bas du menu. Le seuil détermine l'intensité minimale des données (représenté comme un pourcentage du signal maximale dans l'image) qui sera inclus dans les données de la reconstruction.
- Ensuite, sélectionnez> DLIT reconstruction 3D dans la palette d'outils et vérifiez que les propriétés optiques utilisés pour la reconstruction DLIT sont corrects. Sélectionnez> onglet Propriétés et assurez-vous que les paramètres de propriétés des tissus est fixé au tissu de la souris, spectre de la source est réglée sur les bactéries.
- Cliquez sur> Reconstruire pour effectuer la reconstruction DLIT.
- Pour générer le DLIT-μCT film 3D, cliquez> Outils> Animation 3D et sélectionnez> Preset Animations> CCW axe Y et> Durée totale> 10 sec (25 images par seconde). Une fois les paramètres de l'animation 3D sont correctes, appuyez sur> enregistrer et sauvegarder les reconstructions 3D DLIT-μCT aussi. Avi étiquetés avec le point expérimentation, le groupe et l'heure dans un dossier séparé.
Remarque:- Il est important lors de l'exécution des reconstitutions en 3D de données DLIT-μCT d'utiliser un PC avec Living 4.3.1 image et ensemble de services 1 installé et que le PC dispose d'une carte graphique appropriée pour l'exécution du logiciel d'imagerie multi-modalité. Thest un logiciel peut être téléchargé, et caractéristiques de GPU sont contenues dans les notes de version ( http://www.caliperls.com/support/software-downloads.htm ).
- Si les reconstructions 3D DLIT-μCT apparaissent en arrière après avoir été sauvé, votre ordinateur exécute une ancienne version de son pilote graphique et cela peut être corrigé en téléchargeant une mise à jour sur le site Web du fabricant.
- Dans l'étape 5, nous présentons nos paramètres préférés pour la production 3D reconstructions DLIT-μCT. Cependant, il ya plusieurs points au cours des reconstructions en 3D où les paramètres qui ne sont pas abordés dans ce protocole peut être modifié. Pour un guide complet de reconstructions 3D à l'aide Living 4.3.1 de l'image s'il vous plaît se référer au manuel d'instructions du fabricant.
- Il est important de créer des reconstructions 3D en utilisant les mêmes paramètres dans l'outil d'imagerie multi-modalité afin qu'ils soient comparables. En plus dece, lors de la création des reconstructions 3D DLIT-μCT, il est important de rendre les vidéos en utilisant le même nombre d'images par seconde et durée totale (longueur), sinon le calendrier de la vidéo 4D n'est pas homogène.
6. Génération d'un film 4D de C. Infection rodentium
- Clairement étiqueter toutes les reconstructions 3D DLIT-μCT avec l'expérience correct, point de temps et le groupe dans un dossier facilement accessible.
- Créer un nouveau fichier dans Windows Live Movie Maker et insérer les reconstructions DLIT-μCT dans l'ordre chronologique du jour 1 PI en utilisant l'onglet Outils dans le dossier préparé à l'étape 6.1.
- Ajoutez des légendes au début de chaque vidéo décrivant le point de temps, par exemple Jour 1 PI en sélectionnant la vidéo DLIT-μCT approprié, puis en sélectionnant Accueil> ajouter une légende. Une zone de texte apparaît sur l'écran, où la légende approprié est ajouté. Ajustez la police taille, le style, la couleur, et de la justification desIRED l'aide d'onglets identiques à Microsoft Word dans la barre d'outils du logiciel. Enfin, déplacer la légende dans le coin supérieur gauche de la vidéo.
- Répétez l'étape 7.3 pour toutes les vidéos DLIT-μCT.
- Ajouter une page de titre, par exemple C. rodentium jours après l'infection 1-8 en cliquant Accueil> titre. Une zone de texte apparaît sur l'écran où le titre approprié est ajouté à une diapositive vierge. Ajustez la police taille, le style, la couleur, et la justification comme vous le souhaitez en utilisant les onglets identiques à Microsoft Word dans la barre d'outils du logiciel.
- Enregistrer le projet comme un projet Movie Maker * de MMP dans un dossier approprié avec le titre du film. Cette étape est essentielle si vous voulez modifier le film.
- Enregistrez le film en fichier wmv.. Cliquez sur le menu Movie Maker> Enregistrer film> pour ordinateur.
- Convertir le fichier Movie Maker en utilisant un convertisseur de fichier. Avi ou autre type de fichier approprié compatible avec votre ordinateur.
Remarques:- Il est recommandé que les films 4Dsont générés sur un PC avec Windows Live Movie Maker installé ( http://windows.microsoft.com/en-GB/windows7/products/features/movie-maker ) et un bon programme multimédia capable de jouer. wmv ou. avi types de fichiers.
Résultats
L'infection des souris C57BL/6J avec 5 x 10 9 UFC C. rodentium est un modèle d'infection bactérienne bien décrit et se traduit par une infection auto-limitation gastro qui culmine entre 6-8 jours après l'infection et dure entre 3 à 4 semaines 2,14. L'infection est confinée à la lumière intestinale par le système immunitaire murin et en conséquence, les bactéries sont continuellement versé dans les fèces. La colonisation de la souris par C. rodentium peut être contrôlée de manière non invasive par énumération bactérienne directe à partir des fèces, ou l'imagerie par bioluminescence 2,3.
Ce manuscrit décrit un protocole optimisé pour effectuer 3D et 4D multimodalité imagerie C. rodentium au sein souris pour contrôler la charge bactérienne et la localisation au cours de l'infection. Les résultats présentés dans la figure 1 montrent les contrôles qui sont nécessaires pour l'imagerie 4D succès. Avant l'infection des souris, il est essentiel pour dissuadermine qui l'inoculum bactérien est utilisé bioluminescente (figure 1A) et que, suite à l'gavage d'une souris avec bioluminescente C. rodentium, que le signal peut être observé dans l'estomac de l'animal, et non pas dans les poumons (figure 1B) 16.
En plus de surveiller la colonisation bactérienne utilisant l'imagerie par bioluminescence, c'est une bonne pratique de quantifier le nombre de bactéries dans les selles, qui est utilisé comme une mesure indirecte de la colonisation bactérienne de la muqueuse gastro-intestinale La figure 2 montre la charge bactérienne typique dans les selles prélevé sur 8 C57BL6 / J. souris qui ont été infectées par le ~ 5 x 10 9 UFC ICC180 et suivies pendant 8 jours pi colonisation augmente de jour 2 PI jusqu'au jour 6-7 où les pics d'infection à ~ 5 x 10 10 UFC / g, qui est en ligne avec les rapports précédents 2,3,17.
Pour souligner l'importance de l'évaluationTing la propagation de l'infection en une seule souris, les figures 1b et 3 ainsi que la vidéo 1 a été généré à partir de la même souris après C. infection rodentium, comme décrit ci-dessus. Daily DLIT-μCT a été utilisé pour évaluer la répartition spatiale des bactéries bioluminescentes dans ce souris, en utilisant le squelette comme une référence anatomique. Figure 3 montre la reconstruction DLIT-μCT d'une souris C57BL/6J infectés par ICC180 à 3 fois les points clé PI A Jour 3 PI petite bioluminescente foyers peut être observée dans le côlon, qui présentent une augmentation modérée de l'intensité de la bioluminescence par jour 5 PI avec peu de changement dans la distribution spatiale. Au jour 7 PI, nous avons observé une augmentation significative de la bioluminescence et la bioluminescence foyers propagation à travers l'ensemble du côlon.
Vidéo 1 est une compilation des reconstructions 3D DLIT-μCT de jours 1-8 PI avec ICC180 et illustre C.rodentium dans le tractus gastro-intestinal proximal entre les jours 1-2 PI qui se répand dans le côlon au jour 3 PI De 4-6 jours PI le nombre de bactéries dans le côlon étendre jusqu'à un pic au jour 7 PI où les foyers bactérienne couvre la totalité du côlon. Au jour 8 PI que deux foyers bactériens distinctes sont présentes dans le côlon proximal et distal. La possibilité de consulter la reconstruction 3D complète à chaque point de temps dans l'ordre chronologique représente un outil puissant pour analyser les interactions pathogènes de l'hôte et est plus facile à interpréter que d'une 3D toujours du même ensemble de données.
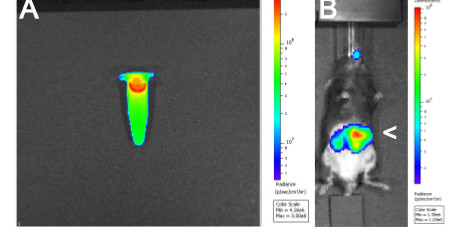
Figure 1. D'imagerie par bioluminescence 2D A) bioluminescentes C. rodentium ICC180 inoculum et B) d'une souris après gavage avec 200 pi de l'inoculum. Arrowhead (>) illustre bioluminescente C. rodentium em> dans l'estomac.
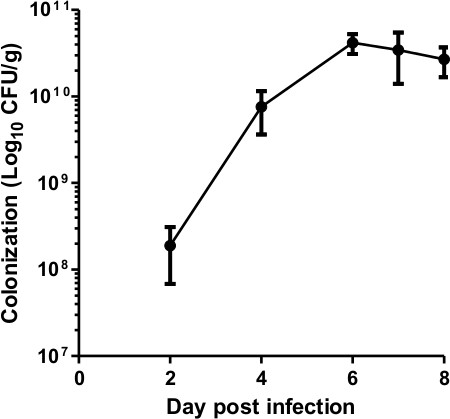
Figure 2. C. rodentium dynamique de colonisation. Quantification de C. colonie de rodentium unités formant des selles pendant 8 jours PI
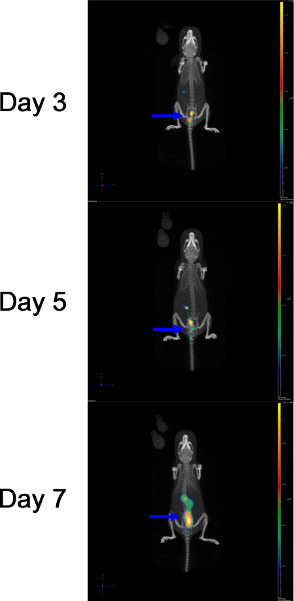
Figure 3. Diffuse la lumière imagerie tomographique μCT scan de bioluminescence C. infection rodentium d'une souris contrôlée au jour 3, 5 et 7 PI Arrowhead (>) illustre la colonisation du côlon. Cliquez ici pour agrandir la figure .
Vidéo 1.p :/ / www.jove.com/files/ftp_upload/50450/LAB_MEDIA_50450_Frankel_Video1.wmv "target =" _blank "> Cliquez ici pour voir la vidéo. film 4D de l'infection à C. rodentium d'une souris contrôlée à partir de 1-8 jours PI
Discussion
Le film 4D d'une infection bactérienne constitue un outil utile pour visualiser et interpréter de grandes quantités de données d'imagerie multi-modalité rapidement et facilement. Cette technique facilite l'analyse détaillée de la façon dont l'infection se propage par une souris individuelle et peut être utilisée pour étudier comment la suppression de l'hôte ou des gènes bactériens ou particulier stratégies d'intervention effet de la charge bactérienne, la distribution et la localisation au cours d'une étude longitudinale 7. Ces vidéos fournissent également des outils pédagogiques utiles et un moyen de diffuser l'information au public.
Il ya plusieurs étapes critiques dans ce protocole qui pourraient affecter la qualité des données obtenues par imagerie DLIT-μCT et la possibilité de compiler une vidéo 4D d'infection. La partie la plus importante de ce protocole est l'infection réussie et homogène de souris avec C. rodentium. Il est essentiel que les souris utilisées pour l'étude sont entre 18-20 g et que la bactéinoculums rial sont fraîchement préparés et environ 5 x 10 9 UFC, comme décrit précédemment 2,3. Avant d'infection des souris, il est important de vérifier que l'inoculum est bioluminescence utilisant le spectre CT et une fois l'inoculum a été préparé, il doit sans cesse être homogénéisé avant chaque souris est par gavage afin de s'assurer que les souris reçoivent des doses infectieuses similaires. L'imagerie DLIT-μCT de souris a été optimisé de sorte que la fonction d'exposition automatique dans le logiciel 4.3.1 image vivante détermine automatiquement les paramètres d'imagerie optimisés pour que le signal soit bien au-dessus du bruit. Cependant, la fonction d'exposition automatique s'appuie sur les paramètres et les paramètres définis par l'utilisateur qui doivent être modifiés comme décrit dans la procédure. Sinon, cela se traduira par des images pauvres avec un faible nombre de photons collectés qui ne donne pas lieu à une progression évidente dans l'infection, comme les réglages d'usine du spectre CT pour l'exposition automatique sont programmés pour l'imagerie des tumeurs exprimantluciférase de luciole. Reconstructions effectuées à l'aide de 560 à 620 nm donnent le meilleur accord entre les données simulées et mesurées et, par conséquent, les données plus fiables à inclure dans la reconstruction.
Une limitation de l'utilisation de DLIT-μCT est que le rayonnement ionisant à partir de l'analyse μCT provoque des dégâts d'irradiation sublétale qui est cumulative au cours d'une étude longitudinale 18. L'exposition aux radiations sub-létaux peut affaiblir la réponse immunitaire, provoquer des lésions de l'ADN et l'apoptose dans les organes internes 19. En fin de compte, dégâts d'irradiation sub-létale cumulatif peut entraîner la mort si le LD 50/30 pour les rayonnements ionisants est dépassé, ce qui est entre 5 et 7 Gy en fonction de la souche de souris et de l'âge des souris utilisé 18,20,21. Bien que certains des dommages moléculaires des rayonnements ionisants peut guérir, puisque le principe fondamental est d'estimer la dose prudente, ce n'est généralement pas pris en compte dans la planification de l'étude. Au lieu de cela, l'objectif est de rester le plus belux de ces limites que possible tout en réalisant les objectifs de l'étude. Ceci est particulièrement important dans cette étude en raison de la réponse immunitaire normale à l'infection, la fréquence de l'imagerie, et le fait que transgénique, immuno-composé, ou fortement animaux infectés peuvent être plus sensibles aux rayonnements ionisants.
Lors de la planification de l'expérience pour produire un film 4D d'infection, il est important de considérer la durée de l'expérience, le nombre de μCT analyse requis au cours de cette période et la LD 50/30 pour les rayonnements ionisants pour la souche de souris utilisée. Une autre limite potentielle à DLIT-μCT est la force de l'expression de journaliste au sein de la souche bactérienne utilisée, car cela aura une incidence sur les limites de détection bactérienne et heures d'imagerie. Il est fortement recommandé que les chercheurs utilisent validés souches bactériennes qui sont très virulents, mais optimisée pour lux expression de l'opéron maximal, comme l'a montré précédemment pour BLI2,3.
Une mise en garde à la conception actuelle de l'imagerie 4D est que chaque film est composé de scans DLIT-μCT individuels qui ont différente échelle photon. Cela peut rendre les images difficiles à interpréter si les modifications apportées à la localisation de la BL foyers, ou son intensité sont subtiles, ou si il ya un accent BL intense entouré de multiples foyers faible. Par conséquent, pour les visualisations longitudinales, il est important de garder les barres de couleur uniforme dans les points dans le temps.
Le concept d'un film 4D d'infection peut être appliquée à n'importe quel agent pathogène bactérien convenablement étiqueté. Le développement futur de cette technique vise à utiliser l'imagerie par fluorescence tomography (EIPC) ainsi que DLIT pour faciliter l'enquête de réponses de l'hôte à l'infection en utilisant une combinaison d'agents pathogènes bactériens bioluminescentes et injectables fluorescentes près de sondes infrarouges pour enquêter sur les réponses de l'hôte à l'infection. En plus de cela, dans ce protocole, nous nedécrire l'utilisation de bactéries bioluminescentes pour créer des films 4D d'infection. Toutefois, dans certains cas, il peut être nécessaire d'utiliser des bactéries marquées par fluorescence, par exemple étiquetés avec IRFP, de sorte que le journaliste de bioluminescence peut être utilisé pour l'étude génétique de l'hôte lors de l'infection. Surtout, l'utilisation de l'imagerie multi-modalité combinant DLIT / FLIT-μCT va nous permettre d'enquêter de manière non invasive des paramètres multiples au cours d'une infection bactérienne, ce qui contribuera de manière significative à la réduction, raffinement, et le remplacement de l'utilisation des animaux dans la recherche scientifique comme indiqué dans l'initiative de la NC3R ( http://www.nc3rs.org.uk/ ).
Déclarations de divulgation
Production et le libre accès à cet article est parrainé par PerkinElmer.
Les auteurs Kevin P, Francis, Jeff Meganck et Chaincy Kuo sont des employés de Caliper-Une société PerkinElmer.
Tous les expérimentations animales ont été effectuées en conformité avec la loi de 1986 animaux de procédures scientifiques et ont été approuvés par le comité d'éthique local.
Remerciements
L'installation dans d'imagerie in vivo à l'Imperial College a été financé par la MRC.
matériels
| Name | Company | Catalog Number | Comments |
| Bioluminescent C. rodentium | Frankel lab | ICC180 | Wiles et al., 2004 |
| Veet | Boots | Optimal depilation time is 7 min. Depilation works better if the cream is rubbed in well. | |
| Isofluorane (100% v/v) | Abbott | B506 | |
| Medical Oxygen | BOC Medical | Size F Cylinder. Note: an appropriate regulator is required. | |
| Luria Bertani broth | Merck | 1.10285.0500 | 25 g in 1L Demineralised water. |
| Luria Bertani agar | Merck | 1.10283.0500 | 37 g in 1L Demineralised water. |
| Kanamycin sulphate | Sigma (Fluka) | 60615 | |
| 50 ml Polypropylene conical Falcon tubes | BD (Falcon) | 352070 | |
| Universals | Corning (Gosselin) | E5633-063 | |
| 1 ml syringe | BD (Plastipak) | 300013 | |
| Oral dosing needle (16G x 75 mm) curved | Vet Tech | DE005 | |
| Microbanks (Cryovial) | Pro-Lab Diagnostics | PL.170/Y | |
| IVIS Spectrum CT | Caliper- a PerkinElmer Company | 133577 Rev A/ Spectrum CT | |
| 6kVA UPS | Caliper- a PerkinElmer Company | ||
| XGI-8 anesthesia system | Caliper- a PerkinElmer Company | 118918 | |
| XAF-8 Anaesthesia filter charcoal | Caliper- a PerkinElmer Company | 118999/00 | |
| Living Image v4.3.1 SP1 | Caliper- a PerkinElmer Company | ||
| Benchtop shaking incubator | New Brunswick Scientific | Innova 44 | |
| |||
Références
- Chang, M. H., Cirillo, S. L., Cirillo, J. D. Using Luciferase to Image Bacterial Infections in Mice. J. Vis. Exp. (48), e2547 (2011).
- Wiles, S., Pickard, K. M., Peng, K., MacDonald, T. T., Frankel, G. In vivo bioluminescence imaging of the murine pathogen Citrobacter rodentium. Infect Immun. 74, 5391-5396 (2006).
- Wiles, S., et al. Organ specificity, colonization and clearance dynamics in vivo following oral challenges with the murine pathogen Citrobacter rodentium. Cell Microbiol. 6, 963-972 (2004).
- Wiles, S., Dougan, G., Frankel, G. Emergence of a 'hyperinfectious' bacterial state after passage of Citrobacter rodentium through the host gastrointestinal tract. Cell Microbiol. 7, 1163-1172 (2005).
- Fanning, S., et al. Bifidobacterial surface-exopolysaccharide facilitates commensal-host interaction through immune modulation and pathogen protection. Proc. Natl. Acad. Sci. U.S.A. 109, 2108-2113 (2012).
- Doyle, T. C., Burns, S. M., Contag, C. H. In vivo bioluminescence imaging for integrated studies of infection. Cell Microbiol. 6, 303-317 (2004).
- Collins, J. W., et al. Pre-treatment with Bifidobacterium breve UCC2003 modulates Citrobacter rodentium-induced colonic inflammation and organ specificity of infection. Microbiology. , 10-1099 (2012).
- Contag, C. H., et al. Photonic detection of bacterial pathogens in living hosts. Mol. Microbiol. 18, 593-603 (1995).
- Hardy, J., et al. Extracellular replication of Listeria monocytogenes in the murine gall bladder. Science. 303, 851-853 (2004).
- Szittner, R., Meighen, E. Nucleotide sequence, expression, and properties of luciferase coded by lux genes from a terrestrial bacterium. J. Biol. Chem. 265, 16581-16587 (1990).
- Andreu, N., Fletcher, T., Krishnan, N., Wiles, S., Robertson, B. D. Rapid measurement of antituberculosis drug activity in vitro and in macrophages using bioluminescence. J. Antimicrob. Chemother. 67, 404-414 (2012).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J. Biomed. Opt. 12, 024007 (2007).
- Cronin, M., et al. High resolution in vivo bioluminescent imaging for the study of bacterial tumour targeting. PLoS One. 7, e30940 (2012).
- Mundy, R., MacDonald, T. T., Dougan, G., Frankel, G., Wiles, S. Citrobacter rodentium of mice and man. Cell Microbiol. 7, 1697-1706 (2005).
- Curtis, A., Calabro, K., Galarneau, J. R., Bigio, I. J., Krucker, T. Temporal variations of skin pigmentation in C57BL/6 mice affect optical bioluminescence quantitation. Mol. Imaging Biol. 13, 1114-1123 (2011).
- Wiles, S., Crepin, V. F., Childs, G., Frankel, G., Kerton, A. Use of biophotonic imaging as a training aid for administration of substances in laboratory rodents. Lab Anim. 41, 321-328 (2007).
- Crepin, V. F., et al. Dissecting the role of the Tir:Nck and Tir:IRTKS/IRSp53 signalling pathways in vivo. Mol. Microbiol. 75, 308-323 (2010).
- Willekens, I., et al. Evaluation of the radiation dose in micro-CT with optimization of the scan protocol. ContrastMedia Mol. Imaging. 5, 201-207 (2010).
- Boone, J. M., Velazquez, O., Cherry, S. R. Small-animal X-ray dose from micro-CT. Mol Imaging. 3, 149-158 (2004).
- Sato, F., Sasaki, S., Kawashima, N., Chino, F. Late effects of whole or partial body x-irradiation on mice: life shortening. Int. J. Radiat. Biol. Relat. Stud. Phys. Chem. Med. 39, 607-615 (1981).
- Kohn, H. I., Kallman, R. F. The influence of strain on acute x-ray lethality in the mouse. II. Recovery rate studies. Radiat. Res. 6, 329-338 (1957).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon