Method Article
Un système de Coeur de travail isolé pour les grands modèles animaux
Dans cet article
Résumé
Most studies involving the Langendorff apparatus use small animal models due to the increased complexity of systems for larger mammals. We describe a Langendorff system for large animal models that allows for use across a range of species, including humans, and relatively easy data acquisition.
Résumé
Depuis son introduction à la fin du 19 e siècle, l'appareil isolé coeur de perfusion de Langendorff, et le développement ultérieur du modèle de travail cardiaque, ont été des outils précieux pour l'étude de la fonction cardiovasculaire et les maladies 1-15. Bien que la préparation de Langendorff coeur peut être utilisé pour n'importe quel coeur de mammifère, la plupart des études portant sur cet appareil utilisent des modèles de petits animaux (par exemple, la souris, le rat et lapin) en raison de la complexité croissante des systèmes pour les grands mammifères 1,3,11. Une difficulté majeure est d'assurer une pression de perfusion coronaire constante sur une gamme de différentes tailles cardiaques - une composante clé de toute expérience en utilisant ce dispositif 1,11. En remplaçant la colonne hydrostatique classique de la post-charge avec une pompe centrifuge, l'appareil de Langendorff travail cardiaque décrit ci-dessous permet un réglage facile et une réglementation stricte des pressions de perfusion, ce qui signifie la même set-up peut être utilisé pour diverses espècess ou tailles cardiaques. En outre, cette configuration peut également basculer de façon transparente entre la pression constante ou un débit constant durant la reperfusion, en fonction des préférences de l'utilisateur. Le caractère ouvert de cette configuration, malgré que la réglementation de la température plus difficile que les autres modèles, permet de faciliter la collecte des données de pression-volume d'effluents et ventriculaires.
Introduction
Une grande partie de notre compréhension de la biologie et de la physiologie cardiaque de base est venu à partir d'expériences qui ont utilisé l'isolement, coeur Langendorff perfusé rétrograde et les systèmes isolés de travail du coeur. Ces systèmes expérimentaux sont encore largement utilisés aujourd'hui pour élargir notre connaissance cardiovasculaire des sujets importants, y compris l'ischémie-reperfusion 2, 4 préconditionnement, la thérapie à base de cellules pour le myocarde endommagé 5,7, les effets cardiaques de médicaments 6,9, et la préservation de l'allogreffe cardiaque techniques 8,15-18.
Bien que les deux systèmes cardiaques isolés peuvent être utilisés pour toutes les espèces de mammifères, ils sont principalement utilisés sur les petits mammifères, tels que la Guinée porc, rat, lapin ou 3,12,13. Plus grands modèles animaux, comme les porcs et les humains, fournissent des données plus pertinentes cliniquement, mais sont moins fréquemment utilisés en raison du coût plus élevé, une plus grande variabilité biologique, de plus grands volumes de solutions de perfusion de sang, et bigger pièces d'équipement 1,12-15. En outre, la collecte de données est plus difficile, en particulier pour les cœurs de travail isolés 1,3,12-15. En raison de cette complexité, les modèles cardiaques isolées cliniquement pertinents sont rarement utilisées, ce qui entrave sérieusement le progrès de la recherche translationnelle cardiovasculaire.
Dans une tentative de résoudre ces difficultés, le travail isolé préparation cardiaque a été modifié pour créer un système qui peut être facilement adapté aux cœurs de différentes espèces, y compris l'homme, en vertu soit une pression constante ou conditions de Langendorff à débit constant. La chambre de compliance de la post-charge a été remplacée par une pompe centrifuge pour simplifier le processus de réglage de la pression de perfusion en mode Langendorff et la post-charge en mode de marche. Au lieu de, un réservoir à double enveloppe fermée pour contenir le coeur, ce système utilise une chambre ouverte pour faire la collecte de données plus facile, en permettant l'utilisation de l'approche transapicale pour conductance cathétérisme. Moreover, cette conception ouverte permet d'accéder à l'évaluation échocardiographique du cœur, élargissant les paramètres physiologiques qui peuvent être mesurés lors de ces expériences. Ces améliorations, nous l'espérons encourager d'autres à utiliser ce système pour grande recherche translationnelle animale.
Protocole
1. Construire l'appareil de Langendorff (voir la figure 1)
- Utilisation de tuyau 3/8 de "connecter le réservoir de coeur pour le réservoir de sang.
- Assurez-vous que ce tuyau passe par une pompe à galet. NOTE: Cela peut nécessiter l'aide de 3/8 "à 1/4" connecteurs de tubes pour créer une pièce de 1/4 "tube à passer par la pompe à galet.
- Connectez le réservoir de sang de chauffage / oxygénateur avec tuyau 3/8 de ".
- Utilisez tuyau 3/8 de "se connecter l'appareil de chauffage / oxygénateur à un connecteur en Y.
- Connectez un bras de connecteur en Y à la pompe centrifuge, puis connectez la pompe centrifuge à un second connecteur en Y (tous les 3/8 "tube).
- Fixer un morceau de 3/8 "tube de fixation d'une valve hémostatique au bras orientée vers le haut, qui servira à la fois un piège à bulles, et des moyens d'insertion du capteur de pression.
- Fixez un morceau de tuyau 3/8 de "au bras vers le bas. Cette partie s'attachera à l'aor canule tic (c'est à dire la ligne de la post-charge).
- Branchez l'autre bras du connecteur en Y à l'entrée de la chambre de pré-charge à l'aide de 3/8 tubes de ". S'assurer que ce tuyau passe par une seconde pompe à galet.
- Connectez excès de 3/8 "tuyau à la sortie de cette chambre. Cette partie s'attachera à l'oreillette gauche (c'est à dire la ligne de précharge).
- Connecter le réservoir d'oxygène et un appareil de chauffage au dispositif de chauffage / oxygénateur.
- Fixer la ligne allant du connecteur en Y à la chambre de pré-charge, comme cette ligne ne sera pas utilisé jusqu'à ce que le coeur est mis en mode de travail.
2. Pression-volume du cathéter Préparation
- Dans un bain-marie à 37 °, chauffer une bouteille de solution saline.
- Faire tremper le transducteur PV conductance de cathéter et la pression dans l'eau chaude salée pendant au moins 30 min.
- Tourner sur les systèmes d'acquisition de données, permettant à la fois à l'échauffement pendant au moins 30 min.
- Allumer le réservoir d'oxygène, dispositif de chauffage, une pompe à rouleaux reliant les deux réservoirs, et une pompe centrifuge. L'appareil de chauffage doit être réglé à la température du corps de l'animal (~ 36 ° C).
- Laver le sang selon les instructions du fabricant. Vitesses de lavage plus lents sont recommandés pour une élimination plus complète de produits de déchets du sang (par exemple, les électrolytes excédentaires, matériau cellulaire lysée).
- Une fois que le sang est lavé, vérifier le niveau avant hémodilution de l'hématocrite.
- Reconstituer les globules rouges lavés avec une solution saline normale à la concentration désirée de l'hématocrite (recommandé: 20 à 25%) et d'ajouter à l'appareil de Langendorff.
- Ajuster les vitesses des deux pompes à commencer l'écoulement de sang à travers le système (à l'exclusion de la chambre de pré-charge).
- Vérifier le pH et des électrolytes du mélange de sang et d'ajuster jusqu'à ce que physiologique de l'espèce utilisée. NOTE: Pour éviter délétère dansflux de calcium lors de la reperfusion, les taux de calcium sur l'appareil de Langendorff doivent d'abord être maintenues basses (de 0,3 à 0,5 mmol / L).
- Si il ya une diminution de l'hématocrite avec augmentation simultanée de potassium, consultez la lactate déshydrogénase et plasmatique libre hémoglobine à exclure hémolyse.
- En cas d'hémolyse ne se produit, s'assurer que toutes les connexions sont serrées et il n'y a pas de zones de tonte évident.
- Fixez le cathéter Millar dans la fente de pression secondaire du système de PowerLab.
- Étalonner le transducteur de pression selon les instructions du fabricant.
4. Préparation du coeur pour la pièce jointe à l'appareil de Langendorff
REMARQUE: Un cœur bien arrêtée doit être utilisé pour toutes les grandes expériences sur des animaux d'un système de coeur isolé. Manque de cardioplégie peut endommager le coeur de telle sorte qu'il ne sera pas produire un travail mesurable. Celsior, ou bas-potassium Universitésité du Wisconsin (UW) solution est recommandée, car non seulement ces solutions semblables à celles utilisées en clinique, mais le faible taux de potassium de la solution permet d'éviter l'hyperkaliémie tandis que sur le circuit. Volume de solution de cardioplégie dépendra de la taille du cœur, avec 1 litre suffit pour les cœurs de porc.
- Enlever rapidement le coeur du conteneur de stockage, verser une solution de stockage dans les ventricules, sécher et peser.
- Pour aider à maintenir une température infarctus du froid jusqu'à ce que le cœur est prêt pour la Langendorff, revenir au cœur de réservoir de stockage et l'orienter de sorte que l'aorte est orientée vers le haut.
- Insérez un "canule 3/8 dans l'aorte et le fixer avec un collier de serrage.
5. Fixation du coeur à l'Langendorff
- Diminuer la pompe centrifuge à un mince filet.
- Filet du sang dans l'aorte jusqu'à ce qu'il est rempli de sang et complètement désaérée.
- Fixez soigneusement le c aortiqueAnnula au tube aortique sur le Langendorff. Prenez note du temps de fixation.
- Insérer le capteur de pression calibré à travers la valve hémostatique [DS1] dans l'aorte native.
- Commencer les mesures de pression et régler la vitesse de la pompe centrifuge jusqu'à ce que la pression souhaitée soit obtenue reperfusion. REMARQUE: La pression peut changer les changements de résistance comme coronaires. Par conséquent, contrôler la pression aortique près, en particulier lors de la reperfusion initiale.
- Augmenter la température sur l'appareil de réchauffement température intramyocardique est mesurée à 37 ° C. NOTE: Il y aura un délai entre les ajustements apportés à l'appareil de réchauffement et les changements de températures intramyocardiques. Par conséquent, les changements de température doivent être effectuées de manière incrémentielle.
- Obtenir une ligne de base (T = 0) à partir de l'échantillon du réservoir de sang veineux pour mesurer le pH, électrolytes, et d'autres mesures biochimiques.
- Insérez la sonde de température dans la cloison et surveiller la température du myocarde. Baisser la température de l'appareil de réchauffementsi la température s'élève au-dessus du myocarde de 39 ° C.
- Prélever des échantillons de sang toutes les 15 minutes, le réglage des paramètres physiologiques comme souhaité pour l'expérience.
- Ajouter environ 1 mmol de calcium à la solution de sang toutes les 5 minutes, en s'assurant que le calcium ionique est> 0,8 mmol / L avant l'initiation du mode de fonctionnement.
6. Mettre le cœur dans le mode de travail
- Insérer une canule de taille appropriée dans l'oreillette / veine pulmonaire gauche. Cela peut être fait soit avec une suture en bourse ou zip-cravate, le cas échéant.
- Fermez les trous dans l'oreillette gauche qui risquent de s'échapper, comme d'autres origines de la veine pulmonaire avec suture ou des agrafes au besoin.
- Ajuster la hauteur de la chambre de pré-charge de telle sorte que la hauteur de la colonne donne la pression de précharge désirée. NOTE: En supposant que la masse volumique du mélange sang / cristalloïde est égale à la densité de l'eau, 1 mmHg = 1,36 cm de la distance entre la valve de l'aorte au début de l'le niveau du sang dans le réservoir de pré-charge (par exemple, 15 mm de Hg = 20,4 cm).
- Desserrer le tuyau allant à la chambre de pré-charge et démarrer lentement la pompe à galet de précharge, en permettant la chambre de pré-charge et le tube de pré-charge pour le remplissage complet de sang.
- Une fois le tube de précharge est complètement désaérée, remplir lentement l'oreillette gauche et la canule de sang.
- Sans permettre à l'air de pénétrer dans le système, connecter le tuyau de précharge à la canule auriculaire gauche.
7. Obtention ventriculaire Pression-Volume (PV) Recordings
- Suivez les instructions du fabricant pour la pression et l'étalonnage de cuve Rho pour les systèmes d'acquisition de données.
- Placez une suture en bourse en utilisant une suture 3-0 en polypropylène au ventricule gauche (VG) de sommet.
- En utilisant une aiguille G 16, faire une incision dans le cordon de bourse.
- Insérez le PV conductance cathéter dans l'incision apicale. REMARQUE: la pose du cathéter Idéal sera depfin d'avoir toutes les électrodes de détection au sein de la LV et deux électrodes d'excitation en dehors de la LV. Veiller à ce que l'animal et le cathéter de taille appropriée ont été sélectionnés (voir Discussion).
- Appuyez sur le bouton "Démarrer" dans le coin en haut à droite pour commencer l'enregistrement des données et déterminer le nombre de segments de volume sont actifs.
- Si tous les segments ne sont pas actifs, ajuster la position du cathéter jusqu'à ce que tous les segments sont actifs. NOTE: Légère torsion du cathéter peut être nécessaire d'optimiser la boucle morphologie
- S'il est impossible d'obtenir des signaux dans tous les segments, ajuster l'emplacement d'électrodes d'excitation et d'électrodes de détection par les instructions du fabricant.
- Une fois la configuration désirée est obtenue, suivez les instructions du fabricant pour le volume et l'étalonnage de l'alpha.
- L'utilisation d'un cathéter correctement calibré, obtenir au moins 30 secondes de données de pression-volume de base. NOTE: Ces boucles pression-volume fourniront le volume dépendanceDent mesures de la fonction cardiaque (par exemple, le débit cardiaque, le volume systolique).
- Une fois que suffisamment de boucles sont obtenues, continuer à l'étape suivante sans arrêter l'enregistrement des données, de manière à obtenir des données de pression-volume occlusion.
- Obstruer le tube de précharge lentement à l'aide d'un collier de tube. REMARQUE: Les boucles pression-volume devraient commencer à devenir plus petits et rétrogradez et à gauche. C'est ce qu'on appelle le "descendre".
- Obtenir 10-15 sec de la marche vers le bas, puis relâchez la pince de tube pour permettre la précharge de réintégrer l'oreillette gauche. NOTE: Ces boucles pression-volume fourniront le volume des mesures indépendantes de la fonction cardiaque (par exemple, précharger travail de course recrutables, relation pression-volume systolique fin).
- Arrêtez l'enregistrement des données en appuyant sur le bouton "Stop" dans le coin supérieur droit de l'écran.
- Attendez au moins 5 minutes avant de répéter l'occlusion.
- Répétez les étapes 7.7 et 7.8 pour obtenir des mesures répétées.
Résultats
La figure 1 est un dessin schématique du circuit, y compris le placement de cathéter suggéré. Les éléments importants de ce dispositif sont les suivantes: utilisation d'une pompe centrifuge pour contrôler la postcharge; le placement d'un cathéter de pression (ligne bleue foncée) dans la racine de l'aorte à surveiller la pression de perfusion; et le placement de la pression-volume (PV) cathéter (ligne bleu clair) transapically. Bien que les connexions de la figure semblent être les connexions droites, connecteurs en "Y" est recommandé, en particulier pour la ligne de précontrainte.
La figure 2 montre les données obtenues à partir du transducteur de pression qui est placé dans la racine de l'aorte d'un coeur de porc pendant la reperfusion sur le circuit, ce qui est toujours entre 40 à 42 mm de Hg pendant plus de 20 min. Les variations de la résistance coronarienne peuvent provoquer des fluctuations de la pression de perfusion (figure 3). Ces variations peuvent être mineurs et progressive, les corriger mêmes au cours du temps (figure 3a). Cependant, dans certains cas, ces variations peuvent être brusques et nécessiter un réglage du débit à travers la pompe centrifuge pour maintenir la pression désirée de reperfusion (Figure 3b). Étant donné que des modifications peuvent se produire, la surveillance de la pression de racine de l'aorte au cours de la reperfusion est nécessaire.
En utilisant le coup incision transapical, les données de pression-volume peuvent être facilement obtenues sur le système cardiaque isolé. Dans cette expérience, un coeur porcin qui a été stockée dans le froid (4 ° C) Solution de préservation pendant 2 heures a été utilisé. Lors de l'introduction initiale de la sonde de PV, les boucles sont de mauvaise qualité (figure 4a), avec de multiples zones de croisement et aucun composant discernables du cycle cardiaque. Cependant, avec une manipulation minimale du cathéter dans le ventricule, la morphologie de la boucle amélioré de façon spectaculaire (figure 4b), ce qui permet que des mesures soient obtenues.
ve_content "> Malgré l'optimisation de la position du cathéter, les boucles acquises sur le ex vivo circuit (Figure 5, rangée du haut) peuvent avoir une morphologie différente de celle des boucles in vivo (figure 5, rangée du bas). Ces changements à boucle morphologie sont probablement en raison de l'orientation différente du coeur sur le circuit par rapport à un animal en décubitus dorsal, ainsi que l'absence des pièces jointes anatomiques trouvés dans un animal vivant (tels que le péricarde). En outre, l'utilisation de fils de stimulation pour aider à réguler la fréquence cardiaque ( recommandée site de fixation: septum interventriculaire) introduit un courant électrique externe, conduisant à des pics observés dans la partie inférieure droite de l'ex vivo boucles Cependant, aussi longtemps que ces boucles disposent encore les composants cardiaques de cycle, ils peuvent toujours obtenir des données interprétables.. Le tableau 1 énumère les multiples paramètres fonctionnels obtenus à partir de ces boucles pression-volume en utilisant le cathéter de PV. L' stockage froid statique probablement causé des dommages intrinsèque au coeur, ce qui explique certains des changements dans les valeurs obtenues sur le circuit par rapport aux mesures in vivo. Certaines des variations dans les variables dépendantes de la charge est également dû à des différences probables de la précontrainte entre le circuit et l'animal vivant.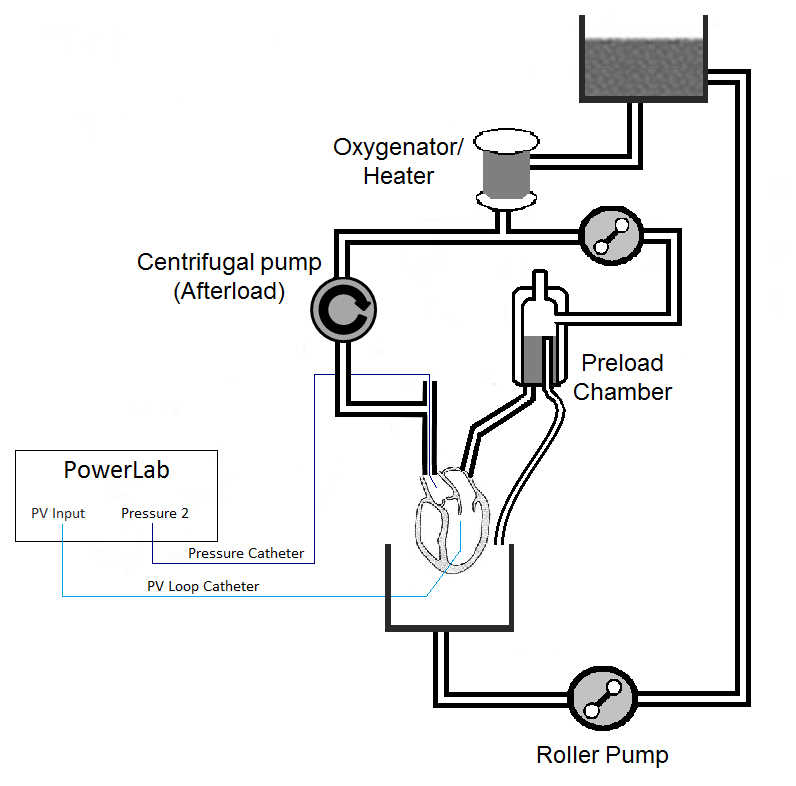
Figure 1. Schéma de l'appareil.

Figure 2. Aortiques mesures de pression racine représentatifs lors de la reperfusion.
g3highres.jpg "width =" 500 "/>
Figure 3. Exemples de changements à la pression de la racine aortique qui peut se produire lors de la reperfusion. Ces changements peuvent être progressive et auto-correction (A), ou brutale et exiger des modifications aux paramètres de la pompe centrifuge (B).
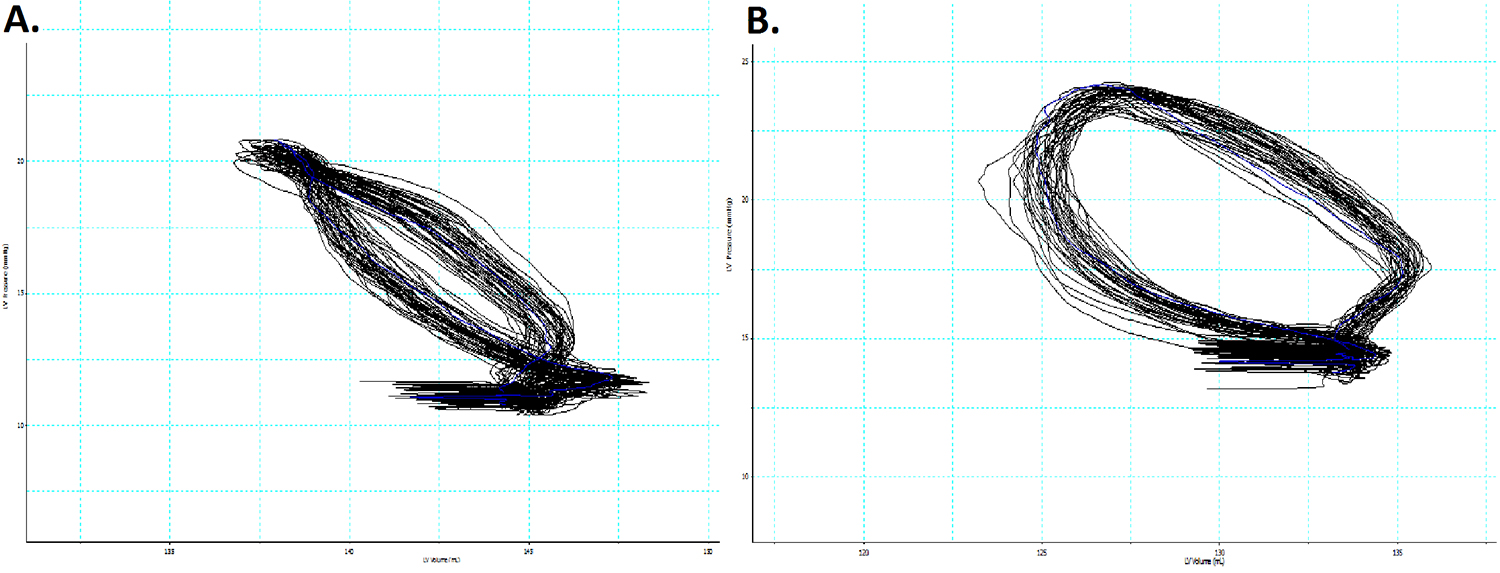
Figure 4. Boucles pression-volume obtenues lors de l'insertion initiale du cathéter transapically (A) et après la manipulation du cathéter secondaire (B). Notez l'amélioration de la morphologie de la boucle, de sorte que le croisement de la boucle est éliminé et les éléments du cycle cardiaque sont reconnaissables . Les pics de la partie inférieure droite de deux ensembles de boucles sont dues à l'utilisation d'un stimulateur, qui introduit un signal électrique extrinsèque.
"Figure 5" fo: contenu width = "5 po" src = "/ files/ftp_upload/51671/51671fig5highres.jpg" width = "500" />
Figure 5. Mesures de pression-volume représentatives prises sur la vivo circuit ex (ligne du haut), avec des mesures in vivo (rangée du bas) pour la comparaison. Là encore, les pointes du stimulateur peut être vu dans le coin inférieur droit des deux ensembles de ex vivo boucles.
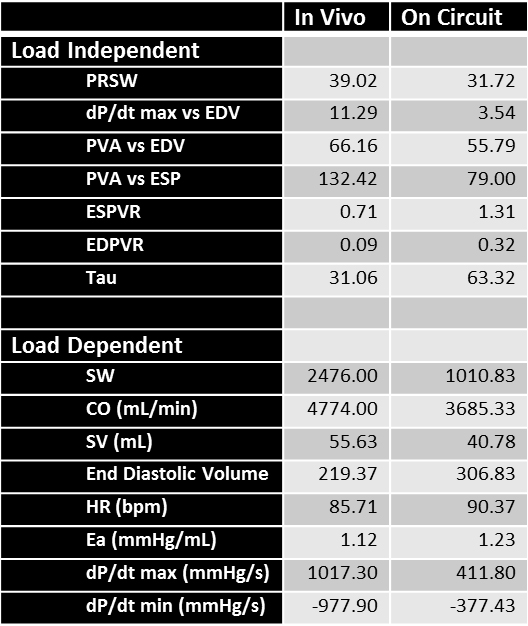
Tableau 1 Paramètres fonctionnels obtenus pour un coeur de porc in vivo (colonne de gauche) et de l'appareil de travail cardiaque après 2 h de stockage à froid (colonne de droite) de CO:.. Débit cardiaque; E a: elastance artérielle; EDPVR: Fin de la relation pression-volume diastolique; EDV: fin de volume diastolique; ESPVR: Fin de la relation pression-volume systolique; PRSW: Travaux de course précharge-recrutables; PVA:zone pression-volume; SV: volume d'éjection systolique; SW: Travaux de course.
Discussion
L'appareil isolé coeur de perfusion de Langendorff et de travail modèle de cœur ont conduit à certaines des découvertes les plus fondamentales en physiologie cardiaque, pathologie, et la pharmacologie. La polyvalence de ce modèle permet son utilisation avec une variété d'espèces sous une variété de conditions normales et pathologiques 1-18. Cependant, le modèle de coeur isolé n'est pas couramment utilisé pour les grands mammifères, en particulier les cœurs humains, en partie en raison de la complexité accrue de la fois la conception de l'appareil et la collecte de données. Par conséquent, le protocole présenté ici montre une tentative pour améliorer ces complexités qui se traduit par un moyen relativement reproductibles de l'étude de coeurs isolés de porcs.
Un élément essentiel de notre dispositif est le remplacement de la chambre de la compliance artérielle / post-charge d'une pompe centrifuge. Cet échange permet d'améliorer le contrôle de la pression de perfusion coronaire et la post-charge de travail dans Langendorff et modes de coeur, respectivement, permet ce set-up pour être facilement adapté aux coeurs de différentes tailles et espèces. Par exemple, dans cette conception, coeurs porcine sont reperfusés à 40-45 mmHg, alors que les coeurs humains sont reperfusés à 60-65 mmHg. Cette variation de pression est obtenu simplement en ajustant les paramètres de la pompe centrifuge; aucun élément du système doit être ajusté physiquement. En outre, en plaçant un capteur de pression à l'intérieur de la racine de l'aorte pour surveiller les pressions de racine permet de passer aisément entre un débit constant et pression constante pendant le mode de Langendorff. Bien que cette modification supprime la chambre de compliance classique, la pompe centrifuge, en permettant un écoulement bidirectionnel se produit fondé sur le gradient de pression, peut servir de chambre de compliance. Avec un volume de course systole et éjecté, flux rétrograde à la pompe sert à diminuer la pression de la post-charge, la réplication élasticité aortique.
La conception d'ouverture de cet appareil est également importante. Ayant le coeur accroché à un un ouvertrea, au lieu d'une chambre semi-fermée ou un entonnoir, permet de faciliter l'instrumentation pour la mesure de pression-volume. La conception ouverte permet l'utilisation d'une incision transapical pour LV pose du cathéter, en évitant de l'approche transvalvulaire. L'approche transvalvulaire est techniquement plus difficile, et nécessite généralement la fluoroscopie pour un placement correct. En outre, cette approche peut également induire une insuffisance valvulaire. En utilisant l'approche transapicale, nous mettons toute sécurité et facilement le cathéter dans le ventricule gauche tout en éliminant les coûts supplémentaires et les inconvénients de la fluoroscopie. La conception ouverte permet également un accès facile à l'échocardiographie et collecte des effluents, élargissant ainsi les paramètres fonctionnels et biochimiques qui peuvent être évalués tandis que sur ce système.
La conception ouverte, tout en facilitant la collecte de données, ne fait régulation de la température du myocarde plus difficile. Maintien de la température physiologique est l'un des problèmes connus avec une Langendorffou comment fonctionne le système cardiaque 1,3,11,13. Le système Langendorff contient typiquement une chambre thermique qui aide à maintenir une température adéquate, mais cette enceinte permet également l'insertion d'un cathéter ventriculaire pression-volume plus difficile. Pour résoudre le réglage de la température inférieure de la conception ouverte, un échangeur oxygénateur / de chaleur est placé après le réservoir. L'espace minimal entre l'échangeur de chaleur et la canule aortique réduit la perte de chaleur, et la sonde de température du myocarde assure la normothermie. L'utilisation d'un tube à double enveloppe ou sources de chauffage externe peut aussi être utilisé pour aider à la régulation de la température.
Un autre élément unique de ce protocole est de laver le sang autologue du porc à l'étude et la reconstitution avec une solution saline normale. Bien que l'utilisation soit perfusats de sang total ou de globules rouges avec des tampons cristalloïdes augmentée n'est pas rare, il ne présente des problèmes. Le premier exige généralement un animal donneur, ce qui ajoute substcoûts antial à l'expérience, tandis que celui-ci peut avoir des problèmes d'immunogénicité, car il est généralement issus de bovins 1,11-13 de sang. En lavant le sang du porc d'origine, le protocole ne nécessite qu'un seul animal et les questions d'immunogénicité sont soumis à une ablation. En outre, le processus de lavage élimine la plupart des électrolytes, ce qui signifie qu'ils peuvent être facilement manipulés par les paramètres expérimentaux. Enfin, en utilisant une unité de conservation du sang élimine la plupart des protéines dans le sang, ce qui est à la fois un avantage et un inconvénient de ce procédé. L'avantage est que tout coagulation des protéines immunologiques et / infectieuses sont éliminées, ce qui diminue le risque de formation de caillots ou de contamination. L'inconvénient est que ce mélange a une faible pression oncotique, ce qui peut conduire à un œdème myocardique et peut-être la perte de la fonction cardiaque au fil du temps. Ce problème peut être résolu, mais, grâce à l'ajout d'albumine ou d'un autre colloïde.
Veiller à ce que la bonne taille d'uniMAL et le cathéter ont été sélectionnés est aussi importante que l'aide de l'appareil approprié cardiaque de travail. Idéalement, le cathéter sera placé avec toutes les électrodes de détection à l'intérieur de l'espace ventriculaire, avec deux électrodes d'excitation (c.-électrodes les plus proximales) à l'extérieur de l'espace ventriculaire. Si la cavité ventriculaire de l'animal est trop petit, ou l'espacement entre les électrodes est trop grande, alors tous les segments ne sont pas adaptés à l'intérieur de l'espace de LV. Bien que l'emplacement des électrodes d'excitation peut être ajustée, une petite cavité de LV peut également provoquer le cathéter de se plier ou de la courbe, ce qui rend difficile la collecte de données. Par conséquent, pour l'analyse fonctionnelle des coeurs de grands animaux, une taille de l'animal d'au moins 60 kg est recommandée. Avec un animal de cette taille, la distance entre les électrodes est de 7 mm permet habituellement pour l'insertion complète du cathéter.
En conclusion, ce manuscrit décrit un système isolé de travail cardiaque qui simplifie la réglementation de la pression de perfusion, col de donnéescollecte, et la conception globale, tout en contrôle seulement un peu plus difficile de température. Ces modifications à cœur de travailler isolé, nous l'espérons permettre son utilisation accrue de grands coeurs de mammifères, dont les humains, approfondir notre compréhension de la pathologie cardiaque et permet des options de traitement plus cliniquement pertinentes à découvrir.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
There are no acknowledgments.
matériels
| Name | Company | Catalog Number | Comments |
| PowerLab 16/35 with LabChart Pro | ADInstruments | PL3516/P | |
| MPVS Ultra Pressure-Volume Unit | ADInstruments | 880-0168 | |
| Ventri-Cath Catheter (5F, 12E, 7 mm, DField, Straight, 122 cm) | Millar | VENTRI-CATH-507s | |
| Pressure Catheter (3.5F, Single, Straight, 100 cm, Ny, Non Repairable) | Millar | SPR-524 | |
| PV Extension Cable (10 ft) | ADInstruments | CEC-10PV | |
| Catheter Interface Cable (10 ft) | ADInstruments | PEC-10D | |
| Rho Calibration Cuvette | ADInstruments | 910-1060 | |
| MPVS Ultra BNC Cable Pack | ADInstruments | 880-0172 | |
| Autotransfusion system | Sorin | 7320000 | |
| Bowl Set with Low Volume (135 ml) Centrifuge Bowl | Sorin | 7135100 | |
| Oxygenator/Heat Exchanger | Terumo | 3CXSX18RX | |
| Perivascular flow probe | Transonic Systems | PAU Series | Size of flow probe will depend on animal size; for 60 kg pig, recommend 20 or 24 mm probe |
| Perivascular flowmeter module | Transonic Systems | TS420 | |
| Myocardial temerpature sensor | Smiths Medical | MTS-40015 | |
| 16 G 1" Regular needle | BD Inc. | 305197 | |
| 4-0 polypropylene suture (double-arm) | Ethicon | 8526H | For purse-string stitches |
| 2-0 polypropylene suture (single-arm) | Ethicon | 8833H | |
| Cable ties | ULINE | S-1021 | |
| Cable tie gun | ULINE | H-241 | |
| Clear, Flexible PVC Tubing | VWR International | 89068 | Inner diameter depends on cannulas, pumps and other equipment used; most commonly use 1/4", 3/8" tubing |
| Straight Tubing Connectors | VWR International | 46600 | |
| Y-Shaped Tubing Connectors | Thermo Scientific | 6152 | |
| Jacketed Bubble Trap | Radnoti | 14040 | For preload chamber |
| Centrifugal pump | Maquet | 70105 | The centrifugal pump and roller pumps were obtained used from perfusion department after clinical use. |
| Roller pumps | Maquet | HL-20 | |
| Hemostasis Valve | Merit Medical | MAP150 | |
| Blood gas analyzer | Instrumentation Laboratory | 570001000 |
Références
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. Journal of Pharmacological and Toxicological Methods. 55, 113-126 (2007).
- Cheung, P. Y., et al. Matrix metalloproteinase-2 contributes to ischemia-reperfusion injury in the heart. Circulation. 101, 1833-1839 (2000).
- Ytrehus, K. The ischemic heart--experimental models. Pharmacological Research: the Official Journal of the Italian Pharmacological Society. 42, 193-203 (2000).
- Ferdinandy, P., Schulz, R. Nitric oxide, superoxide, and peroxynitrite in myocardial ischaemia-reperfusion injury and preconditioning. British Journal of Pharmacology. 138, 532-543 (2003).
- Ohno, N., et al. Transplantation of cryopreserved muscle cells in dilated cardiomyopathy: effects on left ventricular geometry and function. The Journal of Thoracic and Cardiovascular Surgery. 126, 1537-1548 (2003).
- Hamlin, R. L., et al. Sensitivity and specificity of isolated perfused guinea pig heart to test for drug-induced lengthening of QTc. Journal of Pharmacological and Toxicological Methods. 49, 15-23 (2004).
- Lee, M. S., Lill, M., Makkar, R. R. Stem cell transplantation in myocardial infarction. Reviews in Cardiovascular Medicine. 5, 82-98 (2004).
- Ryugo, M., et al. Myocardial protective effect of human recombinant hepatocyte growth factor for prolonged heart graft preservation in rats. Transplantation. 78, 1153-1158 (2004).
- Valentin, J. P., Hoffmann, P., De Clerck, F., Hammond, T. G., Hondeghem, L. Review of the predictive value of the Langendorff heart model (Screenit system) in assessing the proarrhythmic potential of drugs. Journal of Pharmacological and Toxicological Methods. 49, 171-181 (2004).
- Southworth, R., Blackburn, S. C., Davey, K. A., Sharland, G. K., Garlick, P. B. The low oxygen-carrying capacity of Krebs buffer causes a doubling in ventricular wall thickness in the isolated heart. Canadian Journal of Physiology and Pharmacology. 83, 174-182 (2005).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: the Langendorff technique of isolated heart perfusion. Journal of Molecular and Cellular Cardiology. 50, 940-950 (2011).
- Hearse, D. J., Sutherland, F. J. Experimental models for the study of cardiovascular function and disease. Pharmacological Research: the Official Journal of the Italian Pharmacological Society. 41, 597-603 (2000).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacological Research: the Official Journal of the Italian Pharmacological Society. 41, 613-627 (2000).
- Hill, A. J., et al. In vitro studies of human hearts. Ann Thorac Surg. 79, 168-177 (2005).
- Colah, S., et al. Ex vivo perfusion of the swine heart as a method for pre-transplant assessment. Perfusion. 27, 408-413 (2012).
- Ozeki, T., et al. Heart preservation using continuous ex vivo perfusion improves viability and functional recovery. Circ J. 71, 153-159 (2007).
- Garbade, J., et al. Functional, metabolic, and morphological aspects of continuous, normothermic heart preservation: effects of different preparation and perfusion techniques. Tissue engineering. Part C, Methods. 15, 275-283 (2009).
- Poston, R. S., et al. Optimizing donor heart outcome after prolonged storage with endothelial function analysis and continuous perfusion. Ann Thorac Surg. 78, 1362-1370 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon