Method Article
Détermination de la concentration virale par Plaque Essais: Systèmes calque à l'aide traditionnels et nouveaux
Dans cet article
Résumé
Plaque assays are the gold standard for viral quantification, utilizing entrapping overlays on host cellular monolayers to determine viral titers. While various semisolid overlays have traditionally been used, here we demonstrate plaque techniques comparing semisolid overlays to a novel liquid microcrystalline cellulose among several families of viruses.
Résumé
Plaque essais restent l'une des méthodes les plus précises pour la quantification directe de virions infectieux et des substances antivirales par le comptage des plaques discrètes (unités infectieuses et les zones mortes cellulaires) en culture cellulaire. Ici, nous démontrons comment effectuer un test de la plaque de base, et comment les superpositions et les techniques différentes peuvent affecter la formation de plaque et de la production. Typiquement, les substrats de recouvrement solides ou semi-solides, tels que l'agarose ou de la carboxyméthylcellulose, ont été utilisées pour limiter la propagation virale, la prévention de l'infection aveugle à travers le milieu de croissance liquide. Superpositions immobilisées limitent infection cellulaire à la monocouche immédiatement environnante, ce qui permet la formation de foyers dénombrable discret et la formation de plaque postérieure. Pour surmonter les difficultés inhérentes à l'utilisation de revêtements traditionnels, un nouveau revêtement liquide en utilisant de la cellulose microcristalline et la carboxyméthylcellulose de sodium a été de plus en plus utilisés en remplacement dans la normedosage de plaque. Liquides dosages de plaques de recouvrement peuvent être facilement réalisées en SD formats de plaques et 6 ou 12 selon les techniques traditionnelles et ne nécessitent aucun équipement spécial. En raison de son état liquide et la facilité d'application ultérieure et l'enlèvement, formats de plaques de microculture peuvent également être utilisés comme une alternative de débit rapide, précise et haute de titrages viraux à plus grande échelle. Utilisation d'un polymère liquide non visqueux chauffé offre la possibilité de rationaliser le travail, conserve réactifs, l'espace de l'incubateur et augmente la sécurité de fonctionnement lorsqu'il est utilisé dans les laboratoires de confinement traditionnels ou élevés que pas de chauffage du réactif ou la verrerie sont nécessaires. Superpositions liquides peuvent aussi se révéler plus sensibles que les superpositions traditionnels pour certains virus labiles.
Introduction
L'isolement et la quantification précise des échantillons viraux viables a toujours été un objectif de recherche en cours en virologie. Il a fallu attendre l'avènement de l'essai de plaque en 1952 un moyen de calculer quantitativement et qualitativement les titres viraux animaux a d'abord été développé 1,2. Cette technique a été adapté et modifié à partir d'essais de phage, qui avait déjà été utilisée pour calculer les titres d'actions bactériophages en biologie végétale 1,2. Bien que d'autres moyens pour la quantification virale ont depuis été développée et adaptée, telle que des analyses immunologiques par fluorescence et par microscopie électronique à transmission, accordable de détection d'impulsion résistive (de TRPS), la cytométrie en flux, les systèmes rapporteurs recombinantes, et inverse quantitative réaction en chaîne par polymérase (qRT-PCR) Ces méthodes ne parviennent pas à identifier et quantifier les virions réplication compétentes 1,3. Bien que les progrès dans les technologies et les techniques continuent à affiner et modifier le paysage; PLAQUe tests continuent de représenter l'étalon-or dans la détermination des concentrations virales de virions infectieux lytiques 1,4.
Au cours d'un essai sur plaque, une monocouche confluente de cellules de l'hôte est infecté par un virus lytique d'une concentration inconnue qui a été dilué en série à une gamme dénombrable, typiquement entre de 5 à 100 virions. Les monocouches infectées sont ensuite recouvertes d'un milieu de recouvrement de blocage pour empêcher la propagation de l'infection virale indifféremment soit par le flux de convection ou mécanique du milieu liquide au cours de la propagation virale. Alors que les superpositions solides ou semi-solides tels que l'agarose, cellulose de méthyle ou la carboxyméthylcellulose (CMC) ont traditionnellement été utilisés, les superpositions liquides sont devenus une alternative de plus en plus attrayant avec le développement de nouveaux revêtements de liquides tels que Avicel 5- 7. Plaque essais utilisant liquide contre superpositions traditionnels ont plusieurs avantages comme la superposition peut être applié à la température ambiante, et l'application et le retrait est beaucoup plus facile. Comme superpositions liquides ne nécessitent pas de réchauffement, les virus labiles délicates et de chaleur peuvent aussi se révéler plus facile à la plaque.
Après l'infection initiale et l'application du revêtement de blocage, les plaques individuelles, ou des zones de mort cellulaire, commencera à développer l'infection virale et de la réplication que sont limités à la monocouche environnante. Les cellules infectées continueront le cycle de réplication de lyse-infection, la propagation de l'infection en outre, résultant en plaques de plus en plus distincts et discrets. Selon la cinétique de croissance et de la cellule hôte viral utilisé, une plaque visible font normalement dans 2-14 jours. Monocouches cellulaires peuvent alors être comptées avec un microscope en champ clair standard, ou plus généralement fixés par et contre-rouge neutre ou cristal violent afin d'identifier facilement les plaques à l'œil nu. Il existe une grande variété de la plaque contre les taches disponibles, chaque offre eEIR Les avantages et les inconvénients spécifiques. Le cristal violet est généralement ajouté au point de collecte et après la fixation / enlèvement de la couche supérieure, fournir une contre-coloration rapide et distinct qui permet d'identifier de très petites plaques lorsque morphologie mixte est présent. Le rouge neutre a l'avantage d'une application anticipée et contact constant avec la surimpression, permettant le suivi en direct de développer la formation de la plaque, ce qui est particulièrement utile lorsque vous travaillez avec un virus ou de réplication inconnus cinétique. Nous avons cependant constaté que la coloration est généralement pas aussi distinct lors de l'utilisation du rouge neutre. 3- (4,5-diméthylthiazol-2-yl) -2,5-diphényl tétrazolium (MTT) offre plusieurs avantages, comme les taches de colorants de couleur jaune cellules plaques bleues et noires viraux peuvent être comptées sans enlèvement de la couche supérieure en tant que vivent avec du rouge neutre. Le contraste entre cellules vivantes et mortes offertes par MTT permet également la détection de petites plaques lors d'une précédente infection point de temps après, Bien que le stockage serait encore exiger le retrait de la superposition 8. Comme cristal violet peut être simplement fait dans une solution d'eau et d'alcool, et fournit un degré élevé de sensibilité pour la morphologie de la plaque mixte, nous avons choisi comme contre-colorant préféré et simplifié pour le protocole, ont démontré que nous utilisons plusieurs familles de bien virus caractérisés.
Après fixation et coloration de la monocouche cellulaire infectée, plaques sont comptées pour titrer les échantillons de stock virale en termes de unités formant des plages (UFP) par millilitre. Une chute de journal est à noter entre les dilutions en série et, en fonction de la taille de la plaque, entre 5-100 plaques comptées, avec un contrôle négatif utilisé comme une référence. Échantillons statistiquement varient de 10% pour chaque tranche de 100 plaques comptés lorsque l'on compare échantillons répétés 3. L'avantage d'utiliser la méthode des plages afin de déterminer les titres viraux réside dans leur capacité à quantifier le nombre réel de particules virales infectieuses wurant l'échantillon. Comme plusieurs virions pourraient infecter une cellule unique, la terminologie de motifs par rapport à virions est utilisé pendant les titrages de la plaque 1,2.
Plaque morphologie peut varier considérablement dans des conditions de croissance différentes et entre espèces virales. Plaque taille, la clarté, la définition de la frontière, et la distribution devraient tous être noté, car ils peuvent fournir des informations précieuses sur les facteurs de la croissance virus en question et de virulence.
Principes de dosage de la plaque de base peuvent également être adaptés et modifiés dans un certain nombre de façons différentes, par exemple dans l'utilisation de la mise au point des dosages de formage (AGL). FFA ne reposent pas sur la lyse cellulaire et contre-coloration pour détecter la formation de plaques, mais plutôt emploient immunomarquage techniques permettant de détecter directement des protéines virales intracellulaires par des anticorps marqués. Sensibilité accrue, une diminution des temps d'incubation après l'infection, et surtout la capacité à quantifier les virus non lytiques sont toutes distinctesavantages lors de l'utilisation FFA. Bien que largement utilisée, les facteurs limitants critiques dans les FFA par rapport à un essai sur plaque classique réside dans la nécessité d'anticorps appropriés et que la capacité de la sonde pour les sous-unités de protéines virales par rapport aux virions infectieux réels 4.
Aux fins de cette étude, nous limiterons notre discussion à la méthode des plages classiques et décrire l'utilisation des recouvrements solides et semi-solides traditionnels (agarose et CMC), avec de nouveaux revêtements de cellulose microcristalline liquide.
Protocole
1. Préparation des cellules et réactifs
- Le jour avant l'essai, la plaque de cellules hôtes appropriées pour le virus en question (Tableau 1 et 2) à 90 - 100% de confluence.
- Préparer la solution de fixation de 10% de formaldéhyde dans dH 2 O. Dans l'exemple, mélanger 5,56 ml de 36% actions formaldéhyde avec 14,44 ml de H 2 O distillée (dH 2 O).
REMARQUE: Utiliser les pratiques de manipulation de sécurité approprié et ventilation lors de l'utilisation du formaldéhyde. - Préparation du violet cristallisé teinture: 1% de violet cristal (CV) dans 20% d'éthanol et dH 2 O.
- Préparez le support de plaque 2x (type dépendant à une concentration 2x cellulaire; voir le tableau 2). Filtrer sur un filtre de 0,2 um si tous les réactifs ne sont pas stériles.
- Préparation des superpositions d'immobilisation (tableau 3)
- Pour superpositions liquides, faire une solution stérile de 2,4% d'Avicel en DH 2 O. Pour éviter l'agglutination, ajouter la poudre dans un flacon contenant de l'eau eà se mélanger rapidement avec une barre d'agitation, verser Avicel lentement et mélanger rapidement à la température ambiante (RT). Lorsque la solution se révèle trop visqueux pour une barre d'agitation pour homogénéiser, passer à un agitateur de ballon pour> 30 min avec agitation lourd pour assurer une homogénéisation.
REMARQUE: Les solutions mères peuvent être faites à des concentrations plus faibles, mais les solutions peuvent se séparer et devront être remixé pour assurer l'homogénéisation. Les solutions de travail de Avicel peuvent être utilisés allant de 0,6 à 3%. - Après homogénéisation, l'autoclave la solution et magasin fermé à la température ambiante.
- Pour agarose et la carboxyméthylcellulose (CMC) superpositions, préparer une solution de réserve en DH 2 O de 2% de CMC ou 0,6% agarose. Mélanger avec une barre d'agitation et autoclave ou micro-ondes pour mettre en solution.
- Pour superpositions liquides, faire une solution stérile de 2,4% d'Avicel en DH 2 O. Pour éviter l'agglutination, ajouter la poudre dans un flacon contenant de l'eau eà se mélanger rapidement avec une barre d'agitation, verser Avicel lentement et mélanger rapidement à la température ambiante (RT). Lorsque la solution se révèle trop visqueux pour une barre d'agitation pour homogénéiser, passer à un agitateur de ballon pour> 30 min avec agitation lourd pour assurer une homogénéisation.
2. Les dilutions et les infections
- Le jour après l'étalement, vérifier visuellement la confluence et la viabilité des cellules avant de commencer l'essai. Assurer une norme cellulaire morphologietrouver une monocouche confluente ~ 90% est présent.
- Effectuer une dilution en série par dix des échantillons infectieux. Utilisation du milieu de culture cellulaire pour la propagation virale en tant que diluant (tableau 2). Varier le nombre de dilutions nécessaires sur la base du titre attendu du virus en question, et utilisez toujours un échantillon témoin non infecté pour assurer indépendamment la viabilité cellulaire et aide à l'identification de la plaque.
- A partir des dilutions en série, infecter les cellules pendant 45 min à 1 h (tableau 1). Utiliser une quantité suffisante d'inoculum pour recouvrir les cellules, tout en maintenant le volume le plus faible possible afin de maximiser le contact avec la monocouche virale (tableau 4). Plaques rocheuses délicatement toutes les 20 min pour assurer une couverture uniforme et empêchent la monocouche cellulaire de séchage.
- Après l'infection, superposer un volume approprié de milieu immobiliser directement aux inoculums dans le puits (Tableau 2) en utilisant un mélange 1: 1 de 2 x support de plaque et le immobiliztion superposition de choix (CMC, agarose ou Avicel). Agitez doucement pour mélanger.
- Pour superpositions liquides, mélanger 1: 1 avec les médias de la plaque chauffée et 2x 1.2 à 2.4% RT actions Avicel pour obtenir une solution de travail de 0,6-1,2% Avicel milieu de recouvrement.
- Pour une couche d'agarose, utilisez un mélange 1: 1 de médias 2x plaque chauffées et une solution stock de chauffe de 0,6% d'agarose, dans un bain d'eau à 56 ° pendant 30 minutes pour équilibrer la température obtention d'une concentration finale agarose / recouvrement de 0,3 %.
- Pour CMC, préparer une solution de réserve de 2% et de traiter comme décrit pour la couche d'agarose.
- Lors de l'application du revêtement à la monocouche, toujours équilibrer agarose chaud ou CMC dans une eau à 56 C ° pour éviter d'endommager la monocouche. Assurez-vous que la solution est chaud, mais pas chaud au toucher pour empêcher la mort des cellules et des titres viraux réduits. La plupart des superpositions agarose vont commencer à se solidifier en dessous de 42 ° C, travailler rapidement et / ou préparer de petites quantités pour éviter la solidification lors de la manipulation.
- Après addition de la superposition, les plaques incuber à produire des plaques distinctes qui sont clairement dénombrable. La formation de plaque peut prendre 2-14 jours selon le virus en cours d'analyse, le tableau 1.
REMARQUE: Une fois les plaques superposées liquides sont placés dans l'incubateur, ne les déplacez pas. Le déplacement des recouvrements liquides au cours de la période d'incubation se traduira par des plaques tachées. Agarose et CMC superpositions sont semi-solide et peuvent être déplacés ou vérifiés périodiquement sous un microscope optique pour suivre le développement de la plaque.
3. Fixation et coloration des cellules
- Pour fixer les cellules, verser ou aspirer la superposition Avicel, et fixer les cellules en utilisant la solution de formol à 10% pendant 30 min à la nuit (<1 ml par puits pour une plaque de 6).
- Pour agarose ou CMC, ajouter directement la solution de formaldéhyde à la superposition pendant 1 h à une nuit.
REMARQUE: Les échantillons peuvent être conservés pendant de longues périodes de temps dans le fixateur à condition qu'elle nepas évaporer et sécher car cela peut fausser la monocouche.
- Pour agarose ou CMC, ajouter directement la solution de formaldéhyde à la superposition pendant 1 h à une nuit.
- Avant la coloration et après fixation, jeter le formaldéhyde et retirer les bouchons semi-solides pour l'agarose et CMC soit avec l'eau courante ou manuellement avec une spatule. Rincer les plaques Avicel avec de l'eau pour enlever les résidus de superposition / fixateur avant la coloration.
- Pour la coloration, couvrir les cellules avec une quantité minimale de solution de cristal violet pendant ~ 15 min. Roche plaques si nécessaire pour assurer une couverture uniforme.
- Lavez délicatement la tache de cristal violet avec de l'eau. Une fois fixées, colorées, et séché, plaques de magasins indéfiniment pour une analyse ultérieure.
4. Déterminer virales Les titres
- Comptez le nombre de plaques dans chaque puits, en prenant la moyenne pour toutes les répétitions techniques de la même dilution. Pour les grands formats de plaques, puits de réduction de moins de 5 ou plus de 100 plaques. Prenez note de la taille de la plaque et de la morphologie. Le contrôle négatif doit avoir une monocouche uniforme etpeut être utilisé comme un témoin de référence.
- Déterminer le titre viral de l'échantillon de valeurs en prenant le nombre moyen de plaques de dilution et l'inverse du facteur de dilution totale.
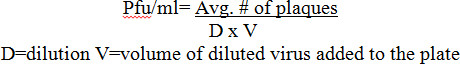
NOTE: À titre d'exemple, 30 et 32 plaques en compte pour les répétitions de la 1 x 10 -7 dilution [31 (moyenne) / 10 -7 (dilution) x 0,4 ml (inoculum)] donnerait un titre de 7,75 x 10 8 pfu / ml.
Résultats
La capacité de la méthode des plages d'évaluer avec précision les titres viraux repose sur de nombreux facteurs: la sélection de la cellule hôte approprié, les médias appropriés et des conditions de croissance pour la viabilité cellulaire et virale, la propagation virale immobilisé, et une détermination précise de la période d'incubation du virus de suffisamment de temps pour distinct et la formation de plaques dénombrable.
Pour cette étude, les virus provenant de trois familles représentatives ont été choisies pour démontrer les différences dans: sélection superposition, des périodes d'incubation, et morphologie de la plaque à travers différents types d'échantillons. L'encéphalite équine du Venezuela (VEEV) a été choisi comme modèle viral (+) ARN simple brin, ce qui peut provoquer une maladie importante chez les espèces et les êtres humains et des équidés représente la famille des Togaviridae. Influenza B souche Taiwan, un segmentée (-) virus à ARN simple brin infectant principalement les humains, représente la famille des Orthomyxoviridae. La vallée du Rift virus de la fièvre (FVR), un - virus à ARN simple brin de arthropode né infectant principalement les arthropodes, ()ruminants et les humains, a été sélectionné en tant que représentant de la famille des Bunyaviridae.
Pour la FVR (Figure 1), les titres ont été déterminées à partir d'une solution mère d'une souche vivante atténuée de MP12 recombinant de la FVR dans un format de 12 plaque bien en utilisant CMC, l'agarose, ou superpositions Avicel qui ont été incubés côté-à-côte pour après l'infection de 72 h (HPI). Une plaque représentant montrant des dilutions allant de 10 -4 à 10 -7 peut être vu dans le panneau A. Plaques utilisant CMC et superpositions agarose a montré petits, clairs, et distinctes des plaques avec une bordure circulaire bien défini. Plaques avec un revêtement liquide étaient légèrement plus abondante et plus par rapport à l'agarose et plaques CMC, et fourni une frontière moins distincte. Les titres viraux ont été comparées dans le panneau B de la totalité des superpositions exécution comparable.
Afin d'obtenir une comparaison visuelle claire entre les superpositions pour MP12 long avec un échantillon plus large à déterminer reprobilité, une plaque de 6 puits a été également fait l'essai en trois exemplaires (Figure 2). Dans le format de plaque à 6 puits, l'utilisation d'une superposition de CMC a montré que les petites plaques d'agarose soit des recouvrements ou liquides, qui sont de taille comparable à l'autre. Bien que les titres viraux étaient similaires entre les trois superpositions (Groupe D), plaques formées dans les recouvrements agarose et liquides se sont révélés plus facile de compter en raison de leur plus grande taille.
En contraste avec VFVR titres Veev morphologie de la plaque et entre les différentes superpositions variait considérablement (figure 3A). Plaques formées dans les recouvrements CMC ont montré une morphologie claire et distincte lors de l'utilisation d'un format de plaque à 12 puits, au détriment de la taille et de la sensibilité plaque (Groupe B). Contrairement à la CMC, l'utilisation de liquides d'agarose et a donné lieu à des superpositions de manière significative plus grandes plaques, ce qui indique une inhibition virale plus faible et une sensibilité accrue à la réplication VEEV. Cela a été confirmé précédemment lorsque l'on compare uniquement agarose contre CMC en apaper publié par Juarez et al. 4. Bien agarose et des superpositions produits liquides plus grandes plaques de CMC, les plaques étaient mal définis et les frontières sont difficiles à compter dans un format à 12 puits, avec des superpositions de liquide fournissant la plus grande diffusion de la frontière. Lorsque les plaques ont été mises à l'essai dans des plaques de 6 puits (figure 4), le plus grand format 6 puits nié la question de ouvertement grandes plaques qui étaient difficiles à différencier au format 12 puits, avec agarose et superpositions liquides prouvant supérieur aux superpositions CMC en termes de définition plaque et sensible (figure 4D).
En comparaison à la FVR ou VEEV, la grippe fournit plusieurs défis uniques lorsque plaquing, telles que l'exigence d'une protéase externe. La sensibilité du virus de la grippe à différentes sélections de recouvrement a également été bien documentée dans le passé que des changements importants ont été constatés lors de modifications mineures comme marques de agarose différentes ont êtreen 9 utilisé.
Il est intéressant pour la souche de grippe B Taiwan, l'utilisation de CMC comme une superposition entraîné nettement plus petites plaques qui étaient difficiles à compter et se sont avérées difficiles à marquer de façon fiable (figure 5A). L'utilisation d'une couche d'agarose a fourni les meilleurs plaques (groupe C), et a donné lieu à une coloration de fond plus foncé (probablement due à une augmentation de la viabilité de la monocouche), et présente des plaques claires et nettes dans la comparaison directe de l'utilisation du revêtement liquide (partie B ).
Un avantage particulier des polymères liquides plus de overlays solides et semi-solides, tels que l'agarose et le CMC, réside dans la facilité d'élimination et d'application. Superpositions semi-solides nécessitent un chauffage, et la solidification peuvent se révéler problématique lors de la manipulation et l'élimination. Afin de capitaliser sur ces avantages et à déterminer la faisabilité de l'utilisation de Avicel d'une manière à haut débit pour la FVR, un format de plaque de 96 puits a été mis à l'essai à différentes concentrations d de recouvrementons (Figure 6). Pour VFVR MP-12, les dilutions ont été réalisées en quatre exemplaires à la fois 0,6 et 1,2% des concentrations finales de Avicel. Demande de recouvrement et l'enlèvement est avérée simple, avec aucune différence apparente entre les répétitions ou entre les concentrations relevées, ce qui démontre un haut degré de reproductibilité. Lors de l'évaluation, les plaques étaient distincts et dénombrable à l'œil nu, ce qui démontre la possibilité d'utiliser des superpositions liquides de manière à haut débit pour la FVR.
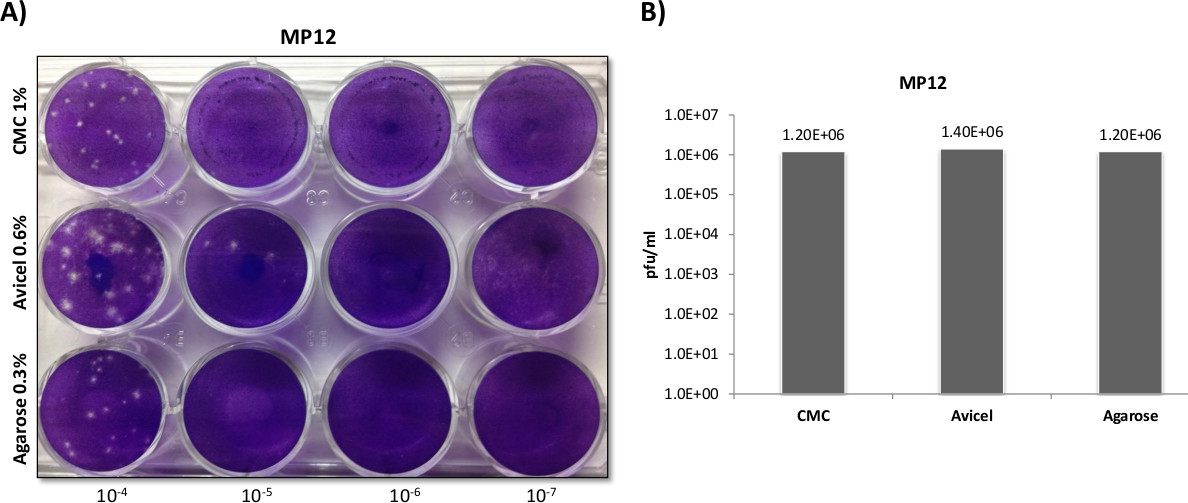
Figure 1:. VFVR plaque de recouvrement en utilisant des comparaisons de plaques de 12 puits ont été ensemencées Veros à 2,5 x 10 5 cellules dans les plaques de 12 puits et infectées avec 200 ul en utilisant le même échantillon dilué en série à partir de la MP12. Après l'infection de 1,5 ml superpositions de 0,3% d'agarose 0,6%, Avicel, ou 1% de CMC (c finaleoncentrations), ont été appliquées afin de comparer directement les superpositions comme l'a démontré dans le Panneau de A. plaques ont été comptées et titrés dans le Panneau B.
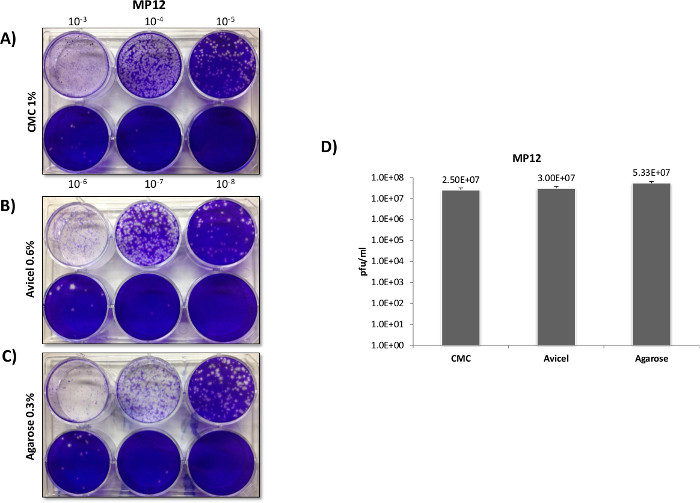
Figure 2:. VFVR plaque de recouvrement en utilisant des comparaisons de plaques à 6 puits ont été ensemencées Veros à 5 x 10 5 cellules dans les plaques à 6 puits et infectées avec 400 ul en utilisant le même échantillon dilué en série à partir de la MP12. Trois ml superpositions de 0,3% d'agarose 0,6%, Avicel, ou 1% de CMC, ont été appliquées afin de comparer directement les superpositions comme démontré dans la partie A, B, et C. Des expériences séparées ont été effectuées de façon identique à celle décrite pour panneaux AC, avec plaques comptés et titrés dans le Panneau de D (N = 3).
Figure 3: plaque de VEEV comparaisons de superposition en utilisant des plaques de 12 puits. Veros ont été étalées à 2,5 x 10 5 cellules dans des plaques de 12 puits et infectées avec 200 ul en utilisant le même échantillon dilué en série à partir de la souche de vaccin TC-83 VEEV. Après l'infection de 1,5 ml superpositions de 0,3% d'agarose 0,6%, Avicel, ou 1% de CMC, ont été appliquées afin de comparer directement les superpositions comme l'a démontré dans le Panneau de A. plaques ont été comptées et titré dans la partie B.
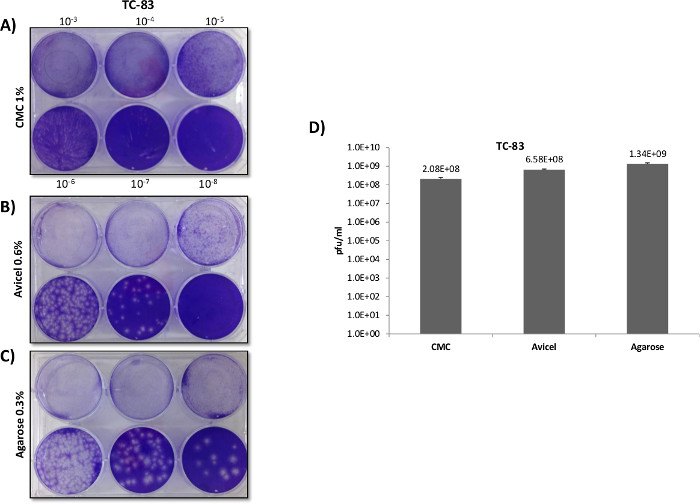
Figure 4:. V EEV comparaisons plaque de recouvrement en utilisant des plaques à 6 puits ont été ensemencées Veros à 5 x 10 5 cellules dans les plaques à 6 puits et infectées avec 400 ul en utilisant le même échantillon dilué en série à partir de VEEV TC-83. Après l'infection, 3 ml superpositions de 0,3% d'agarose 0,6%, Avicel, ou un 1% de CMC, ont été appliquées afin de comparer directement les superpositions comme le montredans les panneaux A, B et C. Des expériences séparées ont été réalisées de manière identique, comme décrit pour les panneaux A - C, avec des plaques comptées et titrés dans le panneau D (N = 3).
Figure 5: comparaison de la grippe plaque de recouvrement des cellules MDCK ont été étalées à 5 x 10 5 cellules dans les plaques à 6 puits et infectées avec 400 ul d'inoculum en utilisant le même échantillon dilué en série à partir de l'influenza B Taiwan.. Aucun sérum bovin fœtal (FBS) a été utilisé dans le milieu de croissance ou des superpositions, comme FBS peut inhiber la propagation de la grippe par l'inhibition de certaines protéases qui sont nécessaires pour la fusion virale. TPCK-trypsine a été ajouté à tous les recouvrements avant l'application, afin de faciliter la fusion et l'entrée virale par les cellules hôtes. Après l'infection, 3 ml superpositions de 0,3% d'agarose 0,6%, Avicel, ou 1% de CMC ont été appliquées afin de comparer directementles recouvrements comme démontré dans le Panneau A, B et C. Des expériences séparées ont été réalisées de manière identique, comme décrit dans les panneaux A - C, avec des plaques comptées et titrés dans le panneau D (N = 3). Alors que la moyenne a été prise pour plaques CMC ils se sont avérés difficiles à dénombrer de façon fiable comme ils ont démontré frontières diffuses et très petites tailles de plages.
Figure 6:. Haut débit superpositions de plaque à plaque de 96 puits de Veros plaqué à 3 x 10 4 cellules par puits, ont été infectées avec 50 ul d'inoculum utilisant le même échantillon de départ dilué en série de la FVR MP12 pendant 1 heure, en quatre exemplaires. Pour les superpositions, 0,6 et 1,2% des concentrations finales de Avicel ont été mis à l'essai afin de déterminer la faisabilité et la reproductibilité de l'utilisation de revêtements liquides de manière à haut débit, Panneaux A et B.
| VFVR | VEEV | Influenza B | |
| Type de cellule | Vero | Vero | MDCK |
| période de l'infection | 1 heure | 1 heure | 45 min |
| Le temps d'incubation | 3 jours | 2 jours | 3 jours |
Tableau 1: Plaque conditions d'essai d'inoculation et types de cellules
| VFVR | VEEV | Influenza B | |
| Type de cellule | Vero | Vero | MDCK |
| Type de croissance | DMEM 1 | DMEM 1 | DMEM 2 |
| Plaque médias | Un 2xEMEM | Un 2xEMEM | 2xEMEM B |
Milieu Eagle modifié de Dulbecco complété avec 1% 10 de sérum bovin fœtal, 1% de L-glutamine, 1% Penicllin / streptomycine.
Milieu Eagle modifié de Dulbecco complété avec 2. 1% de L-glutamine, 1% Penicllin / streptomycine, 0,2% de sérum-albumine bovine, 0,025% de HEPES, DEAE-Dextran 50 ug / ml.
A. 2x milieu minimal essentiel (500 ml) additionné de 5% de FBS (25 ml), 1% acides aminés essentiels minimaux (5 ml), 1% de pyruvate de sodium (5 ml), 1% de L-Glutamine (5 ml), 2% Pen / Strep (10 ml).
B. 2x médias essentiel minimal (500 ml) supplémenté avec 0,2% de sérum-albumine bovine, 1% acides aminés essentiels minimum (5 ml), 50 ug / ml, 0,025% de HEPES, le DEAE-dextrane, la trypsine-TPCK *
* Juste avant la préparation, ajouter 1 pi par 25ml de 2 pg / ml de bouillon de TPCK-trypsine à l'aliquote vous sera utilise pour mélanger avec de l'agarose pour les plaques.
Tableau 2: Plaque et virale / Cellulaire croissance Médias
| VFVR | VEEV | Influenza B | |
| Type de cellule | Vero | Vero | MDCK |
| période de l'infection | 1 heure | 1 heure | 45 min |
| Le temps d'incubation | 3 jours | 2 jours | 3 jours |
Solutions de superposition ne prendront pas fin lorsque fait si longtemps que la stérilité soit maintenue.
Tableau 3: superpositions Stock
| 6 bien | 12 bien | 96 puits | |
| Nombre de cellules / puits | 5 x 10 5 | 2,5 x 10 5 | 3 x 10 4 |
| Le volume de l'inoculum (ul) | 400 | 200 | 50 |
| le volume de recouvrement (ml) | 3 | 1,5 | 0,100 |
Tableau 4: formats de plaques
Discussion
Le facteur le plus critique pour un essai de plaque succès réside dans l'optimisation du protocole pour la culture virale en question que les conditions peuvent varier considérablement. Les points clés à prendre en compte sont: accueillir compatibilité cellulaire par le virus en question, les conditions de croissance virales appropriées, gammes de dilutions suffisantes afin de différencier clairement les plaques, et la sélection de superposition correcte et coloration pour les cellules et les virus en question.
Bien que les deux VFVR VEEV et poussent dans des conditions très similaires en utilisant un grand nombre des mêmes types de cellules hôtes, les différences de morphologie et de croissance varient considérablement plaque cinétique. Lors de l'utilisation des cellules Vero pour les essais de la plaque, qui ont traditionnellement été utilisés comme une lignée cellulaire propagation et l'indicateur pour hémorragiques virus de la fièvre et des alphavirus, VEEV pousse généralement à des titres plus élevés que la FVR et démontre augmenté cinétique de réplication, le développement de grandes plaques uniformes à 48 hpi 4, 10 - 12. Contrairement à VEEV, VFVR nécessite 72 HPI et démontre plaques qui sont généralement beaucoup plus petits et de taille variable.
En opposition à VFVR et VEEV, le virus de la grippe est très cellule hôte spécifique et peut être difficile à se propager à travers la culture de tissus. Pour le virus de la grippe, l'entrée et la fusion virale est normalement initiée par la liaison du récepteur de la surface cellulaire avec la glycoprotéine hamagglutinin virale (HA), qui médie l'entrée dans la cellule cible par liaison avec le récepteur de surface de l'acide α-sialique de la cellule hôte. Est une glycoprotéine HA trimère qui est présente dans l'enveloppe de membrane de tous les virus de la grippe et nécessite un clivage dans le sous-unités HA1 et HA2 de par une protéase spécifique de la cellule hôte. Pour compliquer davantage la situation, ces sites de clivage peuvent souvent varier entre 13 souches virales. Comme l'expression de protéases capables de cliver HA est limitée à des tissus spécifiques, les protéases are souvent ajouté à des milieux de culture cellulaire dans le but de faciliter la fusion virale et l'entrée dans la cellule hôte choisie 13. TPCK-trypsine est un exemple d'une protease couramment utilisé qui est utilisé dans la culture de cellules à la fois avec des cellules MDCK et des cellules Vero: faciliter la reproduction multi-cycle (en l'absence de sérum d'inactivation de la trypsine) par l'intermédiaire de l'activation protéolytique de HA virale 14,15.
Comme démontré dans cette étude et d'autres, les différences dans les cycles de vie virales peuvent influencer sélections de superposition, les formats de plaque, et les temps de collecte, avec des écarts importants entre les classes et les espèces de virus différents. Dans notre étude, les superpositions d'agarose démontré plaques claires à des titres plus élevés que soit CMC ou superpositions liquides à la fois pour la FVR et virus de la grippe B, renforçant son utilité parmi un large éventail de virus et de types cellulaires. En utilisant une faible concentration finale de agarose grandement aidé à enlever les bouchons solides et coloration simplifiée. CMC a démontré l'ensemble, le poorest efficacité comme une superposition pour les trois virus testés et produits très petites et indistinctes plaques de virus de la grippe B. Bien que, globalement CMC a démontré les caractéristiques les moins souhaitables, son utilisation en croissance rapide et extrêmement virus virulents pourraient se révéler avantageux, car il ne semble pour réduire la taille de la plaque avec seulement une diminution minimale dans le titre. Le revêtement liquide est avéré être le plus souple en ce qu 'il est extrêmement simple à préparer, une plus grande facilité d'utilisation, et est comparable à de l'agarose à travers tous les virus sélectionnés. Dans un format de plaque débit supérieur à 96 puits, l'application et l'enlèvement n'a pas été inhibée en raison de solidification avec des superpositions traditionnels, et a fourni des résultats précis et cohérents. Une considération lors de l'utilisation des superpositions liquides réside dans la coloration opaque et l'incapacité à contrôler la formation de plaques comme les plaques ne peuvent être déplacés jusqu'à ce que le point de collecte, de limiter cette adaptation de virus avec la cinétique de réplication précédemment caractérisées.
modifications mineures dans des conditions de test de la plaque peuvent modifier significativement les résultats et l'évaluation et la performance d'un nouveau système ou technique est toujours justifié. Bien qu'un protocole de dosage de la plaque optimisée et standardisée ne existe pas pour toutes les situations, notre rapport démontrent la polyvalence et la facilité d'utilisation en traditionnel ainsi que de nouveaux revêtements liquides pour les essais de la plaque, tout en offrant suffisamment d'expérience pour des modifications ultérieures de l'utilisateur.Déclarations de divulgation
The authors have nothing to disclose and no competing or financial interests in the protocol or products described.
Remerciements
We would like to thank FMC BioPolymer USA for product samples of Avicel. This work was supported through the Defense Threat Reduction Agency grant HDTRA1-13-1-0005 to KK and the NIH research grant 1R15AI100001-01A1to KK.
matériels
| Name | Company | Catalog Number | Comments |
| 6-well CellStar plate for tissue culture | Greiner Bio-One | 658 160 | |
| 12-well CellStar plate for tissue culture | Greiner Bio-One | 665 180 | |
| 96-well CellStar plate for tissue culture | Greiner Bio-One | 655 180 | |
| 96-2ml deep well plate | USA Scientific | C15046314 | For serial dilutions |
| DMEM | Quality Biologicals | 112 013 101 | Cell Media/Diluent |
| 2x EMEM for plaques | Quality Biologicals | 115 073 101 | Warm to 37 °C |
| MEM 100x | Cellgro | 25 025 Cl | |
| Sodium Pyruvate | Cellgro | 25 000 Cl | |
| Penicillin Streptomycin | Gibco | 15140 122 | |
| L-Glutamine | Gibco | 25030 081 | |
| HyClone FBS | Thermo Scientific | SH30910.03 | Heat inactivate before use at 62 °C for 30 min |
| Bovine Serum Albumin | Sigma Aldritch | A7030-50G | |
| Trypsin TPCK | Sigma Aldritch | T1426-50mg | Make aliquots/Avoid freeze thawing |
| HEPES | Gibco | 15630-080 | |
| DEAE-Dextran | Sigma Aldritch | D9885-10G | |
| Crystal Violet | Sigma Aldritch | C3886-25G | |
| Formaldehyde Solution | Sigma Aldritch | F8775-500ml | |
| Ethanol denatured Reagent Grade | Sigma Aldritch | 362808-1L | |
| Avicel RC-591 NF | FMC BioPolymer USA | RC-591 NF | Shake vigorously when reconsitiuting for >30 min to homogenize |
| UltraPure Agarose | Invitrogen | 16500-100 | |
| Carboxymethyl cellulose, Sodium Salt Medium Viscosity | Sigma Aldrich | C4888 |
Références
- Cooper, P. D. The plaque assay of animal viruses. Adv. Virus Res. 8, 319-378 (1961).
- Dulbecco, R., Vogt, M. Some problems of animal virology as studied by the plaque technique. Cold Spring Harb. Symp. Quant. Biol. 18, 273-279 (1953).
- Hartley, J. W., Rowe, W. P. Tissue culture cytopathic and plaque assays for mouse hepatitis viruses. Proc. Soc. Exp. Biol. Med. Soc. Exp. Biol. Med. N. Y. 113, 403-406 (1963).
- Juarez, D., Long, K. C., Aguilar, P., Kochel, T. J., Halsey, E. S. Assessment of plaque assay methods for alphaviruses. J. Virol. Methods. 187, 185-189 (2013).
- Shurtleff, A., Keuhne, A., Biggins, J., Keeney, A. Use of alternative overlays in plaque assays. , (2011).
- Shurtleff, A. C., et al. Standardization of the Filovirus Plaque Assay for Use in Preclinical Studies. Viruses. 4, 3511-3530 (2012).
- Matrosovich, M., Matrosovich, T., Garten, W., Klenk, H. -. D. New low-viscosity overlay medium for viral plaque assays. Virol. J. 3, 63 (2006).
- Klebe, R. J., Harriss, J. V. A technically simple ‘non-lethal’ vital staining procedure for viral plaque and cell transformation assays. Arch. Virol. 81, 359-362 (1984).
- Gaush, C. R., Smith, T. F. Replication and plaque assay of influenza virus in an established line of canine kidney cells. Appl. Microbiol. 16, 588-594 (1968).
- Abiko, C., et al. Outbreak of Human Metapneumovirus Detected by Use of the Vero E6 Cell Line in Isolates Collected in Yamagata, Japan, in 2004 and 2005. J. Clin. Microbiol. 45, 1912-1919 (2004).
- Baer, A., et al. Induction of DNA damage signaling upon Rift Valley fever virus infection results in cell cycle arrest and increased viral replication. J. Biol. Chem. 287, 7399-7410 (2012).
- Austin, D., et al. p53 Activation following Rift Valley Fever Virus Infection Contributes to Cell Death and Viral Production. PLoS ONE. 7, (2012).
- Böttcher-Friebertshäuser, E., Stein, D. A., Klenk, H. -. D., Garten, W. Inhibition of influenza virus infection in human airway cell cultures by an antisense peptide-conjugated morpholino oligomer targeting the hemagglutinin-activating protease TMPRSS2. J. Virol. 85, 1554-1562 (2011).
- Youil, R., et al. Comparative study of influenza virus replication in Vero and MDCK cell lines. J. Virol. Methods. 120, 23-31 (2004).
- Tobita, K., Sugiura, A., Enomoto, C., Furuyama, M. Plaque assay and primary isolation of influenza a viruses in an established line of canine kidney cells (MDCK) in the presence of trypsin. Med. Microbiol. Immunol. (Berl.). 162, 9-14 (1975).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon