Method Article
Minimal intervention chirurgicale invasive d'induire un infarctus du myocarde chez des souris
Dans cet article
Résumé
A highly reproducible model for myocardial infarction in mice with minimal invasive manipulations is described. The model can be easily performed, resulting in a high reproducibility and survival rate. Thus, the described model will reduce the number of required animals as requested by the 3R principle (Replacement, Refinement and Reduction).
Résumé
L'infarctus du myocarde reste la principale cause de décès dans les pays occidentaux, en dépit des progrès considérables dans le domaine du développement de stent dans les dernières décennies. Pour des précisions sur les mécanismes sous-jacents et le développement de nouvelles stratégies thérapeutiques, la disponibilité de modèles animaux valides sont obligatoires. Depuis que nous avons besoin de nouvelles idées dans pathomécanismes de maladies cardiovasculaires sous les conditions in vivo pour lutter contre l'infarctus du myocarde, la validité du modèle animal est un aspect crucial. Toutefois, la protection des animaux sont très pertinents dans ce contexte. Par conséquent, nous établissons un modèle minimalement invasive et simple d'infarctus du myocarde chez les souris, qui assure une haute reproductibilité et le taux de survie des animaux. Ainsi, ces modèles répond aux exigences du principe des 3R (remplacement, raffinement et réduction) pour les expérimentations animales et d'assurer l'information scientifique nécessaire à la poursuite développement de stratégies thérapeutiques pour cardiovasculaire maladies.
Introduction
L'infarctus du myocarde est une des principales causes de décès dans les pays industrialisés. Malgré des progrès indéniables des approches diagnostiques et thérapeutiques, les maladies cardiovasculaires demeurent la principale cause de mortalité. Compte tenu de l'espérance de vie améliorée et les risques liés à la vie, il est prévu une augmentation continue de l'incidence des maladies cardiovasculaires à l'avenir. Par conséquent, il existe un fort besoin pour établir et valider de nouvelles approches pour le traitement de maladies cardiovasculaires. Les informations des études humaines souffrent de ses limites, ces études sont généralement insuffisantes pour expliquer et comprendre les mécanismes à l'échelle moléculaire, étant incapable de fournir des solutions à ces problèmes de santé majeurs.
En outre, la recherche fondamentale a été limitée en raison de la complexité et de la difficulté à reproduire les mécanismes de la maladie cardiovasculaire dans le laboratoire. Par conséquent, pour accroître nos connaissances sur la physiopathologie des maladies cardioles maladies vasculaires, il est essentiel de valider des modèles animaux 1,2. Toutefois, afin d'identifier tous les cascades d'événements moléculaires impliqués dans la guérison après un infarctus du myocarde, l'analyse à différents points dans le temps est nécessaire, provoquant un grand nombre d'expérimentations animales.
D'infarctus du myocarde expériences sont souvent réalisées à l'aide de modèles animaux. Induire un infarctus du myocarde chez les petits animaux 3-11 est le modèle le plus approprié et efficace utilisé pour enquêter sur les événements cellulaires et moléculaires que les grands modèles animaux. En outre, aucune autre espèce présente la disponibilité de souches transgéniques ou knock-out que les souris 12. Ces modèles de souris sont très utiles dans d'autres maladies, y compris des pathologies cardio-vasculaires (telles que l'athérosclérose, la resténose en stent) 13,14. En outre, la période de grossesse à faible et le nombre élevé de descendances qualifient modèles de souris comme système le plus attrayant pour étudier les mécanismes moléculaires de l'INFA infarctusrction 12.
Néanmoins, la taille du cœur chez les souris attend haute précision de manipulation lors de la microchirurgie. Enseigner ce personnel de chirurgie qualifiés et compétents est un temps et processus de travail intensif. Par conséquent, nous présentons ici une procédure de microchirurgie détaillée, y compris des conseils et astuces pour guider les collaborateurs, même avec des qualifications moyennes, comme les étudiants ou techniciens pour effectuer le modèle d'infarctus du myocarde complexe chez la souris.
Dans un premier temps, l'intubation est effectuée au moyen d'une canule courte sans utiliser la trachéotomie. L'incision thoracique est situé dans la zone intercostal, en évitant un dommage de nervures et / ou des tissus environnants. Cette sous-étape est très pertinente pour assurer une récupération rapide et la guérison 15. La ligature est faite différencié pour les modèles d'ischémie chronique et l'ischémie / reperfusion, pour un taux de survie élevé tout en conservant une taille significative du myocarde. Notre expérience montre that en utilisant une suture de soie assure une reproductibilité élevée par rapport aux blessures cryo-16.
En conclusion, le procédé décrit ici est applicable à la fois dans des modèles d'ischémie chronique et l'ischémie / reperfusion chez les petits animaux. Les trucs et astuces présentés dans cette procédure sont destinées à permettre au personnel avec la qualification même de faible ou moyenne de l'appliquer dans des petits modèles animaux.
Protocole
REMARQUE Les expériences présentées dans ce document sont réalisées en conséquence de la faible allemand et les lignes directrices de soins des animaux européens. Les animaux sont élevés dans l'animalerie de l'Institut for Laboratory Animal Science, Universiy hôpital Aachen, en Allemagne, sous la supervision du Prof. Dr. R. Tolba et le Dr A. Teubner (animal officier de bien-être).
1. Animal Care
- Garder la souris dans une unité de soins spécialisés, assurant un accès adéquat à la nourriture et le contrôle vétérinaire spécialisée et le traitement. Si les animaux sont déplacés ou achetés à l'extérieur, s'il vous plaît assurer d'une semaine logement avant de subir la procédure.
2. intubation
- Anesthetize 8-10 semaines vieux mâles C57BL / 6 souris de type sauvage, de 25 à 27 g par injection intrapéritonéale de 100 mg / kg de kétamine et 10 mg / kg de xylazine. Surveiller le niveau de l'anesthésie par orteil réflexes de pincement. Placez vétérinaire pommade sur les yeux pour prévenir la sécheresse au cours de la procédure.
- gérer le traitement de la douleur avec buprénorphine 0,1 mg / kg de poids corporel sous-cutanée avant de commencer la procédure chirurgicale, en suivant les lignes directrices de soins aux animaux de votre institution.
- Assurer le maintien de conditions stériles pour éviter les infections au cours de la chirurgie en utilisant des matériaux et des instruments stériles.
- Passer la souris anesthésiées dans une position en décubitus dorsal sur une table d'opération chauffée. Enlever les poils à la fois de surface ventrale du cou et de la moitié gauche de la poitrine au moyen d'un petit rasoir et désinfecter avec 70% d'alcool avant l'incision.
- Effectuer une petite incision médiane de 0,5 cm avec des ciseaux de chirurgie dans le centre de la nuque. Sous la peau, passer par les corps gras 2 avec une pince incurvés stériles et de visualiser la trachée sous stéréomicroscope travers la transparence du muscle de couverture.
- Présentez oralement le canule d'intubation dans la trachée sous vue en utilisant stéréoscopique (figure 1A). Distinguer la canule métallique through le tissu transparent. Et vérifier, la position et l'emplacement lors de l'opération à tout moment (figure 1B).
- Branchez la canule pour le petit ventilateur animale et régler les paramètres de ventilation selon fabrique des lignes directrices (de volume de marée entre 100-150 pi et un taux de respiration entre 100-150 par minute).
3. infarctus du myocarde Induction
- Effectuez une incision de la peau à moins de 0,5 cm dans le milieu d'une ligne entre xyphoïde et axila gauche. Utiliser des pinces pour séparer la couche musculaire de nervures sous-jacentes.
- Effectuer une petite incision entre les côtes en utilisant un petit ciseau jusqu'à ce que la cavité thoracique est ouverte 17. Pour myocarde chronique, effectuer l'incision dans l'espace 5 ème intercostal (figure 1C) et / ou du modèle d'ischémie / reperfusion, dans la 4 ème espace intercostal (Figure 1D): pour un indice d'approche facile en dessous de la 2 ème et la 3 e espace intercostal, respectivement).
- Placez les écarteurs dans l'incision pour ouvrir la cavité thoracique et de visualiser le coeur.
- Retirez délicatement le péricarde pour empêcher les processus fibrotiques excessives.
- Visualisez l'artère coronaire gauche (AIA) comme un navire lumière rouge profond positionné. Si la DAL ne peut être visualisé, considérer quelques points de référence pour augmenter la reproductibilité.
- Pour un modèle d'infarctus chronique, placer la ligature au milieu de la face ventrale du cœur (oreillette et entre l'apex), ayant comme référence la veine comme indiqué sur la figure 1C. Lier les deux branches de l'artère en utilisant une suture de soie 0/7 pour obtenir une antérieure et postérieure du myocarde transmural. La couleur grise indique la position de la ligature et peut être répétée si nécessaire (figure 1C).
- Pour l'ischémie / modèle de reperfusion, placer la ligature sous le pavillon de l'oreille, sur le corps principal de LAD (figure 1D). Le ligature est situé sur un tube de silicium pour protéger l'intégrité de la cuve. La couleur grise indique la zone d'infarctus et devrait apparaître dans l'ensemble du coeur (figure 1D). Passer sutures temporelles sur les nervures au cours de la période d'ischémie et humidifier à l'aide d'une compresse pour éviter le séchage des tissus. Après l'ischémie, retirer le tube de silicium et de couper le fil de suture avec de petits ciseaux pour visualiser la reperfusion.
- Outre les anesthésiques et des analgésiques utilisés au début de la procédure (étapes 2.1 et 2.2), utiliser 0,5% d'isoflurane pendant la chirurgie pour assurer le confort adéquat de l'animal, ou suivre les directives de protection des animaux de votre institution.
4. Suture et récupération
- Éliminer l'air résiduel du thorax en complétant avec une solution saline isotonique chaud.
- Fermer le thorax avec des sutures 0/6 3 (comme le montre la Figure 2A et 2B). Positionner les sutures médian sous un angle de 90 °, afin d'assurer queealed fermeture des nervures, comme représenté sur la figure 2 (figure 2A, B).
- Fermez la couche musculaire avec 2 sutures (figure 2C) et la peau avec des sutures 3-4 0/6 (figure 2D). Effectuez ces sutures séparément pour obtenir une fenêtre appropriée pour de plus amples mesure échocardiographique.
- Débranchez la canule d'intubation du ventilateur et de permettre souffle spontanée. Pour une identification plus tard, marquera la souris en utilisant le système local (demander à l'agent de protection des animaux de votre institution).
- Fixer la souris sur le côté gauche sous la lampe rouge jusqu'à ce qu'il se réveille. Ne pas laisser un animal sans surveillance tant qu'il a repris conscience suffisante. Ne pas laisser un animal qui a subi une intervention chirurgicale pour être en compagnie d'autres animaux jusqu'à guérison complète.
- Gérer le traitement de la douleur avec buprénorphine 0,1 mg / kg de poids corporel, voie sous-cutanée pour les 3 prochains jours, en suivant les lignes directrices de soins aux animaux de votre institution.
5. Analyse de l'infarctus du myocarde
- Surveiller régulièrement la fonction cardiaque au moyen de l'échocardiographie (figure 3A): la fraction d'éjection, la fraction de raccourcissement, le débit cardiaque et les dimensions cardiaques.
- Anesthésier les animaux en utilisant une injection intraperitoneale de 100 mg / kg de kétamine et 10 mg / kg de xylazine. Confirmez anesthésie appropriée avant la chirurgie par l'absence de réflexes.
- Ouvrez la cavité thoracique et exciser le coeur, le plaçant dans une solution de PBS stérile laver abondamment le reste du sang.
- Si nécessaire, collecter le sang directement à partir du coeur en évitant la lésion des régions infracted, ou après élimination du coeur, à partir de la cavité thoracique.
- Après le lavage, arrêter le coeur dans Diastola dans une solution saturée de KCl (stérile filtré 3M KCl dans du PBS). Pour l'analyse histologique fixer le coeur formol à 10% et passez à l'étape 5.7.
- Si nécessaire, mesurer la viabilité de la voitureDiac cellules par Evans-Bleu / Triphenyl tétrazolium (TTC) coloration. Après la reconstruction de la ligature à l'endroit initial, perfuser le coeur avec 200 pi 1% solution de bleu Evans en utilisant une canule aortique et de geler le cœur dans un petit sac en plastique à -20 ° C, sans lavage.
- Après 2 h, effectuer 5 toboggans transversalement l'aide d'un scalpel et les incuber pendant 10-15 min en solution TTC à 37 ° C, comme décrit par manufacturé. Fixer les lames pendant 10 minutes dans 10% de formol et de les mettre entre les lames microscopiques pour une analyse plus approfondie.
- Incluez le tissu cardiaque dans de la paraffine, en positionnant le coeur sur la pointe, pour effectuer transversale sectionnement. Effectuer section de série de 5 um. Recueillir les 20 premiers tronçons et jeter le prochain 300 um. Continuer le protocole de section jusqu'à ce que le niveau de la valve mitrale a été atteint (figure 3A, B). Des coupes en série, 400 um part le long de la totalité de coeur sont recueillis et peuvent être colorées fou l'analyse qualitative et quantitative.
- Mesurer la taille de l'infarctus en utilisant une seule étape de Gomori coloration 6-8.
- Analyser l'angiogenèse, la teneur en collagène ou inflammatoire recrutement de cellules dans la section série en utilisant une coloration immunohistochimique d'habitude.
Résultats
La procédure de l'infarctus du myocarde se produit dans les 25 à 30 min et présente un taux de mortalité de 10%. Après la chirurgie, les souris se remettre de l'anesthésie dans les 15 prochaines minutes. Aucune déficience physique a été observée à la souris exploité. Cependant, il ya un risque plus élevé de rupture coeur d'une semaine après un infarctus du myocarde post-chronique, si les processus de réparation sont perturbés au cours de la phase inflammatoire. Depuis coeur est capable de changer de façon significative ses dimensions pendant le pompage, il est important pour tous les cœurs recueillies pour être arrêtés dans la même position, par exemple dans Diastola. Ceci peut être réalisé en perfusant le coeur avec une solution saturée de KCl. L'augmentation de la concentration extracellulaire blocs K + des pompes ioniques, diminue le potentiel de membrane au repos des cellules cardiaques, ce qui entraîne un arrêt de l'activité cardiaque diastolique.
La zone du myocarde peut être vu dans l'analyse par ultrasons (figure 3A, panneau inférieur). En comparaison dele myocarde normal, les régions ischémiques apparaît mince et hypokinétique (figure 3A, panneau supérieur). Selon le modèle utilisé, la taille de l'infarctus sera différent. Le modèle d'infarctus chronique induit circulaire, infarctus transmural de l'apex (figure 3B), tandis que l'ischémie / reperfusion induit une mince, milieu-mur et à travers tout le coeur (figure 3C). Il existe de nombreuses méthodes pour déterminer la taille de l'infarctus. Si l'objectif est d'analyser l'effet direct sur la viabilité cardiaque, un Evans-Bleu / TTC coloration 18 est indiqué pour être effectuée au moins 2 heures après la reperfusion, pour être en mesure de voir les changements dans le myocarde. Les articles peuvent être analysés immédiatement (figure 3B, panneau du milieu) après coloration ou peuvent être conservés entre des lames de verre dans du formol pendant 2-3 jours (figure 3C, panneau du milieu). La zone bleue représente le myocarde sain, pas affecté par l'ischémie. La zone rouge représente le myocarde viable à l'intérieur ee zone ischémique (myocarde de risque), et la zone blanche représente le tissu mort. Habituellement, la taille de l'infarctus est exprimée en pour cent de la zone de risque.
La cicatrice maturité résultant après des processus de remodelage peut être facilement mesurée par immunohistolgy utilisant une seule étape de la coloration de Gomori. Les zones colorées en bleu et rouge infarcis teinté sains ventriculaires (figure 3B et C, panneaux de droite) sont déterminés dans la première section de chaque niveau jusqu'à ce que la valve mitrale. Pour éviter la variation due à la liaison de LAD à différents niveaux, de l'infarctus est considérée comme tout article et exprimée en pourcentage du volume total du ventricule gauche. Un volume de l'infarctus de 15 à 20% dans le modèle chronique de l'infarctus et de 10 à 15% après modèle d'ischémie / reperfusion peut être obtenue. En outre, le modèle d'infarctus chronique va induire une dilatation accentuée, pas observé dans le modèle ischémique / de reperfusion (figure 3B et C right panneau).
Des procédures classiques de coloration peuvent être utilisés, tels que: la coloration CD31 utilisé pour révéler l'angiogenèse (rouge, figure 4A) ou lisse coloration de l'actine de muscle afin de déterminer les myofibroblastes (vert, la figure 4B). Double coloration de fluorescence peut également être appliquée pour identifier les molécules cibles différentes dans la zone du myocarde, car l'absence de cardiomyocytes ne donne aucune auto-immunofluorescence (Figure 4C).
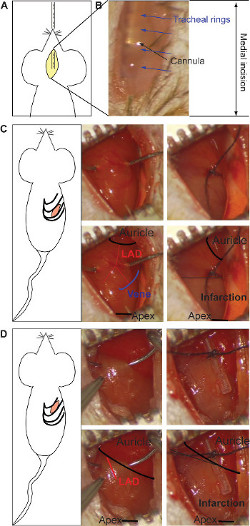
Figure 1: Incision médiane et l'insertion de la canule de l'intubation (A). La visualisation stéréomicroscopique de la canule métallique à travers la transparence du tissu (B). Les anneaux de la trachée (flèches bleues) et la canule (flèche noire) sont soulignés. L'incision intercostale pour le mo myocarde chroniquedel et la ligature de LAD (C). La ligature est situé au milieu du cœur (entre l'oreillette et le sommet, noir dans le panneau inférieur), en prenant comme référence la fin de la veine (schématique en bleu, panneau inférieur). Les deux branches de l'artère devraient être liés (rouge dans le panneau inférieur). La couleur grise indique zone infarcie et il apparaît dans la moitié inférieure du coeur (à droite du panneau inférieur). La ligature pour le modèle d'ischémie / reperfusion est faite en vertu de l'oreillette, contraignant le corps principal de LAD (rouge dans le panneau inférieur) sur un tube de silicium (à droite) (D). La couleur grise indique la zone infarci, qui est présent sur l'ensemble du coeur (à droite du panneau inférieur). S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
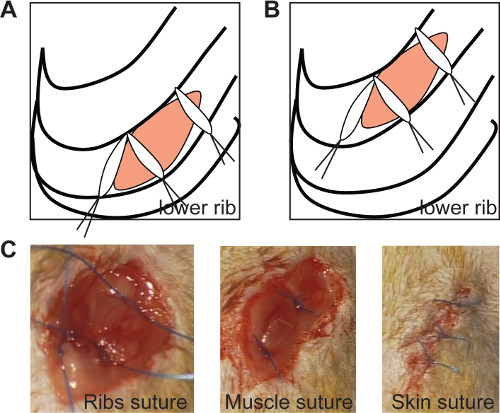
Figure 2: Les joints de suture ribs l'incision thoracique si les sutures médiales sont positionnés à un angle de 90 ° dans les deux chroniques (A) et l'ischémie / modèle de reperfusion (B, panneau de gauche). En imagerie in vivo de nervures suture (C, panneau de gauche ), suture musculaire (C, panneau du milieu) et la suture de la peau (C, panneau de droite). S'il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
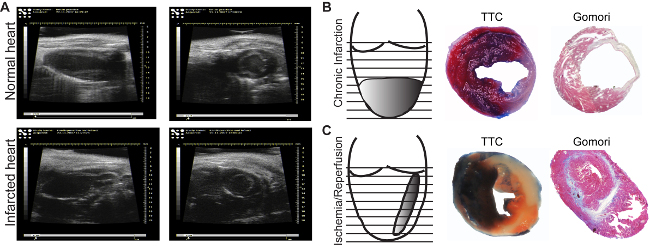
Figure 3: images échocardiographiques. Les images de la normale (A, panneau supérieur) et des zones infarctus (A, panneau inférieur), sont acquises à l'axe longitudinal (longitudinaux, panneaux de gauche) ou à l'axe court (transversal, panneaux de droite) .. myocarde induite par ligature chronique(B) et par une ischémie suivie d'une reperfusion h (C). Evans Bleu / TTC coloration permet l'identification des perfusé (bleu) / zones non-perfusé ainsi que la viabilité (rouge) / morts (blanc) myocarde (B, C, panneaux du milieu). Une étape de coloration de Gomori permet l'identification des zones infarctus (en bleu), et les différencie des régions normales (rouge) (B, C, panneaux de droite). S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
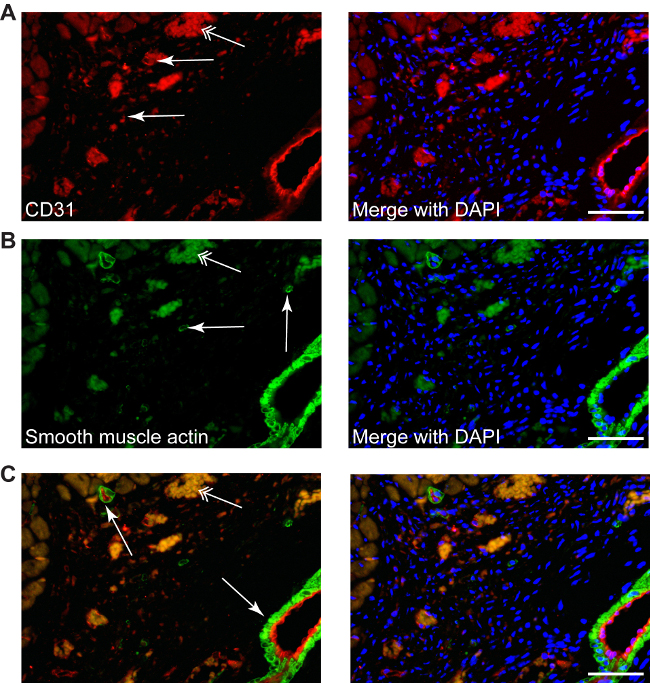
Figure 4: Les différentes colorations peuvent être réalisées dans la zone infarci, tels que CD31 pour la néo-angiogenèse décrit (A, rouges, flèches simples), ou l'actine de muscle lisse de myofibroblastes (B, green, flèches simples), ainsi que la double coloration (C, CD31-rouge / vert-actine musculaire), DAPI pour les noyaux (bleu). Myofibroblastes peuvent être différenciées facilement à partir de cellules musculaires lisses de petites ou de grandes artères, qui sont toujours accompagnés d'une couche endothéliale (C, flèches). Les doubles flèches pointent du érythrocytes autofluorescence. Échelle barres 50 um.
Discussion
Durant la procédure, il ya quelques points essentiels à noter: l'intubation, l'ouverture de la cavité thoracique et la ligature LAD. La première étape critique est l'intubation de l'animal avant experiements. De nombreux groupes utilisent un support vertical pour la fixation de la souris et une source de lumière pour insérer la canule directement dans la trachée. Cette méthode a l'incertitude concernant l'insertion correcte de la canule dans la trachée et est le plus sujettes à l'échec par les novices. Faire une petite incision, la position de la canule peut être contrôlé pendant toute la manoeuvre, diminuant ainsi le taux de défaut. En outre, la trachéotomie est dépassé, diminuant ainsi les complications et de réduire le temps de fonctionnement.
La prochaine étape critique est l'ouverture de la cavité thoracique. La sternotomie médiane représente une manoeuvre à haut risque de retarder la récupération des animaux. L'incision latérale gauche implique la coupe de 2-3 nervures 15 , conduit à la récupération déficiente et une mortalité accrue. Nous avons utilisé dans le modèle petite incision entre les côtes discrète offrant une contrainte minimale. Les animaux récupèrent très rapidement après la chirurgie et ne présentent pas de défauts ou la guérison perturbé. L'espace inter-costal inférieur est prise comme point de référence. Considérant cela, l'accès approprié et différenciée à l'endroit pour ligature chronique et l'ischémie / reperfusion modèle, ne soulève pas de problèmes sérieux.
La ligature lui-même représente l'étape la plus critique. L'artère coronaire gauche est difficile à visualiser, et souvent besoin d'être lié sans vue. Par conséquent, certains points de référence anatomiques sont signalés pour aider le chirurgien pour effectuer la ligature correcte. Pour le modèle d'infarctus chronique, la ligature est placé au milieu de la face ventrale du coeur, entre l'oreillette et le sommet, au-dessus de la terminaison de la veine principale antérieure (figure 2B). L'efficacité peut être controrempli par la visualisation de l'apparition de la couleur grise dans les zones touchées. Si la zone infarcie apparaît antérieur et ne comprend pas la paroi postérieure, un nouveau fil de suture peut être placé à la gauche de la première suture. La principale racine de LAD est toujours visible dans l'oreillette 18, et donc ne présente pas de graves problèmes dans la détection de cette partie. Cependant, l'oreillette présente le risque majeur de saignement et doit être manipulé avec soin.
La procédure est limitée par l'existence d'un équipement approprié. Un ventilateur et système d'anesthésie appropriée pour les petits animaux sont coûteux et nécessitent des connexions à gaz et système de ventilation de la pièce. En outre, une surveillance étroite des animaux est nécessaire dans la première semaine après la procédure pour détecter la clinique possible. Pour examiner la fonction cardiaque pendant l'expérience, l'échographie haute résolution, perfusion-Langendorf système complexe, ou de petites mesures de cathéter intraventriculaire sont nécessaires, invÉSOLUTION coûts élevés et une expertise supplémentaire.
Compte tenu de l'infarctus du myocarde, il n'y a pas d'autres méthodes disponibles pour reproduire la complexité des événements in vitro. Selon le point d'intérêt, ex vivo perfusion d'un coeur isolé dans le système de Langendorff fournit des informations sur la contractilité, la fonction cardiaque et la viabilité myocardique en réponse à différents stimuli ou des médicaments. Cependant, il exclut toutes les interférences des composants sanguins et le système immunitaire, et il est pas indiqué pendant de longues études de remodelage et la guérison après un infarctus du myocarde.
Après avoir effectué la procédure d'infarctus du myocarde, tous les autres l'analyse fonctionnelle peut être effectuée, comme mesures de la pression intraventriculaire, l'échographie (systèmes d'échographie petit animal) ou le cœur isolé de Langendorff perfusion. De plus, toute analyse biologique moléculaire et peut être effectuée pour identifier des cellules, des protéines, des micro-ARN, ARNm, genes ou d'autres biomarqueurs, qui peuvent être utilisés en tant que cibles thérapeutiques pour développer de nouvelles stratégies de traitement pour l'infarctus du myocarde.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by Interdisciplinary Centre for Clinical Research IZKF Aachen (junior research group to E.A.L.) within the faculty of Medicine at RWTH Aachen University. We are grateful Dr. Rusu and Ashley Christina Vourakis for critical review of the manuscript and Mrs. Roya Soltan for the professional help with immunohistochemistry staining.
matériels
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | |
| Mouse ventilator | Harvard Apparatus | 730043 | Model Minient 845 |
| Dual Anesthesia System (Tabletop Version) | Harvard Apparatus | Selfcontained isofluranebased anesthesia unit for use on lab tables, with a compact 8" x 11" footprint. | |
| Intubation cannula | Harvard Apparatus | 732737 | |
| Forceps | FST, Germany | 9119700 | standard tip curved 0.17 mm x 0.1 mm |
| Scissors | FST, Germany | 9146011 | straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | |
| Retractors | FST, Germany | 1820010 | 2.5mm wide |
| Retractors | FST, Germany | 1820011 | 5 mm wide |
| Wire handles | FST, Germany | 1820005 | 10 cm |
| Wire handles | FST, Germany | 1820006 | 14 cm |
| Ketamine 10% | CEVA, Germany | ||
| Xylazine 2% | Medistar, Germany | ||
| Bepanthene eye and nose cream | Bayer, Germany | ||
| Silicon tube | IFK Isofluor, Germany | custommade product | diameter 500 µm |
| section thickness 100 µm | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | |
| Ultrasound | Vevo, Canada | 770 Vevo |
Références
- Liehn, E. A., Postea, O., Curaj, A., Marx, N. Repair after myocardial infarction, between fantasy and reality: the role of chemokines. J Am Coll Cardiol. 58 (23), 2357-2362 (2011).
- Liehn, E. A., Radu, E., Schuh, A. Chemokine contribution in stem cell engraftment into the infarcted myocardium. Curr Stem Cell Res Ther. 8 (4), 278-283 (2013).
- Alexander, S., et al. Repetitive transplantation of different cell types sequentially improves heart function after infarction. J Cell Mol Med. 16 (7), 1640-1647 (2012).
- Liehn, E. A., et al. Compartmentalized protective and detrimental effects of endogenous macrophage migration-inhibitory factor mediated by CXCR2 in a mouse model of myocardial ischemia/reperfusion. Arterioscler Thromb Vasc Biol. 33 (9), 2180-2186 (2013).
- Liehn, E. A., et al. Ccr1 deficiency reduces inflammatory remodelling and preserves left ventricular function after myocardial infarction. J Cell Mol Med. 12 (2), 496-506 (2008).
- Liehn, E. A., et al. A new monocyte chemotactic protein-1/chemokine CC motif ligand-2 competitor limiting neointima formation and myocardial ischemia/reperfusion injury in mice. J Am Coll Cardiol. 56 (22), 1847-1857 (2010).
- Liehn, E. A., et al. Double-edged role of the CXCL12/CXCR4 axis in experimental myocardial infarction. J Am Coll Cardiol. 58 (23), 2415-2423 (2011).
- Oral, H., et al. CXC chemokine KC fails to induce neutrophil infiltration and neoangiogenesis in a mouse model of myocardial infarction. J Mol Cell Cardiol. 60, 1-7 (2013).
- Projahn, D., et al. Controlled intramyocardial release of engineered chemokines by biodegradable hydrogels as a treatment approach of myocardial infarction. J Cell Mol Med. 18 (5), 790-800 (2014).
- Schuh, A., et al. Novel insights into the mechanism of cell-based therapy after chronic myocardial infarction. Discoveries. 1 (2), e9 (2014).
- Schuh, A., et al. Effect of SDF-1 alpha on Endogenous Mobilized and Transplanted Stem Cells in Regeneration after Myocardial Infarction. Curr Pharm Des. 20 (12), 1964-1970 (2013).
- Zaragoza, C., et al. Animal models of cardiovascular diseases. J Biomed Biotechnol. 2011, 497841 (2011).
- Kanzler, I., Liehn, E. A., Koenen, R. R., Weber, C. Anti-inflammatory therapeutic approaches to reduce acute atherosclerotic complications. Curr Pharm Biotechnol. 13 (1), 37-45 (2012).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Kolk, M. V. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. J. Vis. Exp. (32), 1438 (2009).
- Ryu, J. H., et al. Implantation of bone marrow mononuclear cells using injectable fibrin matrix enhances neovascularization in infarcted myocardium. Biomaterials. 26 (3), 319-326 (2005).
- Frobert, A., Valentin, J., Cook, S., Lopes-Vicente, J., Giraud, M. N. Cell-based Therapy for Heart Failure in Rat: Double Thoracotomy for Myocardial Infarction and Epicardial Implantation of Cells and Biomatrix. J. Vis. Exp. (91), e51390 (2014).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A Murine Model of Myocardial Ischemia-reperfusion Injury through Ligation of the Left Anterior Descending Artery. J. Vis. Exp. (86), e51329 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon