Method Article
Minimal procedimento cirúrgico invasivo de induzir Infarto do Miocárdio em Ratos
Neste Artigo
Resumo
A highly reproducible model for myocardial infarction in mice with minimal invasive manipulations is described. The model can be easily performed, resulting in a high reproducibility and survival rate. Thus, the described model will reduce the number of required animals as requested by the 3R principle (Replacement, Refinement and Reduction).
Resumo
O infarto do miocárdio ainda permanece a principal causa de morte nos países ocidentais, apesar de progressos consideráveis na área de desenvolvimento de stent nas últimas décadas. Para esclarecimento dos mecanismos subjacentes eo desenvolvimento de novas estratégias terapêuticas, a disponibilidade de modelos animais válidos são obrigatórios. Desde que nós precisamos de novos insights sobre pathomechanisms de doenças cardiovasculares sob as condições in vivo para combater infarto do miocárdio, a validade do modelo animal é um aspecto crucial. No entanto, a protecção dos animais são altamente relevantes neste contexto. Portanto, estabelecer um modelo minimamente invasiva e simples de infarto do miocárdio em ratos, o que garante uma alta reprodutibilidade ea taxa de sobrevivência dos animais. Assim, este modelos satisfaz as exigências do princípio 3R (substituição, aperfeiçoamento e redução) para experimentos com animais e assegurar a informação científica necessária para posterior desenvolvimento de estratégias terapêuticas para cardiovdoenças ascular.
Introdução
O infarto do miocárdio é uma das principais causas de morte nos países industrializados. Apesar do progresso inegável de abordagens diagnósticas e terapêuticas, as doenças cardiovasculares ainda são a principal causa de mortalidade. Dada a expectativa de vida melhorou e os riscos relacionados com a vida, é esperado um aumento contínuo na incidência de doenças cardiovasculares no futuro. Por conseguinte, existe uma forte necessidade de estabelecer e validar novas abordagens para o tratamento de doenças cardiovasculares. As informações de estudos em seres humanos sofrem de suas limitações, esses estudos geralmente são insuficientes para explicar e compreender os mecanismos a nível molecular, sendo incapaz de fornecer soluções para estes graves problemas de saúde.
Além disso, a pesquisa básica tem sido limitada devido à complexidade e dificuldade para reproduzir os mecanismos de doenças cardiovasculares em laboratório. Portanto, para aumentar o nosso conhecimento sobre a fisiopatologia de cardiodoenças vasculares, é essencial para validar modelos animais 1,2. No entanto, para identificar todas as cascatas de eventos moleculares envolvidos na cicatrização após enfarte do miocárdio, a análise em diferentes pontos de tempo é necessário, causando um grande número de experiências animais.
Experimentos de infarto do miocárdio são muitas vezes realizadas usando modelos animais. Induzindo o infarto do miocárdio em pequenos animais 11/03 é o modelo mais adequado e eficiente empregada para investigar eventos celulares e moleculares do que as grandes modelos animais. Além disso, nenhuma outra espécie apresenta a disponibilidade das estirpes transgénicas ou como ratinhos knockout 12. Estes modelos de ratinho são altamente úteis em outras doenças, incluindo patologias cardiovasculares (tal como a aterosclerose, a restenose de stents) 13,14. Além disso, o período de gravidez de baixo e do elevado número de progênies qualificar modelos de mouse como o sistema mais atraente para estudar mecanismos moleculares de infa miocárdiorction 12.
No entanto, o tamanho do coração nos ratos espera alta precisão da manipulação durante a microcirurgia. Ensinar esse pessoal de cirurgia qualificados e especializados é um demorado e processo intensivo de trabalho. Portanto, aqui apresentamos um procedimento de microcirurgia detalhada, incluindo dicas e truques para orientar os colaboradores, mesmo com qualificações médias, como estudantes ou técnicos para executar o modelo de infarto do miocárdio complexo em camundongos.
Inicialmente, a intubação é realizada por meio de uma pequena cânula, sem utilizar a traqueotomia. A incisão torácica está localizado na área intercostal, evitando lesões de nervuras ou / e do tecido circundante. Esta sub-passo é altamente relevante para assegurar a recuperação e cura de 15 rápido. A ligadura é feita diferencial para modelos de isquemia crônica e isquemia / reperfusão, para uma elevada taxa de sobrevivência, mantendo um tamanho significativo infarto. Nossa experiência mostra that usando sutura de seda garante uma reprodutibilidade maior em comparação com crio lesões 16.
Em conclusão, o método aqui descrito é aplicável em ambos os modelos de isquémia crónica e isquemia / reperfusão, em animais de pequeno porte. As dicas e truques apresentados neste procedimento são destinadas a permitir que o pessoal com qualificação ainda baixa ou média para aplicá-lo em pequenos modelos animais.
Protocolo
NOTA: Os experimentos apresentados neste trabalho são realizadas em conformidade com o baixo alemão e às orientações europeias de cuidados de animais. Os animais são criados na unidade de animal Institute for Science Laboratory Animal, Universiy hospital de Aachen, na Alemanha, sob a supervisão do Prof. Dr. R. Tolba e Dr. A. Teubner (oficial de bem-estar animal).
1. Animal Care
- Mantenha os ratos em uma unidade de cuidados especializados, assegurando acesso adequado à alimentação e controlo veterinário especializado e tratamento. Se os animais são movidos ou comprados de fora, por favor, assegurar alojamento de uma semana antes de se submeter ao procedimento.
2. intubação
- Anestesiar 8-10 semanas de idade C57BL / 6 murganhos do tipo selvagem, 25-27 g usando injecção intraperitoneal de 100 mg / kg de cetamina e 10 mg / kg de xilazina. Monitorar o nível de anestesia por reflexos pitada dedo do pé. Coloque veterinário pomada nos olhos para evitar a secura durante o procedimento.
- Gerenciar terapia da dor com peso buprenophine subcutaneamente 0,1 mg / kg corpo antes de iniciar o procedimento cirúrgico, seguindo as orientações de cuidados de animais de sua instituição.
- Assegurar a manutenção de condições estéreis a fim de evitar as infecções durante a cirurgia, utilizando materiais e instrumentos estéreis.
- Posicione o mouse anestesiados em decúbito dorsal sobre uma mesa de cirurgia aquecida. Remover o cabelo, tanto da área ventral do pescoço e metade esquerda do tórax com uma pequena lâmina de barbear e desinfectar com álcool a 70% antes da incisão.
- Executar uma pequena incisão mediana de 0,5 cm, utilizando tesouras de cirurgia no centro do pescoço. Sob a pele, percorrer os corpos gordos 2 com uma pinça curva estéreis e visualizar a traqueia sob lupa através da transparência do músculo cobertura.
- Introduzir por via oral a cânula de intubação na traquéia sob visão usando o microscópio estereoscópico (Figura 1A). Distinguir a cânula de metal through o tecido transparente. E verificar, a posição eo local durante a operação a qualquer momento (Figura 1B).
- Conecte-se a cânula para o pequeno ventilador animais e ajustar as configurações de ventilação de acordo com as diretrizes fabrica (volume corrente entre 100-150 mL e uma taxa de respiração entre 100-150 por min).
3. Infarto do Miocárdio Indução
- Realize uma incisão na pele inferior a 0,5 cm no meio de uma linha entre xifóide e axila esquerda. Use uma pinça para separar a camada muscular das nervuras subjacentes.
- Realize uma pequena incisão entre as costelas usando uma pequena tesoura até a cavidade torácica é aberta 17. Para enfarte crónica, realizar a incisão no espaço intercostal 5 th (Figura 1C) e / ou para o modelo de isquemia / reperfusão, no 4 o espaço intercostal (Figura 1D): para um número de abordagem mais fácil de seguir o 2 ° eo 3 th espaço intercostal, respectivamente).
- Colocar os afastadores dentro da incisão para abrir a cavidade torácica e para visualizar o coração.
- Retire cuidadosamente o pericárdio para impedir processos fibróticos excessivos.
- Visualize a artéria coronária esquerda descendente (LAD) como um vaso vermelho luz profunda posicionado. Se o rapaz não pode ser visualizada, considerar alguns pontos de referência para aumentar a reprodutibilidade.
- Para o modelo de enfarte crónica, colocar a ligadura no meio do lado ventral do coração (entre a aurícula e do vértice), tendo como referência a veia, como mostrado na Figura 1C. Vincular ambos os ramos da artéria 0/7 usando sutura de seda para obter uma anterior e posterior infarto transmural. A cor cinza indica a posição da ligadura e pode ser repetido se necessário (Figura 1C).
- Para modelo de isquemia / reperfusão, colocar a ligadura sob a aurícula, sobre o corpo principal de LAD (Figura 1D). O ligtura está localizada ao longo de um tubo de silicone para proteger a integridade do recipiente. A cor cinza indica a área infartada e deve aparecer em todo o coração (Figura 1D). Coloque suturas temporais nas costelas durante o período de isquemia e umedeça com uma compressa para evitar a secagem do tecido. Após a isquemia, remover o tubo de silicone e cortar a sutura com pequenas tesouras para visualizar a reperfusão.
- Ao lado dos anestésicos e analgésicos utilizados no início do procedimento (passos 2.1 e 2.2), use 0,5% de isoflurano durante a cirurgia para garantir o conforto adequado do animal, ou siga as orientações de cuidados de animais de sua instituição.
4. Sutura e Recuperação
- Eliminar o ar residual do tórax através do preenchimento com solução salina isotônica quente.
- Feche o tórax com 3 suturas 0/6 (como mostrado na Figura 2A e 2B). Posicionar as suturas mediais a um ângulo de 90 °, para assegurar queealed encerramento das nervuras, como se mostra na Figura 2 (Figura 2A, B).
- Fechar a camada muscular com duas suturas (Figura 2C) e a pele com 3-4 suturas 0/6 (Figura 2D). Executar essas suturas separadamente para obter uma janela adequada para posterior medida ecocardiográfica.
- Desligue a cânula de intubação do ventilador e permitir a respiração espontânea. Para posterior identificação, marcar o mouse usando o sistema local (pedir o oficial de bem-estar animal de sua instituição).
- Deite o mouse no lado esquerdo sob a luz vermelha até que ele acorda. Não deixe um animal sem supervisão até que tenha recuperado a consciência suficiente. Não permita que um animal que tenha sido submetido a cirurgia para estar na companhia de outros animais até que esteja totalmente recuperado.
- Gerencie terapia da dor com buprenophine 0,1 mg / kg de peso corporal, por via subcutânea, para os próximos três dias, seguindo as orientações de cuidados de animais de sua instituição.
5. Análise do Infarto do Miocárdio
- Regularmente monitorar a função cardíaca por meio de ecocardiografia (Figura 3A): a fração de ejeção, fração de encurtamento, o débito cardíaco e as dimensões do coração.
- Anestesiar os animais utilizando injecção intraperitoneal de 100 mg / kg de cetamina e 10 mg / kg de xilazina. Confirmar anestesia adequada antes da cirurgia pela ausência de reflexos.
- Abra a cavidade torácica e extirpar do coração, colocando-o em solução PBS estéril lavagem extensivamente o sangue restante.
- Se necessário, recolher o sangue directamente do coração, evitando a lesão das regiões infracted, ou após a remoção do coração, a partir da cavidade torácica.
- Após a lavagem, parar o coração em Diastola em solução de KCl saturada (steril filtrada 3M KCl em PBS). Para a análise histológica corrigir o coração em formol 10% e prossiga com o Passo 5.7.
- Se necessário, medir a viabilidade do carrocélulas cardíacas por cloreto de tetrazólio Evans-Azul / trifenil (TTC) coloração. Após a reconstrução da ligadura inicial no local, o coração perfundir com 200 ul de uma solução de azul de Evans% usando uma cânula aórtica e congelar o coração num pequeno saco de plástico a -20 ° C, sem lavagem.
- Após 2 h, executar 5 slides transversalmente usando um bisturi afiado e incubar durante 10-15 minutos em solução de TTC a 37 ° C, tal como descrito por fabricado. Fixar as lâminas durante 10 minutos em 10% de formalina e colocá-los entre as lâminas microscópicas para posterior análise.
- Incorporar o tecido cardíaco em parafina, posicionando-se o coração na ponta, para efectuar o seccionamento transversal. Realizar secção série de 5 um. Recolher os primeiros 20 seções e descartar o próximo 300 m. Continuar o protocolo de secção até que o nível da válvula mitral foi atingido (Figura 3A, B). As secções em série, 400 um entre si ao longo de todo o coração são recolhidos e podem ser corados fou a análise qualitativa e quantitativa.
- Meça o tamanho do infarto usando uma etapa de Gomori coloração 6-8.
- Analisar a angiogênese, conteúdo de colágeno ou recrutamento de células inflamatórias na secção de série utilizando a coloração imuno habitual.
Resultados
O procedimento de infarto do miocárdio ocorre dentro de 25-30 min e mostra uma taxa de mortalidade de 10%. Após a cirurgia, os ratos recuperar da anestesia dentro do próximo 15 min. Sem deficiência física foi observada para o mouse operado. No entanto, há um maior risco de rotura cardíaca uma semana após enfarte do miocárdio pós-crónica, se os processos de reparação são perturbados durante a fase inflamatória. Uma vez que o coração é capaz de alterar significativamente as suas dimensões durante a bombagem, é importante que todos os corações recolhidos para ser parado na mesma posição, por exemplo, em Diastola. Isto pode ser conseguido por perfusão do coração com uma solução saturada de KCl. O aumento da concentração de K + blocos extracelulares as bombas iónicas, diminui o potencial de repouso da membrana das células cardíacas, o que resulta numa paragem cardíaca diastólica de actividade.
A área de enfarte pode ser observado na análise de ultra-sons (Figura 3A, painel inferior). Em comparação ao miocárdio normal, regiões isquêmicas aparecer fino e hipocinético (Figura 3A, painel superior). Dependendo do modelo utilizado, o tamanho do enfarte serão diferentes. O modelo de enfarte crónica induz circular enfarte, transmural do vértice (Figura 3B), enquanto que a isquemia / reperfusão induz um, meio-parede fina e ao longo de todo o coração (Figura 3C). Existem muitos métodos para determinar o tamanho do enfarte. Se o objectivo é o de analisar o efeito directo na viabilidade cardíaca, uma Evans Azul / TTC coloração 18 é indicado para ser realizada pelo menos 2 horas após a reperfusão, para ser capaz de ver qualquer mudança no miocárdio. As secções podem ser analisadas imediatamente (Figura 3B, painel do meio) depois da coloração ou pode ser mantida entre as lâminas de vidro em formalina durante 2-3 dias (Figura 3C, painel do meio). A área azul representa o miocárdio normal, não afetada pela isquemia. A área vermelha representa o miocárdio viável dentro the área isquêmica (miocárdio de risco), ea área branca representa o tecido morto. Geralmente, o tamanho do enfarte é expressa como percentagem da área de risco.
A cicatriz madura resultante após os processos de remodelação pode ser facilmente medido por immunohistolgy usando um passo de coloração de Gomori. Áreas azuis manchados de infartados e manchados de vermelho saudáveis ventriculares (Figura 3B e C, painéis à direita) são determinados na primeira seção de cada nível até que a válvula mitral. Para evitar a variação devida à ligação de LAD em diferentes níveis, o enfarte de toda a secção é considerado e expresso como uma percentagem do volume ventricular esquerda total. Um volume de enfarte de 15-20% no modelo de enfarte crónico e de 10-15% após o modelo de isquemia / reperfusão pode ser alcançado. Além disso, o modelo de enfarte crónica vai induzir uma dilatação acentuada, não observado no modelo de isquemia / reperfusão (Figura 3B e C righpainel de t).
Procedimentos de coloração convencionais podem ser usados, tais como: coloração CD31 usado para revelar a angiogénese (vermelho, Figura 4A) ou coloração com actina de músculo liso para determinar miofibroblastos (verdes, a Figura 4B). Coloração por fluorescência dupla também pode ser aplicado para identificar diferentes moléculas alvo na área de enfarte, visto que a ausência de cardiomiócitos não dá nenhuma de auto-imunofluorescência (Figura 4C).
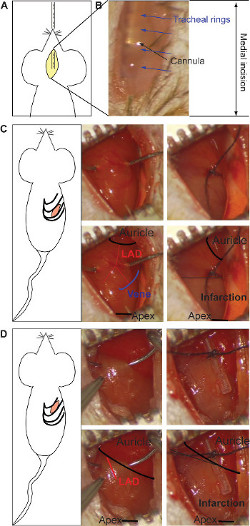
Figura 1: Incisão medial e inserção da cânula da intubação (A). A visualização estereomicroscopia da cânula de metal através da transparência do tecido (B). Os anéis traqueais (setas azuis) e da cânula (seta preta) são apontados. A incisão intercostal, para o mo enfarte crónicadel ea ligadura de LAD (C). A ligadura está localizado no meio do coração (entre a aurícula e do vértice, preto no painel inferior), tomando como referência a extremidade do veia (esquemático em azul, painel inferior). Ambos os ramos da artéria deve ser ligado (vermelho no painel inferior). A cor cinza indica a área infartada e ele aparece na parte inferior metade do coração (painel inferior direito). A ligadura para o modelo de isquemia / reperfusão é feita sob a aurícula, a ligação do corpo principal de LAD (vermelho no painel inferior) ao longo de um tubo de silicone (lado direito) (D). A cor cinza indica a área de infarto, que está presente no coração de todo (painel inferior direito). Por favor clique aqui para ver uma versão maior desta figura.
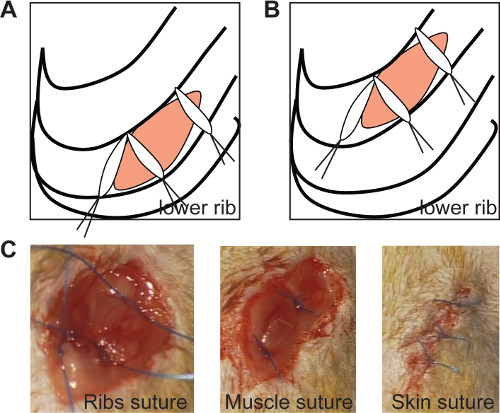
Figura 2: Os selos de sutura a incisão torácica costelas se as suturas medial estão posicionadas segundo um ângulo de 90 ° em ambas crónica (A) e de isquemia / reperfusão modelo (B, painel esquerdo) imagiologia in vivo de nervuras de sutura. (C, painel esquerdo ), sutura muscular (C, painel do meio) e sutura da pele (C, painel direito). Por favor clique aqui para ver uma versão maior desta figura.
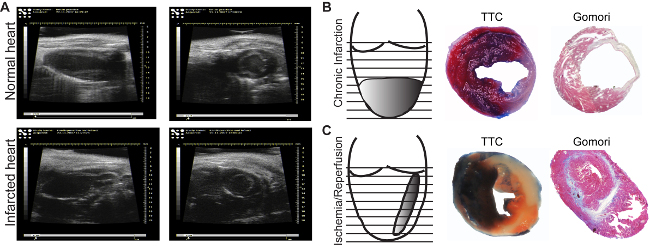
Figura 3: As imagens ecocardiográficas. Imagens de normal (A, painel superior) e áreas enfartadas (A, painel inferior), são adquiridos no eixo comprido (longitudinais, painéis esquerdos) ou no eixo curto (transversal, painéis direitos) .. Enfarte induzida por ligadura crónica(B) e por uma isquemia h seguida de reperfusão (C). Evans Blue / TTC coloração permite a identificação de perfusão (azul) / áreas não perfundidos bem como a viabilidade (vermelho) / (branco) miocárdio morto (B, C, painéis de média). Uma etapa de coloração de Gomori permite a identificação de áreas infartadas (azul), e os diferencia as regiões normais (vermelho) (B, C, painéis à direita). Por favor clique aqui para ver uma versão maior desta figura.
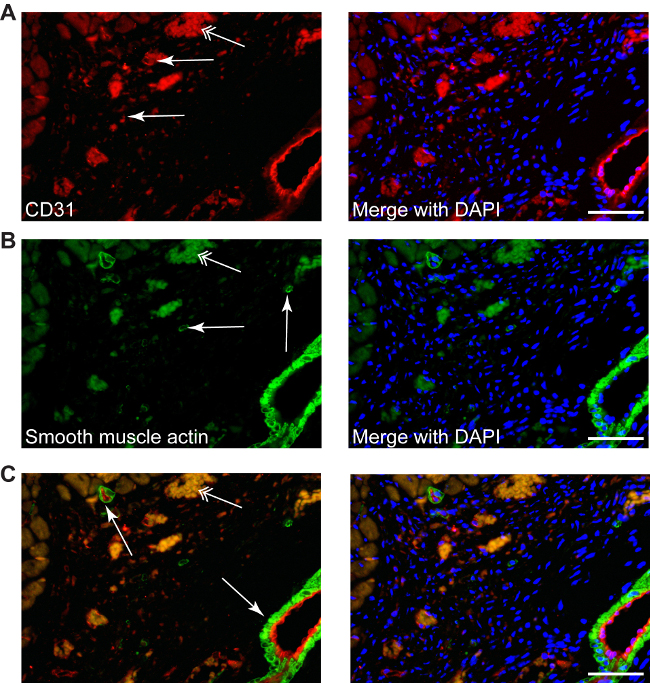
Figura 4: Diferentes colorações podem ser realizadas em área de infarto, tal como descrito para CD31 neo-angiogénese (A, vermelho, setas simples), ou de actina do músculo liso para miofibroblastos (B g;reen, setas simples), bem como coloração dupla (C, CD31-vermelho / verde-actina de músculo liso), contrastadas com DAPI para núcleos (azul). Miofibroblastos podem ser diferenciadas facilmente a partir de células musculares lisas de artérias pequenas ou grandes, que são sempre acompanhados por uma camada endotelial (C, setas). Setas duplas apontar o autofluorescência eritrócitos. Escala das barras 50 um.
Discussão
Durante o procedimento, há alguns pontos críticos a serem observados: a intubação, a abertura da cavidade torácica ea ligadura LAD. O primeiro passo crítico é a intubação do animal antes experiements. Muitos grupos são usando um suporte vertical para a fixação do rato e uma fonte de luz para inserir a cânula directamente na traqueia. Este método tem incerteza quanto à inserção correta da cânula na traquéia e é a mais propensos a falhas pelos novatos. Fazendo uma pequena incisão, a posição da cânula pode ser controlada durante toda a manobra, diminuindo assim a taxa padrão. Além disso, a traqueotomia é ultrapassado, diminuindo assim as complicações e reduzir o tempo de operação.
O próximo passo é crítico da abertura da cavidade torácica. A esternotomia mediana representa uma manobra de alto risco atrasar a recuperação dos animais. A incisão lateral esquerdo que implica o corte de 2-3 costelas 15 , leva a recuperação deficiente e aumento da mortalidade. Nós utilizado no modelo de pequena incisão, discreta entre as costelas que oferecem carga mínima. Os animais recuperar muito rapidamente após a cirurgia e não apresentam defeitos ou cura perturbado. O espaço inter-costal inferior é tomado como ponto de referência. Considerando isso, o acesso adequado e diferenciado para o lugar ligadura para crônico e isquemia / reperfusão modelo, não levanta problemas sérios.
A ligadura si representa o passo mais crítico. A artéria coronária descendente esquerda é difícil de ser visualizada, e muitas vezes precisa ser vinculado sem vista. Por isso, alguns pontos de referência anatômicos são apontados para ajudar o cirurgião a realizar a ligação correta. Para o modelo de enfarte crónico, a ligadura é colocada no meio do lado ventral do coração, entre a aurícula e o vértice, acima do fim da veia principal anterior (Figura 2B). A eficiência pode ser controencheram visualizando a aparência da cor cinzenta nas áreas afectadas. Se a área enfartada aparece anterior e não inclui a parede posterior, um novo fio de sutura pode ser colocado à esquerda do primeiro fio de sutura. A principal raiz do LAD é sempre visível sob a orelha 18 e, portanto, não apresenta graves problemas em detectar esta parte. No entanto, a aurícula apresenta o maior risco de sangramento e precisa ser tratado com cuidado.
O procedimento é limitada pela existência de equipamento adequado. Um sistema de anestesia adequada ventilador e para os pequenos animais são caros e requerem conexões com sistema de gás e ventilação da sala. Além disso, uma supervisão rigorosa dos animais é necessária na primeira semana após o procedimento para detectar a possível clínica. Para examinar a função cardíaca durante o experimento, de alta resolução ultra-som, complexo do sistema de perfusão Langendorf, ou pequenas medições cateter intraventricular são necessários, involving altos custos e conhecimentos adicionais.
Considerando-se o enfarte do miocárdio, não há métodos alternativos disponíveis para reproduzir a complexidade dos acontecimentos in vitro. Dependendo do ponto de interesse, ex vivo de perfusão de coração isolado no sistema de Langendorff fornece informações sobre a contratilidade, a função cardíaca e viabilidade miocárdica em resposta a diferentes estímulos ou drogas. No entanto, exclui todas as interferências de componentes do sangue e do sistema imunitário, e não é indicado para estudos de longo-de remodelação e cicatrização após infarto do miocárdio.
Depois de realizado o procedimento de enfarte do miocárdio, todos os outros análise funcional pode ser realizada, como medições da pressão intraventricular, ultra-som (sistemas de ultra-som pequeno animal) ou isolado do coração de Langendorff-perfusão. Além disso, todas as análises biológicas e moleculares podem ser realizados para identificar células, proteínas, mRNAs, microARNs, GEnes ou outros biomarcadores, que podem ser utilizados como alvos terapêuticos para o desenvolvimento de novas estratégias de tratamento de enfarte do miocárdio.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by Interdisciplinary Centre for Clinical Research IZKF Aachen (junior research group to E.A.L.) within the faculty of Medicine at RWTH Aachen University. We are grateful Dr. Rusu and Ashley Christina Vourakis for critical review of the manuscript and Mrs. Roya Soltan for the professional help with immunohistochemistry staining.
Materiais
| Name | Company | Catalog Number | Comments |
| Stereomicroscope | Olympus | SZ/X9 | |
| Mouse ventilator | Harvard Apparatus | 730043 | Model Minient 845 |
| Dual Anesthesia System (Tabletop Version) | Harvard Apparatus | Selfcontained isofluranebased anesthesia unit for use on lab tables, with a compact 8" x 11" footprint. | |
| Intubation cannula | Harvard Apparatus | 732737 | |
| Forceps | FST, Germany | 9119700 | standard tip curved 0.17 mm x 0.1 mm |
| Scissors | FST, Germany | 9146011 | straight |
| Vannas scissor | Aesculap, Germany | OC 498 R | |
| Retractors | FST, Germany | 1820010 | 2.5mm wide |
| Retractors | FST, Germany | 1820011 | 5 mm wide |
| Wire handles | FST, Germany | 1820005 | 10 cm |
| Wire handles | FST, Germany | 1820006 | 14 cm |
| Ketamine 10% | CEVA, Germany | ||
| Xylazine 2% | Medistar, Germany | ||
| Bepanthene eye and nose cream | Bayer, Germany | ||
| Silicon tube | IFK Isofluor, Germany | custommade product | diameter 500 µm |
| section thickness 100 µm | |||
| polytetrafluorethylene catheter | |||
| PROLENE Suture 6/0 | ETHICON | 8707H | polypropylene monofilament suture, unresorbable, needle CC1, 13 mm, 3/8 Circle |
| 7/0 Silk | Seraflex | IC 1005171Z | |
| Ultrasound | Vevo, Canada | 770 Vevo |
Referências
- Liehn, E. A., Postea, O., Curaj, A., Marx, N. Repair after myocardial infarction, between fantasy and reality: the role of chemokines. J Am Coll Cardiol. 58 (23), 2357-2362 (2011).
- Liehn, E. A., Radu, E., Schuh, A. Chemokine contribution in stem cell engraftment into the infarcted myocardium. Curr Stem Cell Res Ther. 8 (4), 278-283 (2013).
- Alexander, S., et al. Repetitive transplantation of different cell types sequentially improves heart function after infarction. J Cell Mol Med. 16 (7), 1640-1647 (2012).
- Liehn, E. A., et al. Compartmentalized protective and detrimental effects of endogenous macrophage migration-inhibitory factor mediated by CXCR2 in a mouse model of myocardial ischemia/reperfusion. Arterioscler Thromb Vasc Biol. 33 (9), 2180-2186 (2013).
- Liehn, E. A., et al. Ccr1 deficiency reduces inflammatory remodelling and preserves left ventricular function after myocardial infarction. J Cell Mol Med. 12 (2), 496-506 (2008).
- Liehn, E. A., et al. A new monocyte chemotactic protein-1/chemokine CC motif ligand-2 competitor limiting neointima formation and myocardial ischemia/reperfusion injury in mice. J Am Coll Cardiol. 56 (22), 1847-1857 (2010).
- Liehn, E. A., et al. Double-edged role of the CXCL12/CXCR4 axis in experimental myocardial infarction. J Am Coll Cardiol. 58 (23), 2415-2423 (2011).
- Oral, H., et al. CXC chemokine KC fails to induce neutrophil infiltration and neoangiogenesis in a mouse model of myocardial infarction. J Mol Cell Cardiol. 60, 1-7 (2013).
- Projahn, D., et al. Controlled intramyocardial release of engineered chemokines by biodegradable hydrogels as a treatment approach of myocardial infarction. J Cell Mol Med. 18 (5), 790-800 (2014).
- Schuh, A., et al. Novel insights into the mechanism of cell-based therapy after chronic myocardial infarction. Discoveries. 1 (2), e9 (2014).
- Schuh, A., et al. Effect of SDF-1 alpha on Endogenous Mobilized and Transplanted Stem Cells in Regeneration after Myocardial Infarction. Curr Pharm Des. 20 (12), 1964-1970 (2013).
- Zaragoza, C., et al. Animal models of cardiovascular diseases. J Biomed Biotechnol. 2011, 497841 (2011).
- Kanzler, I., Liehn, E. A., Koenen, R. R., Weber, C. Anti-inflammatory therapeutic approaches to reduce acute atherosclerotic complications. Curr Pharm Biotechnol. 13 (1), 37-45 (2012).
- Liehn, E. A., Zernecke, A., Postea, O., Weber, C. Chemokines: inflammatory mediators of atherosclerosis. Arch Physiol Biochem. 112 (4-5), 229-238 (2006).
- Kolk, M. V. V., et al. LAD-Ligation: A Murine Model of Myocardial Infarction. J. Vis. Exp. (32), 1438 (2009).
- Ryu, J. H., et al. Implantation of bone marrow mononuclear cells using injectable fibrin matrix enhances neovascularization in infarcted myocardium. Biomaterials. 26 (3), 319-326 (2005).
- Frobert, A., Valentin, J., Cook, S., Lopes-Vicente, J., Giraud, M. N. Cell-based Therapy for Heart Failure in Rat: Double Thoracotomy for Myocardial Infarction and Epicardial Implantation of Cells and Biomatrix. J. Vis. Exp. (91), e51390 (2014).
- Xu, Z., Alloush, J., Beck, E., Weisleder, N. A Murine Model of Myocardial Ischemia-reperfusion Injury through Ligation of the Left Anterior Descending Artery. J. Vis. Exp. (86), e51329 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados