Method Article
Adaptation vidéofluoroscopie Swallow Méthodes étude humaine pour détecter et caractériser dysphagie dans les modèles murins de la maladie
Dans cet article
Résumé
Cette étude a adapté avec succès vidéofluoroscopie avaler étude (BVF) méthodes humaines pour l'utilisation avec des modèles murins de la maladie dans le but de faciliter la recherche translationnelle de dysphagie.
Résumé
Cette étude adapté vidéofluoroscopie humaine avaler étude (BVF) méthodes pour une utilisation avec des modèles murins de la maladie dans le but de faciliter la recherche translationnelle de dysphagie. Les résultats positifs dépendent trois composantes essentielles: chambres d'essai qui permettent auto-alimentation en position debout sans retenue dans un espace confiné, des recettes qui masquent l'aversion goût / odeur de disponibles dans le commerce des agents de contraste par voie orale, et un protocole étape par étape test permet la quantification de la déglutition physiologie. Élimination de l'un ou plusieurs de ces composants aura un impact négatif sur les résultats de l'étude. En outre, la capacité de niveau d'énergie du système de fluoroscopie avaler qui déterminera les paramètres peuvent être étudiés. La plupart des centres de recherche ont fluoroscopes élevés de l'énergie conçus pour être utilisés avec des personnes et des animaux plus gros, ce qui entraîne exceptionnellement mauvaise qualité d'image lors de l'essai souris et autres petits rongeurs. Malgré cette limitation, nous avons identifié sept VFSparamètres S qui sont toujours quantifiable chez la souris lors de l'utilisation d'un amplificateur de brillance de haute énergie en combinaison avec le nouveau protocole de BVF murin. Nous avons récemment obtenu un système de radioscopie à faible énergie avec des capacités exceptionnellement haute résolution d'imagerie et grossissement qui a été conçu pour une utilisation avec souris et autres petits rongeurs. Les travaux préliminaires en utilisant ce nouveau système, en combinaison avec le nouveau protocole de BVF murin, a identifié 13 paramètres d'hirondelle qui sont toujours quantifiable chez la souris, ce qui est presque le double du nombre obtenu à l'aide conventionnelle (ce est à dire, à haute énergie) fluoroscopes. Identification des paramètres d'hirondelle supplémentaires est prévu que nous optimisons les capacités de ce nouveau système. Les résultats démontrent jusqu'à présent l'utilité d'utiliser un système de radioscopie à faible énergie pour détecter et quantifier les changements subtils dans la physiologie hirondelle qui pourraient autrement être négligés lors de l'utilisation fluoroscopes élevés de l'énergie pour enquêter sur des modèles murins de la maladie.
Introduction
Dysphagie (déglutition) est un symptôme fréquent de nombreuses conditions médicales qui touchent les personnes de tous âges. Les exemples incluent accident vasculaire cérébral, la maladie de Parkinson, la maladie d'Alzheimer, la paralysie cérébrale, la dystrophie musculaire, la sclérose latérale amyotrophique (SLA), la maladie de Batten, la tête et du cou, de naissance prématurée, et le vieillissement avancé. Dysphagie est fortement corrélée à la mortalité, généralement comme une conséquence de la malnutrition sévère ou pneumonie bactérienne qui se développe lorsque chargé alimentaire / liquide / la salive est aspiré dans les poumons 1-4. Cette condition médicale débilitante et mortelle affecte plus de 15 millions de personnes chaque année aux États-Unis seulement trois. Malgré la prévalence élevée et les résultats négatifs associés, les options de traitement actuelles pour dysphagie sont limités aux soins palliatifs (plutôt que curative) approches, telles que la modification de l'alimentation (par exemple, en évitant les consistances aliments / liquides spécifiques), les changements de posture (par exemple, Tucking le menton en avalant), les approches de moteur (par exemple, des exercices ciblant les muscles dans la cavité buccale, du pharynx et du larynx), les approches sensorielles (par exemple, la saveur la mise en œuvre, de la température, et de stimulation / ou mécanique), et le tube d'alimentation (par exemple, la nutrition et l'hydratation administré par sonde nasogastrique (NG) tube ou percutanée gastrostomie (PEG) tube). Ces traitements ne servent qu'à la thérapie symptomatique plutôt que de cibler les causes sous-jacentes du problème. En effet, un obstacle majeur à la découverte de nouveaux traitements efficaces, de la dysphagie est la connaissance scientifique limitée des mécanismes pathologiques responsables, qui sont probablement différentes pour chaque maladie.
le diagnostic de la dysphagie est principalement faite en utilisant une procédure radiographique appelé vidéofluoroscopie avaler étude (BVF), aussi connu comme une étude de baryum hirondelle modifié. Au cours des dernières années plus de 30, ce test de diagnostic a été considérée comme la norme d'or pour evaluating fonction hirondelle 5-7. Ce test consiste à avoir le patient assis ou debout à l'intérieur du trajet du faisceau de rayons X d'un appareil de fluoroscopie pendant l'ingestion de nourriture et volontairement consistance liquide mélangé à un agent de contraste oral, typiquement le sulfate de baryum ou l'iohexol 10 8,9. Comme le patient avale, de la nourriture et de liquide contenant un agent de contraste peut être vu en temps réel via un écran d'ordinateur tout en voyageant de la bouche à l'estomac. Structures des tissus mous sont également visibles et peuvent être évalués par rapport à structure et la fonction. Les patients sont invités à effectuer plusieurs hirondelles de chaque aliment et de consistance liquide, qui sont tous des vidéo enregistrée pour la visualisation et l'analyse subséquentes image par image à quantifier la présence et le degré de dysphagie. De nombreux composants physiologiques de la déglutition sont généralement analysés, tels que le point de déclenchement anatomique de l'hirondelle pharyngée, bolus temps de transit par le pharynx et de l'oesophage, de l'étendue et la durée de Laryngeal élévation, l'emplacement et la quantité de résidu post-hirondelle, et la présence et la raison physiologique pour l'aspiration 7,11.
Aspects du protocole de BVF humaine ont été récemment adaptés pour étudier les rats se comporter librement; cependant, les résultats ont été limités parce que les rats ne sont pas restés dans le domaine vidéofluoroscopie de vue lors des essais 12. BVF n'a pas déjà été tentée avec des souris. Une adaptation réussie du protocole de BVF humaine pour une utilisation avec des souris et des rats fournirait une méthode de recherche novatrice pour enquêter sur les centaines de murin existant actuellement (de la souris et le rat) modèles de maladies qui sont connus pour causer la dysphagie chez les humains. Cette nouvelle méthode (ci-après dénommée BVF murin) serait donc d'accélérer l'identification et la validation de modèles murins de la dysphagie qui sont appropriés pour enquêter sur les mécanismes neurophysiologiques sous-jacents dans le tissu muscles, les nerfs et le cerveau qui sont pathologiques et de contribuer à la dysphagie in humains. En outre, murin BVF permettrait l'identification des mesures objectives (biomarqueurs) de la fonction hirondelle / dysfonctionnement qui pourrait être directement comparé avec les humains. Ces inter-espèces biomarqueurs vidéofluoroscopie pourraient alors servir de nouvelles mesures de résultats pour quantifier l'efficacité du traitement dans les essais précliniques sur des souris et des rats, qui permettrait de mieux traduire les essais cliniques avec les gens.
A cet effet, le protocole de BVF murin a été établie en utilisant ~ 100 souris des deux sexes. Toutes les souris étaient soit des souches hybrides C57 ou C57 / SJL. Les souris C57 ne ont pas été génétiquement modifiés, alors que C57 / SJL était la souche de fond pour une colonie de transgéniques SOD1 G93A (ou SOD1) chez la souris, modèle animal le plus largement utilisé de la SLA. La colonie de SOD1 était une participation d'environ 50 à 50 mélange de transgénique (ce est à dire, la SLA-souris touchées) et non transgéniques de la même portée (ce est à dire, ne sont pas touchés).
Le protocole de BVF murin compose de trois éléments:
- chambres d'observation conçus sur mesure qui permettent l'alimentation et la déglutition volontaire en position debout sans retenue dans un espace confiné dans une machine fluoroscopie,
- Recettes qui masquent le goût aversif / odeur d'agents de contraste orales et produisent radiodensité suffisante pour permettre une bonne visualisation de la déglutition,
- Un protocole étape par étape test qui maximise le respect des animaux, minimise le temps de test totale et l'exposition aux rayonnements, et permet la quantification de plusieurs paramètres d'hirondelle pour chaque étape de la déglutition (c.-à-bouche, du pharynx, de l'œsophage et).
L'effet combiné produit un faible niveau de stress, environnement confortable, auto-alimentation examen que l'évaluation de l'alimentation typique et comportements déglutition de souris permet.
Protocole
Le protocole de BVF murin suit un comité de protection des animaux et l'utilisation institutionnelle (IACUC) protocole approuvé et directives du NIH.
1. Chambres à partir de polycarbonate tubes et feuilles Construct observation (Figure 1)
- Coupez 5 cm de large tube carré (~ épaisseur de paroi de 2 mm), de polycarbonate en 16 cm de longueur en utilisant une machine manuelle de fraisage. La plupart des souris se adaptent de manière adéquate dans ces dimensions, ce qui résulte en une chambre d'essai étroite qui permet la marche et tournant autour comme vous le souhaitez. Une épaisseur de paroi de 2 mm ~ fournit une rigidité suffisante sans atténuer de façon significative le faisceau de rayons X.
- Deux types de chambres sont essentiels à ce protocole: "tubes bec", conçus pour la distribution de liquides via le bec, et "tubes de ventilation", conçus pour la distribution de liquides par peg-bol.
- Pour les "tubes" bec, faire un petit trou oblong (12 x 8 mm) dans le haut de chaque tube près d'une extrémité à l'aide d'un broyage manuel machine. Ce trou est utilisé pour fournir des solutions de consommation d'alcool par un bec de tube de sipper pendant le conditionnement comportemental et les tests BVF.
- Pour les "tubes de ventilation", forage neuf petits trous de ventilation dans le haut de chaque tube près d'une extrémité. Ce tube est utilisé pendant les essais BVF avec un peg-bol au lieu de tube de sipper.
- Il est possible d'utiliser des tubes de bec lors de la livraison liquide par peg-bol; Toutefois, l'ouverture dans le plafond de la chambre doit être bloqué afin d'éviter les comportements exploratoires distraire par les souris (voir l'étape 6.2.2).
- Deux types de chambres sont essentiels à ce protocole: "tubes bec", conçus pour la distribution de liquides via le bec, et "tubes de ventilation", conçus pour la distribution de liquides par peg-bol.
- Cut feuille de polycarbonate (3/4 "d'épaisseur) en bouchons (50 x 50 mm, par tube 2) à l'aide d'une fraiseuse informatisé, appelé aussi une machine à commande numérique informatisée (CNC).
- Mill une rainure oblongue (19 x 6 mm) près d'un bord de la face intérieure de chaque bouchon. Utilisez cette rainure pour obtenir un peg-bol pour les souris en boire pendant les essais BVF.
- Mill 5 trous ronds de ventilation (6 mm de diamètre) À travers chaque capuchon d'extrémité.
- Mill un trou plus petit rond (diamètre de 5 mm) à travers le bouchon, directement au-dessus de la rainure oblongue. Utilisez ce trou pour délivrer du liquide dans le peg-bol pendant les essais BVF.
- Sur la face extérieure de l'embout, un moulin 9/16 "de diamètre qui est contre-quart" de profondeur autour de ce trou plus petit.
- Moulin à 2 mm le long du périmètre de la face intérieure du bouchon à une profondeur de 7 mm de faire une étape qui insère facilement dans l'extrémité du tube.
- Moulin à 1 mm rainure dans l'étape de l'embout pour recevoir un joint torique, qui est nécessaire pour empêcher le bouchon de tomber de l'extrémité du tube.
- Arrondir les bords exposés et biseauter tous les coins des bouchons pour éviter de mâcher par des souris.
- Assurez-peg-bols de polycarbonate feuille en utilisant une machine CNC. Encombrement devraient être 24 x 19 x 6 mm 3, avec un bol en forme de dépression 10 x 3 mm 2 à une extrémité. Un peg-bol est needed pour chaque tube. PEG-bols devraient insérer parfaitement dans la rainure oblongue dans les bouchons (Figure 2).
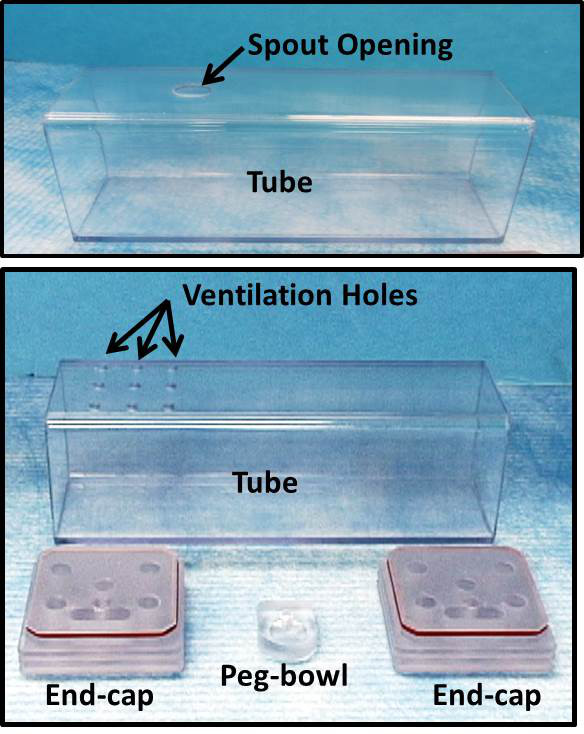
Figure 1:. Observation Chambers chambres d'observation ont été conçus pour maintenir les animaux se comportent librement dans le champ de vue fluoroscopie. Ces images montrent composants de la chambre essentiels pour mener BVF. Haut: «tube de bec", conçu pour la distribution de liquides via bec. En bas: "tube de ventilation", conçu pour la distribution de liquides par peg-bol. Les deux embouts sont interchangeables entre les tubes de bec et de ventilation.

Figure 2:. PEG-bols Chaque peg-bol se enclenche dans une rainure dans la face intérieure de chaque bouchon. Gauche:composants non assemblés. Moyen: assemblé composants. Droite:. Face extérieure de bouchon Se il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
2. Construire Sipper Tube bouteilles de Tubes à centrifuger, Échec au silicone, et métalliques Becs (Figure 3)
- Utilisez un perce-bouchon (5/16 ") pour faire un trou central à travers chaque bouchon en silicone.
- Appliquer quelques gouttes d'huile minérale dans le trou d'alésage et insérer manuellement un bec en métal dans l'extrémité large du bouchon. Becs droites bille sont préférés parce droites becs à bout libre se traduisent par des fuites et des éclaboussures excessives de l'agent de contraste à l'intérieur de la chambre d'observation, ce qui peut interférer avec la visualisation au cours de l'essai.
- Ajuster la longueur du bec de sorte qu'il se étend sur toute la longueur du bouchon en silicone et se étend d'environ 3 cm au-delà de l'extrémité large du bouchon.
- Insérer l'extrémité étroite de chaque bouchon (contenant un tube aspirante) dans un tube de centrifugeuse de 30 ml.
- Vérifiez que la longueur du bec est suffisante en l'insérant à travers le trou oblong dans la partie supérieure de la chambre d'observation. La pointe du bec devrait reposer environ 1 cm du plafond de la chambre, ce qui est suffisamment longue pour les souris adultes en bonne santé à atteindre.
NOTE: Des longueurs entraînent chez la souris potable tout en tournant / inclinant la tête, qui obscurcit la visualisation d'avaler pendant BVF. - Elargir la longueur du bec pour accueillir les jeunes souris, souches de souris plus petite taille, et des modèles de maladies de la souris qui ne peuvent pas atteindre le bec en raison de la déficience motrice des membres.
- Laver les becs nouvellement faites avant utilisation pour éliminer l'huile minérale, les débris de silicone, et d'autres contaminants lors de la manipulation.

Figure 3: Sipper. Tube Bouteilles Gauche: composants non assemblés. Moyen: assemblé composants. Droite:. Potable de la souris à partir du tube de sipper dans la chambre d'observation Se il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
3. Construire un système de livraison seringue pour une utilisation avec PEG-bols (Figure 4)
- Utilisez un tour à faire adaptateurs pour connecter polyéthylène (PE) tuyau à la chambre d'observation bouchons, décrite comme suit.
- Couper 1/2 "de diamètre matériau de tige de résine acétal dans une 1/4" sections de longueur, ci-après dénommées adaptateurs de tube (ou adaptateurs).
- À une extrémité de chaque adaptateur, réduire une "section de longueur à la pointe de 3/16" 1/2 de diamètre, appelée ici la fin étroit.
- Pour le 3/4 "section de longueur de chaque adaptateur (à savoir la moitié" reste extrémité de diamètre), des rainures de machines pour la préhension manuelle cours nouse. Cette section est cité ici par l'extrémité large.
- Dans la grande fin de chaque adaptateur, percer un trou central qui est 0,098 "de diamètre et de 1" de profondeur.
- Perceuse rame et la partie restante du trou au centre de chaque adaptateur de 0,096 "pour fournir un ajustement serré sur le tube en PE.
- Couper tube PE (PE 240, diamètre intérieur 1,67 mm) à la longueur désirée à l'aide d'un ciseau. Une longueur de 3-4 pieds augmente suffisamment la distance entre l'enquêteur et fluoroscope pendant les essais BVF pour améliorer la sécurité de rayonnement.
NOTE: Des longueurs utiliseront un plus grand volume de la solution d'agent de contraste au cours des essais BVF, peut-être supérieure à la norme de 30 ml recette. - Insérer une aiguille 15 G pointe arrondie à fond dans une extrémité du tuyau en PE. Le montage doit être bien ajusté.
- Insérez l'autre (libre) extrémité du tube de PE à travers le trou central du tube de l'adaptateur, à partir de til extrémité large.
- Tirer le tube de PE sur l'extrémité étroite de l'adaptateur de sorte qu'il se étend ~ 2 mm.
- Insérer l'extrémité étroite de l'adaptateur (~ 2 mm avec un tube de PE se étendant depuis elle) dans le bouchon d'un tube d'observation; il doit être bien ajusté dans le trou contre situé directement au-dessus de la cheville-bol.
- Ajuster la longueur de tube de PE à l'extrémité étroite de l'adaptateur de sorte qu'il se étend à peine au dessus de la dépression de la cuve dans le peg-bol.
- Remplir une seringue de 10 ml (sans aiguille fixée) avec de l'eau à partir d'un bécher et éliminer les bulles d'air.
- Fixer la seringue remplie à l'extrémité d'aiguille de la tubulure en PE.
- Poussez lentement le piston de la seringue pour fournir de l'eau dans le peg-bol dans la chambre d'observation. Arrêtez lorsque le peg-bol est presque plein. Éviter de trop remplir, ce qui entraînera éclaboussures au cours potable.
- Si le peg-bol ne remplit pas correctement, ajuster la longueur du tube PE étendant au-dessus de la cheville-bol.
- Over-extension du PEtube séduira souris de mâcher sur elle pendant les essais, plutôt que de boire de la cheville-bol.
- Si le tube PE ne est pas étendu assez loin, liquide va courir sur le plancher de la chambre d'observation plutôt que de remplir le peg-bol.
- Après utilisation, déconnecter la seringue et laver l'ensemble du système de distribution de la seringue avec de l'eau et du savon. Utiliser une seringue de 10 ml pour pousser l'air à travers le tube de PE pour éliminer l'eau. Stériliser à l'autoclave au besoin.
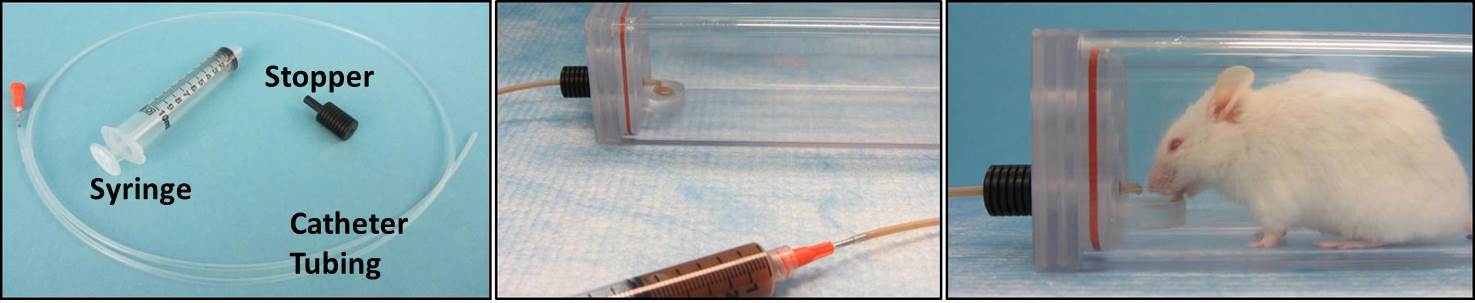
Figure 4:. Seringue Système de livraison Gauche: composants non assemblés. Moyen: assemblé composants. Droite:. Potable de la souris de la cheville-bol dans la chambre d'observation Se il vous plaît, cliquez ici pour voir une version plus grande de cette figure.
4. Construire un Sciss motoriséou Décrochez le tableau pour le positionnement à distance de la Chambre Observation (Figure 5)
- Construire une table élévatrice à ciseaux avec une plate-forme cm 12 x 12 qui peut descendre et monter de 5 cm pour accueillir souris affichage dans différentes positions dans le domaine de fluoroscopie de vue. matériel de levage doit être en métal ou en plastique pour la facilité de nettoyage avec des désinfectants.
- Monter moteurs pas à pas pour ajuster la hauteur et la position longitudinale de l'ascenseur.
- Coupler le premier moteur pas à pas au mécanisme de levage à ciseaux pour contrôler la hauteur de la traduction d'un cadre. Ce couplage peut être une vis ou à crémaillère et pignon engrenage plomb.
- Coupler le deuxième moteur pas à pas au cadre de levage à ciseaux pour contrôler la position longitudinale de la traduction de l'ensemble du cadre de levage par rapport à la table. Ce couplage peut être une vis ou à crémaillère et pignon engrenage plomb.
- Raccorder un système de télécommande pour les moteurs pas à pas pour permettre un ajustement de la position de la chambre d'observation au cours de l'imagerie, tout en minimisant Investigal'exposition à des rayonnements de Tor.
- Interface touches de la télécommande manuelle avec une puce de microcontrôleur pour commander l'activation et la direction de chaque moteur pas à pas.

Figure 5:. Télécommandé ciseaux Table élévatrice gauche: vue de côté de la table élévatrice à ciseaux. Droite: table élévatrice avec la chambre d'observation positionné dans fluoroscope. La table élévatrice ajuste la position de la chambre d'observation de maintenir souris dans le champ de vision. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
5. Effectuez conditionnement comportemental avant de tester BVF pour assurer une participation maximale
- 1-2 semaines avant BVF tests, les souris soumises à une nuit (12-16 h) période de régulation de l'eau pour induiresoif, temps pendant lequel de l'eau est retenue dans la cage d'accueil. L'objectif de la régulation de l'eau est pour les animaux d'avoir soif, pas déshydraté. Les animaux doivent rester en alerte et réactif. Ce cadre de la durée et le temps est essentielle pour prévenir la déshydratation, qui peut se produire à la suite d'épisodes de régulation 2 d'eau dans 1 semaine (ce est à dire, un pour le conditionnement comportemental et un autre pour les tests BVF).
- Placez un seul "tube bec" (avec une extrémité est fermée par un bouchon) sur le sol d'une cage d'accueil contenant de litière fraîche. L'extrémité fermée doit être la plus proche de l'ouverture de bec dans le plafond de la chambre. Cette étape garantit une ventilation adéquate tout en multiples souris sommeil blotti dans la profondeur de la chambre la nuit. L'extrémité ouverte permet d'entrer librement souris / sortir de la chambre.
- Retirer autre matériel d'enrichissement (par exemple, nestlet et de la hutte) pour encourager les souris à explorer et le sommeil dans la chambre la nuit (figure 6). Cette étape garantit que les sourissont acclimatés à être dans la chambre pendant de longues durées avant l'essai BVF.
- Fournir une seule boulette de nourriture standard par la souris sur le plancher de la cage pour manger la nuit; ne fournissent pas d'eau ou d'autres sources d'hydratation.
- Utilisez un top filtre standard pour contenir les souris dans la cage la nuit, que les dimensions de la chambre d'observation empêchent un couvercle métallique standard à partir de montage dans la cage. Rangez le couvercle enlevé de fil (contenant de la nourriture et une bouteille d'eau) sur le dessus de la partie supérieure du filtre à peser sur le couvercle et éviter souris de se échapper.
- Effectuer appétence tester le lendemain matin, décrite comme suit.
- Faire une solution de test chocolaté dans un 30 ml tube sipper bouteille, sans addition d'un agent de contraste (eau substitut pour iohexol). Cette recette est décrite dans le tableau 1. Faire une bouteille par cage à tester.
- Retirer la chambre d'observation et remplacer le couvercle de fil standard. Offrez l'chocolatéesolution (à la température ambiante, ~ 22 ° C) pendant 2 min par cage, inséré à travers le couvercle métallique.
- Évaluer appétence en observant les comportements de consommation d'alcool pendant la période d'essai de 2 min.
- Note sapidité selon les critères suivants:
- Latence jusqu'à ce que les premiers verres de souris à bec pendant au moins 5 secondes sans interruption.
- Pourcentage de souris par cage qui boivent la solution.
- Nombre de souris qui boivent simultanément au bec.
- La solution est considérée comme acceptable si la majorité des souris dans chaque cage ont de multiples de long (> 5 sec) des épisodes de consommation d'alcool et si plusieurs souris boivent simultanément du bec (figure 7).
- Si la solution à saveur de chocolat ne est pas acceptable, répéter les tests de palatabilité avec d'autres exhausteurs de goût à diverses concentrations afin d'identifier une solution unique privilégiée.
- Offrir un maximum de quatre solutions différentes (à différentes concentrations) un à la foisdans un ordre aléatoire à plusieurs cages de souris en une seule journée de test, sans une période d'élimination ou de la solution lavage. Saveurs appropriés exhausteurs à considérer pour les souris sont le sucre, le fromage, le beurre d'arachide, divers arômes de fruits et de noix, et le lait.
NOTE: Ne pas effectuer appétence tester plus d'une fois par semaine pour éviter la déshydratation des épisodes répétés de régulation de l'eau. - Il peut prendre plusieurs semaines pour identifier avec succès la solution préférée pour chaque souche de souris. L'objectif est d'identifier les saveurs de candidats qui se traduisent par multiples de long (> 5 sec) des épisodes de consommation d'alcool par les souris immédiatement (<30 sec) après l'exposition, que ces qualifications sont jugées essentielles à l'obtention de résultats de BVF succès.
- Après une solution de saveur préférée est identifié, retourner la chambre d'observation à chaque cage de la maison pour continuer conditionnement comportemental, décrite comme suit.
- Attachez un bouchon à la chambre d'observation à l'extrémité la plus proche de laovale (bec) trou.
- Offrir souris la solution de chocolat aromatisé à 2-3 h par l'insertion de la bouteille aspirante du tube à travers le trou ovale dans la partie supérieure de la chambre. Cette étape garantit que toutes les souris ont été conditionnés à boire au fond de la chambre d'observation.
- Retirez le couvercle métallique pour accueillir la chambre d'observation.
- Placez une aliments granulés par souris sur le plancher de la cage à la consommation ad libitum pendant la période de test.
- Couvrir la cage avec un top filtre standard pour empêcher les souris de se échapper pour le reste de la période de conditionnement comportemental. Rangez le couvercle enlevé de fil (contenant de la nourriture et une bouteille d'eau) sur le dessus de la partie supérieure du filtre à peser sur le couvercle.
- Fournir libitum de l'eau et la nourriture ad dans la cage de la maison quand le conditionnement comportemental est terminée.
- Laver les chambres d'observation (tubes et embouts) et des bouteilles de tubes de sipper (becs et des tubes de centrifugation) avec de l'eau et du savon; stériliser à l'autoclave selon les besoins. Éviteren utilisant de l'acétone pour nettoyer les tubes car il provoque un effet d'opacification permanente qui rend le tube opaque plutôt que translucide.

Figure 6:. Souris Explorer Observation Chambers souris sont naturellement enclins à chercher refuge dans les petits espaces. Par conséquent, ils entrent librement et explorer le tube d'observation lorsqu'il est placé dans la cage d'accueil. La plupart des souris sont trouvés dormir dans la chambre le matin. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| INGRÉDIENTS | Solution de chocolat (pour les essais appétence) | Chocolaté Iohexol (pour les essais BVF) |
| sirop de chocolat | 3 ml | 3 ml |
| Iohexol (350 mg d'iode / ml) | 0 ml | 15 ml |
| Eau (DI ou filtrée) | Ajuster à 30 ml volume final (27 ml) | Ajuster à 30 ml de volume final (12 ml) |
| Volume final | 30 ml | 30 ml |
Tableau 1: chocolat aromatisé solution de test Préféré par C57 et C57 / SJL souches de souris.

Figure 7:. Essais appétence un indicateur de préférence de goût lors des essais de sapidité est le nombre de souris qui boivent simultanément à partir d'un seul bec dans la cage d'accueil. Cette image montre quatre souris simultanément une solution à boire aromatisé au chocolat, qui a été identifié comme étant lepréféré exhausteur de goût par des souches C57 et C57 / SJL.
6. BVF Test Préparation
- Souris soumis à une période de régulation de l'eau pendant la nuit (ce est à dire, de retenir l'eau pendant 12 à 16 h), comme décrit dans l'étape 5 ci-dessus.
- Placez un seul "tube de ventilation" (avec une extrémité est fermée par un bouchon) sur le sol d'une cage d'accueil contenant de litière fraîche. L'extrémité fermée devrait être plus proche des trous de ventilation dans le plafond de la chambre. Cette étape garantit une ventilation adéquate tout en multiples souris sommeil blotti dans la profondeur de la chambre la nuit. L'extrémité ouverte permet d'entrer librement souris / sortir de la chambre.
- Le lendemain matin, enlever des chambres d'observation des cages sales et les rincer rapidement avec de l'eau du robinet et complètement sec en prévision des essais BVF.
- Enlever et nettoyer une seule chambre à la fois pour éviter le mélange jusqu'à chambres entre les cages, ce qui peut provoquer des comportements exploratoires excessivesinterférer de manière significative avec les tests BVF.
- Si "tubes bec" sont utilisés au lieu de "tubes de ventilation" pour les essais BVF, insérer un bouchon de silicone dans l'ouverture du bec du plafond de la chambre d'observation pour prévenir les comportements exploratoires (figure 8).
- Étiqueter chaque chambre (par exemple, avec le numéro de la cage de la maison) pour éviter confusion.
REMARQUE: Utilisez un marqueur effaçable à sec pour étiqueter chaque tube nettoyé avant de le remettre dans la cage de la maison. Marqueur permanent doit être évitée car elle est absorbée par le matériau du tube et ne lave pas hors tension, même avec de l'alcool ou de l'acétone.
- Préparer la solution de iohexol aromatisé au chocolat (ou une autre solution acceptable).
- Faire une seule recette (30 ml) de la solution d'essai (tableau 1) pour plusieurs cages.
- PRÉCAUTIONS POUR Iohexol: Magasin bouteilles de iohexol non ouvert à la température ambiante, à l'abri de la lumière. Utilisation ouvert à l'intérieur de flacons de 24 iohexolh, que la viscosité et le goût peuvent changer dans un jour ou deux après l'exposition à l'air. Alternativement, geler aliquotes de portions individuelles (15 ml) dans des tubes de centrifugeuses pour le stockage à long terme. Solutions de test iohexol préparés doivent être utilisés dans quelques heures pour assurer la fraîcheur et de prévenir l'évasion par les souris. Administrer solutions iohexol à température ambiante pour éviter de confondre l'étude en raison d'effets de la température sur la fonction de déglutition. Ne pas congeler toute solution préparée pour essais restants, comme la saveur de chocolat devient amer avec la congélation et les résultats dans l'évitement par les souris.
- Préparez l'environnement fluoroscopie.
- Utilisez une pièce de rechange chambre (vide) d'observation et peg-bol (ou tube de sipper bec) pour déterminer la hauteur et la position optimale dans le faisceau de radioscopie qui permet la visualisation de boire dans le plan (horizontal) latérale.
- Réglez la vitesse de défilement fluoroscopie pour 30 images par seconde; plus élevés (mais pas inférieur) des taux de trame peuvent être utilisés se ils sont disponibles.
- ENSure qu'un marqueur radio-opaque d'étalonnage est placé de façon appropriée sur l'appareil de radioscopie / détecteur de sorte qu'il est visible sur l'écran d'affichage au cours de l'ensemble du test. Cette étape est nécessaire pour permettre un étalonnage des mesures de longueur utilisées pour quantifier les paramètres d'hirondelle.

Figure 8:. Branchez silicone lors de l'utilisation PEG-Bols Gauche: bouchon de silicone. A droite: Un bouchon de silicone est tiré à travers l'ouverture du tube aspirante dans la partie supérieure de la chambre d'observation. Ce plug empêche les souris de se laisser distraire par l'ouverture du bec lorsque vous utilisez un peg-bol plutôt que tube de sipper pendant les essais BVF. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
7. Test BVF de souris
- Observez chaque cage de déterminer quand une souris entre librement la chambre d'observation.
- Soulevez la chambre hors de la cage et doucement fixer le 2 ème bouchon (avec le peg-bol fixé, si un tube de sipper ne sera pas utilisé), en faisant attention à ne pas pincer la souris (en particulier la queue).
NOTE: Cette approche minimise la réponse au stress de la souris en raison de la manipulation, ce qui est particulièrement important pour les souris qui sont testées pour la première fois. - Avec des tests répétés, les souris peuvent être facilement amenées à pénétrer dans la chambre quand il est placé en face d'eux à l'intérieur de la cage, ou lorsqu'il est suspendu par la queue au-dessus de l'ouverture de chambre.
- Soulevez la chambre hors de la cage et doucement fixer le 2 ème bouchon (avec le peg-bol fixé, si un tube de sipper ne sera pas utilisé), en faisant attention à ne pas pincer la souris (en particulier la queue).
- Positionner la chambre d'observation (contenant la souris) dans la machine de fluoroscopie pour commencer le test BVF dans le plan latéral (c.-à-faisceau de rayons X horizontal).
- Fournir la solution d'iohexol chocolaté (tableau 1) par peg-bol ou flacon tube aspirante.
- Si vous utilisez un peg-bol, Fournir la solution par l'intermédiaire du système de distribution de seringue décrit dans l'étape 3 ci-dessus. Ce système permet un remplissage rapide et facile de la cheville-bol au besoin.
- Si l'on utilise un tube bouteille aspirante, insérer le tube péristaltique à travers l'ouverture ovale dans la partie supérieure de la chambre d'observation. Incliner la bouteille de sorte que le bec est dirigé vers le centre de la chambre.
- Lancer l'enregistrement de vidéofluoroscopie lorsque la souris se met à boire.
- Ajuster la position de la chambre d'observation (à l'aide de la table à ciseaux commandée à distance décrit dans l'étape 4) de sorte que le mécanisme de la déglutition est visible dans le champ de vision.
- Mettre en pause l'enregistrement de chaque fois que la souris se détourne du peg-bol ou bec de minimiser la durée de l'exposition aux rayonnements.
- Reprendre l'enregistrement lorsque les rendements de la souris au bec ou peg-bol.
- Remplir le peg-bol au besoin.
- Arrêtez de tester si la souris ne boit pas dans les 5 min. Le but est d'enregistrer plusieurs long (> 5 sec) des épisodes de consommation continue, ce qui est typique pour la plupart des souris dans les 2 premières minutes de l'essai.
- Retour souris non conforme à la cage de la maison (sans eau) pour un nouveau test à un moment plus tard, le même jour; ne pas dépasser une période de régulation de l'eau 24 heures. Les souris qui restent non conformes pour trois essais sont retirés de l'étude.
- Si nécessaire, repositionner le fluoroscope pour tester les souris dans le plan dorsal-ventral (c.-à-faisceau de rayons X vertical). Ce plan est utilisé pour identifier les écarts de débit de bolus à travers le pharynx et de l'oesophage lors de la déglutition.
- Lors du test de plusieurs souris de la même cage:
- Nettoyez le peg-bol (et la pointe du tube PE) ou le tube de sipper bec avec une serviette en papier sèche entre les souris.
- Nettoyer la chambre d'observation au besoin entre les souris pour enlever toute iohexol éclaboussé sur les parois de la chambre. Rincer la chambre avec de l'eau du robinet et sécher avec une serviette en papier.
- Lors du test souris vientma cage différente:
- Utilisez un nouveau PEG-bol (ou changer le tube de bec sipper). Sinon, les souris peuvent être distraits par l'odeur des autres souris qui ont bu de la même peg-bol ou tube de sipper. Le PEG-bols et tubes Sipper doivent être étiquetés pour éviter toute confusion.
- Lorsque le test de toutes les souris dans une cage unique est terminée, fournir de l'eau et de la nourriture dans la cage d'accueil.
- Laver les chambres d'observation (tubes et embouts), le PEG-bols, système de distribution de la seringue, et des bouteilles de tubes de sipper (becs et des tubes de centrifugation, le cas échéant) avec de l'eau et du savon; stériliser à l'autoclave selon les besoins.
- Jeter toute solution restante iohexol comme dirigé par les directives de sécurité; élimination de vidange peut être acceptable dans la plupart des installations.
8. Analyse vidéo
- Utilisez un logiciel de montage vidéo qui permet l'analyse image par image des enregistrements vidéofluoroscopie de quantifier les paramètres d'hirondelle d'intérêt (tableau 2).
- Identifier au moins deux évaluateurs formés pour analyser chaque vidéo en aveugle: Un examinateur principal et un ou deux examinateurs secondaires.
- Examinateur principal: Voir chaque vidéo pour identifier et analyser 3-5 longues (environ 5 sec) beuveries. Ce critère est basé sur des études publiées hirondelle non radiographiques avec des souris 13,14 et BVF avec 12 rats montrant que 3-5 mesures par paramètre hirondelle sont suffisants pour les analyses statistiques.
- Lecteurs secondaires: analyser les 3-5 Indépendamment mesures par paramètre hirondelle pour chaque souris qui ont été initialement identifié et analysé par l'examinateur principal.
- Identifier les écarts des voyageurs pour chaque souris. Re-analyser tous les écarts en tant que groupe de l'examinateur pour atteindre 100% de consensus.
- Moyenne, les 3-5 consensus valeurs (ce est à dire, non contestés) pour chaque avaler paramètre afin d'obtenir la valeur moyenne pour chaque souris pour une utilisation dans les analyses statistiques. Quand moins de 3 mesures sont obtenus pour un paramètre unique pour avaler une souris donnée, entrez une valeur manquante (ce est à dire, pas zéro) dans la base de données statistiques pour le paramètre correspondant hirondelle.
| PARAMÈTRES d'hirondelle | DESCRIPTION |
| Inter-Swallow Intervalle (ISI) | Le nombre de trames vidéo entre deux hirondelles, ininterrompues successives. Le cadre de départ pour le calcul de l'ISI est le "cadre repos» qui précède immédiatement le transfert visible du bolus de la vallécules à l'oesophage. L'image de fin est le «cadre repos" de la prochaine hirondelle. Le nombre d'images entre les deux hirondelles successives est alors divisé par 30 images par seconde (ips) pour convertir en temps (sec). |
| Jaw Excursion Taux (Léchez taux équivalent) | La langue ne est pas clairementvisible pendant BVF pour permettre la quantification des taux lécher; Toutefois, le taux de la mâchoire excursion est facilement quantifiable. Au cours de léchage, la mâchoire doit se ouvrir pour permettre à la languette de faire saillie à partir de la bouche. Par conséquent, le nombre de mâchoire d'ouverture / fermeture (randonnée) cycles par seconde (30 images) en buvant équivaut à lécher taux. Chaque cycle mâchoire excursion commence avec la mâchoire ouverte maximum (qui coïncide avec protrusion de la langue) et se termine lorsque la mâchoire retourne position ouverte au maximum. Les cycles ultérieurs de la fermeture de la mâchoire et réouverture sont comptés comme des épisodes d'excursion de la mâchoire individuelle. |
| Jaw Excursion Distance | La distance de la mâchoire se ouvre pendant les cycles d'excursion de la mâchoire, de mesurer en mm entre le incisives supérieures et inférieures. |
| Ratio Lick-Swallow | Le nombre de cycles d'excursion mâchoire qui se produisent au cours de chaque ISI (entre deux hirondelles, ininterrompues successives). |
| Swallow Taux | Le nombre d'hirondelles se produisant pendant chaque épisode 2 sec de consommation ininterrompue au bec. |
| Temps de transit pharyngé (PTT) | Le temps que prend le bolus d'être avalé par le pharynx. L'image de départ est identique à l'image de début ISI (ie, le "cadre repos» qui précède immédiatement le transfert visible du bolus de la vallécules). Le châssis d'extrémité lorsque la queue est du bolus a complètement dépassé la 2 ème vertèbre cervicale (C2), qui est le point de repère anatomique le plus évident dans la colonne cervicale de la souris. Le nombre d'images entre les images de début et de fin est ensuite divisé par 30 fps et converti en millisecondes (ms). |
| Vitesse de Bolus travers pharynx | Pharyngée vitesse de bolus est mesurée par rapport à PTT (décrit ci-dessus). En utilisant le logiciel ImageJ, la distance (mm) à partir du vallécules à la vertèbre C2 est mesurée, mise à l'échelle en utilisant un marqueur de calibrage. Cette distanciationE (mm) est ensuite divisé par PTT (ms) pour déterminer la vitesse de bolus (mm / msec). |
| Temps de transit oesophagien (de ETT) | L'image de départ ETT est identique à l'image de fin PTT (décrit plus haut). La trame de fin ETT est lorsque le bol soit complètement entré dans l'estomac, qui est définie comme la disparition du bolus de l'œsophage. Le nombre d'images entre les début et de fin des trames ETT est ensuite divisé par 30 fps et converti en msec. |
| Vitesse de Bolus travers l'oesophage | Vitesse de bolus de l'oesophage est mesurée par rapport à TEF (décrit plus haut). En utilisant le logiciel ImageJ, la distance (mm) mesurée est de la vertèbre C2 à la jonction gastro, mise à l'échelle en utilisant le marqueur de calibrage. Cette distance (mm) est ensuite divisé par TEF (ms) pour déterminer la vitesse de bolus (mm / msec). |
| Vitesse Bolus travers pharynx et de l'oesophage | Ce paramètre est utilisé lorsque C2 ne est pas un repère anatomique facilement visible; par conséquent,il ne est pas possible de distinguer entre le pharynx et l'œsophage stades de la déglutition. Dans de tels cas, la vitesse de bolus à travers le pharynx et larynx est combiné en un seul paramètre de déglutition. L'image de départ est identique à l'image de début PTT (ce est à dire, le "cadre repos» qui précède immédiatement le transfert visible du bolus de la vallécules). La trame de fin est identique à l'image de fin ETT (lorsque le bolus soit complètement entré dans l'estomac). Le nombre d'images entre ces deux événements est divisé par 30 fps et converti en msec. |
| Bolus Area | En utilisant le logiciel ImageJ, zone de bolus est mesurée à la vallecular "trame de repos" avant le début du pharynx hirondelle, mise à l'échelle en utilisant un marqueur de calibrage. |
| Pharyngée résidus Area | Pharyngée zone de résidu est mesurée en utilisant le logiciel ImageJ, mise à l'échelle en utilisant un marqueur de calibrage. |
| Volume de liquide Consumed | Le volume de liquide consommé à partir d'une bouteille aspirante du tube est difficile à évaluer en raison de fuites du bec. Cependant, le volume de liquide consommé à partir d'un PEG-bol peut être calculée de façon plus précise comme suit: 1) déterminer la densité (ce est à dire, le rapport de poids à volume) du volume calibré de liquide qui a été administré dans la cheville de la cuvette, 2 ) déterminer le poids de la cheville-bol contenant le liquide résiduel, 3) entrer ces valeurs dans un poids au convertisseur de volume (par exemple, http://www.thecalculatorsite.com/conversions/weighttovolume.php . |
Tableau 2: Avalez paramètres quantifiables Pendant murin BVF.
Résultats
Nous avons réussi à concevoir un nouveau protocole et reproductible BVF-murin spécifique qui comprend des chambres de test qui permettent l'auto-alimentation, des recettes pour aromatiser des agents de contraste par voie orale, et un protocole étape par étape test qui permet la quantification de la déglutition de la physiologie. La capacité de niveau d'énergie du système de fluoroscopie déterminée qui avalent paramètres peuvent être étudiés chez la souris. Nous avons d'abord utilisé fluoroscopes élevés de l'énergie conçus pour être utilisés avec des personnes et des animaux plus gros (par exemple, GE Advantx, GE OEC 9600, et l'Oméga de cathétérisme cardiaque CS-25, chacun à 30 images par seconde). Cependant, ces systèmes ont des capacités de grossissement insuffisantes pour les souris de test, ce qui a entraîné le remplissage des animaux seulement une petite partie du champ de vision (Figure 9). En conséquence, la qualité d'image était exceptionnellement faible, ce qui rend impossible de visualiser la plupart des structures du mécanisme de déglutition. Malgré cette limitation, nous avons identifié sept objectif VFSS avaler paramètres qui étaient toujours quantifiable pour les souris en utilisant un (ce est à dire, à haute énergie) radioscopie classique en combinaison avec le nouveau protocole de BVF murin (tableau 3). En outre, nous avons identifié l'espace de vallecular que le point de déclenchement anatomique pour avaler chez les souris adultes en bonne santé (3-17 mois d'âge), ainsi que des souris avec des conditions d'âge avancé (> 18 mois) et la SLA en phase terminale.
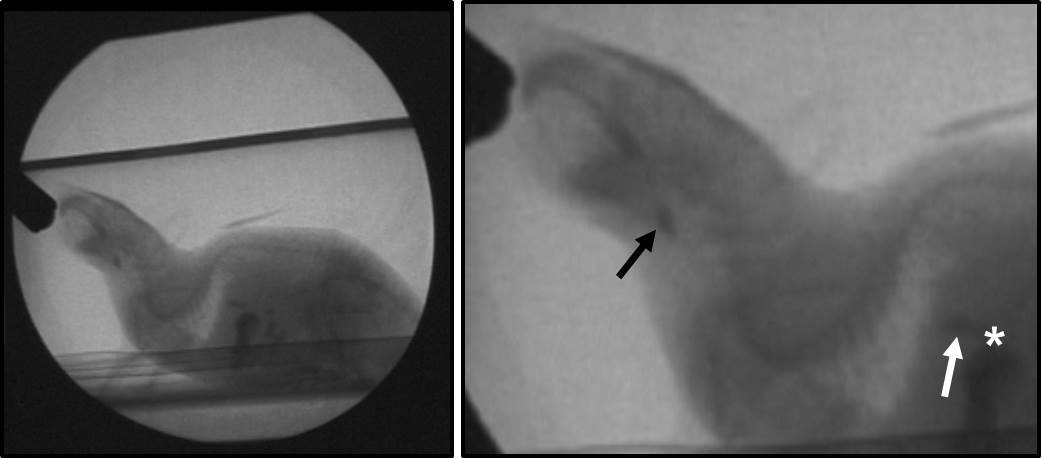
Figure 9:. Systèmes de radioscopie à haute teneur énergétique Gauche: Représentant l'image d'une souris obtenue à l'aide de haute énergie (c.-à-classiques) systèmes de radioscopie. Notez que la souris se remplit seulement une petite partie du champ de vue de fluoroscopie, démontrant ainsi la capacité de grossissement insuffisant de fluoroscopes classiques de rongeurs d'imagerie. Droite: Même image agrandie post-capture en utilisant un logiciel d'édition vidéo. Flèche noire: avaler point de déclenchement (de vallécules). Flèche blanche:. Bolus dans l'oesophage distal, immédiatement avant de passer à travers la jonction GE (astérisque blanc) Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| PARAMÈTRES d'hirondelle | Système de haute énergie | Système énergétique à faible |
| Inter-Swallow Intervalle (ISI) | X | X |
| Jaw Excursion Taux (Léchez taux équivalent) | X | X |
| Jaw Excursion Distance | X | X |
| Ratio Lick-Swallow | X | X |
| Swallow Taux | X | X |
| PharyngTemps de transit EAL (PTT) | X | |
| Vitesse de Bolus travers pharynx | X | |
| Temps de transit oesophagien (de ETT) | X | |
| Vitesse de Bolus travers l'oesophage | X | |
| Vitesse Bolus travers pharynx et de l'oesophage | X | X |
| Bolus Area | X | |
| Pharyngée résidus Area | X | |
| Volume de liquide consommé | X | X |
Tableau 3: Swallow paramètres quantifiables Utilisation élevée ou faible en systèmes de radioscopie énergie.
Nous avons récemment obtenu un système de radioscopie faible grossissement d'énergie appelé Le LabScope (Glenbrook Technologies, Randolph, NJ) qui a été spécialement conçu pour notre laboratoire pour une utilisation avecsouris et autres petits rongeurs (figure 10). Cependant, les niveaux de grossissement nettement plus de ce système rendaient impossible de voir le mécanisme de déglutition ensemble d'une souris dans un seul champ de vue. Au lieu de cela, deux postes d'essai sont nécessaires, comme le montre la Figure 11. Position permet une visualisation de l'ensemble de tête proximale et la région thoracique. Cette position est nécessaire pour évaluer les stades bouche et du pharynx de déglutition. Position 2 permet la visualisation du point hirondelle de déclenchement (ce est à dire, vallécules) à la gastro (GE) jonction. Cette position est nécessaire pour évaluer le stade de l'œsophage de la déglutition. Les travaux préliminaires en utilisant le LabScope en combinaison avec le nouveau protocole de BVF murin a identifié 13 paramètres d'hirondelle objectifs qui sont toujours quantifiable chez la souris, ce qui est presque le double du nombre obtenu en utilisant haute énergie fluoroscopes (c.-à-conventionnels) (tableau 3). Cette o ESULTAT est attribuée à la capacité de grossissement élevé de la LabScope, ce qui permet la visualisation de plusieurs structures anatomiques (figure 12) qui sont essentiellement invisibles pour l'utilisation de systèmes classiques: par exemple, les os hyoïde, la trachée, et les vertèbres cervicales. En conséquence, nous avons été en mesure d'analyser les vidéos des preuves de pénétration du larynx et de l'aspiration. Ni la pénétration, ni aspiration a été observée pour ne importe quelle souris dans cette étude, indépendamment des conditions de santé ou de maladie.

Figure 10:. Le LabScope Gauche: Le LabScope fonctionne comme un fluoroscope de bureau pour les petits animaux. Droite: Vue rapprochée de La LabScope avec des composants marqués. Le tableau élévatrice à ciseaux se positionne une chambre d'observation dans le champ de vision de radioscopie. tp_upload / 52319 / 52319fig10highres.jpg "target =" _ blank "> Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
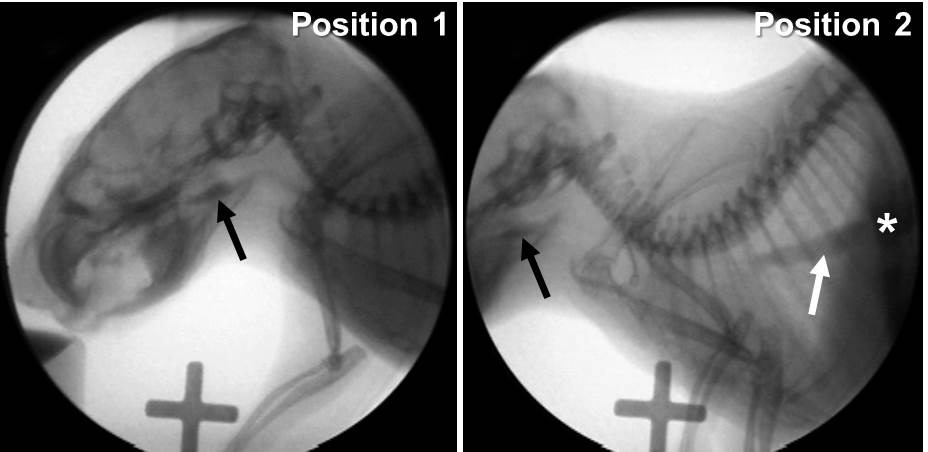
Figure 11:. Faible système de fluoroscopie énergie Images d'une souris obtenue en utilisant un système de radioscopie à faible énergie. A noter que la capacité de grossissement élevé empêche la visualisation de l'ensemble du mécanisme d'aronde dans le champ de vue de la fluoroscopie. Gauche: Position 1 - permet la visualisation de l'ensemble tête et proximale région thoracique. Le point hirondelle de déclenchement (flèche noire) est essentiellement centré dans le champ de vision. Droite: Position 2 - permet de visualiser du point hirondelle de déclenchement (flèche noire) à la jonction GE (astérisque blanc). Notez le bolus passant par l'oesophage distal (flèche blanche). g11highres.jpg "target =" _ blank "> Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
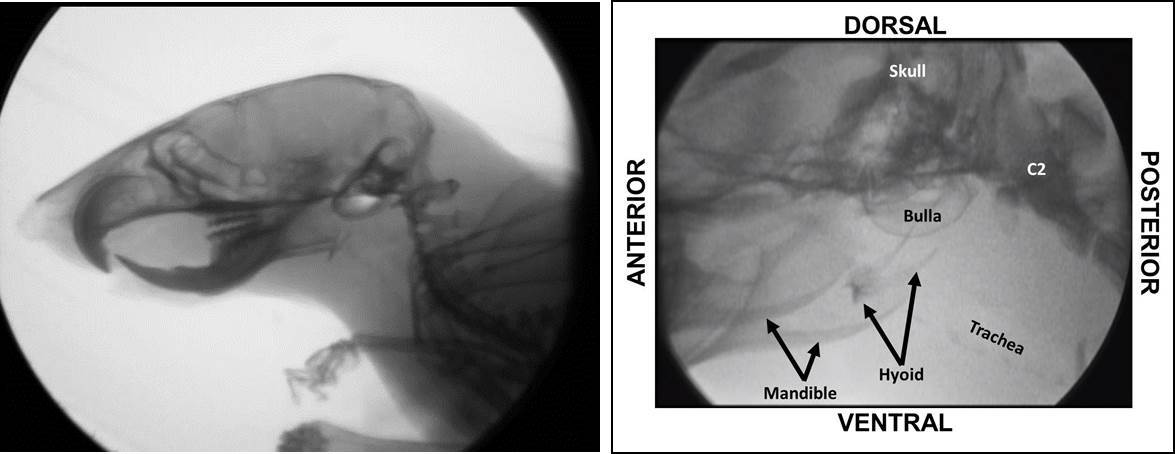
Figure 12:. Utilisation de structures anatomiques Visible un système de fluoroscopie Low Energy Même au réglage le plus bas de grossissement (à gauche), structures osseuses de la tête et du cou d'une souris sont facilement visibles en utilisant notre système de basse radioscopie de l'énergie (ce est à dire, Le LabScope). Les structures anatomiques dans le carré noir sont présentés (et étiquetés) à un grossissement supérieur vers la droite. Amélioration de la visualisation des structures osseuses permet la quantification de plusieurs paramètres d'hirondelle supplémentaires qui étaient impossibles à analyser en utilisant fluoroscopes élevés de l'énergie. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
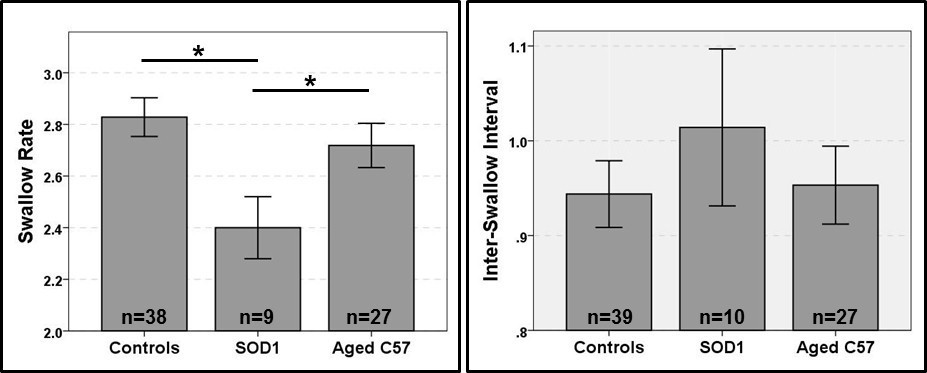
Figure 13:. Résultats préliminaires Cette figure montre les résultats préliminaires représentatifs des deux paramètres d'hirondelle BVF quantifiés en utilisant le protocole de BVF murin: taux (à gauche) et l'intervalle inter-hirondelle (à droite) avaler. Avalez taux était significativement plus lent pour les souris SOD1 rapport aux souris contrôles et C57 âgés. Pas de différences entre les groupes importants ont été identifiés pour inter inter-hirondelleval. Lignes en haut des barres indiquent des différences statistiquement significatives (p <0,05) entre les groupes, identifiés en utilisant des comparaisons par paires Bonferroni. Les barres d'erreur représentent ± 1 SEM. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Des centaines de modèles murins (souris et rats) sont disponibles dans le commerce pour étudier les maladies humaines. Cependant, seulement trois modèles murins de la maladie ont été spécifiquement étudiée par rapport à la dysphagie: modèles d'un modèle souris de la SLA 13,14 et le rat de la maladie de Parkinson 12,15-17 et d'AVC 18. Chacune de ces études préliminaires différentes méthodologies utilisées pour évaluer la dysphagie, rendant impossible de tirer des comparaisons significatives entre les espèces et les maladies. Cette limitation majeure peut être surmonté dans les études futures en utilisant le protocole de BVF murin nouvellement développé qui permet la quantification objective de nombreux paramètres d'hirondelle chez les animaux d'auto-alimentation.
Résultats de BVF réussies dépendent de trois composantes essentielles: 1) des chambres de test qui permettent auto-alimentation en position debout sans retenue dans un espace confiné, 2) les recettes qui masquent le goût aversif / odeur de disponible dans le commerce orale contraste agents, et 3) un protocole étape par étape test qui permet la quantification de la physiologie hirondelle. L'effet combiné produit un faible niveau de stress, environnement confortable, auto-alimentation Examen qui évoque l'alimentation typique et comportements de déglutition. Élimination de l'un ou plusieurs de ces composants aura un impact négatif sur les résultats de l'étude. Des exemples de résultats négatifs incluent l'incapacité de maintenir les animaux dans le domaine radioscopie de vue, les comportements indésirables qui distraient de boire, l'aversion à l'agent de contraste par voie orale, et l'incapacité de quantifier les paramètres d'hirondelle en raison de l'insuffisance des épisodes de consommation.
Un défi majeur dans l'obtention de résultats optimaux de BVF a été la conception d'une chambre de test approprié. De nombreuses révisions de notre conception du prototype abouti à une chambre d'observation qui maintient suffisamment souris dans le champ de vision et empêche les comportements qui distraient de boire. Les chambres ont été faites en utilisant des machines de fraisage pour obtenir des dimensions uniformes de etubes électroniques et embouts, assurant ainsi l'interchangeabilité des composants pour plusieurs chambres d'observation de même diamètre. Les dimensions intérieures (diamètre et longueur) ont été appariés à être légèrement plus grand que la taille du corps d'une souris adulte, ce qui a entraîné dans une chambre de test étroite qui permet suffisamment marcher en ligne droite et en tournant autour. La conception étroite, en combinaison avec le positionnement stratégique du bec et peg-bol à la fin seulement, maintient la tête et le corps de souris alignés le long de la longueur de la chambre tout en buvant. Une fois engagé dans l'eau potable, les souris restent remarquablement auto-stabilisé à bec ou un bol pendant quelques secondes à la fois, résultant en un minimum de mouvement artefact interférer avec les tests. Ainsi, il est possible d'obtenir non faussée, l'observation close-up / enregistrement vidéo et l'imagerie vidéofluoroscopie de souris tout en buvant dans les plans latéraux et dorsale-ventrale.
(Souris et autres petits rongeurs) sont naturellement enclins à voirk refuge dans les petits espaces. Par conséquent, ils entrent librement la chambre d'essai (avec une extrémité déjà fermé par un bouchon) lorsqu'il est placé dans la cage d'accueil, ce qui élimine le stress / anxiété causée par la manipulation (par exemple, choisir manuellement l'animal à placer dans la chambre). Une fois que la souris pénètre dans la chambre, l'autre extrémité est fermée par la fixation d'un bouchon 2 e. Cette conception empêche évasion tout en créant une chambre basse de test d'anxiété pour les souris à explorer librement.
La forme carrée de la chambre fournit une fonction de la stabilité de mouvement qui lui permet d'être utilisé dans un mode autonome, éliminant ainsi la nécessité pour les tests intérieur d'une cage standard pour rongeurs. L'ensemble du dispositif est léger, portable, empilable à des fins de stockage, robuste, facile à nettoyer, et peut être stérilisé à l'autoclave. Alors que les chambres ont été initialement conçus pour une utilisation avec la fluoroscopie, ils sont également compatibles avec la radiographie spot-métrage, la neuro-imagerie (par exemple, IRM, PET, CT), et Visual observation / enregistrement vidéo de divers comportements.
Un deuxième défi majeur à surmonter était masquer le goût aversif / odeur d'agents de contraste par voie orale (ce est à dire, le sulfate de baryum et iohexol). Étant donné que la sensibilité gustative varie considérablement entre les souches de souris de 19 à 21 et peut-être avec 22,23 âge, il était nécessaire de trouver une solution de test unique qui était acceptable pour toutes les souris, indépendamment de la souche et l'âge. Ce résultat est essentiel pour permettre des comparaisons directes de la fonction hirondelle / dysfonction travers souches et les âges, tout en éliminant les résultats de confusion en raison de différences dans rhéologique (par exemple, la viscosité, la densité, etc.) et les propriétés chimiques de solutions d'essai. À cette fin, nous avons développé une approche de dépistage simple, rapide appétence pour identifier le rehausseur de saveur préférée pour masquer le goût aversif / odeur d'agents de contraste oraux pendant BVF murin. Des méthodes ont été modélisés après le bref essai d'exposition, ce qui nécessite un coup de langueOmeter (c.-à-capteur lécher) pour enregistrer les taux lécher pendant les 2 premières minutes après une période de régulation de l'eau (ce est à dire, la retenue d'eau pendant une nuit) pour induire la soif 24,25. Un lickometer ne était pas disponible pour cette étude; donc, la préférence a été évaluée par l'observation du comportement, ainsi que des méthodes d'enregistrement vidéo standard pour lécher taux qui ont déjà été validée dans notre laboratoire 13,14. En utilisant cette approche de dépistage d'appétence, le chocolat a été identifié comme l'exhausteur de goût préféré par des souches C57 et C57 / SJL. En particulier, 100% des souris dans chaque cage facilement des solutions bu de chocolat aromatisé dans les 30 secondes d'exposition, avec plusieurs souris boire simultanément au bec. Cependant, l'addition de baryum entraîné que de brefs épisodes de consommation d'alcool par la plupart des souris, indépendamment de baryum ou de la concentration de chocolat.
Une alternative à baryum est iohexol, un agent de contraste à base d'iode qui n'a que récemment été reconnu comme un suiTable alternative au sulfate de baryum pour BVF humaine 10; Ainsi, il n'a pas encore été normalisés à cette fin. Plusieurs concentrations différentes de iohexol aromatisé au chocolat ont été offerts à des souris. Recettes contenant jusqu'à une solution à 50% de stock iohexol (350 mg d'iode par ml) ont été facilement bu par la plupart des souris après une période de régulation de l'eau pendant la nuit. Des concentrations plus élevées ont entraîné des comportements d'évitement. Un iohexol à 50% (350 mg d'iode par ml) de la solution produite radio-opacité suffisante, tout en étant avalé par les souris, alors que des concentrations plus faibles ont été nettement moins visibles et empêchés de quantification hirondelle physiologie. Par conséquent, la solution d'essai optimal pour BVF avec des souris a été identifié comme une solution à 50% iohexol au goût de chocolat ajouté. Tests de palatabilité Répétez n'a pas abouti à des comportements d'évitement ou d'événements indésirables.
Un troisième défi à relever était d'empêcher les souris de tourner / incliner leur tête en buvant, qui obscurcit la visualisationdu mécanisme de la déglutition pendant BVF. Boire à une cheville-bol positionné juste au-dessus du sol à une extrémité de la chambre a résolu ce problème. Il ya plusieurs avantages supplémentaires de l'aide d'un peg-bol au lieu d'une bouteille de tube de sipper. Par exemple, un volume calibré de liquide peut être introduit à la pipette dans le peg-bol à travers un trou de ventilation dans le bouchon du tube d'observation. Cette approche permet de quantifier le volume de minutes de la solution d'essai consommée au cours de la brève durée de l'essai de BVF. En outre, l'augmentation de la surface de la solution de test dans le peg-bol, par rapport à une petite ouverture de tube de sipper, peut fournir davantage de stimulation olfactive à motiver davantage potable. PEG-bols peuvent être mieux adaptés pour l'étude de souris jeunes ou moins contrainte, que la hauteur de la cuvette est une distance normalisée du sol. En revanche, les longueurs de tubes Sipper doivent être ajustées pour tenir compte des souris de taille différente, ce qui ajoute une autre variable potentiellement confondant à considérer. En outre, le mode de la sourisls de maladies neurologiques peuvent avoir des difficultés à atteindre une bouteille de tube de sipper en raison de la déficience motrice des membres, alors ils peuvent facilement atteindre un bol de cheville. Souris avec la langue et / ou un dysfonctionnement de la mâchoire peut être incapable d'appuyer suffisamment la balle dans le bec pour accéder au liquide; utilisant du PEG-bols peut éliminer cette confondre. Pour ces raisons, l'utilisation de PEG-cuvettes sur des bouteilles de tubes Sipper est la méthode préférée de test de BVF murin. Cependant, les chambres d'observation ont été conçus pour se adapter à bec à boire selon les besoins. Une mise en garde importante à considérer est que les taux lécher sont connus pour différer entre le bec et le bol potable 13,26. Par conséquent, le choix de bec ou peg-bol pour BVF doit être conforme à l'intérieur et entre les expériences.
Un quatrième défi était d'identifier les paramètres d'hirondelle quantifiables pour les souris qui sont comparables aux paramètres de BVF couramment utilisés dans les études sur les humains et la pratique clinique. Nos résultats préliminaires ont montré latype de système de fluoroscopie détermine qui avalent paramètres peuvent être étudiés chez la souris. La plupart des centres de recherche et les milieux médicaux ont haute énergie (75-95 kV, 1-5 mA) fluoroscopes conçu pour une utilisation avec les gens et les animaux plus gros, qui se traduisent par exceptionnellement mauvaise qualité d'image lors de l'essai souris et autres petits animaux. A titre d'exemple, une étude récente utilisant une radioscopie à haute énergie avec des rats a pu identifier seulement quatre paramètres d'hirondelle quantifiables 12, et nous avons été en mesure d'identifier seulement 7 paramètres d'hirondelle pour les souris dans la présente étude. Pour surmonter cette limitation majeure, nous avons récemment obtenu un système de basse énergie appelée fluoroscopie Le LabScope (Glenbrook Technologies). Le système est un fluoroscope miniature générant un faisceau conique continu de rayons X avec des énergies de photons entre 15 et 40 kV et un courant de crête du tube de 0,2 mA (8 W puissance maximale). Les niveaux d'énergie inférieurs de ce système sont mieux atténuées par le mince os et les tissus mous de la souris et ainsi fournissent higher résolution de contraste que conventionnel (ce est à dire, à haute énergie) fluoroscopes. Le faisceau de rayons X de La LabScope est dirigée vers un 5 cm de diamètre intensificateur image, ce qui est nettement plus petit que le 15 à 57 cm de diamètre image intensificateur de fluoroscopes classiques. La distance minimale de la source au intensificateur (SID) de la LabScope est ~ 6 cm (contrairement à ~ 30 cm pour fluoroscopes conventionnels), qui permet d'accroître les capacités d'agrandissement. En outre, Le LabScope utilise une technologie brevetée qui grossit numériquement l'image jusqu'à 40 fois en temps réel, sans altérer la SID. Le résultat est essentiellement un microscope à rayons X qui peut zoomer et dézoomer en temps réel pour afficher de petites régions d'intérêt, tels que le mécanisme de déglutition d'une souris.
Un avantage majeur de ce système de radioscopie à faible énergie est améliorée radioprotection. En plus des animaux recevant des doses de rayonnement inférieure avec le LabScope, les chercheurs qui utilisent le système sont exposés à beaucoup less rayonnement dispersion. L'exposition au rayonnement directement en face de l'unité sur le panneau de commande est de 10,3 mR / h. À une distance de 1 m à l'avant de l'appareil, l'exposition tombe à 580 μR / h. La plupart des autres endroits dans la salle ont une très faible exposition au-dessous de 10 μR / h. Malgré cette amélioration, nous avons pris des mesures supplémentaires pour améliorer la sécurité de rayonnement. Par exemple, le blindage acrylique au plomb a été ajoutée autour de La LabScope pour bloquer dispersés photons de rayons X, ce qui permet aux chercheurs d'effectuer des tests de BVF murin sans porter blindage personnelle (par exemple, le tablier de plomb, de boucliers de la thyroïde, et des lunettes). En outre, l'acrylique transparent permet la visualisation de la souris à distance. En outre la sécurité de rayonnement est fourni par une table élévatrice à ciseaux motorisé, qui est commandé à distance par l'investigateur. A partir d'une distance allant jusqu'à 3 m du fluoroscope, les chercheurs peuvent utiliser le dispositif télécommandé pour régler la position verticale et horizontale de la chambre d'observation dans le bea rayons Xm. En conséquence, les régions anatomiques d'intérêt puissent être maintenues dans le champ de vue de fluoroscopie alors que la souris se déplace librement à l'intérieur de la chambre d'observation. Bien que la table élévatrice à ciseaux a été conçu pour une utilisation avec Le LabScope, il est également compatible pour une utilisation avec fluoroscopes classiques pour améliorer la sécurité de rayonnement pour les chercheurs. Une étape finale consiste à améliorer la sécurité de rayonnement pendant murin BVF implique l'utilisation d'un système de distribution de la seringue pour les liquides. Ce système comprend un pied 3-4 (ou plus, si nécessaire) longueur du tube PE, qui permet une livraison rapide et efficace des liquides dans le peg-bol à distance. Ce système de distribution de la seringue pour liquides, en combinaison avec les chambres d'observation, peut également être utilisé avec fluoroscopes classiques.
Les travaux préliminaires en utilisant le LabScope, en combinaison avec le nouveau protocole de BVF murin, démontre un avantage majeur de rapport aux systèmes conventionnels: le nombre de paramètres d'hirondelle qui peut être quantifié de manière fiable is presque doublé. Cependant, les structures des tissus mous du mécanisme de déglutition (par exemple, de la langue, vélum, paroi postérieure du pharynx, et de l'épiglotte) de souris ne sont pas facilement accessibles pour l'utilisation de systèmes de radioscopie à basse ou haute énergie. Par conséquent, nous nous sommes concentrés sur la quantification des mesures de flux de bolus plutôt que la biomécanique de la déglutition. Nous étions surtout intéressés par des paramètres qui pourraient être quantifiés sur la base des unités de temps, espace, distance, volume, etc., plutôt que d'utiliser des mesures à l'échelle de type Likert. Bolus de nombreux paramètres de l'écoulement à cette exigence ont été décrits dans la littérature de BVF humaine, telles que le temps de transit par voie orale de 27 à 29, du pharynx temps de transit de 27 à 33, et le temps de transit oesophagien 34-36, pour ne en nommer que quelques-uns. transport Bolus travers la cavité buccale ne était pas facilement visible chez la souris, probablement en raison de la petite taille de bolus pendant potable spontanée. Cependant, nous étions en mesure de quantifier de façon fiable du pharynx et de transit oesophagien fois, ainsique plusieurs autres mesures relatives à l'écoulement de bolus et le dédouanement. Identification des paramètres de translation d'hirondelle supplémentaires est prévu que nous optimisons les capacités des LabScope.
Les résultats de cette étude ont montré que les souris prennent plusieurs lèche rythmiques par hirondelle cours potable spontanée, chaque petit bolus séquentielle liquide remplissant l'espace vallecular avant de déclencher l'hirondelle pharyngée. Ce comportement, qui est typique pour les mammifères qui utilisent lécher comme principal moyen de l'ingestion de liquide 37-40, ressemble au modèle sucer avaler rythmique de déglutition infantile humaine et tous les mammifères infantiles en général. Nourrisson avaler la physiologie est caractérisé par plusieurs rythmique suce suivie d'une hirondelle pharyngée réflexive, communément décrit comme le cycle sucer avaler 37,41-43. Ainsi, la langue et la mâchoire mouvements rythmiques impliqués dans les comportements ingestion de léchage de souris peuvent être plus comparable à l'ingestion comportements suceurs de humune nourrissons plutôt que tasse potable par les enfants et les adultes. Nous avons donc de quantifier les taux et lick-hirondelle rapport coup de souris pour de futures comparaisons avec le rapport aspirer taux et sucer avaler des nourrissons humains. Peut-être la recherche de BVF murin donnera un aperçu des troubles de la déglutition développement.
Comme avec toute nouvelle méthode de recherche, domaines d'amélioration ont été identifiés. Par exemple, le protocole de BVF murin a été développé en utilisant uniquement des souches C57 et C57 / souris SJL; il n'a pas encore été testée sur des rats. Les chambres d'observation devront être mis à l'échelle dans la taille (diamètre et longueur) pour accueillir la plus grande taille du corps de rats. En outre, on ne sait pas si l'iohexol aromatisé au chocolat est approprié en tant que solution d'essai de BVF murin universel. Par conséquent, plus grande échelle des tests avec plusieurs souches de souris et les rats est justifiée à cet effet. En outre, l'utilisation de baryum comme un agent de contraste pour murin BVF ne doit pas être exclue. Souris préfère clairement la iohexol recettes plus de baryum; tentatives cependant plus rigoureuse et systématique à masquer le goût aversif / odeur de baryum peuvent fournir des alternatives acceptables pour iohexol. Futures études comparant les effets du sulfate de baryum et iohexol (ainsi que d'autres agents potentiels de contraste oraux) sur les préférences de goût et avalent la physiologie chez les souris et les rats sans aucun doute fournir des informations importantes qui est directement pertinente et translationnelle à BVF humaine.
BVF avec les humains comprend plusieurs consistances d'aliments et de liquide, et la dysphagie est le plus évident lors de la déglutition liquides minces et des aliments solides, secs 44,45. Le protocole de BVF murin est donc élargi pour inclure les consistances supplémentaires susceptibles de faciliter la détection et la quantification de la dysphagie dans les modèles de la maladie. Il sera également nécessaire d'effectuer des tests de viscosité des liquides recettes pour BVF murin afin d'ajuster les viscosités pour correspondre à celles utilisées lors de BVF humaine. Aborder ces limitesations seront de faciliter l'identification de biomarqueurs de BVF traductionnelles de la dysphagie qui peuvent être directement comparés entre les souris, les rats et les humains.
L'utilité de BVF murin peut être considérablement améliorée par l'implantation des marqueurs radio-opaques dans les structures des tissus mous du mécanisme de déglutition qui sont par ailleurs pas visible, ce qui permet enquêtes de la biomécanique de la déglutition. Cette approche a été utilisée avec succès depuis de nombreuses années à étudier la biomécanique de la déglutition infantile chez les porcs, en utilisant un assortiment de clips et fils métalliques 37,42. Nous prévoyons l'utilisation de marqueurs similaires, mais plus petites, chez la souris permettrait quantification de plusieurs paramètres d'hirondelle supplémentaires pour comparaison avec les grands mammifères, incluant les humains. Nous développons actuellement une méthodologie pour l'implantation marqueurs radio-opaques dans la langue, le palais mou, pharynx, du larynx et de l'oesophage proximal de souris pour tester cette hypothèse.
Le recordin vidéog Les taux de fluoroscopes LabScope et conventionnelles cadre est limité à 30 images par seconde (fps). Cependant, nos résultats préliminaires ont montré que toute la scène pharyngée de la déglutition pour les souris saine se produit en moins de 66 ms (ce est à dire, deux cadres), qui est environ 10 fois plus vite que les humains. Ainsi, la phase pharyngée de la déglutition chez les souris se produit si rapidement que les détails ne sont pas sensibles avec un appareil photo de 30 fps. Un taux de trame supérieur (probablement> 100 fps) sera nécessaire pour visualiser suffisamment et quantifier les mouvements extrêmement rapides et complexes de la scène pharyngée de la déglutition chez les souris et autres rongeurs. En conjonction avec un taux de trame supérieur, intégrant la technologie pour l'imagerie fluoroscopique biplan 3D serait certainement élargir l'utilité murin BVF. Par conséquent, les futures considérations de conception doivent inclure un appareil photo plus élevé de taux de trame et des capacités d'imagerie biplan.
Enfin, a été montré rayonnement à faible dose pour provoquer la stérilité chez lessouris femelles C57, résultant en des niveaux modifiés de hormones ovariennes stimulée qui peuvent confondre les études de durée de vie 46. Résultats portant spécifiquement sur les effets de l'exposition répétée faibles doses de rayonnements associée au dépistage BVF ne ont pas encore été étudiés chez la souris, d'autres animaux ou des humains. Cependant, le dysfonctionnement de l'ovaire (non lié à l'exposition aux rayonnements) chez les femelles humaines a été liée à des troubles de la motilité gastro-intestinaux, et en particulier à la dysphagie dans certains cas 47, qui fournit encore une autre mise en garde à considérer lors de la conception de futures études de BVF qui incluent femelles (animaux et les humains ). Exclusion des femmes devrait être évitée, car des différences significatives entre les sexes en fonction de déglutition ont été rapportés pour les personnes 48,49 et serait important de détecter et de caractériser des modèles de maladies animales ainsi. Par conséquent, les résultats des études longitudinales de BVF dans les souris et les rats des deux sexes ont un potentiel énorme pour les humains de translation par rapport à dysphagia, ainsi que sur les risques de l'exposition aux rayonnements à faible dose associés aux tests de BVF répétition.
Déclarations de divulgation
Open Access pour cet article est sponsorisé par Glenbrook.
Remerciements
Nous remercions gracieusement membres supplémentaires du levier Lab qui ont contribué à la collecte de données (Andries Ferreira, Danarae Aleman, Alexis Mok, Kaitlin Flynn, Elizabeth Bearce et Matan Kadosh) et évaluation des manuscrits (Andries Ferreira, Rebecca Schneider, et Kate Robbins). Nous reconnaissons également Roderic Schlotzhauer et Edwin Honse de la MU Physique Machine Shop pour leur entrée de la conception et la fabrication des tubes d'observation de rongeurs utilisés dans cette étude. Nous sommes particulièrement reconnaissants de Malea Jan Kunkel (radiologie superviseur dans la médecine et la chirurgie vétérinaires Département à l'Université de Missouri - Collège de médecine vétérinaire) et Jan Ivey (directeur du laboratoire de cathétérisme animale recherche à l'Université du Missouri - School of Medicine) pour démontrer la patience et la motivation constante, tandis que l'exploitation des fluoroscopes élevés de l'énergie que nous avons développé le protocole de BVF murin. Les sources de financement pour cette étude comprenait NIH / NIDCD (TE levier), NIH / NINDS (GK Pavlath), Otolaryngofonds Head and Neck Surgery démarrage (TE levier), Fonds MU PRIME (TE levier), Mizzou Advantage (TE levier), et le centre MU sur le vieillissement (TE levier) - logie.
matériels
| Name | Company | Catalog Number | Comments |
| Polycarbonate tubing for observation chambers | McMaster-Carr | 3161T41 | Body of observation tubes, 2"X2" diameter, 0.080" thick wall |
| Polycarbonate sheet for observation chambers | McMaster-Carr | 9115K71 | End-caps for observation tubes, 2"x12"x3/4" |
| Polycarbonate sheet for observation chambers | McMaster-Carr | 8574K281 | Peg-bowls for observation tubes |
| Silicone O-rings for end-caps of observation chambers | McMaster-Carr | 9396K108 | S1138 AS568-029, pack of 25 http://www.mcmaster.com/#o-rings/=t0wt5r |
| Silicone stoppers for observation chambers | McMaster-Carr | 2903K22 | Package of 10 stoppers to plug the oval opening in the top of the observation chamber when using a peg-bowl http://www.mcmaster.com/#catalog/120/3803/=t0y5at |
| Centrifuge tubes for sipper tube bottles | Evergreen Scientific | 222-3530-G80 | 30 ml freestanding centrifuge tubes, with caps, sterile https://www.evergreensci.com/labware-catalog/tubes-and-vials/30-and-50-ml-centrifuge-tubes/ |
| Silcone stoppers for sipper tube bottles | Saint-Gobain Performance Plastics | DX263031-10 | Number 31D, size: 26 mm bottom, 32 mm top, 30 mm high; 10 pack; http://www.labpure.com/en/Products.asp?ID=179&PageBrand=STOPPERS |
| Stopper borers for sipper tube bottles | Thomas Scientific | 3276G40 | Cork Borer Set that ranges from 3/16-15/16 inch http://www.thomassci.com/Supplies/Corks/_/CORK-BORER-SET-316-1516-IN?q=Humboldt |
| Drinking tubes for sipper tube bottles | Ancare | TD-100 | 2 1/2” long drinking tubes with 5/16” opening, straight ball-spout http://www.ancare.com/products/watering-equipment/open-drinking-tubes/straight-tubes-ball-point |
| Iohexol for making oral contrast agent solution | GE Healthcare | 350 mg iodine per ml http://www3.gehealthcare.com/en/products/categories/contrast_media/omnipaque | |
| Chocolate syrup for flavoring oral contrast agent | Herseys | ||
| 10 ml syringe for syringe delivery system | Becton, Dickinson and Company | 309604 | Luer lock tip syringe without needle, 100 per box http://www.bd.com/hypodermic/products/syringeswithoutneedles.asp |
| Catheter tubing for syringe delivery system | Becton, Dickinson and Company | 427451 | Polyethylene Tubing (Non-Sterile) (PE 240) 100' http://www.bd.com/ds/productCenter/427451.asp |
| Needle for syringe delivery system | Becton, Dickinson and Company | 427560 | 15-gauge needle, fits into PE 240 catheter tubing http://www.bd.com/ds/productCenter/427560.asp |
| Delrin acetal resin rod for syringe delivery system | McMaster-Carr | 8576K15 | 1/2 inch diameter, black http://www.mcmaster.com/#catalog/120/3609/=t0wvaf |
| Acrylic sheeting for scissor lift | Ponoko | Laser cut http://www.ponoko.com | |
| 3D printed ABS frame | Engineering Rapid Prototyping Facility, University of Missouri | ||
| Brass rods for scissor lift | Amazon | TTRB-03-12-03 | made into axles http://www.amazon.com/Brass-Seamless-Round-Tubing-Length/dp/B000FN898M |
| Drawer slide for scissor lift | Richelieu | 10292G116 | Attaches to base of scissor lift http://www.lowes.com/pd_380986-93052-T35072G16_0__?productId=50041754 |
| 28BYJ-48 stepper motor for scissor lift | 2 each | ||
| ULN2003 Darlington transistor array for scissor lift | Toshiba | ULN2003APG | Used as stepper drivers (2 each) |
| ATTINY85 microcontroller for scissor lift | Atmel | ATTINY85-20PU | 2 each http://www.taydaelectronics.com/attiny85-attiny85-20pu-8-bit-20mhz-microcontroller-ic.html |
| Nylon spur gear | McMaster-Carr | 57655K34 | 2 each http://www.mcmaster.com/#57655k34/=t0yaqz |
| Nylon spur gear rack | McMaster-Carr | 57655K62 | 2 each http://www.mcmaster.com/#57655k62/=t0ybh9 |
| 4-40 nylon machine screws | McMaster-Carr | 95133A315 | Lift assembly http://www.mcmaster.com/#95133a315/=t0yd8q |
| 4-40 nylon hex nuts | McMaster-Carr | 94812A200 | Lift assembly http://www.mcmaster.com/#94812a200/=t0ye29 |
| Buna-N O-Ring AS568A Dash No. 104 | McMaster-Carr | 9452K318 | Lift assembly http://www.mcmaster.com/#9452k318/=t0yem7 |
Références
- Shigemitsu, H., Afshar, K. Aspiration pneumonias: under-diagnosed and under-treated. Curr Opin Pulm Med. 13 (2), 192-198 (2007).
- Gresham, S. L. Clinical assessment and management of swallowing difficulties after stroke. Med J Aust. 153 (7), 397-399 (1990).
- Marik, P. E., Kaplan, D. Aspiration pneumonia and dysphagia in the elderly. Chest. 124 (1), 328-336 (2003).
- Marik, P. E. Pulmonary aspiration syndromes. Curr Opin Pulm Med. 17 (3), 148-154 (2011).
- Logemann, J. A., Larsen, K. Oropharyngeal dysphagia: pathophysiology and diagnosis for the anniversary issue of. Diseases of the Esophagus. Dis Esophagus. 25 (4), 299-304 (2012).
- Logemann, J. A. Swallowing disorders. Best practice & research Clinical gastroenterology. 21 (4), 563-573 (2007).
- Martin-Harris, B., Jones, B. The Videofluorographic Swallowing Study. Physical Medicine and Rehabilitation. Clinics of North America. 19 (4), 769-785 (2008).
- Dietsch, A. M., Solomon, N. P., Steele, C. M., Pelletier, C. A. The effect of barium on perceptions of taste intensity and palatability. Dysphagia. 29 (1), 96-108 (2014).
- Stokely, S. L., Molfenter, S. M., Steele, C. M. Effects of barium concentration on oropharyngeal swallow timing measures. Dysphagia. 29 (1), 78-82 (2014).
- Harris, J. A., et al. The Use of Low-Osmolar Water-Soluble Contrast in Videofluoroscopic Swallowing Exams. Dysphagia. , (2013).
- Hillel, A., Miller, R. Bulbar Amyotrophic Lateral Sclerosis: Patterns of Progression and Clinical Management. Head & Neck. 11, 51-59 (1989).
- Russell, J. A., Ciucci, M. R., Hammer, M. J., Connor, N. P. Videofluorographic assessment of deglutitive behaviors in a rat model of aging and Parkinson disease. Dysphagia. 28 (1), 95-104 (2013).
- Lever, T. E., et al. An animal model of oral dysphagia in amyotrophic lateral sclerosis. Dysphagia. 24 (2), 180-195 (2009).
- Lever, T. E., et al. A mouse model of pharyngeal dysphagia in amyotrophic lateral sclerosis. Dysphagia. 25 (2), 112-126 (2010).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behavioural Brain Research. 222 (2), 315-320 (2011).
- Ciucci, M. R., Schaser, A. J., Russell, J. A. Exercise-induced rescue of tongue function without striatal dopamine sparing in a rat neurotoxin model of Parkinson disease. Behavioural Brain Research. 252, 239-245 (2013).
- Plowman, E. K., Kleim, J. A. Behavioral and neurophysiological correlates of striatal dopamine depletion: A rodent model of Parkinson’s disease. Journal of Communication Disorders. 44 (5), 549-556 (2011).
- Sugiyama, N., et al. A novel animal model of dysphagia following stroke. Dysphagia. 29 (1), 61-67 (2014).
- Bachmanov, A. A., Reed, D. R., Li, X., Beauchamp, G. K. Genetics of sweet taste preferences. Pure Appl Chem. 74 (7), 1135-1140 (2002).
- Ishiwatari, Y., Bachmanov, A. A. NaCl taste thresholds in 13 inbred mouse strains. Chem Senses. 37 (6), 497-508 (2012).
- Pinhas, A., et al. Strain differences in sucrose- and fructose-conditioned flavor preferences in mice. Physiol Behav. 105 (2), 451-459 (2012).
- Midkiff, E. E., Bernstein, I. L. The influence of age and experience on salt preference of the rat. Dev Psychobiol. 16 (5), 385-394 (1983).
- Niimi, K., Takahashi, E. Differences in saccharin preference and genetic alterations of the Tas1r3 gene among senescence-accelerated mouse strains and their parental AKR/J strain. Physiol Behav. , (2014).
- Weijnen, J. A. Licking behavior in the rat: measurement and situational control of licking frequency. Neurosci Biobehav Rev. 22 (6), 751-760 (1998).
- Weijnen, J. A. Lick sensors as tools in behavioral and neuroscience research. Physiol Behav. 46 (6), 923-928 (1989).
- Kobayashi, M., et al. Electrophysiological analysis of rhythmic jaw movements in the freely moving mouse. Physiol Behav. 75 (3), 377-385 (2002).
- Dantas, R., et al. Effect of swallowed bolus variables on oral and pharyngeal phases of swallowing. 258, G675-681 (1990).
- Johnsson, F., Shaw, D., Gabb, M., Dent, J., Cook, I. Influence of gravity and body position on normal oropharyngeal swallowing. American Journal of Physiology. 35 (5), G653-G658 (1995).
- Han, T. T., Paik, N. -. J., Park, J. W. Quantifying swallowing function after stroke: A functional dysphagia scale based on videofluoroscopic studies. Archives of Physical Medicine and Rehabilitation. 82 (5), 677-682 (2001).
- Molfenter, S. M., Steele, C. M. Kinematic and temporal factors associated with penetration-aspiration in swallowing liquids. Dysphagia. 29 (2), 269-276 (2014).
- Kendall, K. A., McKenzie, S., Leonard, R. J., Goncalves, M. I., Walker, A. Timing of events in normal swallowing: A videofluoroscopic study. Dysphagia. 15, 74-83 (2000).
- Choi, K. H., Ryu, J. S., Kim, M. Y., Kang, J. Y., Yoo, S. D. Kinematic analysis of dysphagia: Significant parameters of aspiration related to bolus viscosity. Dysphagia. 26, 392-398 (2011).
- Molfenter, S. M., Steele, C. M. Variation in temporal measures of swallowing: Sex and volume effects. Dysphagia. 28, 226-233 (2013).
- Alves, L. M. T., Secaf, M., Dantas, R. Effect of a bitter bolus on oral, pharyngeal, and esophageal transit of healthy subjects. Arquivos de gastroenterologia. 50 (1), 31-34 (2013).
- Dalmazo, J., Aprile, L. R. O., Dantas, R. O. Esophageal contractions, bolus transit and perception of transit after swallows of liquid and solid boluses in normal subjects. Arquivos de gastroenterologia. 49 (4), 250-254 (2012).
- Kahrilas, P. J., Dodds, W. J., Hogan, W. J. Effect of peristaltic dysfunction on esophageal volume clearance. Gastroenterology. 94 (1), 73-80 (1988).
- German, R. Z., Crompton, A. W., Levitch, L. C., Thexton, A. J. The mechanism of suckling in two species of infant mammal: Miniature pigs and long-tailed macaques. Journal of Experimental Zoology. 261 (3), 322-330 (1992).
- Herring, S. W., Scapino, R. P. Physiology of feeding in miniature pigs. Journal of Morphology. 141 (4), 427-460 (1973).
- Gordon, K. R., Herring, S. W. Activity patterns within the genioglossus during suckling in domestic dogs and pigs: Interspecific and intraspecific. Brain, Behavior, and Evolution. 30 (5-6), (1987).
- Hiiemae, K. M., Palmer, J. B. Food transport and bolus formation during complete feeding sequences on foods of different initial consistency. Dysphagia. 14 (1), 31-42 (1999).
- Thexton, A. J., Crompton, A. W., German, R. Z. EMG activity in the hyoid muscles during pig suckling. Journal of Applied Physiology. 112, 1512-1519 (2012).
- Thexton, A. J., Crompton, A. W., German, R. Z. Transition from suckling to drinking at weaning: A kinematic and electromyographic study in miniature pigs. Journal of Experimental Zoology. 280 (5), 327-343 (1998).
- Goldfield, E. C., Richardson, M. J., Lee, K. G., Margetts, S. Coordination of sucking, swallowing, and breathing and oxygen saturation during early infant breast-feeding and bottle-feeding. Pediatric Research. 60 (4), 450-455 (2006).
- Ottaviano, F. G., Linhares Filho, T. A., Andrade, H. M., Alves, P. C., Rocha, M. S. Fiberoptic endoscopy evaluation of swallowing in patients with amyotrophic lateral sclerosis. Braz J Otorhinolaryngol. 79 (3), 349-353 (2013).
- Inamoto, Y., et al. The effect of bolus viscosity on laryngeal closure in swallowing: kinematic analysis using 320-row area detector CT. Dysphagia. 28 (1), 33-42 (2013).
- Spalding, J. F., Thomas, R. G., Tietjen, G. L., Rein, S. e. r. e. n. e. . Los Alamos National Laboratory. , (1982).
- Palomba, S., Di Cello, A., Riccio, E., Manguso, F., La Sala, G. B. Ovarian function and gastrointestinal motor activity. Minerva Endocrinol. 36 (4), 295-310 (2011).
- Alves, L. M., Cassiani Rde, ., Santos, A., M, C., Dantas, R. O. Gender effect on the clinical measurement of swallowing. Arq Gastroenterol. 44 (3), 227-229 (2007).
- Logemann, J. A., Pauloski, B. R., Rademaker, A. W., Kahrilas, P. J. Oropharyngeal swallow in younger and older women: videofluoroscopic analysis. J Speech Lang Hear Res. 45 (3), 434-445 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon