Method Article
Délivrance systémique des micro-ARN, à l’aide de Recombinant Adeno-associated Virus sérotype 9 pour traiter des maladies neuromusculaires chez les rongeurs
Dans cet article
Résumé
Nous décrivons ici la livraison des micro-ARN, à l’aide d’un sérotype de virus adeno-associé recombinant 9 dans un modèle murin d’une maladie neuromusculaire. Une seule administration périphérique chez les souris a entraîné surexpression de miRNA soutenue dans les muscles et les neurones moteurs, fournissant l’occasion de l’étude miRNA fonction et thérapeutiques potentiels in vivo.
Résumé
L’interférence ARN via la voie endogène miRNA régule l’expression des gènes en contrôlant la synthèse des protéines par le biais de post-transcriptional gene silencing. Ces dernières années, la régulation des gènes miRNA-mediated a montré potentielle pour le traitement des troubles neurologiques causés par un gain toxique du mécanisme de la fonction. Toutefois, la prestation efficiente aux tissus cibles a limité sa demande. Ici nous avons utilisé un modèle de souris transgéniques pour l’atrophie musculaire spinale et bulbaire (SBMA), une maladie neuromusculaire causée par une expansion de polyglutamine dans le récepteur des androgènes (AR), afin de tester le silençage génique par un nouveau identifié AR-ciblage miRNA, miR-298. Nous avons surexprimé miR-298 utilisant un vecteur de sérotype 9 de recombinant virus adeno-associé (rAAV) pour faciliter la transduction des cellules non-divisant. Une seule injection de queue veineuse chez la souris SBMA induit soutenue et généralisée de la surexpression de la miR-298 dans le muscle squelettique et les neurones moteurs et a abouti à une amélioration du phénotype neuromusculaire chez les souris.
Introduction
MiARN est non codantes RNAs, 21-23 nucléotides de long, qui jouent un rôle important dans la régulation de l’expression génique et contrôle des diverses voies métaboliques et cellulaires. 1 l’expression des gènes est principalement régie en induisant la dégradation de le post-transcriptional gene silencing ou ARNm. 2 miARN est généralement complémentaires pour la région 3' non traduite (UTR) du codage de gènes, bien que la liaison à la 5' UTR et codage des régions de l’objectif qu'a également décrit des ARNm. 3
Que se développe la compréhension actuelle du rôle des miRNA dans la pathogenèse des maladies humaines, modulation pharmacologique des miARN individuels ou familles de miARN est de plus en plus une option thérapeutique viable. Par rapport à d’autres stratégies de l’inhibition du RNA, miRNAs présentent de nombreux avantages : miARN sont moins toxiques et moins immunogènes et facilement exploitables dans les cellules à cause de leur petite taille. 4 , 5 , 6 miARN ont généralement plusieurs cibles dans les réseaux cellulaires, donc les effets potentiels hors cible et les problèmes de sécurité doivent être prises en compte, ainsi que de l’efficience aux tissus cibles.
Maladies neuromusculaires sont acquis ou hérités des conditions qui affectent les muscles et neurones moteurs. Le ciblage des médicaments dans le muscle squelettique est un domaine émergent de la recherche, où le principal défi est d’atteindre une large diffusion au sein de la fenêtre thérapeutique. 7 les neurones moteurs sont plus difficiles à cibler, principalement parce que l’accès aux médicaments est exclue par la barrière hémato-encéphalique.
Modèles cellulaires de la culture et de la souris de l’atrophie musculaire spinale et bulbaire (SBMA) ont été utilisées dans cette étude. SBMA est une maladie neuromusculaire causée par un gain toxique du mécanisme de la fonction, dans laquelle les muscles et neurones moteurs sont touchés. 8 , 9 SBMA (maladie de Kennedy ; OMIM #313200) est une maladie liée à le X, caractérisée par une faiblesse musculaire et une atrophie, causée par une expansion CAG répétition du gène AR, qui encode un tract polyglutamine étendu dans la protéine de l’AR . 10 aucun traitement modificateur de la maladie n’est actuellement disponible pour ce trouble. Le modèle de souris transgénique utilisé dans cette étude récapitule les caractéristiques de la maladie, y compris la spécificité des sexes, motoneurone pathologie et l’atrophie musculaire progressive. 11
Dans cette étude, nos efforts axés sur l’identification d’un miRNA entraîne directement des expression du transgène AR mutant et sur la conception d’un mode efficace et sécuritaire de la livraison de la miRNA à la moelle épinière et les muscles squelettiques de notre modèle de souris de la maladie.
Ici, nous avons identifié un miRNA relativement indéterminé, miRNA-298 (numéro MIMAT0004901),12 pour réduire directement mutante expression AR dans les modèles SBMA. Afin de réaliser la prestation de miR-298 aux tissus cibles, nous avons utilisé une stratégie virale, par sérotype de virus adeno-associé recombinant 9 (rAAV9). rAAV9 est capable de traverser la barrière hémato-encéphalique et de médiation de l’expression génique à long terme dans les cellules non-Division, dont les neurones. 13 une seule administration systémique de AAV9-miR-298 a entraîné une expression durable de la miRNA, transduction efficace du muscle et des neurones moteurs, down-régulation de l’expression de l’AR et amélioration du phénotype de la maladie chez les souris SBMA. 14 cette méthodologie peut être utilisée pour fournir miRNA ou antagomirs surexpression in vivo.
Protocole
Toutes les procédures ont été effectuées conformément au instituts nationaux de santé Guide pour le soin et l’utilisation des animaux de laboratoire (8e éd., National Academies Press, révision 2011) et ont été approuvés par le Comité de protection des animaux NINDS.
1. AAV9-miRNA conception stratégie et miRNA sélection
- MiRWalk base de données prédictive permet de sélectionner le candidat miARN qui interagissent avec la région du gène cible de mRNA 3' UTR. 15
NOTE : Limiter la longueur minimale de semences de miRNA séquence au moins 7 nucléotides. Sélectionnez les autres programmes de prévision établie miRNA (miRanda, miRDB, Targetscan) pour l’analyse comparative. Selon ces critères de sélection, ici, miR-185, miR-298, miR-873 et miR-877 ont été sélectionnés pour une évaluation plus poussée. - Récupérer la séquence de la miRNA sélectionné de miRBase (http://www.mirbase.org/).
- Cloner le pri-mir (60-70 nts) et ses 250-300 nts flanquant la séquence génomique sur les deux côtés, ou une séquence de simulacre, dans l’AAV approprié cis vectoriels.
Remarque : La séquence flanquante est nécessaire pour l’expression correcte pri-mir et le traitement de micro-ARN mature. Sélectionner un vecteur de cis dual-promoteur rAAV avec une cassette d’expression composée par exemple d’un promoteur de facteur 1 alpha (EIF1α) allongement humaine suivi du miRNA sélectionné ou séquence de simulacre, et le promoteur du cytomégalovirus humain (CMV) suivie d’ADNc codant la balise fluorescente GFP. Le promoteur EIFα a été choisi parce qu’il garantit une expression stable et homogène, avec des risques minimes de réduire au silence. Promoteurs spécifiques ou conditionnelles de tissu peuvent être utilisés, selon les demandes spécifiques. - Préparer, purifier et titrer l’AAV, suivant des protocoles publiés. 16
NOTE : Ici, le clonage de la pri-mir dans l’AAV vecteur et production virale ont été réalisés par un fabricant extérieur.
2. queue Injection dans la veine du plasmide AAV-miRNA
Remarque : Cette étape a besoin d’ajustement selon le gène cible et l’âge et le poids des souris. Les orientations institutionnelles et protection des animaux et utilisation Comité (IACUC) permet de déterminer l’intervalle de doses, le volume et la meilleure voie d’administration fondée sur l’âge et le poids des souris. GFP fluorescence signal et miRNA niveaux d’expression dans les tissus cibles sont censés pic à partir de 2 semaines après l’injection. Le protocole suivant fait référence à des souris mâles dans l’âge adulte. AAV doit être manipulé comme un danger biologique en vertu des lignes directrices sur la biosécurité de niveau 1.
- Diviser le stock de plasmide AAV-miRNA dans 100-200 µL d’extraits contenant une charge virale de 1010-1011 génomes viraux par mL (vg/mL) à l’aide de salin stérile tamponnée au phosphate (PBS). Équipement de protection individuelle de laboratoire biologique doit être utilisé pour gérer la solution AAV.
Remarque : Une fois une partie aliquote est décongelée il peut être stocké à 4 ° C pendant deux semaines. Stock virale peut être stocké au congélateur-80 ° C. - Immobiliser la souris en dynamiques disponibles dans le commerce comme le tube de film plastique en plastique ou conique de taille appropriée.
- Nettoyer la surface de la queue avec des lingettes d’alcool 70 %.
- Une touche chaude (28-30 ° C) sous la queue d’augmenter vasodilatation pendant 30 s. alternativement, réchauffer les animaux à l’aide d’une lampe rouge (à une distance de 2-3 pieds) ou en plongeant la queue dans l’eau tiède.
-
À partir de la portion distale de la queue, insérer l’aiguille (27-30 G) chargés de l’aliquote virale, biseau vers le haut, 15° de la queue, dans la veine. Avant l’injection, s’assurer que l’aiguille est insérée correctement.
- Si une résistance est ressentie pendant l’injection, ou gonflement apparaît sous la peau, arrêter la procédure. Retirer l’aiguille et ré-insérer l’aiguille au-dessus du site d’injection précédente.
NOTE : Sinon, c’est possible en aspirant doucement l’aiguille et en observant de sang. Aspiration dure peut s’effondrer la veine caudale. Si la veine blanches pendant l’injection, l’aiguille est insérée correctement.
- Si une résistance est ressentie pendant l’injection, ou gonflement apparaît sous la peau, arrêter la procédure. Retirer l’aiguille et ré-insérer l’aiguille au-dessus du site d’injection précédente.
- Une fois l’injection terminée, attendre quelques secondes avant de relever l’aiguille.
- Observer le point d’injection pour les saignements. Appliquer une pression modérée à l’aide de deux doigts sur le site jusqu'à ce que le saignement s’arrête.
- Retourner l’animal de sa cage.
3. comportements dosages
Remarque : Toutes les expériences ont été menées aveuglément par une tierce partie, avec la dissimulation des traitements par flacons unique codés. Ordre des traitements a été randomisé. Lorsque vous effectuez les tests décrits ci-dessous, les conditions expérimentales (type de chambre) et l’heure de la journée doivent être contrôlées pour réduire la variation. Ce test devrait être effectué sur des souris âgées de quatre semaines pour atteindre des résultats fiables. Souris a subi une évaluation comportementale une fois avant l’injection virale à 5 semaines d’âge pour obtenir un rendement normal de référence. Après injection virale, les souris ont été évaluées une fois par semaine à partir de 48 h après l’injection, jusqu'à à 40 semaines d’âge.
- Amener la souris injectée avec AAV dans une pièce calme et sombre qui est exempte de bruit ou d’autre perturbations au moins 30 min avant de commencer les essais. Ne pas déranger les animaux au cours de cette période d’acclimatation.
- Acclimater la souris à la nouvelle salle pendant 30 min et ensuite commencer les épreuves comportementales suivantes (étapes 3.3 et 3.4). Garder un écart de 10 min entre chaque série de tests comportementaux.
-
Essai de fil de suspension
Remarque : Ce test surveille la force musculaire et des troubles moteurs.- Utiliser une feuille de rembourrage d’agir comme un coussin. Soulevez la souris par la queue et placez-le sur le centre de la grille grille. Soulever le panier de 15-20 pouces au-dessus de la surface et inverser lentement l’écran pour permettre à l’animal d’ajuster son emprise sur l’écran.
- Une fois que la grille est complètement inversée, démarrer le compte à rebours et enregistrer le temps de tomber.
NOTE : Les souris seront bloque avec quatre membres sur une grille. Si le fil est réglé trop bas les souris ne peuvent pas accrocher aux. Si la souris tombent en bas de la grille avant 60 s, placez-les sur la grille, réinitialiser la minuterie et répétez l’opération jusqu'à deux autres essais. Enregistrer la meilleure performance. - Lorsque le délai de 60 s est atteinte, le dos animaux de retour à la cage.
-
Test impression de pied
Remarque : La feuille absorbante doit être une piste étroite environ 70 cm de long et 5 cm de large avec de hauts murs de 5 cm.- Maintenez la souris doucement d’une main et appliquer l’encre rouge aux pattes avant et encre bleue pour les pattes avec une brosse.
- Placez la feuille absorbante sur le sol d’une piste étroite.
- Laissez la souris pour marcher ou courir sur une feuille absorbante en ligne droite dans la piste d’un bout à l’autre.
- Répétez l’opération deux fois avec la souris à l’aide d’une feuille absorbante douce.
- Mesurez la distance entre deux marches consécutives dans le mouvement vers l’avant. Ne pas inclure tout d’abord et durer quelques empreintes où l’animal est juste lancer et finir sa course.
4. euthanasie et récolte de tissus
- Utiliser une chambre de l’euthanasie ou une cloche de verre. Si vous utilisez une cloche de verre, effectuez la procédure sous une hotte aspirante.
- Faire tremper le coton à l’isoflurane et le placer dans la cloche de verre. Utiliser un séparateur physique pour empêcher l’animal de contact physique avec le matériel d’anesthésie. Placer l’animal dans le pot immédiatement après cette étape.
Remarque : La cloche de verre ne doit pas être préchargé avec l’isoflurane pour éviter la possibilité d’une hypoxémie chez les animaux. - Continuer l’exposition isoflurane jusqu'à 30 s après l’arrêt de la respiration.
- Immédiatement après avoir enlevé la souris à partir du pot, euthanasier par dislocation cervicale.
Remarque : Cette étape devrait avoir lieu aussi rapidement que possible pour éviter la dégradation des tissus. -
Récolte de la spinal cord tout d’abord, puis les muscles squelettiques du quadriceps.
- De récolter la moelle épinière, exposer la face arrière de la souris et fixer les quatre branches sur le côté à un Conseil de dissection.
- Laver le site de dissection de l’éthanol à 70 %.
- Effectuer la dislocation cervicale à l’aide de ciseaux pointu.
- Faire une incision dans la peau de la ligne médiane. Enlever la peau par coupe ou prudent de déchirure de la peau dans le plan transversal, puis en tirant la peau vers le haut et au-dessus de la tête. Sortez la tête de coupe avec des ciseaux sous les omoplates et dans la région de C1-2 de la colonne (trouvée près de la base du crâne).
- Couper la musculature de la paroi abdominale sur la face ventrale et continuer latéralement, une direction à la fois, jusqu'à ce que la colonne vertébrale est atteinte.
- À l’aide d’une vertèbre de supprimer de ciseaux pointus à partir de la moelle épinière cervicale. Enlever les parties latérales des vertèbres en coupant à travers les arcs vertébraux sur les deux côtés.
- Après avoir enlevé les vertèbres ensemble libérer la moelle épinière.
-
Composant logiciel enfichable geler les tissus récoltés en 2-Méthylbutane préalablement refroidie à l’aide de la méthode suivante :
- La moitié remplir un bol en acier inoxydable avec 2-Méthylbutane et submerger le quart inférieur du bol dans un récipient rempli d’azote liquide.
- Avant Faites refroidir le 2-Méthylbutane dans l’azote liquide pendant 1-2 min.
- Placer le muscle squelettique avec une pince dans le 2-Méthylbutane jusqu'à ce qu’il blanchisse. Transférer immédiatement le tissu pour la glace sèche et ensuite le stocker à-80 ° C.
- Pour la moelle épinière immunostaining, incorporer le tissu dans des blocs de paraffine à température ambiante avant snap gel comme décrit. 17
- Pour une analyse biochimique et la quantification de la miRNA,1 placer le tissu récolté dans un cryovial et congélation dans l’azote liquide. Stocker les échantillons à-80 ° C.
Résultats
Une charge virale de 1011 vg de AAV9-miR-298 a été injectée à travers une seule injection de queue veineuse dans des souris SBMA âgés de 5 semaines. Ces souris portent le transgène AR humain avec anormalement élargi polyglutamine tract à l’AR (AR97Q) et développent des signes de la maladie neuromusculaire en 10 semaines d’âge (perte de poids, le dos voûté et atrophie musculaire). 11 la moelle épinière lombaire et muscle quadriceps ont été récoltés à 2, 4, 8 et 12 semaines après l’administration de quantification de miRNA, dosage biochimique et immunohistochimie (Figure 1). Administration du traitement et les analyses subséquentes ont été effectuées par les enquêteurs aveugles.
analyse qRT-PCR a montré respectivement, l’expression de miR-298 dans le muscle squelettique et de la moelle épinière deux et quatre semaines après le traitement avec les niveaux d’expression de pointe à 8 semaines dans le muscle squelettique et 12 semaines dans la moelle épinière après l’injection (Figure 2 ). À l’aide d’un microscope (Axiovert 100 M), le signal de fluorescence verte a été détecté dans le tissu musculaire et dans les neurones moteurs spinaux de co-localisation des GFP et la motoneurone marqueur choline acétyltransférase (ChAT) 10 semaines après le traitement, quand les souris commencent à apparaître manifestations de la maladie (Figure 2).
En utilisant le même schéma posologique, une cohorte de souris SBMA a été randomisée pour recevoir soit miR-298 ou moquer de 7 semaines d’âge par injection dans la veine queue pour les analyses biochimiques et caractérisation fonctionnelle. Injection a été suivie de poids hebdomadaire et évaluation comportementale à 40 semaines d’âge. analyse qRT-PCR ont montré que le traitement de miR-298 réduit les concentrations de mutant AR dans les tissus affectés (Figure 3) et a augmenté le poids corporel et amélioré les performances du moteur (Figure 4) à partir de 10 semaines après l’injection.
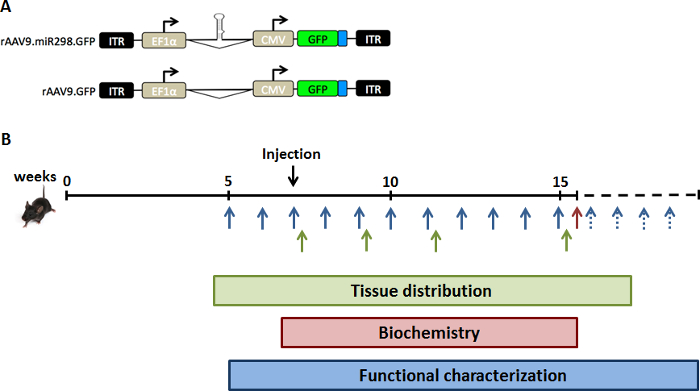
Figure 1 : schéma de conception de l’étude. Pour augmenter les niveaux d’expression de miR-298 in vivo, nous avons injecté souris SBMA avec (A), le vecteur d’AAV double promoteur plasmide exprimant GFP et miR-298 ou fictifs. Souris (B) ont été injectés par une seule injection de queue-vain à 7 semaines d’âge (stade présymptomatique). La moelle épinière et muscle quadriceps ont été prélevés sur une cohorte de souris SBMA à des moments différents pour l’analyse de la distribution tissulaire (vert). Une cohorte de souris SBMA a été traitée et sacrifiée à 16 semaines d’âge pour les analyses biochimiques (rouges). Poids et tests comportements ont été réalisées par semaine vers le haut à 40 semaines d’âge pour la caractérisation fonctionnelle (bleu). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : AAV9-miR-298 livraison chez la souris. À l’aide de la méthode décrite ici, des souris ont reçu AAV9-miR-298-GFP ou AAV9-maquette-GFP par injection intraveineuse. MiRNA total a prélevé de la moelle épinière lombaire et le muscle quadriceps au 2,4,8 et 12 semaines après l’injection. qRT-PCR a été réalisée afin d’évaluer le niveau d’expression du muscle quadriceps miR-298 (A) (n = 5) (B) la moelle épinière lombaire (n = 5, P < 0,01). Toutes les données sont déclarées comme moyen ± écart-type moyenne. La transduction généralisée du vecteur AAV dans les tissus récoltés à 10 semaines après que traitement ont été confirmé par la localisation de coloration pour GFP dans le muscle quadriceps (C) (origine grossissement 10 X. Echelle = 100 µm) et les neurones moteurs (D) dans la moelle épinière lombaire (grossissement original, 40 X. Echelle = 10 µm. GFP (green), ChAT (rouge) et le DAPI (bleu). La figure a été modifiée par doi : 10.1038/mt.2016.13. 14 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : MiRNA-298 surexpression entraîne mutant AR dans la moelle épinière et muscle quadriceps chez les souris. qRT-PCR a été réalisée pour estimer les niveaux d’expression des ARNm de AR dans la moelle épinière lombaire (A) et (B) le muscle quadriceps traitées avec AAV9-miR-298-GFP ou AAV9-maquette-GFP. Niveaux de transcription ont été normalisés à snoRNA202 (n = 5 par traitement). * P < 0,05, ** P < 0,01. Toutes les données sont déclarées comme moyen ± erreurs-types. La figure a été modifiée par doi : 10.1038/mt.2016.13. 14

Figure 4 : surexpression de MiR-298 améliore la fonction motrice et réduit la perte de poids. Comportementale a été effectuée une fois par semaine (w), entre la semaine 5 à 40. Corps poids (à gauche) et la pendaison des performances de fil (à droite) de souris (n = 15 / groupe). Toutes les données sont déclarées comme moyen ± erreurs-types. La figure a été modifiée par doi : 10.1038/mt.2016.13. 14
Discussion
Nous démontrons une méthodologie très efficace et accessible pour les sélectionner et livrer par injection de queue un miRNA utiliser rAAV9 comme un vecteur viral pour cibler les muscles squelettiques et les neurones moteurs chez la souris. 14 par rapport à d’autres stratégies d’Arni, miARN est moins toxiques et moins immunogènes. 18 en outre, leur petite taille les rendent bien adapté à la capacité limitée d’emballage de vecteurs viraux. 2 algorithmes de calcul et les outils de prédiction permettent l’identification de miRNA putatif-ARNm cibles. Une fois identifiés, les effets de miRNA sur l’expression des gènes cible doivent être vérifiées. Une approche courante consiste à surexpriment un miRNA donné in vitro et de détecter les niveaux d’expression de protéine cible en utilisant l’analyse de l’Ouest. 14 , 19
Diverses études ont utilisé les stratégies virus et non viraux pour livrer des miARN. 13 ici nous avons utilisé des adeno-associated virus (AAV) comme un outil de livraison de gène. Par rapport aux autres vecteurs viraux, AAV suscite faible immunogénicité, permet un transfert de gènes à long terme, et a un large spectre de tropisme en divisant et non de Division des cellules. 18 cette méthode de livraison peut également contourner la nécessité d’une modification chimique qui peut-être affecter la fonctionnalité et la spécificité de la molécule d’ARN. Il y a plusieurs sérotypes d’AAV, qui sont principalement déterminés par la composition des protéines de capside. Ces sérotypes diffèrent dans leur tropisme et transmettre divers types de cellules. Il est nécessaire de sélectionner le sérotype correct si l'on considère le tissu cible. Nous avons choisi rAAV9, en raison de son efficacité de transduction élevé dans le système nerveux central et le muscle squelettique après administration périphérique19,20. Cette approche a montré une plus grande efficacité de transduction chez les animaux nouveau-nés par rapport à des animaux adultes, probablement en raison de différences dans la composition de la matrice extracellulaire, le neurone-glie au rapport et maturité de la barrière hémato-encéphalique. 21 , 22
Une étape importante dans le présent protocole est la conception du vecteur d’expression. Par rapport aux vecteurs bicistronique, qui sont gênés par la plus faible expression du gène deuxième comparé avec le premier gène à côté du promoteur, le vecteur dual promoteur permet une configuration dos à dos, donnant une expression élevée de la miRNA et EGFP, ainsi permettant la localisation de la miRNA dans les tissus de souris par immunofluorescence.
Une injection intraveineuse de AAV9 conduit à haut rendement et transduction homogène dans les tissus cibles, les muscles squelettiques et les neurones moteurs. Cette voie d’injection permet à la dose administrée d’atteindre la circulation systémique et franchir la barrière sang cerveau, qui est importante pour les thérapies ciblant le système nerveux central. En outre, c’est une méthode non invasive pour injection dans le SNC. MiR-298 expression augmentée dans la moelle épinière et les muscles après 2 à 4 semaines avec une seule injection périphérique à 5 semaines d’âge. Quand à l’aide des vecteurs d’AAV, la synthèse de novo du second brin d’ADN simple brin du génome pourrait expliquer la transduction retardée. 23
Niveaux de miR-298 humaine étaient indétectables chez les souris traitées 20 semaines après une seule administration, ce qui suggère que, pour des maladies chroniques, injections multiples peuvent être nécessaires pour atteindre un bénéfice thérapeutique. Cependant, miRNA dégradation au fil du temps peut être limitant lorsqu’une administration répétée tout au long est requise. En outre, l’immunité adaptative à des vecteurs d’AAV peut former un autre obstacle à une livraison réussie de gène. 24 ainsi génération des vecteurs d’AAV qui sont immunologiquement inerte est cruciale pour l’administration répétée et la réalisation des effets à long terme avec ce système de livraison prometteur. 25
Une limitation de l’utilisation des miARN comme une stratégie thérapeutique est le risque d’effets hors cible. MiARN peut-être interagir par le biais d’incomplementary base appareillant avec autres transcriptions de gène, qui pose un risque pour la sécurité avec cette approche. Amélioré la conception des séquences Arni, y compris l’utilisation des miARN non canoniques, tels que mirtrons, qui contourner le micro-processeur complexe et des études à long terme d’innocuité et de tolérabilité sont essentiels avant de traduire cette stratégie dans un coffre-fort et traitement efficace. 26 , 27 , 28
La méthode décrite ici a été initialement développée pour l’overexpression de miRNA, mais il peut également être utilisé pour la thérapie de l’inhibition de miRNA à l’aide d’antagomirs.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs ne déclarent aucun conflit d’intérêts. Nous remercions les laboratoires SignaGen (Rockvile, MD, USA) pour la production de virus AAV9. Cette recherche a été financée par le programme de recherche intra-muros de la NINDS, NIH. Philip R. Lee a été pris en charge par des fonds de la Division de recherche intra-muros du NICHD. Carlo Rinaldi a été soutenu par une bourse de l’Association Française contre les Myopathies (AFM).
matériels
| Name | Company | Catalog Number | Comments |
| QIAzol Lysis Reagent | Qiagen | 79306 | Lysis of fatty and standard tissues before RNA isolation |
| miRNeasy Mini Kit | Qiagen | 217004 | Purification of miRNA and total RNA |
| TaqMan MicroRNA Reverse Transcription kit | ThermoFisher Scientific | 4366596 | A highly specific kit that quantitates only mature miRNAs |
| snoRNA202 Primer | ThermoFisher Scientific | 1232 | Taqman miRNA control assay in mouse |
| miR-298 Primer | ThermoFisher Scientific | 2190 | Taqman miRNA-298 assay in mouse |
| Anti-GFP antibody | abcam | ab290 | Rabbit polyclonal to GFP - ChIP Grade |
| Red ink pad | Dovecraft Essentials | ||
| Blue ink pad | Dovecraft Essentials | ||
| AAV9-GFP vector | SignaGen Laboratories | SL100840 | Large scale AAV plasmid construction, packaging and purification |
| mmu-miR-298-5p | ThermoFisher Scientific | MC12525 | mirVana miRNA mimic |
| AAV9-EF1a-has-mir-298-GFP | Vector Biosystems Inc |
Références
- Broderick, J. A., Zamore, P. D. miRNA therapeutics. Gene Therapy. 18, 1104-1110 (2011).
- Esteller, M. Non-coding RNAs in human disease. Nat Rev Genet. 12, 861-874 (2011).
- Pickering, B. M., Willis, A. E. The implications of structured 5' untranslated regions on translation and disease. Semin Cell Dev Biol. 16, 39-47 (2005).
- Bilen, J., Liu, N., Burnett, B. G., Pittman, R. N., Bonini, N. M. MicroRNA pathways modulate polyglutamine-induced neurodegeneration. Mol Cell. 24, 157-163 (2006).
- Lee, Y., Samaco, R. C., Gatchel, J. R., Thaller, C., Orr, H. T., Zoghbi, H. Y. miR-19, miR-101 and miR-130 co-regulate ATXN1 levels to potentially modulate SCA1 pathogenesis. Nat Neurosci. 11, 1137-1139 (2008).
- Liu, N., et al. The microRNA miR-34 modulates ageing and neurodegeneration in Drosophila. Nature. 482, 519-523 (2012).
- Ebner, D. C., et al. Strategies for skeletal muscle targeting in drug discovery. Curr Pharm Des. 10, 1327-1336 (2015).
- Giorgetti, E., Lieberman, A. P. Polyglutamine androgen receptor-mediated neuromuscular disease. Cell Mol Life Sci. 73, 3991-3999 (2016).
- Grunseich, C., Rinaldi, C., Fischbeck, K. H. Spinal and bulbar muscular atrophy: pathogenesis and clinical management. Oral Dis. 20, 6-9 (2014).
- La Spada, A. R., Wilson, E. M., Lubahn, D. B., Harding, A. E., Fischbeck, K. H. Androgen receptor gene mutations in X-linked spinal and bulbar muscular atrophy. Nature. 352, 77-79 (1991).
- Katsuno, M., Adachi, H., Kume, A., Li, M., Nakagomi, Y., Niwa, H., Sang, C., Kobayashi, Y., Doyu, M., Sobue, G. Testosterone reduction prevents phenotypic expression in a transgenic mouse model of spinal and bulbar muscular atrophy. Neuron. 35, 843-854 (2002).
- Boissonneault, V., Plante, I., Rivest, S., Provost, P. MicroRNA-298 and microRNA-328 regulate expression of mouse beta-amyloid precursor protein-converting enzyme 1. J Biol Chem. 284, 1971-1981 (2009).
- Choudhury, S. R., et al. Widespread central nervous system gene transfer and silencing after systemic delivery of novel AAV-AS vector. Mol Ther. 24, 726-735 (2016).
- Pourshafie, N., et al. MiR-298 counteracts mutant androgen receptor toxicity in spinal and bulbar muscular atrophy. Mol Ther. 24, 937-945 (2016).
- Dweep, H., Sticht, C., Pandey, P., Gretz, N. miRWalk--database: prediction of possible miRNA binding sites by "walking" the genes of three genomes. J Biomed Inform. 44, 839-847 (2011).
- McClure, C., Cole, K. L., Wulff, P., Klugmann, M., Murray, A. J. Production and titering of recombinant adeno-associated viral vectors. J Vis Exp. (57), e3348(2011).
- Stuard, D. A., Oorschot, D. E. Embedding, sectioning, immunocytochemical and stereological methods that optimise research on the lesioned adult rat spinal cord. J Neurosci Methods. 61, 5-14 (1995).
- Huang, F., et al. miR-25 alleviates polyQ-mediated cytotoxicity by silencing ATXN3. FEBS Lett. 588, 4791-4798 (2014).
- Kuhn, D. E., Martin, M. M., Feldman, D. S., Terry, A. V., Nuovo, G. J., Elton, T. S. Experimental validation of miRNA targets. Methods. 44, 47-54 (2008).
- Yang, N. An overview of viral and nonviral delivery systems for microRNA. Int J Pharm Investig. 5, 179-181 (2015).
- Bourdenx, M., Dutheil, N., Bezard, E., Dehay, B. Systemic gene delivery to the central nervous system using Adeno-associated virus. Front Mol Neurosci. 7, 50(2014).
- Foust, K. D., Nurre, E., Montgomery, C. L., Hernandez, A., Chan, C. M., Kaspar, B. K. Intravascular AAV9 preferentially targets neonatal neurons and adult astrocytes. Nat Biotechnol. 27, 59-65 (2009).
- Wang, Z., Ma, H. -I., Li, J., Sun, L., Zhang, J., Xiao, X. Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo. Gene Therapy. 10, 2105-2111 (2003).
- Saunders, N. R., Joakim Ek, C., Dziegielewska, K. M. The neonatal blood-brain barrier is functionally effective, and immaturity does not explain differential targeting of AAV9. Nat Biotechnol. 27, 804-805 (2009).
- Boudreau, R. L., Spengler, R. M., Davidson, B. L. Rational design of therapeutic siRNAs: minimizing off-targeting potential to improve the safety of RNAi therapy for Huntington’s disease. Mol Ther. 19, 2169-2177 (2011).
- Duque, S., Joussemet, B., Riviere, C., Marais, T., Dubreil, L., Douar, A. M., et al. Intravenous administration of self-complementary AAV9 enables transgene delivery to adult motor neurons. Mol Ther. 17, 1187-1196 (2009).
- Lowenstein, P. R. Crossing the rubicon. Nat Biotechnol. 27, 42-44 (2009).
- Sibley, C. R., Seow, Y., Curtis, H., Weinberg, M. S., Wood, M. J. Silencing of Parkinson's disease-associated genes with artificial mirtron mimics of miR-1224. Nucleic Acids Res. 40, 9863-9875 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon