Method Article
Une méthode Simple pour le criblage à haut débit chimique chez Caenorhabditis Elegans
Dans cet article
Résumé
Nous décrivons ici un protocole simple pour produire rapidement des centaines de gélose de croissance nématode de médias, des plaques de 96 puits de culture avec un nombre uniforme de Caenorhhabditis elegans / puits. Ces cultures sont utiles pour le dépistage phénotypique des organismes entiers. Nous nous concentrons ici sur l’utilisation de ces cultures de produits chimiques pour des effets Pro-longévités.
Résumé
Caenorhabditis elegans est un organisme utile pour tester les effets chimiques sur la physiologie. Écrans de petites molécules de l’organisme entier offrent des avantages significatifs pour l’identification des structures chimiques biologiquement actifs qui peuvent de modifier des phénotypes complexes tels que la durée de vie. Décrit ici est un protocole simple pour produire des centaines de plaques de 96 puits de culture avec un nombre assez constant c. elegans dans chaque puits. Ensuite, nous avons précisé l’utilisation de ces cultures à l’écran des milliers de produits chimiques pour les effets sur la durée de vie du nématode c. elegans. Ce protocole utilise des souches stériles sensibles de température, les conditions de plaque agar et animal simple gérant de manière à faciliter la production rapide et haut débit de cultures animales synchronisées pour le dépistage.
Introduction
Un protocole est décrit ici qui a été développé pour le criblage à haut débit de composés chimiques aux effets sur la durée de vie de Caenorhabditis elegans . Le protocole lui-même est facilement adaptable aux autres écrans phénotypiques, y compris les études utilisant des souches de c. elegans de journaliste. Ce protocole a été utilisé avec succès pour identifier un nouveau composé bioactif, NP1 (nitrophényl-pipérazine 1), qui étend fortement la durée de vie de c. elegans grâce à un mécanisme de restriction alimentaire. NP1 et une caractérisation de son effet sur la durée de vie, y compris une description des voies génétiques en jeu, a été précédemment décrit ailleurs1. Ce rapport contient également une description des résultats d’une application à grande échelle de l’écran. Nous décrivons ici beaucoup plus en détail la méthodologie et la mise en place de l’écran lui-même, qui est évolutive pour les applications à petite et à grande échelle.
Le but qui a conduit à la création du protocole décrit ici a été de développer une plate-forme de la culture de c. elegans permettant le dépistage rapide des grandes bibliothèques chimiques pour les nouveaux composés biologiquement actifs. Alors que les écrans chimiques ont été effectuées avant l’élaboration du présent protocole, il s’agissait principalement de petites exploitations et/ou type de candidat s’approche de2,3. En effet, la plupart des écrans effectuées en laboratoire sur des dizaines de composés utilisés des stress tests de résistance, et hits projetés pour la longévité des effets4. Cette étude visait plutôt à dépister directement les effets de la durée de vie. Fait remarquable, il y a quelques descriptions dans la littérature scientifique au moment de la réalisation d’écrans chimiques à grande échelle avec le c. elegans. En effet, par rapport à d’autres types d’écrans5,6,7, dépistage à grande échelle de produits chimique à l’aide de c. elegans semblait être sous-employé.
Il y a deux descriptions d’écrans chimiques à grande échelle chez c. elegans qui étaient utilisés comme une base pour développer cette approche. Le premier d'entre eux était une élégante étude du laboratoire de Peter Roy au moyen d’écrans chimiques afin d’identifier des composés qui pourraient perturber le développement des animaux. L’étude puis enchaîné avec un écran de mutagenèse avant d’identifier les cibles génétiques de ces produits chimiques8. Le protocole décrit dans cette étude a utilisé 24 plats pates, qui était tout simplement impraticable pour des besoins spécifiques de cette étude (quantités limitées de produits chimiques dans la bibliothèque et l’espace limité disponible incubateur). L’autre étude a été novateur et ambitieux écran de petites molécules de Michael Petrascheck pour la durée de vie qui s’étend des produits chimiques9,10. Cette étude a utilisé plaques 384 puits et cultures en milieu liquide. L’autre caractéristique principale de cet écran est l’utilisation de FUDR (5-fluorodésoxyuridine) pour inhiber la production de descendance chimiquement. Après avoir examiné le protocole décrit dans cette étude considérable, autant la stérilisation chimique que des cultures liquides de c. elegans ont été évitées.
Bien que FUDR est largement utilisé dans les expériences de durée de vie de c. elegans , on craint que FUDR peut provoquer des interactions médicamenteuses imprévue, ou que FUDR elle-même peut avoir un certain effet sur la durée de vie. Récemment cette dernière question a été validée, au moins à certaines concentrations et en particulier à 25 ° C11. Pour contourner le problème de contamination de la progéniture, souche de c. elegans TJ1060 a été utilisée, qui abrite deux mutations sensible de température indépendant (spe-9 (hc88) I ; rrf-3(b26)II) abolir la production de spermatozoïdes, qui se sont avérées pour être utile pour les cultures massives de populations synchrone12. Cette souche a été complètement stérile à 25 ° C, mais produira progéniture lorsqu’il est cultivé à 15-20 ° C. Cette étude utilise des conditions de culture conventionnelle, avec vers rampant sur la surface de la gélose, comme les résultats obtenus avec les cultures liquides ne sont pas toujours reproductibles avec des plaques de gélose classiques. Alors que ce phénomène n’est pas complètement élucidé, il a été démontré que vers cultivées en liquide répondre au docteur (restriction alimentaire) d’une manière différente que vers cultivés sur des supports standard13,14. Il est donc plausible que les milieux liquides pourrait masquer certains DR mimétiques qui seraient autrement identifiés avec l’écran.
S’étant établi sur les conditions de culture agar, étaient considérés comme des options différentes pour la notation de la performance des puits dans ce test. Alors que divers essais de fonction automatisées ou d’imagerie sont disponibles, ils ont nécessité acquisition et le déploiement de techniquement difficiles périphériques, dont la plupart était prohibitivement cher. Tout en tenant compte de ces options, il est indispensable de se référer aux écrans précédents de durée de vie de tous les types. En fin de compte, cette étude a utilisé une méthode de notation adaptée de génome entier Arni écran du Siu Sylvia Lee laboratoire pendant la durée de vie des phénotypes15. Plus précisément, toutes les plaques de la durée de vie ont été créés de la même manière, mais seulement les témoins négatifs ont été surveillés. Une fois que les plaques de contrôle négatif ont été confirmés d’avoir près de mortalité complète, plaques d’essai ont été marqués à la main. Dans cet écran à grande échelle, points positifs ont été confirmés par re-tester des produits chimiques fraîchement préparés, à l’aide de trois exemplaires des primaires positifs répétées.
Protocole
1. préparation des tampons
-
Bouillon LB
- Utiliser des granulés prémélangés (voir Table des matières) et suivre le protocole du fabricant pour la préparation.
-
Croissance de nématode Media (NGM) Agar
- Mélanger 23 g d’agar, 3 g de NaCl, 2,5 g de bacto peptone et eau déionisée à 0.972 L. Autoclave et laissez refroidir à 60 ° C, puis ajouter 25 mL de tampon de phosphate (KPO4) potassium 1 M (pH 6.0), 1 mL de sulfate de magnésium de 1 M (MgSO4) , 1 mL de chlorure de calcium 1 M (CaCl2) et 1 mL de cholestérol 5 mg/mL (dans de l’éthanol).
-
Solution d’hypochlorite
- Mélangez 5 mL de 5 M KOH, 4 mL de solution d’hypochlorite de sodium (6 %) et désionisée H2O pour un volume total de 50 mL.
-
S basale
- Mélanger 5 g de NaCl, 1 g de K2HPO4, 6 g de KH2PO4et de l’eau déminéralisée pour 1 L, autoclave puis.
2. préparation du concentré d’e. coli (OP50)
Remarque : Cette étape concentre 1 L d’une solution saturée d’e. coli dans 25 mL de tampon basale S.
- Inoculer 5 mL du bouillon LB autoclavé (étape 1.1) avec une seule colonie d’Escherichia coli (Strain OP50) et incuber pendant 4 à 6 heures à 37 ° C sous agitation (250 tr/min). 0,1 mL de cette solution permet d’ensemencer 1 L de la LB dans une fiole d’Erlenmeyer de 2 L. Incuber les flacons 1 L du jour au lendemain (12-16 h) à 37 ° C sous agitation (250 tr/min).
- Centrifuger les cultures nuit 1 L en bouteilles de 500 mL Centrifuger pendant 5 min à 10 000 x g et 4 ° C à la bactérie de granule et décanter les médias restants loin. Resuspendre le culot dans 25 mL de S basale (étape 1.4). Conserver à 4 ° C.
3. préparation des plaques de Culture NGM
- Pour les plaques de culture de masse utilisées pour produire un grand nombre de vers, diluer 30 mL de gélose NGM fondu (60 ° C) (étape 1.2) dans une enceinte à flux laminaire sur des plaques de culture de 10 cm avec un appareil automatisé de distribution fluid ou une pipette sérologique. Laisser sécher pendant la nuit.
- Pipette de 2 mL de concentré OP50 sur chaque plaque de 10 cm, répartie pour couvrir complètement la surface de la gélose en inclinant et en tournant la plaque, puis autoriser plaques sécher. Stocker les plaques à 4 ° C pendant 2 semaines.
- Pour plaques de culture haut débit test utilisés pour le dépistage, utiliser un distributeur automatisé de 8 canaux pour distribuer 0,15 mL de gélose NGM fondu dans chaque puits d’une plaque 96 puits dans une enceinte à flux laminaire. Faire attention à faire sûr que puits sont dépourvues de bulles, ce qui permettra à terriers de vers qui vont compromettre le test dans ce puits. Laisser sécher pendant la nuit. Stocker les plaques à 4 ° C pendant 2 semaines.
4. préparation des Cultures massives de température sensible (ts) stériles C. Elegans
- Pour démarrer les cultures, à l’aide d’un « pick ver » (une pipette en verre avec un fil de platine ci-joint ou un ver manufacturé pick) sous un microscope à dissection, transférer 20 oeufs (souche TJ1060 : spe-9 (hc88) I ; rrf-3(b26)II) sur la culture de masse plaques préparées à l’étape 3.1. Puis, incuber les boîtes à 20 ° C pendant 6 jours (permet plusieurs générations de croissance, que vous ciblez pour la collecte de la progéniture des 20 oeufs déplacés).
- Confirmez visuellement la présence d’adultes gravides (œufs présents dans l’utérus) avec un microscope à dissection. Recueillir les adultes gravides en distribuant de 2-3 mL de S basal sur la plaque à l’aide d’une pipette de verre. Agiter le liquide autour de la plaque à la main, puis recueillir le liquide dans un tube de 15 mL à l’aide d’une pipette de verre.
- Tournez en bas du tube (1 000 x g pendant 1,5 min à 20 ° C) à worms de granule, puis aspirer hors surnageant. Ajouter 10 mL de solution d’hypochlorite (étape 1.3) au culot ver et rapidement agiter le tube à la main en direction de haut en bas pendant 5 s. Incuber pendant 5 min, secouant toutes les 2,5 minutes.
- Tournez encore une fois, en bas du tube (1 000 x g pendant 1,5 min) ; le culot doit être brun-jaunâtre. Aspirer hors le surnageant. Ajouter 10 mL de solution d’hypochlorite à la pastille de le œuf et agiter vigoureusement le tube. Incuber 1-3 min, avec agitation occasionnels et tout en surveillant l’apparition avec le microscope à dissection. Confirmez visuellement sont encore que des œufs et passez à l’étape suivante.
- Tournez en bas du tube (1 000 x g pendant 1,5 min) et aspirer hors le surnageant. Le culot doit être blanc avec aucune coloration brune.
Remarque : Après le retrait de la solution d’hypochlorite, il est essentiel d’utiliser les techniques stériles et tampons, depuis la contamination (bactériennes et fongiques, en particulier) peut ruiner l’expérience, perdre un temps précieux et réactifs. Cette étude utilise une enceinte à flux laminaire filtré et déplacé liquides en utilisant uniquement des pipettes stériles et des conseils. - Ouvrir les tubes dans un espace stérile. Laver le culot 3 fois avec S basale, filer vers le bas (1 000 x g pendant 1,5 min) et en aspirant loin le surnageant de chaque fois. Resuspendre le culot de œufs dans 2-3 mL S basale. Ces œufs peuvent maintenant servir pour une trappe d’une nuit ou plus dans un tampon à recueillir larve L1 (étape 5).
5. C. Elegans d’oeufs à couver dans un tampon pour obtenir des Cultures synchrones (préparation des larves L1 C. Elegans )
- Décanter le culot d’oeuf et tampon dans Pétri stériles de verre avec un couvercle. Rincer les œufs restants du tube dans un plat à l’aide d’une pipette sérologique avec 2-3 mL de S basale. Ajouter 5 mL de S basale pour soulager le surpeuplement, car cela peut encourager l’éclosion, comme s’allumera secouant (20 tr/min avec un agitateur orbital de danseuse du ventre). Incuber pendant la nuit à 20 ° C, pour permettre aux œufs jusqu'à l’éclosion (16-24h). Tous les nouveau-nés seront arrêter à la 1ère allure larvaire (L1) en raison de l’absence de nourriture.
Remarque : Des preuves anecdotiques indiquent que des préparations fraîches de L1 (16-36 h après la collecte des œufs) génèrent les populations plus synchrones vers adultes. - L1s s’accumuler dans un tube de 15 mL avec une pipette sérologique. Tournez en bas L1s dans une centrifugeuse (1 000 x g pendant 1,5 min), aspirer loin le surnageant et répétez jusqu'à ce que tous L1s ont été recueillies de l’éclosion des plaques, tout en laissant 10 mL de S basale pour la prochaine étape.
- Dans le tube contenant L1s, micropipette 0,01 mL (immédiatement après le mélange) et dispensent sur un non ensemencées (aucun e. coli) plaque NGM. Compter le nombre de L1s sur la plaque. Répéter 10 fois et obtenir une moyenne pour le nombre de L1s dans chaque aliquote. En général, attendre entre 1-3 L1s par µL (lors du démarrage avec 1 plaque de culture de masse contenant 20 oeufs).
- Déterminer avec une pipette sérologique, le volume de S tenant le L1s basale. Ensuite extrapoler le nombre de vers par 0,01 mL, obtenu à l’étape précédente, afin d’estimer le nombre total de L1s moyen déterminé. En général, attendre entre 10 000-30 000 L1s (par la culture de masse plaque contenant 20 oeufs).
- Pour utiliser cette culture à 96 puits assay, diluer la suspension de L1 à 1 L1 par µL dans un flacon stérile médias rond, puis passez à l’étape 7. Si cette culture doit être utilisé pour générer des elegans de Caenorhabditis cultures de masse, puis passez à l’étape 6.
6. grande échelle Culture synchrone préparation
Remarque : Les solutions de L1 peuvent être utilisées pour augmenter rapidement les populations de ver.
- Pour générer des nombres de gros ver avec une solution de L1, diluer jusqu'à 5 000 L1s sur le nombre désiré de plaques de culture de masse. Recueillir les adultes gravides 2,5 jours plus tard (20 ° C) comme indiqué aux paragraphes 4.1-2 et passez à l’étape 4.3 pour recueillir les oeufs.
- Comme il a été observé pour l’anecdote que répétée d’hypochlorite collection peut souligner la population subjuguée, diviser les populations de cueillette d’oeufs de multiplication avant de soumettre le reste de la population aux traitements de l’hypochlorite, alors cette multiples générations de la population ne subissent pas à plusieurs reprises de traitement mise en solution d’hypochlorite.
7. installation des plaques de 96 puits Assay
- Laisser les plaques de dosage (préparés à l’étape 3.3) à température ambiante. Puis, dans un flux laminaire, ajouter 5 µL de concentré OP50 (préparé à l’étape 2.2) dans chaque puits. Comme avant, utilisez un distributeur automatisé de 8 canaux.
- Ajouter 10 µL de suspension L1 dans chaque puits à l’aide d’un distributeur de 8 canaux automatisés. Cela permet d’obtenir sur les vers de moyenne 10 / puits, puisqu’ils sont présents dans la suspension à 1 L1 par µL. Afin de promouvoir une répartition égale des L1s de la boue, distribuer L1s provenant d’une bouteille ronde médias activement mélangée avec un tournant modérément lentement barre de remuer.
- Plaque de recouvrement avec couvercle, lots de boîte de plaques et incuber à 25 ° C pendant 2 jours.
8. 1 st journée adulte c. elegans , avec des produits chimiques de traitement
- Enlever les plaques de la bibliothèque chimique du congélateur et laisser les plaques à température ambiante avant de procéder.
NOTE : Les plaques de bibliothèque chimique tel que décrit ici sont 96 plaques puits contenant des composés distincts dans chaque puits, qui sont à la même concentration et dissous dans le DMSO. Ces bibliothèques n’utilisent pas les colonnes extérieures, et donc chaque plaque a un maximum de 80 chimiques distinctes. Dans le protocole décrit ici, la concentration de la bibliothèque est 10 mM. Il est important de tenir compte des effets de solvant sur les phénotypes. Tandis que les écrans de cette étude à une concentration de DMSO de 0,5 %, ce niveau n’a été jamais dépassé ces essais de durée de vie et dans des essais de débit faible, où il est plus susceptible de choisir une concentration du composé en solution stock. Ce protocole ne dépasse pas 0,25 %, ce qui est un niveau auquel modifications de durée de vie ne produisent pas16, au moins chez la souche N2. - Secouer doucement plaque à 60 tr/min sur un agitateur de microplaque pendant 1 min immédiatement avant leur utilisation.
- En utilisant un automatisé 96 puits liquide gestionnaire, transfert 0,75 µL du composé (ou le DMSO) de la plaque de la bibliothèque à la plaque de test. La profondeur de la pipette lors de l’accouchement liquide sur la plaque de test est contrôlée avec soin, tels que les pointes de pipette du gestionnaire liquid livrez le volume 0,75 µL dans le µL de ~ 15 du liquide sur la surface de la gélose (avec vers et concentré OP50 étapes 7.1 -2) et ne pas piquer la surface de la gélose dans le puits. Ne pas utiliser des pipettes multicanaux manuel 8 ou 12 sauf dans très petits écrans (< 10 plaques), car ils peuvent augmenter erreur et souvent le résultat dans la perforation de la surface de la gélose, qui compromet le dosage.
- Préparez les plaques de contrôle négatif bibliothèque chimique avec le DMSO (diméthyl sulfoxyde), en supposant que la bibliothèque testée utilise DMSO comme solvant. Faire 1 plaque de contrôle négatif pour tous les 5 plaques, jusqu'à 10 plaques de contrôle négatif d’essai. Si possible, aussi faire une plaque de contrôle positif (NP11 à 20 mM, pour une concentration finale de dosage de 0,1 mM, est efficace à cet effet ; Voir la section représentant résultats). Ne pas ajouter de produits chimiques (test ou contrôle) pour les 2 colonnes extérieures des plaques, car ils sont particulièrement sensibles à la dessiccation.
9. Cultures de séchage
- Pour évacuer le liquide de la surface de la gélose, sécher les plaques dans le flux laminaire pendant 4 à 8 heures. Il est essentiel que ces plaques sont complètement sèches, mais pas devenir desséchées. Comme quelques plaques prendra plus de temps à sécher que d’autres, suivre de près toutes les plaques et retirer dès qu’ils sont secs. Confirmer le séchage par une inspection visuelle attentive des puits individuels de la plaque.
Remarque : En fonction de facteurs, dont le taux de gaz d’échappement de l’armoire, le temps que cela prend doit être empiriquement déterminé. Cette étape de séchage peut prendre environ 4 à 8 heures pour une armoire complète. - Sceller les plaques avec un film transparent, puis mettre sur les couvercles de la plaque.
- Faites tourner les plaques 96 puits assay pour 45 s à 1 000 x g.
- Plaques de magasin inversés à 25 ° C.
10. notation des Cultures de C. Elegans pour la longévité
- Surveiller les plaques de contrôle négatif jusqu'à > 95 % de mortalité est observé. Vérifier les plaques par semaine pour les deux premières semaines et tous les jours par la suite. Caenorhabditis cohortes de la même souche et espèces peuvent afficher significativement différentes durées de vie en première instance17.
Remarque : Pour la détermination de la durée de vie décrite ici, avec des animaux TJ1060 cultivées à 25 ° C, 95 % de mortalité chez ces populations s’est produite entre adulte jour 16-20. - Quand les puits de contrôle négatif considérés ont atteint le > 95 % marque, tournez en bas toutes les plaques de 96 puits assay pour 45 s sur une centrifugeuse de dessus de table avec une microplaque adapté du rotor (250 x g pendant 45 s à 20 ° C).
- Marquer tous les puits dans les plaques de contrôle. Cela se fait en comptant et en enregistrant le nombre d’animaux vivants et morts dans chaque puits. Vers morts peuvent être différenciés vers vivants par leur absence totale de mouvement. Provoquer des mouvement à worms vivants en laissant tomber la plaque 96 puits d’environ 7 cm sur la surface du microscope dissection en regardant dans l’oculaire pour toute réponse évoquée. Vers morts ne répondra pas, et à proximité des compagnons de laboratoire ne peuvent pas apprécier le bruit répétitif.
- Pour les plaques d’essai, compter et enregistrer seulement les puits contenant vers vivants. Quand on observe un ver vivant, compter tous les animaux vivants et morts dans ce puits, ainsi que la position de bien et de la plaque.
Remarque : Il est souvent utile de re-marquer les plaques après > 99 % du témoin négatif vers sont morts. Dans les écrans de grande échelle, c’est peut-être le meilleur point de faire le score initial. Dans les deux cas, score/re-score comme décrit ci-dessus
11. effectuer un nouveau test composés
- Lors de l’essai seulement un petit nombre de composés candidats (< 320 composés), comme avec un nouveau test ou un écran de candidat (voir résultats représentatifs), restreindre l’analyse aux 32 puits centrales afin de minimiser les effets possibles de plaque. Cela laisse les 2 puits plus proche du bord de la plaque non traitées mais encore contenant agar, nourriture et les vers.
Résultats
Nous commençons par examiner les résultats représentatifs d’employer ce protocole pour les essais de durée de vie de 96 puits. Dans le premier exemple, la méthode a été utilisée à l’écran avec succès par le biais de 30 000 produits chimiques à identifier les substances chimiques qui prolongent la durée de vie de c. elegans et inclut également les résultats de l’écran suivi de re-tester du plus performant des produits chimiques à l’aide de la même protocole. Ces résultats ont été décrites précédemment1. Le deuxième exemple utilise le même protocole dans un écran de plus petite échelle des composés candidats.
Écran à grande échelle et re-tester : L’écran à grande échelle 30 000 composés de tests a été réalisée à une seule dose, en double exemplaire. Donc, chaque produit chimique a été testé dans deux puits avec une population animale totale prévue de 20. Pour ce faire, trois ensembles distincts de 10 000 composés (en double) ont été projetés sur une période d’environ 3 mois pour couvrir 30 000 composés ensemble. Cela a été fait en partie, afin d’assurer une quantité gérable de pointage manuel à la fin de l’essai et requis un total de 260 des plaques 96 puits assay dans chacune des séries. En plaques stock bibliothèque, seulement 80 puits contenaient composé ; une réplique de 10 000 composés fait 125 plaques de dosage. Cette étude a utilisé 2 répétitions avec 10 plaques de contrôle négatif dans chaque ensemble. Pour augmenter le débit, les plaques ont été marqués lorsque les populations de contrôle négatif ont été évaluées d’avoir vécu ~ 99 % de mortalité. Test tous les puits ont été ensuite examinés pour vers vivants.
Produits chimiques dans les puits avec un ver vivant s’appelaient hits. Produits chimiques dans les puits contenant plus de 1 ver vivant ont été également appelés hits et en outre tous les vers dans les puits (vivants ou morts) ont été comptés pour générer une simple partition (partition vivante pour cent ; le nombre de vers vivants divisé par le nombre de vers morts). Chaque produit chimique dans la bibliothèque pourrait donc être appelé un coup deux fois, et ces visites pourraient, mais peut-être pas, ont obtenu des résultats qui leur sont associés. 512 chimiques distinctes ont été appelés hits (au moins une fois) de l’écran de 30 000 composés. L’écran a été réalisée dans le but de déterminer les effets Pro-longévités (reproductibles) puissants et robustes. Ces deux propriétés différentes peuvent avoir des effets distincts. Substances chimiques pourraient augmenter considérablement la durée de vie, auquel cas nous nous attendrions à un pourcentage élevé de worms d’être en vie dans les puits de la substance. Pour les produits chimiques solides, les deux réplicats devrait avoir direct vers. La liste est classée selon ces critères. 179 des produits chimiques ont donné des scores élevés de pourcentage vivants, ou ont été touchés dans les deux réplicats et furent donc choisis pour effectuer un nouveau test. La plupart des produits chimiques restants qui ont été appelés hits, mais pas sélectionnés pour effectuer un nouveau test, contenait uniquement un seul ver vivant dans un puits répétées.
Re-tester des hits a été effectué, semblable à l’écran principal, sauf 3 répétitions (population animale totale prévue de 30), et leur dosage prudent de la durée de vie des animaux dans les plaques de témoins non traités. Ces modifications ont été ajoutées pour aider à comparer les puits de test et de contrôle. 179 des hits chimiques ont été réorganisées, dilué à 10 mM et emménagé dans 96 plaques bien. Seulement l’intérieurs 24 puits ont été utilisées pour le dosage de re-tester (les versions actuelles de ce protocole auraient utilisé les 32 puits internes tel que décrit dans la section protocole pour re-tester des écrans) et les composés ont été testés de nouveau en trois exemplaires, avec six planches de test de contrôle négatif traité avec le solvant de DMSO. Une plaque de contrôle négatif a été cotée périodiquement pour la survie totale (Figure 1A). Lorsque environ 95 % des animaux témoins étaient morts, toutes les plaques ont été complètement évalués (tous traités en direct et de vers morts ont été dénombrés).
Pour appeler hits à partir des résultats de re-tester, une coupure a été faite à la note moyenne de vivante pour cent des contrôle négatif + 2 écarts-types (SD). Pour les puits de test, en moyenne pour cent vivant (au moment de la notation) a été calculé en faisant la moyenne le pourcentage score vivant de trois répétitions pour chaque puits. Pour ce test particulier, moyen pourcentage vivant a des puits de contrôle négatif été calculé comme la moyenne des trois répétitions pour 48 puits (2 jeux de plaques de contrôle négatif en triple). La carte SD permet d’appeler des hits de l’ensemble chimique contre-essai était que le SD à travers le contrôle négatif 48 en moyenne pourcentage scores vivants. En utilisant cette stratégie, nous avons constaté 57 hits de la bibliothèque de re-tester de 179 composés, démontrant qu’un total de 32 % des produits chimiques contre-essai testé positif (Figure 1B). Binning des scores vivants pour cent en moyenne pour les puits de contrôle et d’essai négatifs indique que les puits d’essai a dépassé les puits témoins (Figure 1C).
Écran candidat : Écrans à petite échelle peuvent être effectuées d’une manière similaire à l’épreuve répétée décrite ci-dessus. Nous décrivons ici les résultats d’un écran de candidat avec 139 composés. Ces candidats ont été assemblés en structures susceptibles de promouvoir la longévité. Pour cet écran, nous avons réalisé 5 répétitions des plaques d’essai à deux doses différentes (50 µM et 100 µM). En outre, nous avons utilisé 8 plaques de contrôle négatif, avec une plaque unique témoin positif (NP1) contenant deux doses différentes ; 50 µM et 100 µM.
Plaques de contrôle négatif ont été suivis jusqu'à ce qu’environ 90 % des animaux étaient morts. A cette époque, puits ont été marqués en comptant les vers vivants et morts dans tous les puits de contrôle et de puits d’essai contenant vers vivants. Le pour cent vivant au moment de la notation ont servi à calculer la moyenne des scores vivants pour cent pour chaque puits. Pour les témoins négatifs, 32 puits avaient pourcentage vivants scores de 8 répétitions. Pour les contrôles positifs, il y avait 4 scores bien moyennées sur 4 répétitions pour chaque dose. Visites ont été appelés pour les puits avec un score de vivant pour cent en moyenne supérieure à la moyenne pour cent de contrôle négatif vivant score + 2 SD Ce seuil de décision 14 hits à gauche de l’écran de candidat et exclue tous les puits de contrôle négatif. Cette coupure a également inclus tous du contrôle positif puits traités à 100 µM et 50 % des contrôles positifs traitement à 50 µM. Ces résultats sont présentés ici en tant que mis en cellule en moyenne des scores vivants pour cent pour les 50 µM (Figure 2A) et les écrans d’essai 100 µM (Figure 2B).
Enfin, toutes les plaques sont ré-a marqué à un moment tardif, ce qui correspondait à un moment lorsque plus de 99 % du témoin négatif traités les animaux était morts. Ces résultats indiquent que les puits de contrôle positif loin surpassé les puits de contrôle et de test négatifs (Figure 2C). Alors que les puits d’essai étaient légèrement mieux que les témoins négatifs. Ce dernier résultat est biaisé par l’indication que bon nombre des puits test semblent pièce toxicité relative au traitement de la commande (tableau 1), confondant ainsi cette interprétation simple. Il fallait s’y attendre, étant donné que la bibliothèque du candidat était un vrai écran de produits chimiques ayant une activité biologique inconnue chez c. elegans, tandis que l’écran de re-tester était essentiellement présélectionné pour les composés qui n’étaient pas toxiques. Cet écran primaire étant pour les composés qui a allongé la durée de vie, sensiblement des produits chimiques toxiques ne devraient pas ont été dans le re-tester fixés.
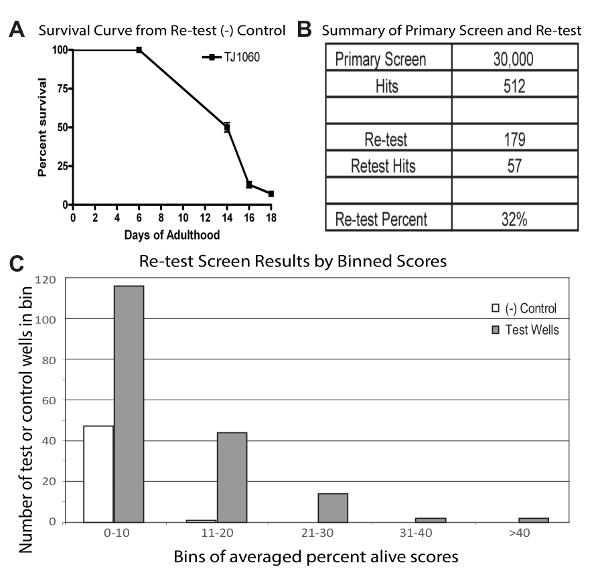
Figure 1 : Représentant résulte d’une haute écran de débit et de re-tester
Courbe de survie (A) d’une plaque de contrôle négatif représentatif utilisée dans l’essai de re-tester. Cette courbe a été construite de marquer tous les vers vivants et morts dans les 24 puits utilisés dans cet essai 4 fois pendant les 18 jours de l’essai. Au 18e jour de l’âge adulte, les contrôles ont été évalués pour avoir environ 5 % de survie et tous les test de contrôle et les plaques ont été ensuite également marqués. (B) tableau résumant les résultats de l’écran et effectuer d’autres essais. (C) Binning des scores vivant pour cent puits en moyenne pour les conditions de contrôle et d’essai depuis l’écran d’effectuer d’autres essais. Pour les contrôles, scores sont de 48 puits chacun composé de la moyenne des 3 répétitions. Résultats des tests sont de 179 puits chacune consistant en la note moyenne variant de trois répétitions. Figure 1 est tiré d’une publication précédente1. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
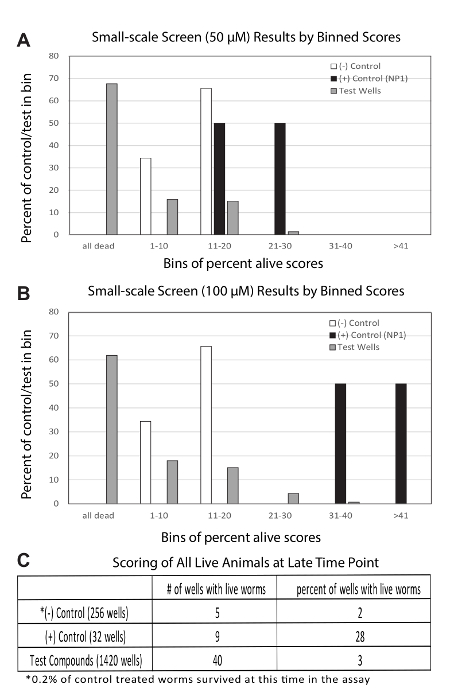
Figure 2 : Représentant résulte d’un écran de candidat
Binning (A) des résultats de l’écran de candidat de 50 µM. Les résultats de test de puits 139 représentent le score vivant pour cent en moyenne de 5 répétitions. Les résultats du contrôle négatif 32 se composent des scores de vivants pour cent en moyenne de 8 répétitions. Les résultats du contrôle positif 4 se composent des scores de vivants pour cent en moyenne de 4 répétitions (total 16 puits contenant NP1 à 50 µM). Binning (B) des résultats sur l’écran du candidat 100 µM. Tout est identique (A), sauf que les puits d’essai et les contrôles positifs ont été traités à des 100 concentrations µM. Les mêmes panneaux de contrôle négatif sont indiqués dans les deux (A et B). (C) représentant les résultats de re-marquer les plaques à un moment fin relativement extrême. Contrôles positifs considérablement a surpassé tous les autres, si juste représente le pourcentage de puits avec vers vivants à ce moment, qui est un parti pris contre puits d’essai tel que décrit dans le texte principal et le tableau 1. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Binning de Scores vivants pour cent en moyenne | ||||||
| Notes groupées | Tous les morts (0) | 1-10 | 11-20 | 21-30 | 31-40 | > 41 |
| Re-tester | ||||||
| Nbre de (-) contrôle | 16 | 31 | 1 | 0 | 0 | 0 |
| nombre de puits d’essai (50µM) | 46 | 69 | 50 | 8 | 3 | 3 |
| Écran de candidat | ||||||
| Nbre de (-) contrôle | 0 | 11 | 21 | 0 | 0 | 0 |
| # du (+) contrôler (50µM) | 0 | 0 | 2 | 2 | 0 | 0 |
| # du (+) contrôler (100µM) | 0 | 0 | 0 | 0 | 2 | 2 |
| nombre de puits d’essai (50µM) | 94 | 22 | 21 | 2 | 0 | 0 |
| nombre de puits d’essai (100 µm) | 86 | 25 | 21 | 6 | 1 | 0 |
Tableau 1 : Représentant résulte de binning différents écrans
Nous présentons ici la sélection des scores vivants pour cent en moyenne à partir des deux écrans (re-tester et candidat). Dans l’écran nouveau test, le pic est semblable au contrôle négatif avec les nouveaux tests surperformant le contrôle négatif nettement sur la droite (longue durée) côté de la table. Cela indique la présence de plusieurs Pro-longévités composés présents dans le jeu de re-tester. Dans l’écran de candidat, nous voyons que le pic est dans la catégorie des morts tous, alors qu’il y a également un signal évident du côté droit du tableau. Cela indique la présence de composés de Pro-longévités dans l’ensemble des candidats, mais indique aussi la présence d’une toxicité importante parmi l’ensemble des candidats de composés.
Discussion
Ici, nous avons décrit une méthode simple pour la culture des c. elegans en plaques 96 puits. Nous décrivons ces cultures pour une utilisation en dépistage chimique et des essais de durée de vie, mais ils peuvent être utilisés pour plusieurs types d’analyses. Alors que les conditions de culture multipuits pour projection chimique ont été précédemment rapporté8, y compris pour l' analyse de la durée de vie10à l’essai décrit ici diffère de plusieurs façons. Le test de durée de vie décrit ici utilise des plaques à 96 puits, s’appuie sur des mutants stériles (au lieu de stérilisation chimique), utilise des conditions de culture agar, utilise le liquide simple manipulation pour déplacer vers et est écrite manuellement au point de terminaison. Les différentes approches utilisées dans ce test peuvent être utile aux chercheurs à la recherche de méthodes qui comprennent ces conditions de dépistage.
Éléments cruciaux au présent Protocole se centrer principalement sur la qualité des plaques produites pour le dosage. Tout d’abord, en faisant des plaques, il est impératif que la surface de la gélose est exempte de bulles et autres imperfections. Ces variations dans la surface de la gélose mènent presque toujours à s’enfouir et perte du puits. Deuxièmement, ce protocole repose sur le séchage liquides déposés durant les étapes d’installation et de droguer. Il est essentiel que ces liquides sont complètement supprimés, mais l’agar ne pas devenir desséchée. Pour l’anecdote, il semble que les vers dans les puits qui ne sont pas complètement secs (natation dans un liquide) vivent plus longtemps que les puits correctement séchées, tandis que trop de séchage des plaques mène à la dessiccation et la fissuration de l’agar, ce qui conduit à s’enfouir et perte de ver. Un autre élément essentiel du présent protocole est de maintenir des conditions stériles. Comme avec n’importe quel test de durée de vie, il y a beaucoup de travail impliqué dans le programme d’installation de la plaque, et beaucoup de possibilités et de temps existent pour l’analyse de ruiner la contamination pour s’installer et se développer sur les plaques.
Alors que le test de durée de vie décrit ici est utile pour dépister des composés chez c. elegans, elle est limitée à des antécédents génétiques particulières, qu’elle repose sur une souche stérile de température sensible (ts) ; Nous avons utilisé TJ1060, qui a une pénétrance élevée de stérilité. Ceci limite les souches disponibles pour le dépistage avec cette méthode. D’autres approches y compris traversant ts mutations stériles dans l’arrière-plan souhaité ou à l’aide de stérilisation chimique. Nous n’avons pas essayé la stérilisation chimique avec ce dosage, mais il devrait être possible. Obstacles potentiels incluent placer le stérilisateur sur les vers à l’étape correcte et la bonne dose. Le protocole décrit ici utilise un distributeur de liquide qui est rapide, mais ne semble pas distribuer efficacement les adultes. Ainsi, ces vers se développent sur les plaques et doivent donc être traités avec la stérilisation chimique sur les plaques. Déterminer la dose optimale et le calendrier serait importants pour le succès. Stratégies alternatives incluent en utilisant une méthode de distribution qui peut déplacer des adultes. Dans le passé, nous avons constaté que les machines capables d’identifier et de trier les adultes sont généralement beaucoup plus lents que les gestionnaires liquides simples, qui peuvent se passer d’un coulis homogène de larve suspendu.
En général, nous utilisons cette méthode rapide produits chimiques et des traitements pour grands effets positifs sur la durée de vie. La méthode est particulièrement efficace lorsqu’il est utilisé à doses multiples, haute numéros de reproduire et suivi des contrôles négatifs qui sont toujours maintenues et intercalées entre les plaques d’essai à proximité. Les témoins positifs sont également utiles pour concevoir et mettre en œuvre les écrans décrits dans ce manuscrit. Toutefois, pour être un positif efficace, le contrôle devra être assez puissant et très robuste. Lorsque l’écran a été déployé à l’origine, un composé suffisamment puissant et robuste n’a pas pu être identifié. Actuellement, il existe plusieurs rapports dans la littérature de « vieillissement » des candidats probables pour des contrôles positifs utiles dans les écrans décrits ici. Comme décrit dans la section candidat de l’écran de la section des résultats escomptés de ce manuscrit et dans la Figure 2 et tableau 1, le composé NP1 est un contrôle efficace et positif pour cet écran. Nous confirmons généralement positives hits de ces écrans avec durée de vie standard des essais sur des plaques de culture de 3 mm.
Déclarations de divulgation
Les auteurs déclarent qu’aucune entité de financement soutenant ce travail n’avait n’importe quelle entrée sur la collecte de données, analyse des résultats ou la décision de publier.
Remerciements
Nous remercions Dipa Bhaumik, Aaron Miller et Bob Hughes pour l’assistance technique. Les souches ont été fournis par la CCG, qui est financée par le NIH Bureau des programmes d’Infrastructure de recherche (P40 OD010440). Nous sommes reconnaissants envers la Géorgie Woods et membres de Lithgow, Kapahi et Melov Labs pour des discussions fructueuses. M.L. a été pris en charge par les National Institutes of Health (NIH) formation Grant T32 AG000266 et une Ellison Medical Foundation/American Federation de vieillissement recherche Post-Doctoral Fellowship. Ce travail a été soutenu par une subvention de BioAge Labs, une subvention de Larry L. Hillblom Foundation, mais aussi des National Institutes of Health des subventions UL1024917, soutenir le Consortium de recherche interdisciplinaire sur élaboré et 1R01AG029631-01 a 1 à G.J.L.
matériels
| Name | Company | Catalog Number | Comments |
| LB Broth Miller Granules | VWR | ||
| Unispense | Wheaton Science Products | automated fluid dispensing apparatus | |
| 96 well assay plate; COSTAR 3370 | Corning | ||
| Multidrop 384; automated 8 channel dispenser | Thermo Fisher Scientific | ||
| manufactored worm pick | Genesee Scientific | ||
| Belly Dancer Orbital Shaker | Stovall Life Science inc. | ||
| microplate shaker; MTS 2/4 Digital | IKA Works, inc. | ||
| automated 96-well liquid handler; Biomek FX Liquid Handler | Beckman Coulter | ||
| automated 96-well liquid handler; Bench Top Pipettor | Sorenson Bioscience, inc. | ||
| manual 8 or 12 multi-channel pipettes | we use rainin… | ||
| transparent 96 well film cover; TempPlate RT Optical Film | USA Scientific | ||
| table top centrifuge; Centrifuge 5810 R | Eppendorf |
Références
- Lucanic, M., et al. Chemical activation of a food deprivation signal extends lifespan. Aging Cell. , (2016).
- Evason, K., Huang, C., Yamben, I., Covey, D. F., Kornfeld, K. Anticonvulsant medications extend worm life-span. Science. 307 (5707), 258-262 (2005).
- Melov, S., et al. Extension of life-span with superoxide dismutase/catalase mimetics. Science. 289 (5484), 1567-1569 (2000).
- Benedetti, M. G., et al. Compounds that confer thermal stress resistance and extended lifespan. Exp Gerontol. 43 (10), 882-891 (2008).
- Hansen, M., Hsu, A. L., Dillin, A., Kenyon, C. New Genes Tied to Endocrine, Metabolic, and Dietary Regulation of Lifespan from a Caenorhabditis elegans Genomic RNAi Screen. PLoS Genet. 1 (1), 17 (2005).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nat Genet. 33 (1), 40-48 (2003).
- Samuelson, A. V., Carr, C. E., Ruvkun, G. Gene activities that mediate increased life span of C. elegans insulin-like signaling mutants. Genes Dev. 21 (22), 2976-2994 (2007).
- Kwok, T. C., et al. A small-molecule screen in C. elegans yields a new calcium channel antagonist. Nature. 441 (7089), 91-95 (2006).
- Petrascheck, M., Ye, X., Buck, L. B. A high-throughput screen for chemicals that increase the lifespan of Caenorhabditis elegans. Ann N Y Acad Sci. 1170, 698-701 (2009).
- Solis, G. M., Petrascheck, M. Measuring Caenorhabditis elegans life span in 96 well microtiter plates. J Vis Exp. (49), (2011).
- Angeli, S., et al. A DNA synthesis inhibitor is protective against proteotoxic stressors via modulation of fertility pathways in Caenorhabditis elegans. Aging (Albany NY). 5 (10), 759-769 (2013).
- Fabian, T. J., Johnson, T. E. Production of age-synchronous mass cultures of Caenorhabditis elegans. J Gerontol. 49 (4), 145-156 (1994).
- Greer, E. L., Brunet, A. Different dietary restriction regimens extend lifespan by both independent and overlapping genetic pathways in C. elegans. Aging Cell. 8 (2), 113-127 (2009).
- Mair, W., Panowski, S. H., Shaw, R. J., Dillin, A. Optimizing dietary restriction for genetic epistasis analysis and gene discovery in C. elegans. PLoS One. 4 (2), 4535 (2009).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes Dev. 19 (13), 1544-1555 (2005).
- Frankowski, H., et al. Dimethyl sulfoxide and dimethyl formamide increase lifespan of C. elegans in liquid. Mech Ageing Dev. 134 (3-4), 69-78 (2013).
- Lucanic, M., et al. Impact of genetic background and experimental reproducibility on identifying chemical compounds with robust longevity effects. Nat Commun. 8, 14256 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon