Method Article
Un metodo semplice per High Throughput Screening chimico in Caenorhabditis Elegans
In questo articolo
Riepilogo
Qui descriviamo un protocollo semplice per produrre rapidamente centinaia di agar media di crescita del nematode, piastre di coltura 96 pozzetti con un numero consistente di Caenorhhabditis elegans per pozzetto. Queste culture sono utili per lo screening fenotipico di interi organismi. Qui ci concentriamo sull'utilizzo di queste culture ai prodotti chimici schermo per effetti di pro-longevità.
Abstract
Caenorhabditis elegans è un organismo utile per testare gli effetti chimici sulla fisiologia. Tutto l'organismo piccola molecola schermi offrono vantaggi significativi per l'identificazione di strutture chimiche biologicamente attive che possono modificare i fenotipi complessi come la durata della vita. Descritto qui è un semplice protocollo per la produzione di centinaia di piatti di coltura 96 pozzetti con un numero abbastanza consistente di c. elegans in ciascun pozzetto. Successivamente, abbiamo specificato come utilizzare queste culture allo schermo migliaia di sostanze chimiche per gli effetti sulla durata del nematode c. elegans. Questo protocollo si avvale di ceppi sterili sensibili di temperatura, condizioni di piastra di agar e animale di semplice gestione per facilitare la produzione rapida e di alta velocità effettiva delle culture sincronizzate animale per lo screening.
Introduzione
Qui un protocollo è descritto che è stato sviluppato per screening su vasta scala di composti chimici per gli effetti sulla durata della vita di Caenorhabditis elegans . Il protocollo stesso è facilmente adattabile agli altri schermi fenotipici, compresi gli studi utilizzando ceppi di c. elegans di reporter. Questo protocollo è stato utilizzato con successo per identificare un romanzo composto biologicamente attivo, NP1 (nitrofenil-piperazina 1), che fortemente si estende la durata della vita di c. elegans attraverso un meccanismo di restrizione dietetica. NP1 e una caratterizzazione del suo effetto sulla durata della vita, compresa una descrizione delle vie genetiche in gioco, è stato precedentemente descritto altrove1. Tale relazione include anche una descrizione dei risultati da un'implementazione su larga scala dello schermo. Qui descriviamo molto più dettagliatamente la metodologia e il programma di installazione dello schermo stesso, che è scalabile per applicazioni piccole e grandi dimensioni.
L'obiettivo che ha portato alla creazione del protocollo descritto qui era di sviluppare una piattaforma di cultura di c. elegans che ha permesso per la selezione veloce di grandi librerie chimiche per nuovi composti biologicamente attivi. Mentre gli schermi chimici sono stati eseguiti prima dello sviluppo del presente protocollo, questi erano principalmente su piccola scala e/o tipo di candidato si avvicina2,3. Infatti, la maggior parte degli schermi eseguite in laboratorio su decine di composti utilizzati saggi di resistenza di sforzo, con colpi essere proiettati per longevità effetti4. Questo studio ha cercato invece di direttamente per effetti di durata della vita dello schermo. Notevolmente, c'erano poche descrizioni nella letteratura scientifica al momento dell'esecuzione di schermi chimico su larga scala con c. elegans. Infatti, rispetto ad altri tipi di schermi5,6,7, schermatura chimica su larga scala utilizzando c. elegans sembrava essere sotto-occupati.
C'erano due descrizioni di schermi chimico su larga scala in c. elegans che sono stati utilizzati come base per sviluppare questo approccio. Il primo di questi era un elegante studio da laboratorio di Peter Roy utilizzando schermi chimici per identificare i composti che potrebbero perturbare lo sviluppo degli animali. Lo studio poi seguiti con uno schermo di mutagenesi avanti identificare i bersagli genetici di questi prodotti chimici8. Il protocollo descritto in quello studio usato 24 pozzetti pates, che era semplicemente inattuabile per esigenze specifiche di questo studio (limitate quantità di prodotto chimico nella biblioteca e lo spazio limitato disponibile incubatrice). L'altro studio era innovativa e ambiziosa della piccolo-molecola a schermo di Michael Petrascheck per durata della vita estendendo prodotti chimici9,10. Tale studio ha utilizzato piastre da 384 pozzetti e colture liquide. L'altra caratteristica principale di questo schermo è stato l'uso di FUDR (5-fluorodeossiuridina) chimicamente inibizione della produzione di progenie. Dopo una notevole considerazione del protocollo descritto in quello studio, sterilizzazione chimica sia colture liquide di c. elegans sono stati evitati.
Sebbene FUDR è ampiamente usato negli esperimenti di durata della vita di c. elegans , c'erano preoccupazioni che FUDR potrebbe causare interazioni farmacologiche imprevisti, o che FUDR stesso può avere qualche effetto sulla durata della vita. Recentemente questa preoccupazione di quest'ultima è stata convalidata, almeno in alcune concentrazioni e in particolare a 25 ° C11. Per aggirare il problema della contaminazione di progenie, ceppo di c. elegans TJ1060 è stato usato, che ospita due mutazioni sensibili di temperatura indipendente (spe-9 (hc88) I; rrf-3(b26)II) che abolire la produzione di spermatozoi e sono stati dimostrati per essere utile per le culture di massa di popolazioni sincrono12. Questo ceppo era completamente sterile a 25 ° C, ma produrrà progenie quando coltivate a 15-20 ° C. Questo studio ha usato condizioni di coltura convenzionale, con i vermi strisciando sulla superficie dell'agar, come i risultati ottenuti con colture liquide non sono sempre riproducibili con piastre di agar convenzionali. Mentre questo fenomeno completamente non è capito, è stato dimostrato che vermi coltivate nel liquido rispondere alla DR (restrizione dietetica) in maniera diversa rispetto vermi coltivate su supporti standard13,14. È pertanto plausibile che mezzi liquidi potrebbero mascherare alcuni mimetics DR che altrimenti sarebbe stato identificato con lo schermo.
Dopo aver depositato su condizioni di coltura agar, diverse opzioni per le prestazioni dei pozzi in questo test di punteggio sono stati considerati. Mentre varie analisi automatizzate o imaging base erano disponibili, hanno reso necessario acquisizione e distribuzione di tecnicamente impegnativi dispositivi, molte delle quali erano proibitivamente costosi. Pur considerando queste opzioni, era indispensabile fare riferimento alle schermate precedenti di durata della vita di tutti i tipi. In definitiva, questo studio ha usato un metodo segnante adattato dalla schermata di RNAi del Siu Sylvia Lee laboratorio intero genoma per durata della vita fenotipi15. In particolare, tutte le piastre di durata della vita sono state istituite nello stesso modo, ma solo controlli negativi sono stati controllati. Una volta che le piastre di controllo negativo sono state confermate per avere vicino completa mortalità, piastre di prova sono stati segnati a mano. In questa schermata su larga scala, aspetti positivi sono stati confermati da ri-test con prodotti chimici preparati al momento, utilizzando ripetizioni in triplice copia dei lati positivi di primari.
Protocollo
1. preparazione di buffer
-
Libbra di brodo
- Utilizzare granuli premiscelati (Vedi Materiali tavolo) e seguire il protocollo del produttore per la preparazione.
-
Crescita del nematode Media (NGM) Agar
- Mescolare 23 g di agar, 3 g di NaCl, 2,5 g di bacto peptone, e acqua deionizzata in 0,972 L. Autoclave e lasciate raffreddare a 60 ° C, quindi aggiungere 25 mL di tampone di 1m potassio fosfato (KPO4) (pH 6.0), 1 mL di solfato di magnesio 1 M (MgSO4) , 1 mL di 1 M di cloruro di calcio (CaCl2) e 1 mL di colesterolo 5 mg/mL (in etanolo).
-
Soluzione di ipoclorito
- Mescolare 5 mL di 5m KOH, 4 mL di soluzione di ipoclorito di sodio (6%) e deionizzata di H2O a un volume totale di 50 mL.
-
S basale
- Mescolare 5 g di NaCl, 1 g di K2HPO4, 6 g di KH2PO4e acqua deionizzata a 1 L, quindi autoclave.
2. preparazione del concentrato e. coli (OP50)
Nota: Questo passaggio si concentra 1 L di una soluzione satura e. coli in 25 mL di tampone basale S.
- Inoculare 5 mL di libbra di brodo in autoclave (punto 1.1) con una singola colonia di Escherichia coli (Strain OP50) e incubare per 4-6 h a 37 ° C con agitazione (250 giri/min). 0,1 mL di questa soluzione consente di inoculare 1 L di LB in un matraccio di Erlenmeyer 2L. Incubare le 1L beute durante la notte (12-16 h) a 37 ° C con agitazione (250 giri/min).
- Centrifugare il culture pernottamento 1 L in bottiglie da 500 mL Centrifuga per 5 min a 10.000 x g e a 4 ° C per i batteri di pellet e decantare fluido rimasto lontano. Risospendere il pellet in 25 mL di S basale (punto 1.4). Conservare a 4 ° C.
3. preparazione di piatti di coltura NGM
- Per lastre di cultura di massa usate per produrre un numero elevato di vermi, versare 30 mL di agar di NGM fuso (60 ° C) (punto 1.2) in un flusso laminare sulle piastre di coltura di 10 cm con un apparato di erogazione fluido automatizzato o una pipetta sierologica. Lasciar asciugare durante la notte.
- Pipettare 2 mL di concentrato OP50 su ogni piatto di 10 cm, diffusa fino a coprire completamente la superficie dell'agar inclinando e ruotando la piastra, quindi consentire piastre ad asciugare. Conservare le piastre a 4 ° C fino a 2 settimane.
- Per piastre di coltura di dosaggio elevato throughput utilizzati per lo screening, utilizzare un erogatore di 8 canali automatizzati per dispensare 0,15 mL di agar di NGM fusa in ciascun pozzetto di una piastra ben 96 in un flusso laminare mobile. Prestare attenzione a rendere sicuri pozzi sono privi di bolle, come queste iniziative permetteranno di scavatori di vermi che comprometteranno il dosaggio in quel pozzo. Lasciar asciugare durante la notte. Conservare le piastre a 4 ° C fino a 2 settimane.
4. preparazione delle colture massa di temperatura sensibile (ts) Sterile C. Elegans
- Per avviare culture, utilizzando un 'pick verme' (una pipetta di vetro con un filo di platino associato o un verme fabbricato pick) sotto un microscopio per dissezione, trasferire 20 uova (ceppo TJ1060: spe-9 (hc88) I; rrf-3(b26)II) sulla cultura di massa piastre preparata al punto 3.1. Poi, incubare le piastre a 20 ° C per 6 giorni (consente più di una generazione di crescita, come ci si rivolge per la raccolta della prole delle 20 uova spostate).
- Confermare visivamente la presenza di adulti gravid (uova presenti nell'utero) con un microscopio per dissezione. Raccogliere gli adulti gravido di erogazione di 2-3 mL di S basale sulla piastra utilizzando una pipetta di vetro. Agitare il liquido intorno alla piastra a mano, quindi raccogliere il liquido in una provetta da 15 mL utilizzando una pipetta di vetro.
- Rotazione verso il basso il tubo (1.000 x g per 1,5 minuti a 20 ° C) per pellet vermi, quindi aspirare il sovranatante. Aggiungere 10 mL di soluzione di ipoclorito (punto 1.3) al pellet di verme e rapidamente agitare il tubo a mano in una direzione di top-to-bottom per 5 s. Incubare per 5 minuti, scuotendo ogni 2,5 min.
- Ancora una volta, girare giù per il tubo (1.000 x g per 1,5 min); il pellet dovrebbe essere bruno-giallastro. Aspirare il sovranatante. Aggiungere 10 mL di soluzione di ipoclorito al pellet di uovo e agitare vigorosamente il tubo. Incubare per 1-3 minuti, con agitazione occasionale e mentre aspetto il monitoraggio con il microscopio per dissezione. Confermare visivamente solo uova rimangono e procedere al passaggio successivo.
- Rotazione verso il basso il tubo (1.000 x g per 1,5 min) ed aspirare il sovranatante. La pallina deve essere bianca con nessuna colorazione marrone.
Nota: Dopo la rimozione della soluzione di ipoclorito, è fondamentale utilizzare tecniche sterili e buffer, dal momento che la contaminazione (batteriche e fungine, in particolare) può rovinare l'esperimento, sprecando tempo prezioso e reagenti. Questo studio usato un filtrato a flusso laminare mobile e spostato liquidi utilizzando solo pipette sterili e suggerimenti. - Aprire le provette in un spazio sterile. Lavare la pallina 3 volte con S basale, filatura giù (1.000 x g per 1,5 min) e aspirare via il supernatante ogni volta. Risospendere il pellet di uovo in 2-3 mL S basale. Queste uova possono ora utilizzabile per un pernottamento hatch nel buffer per raccogliere della larva L1 (passo 5).
5. cova uova di C. Elegans in Buffer per ottenere colture sincroni (preparazione larvale L1 C. Elegans )
- Decantare il buffer e pellet di uovo in un piatto di petri di vetro sterili con una copertura. Sciacquare le rimanenti uova dal tubo in un piatto utilizzando una pipetta sierologica con 2-3 mL di S basale. Aggiungere 5 mL di S basale per facilitare affollamento, come questo potrebbe incoraggiare la schiusa delle uova, come si illuminerà agitazione (20 giri/min con un agitatore orbitale danzatrice del ventre). Incubare per una notte a 20 ° C, per avere tempo di uova di tratteggio (16-24 h). Tutti i hatchlings arresto al 1° stadio larvale (L1) a causa della mancanza di cibo.
Nota: Prova aneddotica indica che freschi preparati in L1 (16-36 h dopo il prelievo degli ovociti) generano le popolazioni più sincrone di vermi adulti. - Raccogliere L1s in una provetta da 15 mL con una pipetta sierologica. Rotazione verso il basso L1s in una centrifuga (1.000 x g per 1,5 min), via aspirare il supernatante e ripetere fino a quando tutti L1s sono stati raccolti da cova piastre, lasciando 10 mL di S basale per il passo successivo.
- Dal tubo contenente L1s, micropipetta fuori 0,01 mL (immediatamente dopo la miscelazione) e dispensarlo su un non teste di serie (nessun Escherichia coli) piastra di NGM. Contare il numero di L1s sulla piastra. Ripetere 10 volte e ottenere una media per il numero di L1s in ciascuna aliquota. In genere, si aspettano tra 1-3 L1s per µ l (quando si inizia con 1 piastra di cultura di massa contenente 20 uova).
- Determinare con una pipetta sierologica del volume di S basale che tiene il L1s. Quindi estrapolare il numero medio determinato di vermi / 0,01 mL, ottenuti nel passaggio precedente, per stimare il numero totale di L1s. In genere, si aspettano tra 10.000-30.000 L1s (per piastra di cultura di massa contenente 20 uova).
- Per utilizzare questa cultura nell'analisi di 96 pozzetti, diluire la sospensione di L1 a 1 L1 per µ l in una bottiglia sterile rotonda media, quindi procedere al passaggio 7. Se questa cultura deve essere utilizzato per generare ulteriori c. elegans culture di massa, quindi procedere al passaggio 6.
6. su larga scala sincrono cultura preparazione
Nota: Soluzioni L1 consente di aumentare rapidamente le popolazioni di verme.
- Per generare numeri di grande vite senza fine con una soluzione di L1, erogare fino a 5.000 L1s su ciascuno del numero desiderato di piastre di cultura di massa. Raccogliere gli adulti gravid 2,5 giorni più tardi (20 ° C), come descritto ai punti 4.1-2 e passare al punto 4.3 per raccogliere le uova.
- Come è stato osservato anecdotally che ripetuto ipoclorito collection può sottolineare la popolazione sottomessa, dividere le popolazioni di raccolta uova per propagazione prima di sottoporre la popolazione restante ai trattamenti di ipoclorito, così che più generazioni della popolazione non sono ripetutamente sottoposti a trattamento di soluzione di ipoclorito.
7. installazione di piastre a 96 pozzetti Assay
- Lasciate le piastre di dosaggio (preparate al punto 3.3) a temperatura ambiente. Quindi, in un flusso laminare, aggiungere 5 µ l di concentrato OP50 (preparata al punto 2.2) in ciascun pozzetto. Come prima, utilizzare un erogatore di 8 canali automatizzati.
- Aggiungere 10 µ l di sospensione di L1 ad ogni pozzetto usando un erogatore di 8 canali automatizzati. Questo produrrà il worm media 10 al pozzo, dal momento che sono presenti in sospensione a 1 L1 per µ l. Per promuovere la distribuzione uguale di L1s dai liquami, dispensare L1s da una bottiglia rotonda media attivamente mescolata con un moderatamente lentamente girando ancoretta.
- Coprire la piastra con il coperchio, lotti di casella di piastre e incubare a 25 ° C per 2 giorni.
8. 1 st giorno adulto c. elegans con prodotti chimici di trattamento
- Rimuovere piastre libreria chimica dal freezer e lasciare piastre a temperatura ambiente prima di procedere.
Nota: Le piastre libreria chimica come descritto qui sono 96 pozzetti contenenti composti discreti in tutti i pozzetti, che sono alla stessa concentrazione e dissolto in DMSO. Queste librerie non utilizzano le colonne esterne, e così ogni piatto ha un massimo di 80 sostanze chimiche distinte. La concentrazione di biblioteca nel protocollo descritto qui, è di 10 mM. È importante prendere in considerazione effetti solvente sui fenotipi. Mentre questo studio schermi ad una concentrazione di DMSO dello 0,5%, questo livello è stato superato mai in queste analisi di durata della vita e nelle analisi di bassa velocità effettiva, dove è più probabile che a prendere una concentrazione di soluzione stock composto. Questo protocollo non superi 0,25%, che è un livello in cui le modifiche di durata della vita non si verificano16, almeno nel ceppo di N2. - Scuotere delicatamente piastra a 60 giri su un agitatore per micropiastre per 1 min immediatamente prima dell'uso.
- Utilizzando un automatizzato 96 pozzetti liquido gestore, trasferire 0,75 µ l del composto (o DMSO) dalla cassa della libreria alla piastra di dosaggio. La profondità della pipetta durante la consegna del liquido alla piastra di dosaggio è controllata attentamente, tale che le punte di pipetta del gestore liquido stanno consegnando il volume 0,75 µ l per il ~ 15 µ l di liquido sulla superficie dell'agar (con vermi e concentrato OP50 da passaggi 7.1 -2) e non perforare la superficie dell'agar nel pozzo. Non usare pipette multicanale manuale 8 o 12 tranne in schermi molto piccoli (< 10 piastre), come possono aumentare errore e spesso sfociano in perforatura della superficie dell'agar, che compromette il dosaggio.
- Preparare piastre di controllo negativo libreria chimica con DMSO (dimetilsolfossido), supponendo che la libreria in fase di test utilizza DMSO come solvente. Fare 1 controllo negativo piastra per ogni 5 piastre, fino a 10 piastre di controllo negativo di prova. Se possibile, anche fare un piatto di controllo positivo (NP11 a 20 mM, per una concentrazione finale del dosaggio di 0,1 millimetri, è efficace per questo scopo; Vedi sezione risultati rappresentante). Non aggiungere prodotti chimici (test o controllo) a 2 colonne esterne delle piastre, così come sono particolarmente suscettibili di essiccazione.
9. essiccazione culture
- Per rimuovere il liquido dalla superficie dell'agar, asciugare piatti nel flusso laminare mobile per 4-8 h. È fondamentale che queste tavole sono completamente asciutto, ma non si asciugano. Come alcune piastre prenderà più tempo ad asciugarsi rispetto ad altri, monitorare attentamente tutte le piastre e rimuovere appena sono asciutti. Confermare l'essiccazione mediante un'attenta ispezione visiva dei singoli pozzetti della piastra.
Nota: A seconda di fattori che includono il tasso di scarico del gabinetto, la durata del che operazione dovrà essere empiricamente determinata. Questa fase di essiccazione può prendere circa 4-8 h per un quadro completo. - Sigillare piastre con pellicola trasparente, poi mettere sui coperchi di piastra.
- Girare le piastre a 96 pozzetti di saggio per 45 s a 1.000 x g.
- Piastre di archivio invertiti a 25 ° C.
10. C. Elegans culture di scoring per la longevità
- Monitorare le piastre di controllo negativo fino a > 95% mortalità è osservato. Verifica piastre settimanale per le prime due settimane e ogni giorno da allora in poi. Prova17 Caenorhabditis coorti della stessa specie e ceppo per visualizzare significativamente differenti aspettative di vita.
Nota: Per il dosaggio di durata della vita descritto qui, con gli animali TJ1060 coltivati a 25 ° C, 95% di mortalità in queste popolazioni è verificato da adulto giorno 16-20. - Pozzetti di controllo negativo vengono considerati di avere raggiunto il > 95% mark, rotazione verso il basso tutte le piastre di dosaggio di 96 pozzetti per 45 s su una centrifuga di piano d'appoggio con una micropiastra adattato rotore (250 x g per 45 s a 20 ° C).
- Punteggio ottenuto tutti i pozzetti delle piastre di controllo. Questo viene fatto dal conteggio e registrazione del numero di animali vivi e morti in ciascun pozzetto. Vermi morti possono essere differenziati da vermi vivi dalla loro mancanza completa di movimento. Provocare movimento in vermi vivi facendo cadere la piastra ben 96 da circa 7 cm sulla superficie del microscopio per dissezione osservando attraverso l'oculare per qualsiasi risposta evocata. Vermi morti non risponderà, e compagni di laboratorio nelle vicinanze potrebbero non apprezzare il rumore ripetitivo.
- Per le piastre di prova, contare e registrare solo i pozzetti contenenti vermi vivi. Quando si osserva un verme vivo, contare tutti gli animali vivi e morti in quel pozzo, insieme con la posizione ben e la piastra.
Nota: È spesso utile segnare nuovamente le piastre dopo > 99% di controllo negativo vermi sono morti. Nelle schermate di larga scala, questo può essere il miglior punto per fare il punteggio iniziale. In entrambi i casi, il Punteggio/re-score come descritto sopra
11. re-Testing composti
- Quando si prova solo un piccolo numero di candidati composti (< 320 composti), come con un re-test o una schermata di candidati (Vedi risultati rappresentativi), limitare l'analisi a 32 pozzi centrali nel tentativo di minimizzare gli effetti possibili di piastra. Questo lascia i 2 pozzi più vicino al bordo della piastra non trattati ma ancora contenente agar, cibo e worm.
Risultati
Cominciamo esaminando risultati rappresentativi da impiegando questo protocollo per i test di durata di 96 pozzetti. Nel primo esempio, il metodo è stato utilizzato per schermo con successo attraverso 30.000 sostanze chimiche per identificare le sostanze chimiche che prolungano la durata del c. elegans e includono anche i risultati dalla schermata di follow-up ri-testare performanti prodotti chimici utilizzando il stesso protocollo. Questi risultati sono stati descritti in precedenza1. Il secondo esempio utilizza lo stesso protocollo in una schermata su scala ridotta di candidati composti.
Schermo su larga scala e ripetere il test: Lo schermo su larga scala test 30.000 composti è stato eseguito una dose singola, in duplice copia. Ogni prodotto chimico è stato quindi testato in due pozzi con una popolazione animale totale prevista di 20. A tale scopo, tre insiemi discreti di 10.000 composti (in duplicato) sono stati selezionati per un periodo di circa 3 mesi per coprire l'intero 30.000 composti. Ciò è stato fatto in parte, per garantire una quantità gestibile di Punteggio manuale alla fine del test ed ha richiesto un totale di 260 delle piastre a 96 pozzetti di saggio in ogni set di. In piastre d'archivio biblioteca, solo 80 pozzi contenuto composto; una replica di 10.000 composti rende 125 piastre di dosaggio. Questo studio ha usato 2 repliche con 10 piastre di controllo negativo in ogni set. Per aumentare la velocità effettiva, piastre sono stati segnati quando popolazioni di controllo negativo sono state valutate ad aver sperimentato ~ 99% di mortalità. Prova tutti i pozzi sono stati quindi esaminati per vermi vivi.
Prodotti chimici in pozzi con un verme di terra sono stati denominati hits. Prodotti chimici in pozzetti contenenti più di 1 verme vivo erano anche chiamato hits e inoltre tutti i vermi in quei pozzetti (vivi e morti) sono stati contati per generare un punteggio semplice (percentuale vivo Punteggio; il numero di vermi vivi diviso per il numero di vermi morti). Ogni prodotto chimico nella libreria potrebbe pertanto essere chiamato un colpo due volte e quelli colpi potrebbero, ma potrebbero non avere punteggi associati con loro. 512 prodotti chimici distinti sono stati denominati hits (almeno una volta) dalla schermata di 30.000 composti. Lo schermo è stato effettuato con l'intento di identificare effetti pro-longevità (riproducibili), potenti e/o robusti. Queste due proprietà diverse possono avere effetti distinti. Potenti sostanze chimiche potrebbero aumentare notevolmente la durata della vita, nel qual caso ci si aspetterebbe un'alta percentuale di vermi che vivo nel pozzo di quella sostanza chimica. Per le sostanze chimiche solide, entrambi replica dovrebbe avere vermi vivi. Lista di colpo è stata classificata sulla base di questi criteri. 179 di sostanze chimiche ha reso punteggi percentuali vivi, o sono stati colpiti in entrambi replicati e pertanto sono stati scelti per il re-test. La maggior parte dei prodotti chimici rimanenti che sono stati chiamati colpi, ma non selezionati per la ri-prova, conteneva solo un singolo verme vivo in uno dei pozzi replicati.
Ri-test dei successi è stato svolto, simile alla schermata principale tranne con 3 repliche (popolazione animale totale prevista di 30) e accurata quantificazione delle durate della vita degli animali nelle piastre di controllo non trattato. Questi cambiamenti sono stati aggiunti per aiutare a confrontare i pozzetti di controllo e test. 179 dei successi chimici erano ri-ordinato, diluito a 10 mM e si trasferì in piastre a 96 pozzetti. Solo l'interni 24 pozzetti sono stati utilizzati per il dosaggio di ripetere il test (versioni correnti di questo protocollo sarebbero hanno usato l'interni 32 pozzi come descritto nella sezione protocollo per testare nuovamente gli schermi) e i composti sono stati ri-testati in triplice copia con sei tavole di analisi di controllo negativo trattati con solvente DMSO. Una piastra di controllo negativo è stata segnata periodicamente per la sopravvivenza totale (Figura 1A). Quando circa il 95% degli animali di controllo erano morti, tutte le piastre completamente sono state segnate (vivere tutti trattati e vermi morti sono stati contati).
Per chiamare colpi dai risultati della ri-prova, un cut-off è stato effettuato presso il Punteggio medio di vivo delle percentuali di controllo negativo + 2 deviazioni standard (SD). Per i pozzi di prova, una media di cento vivo (al momento di segnare) calcolando il punteggio percentuale vivo da tre repliche per ogni pozzetto sono stati calcolati i punteggi. Per questo particolare test, Spartiti di vivo percentuale media dei pozzetti di controllo negativo sono stati calcolati come la media dei tre replicati per 48 pozzetti (2 set di piastre di controllo negativo triplice copia). La SD utilizzata per chiamare hits dal set di chimica di ripetere il test era che la SD attraverso il controllo negativo 48 una media percentuale punteggi vivi. Utilizzando questa strategia, questo studio ha trovato 57 risultati dalla libreria di ripetere il test di 179 composti, dimostrando che un totale di 32% delle sostanze chimiche re-test risultati positivi (Figura 1B). Binning dei media percentuali punteggi vivi per i pozzetti di controllo e test negativi hanno indicato che i pozzi di prova ha superato i pozzetti di controllo (Figura 1C).
Schermo candidati: Schermi di piccole dimensioni possono essere eseguiti in un modo simile al retest descritto sopra. Qui, descriviamo i risultati da uno schermo di candidati con 139 composti. Questi candidati sono stati assemblati come strutture in grado di favorire la longevità. Per questo schermo, abbiamo effettuato 5 replicati delle piastre prova a due diverse dosi (50 µM e 100 µM). Inoltre, abbiamo usato 8 piastre di controllo negativo, con una piastra di singolo controllo positivo (NP1) contenente due dosi differenti; 50 µM e 100 µM.
Piastre di controllo negativo sono stati monitorati fino a ~ 90% degli animali erano morti. A quel tempo, pozzi sono stati segnati da vermi vivi e morti in tutti i pozzetti di controllo e da pozzi di prova contenente Vermi vivi di conteggio. La percentuale viva al tempo di punteggio sono stata utilizzata per calcolare una media percentuale punteggi vivi per ciascun pozzetto. Per i controlli negativi, 32 pozzi avevano punteggi percentuali vivi da 8 ripetizioni. Per i controlli positivi, c'erano 4 punteggi ben media attraverso 4 ripetizioni per ogni dose. Colpi sono stati chiamati per i pozzi con un punteggio di vivo percentuale media che era superiore alla media per cento di controllo negativo vivo Punteggio + 2 SD Questa frequenza di taglio 14 colpi a sinistra nella schermata del candidato ed esclusi tutti i pozzetti di controllo negativo. Quel taglio incluso anche tutto il positivo controllo pozzi trattati a 100 µM e 50% dei controlli positivi trattati a 50 µM. Questi risultati sono presentati qui come cestinate una media percentuali punteggi vivi per entrambi il 50 µM (Figura 2A) e le schermate di test 100 µM (Figura 2B).
Infine, tutti i piatti erano ri-ha ottenuti ad un punto di tempo tardo, che ha corrisposto ad un tempo quando superiore al 99% del controllo negativo trattati gli animali erano morti. Questi risultati hanno indicato che i pozzetti di controllo positivo lontano fuori-eseguita i pozzetti di controllo e test negativi (Figura 2C). Mentre i pozzi di prova erano leggermente meglio di controlli negativi. Questo risultato quest'ultimo è prevenuto dall'indicazione che molti dei pozzi prova sembravano mostrano una tossicità relativa al trattamento di controllo (tabella 1), quindi confondere questa semplice interpretazione. Questo era da aspettarselo, dato che la libreria candidati era un vero schermo di prodotti chimici con attività biologica sconosciuta in c. elegans, mentre lo schermo ri-testare era essenzialmente pre-screening per i composti che non erano tossici. Poiché questa schermata principale era per i composti che allunga la durata della vita, significativamente sostanze chimiche tossiche dovrebbero non nel ri-test impostati.
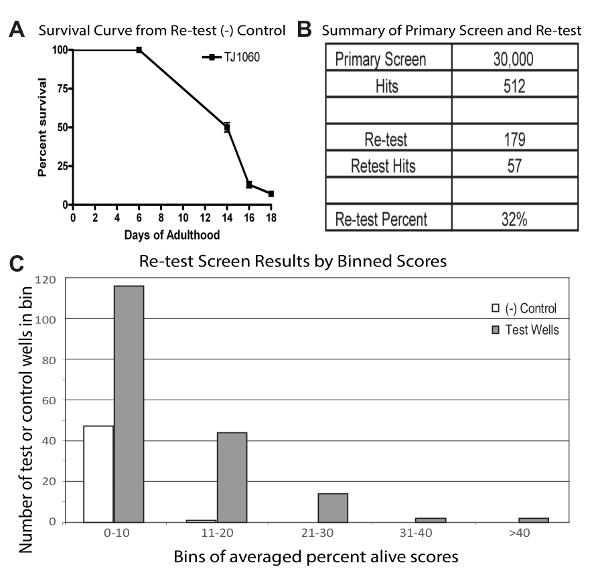
Figura 1 : Rappresentante deriva da un alto throughput schermo e ri-test
Curva di sopravvivenza (A) da una piastra di controllo negativo rappresentativo utilizzata nell'analisi di ripetere il test. Questa curva è stata costruita dal segnando tutti i vermi vivi e morti a 24 pozzetti usati per questo test 4 volte sopra i 18 giorni del dosaggio. Giorno 18 di età adulta, i controlli sono stati valutati per avere sopravvivenza ~ 5% e poi sono stati segnati anche tutti i test di controllo e piastre. (B) tabella che riassume i risultati dello schermo e ripetere il test. (C) Binning dei pozzi in media percentuale punteggi vivo per le condizioni di controllo e di prova dalla schermata di ripetere il test. Per i controlli, punteggi sono da 48 pozzetti ciascuna consistente della media dei 3 replicati. Risultati del test sono da 179 pozzi ciascuno composto il Punteggio medio da tre replicati. Figura 1 è riprodotto da una precedente pubblicazione1. Clicca qui per visualizzare una versione più grande di questa figura.
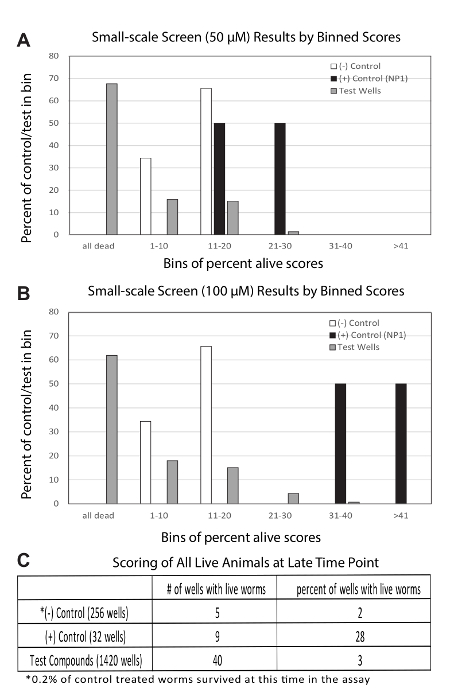
Figura 2 : Rappresentante risultati da uno schermo di candidati
(A) Binning dei risultati dalla schermata del candidato di 50 µM. 139 risultati di prova-ben rappresentano il Punteggio vivo percentuale media da 5 replicati. 32 risultati di controllo negativo è costituito da una media percentuali punteggi vivi da 8 ripetizioni. 4 risultati di controllo positivo è costituito da una media percentuali punteggi vivi da 4 repliche (Totale 16 pozzetti contenenti NP1 a 50 µM). (B) Binning dei risultati dalla schermata del candidato di 100 µM. Tutto è lo stesso come in (A), salvo che i pozzi di prova e controlli positivi sono stati trattati alle concentrazioni di 100 µM. Le stesse piastre di controllo negativo sono mostrate in entrambi (A e B). (C) rappresentante risultati da ri-segnando le piastre presso un punto di tempo di ritardo relativamente estreme. Controlli positivi drammaticamente superato tutti gli altri, se solo contabilità per la percentuale di pozzi con vermi vivi a questo punto del tempo, che è prevenuto nei confronti di pozzi di prova, come descritto nel testo principale e tabella 1. Clicca qui per visualizzare una versione più grande di questa figura.
| Binning dei punteggi vivi percentuale media | ||||||
| Punteggi raggruppati | Tutti morti (0) | 1-10 | 11-20 | 21-30 | 31-40 | > 41 |
| Ripetere il test | ||||||
| n # di (-) controllo | 16 | 31 | 1 | 0 | 0 | 0 |
| # Test pozzi (50 µm) | 46 | 69 | 50 | 8 | 3 | 3 |
| Schermo del candidato | ||||||
| n # di (-) controllo | 0 | 11 | 21 | 0 | 0 | 0 |
| n # di (+) controllo (50 µm) | 0 | 0 | 2 | 2 | 0 | 0 |
| n # di (+) controllo (100 µm) | 0 | 0 | 0 | 0 | 2 | 2 |
| # Test pozzi (50 µm) | 94 | 22 | 21 | 2 | 0 | 0 |
| # Test pozzi (100 µm) | 86 | 25 | 21 | 6 | 1 | 0 |
Tabella 1: Risultati rappresentante da binning diversi schermi
Qui vi presentiamo il binning dei media percentuali punteggi vivi dai due schermi (re-test e candidato). Nella schermata di ripetere il test, il picco è simile al controllo negativo con il re-test superando il controllo negativo drammaticamente sulla destra (lunga vita) lato del tavolo. Ciò indica la presenza di più pro-longevità composti presenti nel set di ripetere il test. Nella schermata di candidato, vediamo che il picco sia nella categoria tutti i morti, mentre c'è anche un evidente segnale dal lato destro della tabella. Questo indica la presenza di composti pro-longevità nel set di candidati, ma indica anche la presenza di tossicità significativa tra l'insieme di candidati di composti.
Discussione
Qui abbiamo descritto un metodo semplice per la coltura di c. elegans in piastre da 96 pozzetti. Descriviamo queste culture per screening chimico e saggi di durata della vita, ma possono essere utilizzati per molti tipi di analisi. Mentre condizioni di coltura multi-pozzetto per lo screening chimico precedentemente sono stati segnalati8, tra cui per durata della vita analisi10, il dosaggio descritto qui differisce in diversi modi. Il test di durata della vita qui descritto utilizza piastre da 96 pozzetti, si basa su mutanti sterili (invece di sterilizzazione chimica), utilizza condizioni di coltura agar, utilizza i componenti liquidi semplici per spostare il worm e manualmente viene segnato all'endpoint. I diversi approcci utilizzati in questo test possono essere di aiuto ai ricercatori alla ricerca di metodi che includono queste condizioni di screening.
Elementi cruciali per questo protocollo centro principalmente sulla qualità delle lastre prodotte per il dosaggio. In primo luogo, quando si effettuano piatti è imperativo che la superficie dell'agar è priva di bolle e altre imperfezioni. Queste variazioni nella superficie dell'agar quasi sempre portano a scavare e perdita del pozzo. In secondo luogo, questo protocollo si basa su l'asciugatura dei liquidi depositati durante le fasi di installazione e drogare. È fondamentale che questi liquidi vengono rimossi completamente, ma l'agar non diventare seccava. Aneddoticamente, sembra che vermi nei pozzi che non sono completamente asciutto (nuoto in liquido) vivono più a lungo di pozzi correttamente essiccati, mentre sopra-essiccamento delle piastre porta ad essiccamento e screpolature dell'agar, che conduce a vite senza fine scavando e perdita. Un altro elemento cruciale del presente protocollo è mantenere condizioni di sterilità. Come con qualsiasi test di durata della vita, c'è un sacco di lavoro coinvolti con la piastra di supporto, e molte opportunità e tempo esiste per dosaggio rovinando la contaminazione per insediarsi e crescere sulle piastre.
Mentre il test di durata della vita qui descritto è utile per lo screening di composti in c. elegans, è limitata a particolari ambiti di provenienza genetici, quanto si basa su un ceppo sterile temperatura sensibile (ts); Abbiamo usato TJ1060, che ha penetranza elevata sterilità. Questo limita i ceppi disponibili per lo screening con questo metodo. I metodi alternativi tra cui attraversando ts sterile mutazioni nello sfondo desiderato o mediante sterilizzazione chimica. Non abbiamo provato la sterilizzazione chimica con questo test, ma dovrebbe essere possibile. Potenziali ostacoli riguardano la collocazione dello sterilizzatore sui vermi nella fase corretta e nella dose corretta. Il protocollo descritto qui usa un dispenser liquido che è veloce, ma non viene visualizzato per erogare efficacemente gli adulti. Così, questi vermi si sviluppano le piastre e pertanto devono essere trattati con la sterilizzazione chimica sulle piastre. Determinare la dose ottima e la tempistica sarebbe importante per il successo. Strategie alternative includono l'utilizzo di un metodo di erogazione che possa spostare gli adulti. In passato, abbiamo trovato che le macchine in grado di identificare e ordinare gli adulti sono generalmente molto più lenti rispetto i gestori liquidi semplici, che possono erogare fanghi omogenee della larva sospesa.
In generale, usiamo questo metodo rapidamente schermo prodotti chimici e trattamenti per grandi effetti positivi sulla durata della vita. Il metodo è particolarmente efficace se usato con dosi multiple, alta replicare i numeri e un attento controllo di controlli negativi che sono sempre mantenuti e intercalati tra le piastre di prova. Controlli positivi sono anche utili nel definire e attuare le schermate descritte in questo manoscritto. Tuttavia, per essere un efficace positivo, il controllo avrebbe bisogno di essere abbastanza potente e/o estremamente robusto. Quando lo schermo è stato originariamente distribuito, non è stato identificato un composto adeguatamente potente e robusto. Attualmente, ci sono molti rapporti nella letteratura 'invecchiamento' di probabili candidati per controlli positivi utili nelle schermate descritte qui. Come descritto nella sezione screen candidato della sezione risultati attesi di questo manoscritto e nella Figura 2 e tabella 1, il composto NP1 è un efficace controllo positivo per questo schermo. Confermiamo generalmente risultati positivi da questi schermi con vita utile standard saggi su piastre di coltura di 3 mm.
Divulgazioni
Gli autori dichiarano che nessun ente di finanziamento sostenere questo lavoro aveva alcun input sulla raccolta di dati, analisi dei risultati o la decisione di pubblicare.
Riconoscimenti
Ringraziamo Dipa Bhaumik, Aaron Miller e Bob Hughes per assistenza tecnica. Ceppi sono stati forniti da CGC, che è finanziato dall'ufficio di NIH di programmi di ricerca dell'infrastruttura (P40 OD010440). Siamo grati a Georgia boschi e membri di Lithgow, Kapahi e Melov Labs per utili discussioni. M.L. era sostenuto da National Institutes of Health (NIH) Training Grant T32 AG000266 e un Ellison medica Foundation/American Federation of invecchiamento ricerca induttrici Fellowship. Quest'opera è stata sostenuta da una sovvenzione BioAge Labs, una sovvenzione di Larry L. Hillblom Foundation, così come i National Institutes of Health concede UL1024917, supportano il Consorzio di ricerca interdisciplinare su Geroscience e 1R01AG029631-01A1 a G.J.L.
Materiali
| Name | Company | Catalog Number | Comments |
| LB Broth Miller Granules | VWR | ||
| Unispense | Wheaton Science Products | automated fluid dispensing apparatus | |
| 96 well assay plate; COSTAR 3370 | Corning | ||
| Multidrop 384; automated 8 channel dispenser | Thermo Fisher Scientific | ||
| manufactored worm pick | Genesee Scientific | ||
| Belly Dancer Orbital Shaker | Stovall Life Science inc. | ||
| microplate shaker; MTS 2/4 Digital | IKA Works, inc. | ||
| automated 96-well liquid handler; Biomek FX Liquid Handler | Beckman Coulter | ||
| automated 96-well liquid handler; Bench Top Pipettor | Sorenson Bioscience, inc. | ||
| manual 8 or 12 multi-channel pipettes | we use rainin… | ||
| transparent 96 well film cover; TempPlate RT Optical Film | USA Scientific | ||
| table top centrifuge; Centrifuge 5810 R | Eppendorf |
Riferimenti
- Lucanic, M., et al. Chemical activation of a food deprivation signal extends lifespan. Aging Cell. , (2016).
- Evason, K., Huang, C., Yamben, I., Covey, D. F., Kornfeld, K. Anticonvulsant medications extend worm life-span. Science. 307 (5707), 258-262 (2005).
- Melov, S., et al. Extension of life-span with superoxide dismutase/catalase mimetics. Science. 289 (5484), 1567-1569 (2000).
- Benedetti, M. G., et al. Compounds that confer thermal stress resistance and extended lifespan. Exp Gerontol. 43 (10), 882-891 (2008).
- Hansen, M., Hsu, A. L., Dillin, A., Kenyon, C. New Genes Tied to Endocrine, Metabolic, and Dietary Regulation of Lifespan from a Caenorhabditis elegans Genomic RNAi Screen. PLoS Genet. 1 (1), 17 (2005).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nat Genet. 33 (1), 40-48 (2003).
- Samuelson, A. V., Carr, C. E., Ruvkun, G. Gene activities that mediate increased life span of C. elegans insulin-like signaling mutants. Genes Dev. 21 (22), 2976-2994 (2007).
- Kwok, T. C., et al. A small-molecule screen in C. elegans yields a new calcium channel antagonist. Nature. 441 (7089), 91-95 (2006).
- Petrascheck, M., Ye, X., Buck, L. B. A high-throughput screen for chemicals that increase the lifespan of Caenorhabditis elegans. Ann N Y Acad Sci. 1170, 698-701 (2009).
- Solis, G. M., Petrascheck, M. Measuring Caenorhabditis elegans life span in 96 well microtiter plates. J Vis Exp. (49), (2011).
- Angeli, S., et al. A DNA synthesis inhibitor is protective against proteotoxic stressors via modulation of fertility pathways in Caenorhabditis elegans. Aging (Albany NY). 5 (10), 759-769 (2013).
- Fabian, T. J., Johnson, T. E. Production of age-synchronous mass cultures of Caenorhabditis elegans. J Gerontol. 49 (4), 145-156 (1994).
- Greer, E. L., Brunet, A. Different dietary restriction regimens extend lifespan by both independent and overlapping genetic pathways in C. elegans. Aging Cell. 8 (2), 113-127 (2009).
- Mair, W., Panowski, S. H., Shaw, R. J., Dillin, A. Optimizing dietary restriction for genetic epistasis analysis and gene discovery in C. elegans. PLoS One. 4 (2), 4535 (2009).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes Dev. 19 (13), 1544-1555 (2005).
- Frankowski, H., et al. Dimethyl sulfoxide and dimethyl formamide increase lifespan of C. elegans in liquid. Mech Ageing Dev. 134 (3-4), 69-78 (2013).
- Lucanic, M., et al. Impact of genetic background and experimental reproducibility on identifying chemical compounds with robust longevity effects. Nat Commun. 8, 14256 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon