Method Article
Routine de procédé de criblage de microparticules dans les Transfusions de plaquettes
Dans cet article
Résumé
Gestion des stocks plaquettaire basée sur le dépistage au moyen de microparticules contenus dans les concentrés de plaquettes est une nouvelle initiative d’amélioration de qualité dans les dépôts de sang hospitaliers. L’objectif est de différencier activés des plaquettes non activé afin d’optimiser l’utilisation des plaquettes. Fournissant des plaquettes non activé aux patients en hématologie-oncologie peut-être réduire leur risque élevé de devenir réfractaire.
Résumé
Gestion des stocks plaquettaire basée sur le dépistage au moyen de microparticules contenus dans les concentrés de plaquettes est une nouvelle initiative d’amélioration de qualité pour les dépôts de sang hospitaliers. Des fragments de cellules au large de microparticules (MP) lorsqu’ils sont stressés. Sang et les composants sanguins peuvent contenir des fragments cellulaires d’une variété de cellules, notamment à partir de plaquettes activées. Lors de l’exécution leur rôle de cellules immunitaires innées et des acteurs majeurs dans l’hémostase et de coagulation, plaquettes changent forme et génèrent des microparticules. Avec la diffusion de la lumière dynamique (DLS)-base de microparticules de détection, il est possible de différencier activés (microparticules élevé) des plaquettes non-activé (microparticules faible) dans les transfusions et optimiser l’utilisation de ce produit sanguin rare. Des recherches antérieures suggèrent que prévoyant l’utilisation prophylactique chez les patients de l’hémato-oncologie de plaquettes non activé pourrait réduire leur risque de devenir réfractaire et améliorer les soins aux patients. Le but de cette méthode de dépistage est de différencier systématiquement activé des plaquettes non activé. La méthode décrite ici décrit les étapes à suivre pour la gestion des stocks courants de plaquettes dans une banque de sang de l’hôpital : obtention d’un échantillon d’une transfusion de plaquettes, charger l’échantillon dans le tube capillaire pour la mesure de DLS, effectuant le DLS tester à identifier les microparticules et en utilisant le contenu au moyen de microparticules signalés pour identifier des plaquettes activées.
Introduction
L’intérêt en microparticules a tourné essentiellement autour de leur implication dans les processus de cellule à cellule communication et biologique. 1 , 2 , 3 plus récemment, des microparticules ont également suscité intérêt comme marqueurs potentiels de diagnostics précoces des maladies auto-immunes et cardiovasculaires. 4 , 5 microparticules, également connu sous le nom extracellulaires vésicules ou les exosomes, ont été largement étudiées par cytométrie en flux. Malheureusement, malgré les efforts visant à normaliser les protocoles de cytométrie en flux classiques il n’existe aucun consensus sur le protocole optimal à utiliser. 6 , 7 , 8 , 9 , 10
Bien que cytométrie conventionnelle peut caractériser certaines sous-populations de MP,11 il a plusieurs rapportées limites. 11 , 12 , 13 , 14 certaines de ces limitations ont été traitées par à l’aide de lasers de puissance plus élevées et de détecteurs dans un soi-disant « option de petites particules »,15,16 ainsi que détection à 15-25 ° vers l’avant angle de dispersion et modifié la pression de la gaine . 17 , 18 néanmoins, une méthode de dépistage rapide et facile à utiliser qui peut être combinée avec ces méthodes sophistiquées est toujours nécessaire d’utiliser des microparticules comme marqueurs de diagnostics précoces. Des niveaux élevés de microparticules sont détectables dans environ un tiers des donneurs de sang normal19 et peuvent indiquer des conditions subcliniques. En conséquence, les niveaux élevés au moyen de microparticules dans les produits de dons de sang pourraient être incompatibles avec bénéficiaires vulnérables. 20
Lorsqu’ils fournissent les transfusions de plaquettes, il y a un risque de non immuns réfractarité - une condition dans laquelle corps d’un patient refuse les transfusions consécutives et ne permet pas une part importante des plaquettes à circuler. 21 , 22 période réfractaire Non immuns peut se traduire par des transfusions gaspillées, séjours de complications de santé pour les patients et prolongée de l’hôpital. 23 les transfusions de plaquettes contenant un nombre élevé de microparticules peuvent être un facteur qui contribue à l’élaboration de l’affaissement non immunes chez les patients vulnérables hémato-oncologie. 20 il est possible de gérer le stock de plaquettes selon la composition des transfusions de plaquettes par dépistage de microparticules, réduisant ainsi le risque pour les patients vulnérables. Toutefois, la plupart des tests de microparticules qu’isolement des microparticules de plaquettes5,12 ou sont par ailleurs très labor intensif24,25 et peut par conséquent pas être mis en œuvre systématiquement à l’hôpital banques de sang.
La technique décrite ici utilise diffusion dynamique de la lumière (DLS) - également connu sous le nom la spectroscopie de corrélation de photons ou la diffusion quasi élastique de la lumière. Pendant des décennies, diffusion dynamique de la lumière a été largement utilisée dans l’industrie pharmaceutique pour caractériser les formulations pharmaceutiques LIPOSOMALES ou émulsions où granulométries sont dans la gamme sub-micronique. 26 , 27 Toutefois, outils mis au point pour ces applications ne sont pas optimisés pour les produits sanguins écran. Un nouveau système de listes de distribution a été mis au point pour surmonter les limitations techniques et rendre la diffusion de la lumière dynamique utile pour le dépistage des transfusions de plaquettes. 28
Diffusion dynamique de la lumière des mesures sont effectuées en illuminant les particules en suspension avec lumière laser et en analysant la variation temporelle de l’intensité lumineuse épars qui est une conséquence des particules en suspension. En outre, cette méthode utilise la relation inverse entre la vitesse de la particule et taille - petites particules se déplacent vite et les grosses particules se déplacent lentement - à fournir des informations sur les distributions granulométriques et les concentrations relatives des composantes échantillon. À l’aide de listes de distribution, la moyenne au moyen de microparticules rayon contenu et moyens de la composante de microparticules peut être quantifié. La teneur de microparticules dans le produit sanguin est donnée en % MP basé sur la superficie de l’histogramme mesurée pour les rayons de particules de 50 à 550 nm. Alors que les particules avec des rayons au-dessous de 50 nm sont détectés par DLS et signalés par le système de listes de distribution, ils ne sont pas inclus dans % MP. Plutôt que d’isoler les microparticules de plaquettes, l’hétérogénéité des transfusions de plaquettes est déterminée selon la teneur relative des microparticules et des plaquettes dans un échantillon. En fait, le rapport entre les pics de microparticules et de plaquettes peut être utilisé pour calculer la concentration absolue de la MP lorsque la numération plaquettaire est connue. 19
Le système DLS fournit des professionnels de la santé avec des informations qualitatives et quantitatives sur les microparticules trouvées dans les échantillons provenant de sang ou de produits sanguins. Le principal avantage de la technique DLS décrite sur les techniques alternatives telles que la cytométrie en flux, microscopie électronique, nanoparticules29 suivi d’analyse30 ou accordable impulsion résistive détection31 est la préparation de l’échantillon : aliquotes de concentrés plaquettaires peuvent être mesurés directement sans avoir besoin d’isoler les MP de plaquettes, de dilution de l’échantillon ou d’autres modifications. 9 , 17 en outre, DLS est une méthode de dimensionnement absolu et ne souffre pas de l’absence de perles de calibrage avec indice de réfraction approprié. 14 , 32
Une corrélation entre l’activation plaquettaire et teneur en MP a déjà démontrée par microscopie33,20 et peut être déduite de l’augmentation de la teneur en MP dans certaines pathologies15,34, 35 , 36 et dans des conditions in vitro connues pour activer les plaquettes. 19 , 37 , 38 Toutefois, plus amples études sont nécessaires pour bien comprendre la relation de l’activation de contenu et plaquettes DLS-mesurée au moyen de microparticules. Basée sur nos connaissances actuelles que les plaquettes activées contiennent un nombre élevé de microparticules, ils sont les meilleurs utilisé pour le traitement thérapeutique des saignements activement les patients39, tandis que les patients en hématologie-oncologie bénéficient non activé plaquettes avec no ou le faible niveau de microparticules20. On a récemment signalé que in vitro la réactivité des plaquettes de donneur n’a pas significativement influé la récupération et la survie de ces plaquettes dans les transfusions unique aux patients stables, pour la plupart non hémorragiques hémato-oncologie40 . De ce constat, on pourrait conclure que l’activation des plaquettes identifiée par la teneur élevée en MP ne joue également aucun rôle significatif dans le traitement prophylactique des patients. Toutefois, en raison de l’étroite sélection des patients, cette étude n’a pas abordé l’impact des facteurs de donateurs pour des patients complexes qui sont fébriles (exclus de l’étude), pas stable et de recevoir beaucoup plus d’une transfusion de plaquettes. La question comment il est possible de réduire la complexité de ces cas de patients - qui détient la promesse de réduire la période réfractaire - reste sans réponse.
Microparticules sont des marqueurs précoces de l’inflammation41,42,43,44 et plaquettes activation45 et sont détectés par conséquent de nombreux donateurs normales. 19 par conséquent, plaquettes activées et microparticules sont présents dans les dons de plaquettes. Il est raisonnable de l’hypothèse que les patients atteints de la fièvre, c'est-à-dire un pleinement activé système immunitaire inné, ne peuvent tolérer le défi supplémentaire d’une transfusion de plaquettes activées. Cependant, des études sont nécessaires pour prouver cette hypothèse. Le dépistage au moyen de microparticules peut atténuer l’incertitude actuelle quant au contenu des transfusions de plaquettes et réduire la complexité du traitement des patients.
Le ratio des plaquettes activées à non-activé dans une banque de sang de l’hôpital repose principalement sur la population de donneurs et à un degré moindre sur les transports, l’irradiation, inactivation des agents pathogènes et autres processus susceptibles d’accroître l’activation plaquettaire dans concentrés. 19 données provenant des banques de sang du grand hôpital aux États-Unis a montré que la composition moyenne de l’inventaire de plaquettes est 49 % activé et 51 % non-activé (gamme de plaquettes activées : 38 à 62 %, communication personnelle). Si les fournisseurs de produits sanguins ou des dépôts de sang hospitaliers veulent savoir combien concentré de plaquettes activées et non activé qu’ils produisent ou recevoir et want gérer leur inventaire basé sur l’activation des plaquettes qu’il ressort des microparticules contenu, cela protocole pourrait être approprié pour eux.
Fonction plaquettaire composition une banque de sang de l’hôpital sera en mesure de diriger les plaquettes non activé, homogènes pour une prophylaxie utilisent et activé, plaquettes hétérogènes pour un usage thérapeutique. Dépistage de plaquettes permet aux hôpitaux de maximiser l’utilisation du stock disponible, ce qui améliore les soins aux patients et diminue le coût. Ce protocole est prévu pour le personnel de laboratoire qui sont familiarisé avec le maniement de base et de la manipulation de produits sanguins.
Présenté ici est une méthode de dépistage de microparticules dans les transfusions de plaquettes qui peuvent s’appliquer systématiquement pour gérer les stocks de banque de sang de l’hôpital où la sélection produit basé sur le contenu au moyen de microparticules est souhaitable. L’objectif du présent protocole est de décrire la mise en œuvre et l’évaluation des listes de distribution pour le dépistage des plaquettes donnés. Le protocole décrit aborde les questions courantes d’accès non invasif à échantillons, intégration des tests dans le flux de travail de la Banque de sang et les caractéristiques de performance.
Protocole
Le protocole suivant a été réalisé dans le respect de toutes les directives de la société canadienne du sang (SCS). Bénévoles ont donné le consentement que leurs dons pourraient être utilisés pour réaliser ces études. Concentrés plaquettaires ont été préparés selon les modes opératoires normalisés CBS. Tous les tests de performance décrit ici a été réalisée au Centre pour Blood Research à l’Université de la Colombie-Britannique, Vancouver, Canada avec approbation institutionnelle de Research Ethics Board.
1. contrôle de qualité
- Effectuer un contrôle de qualité au moins une fois par essai jour pour vérifier le bon fonctionnement du système DLS. Mesurer les perles de fourni (rayon de 50 nm) suivant les instructions du fabricant pour l’utilisation.
- Récupérer le flacon de contrôle de la salle frigorifique et laisser 15 min à température ambiante. Les perles doivent s’équilibrer à température ambiante avant de l’utiliser.
- Allumez le système DLS avant la préparation de l’échantillon pour le laser de 15 min période d’échauffement est terminé au moment où que le premier échantillon est prêt à être testé.
- Une fois que la console a démarré, suivez les instructions à l’écran tactile pour ouvrir une session et sélectionnez l’option système Test pour mesurer l’échantillon de contrôle.
- Vortex mélanger le flacon pour 10 s pour garantir un échantillon représentatif.
- Remplir un capillaire avec les perles de contrôle utilisant un 100 pipette de volume fixe µL, de pipette et capillaire de la trousse d’essai.
- Une fois le test terminé, suivez les instructions à l’écran du système DLS.
NOTE : Les résultats du test de la perle contrôle sont comparées automatiquement aux informations stockées dans l’étiquette de code à barres de perle de contrôle et un laissez-passer ou FAIL notification ainsi que des informations de l’échantillon sont indiquées sur l’écran du système DLS à la fin de l’essai.
2. obtention d’un échantillon d’un concentré de plaquettes
Remarque : Les étapes suivantes décrivent le processus d’échantillonnage non invasif de la transfusion plaquettaire dans le DLS test capillaire pour la gestion des stocks courants de plaquettes. Une vue d’ensemble est illustré à la Figure 1. Accessoires nécessaires : tube de scellant, décolleur manuel tube, ciseaux et bavette.
- Retirez le concentré plaquettaire de l’inventaire non testé.
- Obtenir l’échantillon du produit plaquettaire soit à partir d’une pochette d’échantillonnage inutilisés (passez à l’étape 2.3) ou un segment de tuyau (passez à l’étape 2.4, si elle est vide ou étape 2.5 Si non vide).
Pour déconnecter la pochette tube ou tuyau segment utiliser un scellant de tube. Pour faire fonctionner la scelleuse de tube, suivez les instructions du fabricant. En bref, clamper la tubulure à sceller dans une position précise entre les deux mâchoires chauffées. Dans un appareil de poche, appuyez sur le tube fondu ensemble et laisser refroidir sous haute pression, tout en appuyant sur le levier (la durée est indiquée par le voyant vert) ayant pour résultat une étanchéité permanente, étanche. -
Prélèvement d’échantillons dans une pochette
- Mélanger le contenu du sac plaquettes bien en doux mouvement horizontal pendant 5 s (basculement d’un bout à l’autre cinq fois).
- Ouvrir la pince à la poche. La pochette est vide et se remplit par lui-même. Il n’est pas nécessaire remplir la poche complètement car seulement 100 µL d’échantillon sera requis pour tester les listes de distribution.
- Débrancher la pochette du sac en tubes de thermocollage la connexion avec un scellant de tube. Passez à l’étape 3.
-
Prélèvement d’échantillons dans les tubes vides
- Vérifier que les plaquettes sac tube a été stocké vide et le bloc de tube est toujours en place. Inspecter visuellement le tube pour vérifier qu’il n’y a pas une quantité importante de concentré plaquettaire dans le tube. Si le tuyau n’est pas vide, continuez au point 2.5.
- Fermer le stripper de tube sur le tube comme près du bloc de tubes que possible en compressant les poignées pour la tuyauterie entre les rouleaux.
- Accrocher le sac verticalement et garder comprimant les poignées de la strip-teaseuse.
- Tout en gardant le stripper fermée, sortie le bloc de la tubulure.
- Tirez-en le stripper vers le bas le tube vide permettant le tube à remplir lentement derrière la strip-teaseuse. Continuer jusqu'à ce que la section ci-dessous le stripper est complètement gonflé ou la strip-teaseuse se trouve à 1 pouce de l’extrémité de la tubulure.
- Une fois que le point d’arrêt est atteint avec la strip-teaseuse, utiliser le scellant en tube à la chaleur joint le tube 1 pouce au-dessus du stripper.
- Relâcher la poignée de la strip-teaseuse de tube manuelle.
- Chaleur sceller à nouveau 1 à 2 pouces au-dessus de la garniture précédente pour créer le segment de test.
- Couper le segment de test de l’unité de plaquettes. Ce segment sera utilisé pour les essais de DLS.
-
Prélèvement d’échantillons dans les tubes qui n’est pas vide
- Accrocher le sac verticalement et le bloc de la tubulure de sortie si en place.
- Inspecter visuellement la tubulure afin de déterminer s’il y a tout amas solides importantes. Si les touffes solides existent, sceller au-dessus d’eux telle qu’ils ne peuvent pas être dénudés dans le sac.
- Fermer le stripper de tube sur le tube comme près de l’extrémité scellée du tube que possible.
- Supprimer le contenu du tube dans le sac en compressant les poignées pour la tuyauterie entre les rouleaux et, tout en conservant la force de serrage, déplacer le stripper de tube le long de la tubulure vers le sac.
- Retirer le sac de plaquettes le crochet de suspension et mélanger doucement le sac pour 5 s en inclinant il d’un bout à l’autre cinq fois tout en gardant le stripper fermé.
- Accrocher le sac verticalement tout en gardant le stripper fermé.
- Tirez-en le stripper vers le bas le tube vide, permettant le tube à remplir lentement derrière la strip-teaseuse. Continuer jusqu'à ce que la section ci-dessous le stripper est complètement gonflé ou la strip-teaseuse se trouve à 1 pouce de l’extrémité de la tubulure.
- Une fois que le point d’arrêt est atteint avec la strip-teaseuse, utiliser le scellant en tube à la chaleur joint le tube 1 pouce au-dessus du stripper.
- Communiqué de la strip-teaseuse.
- Chaleur sceller à nouveau 1 à 2 pouces au-dessus de la garniture précédente pour créer le segment de test.
- Couper et jeter la dernière partie du tube.
- Couper le segment de test de l’unité de plaquettes. Ce segment sera utilisé pour les essais de DLS.
3. remplissage de l’échantillon dans le DLS test capillaire
- À l’aide d’un bouclier et des ciseaux propre et sec, couper une extrémité de la pochette tube ou tests de segment.
Remarque : Le tube capillaire utilisé pour DLS essais doit être rempli immédiatement. - Remplir le tube capillaire à l’aide de l’outil d’échantillonnage (pipette de volume fixe assemblé 100 µL, de pipette et capillaire) à tirer l’échantillon directement à partir de la pochette ouverte ou un segment de tube dans le capillaire.
- Sceller le fond du capillaire rempli en poussant doucement le tube capillaire rempli dans le joint d’étanchéité du tube capillaire tout en exerçant une légère torsion et des pressions contre la barre d’État.
- Déconnecter les 100 µL fixe pipette de volume et de la pointe de la capillaire, garantissant le capillaire reste solidement ancrés dans le joint d’étanchéité du tube capillaire.
- Retirez le tube capillaire du plateau d’étanchéité tube capillaire, essuyer avec un tampon d’alcool isopropylique et veiller à ce qu’aucune bulle d’air n’est pris au piège par effleurer doucement la partie inférieure du capillaire.
- Placer le tube capillaire dans le système de listes de distribution.
4. effectuer le test DLS
- Sélectionnez l’option de test de MP pour lancer un nouveau test DLS pour mesurer le contenu au moyen de microparticules d’un échantillon de plaquettes.
- Entrez les informations de l’échantillon (numéro d’Identification Don (ISBT), Collection/Production Date d’Expiration et Code de produit) en utilisant le scanner de code à barres ou manuellement.
- Si aucun code de produit n’est disponible d'où le système DLS peut extraire l’information moyenne fluide, sélectionnez le milieu liquide approprié manuellement (pour la plupart des plaquettes concentrés sélectionner le plasma mais pour les échantillons contenant des plaquettes additif Solution (Fe), entrez le pourcentage de plasma résiduel).
Remarque : Une petite déviation du pourcentage de PAS entre le nominal 65 % entraînera une petite erreur dans la viscosité (calculée automatiquement par le système de listes de distribution) qui touche au minimum le rayon de MP calculée mais pas % MP. - Placez le tube capillaire dans le système DLS quand vous êtes invité et démarrer le test.
- Une fois le test terminé, enlevez l’échantillon de la titulaire capillaire et des consommables correctement selon les directives d’installation. Enlevez l’échantillon de la titulaire capillaire et des consommables correctement selon les directives d’installation.
- Tag le sac de plaquettes avec la couleur correspondant au résultat, par exemple orange pour non-activé (homogène) avec % MP égale ou inférieure à 15 % et rose pour activé (hétérogène) % MP au-dessus de 15 %.
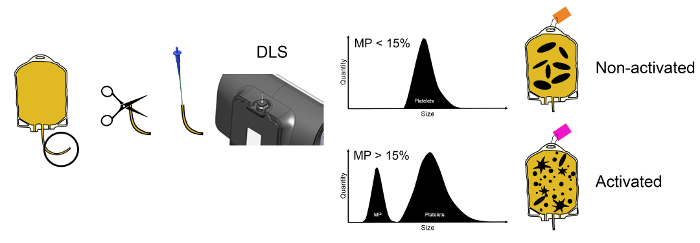
Figure 1 : Vue d’ensemble de la méthode. Aperçu des étapes à effectuer pour la gestion des stocks courants de plaquettes dans une banque de sang de l’hôpital : obtention d’un échantillon d’une plaquette concentré, charger l’échantillon dans le tube capillaire pour la mesure de DLS, effectuant le DLS test pour identifier les microparticules et à l’aide de la MICROPARTICULE déclaré contenu pour identifier des plaquettes activées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Résultats
Temps de préparation moyen
Les plaquettes en utilisant un système DLS le processus de présélection est résumée dans la Figure 1. Les plaquettes sont testés avec le système de listes de distribution au moment de la réception par le fournisseur de sang. Comme il est indiqué dans le tableau 1 , le temps de préparation moyen pour les utilisateurs formés est de 2 min 23 s, tandis que le nettoyage et temps de travail d’après les tests sont 14 s et 46 s, respectivement. Au total, l’utilisateur moyen prend 3 min et 23 s de temps de pratique par test.
| Activité | Temps d’activité | Durée d’essai de marche-away | TOTAL |
| Préparer le système DLS | 14 s | ||
| Assembler l’outil d’échantillonnage | 28 s | ||
| Obtenir le segment | 52 s | ||
| Remplissage capillaire et de commencer le test | 49 s | ||
| 5 min | |||
| Nettoyage | 14 s | ||
| Sac de plaquettes tag et l’inventaire | 46 s | ||
| Temps total nécessaire par échantillon | 3 min 23 s | 5 min | 8 min 23 s |
Tableau 1 : ventilation Active à temps test. Le test lui-même est un test de marche à l’extérieur avec une durée moyenne de 5 min. L’utilisateur moyen prend 3 min 23 s pour préparer le système de listes de distribution pour un test, obtenir et tester un échantillon suivant ce protocole et baliser le sac de plaquettes.
Precision
La précision du système DLS a été évaluée à trois niveaux au moyen de microparticules, 0-7 %, de 12 à 25 % et de 28 à 75 %. La gamme cliniquement pertinente de % MP est 3-75 %. Deux opérateurs testé des échantillons de contrôle faible, moyen et élevé pendant 16 jours d’exploitation sur deux systèmes de listes de distribution en parallèle. Échantillons ont été testés en double exemplaire, mais dans un ordre aléatoire sur chaque jour de test.
Le tableau 2 résume la précision au sein de l’appareil de mesure DLS pour les microparticules de pour cent (% MP) par rapport aux plaquettes.
| Contenu de microparticules | |||
| Faible | Médium | Haute | |
| Veux dire % MP (%) | 4.4 | 19,5 | 53,8 |
| Écart (%) | 1.8 | 2.6 | 5.8 |
| CV (%) | 40,4 | 13.2 | 10.6 |
Tableau 2 : précision au sein de l’appareil de microparticules pour cent (% MP). À une teneur très faible au moyen de microparticules petites plaquettes peuvent contribuer à % MP entraînant a augmenté de variabilité pour les échantillons de contenu au moyen de microparticules faible.
Le tableau 3 montre la précision au sein de l’appareil de mesure DLS pour rayon de microparticules moyenne entre 50 à 550 nm.
| Contenu de microparticules | |||
| Faible | Médium | Haute | |
| Moyenne de rayon (nm) | 331 | 161 | 188 |
| Déviation standard (mm) | 133 | 41 | 25 |
| CV (%) | 40,1 | 25.2 | 13.5 |
Tableau 3 : précision au sein de l’appareil au moyen de microparticules rayon de. À très faible au moyen de microparticules contenus petites plaquettes peuvent contribuer à microparticules pour cent (% MP) ce qui a augmenté de variabilité pour les échantillons de contenu au moyen de microparticules faible.
Le tableau 4 montre la reproductibilité des mesures de DLS pour les microparticules de pour cent (% MP).
| Contenu de microparticules | |||
| Faible | Médium | Haute | |
| Veux dire % MP (%) | 4.4 | 29.2 | 53,6 |
| Reproductibilité (%) | 1.5 | 2.3 | 5 |
| CV (%) | 35 | 11,8 | 9.4 |
Tableau 4 : Reproductibilité des mesures de diffusion de la lumière dynamique (DLS) de microparticules pour cent (% MP).
Linéarité
La figure 2 montre que les résultats de listes de distribution sont linéaires, c'est-à-diremonter une ligne droite en ce qui concerne les valeurs affectées des échantillons. Sept échantillons ont été préparés avec différents contenus de microparticules. Échantillons avec haute (MP7) et faible teneur en microparticules (MP1) et concentration de plaquettes correspondants ont été préparés et mélangés à des ratios différents pour créer des échantillons intermédiaires (MPx). Des échantillons ont été testés avec écoulement cytometry comme décrit plus haut19 et DLS et résultats % MP à chaque concentration ont été tracés en entrée et sortie. Le coefficient de détermination s’est avéré 0,985. Exemples d’histogrammes DLS pour les microparticules basse et à haute teneur sont présentés dans la Figure 3A. Les résultats de listes de distribution ont été confirmés par cytométrie en flux (Figure 3B).
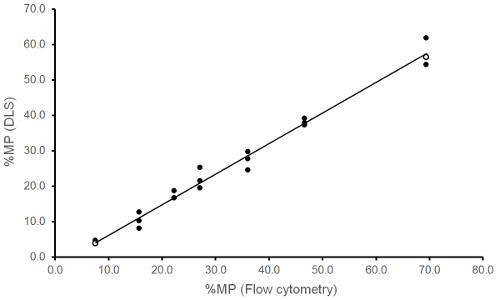
Figure 2 : Comparaison de la cytométrie en flux et DLS résultats. Une relation linéaire entre % MP déterminée par cytométrie en flux (entrée) et DLS (sortie), les données originales de listes de distribution de deux échantillons marqués par la symbole ouvert ○ sont indiquées à la Figure 3. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
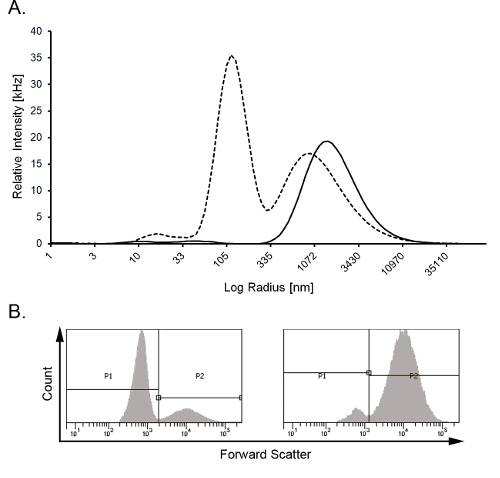
Figure 3 : Contenu de microparticules pour différencier les plaquettes activées et non activé. (A) résultats de listes de distribution de contenu de la MP en plaquettes activées (ligne pointillée) était de 57 % par rapport à 4 % dans les plaquettes non-activé (trait plein). Essais ont été réalisés à une température de mesure de 37 ° C, réglage de viscosité plasmatique de 1,06 x10-3 PA.s et réglage de l’intensité totale entre 200-600 kHz. (B) écoulement cytometry (résultats tel que décrit précédemment19) des mêmes échantillons comme indiqué en (A) ; dans les histogrammes avant dispersion P1 et P2 représentent les portes MP et plaquettes, respectivement ; pour les plaquettes activées (gauche) 76 % des événements est tombé dans le portail MP contre 6 % pour les plaquettes non-activé (à droite). La ligne de régression linéaire suggère une contribution relative constante du bruit de fond à % MP par cytométrie en flux, conduisant à des résultats toujours plus élevés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Spécificité/interférence
L’Organisation internationale de normalisation (ISO) définit la spécificité analytique comme la capacité d’une procédure de mesure pour détecter ou mesurer seulement le mesurande, bien qu’il existe des autres quantités présentes dans l’échantillon. La spécificité analytique de microparticules de dépistage peut-être être affectée par les globules rouges (RBC). DLS mesure teneur en MP par rapport au contenu des plaquettes. RBC peut interférer car la contribution de la diffusion de RBC est incluse dans la contribution de la diffusion de plaquettes, réduisant la contribution relative des MP. Il existe des limites réglementaires pour le contenu de RBC admissible dans les produits sanguins ; une conversion conservateur du seuil recommandé par AABB pour concentration admissible de RBC en plaquettes concentrés à 2 mL d’emballé RBC dans une unité de plaquettes-entraîné 8.0 x1010 cellules/L (hypothèses : volume de RBC est 8,5 x10-14L, l’hématocrite de RBC emballé est de 68 %, volume de l’unité de plaquettes est de 200 mL). Les concentrations résiduelles signalées de RBC dans différents produits sont bien en deçà de ce seuil de46.
Trois différents donateurs a fait don de plaquettes et globules rouges (RBC) sur deux jours différents, comme éligibles, pour trois expériences indépendantes. Le contenu initial de RBC dans les concentrés de plaquettes (échantillon de référence) est de 0,05 - 0,15 x109 cellules/L déterminées au moyen d’un hémocytomètre. Cinq échantillons supplémentaires ont été créés par des enrichissements en quantités connues de RBC en aliquotes de concentré plaquettaire ; niveaux cibles RBC dans ces échantillons étaient 1.0 5.0, 10, 40 et 80 x109 cellules/L.
Le seuil de l’interférence des globules rouges était environ 1,0 x1010 cellules/L (Figure 4), qui a également une corrélation avec le niveau auquel la présence de globules rouges a été visuellement évident (Figure 5). Au-dessus de ce niveau, % MP a été sous-estimé ce qui signifie que dans visuellement rouge échantillons qui contiennent RBC plutôt que de microparticules signalés l’hémoglobine, le contenu sera trop faible.
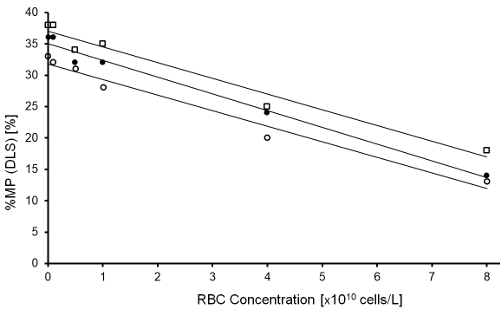
Figure 4 : Une relation linéaire entre % MP (DLS) et de la Concentration de RBC (cellules/L). Augmentation des concentrations de RBC de 0,1 x109, 1.0 x109, 5.0 x109, 1.0 x1010, 4.0 x1010et 8,0 x1010 cellules/L (de gauche à droite) de 3 expériences indépendantes (○ expérience 1, ● expérience 2, expérience □ 3, droites de régression linéaire sont indiqués pour chaque expérience). Supérieur à 1,0 x1010 RBC/L conduit à une sous-estimation de % MP. Aspect visuel des échantillons contenant de RBC est illustré à la Figure 5. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : Aspect visuel des échantillons contenant de RBC. Rougeur des plaquettes d’échantillons contenant des concentrations de RBC de 0,1 x109, 1.0 x109, 5.0 x109, 1.0 x1010, 4.0 x1010et 8,0 x1010 cellules/L, de gauche à droite. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Précision
Précision est définie comme la différence entre un résultat de mesure unique et une valeur vraie assignés à l’échantillon. Cette erreur de mesure comprend une composante systématique estimée par le biais de mesure et une composante aléatoire estimée par un écart. Ainsi, la précision d’un résultat de mesure est une combinaison de justesse et précision.
Un cordon standard a été utilisé pour déterminer l’exactitude du test DLS. Précision a été évaluée à deux concentrations au sein de la gamme cliniquement pertinente de l’essai de MP 3-75 %. Mélanges de perles de référence ont été utilisés pour préparer des échantillons de concentrations connues parce que les perles de référence ont une taille connue et une concentration. Par conséquent, perles de référence peuvent être mélangés pour obtenir des échantillons avec des concentrations et la granulométrie désirée.
Billes de polystyrène standards avec un rayon nm 125 étaient utilisées pour représenter les microparticules et perles avec 1,5 µm rayon étaient utilisées pour représenter des plaquettes. L’exactitude de l’analyse au moyen de microparticules a été évaluée avec des mélanges de perle d’environ 20 % et 50 % teneur en MP. L’exactitude des rayons particules mesurées a comparé les rayons de particules inscrites sur les certificats d’analyse pour les perles de référence tel qu’indiqué dans le tableau 5.
| 125 perles nm | 1,5 µm perles | |||||
| Certificat d’analyse | Certificat d’analyse | |||||
| 20 % MP | 50 % MP | 20 % MP | 50 % MP | |||
| Moyenne de rayon | 122,0 | 113,8 | 124,4 | 1.5 | 1.6 | 1.60 |
| Écarts-type | 4.5 | 2,83 | 3.6 | 0,035 | 0,06 | 0,07 |
| CV | 3,60 % | 2,48 % | 2,89 % | 2,20 % | 3,74 % | 4,05 % |
| Précision | 6,70 % | 2,00 % | 6,50 % | 6.30 % | ||
Tableau 5 : précision des mesures de diffusion de la lumière dynamique (DLS). Comparaison de taille pour DLS résultats au certificat d’analyse pour les perles avec 125 nm et 1,5 µm dans les mélanges.
Discussion
Ce protocole décrit une méthode de diffusion dynamique de la lumière pour le dépistage au moyen de microparticules optimisé pour les concentrations élevées de particules trouvées dans des échantillons biologiques tels que les concentrés plaquettaires. La méthode de DLS est intrinsèquement normalisée pour mesurer avec précision la taille. La concentration relative des microparticules peut être convertie en une concentration absolue si la concentration plaquettaire est connue et que la surface du pic plaquettaire est utilisée comme le pic de référence19. Comme les plaquettes, les concentrations sont habituellement obtenues avec des analyseurs d’hématologie ou cytomètres ces méthodes peuvent être considéré comme technologies de compagnon de DLS.
La fonctionnalité du système DLS est assurée en exécutant la commande perles régulièrement. L’eau distillée peut être mesurée pour vérifier que le bruit de fond est minime. Normes de plaquettes disponibles dans le commerce peuvent être analysés comme témoins MP-négatifs et, après addition de perles de rayon 125 nm, en tant que contrôles positifs MP. Dans les concentrations de gamme biologique de MP d’intérêt, les procédures sont pratiques et rapides à effectuer dans le cadre de la Banque de sang de routine.
Par opposition à la cytométrie en flux, cette méthode ne repose pas sur la comparaison de l’intensité de la diffusion des particules, mais plutôt la vitesse de leur mouvement brownien. Ainsi, les exosomes peut également être détecté malgré leur petite taille et sont présentées séparément des MP.
Conçu comme un outil de dépistage, les limitations de cette méthode sont liées à son incapacité à distinguer les différents types de microparticules. Il y a salle de potentiel d’amélioration si des mesures supplémentaires d’isolement sont utilisés ; les échantillons pourraient être testés avant et après que la suppression spécifique de microparticules par anticorps couplé capture de billes magnétiques. En outre, on ne peut présumer que tous détecté des microparticules sont cellulaire car les chylomicrons formés en hyperlipidémie47,48 et petites bactéries ou virus6 figureront également dans la gamme de microparticules. Toutefois, les autres garanties existent au sein de l’apport sanguin à éviter fortement lipémiques ou contaminés plaquettes pour entrer dans l’inventaire de banque de sang de l’hôpital.
Le choix d’anticoagulant dans l’échantillon détermine l’étendue de l’activation plaquettaire et, par conséquent, le contenu de MP49. Ce facteur doit être examinée pour les comparaisons de produits différents. En outre, échange de plasma avec MP suspension libre médias tels que PAS aura une incidence sur le contenu de la MP et le seuil pour déterminer l’hétérogénéité-si seulement environ un tiers du contenu original MP est laissé dans le plasma résiduel dans le concentré une en conséquence, seuil contenu MP indiquera le même niveau d’activation des plaquettes comme dans le plasma de 100 %. MP pour cent est le contenu de MP par rapport aux plaquettes. Auparavant, il a été signalé que le nombre de plaquettes moyenne du produit PAS était plus faible, alors que la moyenne % MP était encore 9,5 %19. Le seuil de % MP pour plaquettes PAS homologué aux États-Unis est actuellement fixé à 10 %.
Alors que la principale source de MP dans les concentrés de plaquettes est le donateur, processus qui causent du stress aux plaquettes augmentera le niveau de MP selon la susceptibilité des plaquettes au stress-si les plaquettes sont déjà fortement activés, mineur agents stressants tels que prolongé la durée de conservation, inactivation des agents pathogènes, lavage, irradiation ou transport sur de longues distances peut entraîner une augmentation significative de la teneur en MP. Aucun de ces facteurs de stress ont démontré peut influer considérablement sur les plaquettes homogènes, non activé19. En outre, l’attention doit être payée pour le risque de changements dans la composition de l’échantillon dans le tube capillaire sinon testée immédiatement après la préparation (achèvement de l’étape 3 du présent protocole).
Ce protocole porte sur la détermination de la composition des particules présentes dans les transfusions de plaquettes et d’utiliser des microparticules comme biomarqueurs de l’activation des plaquettes. Les transfusions de plaquettes sont étiquetées comme soit non-activé (orange) ou activées (rose) basée sur un seuil exprimé en pourcentage de microparticules de 15 %. Le seuil de 15 %, que député de plaquettes dans le plasma de 100 % a été déterminée empiriquement comme leème percentile de moyenne 66 de plusieurs sites.
L’objectif de gestion de l’inventaire de plaquettes issue des microparticules systématique de dépistage avec DLS est d’améliorer l’efficacité de coût patiente soins et promenade en empêchant l’affaissement des plaquettes non immuns. La mise en œuvre du système DLS pour le dépistage des sacs de plaquettes permettra à l’utilisateur de diriger des plaquettes non activé aux populations de patients plus à risque de développer le caractère réfractaire de plaquettes.
Déclarations de divulgation
EMS est le fondateur de LightIntegra Technology Inc., une entreprise d’appareils médicaux pour développer le système de ThromboLUX de microparticules et de tests de qualité de plaquettes. Tous les autres auteurs sont des employés de la technologie LightIntegra. Production et un accès gratuit à cet article sont parrainés par LightIntegra Technologies Inc.
Remerciements
Nous remercions le personnel et les donneurs de sang au Canadian Blood Services réseau Centre pour le développement appliquée pour la collecte et de production des unités de plaquettes utilisées dans cette étude. Nous reconnaissons la Fondation canadienne pour l’Innovation et de la Michael Smith Foundation for Health Research pour le financement de l’infrastructure à l’UBC Centre for Blood Research. La publication a été financée par LightIntegra Technology Inc., fabricant de ThromboLUX.
matériels
| Name | Company | Catalog Number | Comments |
| ThromboLUX-M | LightIntegra Technology Inc. | LPN120 | DLS System |
| ThromboSight Software | LightIntegra Technology Inc. | LPN124 | DLS analysis software |
| Capillaries | LightIntegra Technology Inc. (included in test kit, vendor Optinova MLE) | LPN065 | Custom extruded non-activating, non-birefringent plastic tube, inspected and irradiated |
| MiniPet | LightIntegra Technology Inc. (included in test kit, vendor TriContinent Scientific) | LPN082 | 100 µL fixed volume pipette for sampling |
| MicroFlex 1-200 µL Pipette tips | LightIntegra Technology Inc. (included in test kit, vendor ESBE Scientific) | LPN080 | Pipette tips for sampling |
| Critoseal | LightIntegra Technology Inc. (included in test kit, vendor Fisher Scientific) | LPN075 | Capillary Tube Sealant |
| Dukal Alcohol Pad or equivalent | LightIntegra Technology Inc. (included in test kit, vendor Dukal Corp.) | LPN085 | Isopropyl pad (saturated with 70% isopropyl alcohol) |
| Control beads, 50 nm radius | LightIntegra Technology Inc. (included in test kit, vendor PolySciences Inc.) | LPN128 | Control beads |
| Microbead NIST Traceable Particle Size Standard, 3 µm | PolySciences Inc. | 64060 | Standard microbeads: 1.5 µm radius Polystyrene beads; range 1.43-1.58 µm; 1% solids suspensions in de-ionized water |
| Nanobead NIST Traceable Particle Size Standard, 250 nm | PolySciences Inc. | 64014-15 | Standard nanobeads: 125 nm radius Polystyrene beads; range 120 - 130 nm; 1% solids suspensions in de-ionized water |
| Genesis BPS RapidSeal II or equivalent | Genesis BPS | 428-SE640 | Tube sealer |
| Fresenius Kabi Tube Stripper or equivalent | Fresenius Kabi | 6R4452 | Manual tube stripper |
| Biohazard Shield - Cell Counter or equivalent | CardinalHealth | S1389-75 | Splash Shield |
| Corning LSE Vortex Mixer or equivalent | Corning Incorporated | 6775 | Vortex mixer |
| FACSCanto II Flow cytometer with FACSDiva software version 6.1.3 or equivalent | BD Biosciences | 338960 | Flow cytometer |
Références
- Dinkla, S., et al. Platelet microparticles inhibit IL-17 production by regulatory T cells through P-selectin. Blood. 127 (16), 1976-1986 (2016).
- Yin, W., Ghebrehiwet, B., Peerschke, E. I. Expression of complement components and inhibitors on platelet microparticles. Platelets. 19 (3), 225-233 (2008).
- Aatonen, M., Gronholm, M., Siljander, P. R. Platelet-derived microvesicles: multitalented participants in intercellular communication. Semin Thromb Hemost. 38 (1), 102-113 (2012).
- Suades, R., Padro, T., Alonso, R., Mata, P., Badimon, L. High levels of TSP1+/CD142+ platelet-derived microparticles characterise young patients with high cardiovascular risk and subclinical atherosclerosis. Thromb Haemost. 114 (6), 1310-1321 (2015).
- Obeid, S., et al. Development of a NanoBioAnalytical platform for "on-chip" qualification and quantification of platelet-derived microparticles. Biosens Bioelectron. 93, 250-259 (2017).
- Witwer, K. W., et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles. 2, (2013).
- Lacroix, R., Robert, S., Poncelet, P., Dignat-George, F. Overcoming Limitations of Microparticle Measurement by Flow Cytometry. Semin Thromb Hemost. 36 (8), 807-818 (2010).
- Lacroix, R., et al. Standardization of platelet-derived microparticle enumeration by flow cytometry with calibrated beads: results of the International Society on Thrombosis and Haemostasis SSC Collaborative workshop. J Thromb Haemost. 8 (11), 2571-2574 (2010).
- Shah, M. D., Bergeron, A. L., Dong, J. F., Lopez, J. A. Flow cytometric measurement of microparticles: pitfalls and protocol modifications. Platelets. 19 (5), 365-372 (2008).
- Nolan, J. P., Jones, J. C. Detection of platelet vesicles by flow cytometry. Platelets. 28 (3), 256-262 (2017).
- Connor, D. E., Exner, T., Ma, D. D., Joseph, J. E. The majority of circulating platelet-derived microparticles fail to bind annexin V, lack phospholipid-dependent procoagulant activity and demonstrate greater expression of glycoprotein Ib. Thromb Haemost. 103 (5), 1044-1052 (2010).
- Inglis, H., Norris, P., Danesh, A. Techniques for the analysis of extracellular vesicles using flow cytometry. J Vis Exp. (97), (2015).
- Inglis, H. C., et al. Techniques to improve detection and analysis of extracellular vesicles using flow cytometry. Cytometry A. 87 (11), 1052-1063 (2015).
- van der Pol, E., Coumans, F., Varga, Z., Krumrey, M., Nieuwland, R. Innovation in detection of microparticles and exosomes. J Thromb Haemost. 11, 36-45 (2013).
- Boudreau, L. H., et al. Platelets release mitochondria serving as substrate for bactericidal group IIA-secreted phospholipase A2 to promote inflammation. Blood. 124 (14), 2173-2183 (2014).
- Rousseau, M., et al. Detection and quantification of microparticles from different cellular lineages using flow cytometry. Evaluation of the impact of secreted phospholipase A2 on microparticle assessment. PLoS One. 10 (1), 0116812 (2015).
- Groot Kormelink, T., et al. Prerequisites for the analysis and sorting of extracellular vesicle subpopulations by high-resolution flow cytometry. Cytometry A. 89 (2), 135-147 (2016).
- van der Vlist, E. J., Nolte-'t Hoen, E. N., Stoorvogel, W., Arkesteijn, G. J., Wauben, M. H. Fluorescent labeling of nano-sized vesicles released by cells and subsequent quantitative and qualitative analysis by high-resolution flow cytometry. Nat Protoc. 7 (7), 1311-1326 (2012).
- Maurer-Spurej, E., Larsen, R., Labrie, A., Heaton, A., Chipperfield, K. Microparticle content of platelet concentrates is predicted by donor microparticles and is altered by production methods and stress. Transfus Apher Sci. 55 (1), 35-43 (2016).
- Maurer-Spurej, E., et al. Platelet quality measured with dynamic light scattering correlates with transfusion outcome in hematologic malignancies. Transfusion. 49 (11), 2276-2284 (2009).
- Hess, J. R., et al. Clinical and laboratory correlates of platelet alloimmunization and refractoriness in the PLADO trial. Vox Sang. 111 (3), 281-291 (2016).
- Doughty, H. A., et al. Relative importance of immune and non-immune causes of platelet refractoriness. Vox Sang. 66 (3), 200-205 (1994).
- Vassallo, R. R., Norris, P. J. Can we "terminate" alloimmune platelet transfusion refractoriness. Transfusion. 56 (1), 19-22 (2016).
- Anderson, W., Kozak, D., Coleman, V. A., Jaemting, A. K., Trau, M. A comparative study of submicron particle sizing platforms: Accuracy, precision and resolution analysis of polydisperse particle size distributions. J colloid inter sci. 405, 322-330 (2013).
- Gyoergy, B., et al. Improved Flow Cytometric Assessment Reveals Distinct Microvesicle (Cell-Derived Microparticle) Signatures in Joint Diseases. Plos One. 7 (11), 49726-49726 (2012).
- Urey, C., et al. Combining gas-phase electrophoretic mobility molecular analysis (GEMMA), light scattering, field flow fractionation and cryo electron microscopy in a multidimensional approach to characterize liposomal carrier vesicles. Int J Pharm. 513 (1-2), 309-318 (2016).
- Mohr, K., et al. Evaluation of multifunctional liposomes in human blood serum by light scattering. Langmuir. 30 (49), 14954-14962 (2014).
- Maurer-Spurej, E., Brown, K., Labrie, A., Marziali, A., Glatter, O. Portable dynamic light scattering instrument and method for the measurement of blood platelet suspensions. Physics in Medicine and Biology. 51 (15), 3747-3758 (2006).
- Arraud, N., et al. Extracellular vesicles from blood plasma: determination of their morphology, size, phenotype and concentration. J Thromb Haemost. 12 (5), 614-627 (2014).
- Ambrose, A. R., Alsahli, M. A., Kurmani, S. A., Goodall, A. H. Comparison of the release of microRNAs and extracellular vesicles from platelets in response to different agonists. Platelets. , 1-9 (2017).
- Buzas, E. I., Gardiner, C., Lee, C., Smith, Z. J. Single particle analysis: Methods for detection of platelet extracellular vesicles in suspension (excluding flow cytometry). Platelets. 28 (3), 249-255 (2017).
- Stoner, S. A., et al. High sensitivity flow cytometry of membrane vesicles. Cytometry A. 89 (2), 196-206 (2016).
- Labrie, A., Marshall, A., Bedi, H., Maurer-Spurej, E. Characterization of platelet concentrates using dynamic light scattering. Transfus Med Hemother. 40 (2), 93-100 (2013).
- Ueba, T., et al. Plasma level of platelet-derived microparticles is associated with coronary heart disease risk score in healthy men. J Atheroscler Thromb. 17 (4), 342-349 (2010).
- Badimon, L., Suades, R., Fuentes, E., Palomo, I., Padro, T. Role of Platelet-Derived Microvesicles As Crosstalk Mediators in Atherothrombosis and Future Pharmacology Targets: A Link between Inflammation, Atherosclerosis, and Thrombosis. Front Pharmacol. 7, 293 (2016).
- Berezin, A. E., Kremzer, A. A., Berezina, T. A., Martovitskaya, Y. V. The pattern of circulating microparticles in patients with diabetes mellitus with asymptomatic atherosclerosis. Acta Clin Belg. 71 (1), 38-45 (2016).
- Marcoux, G., et al. Microparticle and mitochondrial release during extended storage of different types of platelet concentrates. Platelets. 28 (3), 272-280 (2017).
- Yanez-Mo, M., et al. Biological properties of extracellular vesicles and their physiological functions. J Extracell Vesicles. 4, 27066 (2015).
- Reddoch, K. M., et al. Hemostatic function of apheresis platelets stored at 4 degrees C and 22 degrees C. Shock. 41, 54-61 (2014).
- Kelly, A. M., et al. The effect of variation in donor platelet function on transfusion outcome: a semirandomized controlled trial. Blood. 130 (2), 214-220 (2017).
- Peerschke, E. I., Yin, W., Ghebrehiwet, B. Platelet mediated complement activation. Adv Exp Med Biol. 632, 81-91 (2008).
- Redman, C. W., Sargent, I. L. Microparticles and immunomodulation in pregnancy and pre-eclampsia. J Reprod Immunol. 76 (1-2), 61-67 (2007).
- Ripoche, J. Blood platelets and inflammation: their relationship with liver and digestive diseases. Clin Res Hepatol Gastroenterol. 35 (5), 353-357 (2011).
- Ling, Z. L., Combes, V., Grau, G. E., King, N. J. Microparticles as immune regulators in infectious disease - an opinion. Front Immunol. 2, 67 (2011).
- Melki, I., Tessandier, N., Zufferey, A., Boilard, E. Platelet microvesicles in health and disease. Platelets. 28 (3), 214-221 (2017).
- Culibrk, B., et al. Application of the ADVIA cerebrospinal fluid assay to count residual red blood cells in blood components. Vox Sang. 103 (3), 186-193 (2012).
- Connolly, K. D., et al. Lipoprotein-apheresis reduces circulating microparticles in individuals with familial hypercholesterolemia. J Lipid Res. 55 (10), 2064-2072 (2014).
- Mork, M., et al. Prospects and limitations of antibody-mediated clearing of lipoproteins from blood plasma prior to nanoparticle tracking analysis of extracellular vesicles. J Extracell Vesicles. 6 (1), 1308779 (2017).
- Raczat, T., et al. The influence of four different anticoagulants on dynamic light scattering of platelets. Vox Sang. 107 (2), 196-199 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon