Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Surveillance de cellule à cellule Transmission des agrégats de protéine Prion chez Drosophila Melanogaster
Dans cet article
Résumé
Accumulation de preuves souscrit l’idée qu’agrégats de protéine pathogène est associée aux maladies neurodégénératives répartis entre les cellules ayant des propriétés prion. Nous décrivons ici une méthode qui permet la visualisation de cellule à cellule propagation des agrégats de type prion dans l’organisme modèle, Drosophila melanogaster.
Résumé
Agrégation des protéines est un élément central de la plupart des maladies neurodégénératives, y compris la sclérose latérale amyotrophique (SLA), maladie de Huntington (MH), la maladie d’Alzheimer (ma) et maladie de Parkinson (MP). Agrégats de protéines sont étroitement associées à la neuropathologie dans ces maladies, bien qu’on ne connaît pas le mécanisme exact par lequel agrégation de protéines aberrantes perturbe l’homéostasie cellulaire normale. Nouvelles données fort appuyer l’hypothèse qu’agrégats pathogènes en AD, PD, HD, et ALS ont beaucoup de similitudes aux prions, qui sont des protéines uniquement les agents infectieux responsables des encéphalopathies spongiformes transmissibles. Prions répliquent par la création de modèles la conversion des versions nativement plié de la même protéine, entraînant la propagation du phénotype agrégation. Comment prions et protéines de type prion dans AD, PD, HD et ALS déplacer d’une cellule à l’autre est actuellement un domaine de recherche intense. Ici, un modèle de Drosophila melanogaster qui permet une surveillance de transmission de prion-like, cellule-cellule des agrégats de la huntingtine mutante (Htt) associé à HD est décrite. Ce modèle tire parti des outils puissants pour manipuler l’expression du transgène dans de nombreux tissus différents de drosophile et utilise une protéine cytoplasmique fluorescent-étiquetées directement rapport à prions comme transfert de mutant Htt agrégats. Ce qui est important, l’approche que nous décrivons ici peut servir à identifier de nouveaux gènes et voies qui médient propagation d’agrégats de protéines entre diverses cellules types in vivo. Information obtenue grâce à ces études étendra la compréhension limitée des mécanismes pathogènes qui sous-tendent les maladies neurodégénératives et révéler de nouvelles possibilités d’intervention thérapeutique.
Introduction
L’hypothèse de prion stipule que l’agent infectieux responsable pour les encéphalopathies spongiformes transmissibles (p. ex., maladie de Creutzfeldt - Jakob chez les humains, la tremblante du mouton, maladie du dépérissement chronique chez les cerfs et de wapitis et « maladie de la vache folle » chez les bovins ) est uniquement composé de protéines et dépourvu d’acides nucléiques1. Dans les maladies de prion, la protéine prion cellulaire (PrPC) suppose un pli non indigènes, stable (PrP-Sc) qui est hautement bêta feuille riche et peut se propager autonome en convertissant et recruter des molécules monomères de PrPC pour amyloïde stable agrégats. PrPSc agrégats utilisent ce mécanisme auto-répliquant de répartir entre les différentes cellules dans l’organisme et même entre des organismes individuels2.
Repliement et agrégation est également un élément central de la plupart des maladies neurodégénératives (maladie d’Alzheimer (ma), maladie de Parkinson (MP), maladie de Huntington (MH) et la sclérose latérale amyotrophique (SLA))3. Formation des assemblées intra - ou extra-cellulaires protéines agrégées dans ces maladies est étroitement associée à la cytotoxicité4 et progresse le long de chemins très reproductibles et propres à la maladie à travers le cerveau au cours du temps5, 6. ces schémas de propagation suggèrent que des agrégats pathogènes associés à ces troubles ont des propriétés de type prion. Fort soutien existe maintenant pour la transmission de prion-comme des agrégats associés à annonce, PD, HD et ALS - elles s’étendent de cellule-cellule et modèle le changement conformationnel de formes monomères de la même protéine dans les cellules affectées précédemment7, 8.
La plupart des études portant sur la propagation du prion comme des agrégats de protéine à ce jour ont été effectuée à l’aide de modèles de culture de cellules de mammifères, où agrégats transvaser dans le cytoplasme des cellules naïves de l’espace extracellulaire ou d’une autre cellule cytoplasme9,10,11,12,13,14,15, ou en injectant des matériaux contenant de l’agrégat dans le cerveau de souris et surveillance agréger l’apparence à l’extérieur de l’injection site16,17,18,19,20,21,22, 23. plus récemment, les animaux transgéniques ont été utilisés pour démontrer que des agrégats intracellulaires se propager à d’autres cellules dans le cerveau intact24,25,26,27, 28,29,30. Nous décrivons ici une méthode pour une visualisation directe de cession globale entre différentes cellules dans le cerveau intact de Drosophila melanogaster. Modèles de drosophile de HD/polyglutamine (polyQ) maladies ont été développés tout d’abord il y a près de vingt ans31,32 et ont fourni beaucoup de précieux conseils sur les mécanismes pathogènes qui sous-tendent ces troubles 33. HD est une maladie neurodégénérative héréditaire causée par une mutation autosomique dominante du gène codant pour la protéine huntingtine (Htt)34. Cette mutation se traduit par l’élargissement d’un tronçon de polyQ près aminée de Htt au-delà d’un seuil pathogène de ~ 37 glutamate, causant les protéines à repliement et agrégation35,36. Protéines de Htt sauvage contenant < 37 glutamate dans ce tronçon atteindre leur giron natif, mais peuvent être induites à global sur le contact physique direct avec un Htt globale « graine »12,27,37. Nous exploitons cette homotypique, nucléée agrégation de Htt sauvage comme une lecture pour le transfert de type prion et entrée cytoplasmique de mutant Htt agrégats originaires d’autres cellules.
Détermination des mécanismes de quels agrégats prion comme voyage entre les cellules peut conduire à l’identification de nouvelles cibles thérapeutiques pour les maladies neurodégénératives incurables. Nous prenons l’avantage du cycle de vie rapid, facilité d’utilisation et la traçabilité génétique de Drosophila melanogaster de définir des mécanismes moléculaires de la cellule-cellule propagation du mutant Htt agrégats. Notre stratégie expérimentale utilise deux systèmes d’expression binaire disponibles dans drosophile, le bien établi Gal4 spécifiques en amont activant séquence (Gal4-UAS) système38 et le récemment développés QF-QUAS système39. Ces deux systèmes indépendants de couplage permet de restreindre l’expression de transgènes Htt mutant et sauvage aux populations cellulaires distincts au sein de la même mouche40. En utilisant cette approche, nous examinons prion comme propagation du mutant Htt en surveillant la redistribution des cytoplasmique Htt sauvage de son état normalement diffuse, soluble à un état agrégé, conséquence directe d’un contact physique avec un mutant pré-formé Htt agrégat « semence ». Conversion de type sauvage Htt par mutant Htt peut être confirmée en utilisant biochimiques ou de transfert de techniques biophysiques qui signalent des interactions protéine-protéine, tels que l’énergie de résonance de fluorescence (FRET)9,27,41 .
Ce qui est important, nous pouvons également accéder à un grand nombre d’outils génétiques chez la drosophile pour identifier des gènes et/ou des voies qui véhiculent la propagation du prion comme des agrégats de protéine. Nous avons récemment utilisé cette approche pour dévoiler un rôle clé pour le récepteur scavenger surface des cellules,42,Draper43, en transférant mutant Htt agrégats d’axones neurones à proximité glia phagocytaire chez la drosophile central système nerveux (SNC)27. Ainsi, l’approche génétique et d’imagerie dotés que nous décrivons ici peut révéler des informations biologiques base importantes concernant un phénomène maladie pertinents dans le simple à utiliser mais puissant organisme, drosophile.
Protocole
1. accouplement à médiation Gal4 et QF Htt Transgene Expression chez la drosophile
- Recueillir ou générer transgéniques Drosophila melanogaster lignes contenant tissu-spécifique Gal4 ou QF « pilotes », ainsi que les lignes contenant le type sauvage ou mutant transgènes Htt en aval du Gal4-UAS38 ou QF-QUAS39. Veiller à ce que les protéines qui sont exprimés de ces transgènes sont soudés aux protéines fluorescentes ou épitope-tag pour permettre la différenciation des mutants et sauvage Htt transgène produits dans la même volée. Voir la Figure 1.
Remarque : Nous utilisons généralement des fragments de l' humain du gène Htt27exon 1. Cependant, mouches transgéniques peuvent plutôt être générés pour exprimer plus Htt fragments ou autres gènes si vous le souhaitez. - Planifier la stratégie génétique telle que les transgènes Htt mutant et sauvage seront exprimés dans les populations de cellules distinctes, non chevauchantes.
- En cas de chevauchement expression, mutantes et sauvage Htt protéines synthétisées dans les mêmes cellules seront conjointement agréger et empêcher la détection d’événements de type prion. Pour éviter cela, utilisez les répresseurs spécifiques Gal4 et QF, Gal80 et QS40, respectivement (Figure 1). Sélection pilotes Gal4 et/ou QF développemental contrôlé peut aide à limiter l’expression du mutant Htt à cellules post-mitotiques, éliminant la possibilité que la division cellulaire pourrait contribuer à la diffusion globale de cellule-cellule.
- À l’aide de conditions normales de culture, s’accoupler les mouches pour générer la progéniture qui expriment la population de cellules mutante Htt via QF (ou Gal4) dans un « donneur » et population cellulaire de type sauvage Htt via Gal4 (ou QF) dans un « récipient ». Voir la Figure 1 pour un schéma montrant un mélange génétique possible.
Remarque : Les pilotes QF et Gal4 qui ont été utilisés pour générer les données présentées dans les Figures 1-4 et dans notre précédente publication27 incluent le pilote de neurone (ORN) de récepteurs olfactifs DA1, Or67d-QF et le pilote pan-gliales, repo-Gal4. - Générer des mouches de contrôle en parallèle qui expriment Htt sauvage dans les deux populations de cellules QF et Gal4-marqués.
- Recueillir des descendants du génotype désiré et âge les animaux selon le cas.
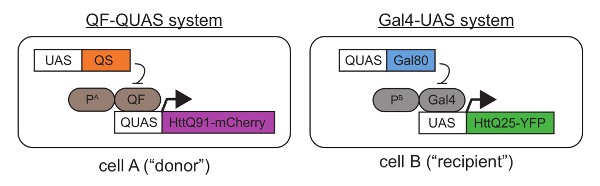
Figure 1 . Une approche génétique pour couplé expression de transgènes Htt mutant et sauvage en utilisant les systèmes d’expression binaire QF-QUAS et Gal4-UAS. « Cellule A, » une mCherry-tag mutant Htt protéine contenant un tronçon de pathogènes longueur polyQ (Q91) est exprimée en utilisant un pilote de QF situé en aval d’un promoteur spécifique aux tissus un (« PA»). « Les cellules B, » une YFP-tag sauvage Htt contenant un tronçon de polyQ normal (Q25) est exprimée via un pilote de Gal4 contrôlé par promoteur spécifique aux tissus B (« PB»). Dans les Figures 2-4, Or67d-QF a été utilisé pour exciter QUAS-HttQ91-mCherry expression dans DA1 Orn et repo-Gal4 servait à exprimer le SAMU-HttQ25-YFP dans toutes les cellules gliales27. Ce qui est important, HttQ91-mCherry n’est exprimée dans les cellules exprimant le QF en vertu de la séquence QUAS placé en amont du transgène. De même, HttQ25-YFP n’est exprimée par l’intermédiaire de Gal4, qui reconnaît spécifiquement la SAMU. Si tout chevauchement dans la distribution tissulaire des pilotes QF et Gal4 est détecté, les transgènes codant QS dans les cellules exprimant Gal4 et Gal80 dans les cellules exprimant le QF peut être introduit. L’ajout de balises de la protéine fluorescente sur le sauvage et le mutant Htt permet la différenciation des deux protéines durant l’imagerie et la capacité de mesurer la frette entre paires de donneur/accepteur approprié (par exemple, CFP/YFP ou YFP/mCherry). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
2. micro-dissection et Fixation du cerveau adulte Drosophila
Remarque : Cette procédure de dissection a été modifiée par une précédente publication44et peut être utilisée pour préparer les cerveaux d’imagerie par fluorescence directe signal de fusions de protéine fluorescente Htt. Modifications à la procédure qui peut être fait pour immunostaining les cerveaux sont discutées dans la section suivante.
- Collecter les matériaux suivants et placer sur la glace : une solution saline tamponnée au phosphate contenant 0,03 % Triton X-100 (PBS/T) ; tubes de microcentrifuge contenant 970 µL de solution de fixation de paraformaldéhyde à 4 % (PFA) préparée en ajoutant 200 µL 20 % PFA à 770 µL PBS/T ; un plat de verre transparent contenant des puits ; une pipette de transfert jetable ; deux pinces de dissection (un n ° 3 et un n ° 5).
- Anesthésier les mouches adultes à l’aide de CO2 et de les transférer dans un puits du verre plat sur la glace.
- À l’aide d’une pipette de transfert, ajouter une petite quantité (~ 500 µL) de PBS/T froid dans la cupule contenant les mouches ainsi qu’un puits vide. Éviter d’introduire trop de bulles, car ils peuvent interférer avec la dissection.
- Placez le plat en verre sur une surface plane sous un microscope à dissection et ajustez le grossissement jusqu'à ce que le corps de mouche remplit le champ de vision et est en discussion.
- Placez une paire de sources lumineuses à col de cygne pour que la lumière illumine les deux côtés du verre plat. Un tissu plié lab sous le plat en verre à jeter des pièces de corps/cuticule au cours de la dissection de l’ancre.
- À l’aide de la pince n ° 3 dans la main non dominante, transférer une seule mouche dans le contenant bien PBS/T. immobiliser la volée en saisissant la main sur son abdomen avec la face ventrale vers le haut.
- En gardant la volée entièrement submergée PBS/T, sortez la tête de mouche avec la pince n ° 5 dans la main dominante. Insérez une extrémité de cette pince sous la cuticule dans le petit espace adjacent à la trompe d’un côté de la tête de mouche. Fixer la poignée sur la tête en pinçant la pince pour s’emparer de le œil des deux côtés.
- Retirez la tête de mouche de son corps en tirant les deux pinces. Jeter le corps de mouche sur un tissu de laboratoire placé à proximité. Maintenir la pression sur la pince de la main dominante afin que la tête de mouche n’est pas perdue.
- Une astuce de position de la pince de N3 dans le non dominant la main dans le même petit espace sous la cuticule de l’autre côté de la trompe. Une fois en place, pincer les pinces pour serrer les yeux au même endroit sur les deux côtés de la tête.
- Une fois la poignée sur la cuticule est sécurisée, tirer doucement la pince apart à 180°. Cette action se sépareront la cuticule tête sans endommager le cerveau. Jeter les résidus de cuticule sur un tissu de laboratoire.
- Bien qu’idéale, la cuticule tête ne peut-être totalement quitter en une seule étape. Dans ce cas, retirer la cuticule pièce par pièce, jusqu'à ce que le cerveau est entièrement exposé. Prendre soin de ne pas pour endommager le cerveau en évitant le contact direct avec la pince.
- Enlever le cerveau disséqué de la PBS/T ahold saisissant d’une trachée ci-joint, ou en aspirant le cerveau dans l’espace entre les extrémités des pinces par capillarité.
NOTE : Suppression de la trachée est facultative, car elle tend à ne pas occulter les lobes antennaires sur la surface antérieure du cerveau où nous image en général. Toutefois, si la trachée interférer avec l’imagerie, enlevez-les soigneusement afin que le cerveau n’est pas endommagé par cette manipulation. - Transvaser le cerveau mouche dans un des tubes de microcentrifuge contenant la solution de fixation sur la glace. Veiller à ce que le cerveau se détache de la pince et qu’il est immergé dans la solution de fixation.
- Une fois que tous les cerveaux ont été disséqués, les soumettre à un « court-fix » en plaçant les tubes fermés sur un nutator pour ~ 5 min à température ambiante dans l’obscurité.
Remarque : Cette étape courte fixation assure que les cerveaux sont plus faciles à gérer dans les étapes suivantes et n’adhèrent pas aux parois du tube microcentrifuge. - Retirez la majorité de la solution de fixation avec une pipette P1000 et jetez-le.
- Éviter d’aspirer des cerveaux du tube au courant et n’importe quelle étape de lavage ultérieures. Affectez le P1000 un volume inférieur (par exemple, 650 µL) et retirez le surnageant en deux étapes. En outre, tenir les tubes de microcentrifuge conformément à une source de lumière (par exemple les plafonniers) lors de l’aspiration pour mieux visualiser le cerveau.
- Ajouter 1 mL de PBS frais/T dans le cerveau. Laver rapidement (< 1 min) dans l’obscurité, aspirer le surnageant de la cervelle et jeter.
- Répéter le lavage avec PBS/T dans l’obscurité à température ambiante selon l’horaire suivant : 2 lavages rapides (< 1 min), 1 X 5 min, 3 X 20 min et lavage de 1 X 1 h. Sécuriser le dessus sur les tubes de microcentrifuge et placer les tubes sur une nutator entre les lavages.
- Si une coloration DAPI est souhaitée, remplacer le lavage final 1 h avec 1 X 30 min d’incubation avec 250 ng/mL DAPI dilué dans du PBS/T, suivi par 2 X rapide et 1 X 20 min lavages.
- Après le dernier lavage, enlever la majorité du surnageant de tampon de lavage, en prenant soin de ne pas pour déranger le cerveau et ajouter 30 µL de réactif antifade à base de glycérol sur le cerveau. Incuber à 4 ° C dans l’obscurité sans mouvement pendant au moins 1 h et jusqu'à 24h.
3. modifications à la Section 2 pour cerveaux Immunostaining adulte
Remarque : Utiliser ce protocole pour l’imagerie des protéines fluorescentes ou de fusions de la protéine fluorescente avec fluorescence faible.
- Augmenter la concentration de Triton X-100 PBS/t par un facteur 10 (PBS + 0,3 % Triton X-100) pour chaque étape. Cela garantit que suffisamment de détergent est présent pour permeabilize des membranes cellulaires et permettent d’accéder aux espaces intracellulaires, les anticorps.
- Difficulté les cerveaux de 4 % PFA dans PBS/T pendant 20 min à température ambiante.
- Après avoir effectué tous les lavages, incuber 30 min à température ambiante dans l’obscurité le cerveau dans un tampon bloquant fraîchement préparés (PBS/T + 5 % de sérum de chèvre normal (NGS)).
- Retirer et jeter le tampon de blocage. Ajouter 0,5 mL de solution d’anticorps primaire par tube préparé comme un mélange maître en diluant les anticorps primaires selon qu’il conviendra dans un tampon bloquant fraîche (voir Table des matières pour les anticorps couramment utilisés et les dilutions). Incuber les cerveaux de l’anticorps primaires sur un nutator pendant au moins 24 h à 4 ° C dans l’obscurité.
- Enlever la solution de l’anticorps primaire du cerveau à l’aide d’un P1000 et réserver dans un nouveau tube. Ajouter 1 mL de PBS/T pour laver le cerveau.
Remarque : La solution d’anticorps primaires réservés peut être stockée à 4 ° C pendant quatre semaines. Nous avons avec succès recyclé anticorps primaires jusqu'à deux fois dans des expériences ultérieures. - Laver le cerveau rapidement (< 1 min) en PBS/T, aspirer le surnageant de cerveaux et jeter. Répéter une fois de plus ce lavage rapide.
- Continuer à laver avec 1 mL de PBS/T à la température ambiante selon l’horaire suivant : 1 X 5 min, 3 X 20 min et lavage de 1 X 1 h. Sécuriser le dessus sur les tubes de microcentrifuge et placer les tubes sur un nutator au cours de lavages.
- Après le dernier lavage, enlever la majorité du liquide surnageant PBS/T et ajouter 0,5 mL de solution d’anticorps secondaire préparée comme un mélange maître en diluant les anticorps selon qu’il conviendra dans un tampon bloquant fraîche (voir Table des matières pour les anticorps couramment utilisés et les dilutions). Incuber les cerveaux des anticorps secondaires pendant 24 h à 4 ° C dans l’obscurité.
- Répétez les étapes de lavage en étapes 3.5, 3.6 et 3.7 après incubation avec l’anticorps secondaires.
- Après le lavage final, retirer la majorité de la mémoire tampon de lavage et s’assurer que tous les cerveaux est situés au fond du tube. Ajouter 30 µL de réactif d’antifade à la cervelle. Incuber à 4 ° C dans l’obscurité sans mouvement pendant 16 à 24 heures.
4. cerveau montage
- Placez une lame de microscope de verre sous un microscope à dissection et l’étiquette des informations d’identification.
Remarque : Par ailleurs, le cerveau peut être monté directement sur une lamelle couvre-objet pour accéder aux deux côtés du cerveau au cours de l’imagerie. Un protocole décrivant cette procédure de montage a été précédemment publié45. - Retirer le cerveau de chaque tube de microcentrifuge en utilisant un embout de la pipette atténuée (préparés à l’aide d’une lame de rasoir pour supprimer le fond ~ 1 cm sur une pointe de 1-200 µL) et de les transférer au milieu de la diapositive. Transfert comme peu réactif antifade avec le cerveau que possible.
- Forceps permet de placer le cerveau dans l’orientation désirée (par exemple, pointant vers le haut de la lame et la surface antérieure vers le haut pour l’imagerie du lobe antennaire dorsale). Lorsque vous orientant les cerveaux, envisagez le trajet optique du microscope à utiliser pour leur imagerie.
- Retirez antifade excès de réactif de la diapositive à l’aide de l’angle pointu d’un tissu plié lab sans déranger le cerveau. Laisser la diapositive pour ~ 5-10 min à l’obscurité pour permettre les cerveaux d’adhérer à la diapositive.
- Entourent le cerveau mouche avec quatre petits morceaux de verre brisé de couverture placés de chaque côté des cerveaux pour former un carré qui est ~ 19 mm x 19 mm. Placez un bord d’un verre de couverture de 22 x 22 mm no 1.5 juste à l’extérieur de l’un de ces petits morceaux de verre et abaissez doucement la lamelle sur le cerveau pour achever le pont-Mont.
- Lentement dispense de frais antifade réactif pour remplir la surface sous la lamelle, en veillant à ne pas perturber la lamelle ou le cerveau. Essuyez tout excès antifade utilisant le coin pointu d’un tissu plié lab sans contacter directement la lamelle.
- Ajouter une goutte de vernis à ongles clair, à séchage rapide pour chacun des quatre coins de la lamelle. Laisser pour sécher pendant ~ 10 min. Puis, Scellez les quatre bords de la lamelle avec vernis à ongles pour enfermer complètement le cerveau.
- Image du cerveau immédiatement, ou à conserver à 4 ° C jusqu’au moment.
- Si l’imagerie de fluorescence intrinsèque de fusions de protéine fluorescente Htt, image du cerveau dans les 24h pour le meilleur signal.
5. imagerie et quantification de Transmission de Prion-comme des agrégats
- Le cerveau monté à l’aide d’un microscope confocal, équipé d’un 40 X ou 60/63 X objectif huile pour recueillir des images de z-tranche à travers la région du cerveau où les pilotes sélectionnés de Gal4 et QF sont exprimés (Figure 2A, B) de l’image.
- Exciter les fusions de la protéine fluorescente ou protéines immunomarquées en utilisant les lasers appropriées (p. ex., 488 nm pour GFP/YFP/FITC ou 552 nm pour mCherry/Cy3). Configurer windows de détection que la capture fluorescentes maximale du signal tout en éliminant les canaux diaphonie en utilisant soit un système de détection spectrale ou bande/long passer les filtres d’émission spécifiques pour chaque fluorophore.
NOTE : Soyez attentifs lors de l’imagerie des agrégats de protéine. Il est facile pour les pixels dans le centre de chaque agrégat se saturer, surtout dans les grands agrégats. Essayez de réduire la saturation de l’image, mais être conscient du risque de perdre le signal de plus petits agrégées espèces (Figure 2B, C, D). Trop forte saturation augmentera l’arrière-plan de l’image, rendant plus difficile d’identifier l’examen isolé. Tester différents réglages d’imagerie d’optimiser avant de prendre les images finales dans chaque ensemble de données.
- Exciter les fusions de la protéine fluorescente ou protéines immunomarquées en utilisant les lasers appropriées (p. ex., 488 nm pour GFP/YFP/FITC ou 552 nm pour mCherry/Cy3). Configurer windows de détection que la capture fluorescentes maximale du signal tout en éliminant les canaux diaphonie en utilisant soit un système de détection spectrale ou bande/long passer les filtres d’émission spécifiques pour chaque fluorophore.
- Analyser les données en quantifiant l’examen individuel soit manuellement en déplaçant par z-tranches individuelles (p. ex.,C de la Figure 2et Figure 4A) ou après avoir rendu les tranches confocale en 3 dimensions (Figure 3 A, B).
Remarque : Ceci peut être fait en Image J ou autre logiciel de traitement d’image.- Si les agrégats sont bien séparées, et il n’y a fluorescence de fond minimal, utilisez image analyse logiciel pour systématiquement identifier, quantifier et d’analyser les agrégats distincts « objets » ou « surfaces » une reconstruction 3D de la pile confocale ( Figure 3 ( B).
Remarque : Logiciel actions décrites sont spécifiques à l’instrument et le logiciel utilisé ici (voir la Table des matières).- Visualiser un z-series confocale en mode de visualisation 3D. L’Assistant « Analyse » permet d’identifier des points individuels dans un canal sélectionné (par exemple le canal rouge pour HttQ91-mCherry agrège à la Figure 3). Ajustez le seuil et les filtres pour représenter avec précision tous les agrégats de taille hétérogène en tant qu’objets individuels dans l’image.
- Activer « Diviser les objets » sous « Binaire traitement préfiltre » pour séparer les étroitement associées à des agrégats qui sont anormalement fusionnés par l’algorithme du logiciel. Noter que le nombre total d’objets et de leurs mesures associées est signalé sous « Mesure ».
Remarque : Cette méthode de quantification mutant Htt agrégats n’est pas se prête au protocole immunostaining parce que le Centre des agrégats amyloïdes, est impénétrable aux anticorps. Ainsi, les agrégats apparaissent sur le microscope comme des structures annulaires, et logiciel d’analyse image est incapable d’identifier et de distinguer ces différents « spots » avec précision.
- Quantifier les agrégats Htt sauvage en parcourant la pile-z manuellement et en marquant des agrégats de Htt sauvage, veillant à ce qu’aucun agrégat n’est double-marqué si elles apparaissent dans plus d’une tranche (Figure 4A).
Remarque : Cette méthode de quantification manuelle peut être utilisée lorsque le nombre d’agrégats dans chaque pile confocal est raisonnable (par exemple, 20-50). Il est également utile lorsque le logiciel d’analyse image ne peut pas distinguer examen individuel de signal environnante dans le même canal (par exemple, signal de diffus Htt sauvage dans les cellules voisines) (Figure 2B, C et Figure 4 A). quantification des agrégats Htt sauvage peut être difficile aussi parce que beaucoup de structures normales du cerveau apparaissent ponctuée (p. ex., prolongements cellulaires et des synapses). Co-localisation des signaux de Htt sauvage et mutantes peut être utilisée comme critère de sélection ; Cependant, il est possible que certains mutants Htt « graines » tombent au-dessous de la limite de détection de la confocale. Une protéine autre que Htt qui ne s’agrège pas dans les cellules réceptrices (p. ex., GFP) peut être utilisée pour étiqueter des structures ponctuées non apparentés dans le cerveau.
- Si les agrégats sont bien séparées, et il n’y a fluorescence de fond minimal, utilisez image analyse logiciel pour systématiquement identifier, quantifier et d’analyser les agrégats distincts « objets » ou « surfaces » une reconstruction 3D de la pile confocale ( Figure 3 ( B).
- Logiciel d’analyse image permet de lancer d’autres caractérisation des agrégats individuels. Par exemple, déterminer la granulométrie des agrégats (Figure 3C), pourcentage co-localisation entre mutant et sauvage Htt protéines (Figure 4A), ou mesurer directement les interactions protéine-protéine à l’aide de la frette) Figure 4 ( B).
- Déterminer la distribution granulométrique des punctums individuels en utilisant un algorithme de détection de surface ou spot qui identifie avec précision tous les agrégats visibles dans un canal particulier. Utilisez le logiciel d’analyse de l’image pour prendre les mesures pertinentes des taches ou des surfaces, par exemple obtenir « Diamètre global » (Fig. 3 C), « volume » ou informations « intensité » des « Mesures » dans l’Assistant de « Analyse » du logiciel indiqué au point 5.2.1.
Remarque : Dans la Figure 3C, nous rapportons la distribution des diamètres pour tous les HttQ91-mCherry punctums, identifié dans un glomérule DA1 unique. - Déterminer la pourcentage co-localisation entre HttQ25-YFP et agrégats de HttQ91-mCherry en déplaçant manuellement tranche par tranche à travers une pile de z confocale (méthode la plus précise). Cependant, prendre soin de ne pas pour compter n’importe quel agrégat deux fois. Pour éviter cela, ne compter qu’agrégats dans une z-tranche particulière si le plan de mise au point est à travers le centre de l’agrégat (Figure 4A).
- Calculer efficacité FRET pour les agrégats HttQ25-YFP induites avec épididymaire HttQ91-mCherry le signal à l’aide de la méthode de photoblanchiment accepteur.
- Tout d’abord, éliminer les potentiels la diaphonie entre canaux YFP et mCherry en créant des fenêtres de détection de signaux mCherry seule et YFP seule qui ne produisent aucun signal à l’autre canal. En utilisant ces paramètres, prendre une « image » de chaque examen HttQ25-YFP et leur signal associé de HttQ91-mCherry ( Figure 4B) avant.
- Ensuite, photobleach la mCherry du signal en ajustant le laser rouge (p. ex., 552 nm) à 100 % d’intensité et de balayage jusqu'à ce que le signal a disparu. Rétablir les paramètres utilisés pour le « image » avant et prendre une « image après » de l’examen même (Figure 4B).
- Calculer les mesures d’intensité de fluorescence pour chaque punctum avant et après photoblanchiment avec logiciel d’analyse image.
- Calculer efficacité frette en soustrayant la fluorescence de donateurs YFP mesurée dans le « image » avant (YFPinitiale) de fluorescence donneur YFP dans « l’image après » (YFPfinal). Diviser cette valeur par YFPfinalet multipliez par 100.
NOTE : Efficacité FRET peut être calculée en pixel par pixel ou globale pour chaque agrégat HttQ25-YFP (Figure 4B). Photoblanchiment de l’accepteur est une technique particulièrement utile pour le calcul de l’efficacité de la frette lorsque le signal de mCherry associé à chaque punctum HttQ25-YFP est suffisamment élevé pour produire détectable YFP dequenching après photoblanchiment mCherry.
- Déterminer la distribution granulométrique des punctums individuels en utilisant un algorithme de détection de surface ou spot qui identifie avec précision tous les agrégats visibles dans un canal particulier. Utilisez le logiciel d’analyse de l’image pour prendre les mesures pertinentes des taches ou des surfaces, par exemple obtenir « Diamètre global » (Fig. 3 C), « volume » ou informations « intensité » des « Mesures » dans l’Assistant de « Analyse » du logiciel indiqué au point 5.2.1.
Résultats
Les méthodes décrites ici produisent des données robustes témoignant de prion comme transfert des agrégats de protéine Htt de population d’une cellule à l’autre chez la mouche intacte CNS. Conversion de type sauvage Htt du diffus au ponctuée observe par fluorescence directe de cette protéine de fusion YFP glia bénéficiaire à la suite de HttQ91-mCherry expression dans donateurs Orn (A-C de laFigure 2et Figu...
Discussion
Comme le nombre de patients souffrant de maladies neurodégénératives ne cesse d’augmenter, il y a un besoin urgent d’augmenter la compréhension de la pathogenèse moléculaire de ces maladies, afin que les meilleurs traitements peuvent être développées. Nous décrivons ici des méthodes qui permettent de surveiller la transmission de prion-comme des agrégats de protéine pathogène entre différents types de cellules dans l’organisme modèle, Drosophila melanogaster. Nous avons récemment utilisé ...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions les membres des laboratoires Kopito, Luo et Pearce pour les nombreuses discussions utiles au cours du développement de ces méthodes. Nous remercions également Brian Temsamrit pour une lecture critique de ce manuscrit. Ce travail a été soutenu par le Fonds de l’Université des Sciences et des fiducies de bienfaisance W.W. Smith.
matériels
| Name | Company | Catalog Number | Comments |
| Phosphate buffered saline (PBS), 10X, pH 7.4 | ThermoFisher Scientific | AM9625 | Dilute to 1X |
| Triton X-100 | Sigma-Aldrich | T9284-1L | |
| Kimwipes | Thomas Scientific | 2904F24 | |
| 20% paraformaldehyde (PFA) | Electron Microscopy Sciences | 15713-S | |
| Normal Goat Serum (NGS), filtered | Lampire Biological Laboratories | 7332500 | Aliquot and freeze upon receipt |
| Chicken anti-GFP | Aves Labs | GFP-1020 | Use at 1:500 dilution |
| Rabbit anti-DsRed | Clontech | 632496 | Use at 1:2000 dilution; can recognize DsRed-based fluorescent proteins (e.g. mCherry, mStrawberry, tdTomato, etc.) |
| Mouse anti-Bruchpilot | Developmental Studies Hybridoma Bank | nc82 | Use at 1:100 dilution; will label active pre-synaptic structures thoughout the fly brain |
| FITC anti-chicken | ThermoFisher Scientific | SA1-7200 | Use at 1:250 dilution |
| Alexa Fluor 568 anti-rabbit | Life Technologies | A11011 | Use at 1:250 dilution |
| Alexa Fluor 647 anti-mouse antibody | Life Technologies | A21235 | Use at 1:250 dilution |
| Slowfade Gold Antifade Reagent | Life Technologies | S36936 | |
| Microscope Slides (25 x 75 x 1.0 mm) | Fisher Scientific | 12-550-143 | |
| Cover Glass (22 x 22 mm) | Globe Scientific | 1404-15 | |
| Dumont Biology Grade Forceps, Style 3 | Ted Pella | 503 | use in non-dominant hand |
| Dumont Biology Grade Forceps, Style 5 | Ted Pella | 505 | use in dominant hand |
| LAS X image analysis software | Leica | ||
| Imaris image analysis software | Bitplane |
Références
- Prusiner, S. B. Biology and genetics of prions causing neurodegeneration. Annu Rev Genet. 47, 601-623 (2013).
- Haïk, S., Brandel, J. P. Infectious prion diseases in humans: Cannibalism, iatrogenicity and zoonoses. Infect Genet Evol. 26, 303-312 (2014).
- Balch, W. E., Morimoto, R. I., Dillin, A., Kelly, J. W. Adapting Proteostasis for Disease Intervention. Science. 319 (5865), 916-919 (2008).
- Stroo, E., Koopman, M., Nollen, E. A., Mata-Cabana, A. Cellular Regulation of Amyloid Formation in Aging and Disease. Front Neurosci. 11, 64 (2017).
- Brundin, P., Melki, R., Kopito, R. Prion-like transmission of protein aggregates in neurodegenerative diseases. Nat Rev Mol Cell Biol. 11 (4), 301-307 (2010).
- Jucker, M., Walker, L. C. Self-propagation of pathogenic protein aggregates in neurodegenerative diseases. Nature. 501 (7465), 45-51 (2013).
- Stopschinski, B. E., Diamond, M. I. The prion model for progression and diversity of neurodegenerative diseases. Lancet Neurol. 16 (4), 323-332 (2017).
- Walker, L. C., Jucker, M. Neurodegenerative diseases: expanding the prion concept. Annu Rev Neurosci. 38, 87-103 (2015).
- Holmes, B. B., et al. Heparan sulfate proteoglycans mediate internalization and propagation of specific proteopathic seeds. Proc Natl Acad Sci U S A. 110 (33), 3138-3147 (2013).
- Munch, C., O'Brien, J., Bertolotti, A. Prion-like propagation of mutant superoxide dismutase-1 misfolding in neuronal cells. Proc Natl Acad Sci U S A. 108 (9), 3548-3553 (2011).
- Nonaka, T., et al. Prion-like properties of pathological TDP-43 aggregates from diseased brains. Cell Rep. 4 (1), 124-134 (2013).
- Ren, P. H., et al. Cytoplasmic penetration and persistent infection of mammalian cells by polyglutamine aggregates. Nat Cell Biol. 11 (2), 219-225 (2009).
- Trevino, R. S., et al. Fibrillar structure and charge determine the interaction of polyglutamine protein aggregates with the cell surface. J Biol Chem. 287 (35), 29722-29728 (2012).
- Volpicelli-Daley, L. A., et al. Exogenous alpha-synuclein fibrils induce Lewy body pathology leading to synaptic dysfunction and neuron death. Neuron. 72 (1), 57-71 (2011).
- Zeineddine, R., et al. SOD1 protein aggregates stimulate macropinocytosis in neurons to facilitate their propagation. Mol Neurodegener. 10, 57 (2015).
- Ayers, J. I., Fromholt, S. E., O'Neal, V. M., Diamond, J. H., Borchelt, D. R. Prion-like propagation of mutant SOD1 misfolding and motor neuron disease spread along neuroanatomical pathways. Acta Neuropathol. 131 (1), 103-114 (2016).
- Clavaguera, F., et al. Brain homogenates from human tauopathies induce tau inclusions in mouse brain. Proc Natl Acad Sci U S A. 110 (23), 9535-9540 (2013).
- de Calignon, A., et al. Propagation of tau pathology in a model of early Alzheimer's disease. Neuron. 73 (4), 685-697 (2012).
- Eisele, Y. S., et al. Induction of cerebral beta-amyloidosis: intracerebral versus systemic Abeta inoculation. Proc Natl Acad Sci U S A. 106 (31), 12926-12931 (2009).
- Luk, K. C., et al. Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice. Science. 338 (6109), 949-953 (2012).
- Meyer-Luehmann, M., et al. Exogenous induction of cerebral beta-amyloidogenesis is governed by agent and host. Science. 313 (5794), 1781-1784 (2006).
- Mougenot, A. L., et al. Prion-like acceleration of a synucleinopathy in a transgenic mouse model. Neurobiol Aging. 33 (9), 2225-2228 (2012).
- Rey, N. L., et al. Widespread transneuronal propagation of alpha-synucleinopathy triggered in olfactory bulb mimics prodromal Parkinson's disease. J Exp Med. 213 (9), 1759-1778 (2016).
- Babcock, D. T., Ganetzky, B. Transcellular spreading of huntingtin aggregates in the Drosophila brain. Proc Natl Acad Sci U S A. 112 (39), 5427-5433 (2015).
- Kim, D. K., et al. Anti-aging treatments slow propagation of synucleinopathy by restoring lysosomal function. Autophagy. 12 (10), 1849-1863 (2016).
- Liu, L., et al. Trans-synaptic spread of tau pathology in vivo. PLoS One. 7 (2), 31302 (2012).
- Pearce, M. M., Spartz, E. J., Hong, W., Luo, L., Kopito, R. R. Prion-like transmission of neuronal huntingtin aggregates to phagocytic glia in the Drosophila brain. Nat Commun. 6, 6768 (2015).
- Pearce, M. M. Prion-like transmission of pathogenic protein aggregates in genetic models of neurodegenerative disease. Curr Opin Genet Dev. 44, 149-155 (2017).
- Pecho-Vrieseling, E., et al. Transneuronal propagation of mutant huntingtin contributes to non-cell autonomous pathology in neurons. Nat Neurosci. 17 (8), 1064-1072 (2014).
- Wu, J. W., et al. Neuronal activity enhances tau propagation and tau pathology in vivo. Nat Neurosci. 19 (8), 1085-1092 (2016).
- Jackson, G. R., et al. Polyglutamine-expanded human huntingtin transgenes induce degeneration of Drosophila photoreceptor neurons. Neuron. 21 (3), 633-642 (1998).
- Warrick, J. M., et al. Expanded polyglutamine protein forms nuclear inclusions and causes neural degeneration in Drosophila. Cell. 93 (6), 939-949 (1998).
- McGurk, L., Berson, A., Bonini, N. M. Drosophila as an In Vivo Model for Human Neurodegenerative Disease. Genetics. 201 (2), 377-402 (2015).
- The Huntington's Disease Collaborative Research Group. A novel gene containing a trinucleotide repeat that is expanded and unstable on Huntington's disease chromosomes. Cell. 72 (6), 971-983 (1993).
- Bates, G. P., et al. Huntington disease. Nat Rev Dis Primers. 1, 15005 (2015).
- Scherzinger, E., et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils: implications for Huntington's disease pathology. Proc Natl Acad Sci U S A. 96 (8), 4604-4609 (1999).
- Chen, S., Berthelier, V., Yang, W., Wetzel, R. Polyglutamine aggregation behavior in vitro supports a recruitment mechanism of cytotoxicity. J Mol Biol. 311 (1), 173-182 (2001).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Potter, C. J., Tasic, B., Russler, E. V., Liang, L., Luo, L. The Q system: a repressible binary system for transgene expression, lineage tracing, and mosaic analysis. Cell. 141 (3), 536-548 (2010).
- Riabinina, O., Potter, C. J. The Q-System: A Versatile Expression System for Drosophila. Methods Mol Biol. 1478, 53-78 (2016).
- Costanzo, M., et al. Transfer of polyglutamine aggregates in neuronal cells occurs in tunneling nanotubes. J Cell Sci. 126 (16), 3678-3685 (2013).
- Freeman, M. R., Delrow, J., Kim, J., Johnson, E., Doe, C. Q. Unwrapping glial biology: Gcm target genes regulating glial development, diversification, and function. Neuron. 38 (4), 567-580 (2003).
- MacDonald, J. M., et al. The Drosophila cell corpse engulfment receptor Draper mediates glial clearance of severed axons. Neuron. 50 (6), 869-881 (2006).
- Wu, J. S., Luo, L. A protocol for dissecting Drosophila melanogaster brains for live imaging or immunostaining. Nat Protoc. 1 (4), 2110-2115 (2006).
- Tito, A. J., Cheema, S., Jiang, M., Zhang, S. A Simple One-step Dissection Protocol for Whole-mount Preparation of Adult Drosophila Brains. J Vis Exp. (118), (2016).
- Roszik, J., Szöllosi, J., Vereb, G. AccPbFRET: an ImageJ plugin for semi-automatic, fully corrected analysis of acceptor photobleaching FRET images. BMC Bioinformatics. 9, 346 (2008).
- Spires-Jones, T. L., Attems, J., Thal, D. R. Interactions of pathological proteins in neurodegenerative diseases. Acta Neuropathol. 134 (2), 187-205 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon