Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Synthèse et caractérisation de la Performance de catalyseur seul atome de métal de Transition pour électrochimique CO2 réduction
Dans cet article
Résumé
Ici, nous présentons un protocole pour la synthèse et test électrochimique des métaux de transition unique atomes coordonné en graphène postes vacants comme centres actifs pour la réduction sélective du dioxyde de carbone au monoxyde de carbone en solution aqueuse.
Résumé
Ce protocole présente aussi bien la méthode de synthèse du catalyseur seul atome Ni et l’essai électrochimique de son activité catalytique et la sélectivité dans aqueuse réduction de CO2 . Différent des nanocristaux métalliques traditionnels, la synthèse des atomes métalliques implique un matériel matriciel qui peut confiner les atomes et les empêcher d’agrégation. Nous rapportons un électrofilage et thermique recuit méthode pour préparer Ni atomes dispersés et coordonné dans une coquille de graphène, comme des centres actifs pour la réduction de CO2 à CO. Au cours de la synthèse, dopants N jouent un rôle essentiel dans la création de postes vacants de graphène pour piéger les atomes Ni. Correction de l’aberration de la microscopie électronique par balayage transmission et tomographie sonde tridimensionnelle atome étaient employés pour identifier les sites atomiques d’unique Ni dans le graphène postes vacants. Installation détaillée d’électrochimique CO2 appareil de réduction couplée à une chromatographie en phase gazeuse en ligne est également démontrée. Par rapport à Ni métallique, Ni seul atome catalyseur pièce considérablement améliorée réduction de CO2 et supprimée de réaction côté H2 evolution.
Introduction
Converting CO2 en produits chimiques ou combustibles à l’aide de l’électricité propre devient de plus en plus importante comme une voie possible pour prévenir d’autres CO2 émissions1,2,3,4, 5,6. Cependant, cette application pratique est actuellement contestée par la faible activité et la sélectivité du CO2 réaction de réduction (CO2RR) en raison des barrières cinétiques élevées et la concurrence avec la réaction de dégagement d’hydrogène (HER) en milieu aqueux médias. La plupart du catalyseur métal de transition traditionnels, tels que Fe, Co et Ni, pièce faible CO2RR sélectivité en raison de leur superbe sa activités7,8. Tuning efficacement leurs propriétés pour modifier les chemins réactionnels sur ces catalyseurs métalliques de transition devient critique afin d’améliorer leur CO2RR sélectivité. Parmi différentes méthodes pour modifier les propriétés électroniques des catalyseurs, dispersant des atomes métalliques dans une morphologie unique atome attire les attentions intenses récemment en raison de leurs comportements catalytiques considérablement changés par rapport à leurs homologues en vrac 9 , 10 , 11. Toutefois, en raison de la grande mobilité des atomes sans bornes, il est assez difficile d’obtenir des atomes métalliques sans la présence de matériaux favorables. Par conséquent, un matériel de matrice hôte avec défauts créé pour confiner et coordonner avec les atomes de métal de transition est nécessaire. Cela pourrait ouvrir de nouvelles perspectives à : 1) régler les propriétés électroniques des métaux de transition comme les sites actifs de CO2RR et 2) en même temps maintenir une coordination atomique relativement simple pour les études de mécanisme fondamental. En outre, ces atomes de métaux de transition, pris au piège dans un milieu confiné ne peut pas être déplacées facilement en catalyse, qui empêche la nucléation ou reconstructions des atomes de surface observées dans de nombreux cas12,13 ,14.
Graphène en couches bidimensionnel est particulièrement intéressant en tant qu’hôte pour les atomes métalliques en raison de leur conductivité électronique élevée, stabilité chimique et inertie à la fois la réduction de CO2 et ses réactions catalytiques. Plus important encore, Fe, Co et les métaux Ni étaient connus pour être capable de catalyser le processus de graphitisation de carbone sur leur surface15. En bref, les métaux de transition serait en alliage avec carbone au cours du processus de recuit thermique haute température. Lorsque la température descend, carbone commence à précipiter hors de la phase d’alliage et est catalysée à des couches de graphène de forme sur la surface du métal de transition. Au cours de ce processus, présentant des défauts de graphène générées, atomes métalliques seraient enfermés dans ces défauts de graphène comme les sites actifs de CO2RR16,17,18,19. Nous rapportons ici, ce protocole détaillé avec l’intention d’aider les nouveaux praticiens dans le domaine de la catalyse de l’atome, ainsi que pour fournir une démonstration explicite de CO en ligne analyse de produit de réduction2 . On trouvera plus d’informations dans notre article récemment publié19 et une série de travaux connexes20,21,22,23.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. préparation du Ni Single Atom catalyseur (NiN-GS)
- Préparation de la solution de précurseur électrofilage
- Prendre un flacon de 20 mL à scintillation, dissoudre 0,5 g de polyacrylonitrile (Mw= 150 000), 0,5 g de réticulé (Mw= 1 300 000), 0,5 g de Ni (NO3)2·6H2O et 0,1 g de dicyandiamide (DCDA) dans 10 mL du diméthylformamide (DMF).
- Faites chauffer le mélange DMF à 80 ° C et maintenir le mélange à 80 ° C avec constant, en remuant jusqu'à ce que tous les polymères et le sel sont dissolvent et on observe une solution claire.
- Électrofilage pour produire des fibres de polymère
- Définir les paramètres électrofilage classiques comme : 15 kV de tension électrique statique, 15 cm d’air gap à distance, un substrat de 8 × 8 cm en fibre de carbone papier (PCP) avec - 4 kV de tension électrique.
- Extrait 5 mL de solution de précurseur dans une seringue de 5 mL, commencez le pousse-seringue à un débit de 1,2 mL h−1, puis démarrer l’électrofilage.
Remarque : Une tension élevée est utilisée pour électrofilage. Bien que très faible courant passe par le système pendant le processus de filature, un coffret en bois isolé est suggéré. - Sortez le substrat de la PCP une fois terminé le processus électrofilage. Un film de fibre polymère couvre la surface de la CFP.
- Recuit de fibres polymères en nanotubes de carbone
- Faire chauffer la polymère préparés comme fibre film/PCP à 300 ° C à 1,5 h dans un four de boîte et maintenir la température de 0,5 h à oxyder les polymères.
Remarque : Après le processus d’oxydation, les nanofibres (NFs) sont se détachés le papier carbone résultant dans le film autoportant. - Utiliser une paire de ciseaux pour couper les nanofibres en petits morceaux (~ 0,5 cm × 2 cm) et les placer dans un bateau de quartz.
- Mettez le bateau de quartz dans une fournaise de tube et purger l’air intérieur formant l’atmosphère gazeuse (5 % H2 Ar). Maintenir le débit de gaz comme sccm 100 et la pression comme 1 Tor.
- Chauffer au sein du lancement à 300 ° C en 10 min et 2 h ramping à 750 ° C, où elle est maintenue pendant encore 1 h et suivie par le refroidissement naturel.
- Faire chauffer la polymère préparés comme fibre film/PCP à 300 ° C à 1,5 h dans un four de boîte et maintenir la température de 0,5 h à oxyder les polymères.
- Ball mill synthétisés comme NiN-GS catalyseur pendant 5 min de nanopoudres pour catalyse et caractérisations.
2. mesures de réduction électrochimique CO2
- Cellule et électrodes
- Pour préparer l’électrolyte de 0,1 M KHCO3 pour les mesures suivantes, tout d’abord dissoudre 2,5 g de KHCO3 dans 250 mL d’eau ultrapure, puis purifier l’électrolyte par électrolyse entre deux tiges de graphite à 0,1 mA pendant 24 h pour enlever toute trace quantité de métal ions.
- Prenez un frais carbone vitreux (électrochimique) poli (1 × 2 cm) et couvrir son derrière avec une cire électrochimiquement inerte et hydrophobe, comme le substrat d’électrode de travail.
- Prendre un flacon de 4 mL à scintillation, mixer 5 mg de préparés comme catalyseur de NiN-GS avec 1 mL d’éthanol et 100 µL de solution ionomère (5 % en 2-proponal) dans la cuvette et laisser agir pendant 20 min obtenir une suspension d’encre catalyseur homogène.
- Pipette 80 µL de l’encre de catalyseur sur la surface de carbone vitreux de2 cm 2 (0,2 mg cm-2 charge massique) et vide sec le catalyseur des électrodes enrobées dans un dessicateur avant utilisation.
- Utiliser une feuille de platine et une électrode au calomel saturée (ECS) comme le comptoir et l’électrode de référence, respectivement.
- Utilisez une personnalisé étanche au gaz H-type verre cellule, séparée par une membrane échangeuse de protons, pour les 3 électrodes ci-dessus montage ainsi que les tests électrochimiques en cours d’exécution.
- Placer l’électrode de travail et électrode de référence de CPE dans un compartiment de H-cellule et Pt clinquant électrode dans l’autre chambre. Injecter ~ 25 mL d’électrolyte dans chaque compartiment de H-cellule.
- Connecter les 3 électrodes H-cellule au poste de travail électrochimique pour contrôle éventuel.
- Bulle de l’électrolyte avec N2 à 50,0 sccm (surveillé par le contrôleur de débit massique) pendant 30 min vers N2-saturés 0.1 M KHCO3.
- Sélectionnez technique de voltampérométrie cyclique (CV) dans le logiciel EC-Lab, définissez « E Range (potentiel) » comme « -10 V à 10 V », « Je Range (actuel) » comme « Auto », effectuer des analyses de CV continus 5 de -0,5 V à -1,8 V (vs) à une vitesse de balayage de 50 mV/s en N2-saturés 0.1 M KHCO3.
- Changement de débit de gaz de 50 sccm CO2 , attendre 30 min vers CO2-saturé d’électrolyte de 0,1 M KHCO3 et maintenir le même débit de2 CO tout au long de l’électrolyse suivant.
- Sélectionnez technique de CV dans le logiciel EC-Lab, définissez « E Range (potentiel) » comme « -10 V à 10 V », « Je Range (actuel) » comme « Auto », effectuer des analyses de CV continus 5 de -0,5 V à -1,8 V (vs) à une vitesse de balayage de 50 mV/s à CO2-saturés 0.1 M KHCO3.
- Utiliser un pH-mètre pour déterminer les valeurs de pH des électrolytes, i.e., 0,1 M KHCO3 saturée avec N2 ou CO2.
- Convertir tous les potentiels mesurées contre le CPE à l’échelle d’électrode (RHE) réversible de l’hydrogène dans ce travail E (vs RHE) = E (vs CPE) + 0,244 V + 0.0591 × pH.
- Détermination de la résistance (R-u) de solution dans le logiciel EC-Lab en sélectionnant technique de spectroscopie de l’impédance électrochimique potentiostatique (PEIS), puis set de fréquences de 0,1 Hz à 200 kHz, enregistrez la valeur de la résistance.
- Compenser manuellement iR-tomber sous la forme E (iR corrigé vs RHE) = E (vs RHE) - Ru × I (ampères de courant moyen).
- Analyse de produits réduction CO2 par en ligne chromatographe en phase gazeuse (GC)
- Employer un GC, équipé d’une combinaison de colonnes de 5 a et micropacked tamis moléculaire, pour l’analyse des gaz produits au cours de CO2RR.
Remarque : Les types de colonne GC détaillées se trouvent dans attaché Table des matières. - Utiliser un détecteur de conductivité thermique (TCD) pour quantifier la teneur en2 H et un détecteur à ionisation de flamme (FID) avec un méthaniseur à l’analyse quantitative CO contenu et/ou de toute autre espèce d’alcane.
- Utiliser deux gaz standards pour les courbes d’étalonnage de H2 et de la concentration de CO (H2: 100 et 1042 ppm ; CO : 100 et 496,7 ppm ; symétrique avec Argon).
- Pendant l’électrolyse, maintenir la vitesse d’écoulement de gaz CO2 à 50,0 sccm, livrer le CO2 dans le compartiment cathodique contenant du CO2-saturés 0.1 M KHCO3 électrolyte et évacuation des gaz d’échappement en GC.
- Mélodie progressivement la tension sur l’électrode de travail, allant de -0,3 à -1,0 V vs RHE, garder ~ 15 min pour chaque potentiel et enregistrer la courbe correspondante de chronoamperimetric.
- Déterminer l’H2 et CO contenu dans le gaz d’échappement des signaux TCD et FID, respectivement.
Remarque : Les gaz produits sont échantillonnés après une électrolyse continu de ~ 10 min sous chaque potentiel. Le 50 sccm CO2 gaz, mélangé en continu produit H2 et CO, a coulé à travers de la boucle d’échantillonnage (1 mL) de GC pendant l’électrolyse. - Calculer la densité de courant partielle pour un produit donné de gaz comme ci-dessous :
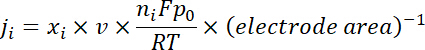
où xj’ai est la fraction de volume de certains produits déterminés par GC en ligne référencé aux courbes d’étalonnage de deux échantillons de gaz étalon (Scott et Airgas), v est la vitesse d’écoulement de 50 sccm, ni est le nombre des électrons impliqués, p0 = 101,3 kPa et F est la constante faradique et R est la constante des gaz. - Calculer le rendement faradique correspondant (FE) à chaque potentiel en tant que
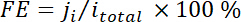 .
.
Remarque : L’efficacité dans l’ensemble faradique pourrait être dans une fourchette de 90 à 110 % en raison des erreurs de débit gaz, densité de courant et analyse de la concentration gaz sur GC.
- Employer un GC, équipé d’une combinaison de colonnes de 5 a et micropacked tamis moléculaire, pour l’analyse des gaz produits au cours de CO2RR.
Access restricted. Please log in or start a trial to view this content.
Résultats
Microscopie électronique (SEM), analyse de microscopie électronique à transmission (tige) et spectroscopie de rayons x dispersive en énergie (EDX) cartographie images sont affichées à la Figure 1 pour la caractérisation de la morphologie de NiN-GS. Atome en trois dimensions sonde tomographie (3D-APT) résultats est présentés dans la Figure 2 pour l’identification directe de distribution unique de sites Ni ainsi que leu...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans le processus électrofilage ci-dessus, deux étapes importantes doivent noter dans les procédures de synthèse matérielle : 1) chauffer le mélange DMF (étape 1.1.2) et réglage de taux 2) la pompe (étape 1.2.2) pour correspondre à la vitesse de rotation. L’image de SEM dans la Figure 1 a montre les nanofibres de carbone obtenus interconnectés entre eux (~ 200 nm de diamètre). Ils ont été brisés en petits morceaux par boule fraise caractérisations comme illustré dans la <...
Access restricted. Please log in or start a trial to view this content.
Remerciements
Ce travail a été soutenu par le Rowland Fellows Program à l’Université de l’Institut de Harvard de Rowland. Ce travail a été effectué en partie au Centre pour échelle nanométrique Systems (CNS), un membre du réseau National de Infrastructure nanotechnologie, qui est soutenu par la National Science Foundation sous prix aucun. ECS-0335765. Le CNS appartient à l’Université Harvard.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| syringe pump | KD Scientific | KDS-100 | |
| tube furnance | Lindberg/Blue M | TF55035A-1 | |
| ball miller | SPEX SamplePrep | 5100 | |
| electrochemical work station | BioLogic | VMP3 | |
| pH meter | Orion | 320 PerpHecT | 2 points calibration before use |
| gas chromatograph | Shimadzu | GC-2014 | a combined seperation system consisting of molecular sieve 5A, Hayesep Q, Hayesep T, and Hayesep N |
| mass flow controller | Alicat Scientific | MC-50SCCM-D/5M | |
| ultrapure water system | Millipore | Synergy | |
| vacuum desiccator | PolyLab | 55205 | |
| polyacrylonitrile | Sigma-Aldrich | 181315 | Mw=150,000 |
| polypyrrolidone | Sigma-Aldrich | 437190 | Mw=1,300,000 |
| Ni(NO3)26H2O | Sigma-Aldrich | 244074 | |
| dicyandiamide | Sigma-Aldrich | D76609 | |
| dimethylformamide | Sigma-Aldrich | 227056 | |
| carbon fiber paper | AvCarb | MGL370 | |
| Nafion 117 membrane | Fuel Cell Store | 117 | used as proton exchange membrane in H-cell |
| KHCO3 | Sigma-Aldrich | 431583 | further purified by electrolysis |
| platinum foil | Beantown Chemical | 126580 | |
| saturated calomel electrode | CH Instruments | CHI150 | |
| glassy carbon electrode | HTW GmbH | SIGRADUR | 1 cm × 2 cm |
| wax | Apiezon | W-W100 | |
| Nafion 117 solution | Sigma-Aldrich | 70160 | used as ionomer in catalyst ink preparation |
| forming gas | Airgas | UHP | 5% H2 balanced with Ar |
| carbon dioxide | Airgas | LaserPlus | |
| sandard gas | Airgas | customized | 500 ppm CO, 500 ppm CH4, 1000 ppm H2 balanced with Ar |
| sandard gas | Air Liquide | customized | 100 ppm H2, 100 ppm CO and other alkanes balanced with Ar |
Références
- Lewis, N. S., Nocera, D. G. Powering the planet: Chemical challenges in solar energy utilization. P. Natl. Acad. Sci. USA. 103, 15729-15735 (2006).
- Appel, A. M., et al. Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation. Chem. Rev. 113, 6621-6658 (2013).
- Jhong, H. R., Ma, S. C., Kenis, P. J. A. Electrochemical conversion of CO2 to useful chemicals: current status, remaining challenges, and future opportunities. Curr. Opin. Chem. Eng. 2, 191-199 (2013).
- Ashford, D. L., et al. Molecular Chromophore-Catalyst Assemblies for Solar Fuel Applications. Chem. Rev. 115, 13006-13049 (2015).
- Nocera, D. G. Solar Fuels and Solar Chemicals Industry. Accounts. Chem. Res. 50, 616-619 (2017).
- Larrazabal, G. O., Martin, A. J., Perez-Ramirez, J. Building Blocks for High Performance in Electrocatalytic CO2 Reduction: Materials, Optimization Strategies, and Device Engineering. J. Phys. Chem. Lett. 8, 3933-3944 (2017).
- Hori, Y., Wakebe, H., Tsukamoto, T., Koga, O. Electrocatalytic Process of Co Selectivity in Electrochemical Reduction of Co2 at Metal-Electrodes in Aqueous-Media. Electrochim. Acta. 39, 1833-1839 (1994).
- Hori, Y. Modern aspects of electrochemistry. , Springer. 89-189 (2008).
- Lin, S., et al. Covalent organic frameworks comprising cobalt porphyrins for catalytic CO2 reduction in water. Science. 349, 1208-1213 (2015).
- Zhang, X., et al. Highly selective and active CO2 reduction electrocatalysts based on cobalt phthalocyanine/carbon nanotube hybrid structures. Nat. Commun. 8, 14675(2017).
- Zhao, C. M., et al. Ionic Exchange of Metal Organic Frameworks to Access Single Nickel Sites for Efficient Electroreduction of CO2. J. Am. Chem. Soc. 139, 8078-8081 (2017).
- Manthiram, K., Beberwyck, B. J., Aivisatos, A. P. Enhanced Electrochemical Methanation of Carbon Dioxide with a Dispersible Nanoscale Copper Catalyst. J. Am. Chem. Soc. 136, 13319-13325 (2014).
- Yang, M., et al. Catalytically active Au-O(OH)(x)-species stabilized by alkali ions on zeolites and mesoporous oxides. Science. 346, 1498-1501 (2014).
- Manthiram, K., Surendranath, Y., Alivisatos, A. P. Dendritic Assembly of Gold Nanoparticles during Fuel-Forming Electrocatalysis. J. Am. Chem. Soc. 136, 7237-7240 (2014).
- Amini, S., Garay, J., Liu, G., Balandin, A. A., Abbaschian, R. Growth of large-area graphene films from metal-carbon melts. J. Appl. Phys. 108, 094321(2010).
- Krasheninnikov, A. V., Lehtinen, P. O., Foster, A. S., Pyykkö, P., Nieminen, R. M. Embedding Transition-Metal Atoms in Graphene: Structure, Bonding, and Magnetism. Phys. Rev. Lett. 102, 126807(2009).
- Jiang, K., Siahrostami, S., Zheng, T., Hu, Y., Hwang, S., Stavitski, E., Peng, Y., Dynes, J., Gangishetty, M., Su, D., Attenkofer, K., Wang, H. Isolated Ni Single Atoms in Graphene Nanosheets for High-performance CO2 Reduction. Energy Environ. Sci. , Advance Article (2018).
- Rodríguez-Manzo, J. A., Cretu, O., Banhart, F. Trapping of Metal Atoms in Vacancies of Carbon Nanotubes and Graphene. ACS Nano. 4, 3422-3428 (2010).
- Jiang, K., et al. Transition metal atoms in a graphene shell as active centers for highly efficient artificial photosynthesis. Chem. 3, 950-960 (2017).
- Jiang, K., Wang, H., Cai, W. B., Wang, H. T. Li Electrochemical Tuning of Metal Oxide for Highly Selective CO2 Reduction. ACS Nano. 11, 6451-6458 (2017).
- Jiang, K., et al. Silver Nanoparticles with Surface-Bonded Oxygen for Highly Selective CO2 Reduction. ACS Sustain Chem. Eng. 5, 8529-8534 (2017).
- Siahrostami, S., et al. Theoretical Investigations into Defected Graphene for Electrochemical Reduction of CO2. ACS Sustain Chem. Eng. 5, 11080-11085 (2017).
- Jiang, K., et al. Metal Ion Cycling of Cu Foil for Selective C-C Coupling in Electrochemical CO2 Reduction. Nat. Catal. , (2017).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon