É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Síntese e caracterizações de desempenho de catalisador de átomo de Metal de transição para redução de eletroquímica CO2
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para a síntese e ensaios eletroquímicos de simples átomos de metal de transição coordenada em vagas de grafeno como centros ativos para redução seletiva de dióxido de carbono ao monóxido de carbono em soluções aquosas.
Resumo
Este protocolo apresenta tanto o método de síntese do catalisador Ni único átomo e de ensaios eletroquímicos de sua atividade catalítica e seletividade em aquosa redução de CO2 . Diferente de nanocristais de metal tradicional, a síntese de átomos metálicos simples envolve um material de matriz que pode limitar os átomos único e impedi-los de agregação. Nós relatamos um eletrofiação e térmico, recozimento método para preparar Ni único átomos dispersaram e coordenado em um shell do grafeno, como centros ativos para redução de CO2 para CO. Durante a síntese, dopantes N desempenham um papel fundamental na geração de vagas de grafeno para aprisionar átomos de Ni. Correção de aberração transmissão microscopia eletrônica e tomografia computadorizada de sonda tridimensional do átomo foram empregados para identificar os sites atômicos único de Ni em vagas de grafeno. Configuração detalhada de eletroquímica CO2 redução aparelhos acoplados com uma cromatografia gasosa on-line também é demonstrada. Em comparação com Ni metálico, catalisador de Ni único átomo exibem melhorou drasticamente redução de CO2 e suprimiu a reação de lateral de evolução de2 H.
Introdução
Conversão de CO2 em produtos químicos ou combustíveis usando a eletricidade limpa é cada vez mais importante como um potencial caminho para evitar futuras CO2 emissões1,2,3,4, 5,6. No entanto, esta aplicação prática atualmente é desafiada pela baixa atividade e seletividade de CO2 redução reação (CO2RR) devido as barreiras cinéticas elevadas e a competição com a reação de evolução de hidrogênio (HER) em aquosa meios de comunicação. A maioria do catalisador de metal de transição tradicional, como Fe, Co e Ni, apresentam baixa CO2RR selectividade devido a sua soberba HER atividades7,8. Efetivamente, ajuste suas propriedades materiais para alterar os caminhos de reação sobre estes catalisadores de metais de transição torna-se fundamental para melhorar sua CO2RR seletividade. Entre diferentes métodos para modificar as propriedades eletrônicas dos catalizadores, dispersão de átomos de metal em uma morfologia do único-átomo atrai atenções intensivas recentemente devido a seus comportamentos catalíticos dramaticamente alterados em relação à sua contraparte em massa 9 , 10 , 11. no entanto, devido a alta mobilidade dos átomos não vinculados, é bastante desafiador para obter átomos de metal único sem a presença de materiais de apoio. Portanto, um material de matriz de anfitrião com defeitos criados para confinar e coordenar com os átomos de metal de transição é necessário. Isso poderia abrir novas oportunidades para: 1) ajustar as propriedades eletrônicas dos metais de transição como locais de CO2RR ativos e 2) ao mesmo tempo manter a coordenação atômica relativamente simples para estudos de mecanismo fundamental. Além disso, esses átomos de metal de transição, presos em um ambiente confinado não podem ser facilmente movidos ao redor durante a catálise, que impede a nucleação ou reconstruções de superfície átomos observadas em muitos casos12,13 ,14.
Grafeno em camadas bidimensional é de particular interesse como host para metais átomos único devido à sua condutividade de elétrons alta, estabilidade química e inércia para redução de CO2 e suas reações catalíticas. Mais importante, Fe, Co e metais Ni eram conhecidos para ser capaz de catalisar o processo de Grafitização de carbono na sua superfície15. Em suma, os metais de transição que liga com carbono durante a térmica de alta temperatura, processo de recozimento. Quando a temperatura cai, o carbono começa a precipitar fora de fase da liga e é catalisado para formar camadas de grafeno na superfície do metal de transição. Durante este processo, com grafeno defeitos gerados, átomos único metais iria ficar preso os defeitos de grafeno como os sítios ativos para CO2RR16,17,18,19. Aqui, nós relatamos este protocolo detalhado com a intenção de ajudar novos actores no domínio da catálise de átomo, bem como a proporcionar uma demonstração explícita de CO on-line, análise de produto de redução2 . Mais informações podem ser encontradas em nosso artigo recentemente publicado19 e uma série de obras relacionadas20,21,22,23.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. preparação do catalisador de Ni único átomo (NiN-GS)
- Preparação da solução de precursor eletrofiação
- Toma um frasco de cintilação de 20 mL, dissolver 0,5 g de poliacrilonitrila (Mw= 150.000), 0,5 g de polipirrolidona (Mw= 1.300.000), 0,5 g de Ni (NO3)2·6H2O e 0,1 g de dicianodiamida (DCDA) em 10 mL de dimetilformamida (DMF).
- Aqueça a mistura DMF a 80 ° C e manter a mistura a 80 ° C, com agitação constante até todos os polímeros e sal são dissolvidos e observa-se uma solução límpida.
- Eletrofiação para produzir fibras de polímero
- Definir parâmetros de eletrofiação convencionais como: 15 kV de tensão elétrica estática, 15 cm de ar gap distância, um substrato de coleção de 8 × 8 cm fibra de carbono papelcom (PCP) - 4 kV de tensão elétrica.
- Extrato de 5 mL de solução de precursor em uma seringa de 5 mL, começar a bomba de seringa com um caudal de 1,2 mL h−1e, em seguida, iniciar a eletrofiação.
Nota: Uma alta tensão é usada por eletrofiação. Apesar de muito baixa corrente que atravessa o sistema durante o processo de fiação, sugere-se um armário de madeira isolado. - Retire o substrato do PCP uma vez terminado o processo de eletrofiação. Uma película de polímero da fibra cobre a superfície do PCP.
- Recozimento de fibras de polímero em nanotubos de carbono
- Aqueça a polímero preparado como fibra filme/PCP a 300 ° C, em 1,5 h em uma fornalha de caixa e manter a temperatura para 0,5 h oxidar os polímeros.
Nota: Após o processo de oxidação, as nanofibras (NFs) são auto desanexadas do papel carbono resultando no filme independente. - Use um par de tesouras para cortar essas nanofibras em pedaços menores (~ 0,5 cm × 2cm) e coloque-os em um barco de quartzo.
- Coloque o barco de quartzo em uma fornalha de tubo e desareá-lo dentro formando a atmosfera de gás (5% H2 no Ar). Manter a taxa de fluxo do gás como 100 sccm e a pressão como 1 Tor.
- Aquecer-se dentro de 10 min de rampa a 300 ° C e 2 h de rampa a 750 ° C, onde é mantido por outro 1h e seguido de resfriamento natural.
- Aqueça a polímero preparado como fibra filme/PCP a 300 ° C, em 1,5 h em uma fornalha de caixa e manter a temperatura para 0,5 h oxidar os polímeros.
- Bola moinho-sintetizados como NiN-GS catalisador por 5 min para nanopós para catálise e caracterizações.
2. medidas de redução de2 CO eletroquímica
- Célula e eletrodos
- Para preparar o eletrólito de3 KHCO 0,1 M para as seguintes medições, primeiro dissolver 2,5 g de KHCO3 em 250 mL de água ultrapura e, em seguida, purificar o eletrólito por eletrólise entre duas varas de grafite em 0.1 mA durante 24 h para remover qualquer rastrear a quantidade de metal íons.
- Pegue um fresco carbono vítreo (eletroquimicamente) polido (1 cm x 2 cm) e cubra sua parte traseira com uma cera eletroquimicamente inerte, hidrofóbica, como o substrato de eletrodo de trabalho.
- Toma um frasco de cintilação de 4 mL, misturar 5 mg de catalisador de NiN-GS como preparado com 1 mL de etanol e 100 µ l de solução de ionômero (5% em 2-proponal) dentro do frasco e proceda à sonicação por 20 min obter uma suspensão de tinta catalisador homogêneo.
- Pipeta 80 µ l da tinta na superfície de carbono vítreo 2cm2 (0,2 mg cm-2 massa de carregamento) e vácuo catalisador secar o catalisador eletrodo coberto num exsicador antes do uso.
- Use uma folha de platina e um eletrodo de calomelano saturado (SCE) como o contador e o eletrodo de referência, respectivamente.
- Use uma personalizado célula de vidro herméticos de H-tipo, separada por membrana de troca de protões, para montagem acima 3 eletrodos, bem como os ensaios eletroquímicos correndo.
- Coloque o eletrodo de trabalho e eletrodo de referência SCE em compartimento de H-célula e eletrodo de folha Pt na outra câmara. Injetar ~ 25 mL do eletrólito em cada compartimento de H-célula.
- Ligar os 3 eléctrodos na H-célula para a estação de trabalho eletroquímico para controle de potencial.
- Bolha do eletrólito com N2 no sccm 50,0 (monitorado pelo controlador de fluxo de massa) por 30 min em direção N2-saturada 0,1 M KHCO3.
- Selecione a técnica de voltametria cíclica (CV) no software de CE-Lab, defina "Gama E (potencial)" como "-10 V a 10 V", "Eu escala (atual)", como "Auto", realizar contínua 5 CV varreduras de -0,5 V para-1.8 V (vs. SCE) em uma taxa de varredura de 50 mV/s em N2-saturada 0,1 M KHCO3.
- Mudar 50 sccm CO2 fluxo de gás, espere por 30 min em direção de CO2-saturado eletrólito de3 KHCO 0,1 M e manter o mesmo fluxo de2 CO em todo o seguinte eletrólise.
- Selecione a técnica de CV no CE-Lab software, definir "Gama E (potencial)" como "-10 V a 10 V", "Eu escala (atual)", como "Auto", realizar contínua 5 CV varreduras de -0,5 V para-1.8 V (vs. SCE) em uma taxa de varredura de 50 mV/s em CO2-saturada 0,1 M KHCO3.
- Usar um medidor de pH para determinar os valores de pH de eletrólitos, i. e., 0,1 M KHCO3 saturado com N2 ou CO2.
- Converter todos os potenciais medidos contra SCE na escala do eletrodo (RHE) hidrogênio reversível usando este trabalho E (versus RHE) = E (vs. SCE) + 0.244 V + 0.0591 × pH.
- Determinar a resistência da solução (Ru) no software de CE-laboratório selecionando a técnica de espectroscopia de impedância electroquímica Potentiostatic (PEIS) e, em seguida, conjunto de frequências de 0,1 Hz a 200 kHz, registre o valor da resistência.
- Manualmente, compensar iR-a gota como E (iR corrigido vs RHE) = E (vs RHE) - Ru × eu (amperes de corrente média).
- Análise de produtos de redução CO2 por on-line cromatógrafo a gás (GC)
- Emprega um GC, equipado com uma combinação de colunas peneira molecular 5A e micropacked, para análise de gás de produtos durante o CO2RR.
Nota: Os tipos de coluna GC detalhados podem ser encontrados em anexo Tabela de materiais. - Use um detector de condutividade térmica (TCD) para quantificar a concentração de2 H e um detector de ionização de chama (FID) com um methanizer para análise quantitativa de teor de CO e/ou qualquer outra espécie de alcano.
- Usar dois diferentes gases padrão para as curvas de calibração da concentração de CO e H2 (H2: 1042 e 100 ppm; CO: 496.7 e 100 ppm; equilibrada com argônio).
- Durante a eletrólise, manter a taxa de fluxo de gás CO2 no sccm 50,0, entrega de CO2 no compartimento catódico contendo CO2-saturada eletrólito de3 KHCO 0,1 M e ventilação de escape em GC.
- Sintonia progressiva da tensão no eletrodo de trabalho, que variam de-0.3 a -1,0 V vs RHE, manter ~ 15 min para cada potencial e recorde a curva correspondente do chronoamperimetric.
- Determine o H2 e conteúdo de CO nos gases de escape de sinais TCD e FID, respectivamente.
Nota: Os produtos de gás são amostrados após uma Electrólise contínua de ~ 10 min sob cada potencial. O 50 sccm CO2 gás, misturado com continuamente produzido H2 e CO, fluiu através da alça de amostragem (1 mL) da GC durante a eletrólise. - Calcule a densidade de corrente parcial para um determinado gás do produto abaixo:
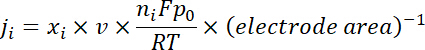
onde x, é a fração de volume de determinado produto determinado pela GC online com referência a curvas de calibração de duas amostras de gás padrão (Scott e Airgas), v é a taxa de fluxo de 50 sccm, n é o número de elétrons envolvidos, p0 = 101.3 kPa e F é a constante de Faradaic e R é a constante dos gases. - Calcular a eficiência Faradaic correspondente (FE) em cada potencial como
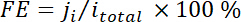 .
.
Nota: A eficiência global Faradaic poderia ser dentro de um intervalo de 90 a 110% devido os erros de taxa de fluxo de gás, densidade de corrente e análise de concentração de gás no GC.
- Emprega um GC, equipado com uma combinação de colunas peneira molecular 5A e micropacked, para análise de gás de produtos durante o CO2RR.
Access restricted. Please log in or start a trial to view this content.
Resultados
Microscopia eletrônica (SEM), varredura, microscopia eletrônica de transmissão (STEM) e espectroscopia de raios-x-energia dispersiva (EDX) imagens de mapeamento são mostradas na Figura 1 , para a caracterização da morfologia de NiN-GS. Átomo tridimensional sonda computadorizada (3D-APT) resultados são mostrados na Figura 2 para a identificação directa da simples distribuição de sites do Ni, bem como sua vizinho ambien...
Access restricted. Please log in or start a trial to view this content.
Discussão
No processo acima eletrofiação, dois passos importantes devem notar-se nos procedimentos de síntese material: 1) a mistura DMF (etapa 1.1.2) e 2) a taxa de bomba ajustando (etapa 1.2.2) para coincidir com a taxa de rotação de aquecimento. A imagem SEM na figura 1A mostra as nanofibras de carbono obtidos interligadas uns com os outros (~ 200 nm de diâmetro). Eles foram quebrados em pedaços pequenos por bola de trituração para caracterizações como mostrado na fi...
Access restricted. Please log in or start a trial to view this content.
Agradecimentos
Este trabalho foi financiado pelo programa Rowland Fellows da Universidade de Rowland Instituto de Harvard. Este trabalho foi realizado em parte no centro para sistemas de nanoescala (CNS), um membro da rede nacional de nanotecnologia infraestrutura, que é apoiado pela Fundação Nacional de ciência sob prêmio nenhum. ECS-0335765. O CNS é parte da Universidade de Harvard.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| syringe pump | KD Scientific | KDS-100 | |
| tube furnance | Lindberg/Blue M | TF55035A-1 | |
| ball miller | SPEX SamplePrep | 5100 | |
| electrochemical work station | BioLogic | VMP3 | |
| pH meter | Orion | 320 PerpHecT | 2 points calibration before use |
| gas chromatograph | Shimadzu | GC-2014 | a combined seperation system consisting of molecular sieve 5A, Hayesep Q, Hayesep T, and Hayesep N |
| mass flow controller | Alicat Scientific | MC-50SCCM-D/5M | |
| ultrapure water system | Millipore | Synergy | |
| vacuum desiccator | PolyLab | 55205 | |
| polyacrylonitrile | Sigma-Aldrich | 181315 | Mw=150,000 |
| polypyrrolidone | Sigma-Aldrich | 437190 | Mw=1,300,000 |
| Ni(NO3)26H2O | Sigma-Aldrich | 244074 | |
| dicyandiamide | Sigma-Aldrich | D76609 | |
| dimethylformamide | Sigma-Aldrich | 227056 | |
| carbon fiber paper | AvCarb | MGL370 | |
| Nafion 117 membrane | Fuel Cell Store | 117 | used as proton exchange membrane in H-cell |
| KHCO3 | Sigma-Aldrich | 431583 | further purified by electrolysis |
| platinum foil | Beantown Chemical | 126580 | |
| saturated calomel electrode | CH Instruments | CHI150 | |
| glassy carbon electrode | HTW GmbH | SIGRADUR | 1 cm × 2 cm |
| wax | Apiezon | W-W100 | |
| Nafion 117 solution | Sigma-Aldrich | 70160 | used as ionomer in catalyst ink preparation |
| forming gas | Airgas | UHP | 5% H2 balanced with Ar |
| carbon dioxide | Airgas | LaserPlus | |
| sandard gas | Airgas | customized | 500 ppm CO, 500 ppm CH4, 1000 ppm H2 balanced with Ar |
| sandard gas | Air Liquide | customized | 100 ppm H2, 100 ppm CO and other alkanes balanced with Ar |
Referências
- Lewis, N. S., Nocera, D. G. Powering the planet: Chemical challenges in solar energy utilization. P. Natl. Acad. Sci. USA. 103, 15729-15735 (2006).
- Appel, A. M., et al. Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation. Chem. Rev. 113, 6621-6658 (2013).
- Jhong, H. R., Ma, S. C., Kenis, P. J. A. Electrochemical conversion of CO2 to useful chemicals: current status, remaining challenges, and future opportunities. Curr. Opin. Chem. Eng. 2, 191-199 (2013).
- Ashford, D. L., et al. Molecular Chromophore-Catalyst Assemblies for Solar Fuel Applications. Chem. Rev. 115, 13006-13049 (2015).
- Nocera, D. G. Solar Fuels and Solar Chemicals Industry. Accounts. Chem. Res. 50, 616-619 (2017).
- Larrazabal, G. O., Martin, A. J., Perez-Ramirez, J. Building Blocks for High Performance in Electrocatalytic CO2 Reduction: Materials, Optimization Strategies, and Device Engineering. J. Phys. Chem. Lett. 8, 3933-3944 (2017).
- Hori, Y., Wakebe, H., Tsukamoto, T., Koga, O. Electrocatalytic Process of Co Selectivity in Electrochemical Reduction of Co2 at Metal-Electrodes in Aqueous-Media. Electrochim. Acta. 39, 1833-1839 (1994).
- Hori, Y. Modern aspects of electrochemistry. , Springer. 89-189 (2008).
- Lin, S., et al. Covalent organic frameworks comprising cobalt porphyrins for catalytic CO2 reduction in water. Science. 349, 1208-1213 (2015).
- Zhang, X., et al. Highly selective and active CO2 reduction electrocatalysts based on cobalt phthalocyanine/carbon nanotube hybrid structures. Nat. Commun. 8, 14675(2017).
- Zhao, C. M., et al. Ionic Exchange of Metal Organic Frameworks to Access Single Nickel Sites for Efficient Electroreduction of CO2. J. Am. Chem. Soc. 139, 8078-8081 (2017).
- Manthiram, K., Beberwyck, B. J., Aivisatos, A. P. Enhanced Electrochemical Methanation of Carbon Dioxide with a Dispersible Nanoscale Copper Catalyst. J. Am. Chem. Soc. 136, 13319-13325 (2014).
- Yang, M., et al. Catalytically active Au-O(OH)(x)-species stabilized by alkali ions on zeolites and mesoporous oxides. Science. 346, 1498-1501 (2014).
- Manthiram, K., Surendranath, Y., Alivisatos, A. P. Dendritic Assembly of Gold Nanoparticles during Fuel-Forming Electrocatalysis. J. Am. Chem. Soc. 136, 7237-7240 (2014).
- Amini, S., Garay, J., Liu, G., Balandin, A. A., Abbaschian, R. Growth of large-area graphene films from metal-carbon melts. J. Appl. Phys. 108, 094321(2010).
- Krasheninnikov, A. V., Lehtinen, P. O., Foster, A. S., Pyykkö, P., Nieminen, R. M. Embedding Transition-Metal Atoms in Graphene: Structure, Bonding, and Magnetism. Phys. Rev. Lett. 102, 126807(2009).
- Jiang, K., Siahrostami, S., Zheng, T., Hu, Y., Hwang, S., Stavitski, E., Peng, Y., Dynes, J., Gangishetty, M., Su, D., Attenkofer, K., Wang, H. Isolated Ni Single Atoms in Graphene Nanosheets for High-performance CO2 Reduction. Energy Environ. Sci. , Advance Article (2018).
- Rodríguez-Manzo, J. A., Cretu, O., Banhart, F. Trapping of Metal Atoms in Vacancies of Carbon Nanotubes and Graphene. ACS Nano. 4, 3422-3428 (2010).
- Jiang, K., et al. Transition metal atoms in a graphene shell as active centers for highly efficient artificial photosynthesis. Chem. 3, 950-960 (2017).
- Jiang, K., Wang, H., Cai, W. B., Wang, H. T. Li Electrochemical Tuning of Metal Oxide for Highly Selective CO2 Reduction. ACS Nano. 11, 6451-6458 (2017).
- Jiang, K., et al. Silver Nanoparticles with Surface-Bonded Oxygen for Highly Selective CO2 Reduction. ACS Sustain Chem. Eng. 5, 8529-8534 (2017).
- Siahrostami, S., et al. Theoretical Investigations into Defected Graphene for Electrochemical Reduction of CO2. ACS Sustain Chem. Eng. 5, 11080-11085 (2017).
- Jiang, K., et al. Metal Ion Cycling of Cu Foil for Selective C-C Coupling in Electrochemical CO2 Reduction. Nat. Catal. , (2017).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados