Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Laboratoire et au champ protocole pour estimer les taux d’érosion de feuille de Dendrogeomorphology
Dans cet article
Résumé
Caractériser l’érosion causée par dendrogeomorphology a généralement porté sur trouver avec précision l’heure de début de l’exposition des racines, par l’examen macroscopique ou changements de niveau cellule causée par l’exposition. Ici, nous offrons une description détaillée des différentes nouvelles techniques pour obtenir des taux d’érosion plus précis de données haute précision microtopographique.
Résumé
L’érosion en nappe est parmi les moteurs essentiels de la dégradation des sols. L’érosion est contrôlée par des facteurs environnementaux et les activités humaines, qui conduisent souvent à des incidences graves sur l’environnement. La compréhension de l’érosion en nappe est, par conséquent, un problème dans le monde entier avec des implications pour l’environnement et des économies. Cependant, les connaissances sur l’évolution de l’érosion dans l’espace et le temps sont encore limitée, ainsi que ses effets sur l’environnement. Ci-dessous, nous expliquons qu'un nouveau protocole de dendrogeomorphological pour dériver érodé épaisseur de sol (E,x) par l’acquisition de microtopographique précises données à l’aide de laser terrestre (TLS) et jauges de profil microtopographique. En outre, des procédures standard dendrogeomorphic, dépendants des variations anatomiques dans les anneaux de la racine, sont utilisées pour établir le calendrier de l’exposition. Profil TLS et de microtopographique calibres servent à obtenir des profils de surface au sol, d'où Ex est évalué après que la distance seuil (TD) est déterminée, c'est-à-dire la distance entre la racine et les sédiments knickpoint, qui permet de définir l’abaissement de la surface du sol causée par l’érosion en nappe. Pour chaque profil, nous avons mesuré la hauteur entre le dessus de la racine et un virtuel plan tangent à la surface du sol. De cette façon, nous avions l’intention d’éviter les petits effets de déformation du sol, qui peut être due à des pressions exercées par le système de racine, ou par la disposition des racines exposées. Cela peut provoquer de petites quantités de sédimentation de sol ou de l’érosion selon la façon dont elles affectent physiquement le ruissellement de surface. Nous démontrons qu’une caractérisation adéquate microtopographique des racines exposées et leur surface de sol associées est très précieuse pour obtenir les taux exacts de l’érosion. Cette constatation pourrait être utilisée pour développer les meilleures pratiques de gestion conçus pour éventuellement arrêter ou peut-être, au moins, réduire l’érosion des sols, afin que les politiques de gestion plus durables peuvent être mises en pratique.
Introduction
Des impacts tant économiques qu’environnementaux produits par l’érosion en nappe rend ce sujet dans une préoccupation mondiale1. Plusieurs méthodes, de techniques directes aux approches axées sur la physique et empiriques, servent à calculer les taux d’érosion de sol sur une variété d’échelles spatiales et temporelles. Les techniques directes utilisent des mesures sur le terrain dans des conditions naturelles et reposent essentiellement sur l’utilisation de Gerlach creux2, collecteurs d’eau3, erosion pins4 et profilomètres5. En outre, les modèles de l’érosion des sols ont été tournés représentant en détail les processus physiques réels responsables de l’érosion,6.
Dendrogeomorphology7 est une subdivision de la dendrochronologie8 qu’il est réussi à caractériser la fréquence et l’ampleur des processus géomorphologiques9,10,11,12, 13,14,15,16,17. Au sujet de l’érosion en nappe, dendrogeomorphology est habituellement employé pour améliorer ou remplacer les méthodes mentionnées ci-dessus, en particulier dans les zones où les taux d’érosion par les techniques directes de sont rares ou indisponible. Dendrogeomorphology est une méthode très flexible pour évaluer l’érosion du sol et peut être utilisé pour calibrer des modèles empiriques et axées sur la physique, ou peut-être comme données de source afin d’améliorer la fiabilité de l’estimation directe techniques18, 19. Dendrogeomorphology permet à l’érosion des sols à être mis en place sur de vastes étendues où les racines exposées sont disponibles. Ces racines exposées devraient montrer les limites de bagues arbre clair et répondent à des profils de croissance annuelle considérée comme optimale d’appliquer les techniques de dendrogeomorphological20. Autres racines exposées à échantillonner doivent être de préférence situés en unités homogènes basées sur leur réaction au sol de l’érosion,21.
La façon de dendrogeomorphical classiques d’estimation de l’érosion en nappe repose sur mesure in situ de l’épaisseur de sol érodé (Ex) de l’époque de la première exposition au présent22,23, 24. Le rapport entre ces deux variables est utilisé pour calculer une valeur de l’érosion dans mm∙yr1. Des recherches menées à ce jour a été entièrement sur l’identification efficacement la première année de l’exposition. L’issue, les modifications de la racine en raison de l’exposition sont analysées au niveau macroscopique25, ou au tissu et les niveaux cellulaires de27,26,28. Le principal changement anatomique présent dans les racines des conifères est en augmentation épaisseur des cernes, suite à un grand nombre de cellules dans le bois initial (EW)26. Une réduction a de même été trouvée dans la zone de lumen des trachéides de EW avec une épaisseur de structure pariétale accrue de bois final (LW) trachéides24,27,29. Ces modifications ont été décrites et quantifiées comme début lorsque l’érosion diminue la surface du sol au-dessus de la racine à peu près trois cm30. Moins d’attention a été accordée à la détermination adéquate du paramètre Ex . L’âge des racines exposées était généralement lié à la hauteur de l’axe central de la racine de la croissance sur le sol de surface31,32. L’estimation de Ex a été corrigée en conséquence étant donné la croissance secondaire en cours30,,33. Plus récemment, ces approches méthodologiques ont également intégré la caractérisation du sol microtopographie pour obtenir l’érosion fiable taux34,35,36.
Nous présentons un protocole de laboratoire et de terrain afin d’estimer les plus précises et fiables feuille taux d’érosion de dendrogeomorphology. Dans ce protocole particulier, nous examinons l’hypothèse que toutes les racines exposées, quel que soit l’orientation relative au chemin de ruissellement et en conjonction avec macrotopographie analyse, l’échantillonnage permet taux d’érosion être précisément reconstruit et quantifiés. Notre objectif, doit donc fournir un protocole pour estimer le taux d’érosion de maximiser la taille de l’échantillon des racines exposées, à l’aide des informations macroscopiques et microscopiques dans la série de cernes de croissance, ainsi que des données topographiques à haute résolution.
Protocole
1. stratégie d’échantillonnage
- Identification des processus géomorphologiques
- Mettre en oeuvre les unités hydrologiques d’intervention approche (HRU)21. À cette fin, identifier les domaines homogènes au sein du site d’étude, comprenant des dépôts de surface et la lithologie, couvert, résidu végétative en contact avec la surface du sol et de la pente. Sélectionnez parmi tous les HRUs, ceux dans lesquels le processus d’érosion de feuille est prédominant.

Figure 1 : exemple de HRUs associé à une ravine sable. Concernant le protocole proposé ici, l’échantillonnage des racines exposées doit être mené dans un HRU dans lequel le processus érosif efficace est l’érosion en nappe (dans cette légende de la figure correspondant à sable exposée avec pente modérée). Ce chiffre a été modifié par Bodoque et al. 21 . S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Échantillonnage des racines exposées
- Recherchez dans les racines de site exposé d’étude correspondant à des espèces d’arbres utiles pour les cernes datant (préférence conifères)20.
- Fournir une description détaillée des caractéristiques spatiales et morphologiques des environs des racines exposées à échantillonner. Recueillir l’information suivante : situation géographique (coordonnées UTM) ; altitude ; aspect en sexagésimales degrés, la colline tant l’emplacement racine particulière (aspect local) ; distance de la section de la racine sur le tronc d’arbre ; pente de la colline et pente de l’emplacement de la racine spécifique (exprimés en degrés) ; orientation de la racine exposée en ce qui concerne le chemin d’accès du ruissellement.
- Prenons un échantillon de sol d’environ 1 kg de la zone qui entoure chaque racine exposée. Les paramètres pour caractériser sont texture, pourcentage de structure organique de matière et de sol.
- Mesurer in situ conductivité hydraulique à l’aide d’un infiltromètre seul anneau sous charge constante.
Remarque : Mettre en œuvre les étapes 1.2.2 et 1.2.3 pour caractériser l’érodabilité des sols. - Localiser les racines exposées qui sont plus loin que de 1,5 m du tronc. À une distance moindre, l’exposition pourrait être liée à la croissance des arbres.
- Couper avec une scie à main au moins 30 racines exposées, avec un diamètre supérieur à 5 cm, 15 cm de long sections. Par la suite, prenez deux tranches d’environ 1,5 cm d’épaisseur.
- En utilisant une truelle de jaugeage, une scie à main et un ruban à mesurer, échantillonner un sous-ensemble des racines enfouies (au moins un tiers des racines exposées totales échantillonnés) à des profondeurs du sol différentes (maximum 20 cm) pour établir l’épaisseur de sol minimale ci-dessous dont les racines commencent à avoir un réponse anatomique dues à l’exposition.

Figure 2 : exemple de la conduite d’échantillonnage sur le terrain. Au moins 30 racines exposées sont sélectionnés et, par la suite, couper avec une scie à main. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
2. Microtopographique de caractérisation de la Surface du sol et des racines exposées à des endroits facilement accessibles
- Utiliser un appareil à balayage Laser terrestre qui peut mesurer jusqu'à 50 000 points par seconde avec une précision de 1 mm à une distance de balayage de 120 m <.
- Examiner au moins deux endroits différents classiques de TLS pour éviter les zones d’ombre.
- Fusionner les différents emplacements en utilisant un minimum de quatre cibles haute définition arpentage (HDS), positionné pour couvrir toute la zone.
- Afin d’obtenir des données topographiques très précises, scanner une superficie moyenne de 300 cm2 depuis les emplacements sélectionnés à l’aide d’une résolution spatiale de 1 mm. inclure les racines exposées et la région environnante qui est représentative de la surface du sol.
3. Microtopographique de caractérisation de la Surface du sol et les racines exposées, aux emplacements terrain difficile et abrupte (environnements montagneux)
- Placez une jauge de profil microtopographique perpendiculaire à la racine exposée et, par la suite, le niveau horizontalement pour toutes les mesures de telle sorte que les différents ensembles de données peuvent être comparées.
- Dessiner le profil obtenu à l’étape 3.1 sur du papier quadrillé pour pouvoir déduire la quantité de sol érodé le long du profil avec précision submillimétrique.

Figure 3 : exemple de caractérisation de la microtopographie de sol à l’aide d’une jauge de profil microtopographique. (A) illustration de racines exposées comme observées le long d’un sentier de randonnée ; (B) des mesures de la microtopographie de sol à l’aide d’un profil microtopographique jauge ; (C) estimation de Ex grâce à l’acquisition de profils microtopographique en dessinant sur un papier millimétré pour permettre de déduire du montant de sol érodé le long du profil et avec une précision submillimétrique. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
4. la détermination du moment de l’exposition des racines
- Analyse macroscopique
- Sécher à l’air les sections obtenues à l’étape 1.2.6 pendant 2 mois.
- Obtenir des deux tranches de sections initiales qui sont chacun environ 2 cm d’épaisseur.
- Poncer et polir les tranches avec papier abrasif (grain jusqu'à 400) afin de faciliter la reconnaissance des anneaux de croissance.
- Scan les tranches avec une résolution minimale de 2 800 dpi afin qu’ils peuvent être analysés avec précision même lorsque les anneaux est particulièrement minces.
- Utiliser l’augmentation en pourcentage de bois d’été et de plus grandes largeurs de cernes comme indicateurs de stress induit par l’exposition.
- Marquer au moins 4-5 rayons le long les diamètres des tranches qui montrent la plus forte variabilité dans les largeurs des anneaux de croissance.
- Utilisez un système d’analyse image ou une table de mesure pour mesurer la largeur des cernes.
- Appliquer les procédures d’interdatation visuelles en comparant la variabilité dans les largeurs de cernes entre les différents rayons, à la fois améliorer la précision de datation pour la première année d’exposition à l’érosion des sols et à correctement jour subséquent anneaux et reconnaître la présence des multiples ou des anneaux discontinus.

Figure 4 : exemple de la façon d’établir une section d’une racine exposée pour accomplir la datation dendrochronologique des cernes série. Dans chaque section, quatre ou cinq rayons sont marqués dans les directions qui montrent la variabilité plus haute au sujet de la largeur des cernes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Analyse au microscope
- Pour les deux échantillons exposés et non exposés racine, utilisez un microtome coulissant pour obtenir des coupes radiales d’environ 1 cm de largeur et 20 microns d’épaisseur.
- Tache de coupes en présence de safranine (c.-à-d., 1 g de safranine + 50 g d’eau + 50 g d’éthanol à 96 %) et déshydrater avec plus en plus riche solution hydro-alcooliques jusqu'à 96 % d’éthanol (par exemple, 50 % et 96 % d’éthanol) jusqu'à ce que l’éthanol soit limpide. Faire tremper les exemples de xylol ou une huile de citron agent (p. ex., Histoclear) de compensation.
- Monter des sections sur des lames revêtues, lamelle couvre-objet avec un époxy durcissement (p. ex., baume du Eukitt, Canada et sécher à température ambiante (c'est-à-dire environ 5 à 8 h pour Eukitt, au moins 24h pour le baume du Canada).
- Observer (sous un grossissement de X 125) et de photographier les échantillons avec un système d’imagerie numérique en microscopie optique.
- Comparer au microscope optique l’empreinte d’anatomique des deux exposés et des échantillons de racines non exposés (étapes 1.2.5 et 1.2.6).
- Prendre des mesures microscopiques à l’aide d’un analyseur d’image sur les photos numériques des paramètres qui ont suivi : une) largeur de l’anneau de croissance ; b) nombre de cellules par anneau ; c) pourcentage de bois final ; et d) zone de lumen dans bois de printemps.
- Tester avec l’analyseur d’image (étape 4.2.6) la présence de canaux résinifères et prendre des mesures pour chaque cycle de croissance.
- Faire une analyse unidirectionnelle ANOVA avec plusieurs tests de la gamme (méthode : 95 % LSD – moins de différence significative) pour les variables anatomiques considérées (étape 4.2.6) vérifier l’existence de différences statistiquement significatives entre les deux groupes de mensurations (racines préalablement exposés vs exposés).
5. estimation de l’épaisseur de la couche de sol érodée depuis l’exposition initiale (Ex)
- Scénario 1 : exposé des racines qui sont parallèles à la voie des eaux de ruissellement.
- Basé sur les données obtenues à l’étape 2.4, utiliser la distance inverse pondération comme la méthode d’interpolation pour obtenir des modèles très précis altimétriques numériques (Man) avec une résolution spatiale de 3 mm.
- Outils SIG permet d’extraire des profils perpendiculaires DEM de la racine exposée avec une distance approximative de 150 cm.
- Effectuez les étapes 5.1.1 et 5.1.2 à des endroits facilement accessibles (étape 2).
- Utiliser les profils perpendiculaires de la racine exposée obtenu à l’étape 3.2 lorsque le site d’étude est situé dans les zones où le terrain est difficile et escarpée (environnements montagneux) (étape 3).
- Dans les profils obtenus lors des étapes 5.1.2 et 5.1.3 Utilisez interprétation visuelle pour localiser la distance seuil (TD), définie comme la distance entre la racine et la knickpoint à la surface du sol. Ceci établit l’abaissement de la surface du sol pour les profils en raison de l’érosion en nappe.
- Estimer l’épaisseur de la couche de sol érodée, en mesurant la hauteur entre le haut de la racine et la knickpoint à la surface du terrain estimée à l’étape 5.1.5.
- Corriger la mesure obtenue à l’étape 5.1.6 il Soustrayez de la croissance en cours secondaire (c.-à-d. , la croissance de la racine depuis l’année de l’exposition) et de l’épaisseur de l’écorce du côté supérieur et inférieur de la racine. Voir Corona et al. 30 pour obtenir une description détaillée.
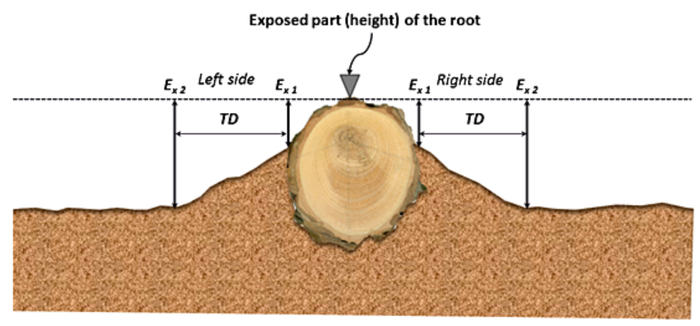
Figure 5 : Exemple est illustrant comment placer TD lorsque les racines exposées échantillonnés sont orientées selon le chemin d’écoulement. Cette figure montre un profil transversal commun de microtopographique de racine non couvert et ses environs immédiats. Ex1 est l’emplacement demandé à l’approche traditionnelle de dendrogeomorphical pour déterminer l’épaisseur de sol érodé ; Ex2 appartient à la position où ce paramètre doit être évaluée. TD est considérée comme une position du guide dont la surface du sol est modifiée par l’érosion en nappe seulement. Ce chiffre a été modifié par Bodoque et al. 34 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Scénario 2 : exposés des racines qui s’exécutent perpendiculaires au trajet du ruissellement
- Mettre en œuvre les étapes 5.1.1 à 5.1.4 comme indiqué sous étape 5.1.
- À l’aide de la calculatrice raster disponible dans n’importe quel logiciel de système d’Information géographique (SIG), pour chaque mesure de profil perpendiculaire la hauteur entre le haut de la racine et la surface du sol à l’aide de la knickpoint à la surface du sol comme une référence. À ce stade mesures de Ex ne sont pas influencés par sédimentation et/ou parcourent l’érosion et, par conséquent, il est possible de mesurer l’érosion des sols.
- Corriger la mesure obtenue à l’étape 5.2.2 à l’aide de la procédure à l’étape 5.1.7.

Figure 6 : exemple dessin comment procéder quand les racines exposées échantillonnés sont orientées selon la perpendiculaire à la chemin de ruissellement Cette figure montre une vue schématique d’un profil de surface au sol associé à une racine perpendiculaire exposée concernant le chemin de ruissellement. Épaisseur de sol érodé (E,x) est quantifié à le knickpoint coïncidant au processus d’érosion la sédimentation et l’érosion qui prévaut est proche de la racine. Ce chiffre a été modifié par Ballesteros-Cánovas et al. 35 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
6. fiche l’érosion des taux Estimation
- Selon les caractéristiques mécaniques du sol du site d’étude, appliquer l’équation 1 (c.-à-d., émet l’hypothèse que la pression de la croissance radiale appliquée par la racine est inférieure à la résistance au cisaillement du sol), ou équation 2 (c'est-à-dire, suppose la stabilité de la axe racine à travers le temps)30:
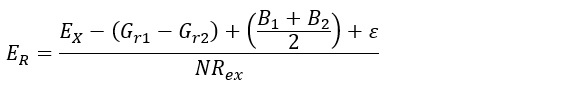 (1)
(1)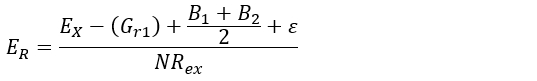 (2)
(2)
Où :
ER (mm∙yr-1), est le taux d’érosion de feuille à estimer.
EX (mm), est-ce que l’épaisseur de la couche de sol érodé depuis l’exposition initiale. Ceci est obtenu en procédant comme 5.1.1 à 5.2.3.
Gr1 et r2de la G(mm) représentent la croissance secondaire (ultérieure) sur la partie haut/bas de la racine après l’exposition. Il est obtenu après avoir effectué l’étape 5.1.7.
B1 et B2 (mm) sont l’épaisseur de l’écorce sur la partie supérieure/inférieure de la racine. Il est obtenu avec la procédure étape 5.1.7.
Ε (mm), est définie comme étant la profondeur minimale du sol sous laquelle racine commence à changer sa configuration anatomique.
NRex (an), est le nombre de cernes d’arbres mis au point après l’année de l’exposition. Elle est obtenue à l’aide de mesures 4.1.1 à 4.2.8.
Résultats
Échantillons de racines exposées souffrent grave détérioration cambiale en raison de l’impact de l’exposition (p. ex., modifications de température, l’incidence de la lumière) et le stress physique, en raison de piétinement par les randonneurs ou animale pâturage et de navigation que les racines l’objet après que qu’ils sont exposés. Détermination de l’existence des anneaux discontinus, comme précisément datant de la première année de la réponse à l?...
Discussion
Le protocole déployé démontre la valeur de caractérisation détaillée et appropriée de la microtopographie de surface au sol, car elle permet de mesurer le taux d’érosion de feuille digne de confiance de dendrogeomorphology. Notre approche méthodologique met l’accent sur l’importance de la caractérisation de la microtopographie dans les environs de racines d’exposition pour améliorer l’estimation de taux d’érosion. Ce facteur a été largement ignoré dans les études antérieures, ce qui entraîne...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les projets de recherche qui a financé cette recherche ont été : MARCoNI (CGL2013-42728-R) ; Dendro-Avenidas (CGL2007-62063) ; MAS Dendro-Avenidas (CGL2010-19274) du ministère espagnol de la Science et technologie et le projet idée-GESPPNN (Marm 163/2010), qui a été financé par le ministère environnement d’Espagne.
matériels
| Name | Company | Catalog Number | Comments |
| Topographic map, soil map, land cover map | To be obtained from public institutions or generate at the first phase of research | ||
| Single ring infiltometer | Turf-Tec International | IN16-W | http://www.turf-tec.com/IN16Lit.html |
| Handsaw | There is noy any specific characteristics to be considered regarding the model | ||
| Measuring tape | With accuracy of 1 mm | ||
| Terrestrial Laser Scanning (TLS) | Leica-Geosystems | Leica ScanStation P16 | https://leica-geosystems.com/products/laser-scanners/scanners/leica-scanstation-p16 |
| Microtopographic Profile Gauge | RS Online | Facom, 19 | https://www.classic-conservation.com/es/herramientas-para-talla-y-escultura-en-madera/511-galga-medidora-de-perfiles.html |
| Sandpaper | from 80 to 400 grit | ||
| Scanner | EPSON | Perfection V800 Photo | https://www.epson.co.uk/products/scanners/consumer-scanners/perfection-v800-photo |
| Image analysis system | Regent Instruments Inc. | WinDENDRO | http://www.regentinstruments.com/assets/windendro_analysisprocess.html |
| Measuring table | IML | https://www.iml-service.com/product/iml-measuringtable/ | |
| Sliding microtome | Thermo Fisher SCIENTIFIC | Microm HM 450-387760 | http://www.thermofisher.com/order/catalog/product/910020 |
| Optical microscope | OLYMPUS | MX63/MX63L | https://www.olympus-ims.com/en/microscope/mx63l/ |
| Digital camera for microscope | OLYMPUS | DP74 | https://www.olympus-ims.com/en/microscope/dc/ |
| Safranin | Empirical Formula (Hill Notation) C20H19ClN4 | ||
| Astrablue | Empirical Formula C47H52CuN14O6S3 | ||
| Alcohol | Alcohol by volume (50%, 75% and 100%) | ||
| Distilled water | H2O | ||
| Citrus oil clearing agent | https://www.nationaldiagnostics.com/histology/product/histo-clear | ||
| Coated slides | Thermo Fisher SCIENTIFIC | https://www.fishersci.com/us/en/products/I9C8JXMT/coated-glass-microscope-slides.html | |
| Hardening epoxy | MERCK | https://www.sigmaaldrich.com/catalog/product/sial/03989?lang=es®ion=ES |
Références
- Montgomery, D. R. Soil erosion and agricultural sustainability. Proceedings of the National Academic of Sciences of the United States of America. 104 (33), 13268-13272 (2007).
- Novara, A., Gristina, L., Saladino, S. S., Santoro, A., Cerdà, A. Soil erosion assessment on tillage and alternative soil managements in a Sicilian vineyard. Soil & Tillage Research. 117, 140-147 (2011).
- Desir, G., Marín, C. Factors controlling the erosion rates in a semi-arid zone (Bardenas Reales, NE Spain). Catena. 71 (1), 31-40 (2007).
- Shi, Z., Wen, A., Zhang, X., Yan, D. Comparison of the soil losses from 7Be measurements and the monitoring data by erosion pins and runoff plots in the Three Gorges Reservoir region, China. Applied Radiation and Isotopes. 69 (10), 1343-1348 (2011).
- Sirvent, J., Desir, G., Gutierrez, M., Sancho, C., Benito, G. Erosion rates in badland areas recorded by collectors, erosion pins and profilometer techniques (Ebro Basin, NE-Spain). Geomorphology. 18 (2), 61-75 (1997).
- Flanagan, D., Ascough, J., Nearing, M., Laflen, J., Harmon, R. S., Doe, W. W. The Water Erosion Prediction Project (WEPP) model. Landscape Erosion and Evolution Modelling. , 145-199 (2001).
- Alestalo, J. Dendrochronological interpretation of geomorphic processes. Fennia -International Journal of Geography. 105, 1-139 (1971).
- Cook, E. R., Kalriukstis, L. A. Methods of Dendrochronology. Methods of Dendrochronology. , 97-104 (1990).
- Pelfini, M. Dendrogeomorphological study of glacier fluctuations in the Italian Alps during the Little Ice Age. Annals of Glaciology. 28 (1639), 123-128 (1999).
- Malik, I., Matyja, M. Bank erosion history of a mountain stream determined by means of anatomical changes in exposed tree roots over the last 100 years (Bílá Opava River - Czech Republic). Geomorphology. 98 (1-2), 126-142 (2008).
- Stoffel, M., Bollschweiler, M., Butler, D., Luckman, B. . Tree Rings and Natural Hazards: A State-of-the-art. , (2010).
- Ballesteros, J. A., Bodoque, J. M., Díez-Herrero, A., Sanchez-Silva, M., Stoffel, M. Calibration of floodplain roughness and estimation of flood discharge based on tree-ring evidence and hydraulic modelling. Journal of Hydrology. 403 (1-2), 103-115 (2011).
- Procter, E., Stoffel, M., Schneuwly-Bollschweiler, M., Neumann, M. Exploring debris-flow history and process dynamics using an integrative approach on a dolomitic cone in western Austria. Earth Surface Processes and Landforms. 37 (9), 913-922 (2012).
- Corona, C., Saez, J. L., Stoffel, M., Rovéra, G., Edouard, J. L., Berger, F. Seven centuries of avalanche activity at Echalp (Queyras massif, southern French Alps) as inferred from tree rings. Holocene. 23 (2), 292-304 (2013).
- Ballesteros-Cánovas, J. A., et al. Can tree tilting be used for paleoflood discharge estimations?. Journal of Hydrology. 529 (P2), 480-489 (2015).
- Šilhán, K. Dendrogeomorphic chronologies of landslides: Dating of true slide movements. Earth Surface Processes and Landforms. 42 (13), 2109-2118 (2017).
- Ballesteros Cánovas, J. A., et al. Gully evolution and geomorphic adjustments of badlands to reforestation. Scientific Reports. , (2017).
- Ballesteros-Cánovas, J. A., et al. Dendrogeomorphology in badlands: Methods, case studies and prospects. Catena. 106, 113-122 (2013).
- Stoffel, M., Corona, C., Ballesteros-Cánovas, J. A., Bodoque, J. M. Dating and quantification of erosion processes based on exposed roots. Earth-Science Reviews. 123, 18-34 (2013).
- Grissino-Mayer, H. D. An updated list of species used in tree-ring research. Tree-Ring Bulletin. 53, 17-43 (1993).
- Bodoque, J. M., Lucía, A., Ballesteros, J. A., Martín-Duque, J. F., Rubiales, J. M., Genova, M. Measuring medium-term sheet erosion in gullies from trees: A case study using dendrogeomorphological analysis of exposed pine roots in central Iberia. Geomorphology. 134 (3-4), 417-425 (2011).
- LaMarche, V. Rate of slope erosion in the White Mountains, California. Geological Scociety of America Bulletin. 72 (10), 1579-1580 (1961).
- LaMarche, V. C. Rates of Slope Degradation as Determined from Botanical Evidence White Mountains California Rates of Slope Degradation as Determined from Botanical Evidence White Mountains California. U.S. Geological Survey Professional Paper. 352 (1), 354-376 (1968).
- Bodoque, J. M., Dies-Herrero, A., Martin-Duque, J. F., Rubiales, J. M., Godfrey, A., Pedraza, J., Carrasco, R. M., Sanz, M. A. Sheet erosion rates determined by using dendrogeomorphological analysis of exposed tree roots: Two examples from Central Spain. Catena. 64 (1), 81-102 (2005).
- Carrara, P. E., Carroll, T. R. The determination of erosion rates from exposed tree roots in the piceance basin, colorado. Earth Surface Processes and Landforms. 4 (4), 307-317 (1979).
- Fayle, D. . Radial Growth in Tree Roots - Distribution, Timing, Anatomy. , (1968).
- Gärtner, H., Schweingruber, F., Dikau, R. Determination of erosion rates by analyzing structural changes in the growth pattern of ex- posed roots. Dendrochronologia. 19, 81-91 (2001).
- Hitz, O. M., Gärtner, H., Heinrich, I., Monbaron, M. Application of ash (Fraxinus excelsior L.) roots to determine erosion rates in mountain torrents. Catena. 72 (2), 248-258 (2008).
- Rubiales, J. M., Bodoque, J. M., Ballesteros, J. A., Diez-Herrero, A. Response of Pinus sylvestris roots to sheet-erosion exposure: An anatomical approach. Natural Hazards and Earth System Science. 8 (2), 223-231 (2008).
- Corona, C., Lopez Saez, J., Rovéra, G., Stoffel, M., Astrade, L., Berger, F. High resolution, quantitative reconstruction of erosion rates based on anatomical changes in exposed roots at Draix, Alpes de Haute-Provence - critical review of existing approaches and independent quality control of results. Geomorphology. 125 (3), 433-444 (2011).
- McAuliffe, J. R., Scuderi, L. A., McFadden, L. D. Tree-ring record of hillslope erosion and valley floor dynamics: Landscape responses to climate variation during the last 400 yr in the Colorado Plateau, northeastern Arizona. Global and Planetary Change. 50 (3-4), 184-201 (2006).
- Danzer, S., Dean, J., Meko, D. M., Sewtnam, T. W. Rates of slope erosion determined from exposedroots of ponderosa pine at Rose Canyon Lake, Arizona. Tree Rings, Environment, and Humanity. , 671-678 (1996).
- Gärtner, H. Tree roots - Methodological review and new development in dating and quantifying erosive processes. Geomorphology. 86 (3-4), 243-251 (2007).
- Bodoque, J. M., Ballesteros-Cánovas, J. A., Lucía, A., Díez-Herrero, A., Martín-Duque, J. F. Source of error and uncertainty in sheet erosion rates estimated from dendrogeomorphology. Earth Surface Processes and Landforms. 40 (9), 1146-1157 (2015).
- Ballesteros-Cánovas, J. A., Corona, C., Stoffel, M., Lucia-Vela, A., Bodoque, J. M. Combining terrestrial laser scanning and root exposure to estimate erosion rates. Plant and Soil. 394 (1-2), 127-137 (2015).
- Bodoque, J. M., Ballesteros-Cánovas, J. A., Rubiales, J. M., Perucha, M. &. #. 1. 9. 3. ;., Nadal-Romero, E., Stoffel, M. Quantifying Soil Erosion from Hiking Trail in a Protected Natural Area in the Spanish Pyrenees. Land Degradation & Development. 28, 2255-2267 (2017).
- Misra, R., Dexter, A., Alston, A. Maximum axial and radial growth pressures of plant-roots. Plant and Soil. 95 (3), 315-326 (1996).
- Clark, L. J., Bengough, A. G., Whalley, W. R., Dexter, A. R., Barraclough, P. B. Maximum axial root growth pressure in pea seedlings: Effects of measurement techniques and cultivars. Plant and Soil. 209 (1), 101-109 (1999).
- Gärtner, H., Cherubini, P., Fonti, P., von Arx, G., Schneider, L., Nievergelt, D., Verstege, A., Bast, A., Schweingruber, F. H., Büntgen, U. A. A Technical Perspective in Modern Tree-ring Research - How to Overcome Dendroecological and Wood Anatomical Challenges. Journal of Visualized Experiments. (97), 1-10 (2015).
- Antonova, G., Stasova, V. Effects of environmental factors on wood formation in Scots pine stems. Trees. 7 (4), 214-219 (1993).
- Saez, J. L., Corona, C., Stoffe, M., Rovéra, G., Astrade, L., Berger, F. Mapping of erosion rates in marly badlands based on a coupling of anatomical changes in exposed roots with slope maps derived from LiDAR data. Earth Surface Processes and Landforms. 36 (9), 1162-1171 (2011).
- Zimmermann, M. . Xylem Structure and the Ascent of Sap. , (1983).
- Tyree, M., Sperry, J. Characterization and propagation of acoustic emission signals in woody plants: towards an improved acoustic emission counter. Plant, Cell and Environment. 12, 371-382 (1989).
- Zheng, M., Chen, X. Statistical determination of rainfall-runoff erosivity indices for single storms in the Chinese Loess Plateau. PLoS One. 10 (3), 1-18 (2015).
- Morgan, R. P., Quiton, J. N., Smith, R. E., Govers, G., Poesen, J. W., Auerswald, K., Chisci, G., Torri, D., Stycaen, M. E. The European Soil Erosion Model (Eurosem): a Dynamic Approach for Predicting Sediment Transport From. Earth Surface Processes and Landforms. 23, 527-544 (1998).
- Ciampalini, R., Follain, S., Le Bissonnais, Y. LandSoil: A model for analysing the impact of erosion on agricultural landscape evolution. Geomorphology. 175, 25-37 (2012).
- Hammitt, W., Cole, D. . Wildland recreation: ecology and management. , (1998).
- Marion, J. L., Leung, Y. F., Nepal, S. K. Monitoring trail conditions: new methodological considerations. George Wright Society Forum. 23 (2), 36-49 (2006).
- Tomczyk, A. M., Ewertowski, M. W. Recreational trails in Poprad Landscape Park , Poland the spatial pattern of trail impacts and use-related, environmental and managerial factors. Journal of Maps. 12, 1227-1235 (2015).
- Jewell, M. C., Hammitt, W. E., Cole, D. N., McCool, S. F., Borrie, W. T., O'Loughlin, J. Assessing soil erosion on trails: A comparison of techniques. Proceedings: Wilderness Science in a time of change Conference Volume 5: Wilderness Ecosystems, Threats, and Management (Proceedings RMRS-P-15-VOL-5). , 133-140 (2000).
- Krause, C., Eckstein, D. Dendrochronology of roots. Dendrochronologia. 11, 9-23 (1993).
- Krause, C., Morin, H. Root growth and absent rings in mature black spruce and balsam fir, Quebec, Canada. Dendrochronologia. 16, 21-35 (1999).
- Poesen, J. Gully erosion and environmental change: importance and research needs. Catena. 50 (2-4), 91-133 (2003).
- Favis-Mortlock, D., Boardman, J. Nonlinear responses of soil erosion to climate change: a modelling study on the UK South Downs. Catena. 25 (1-4), 365-387 (1995).
- Boardman, J., Favis-mortlock, D. Frequency-magnitude distributions for soil erosion, runoff and rainfall - a comparative analysis. Zeitschrift für Geomorphologie. 115, 51-70 (1999).
- Haubrock, S. N., Kuhnert, M., Chabrillat, S., Güntner, A., Kaufmann, H. Spatiotemporal variations of soil surface roughness from in situ laser scanning. Catena. 79 (2), 128-139 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon