Method Article
CRISPR Guide RNA clonage pour systèmes mammaliens
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, un simple, efficace et rentable de clonage de sgRNA est exposée.
Résumé
Le protocole indiqué décrit des méthodes simplifiées pour la production efficace et rentable d’ARN guide associée à Cas9. Deux stratégies de clonage de RNA (gRNA) guide figurent basé sur l’utilisation de l’enzyme de restriction de Type IIS BsmBI en combinaison avec un ensemble de vecteurs compatibles. En dehors de l’accès aux services de séquençage Sanger pour valider les vecteurs générés, aucun équipement spécial ou réactifs ne sont nécessaires en dehors de ceux qui sont standard pour les laboratoires de biologie moléculaire moderne. La méthode décrite est destinée principalement pour le clonage d’un gRNA unique ou un vecteur d’exprimant gRNA apparié à la fois. Cette procédure ne s’adapte pas bien pour la génération de bibliothèques contenant des milliers de gRNAs. À ces fins, des sources alternatives de synthèse d’oligonucléotide comme la synthèse de l’oligo-puce sont recommandés. Enfin, alors que ce protocole met l’accent sur un ensemble de vecteurs de mammifères, la stratégie générale est en plastique et est applicable à tout organisme, si le vecteur gRNA approprié est disponible.
Introduction
Protéine associée à la CRISPR 9 (Cas9) est une endonucléase RNA guidée qui est orientée vers une cible génomique lorsque complexé avec un petit guide bien conçu ARN (gRNA)1,2. gRNAs forment une séquence de nucléotides 20 (la protospacer), qui est complémentaire de la séquence génomique cible. À côté de la cible génomique séquence est un 3' protospacer associés à motif (PAM), qui est requis pour la liaison de Cas9. Dans le cas de Streptococcus Pyogenes Cas9 (SpCas9), c’est la séquence NGG. Sur la liaison à la cible de l’ADN, Cas9 fend les deux brins de l’ADN, stimulant ainsi les mécanismes de réparation qui peuvent être exploitées pour modifier le lieu d’intérêt. L’activation de la voie de (NHEJ) fin-joining erreurs non homologue peut provoquer la rupture d’un gène cible. Alternativement, les réparations effectuées par une recombinaison homologue peut stimuler l’intégration ciblée d’une séquence d’ADN désirée si un modèle de donateurs est prévu le6. Nucléase-morts Cas9 variantes (dCas9) peuvent également être généré3 par mutation des résidus dans Cas9 qui sont essentiels pour l’activité endonucléolytique. dCas9 reste compétente pour la liaison de l’ADN mais ne coupe pas sa cible lié. En fusionnant divers domaines effecteurs à dCas9 et il dirige près de site de départ transcription d’un gène, le dCas9 peut être utilisé pour l’induction de gènes sélective ou partielle de gène silencieux4,5.
Bien qu’incroyablement puissant, la possibilité d’utiliser Cas9 pour cibler une séquence génomique d’intérêt nécessite qu’un utilisateur génère d’abord un gRNA spécifique à la cible (x). Une variété de méthodes pour la construction de vecteurs d’expression gRNA précédemment ont été décrites, bon nombre de variables de l’efficacité et coût6,7,8. Stand-Alone amplimères PCR peut être utilisé comme gRNAs pour le dépistage rapide, allant de la livraison des oligonucléotides de transfection dans plusieurs heures ; Cependant, cette technique nécessite Ultramer (plus de 100 bp) synthèse des oligo, qui est cher9. Il est également possible d’acheter des gBlocks qui sont plus rentables que les Ultramers. Comme Cas9 est rapidement devenue une partie intégrante de la boîte à outils pour la biologie moléculaire moderne, une méthode simple, peu coûteuse et très efficace pour le clonage gRNA serait une aubaine pour le champ. La méthode décrite ici a été employée dans notre groupe et les laboratoires collaborent depuis plusieurs années pour générer de plus 2 000 gRNAs unique4.
La méthode décrite se concentre sur les techniques de clonage des vecteurs LENTIVIRAUX de compatibles contenant un gRNA unique ou au plus deux gRNAs. Pour la génération des plasmides contenant plus de deux gRNAs ou de cloner une bibliothèque de gRNAs, approches alternatives sont recommandées9,10,11,12.
Protocole
Remarque : Le protocole suivant décrit comment effectuer la conception gRNA à l’aide des outils en ligne (étapes 1.1 à 1.4), qui sont communs à toutes les méthodes de construction de plasmide gRNA détaillées dans ce manuscrit. Une fois identifiés les gRNAs désirés, les étapes pour commander les oligonucléotides nécessaires sont décrites ainsi que différentes méthodes pour introduire les oligonucléotides dans des vecteurs d’expression (par exemple, pSB700). 2 méthodes de clonage unique vecteurs exprimant le guide basés sur chaque ligature dans un vecteur d’expression prédigérées (étapes 2-7,3) ou Golden Gate clonage (étapes 8 à 8,4) sont présentées. Décrites plus loin est une stratégie pour appariés exprimant le guide de vecteurs de clonage à l’aide de la chaîne par polymérase (PCR) suivie du Golden Gate, clonage (étapes 11 à 16). Enfin, des méthodes communes pour effectuer une transformation chimique d’e. coli (étapes 9 à 9,6) et une expression vector séquence de validation (étapes 10 à 10.2.3) sont également décrites.
- Concevoir des oligonucléotides gRNA à l’aide d’outils en ligne comme suit.
- GRNAs de conception à l’aide des outils en ligne tels que l' outil en ligne (https://crispr.med.harvard.edu/sgRNAScorerV2/) de sgRNA buteur 2.013 ou alternatives telles que l’outil de conception large sgRNA (http://portals.broadinstitute.org/gpp/public/analysis-tools/ sgrna-conception)14 et plusieurs autres15.
- Utilisez le nom de gène, symbole ou brut des séquences d’ADN cible pour générer des séquences de gRNA potentiels.
Remarque : Un fichier de feuille de calcul (.csv/.xls) avec tous les gRNAs potentiels contre le gène ou la séquence fournie est créé. La qualité de la gRNAs potentiels sera signalée comme Score si on utilise l’outil en ligne de sgRNA buteur 2.0 ou individualisées efficacité % si on utilise l’outil de conception de sgRNA large. Ces deux mesures sont obtenues au basée sur l’activité de découpe sur la cible. - Tenir compte de l' activité hors-cible dans la sélection gRNA classement le gRNAs.
Remarque : Les guides optimales sont ceux avec la plus grande efficacité sur la cible et l’activité moins hors-cible. Pour l’activation (CRISPRa), gRNAs sont conçus pour cibler la région allant de 1 à 200 PB en amont du début de transcription site (TSS)4,15. Pour l’inhibition (CRISPRi), gRNAs sont conçus pour cibler la région de 50 PB en amont du TSS jusqu'à 300 PB en aval de la TSS5. Pour désactiver un gène à l’aide de Cas9 couper, gRNAs sont conçus pour cibler le premier 10-50 % de la séquence codante en aval de l’initiatrice de codon (comme gRNAs ciblant l’extrémité 3' du gène auraient dû être divulgués soient moins efficaces)13. - S’assurer aucune BsmBI les sites internes ne sont présents si les oligonucléotides sont utilisées pour le clonage de Golden Gate, car cela se traduira par les oligonucléotides recuits étant digéré13.
- Sélectionner les séquences génomiques cible et supprimer le 3' NGG PAM (en laissant seulement la séquence de protospacer) pour la modification de séquences oligonucléotidiques gRNA unique (p. ex., séquence de démarrage : CGCGTGCTCTCCCTCATCCATGG).
Remarque : Si vous utilisez une feuille de calcul, la formule suivante va supprimer 3' NGG : =LEFT(A2,LEN(A2)-3), où A2 est la cellule contenant la séquence cible et la PAM.- Ajouter CACCG à l’extrémité 5' de l’oligo.
Remarque : Lors de la ligature à l’épine dorsale pSB700, cette séquence comprendra l’extrémité 3' du promoteur U6 conduite la transcription de la gRNA. La séquence « CACC » garantit que les oligo est compatible avec les surplombs du vecteur pSB700 BsmBI-digéré. Le « G » est une exigence des promoteurs de la polymérase III et assure l’initiation efficace de la transcription de la gRNA. Utilisez la formule suivante dans une feuille de calcul pour effectuer cette tâche : =CONCATENATE("CACCG",(B2)), où B2 est la cellule contenant la séquence protospacer [par exemple, ajout la 5' CACCG de séquence à le protospacer : CACCGCGCGTGCTCTCCCTCATCCA (ceci est les oligo avant définitive dans l’ordonnance)]. - Créer un complément inversé (rc) de la séquence protospacer.
Remarque : par exemple, le complément inverse de la protospacer ci-dessus est TGGATGAGGGAGAGCACGCG. - Ajouter AAAC à l’extrémité 5' de le protospacer rc. Ajouter une C supplémentaire à l’extrémité 3' de le protospacer rc (oligo inverse).
Remarque : La séquence « AAAC » garantit que les oligo est compatible pour le clonage dans le vecteur pSB700 BsmBI-digéré. Le « C » supplémentaire sur l’extrémité 3' est nécessaire de recuire la séquence à la responsable « G » ajouté à l’oligo avant. Utiliser la formule suivante dans une feuille de calcul pour effectuer cette tâche =CONCATENATE("AAAC",(C2),"C"), où C2 est la cellule qui contient la séquence inverse complément [par exemple, AAACTGGATGAGGGAGAGCACGCGC (c’est la finale oligo inverse qui est commander)].
- Ajouter CACCG à l’extrémité 5' de l’oligo.
- Commander les oligonucléotides, sans aucune modification supplémentaire sur les oligonucléotides.
- Commander la quantité minimale d’oligo requis, que seules de très petites quantités sont nécessaires pour les réactions de clonage.
- Diluer les amorces lyophilisés à une concentration finale de 100 μM à 1 x tampon TE (10 mM Tris-Cl, pH 7.5 avec EDTA 1 mM).
- Aliquotes 1:1 et inverses oligonucléotides (p. ex., 10 μL de chaque) dans des bandes-tubes PCR.
Remarque : Ceci permettra le clonage rapide de nombreux gRNAs à la fois à l’aide d’une pipette multicanaux.- Vortex et spin down les mélanges oligo (100 x g pendant 15 s). Incubez la réaction à température ambiante pendant 5 min avant de configurer la ligature.
Remarque : Il n’est pas nécessaire chauffer et refroidir les mélanges oligo pour faciliter leur recuit. Il est à noter que 3-4 paires d’oligonucléotides gRNA peuvent être mis en commun et recuits en une seule réaction (par exemple, mélange 3 μL de vers l’avant et 3 μL d’inverser oligonucléotides ensemble de jusqu'à 4 paires d’oligo gRNA, ce qui donne un volume total de 24 μL). Le volume des oligonucléotides utilisé pour le recuit peut être ajusté pour répondre aux besoins de l’utilisateur.
Remarque : Les étapes 6-7.3 décrivent la predigestion de pSB700. Pour une autre méthode, reportez-vous à l’étape 8, qui décrit une seule étape BsmBI restriction des trompes.
- Vortex et spin down les mélanges oligo (100 x g pendant 15 s). Incubez la réaction à température ambiante pendant 5 min avant de configurer la ligature.
- Digérer les 1-5 μg du vecteur d’expression guide sélectionné pSB700 avec BsmBI (0,5 μL / 1 μg) pendant 1 h à 55 ° C15. Effectuer la digestion du vecteur pSB700 gRNA expression dans un volume total de 40 μL (tableau 1).
- Exécuter les produits de digestion sur gel d’agarose à bas point de fusion 1,5 % (wt/vol).
- Découper la bande d’épine dorsale vector digérées qui correspond à un fragment de ~ 9 kb en taille et placez la tranche de gel dans un tube de microtubes de 1,5 mL (Figure 1).
- Un kit de purification de gel commercial permet d’extraire l’ADN du gel d’agarose selon les instructions du fabricant.
- Éluer l’ADN dans 10-15 μL de tampon TE (10 mM Tris, pH 7,5 ; 10 mM Tris, pH 8,0) pour obtenir un concentré éluat.
- Ligaturer les oligonucléotides gRNA recuit de l’étape 4 dans le vecteur d’expression guide pSB700 BsmBI-digéré dans une réaction de 20 μL (tableau 2) pour le clonage des oligonucléotides gRNA dans le vecteur d’expression pSB700 prédigéré.
- Tout d’abord, ajouter l’eau, tampon et ADN, puis vortex le mélange et enzyme, vortex 1 fois final après l’ajout de l’enzyme et la Centrifuger la solution (100 x g pendant 15 s). Incuber les réactions à la température ambiante jusqu’au lendemain.
- Inclure une réaction de contrôle négatif non-insert qui a un vecteur digérés BsmBI seul, sans un gRNA recuit oligo insert. 1 μL d’eau peut être utilisé à la place de la 1 μL d’oligonucléotides gRNA du contrôle négatif non-insert.
- Procéder à la transformation (étape 9).
Note : Étape 8 est une méthode alternative à la predigestion de pSB700 comme décrit aux étapes 6-7.3.
- Introduire les oligonucléotides gRNA (décrites aux étapes 1-5.1) dans le vecteur pSB700 grâce à l’utilisation de Golden Gate clonage pour la ligature de restriction de BsmBI seule étape.
- Assembler les master mix (1 x) — si gRNAs multiples sont être clonés, préparer le mélange maître sans les oligonucléotides insert ajoutés (tableau 3). Aliquot le capitaine mélanger dans des tubes PCR et utiliser une pipette multicanaux pour ajouter les oligonucléotides gRNA d’étape 4.2. Inclure un contrôle non-insert à l’aide de 1 μl d’eau.
- En incluant les enzymes BsmBI et T4 DNA ligase au sein de la même réaction, la digestion simultanée de restriction et ligature sont atteints (c.-à-d., Golden Gate clonage). Utiliser le protocole de porte Simple suivant pour digérer le vecteur et ligaturer les inserts dans 1 réaction : garder la réaction à 37 ° C pendant 2 h, à 50 ° C pendant 10 min, à 65 ° C pendant 15 min, à 80 ° C pendant 15 min et enfin , tenez-le à 4 ° C.
- À noter, vérifier que les oligonucléotides ne contiennent pas de sites de BsmBI avant d’utiliser cette méthode. Si les gRNAs être clonés contiennent des sites de restriction de BsmBI, ils vont être digérés lors de l’addition de BsmBI. Cela empêche l’utilisateur d’obtenir des transformants.
- Après la réaction initiale de porte Simple, ajouter une supplémentaire μL 0,5 de BsmBI enzyme à chaque réaction et placez-les à 55 ° C pendant 1 h. Après la digestion, maintenir la réaction à 4 ° C ou congelez-la jusqu’au moment de transformer. Ce second tour de l’incubation de l’enzyme de restriction supprime tout non digérés ou religaturé sauvage pSB700 vecteur colonne vertébrale du mélange réactionnel afin que seuls vecteurs qui ont reçu les inserts oligo restent intactes et donneront des transformants.
- Procéder à la transformation (étape 9).
- Transformer les 0,5 μl du mélange réactionnel en 8 μL de compétentes d' Escherichia coli [p. ex., NEB, DH5a (1-3 x 109 UFC/µg d’ADN de pUC19) ou NEB Stable 1 - 3 x 109 UFC/µg d’ADN de pUC19). Pour les plasmides des gènes, cellules stables NEB fournira plus cohérente des rendements de plasmide.
- Supprimer les e. coli de stockage à-80 ° C et Décongelez-le sur glace pendant 5-10 min.
- Ajouter 0,5 μl du mélange réaction à 8 μL de compétentes d' Escherichia coli et garder le mélange sur la glace pendant 30 min.
- Chaleur de choc le mélange à 42 ° C pendant 45 s.
- Posez-la sur la glace pendant 2 min.
- Récupérer la culture sur un agitateur rotatif dans 250 μL de médias SOC pendant 1 h à 37 ° C pendant NEB DH5a et à 30 ° C pour les écuries de l’ONÉ.
- Plaque de 80 μL de la culture sur une résistance aux antibiotiques appropriée lysogénie bouillon (LB) plaque et incuber durant une nuit à 37 ° C pendant NEB DH5a et à 30 ° C pour les écuries de l’ONÉ [par exemple, pSB700 est plaqué sur LB avec plaques d’ampicilline (100 μg/mL)] (Figure 3).
- Valider la séquence du plasmide expression gRNA : vérifier la séquence de chaque colonie par Sanger sequencing à l’aide de l’apprêt 5'-GAGGGCCTATTTCCCATGATTCC-3' quels nombres premiers au promoteur U6 en amont de l’oligo gRNA insérer.
- Prélever des colonies de 2-3 par la réaction de séquençage (tableau 4).
Remarque : Plusieurs fournisseurs de séquençage maintenant offre des services qui peuvent exécuter Sanger sequencing directement à partir de colonies bactériennes, ce qui réduit considérablement les temps et les coûts en éliminant le besoin de purifier les plasmides avant séquençage. Par ailleurs, un kit d’isolation de plasmide peut servir à récupérer l’ADN plasmidique des clones bactériens individuels. Plasmides purifiés peuvent alors être soumises pour le séquençage. Si une réaction de mise en commun de la ligature est exécutée, utilisez tableau 4 comme un guide pour le nombre de colonies qui devraient être sélectionnés et présentés pour le séquençage. - Après la confirmation par séquence, isoler les plasmides d’expression gRNA.
- Utiliser un embout de la pipette stérile pour inoculer la colonie voulue en une culture de 5 mL de milieu LB contenant 100 μg/mL d’ampicilline pour vecteurs d’expression pSB700.
- Cultiver les cellules dans un incubateur rotatif à 100 tr/min à 37 ° C pendant la nuit (30 ° C si ONÉ écuries sont utilisés).
- Isoler l’ADN de plasmide issus des cultures à l’aide d’un kit de préparation de plasmide, suivant le protocole du fabricant.
Remarque : Même si les méthodes ci-dessus permettent aux utilisateurs de créer de simples vecteurs contenant gRNA, ce protocole permettra aux utilisateurs de créer des vecteurs qui contiennent 2 gRNAs, chacune entraînée par son propre promoteur III de RNA polymérase.
- Prélever des colonies de 2-3 par la réaction de séquençage (tableau 4).
- Pour une conception gRNA appariés, utiliser le fichier de sortie dans les outils de conception de sgRNA décrites ci-dessus (étapes 1.1 à 1.4), puis sélectionnez 2 guides d’intérêt.
- Pour une activation ou de la répression, sélectionnez paires de guides qui sont au moins 30 nt dehors.
- Pour gRNAs utilisé pour la coupe, sélectionnez guides qui ciblent les 2 différents exons du gène.
- Pour les instructions qui suivent, de désigner le premier gRNA dans le tableau gRNA-A et le deuxième gRNA dans le tableau gRNA-B, pour créer une modification de séquences oligonucléotidiques gRNA appariés.
Remarque : Les oligo utilisé pour créer gRNA-a s’appellera fA, et les oligo inverse utilisé pour introduire gRNA-B sera dénommé rB. La méthode de clonage ci-dessous ajoute automatiquement un G initial à l’extrémité 5' de chacune du gRNAs.- Créez les oligo fA approprié comme suit.
Note : Les 20 nucléotides comprenant le gRNA ciblant la séquence pour gRNA-A volonté constituent la séquence de fA initiale sur laquelle les étapes suivantes seront appuiera (p. ex., protospacer - aggggctacaccactcattg).- Ajouter TTTTCGTCTCTCACCG à l’extrémité 5' de fA (par exemple, de la séquence de TTTTCGTCTCTCACCGaggggctacaccactcattg).
- Ajouter GTTTTAGAGCTATGCTGAAAAGCA à l’extrémité 3' de fA (par exemple, de la séquence TTTTCGTCTCTCACCGaggggctacaccactcattgGTTTTAGAGCTATGCTGAAAAGCA). Il s’agit de la version finale de la fA oligo qui seront commandé.
- Créez les oligo rB nécessaire comme suit.
Remarque : Les 20 nucléotides comportant la séquence de ciblage gRNA pour gRNA-B constituera la séquence initiale de rB sur lesquels les étapes suivantes seront appuiera (par exemple, de le gtcccctccaccccacagtg départ de séquence).- Prendre le complément inverse de rB = (revcom) rB (p. ex., cactgtggggtggaggggac).
- Ajouter TTTTCGTCTCTAAAC à l’extrémité 5' de (revcom) rB (e.g., TTTTCGTCTCTAAACcactgtggggtggaggggac).
- Ajouter CGGTGACCCAGGCGGCGCACAAG à l’extrémité 3' de (revcom) rB (p. ex., TTTTCGTCTCTAAACcactgtggggtggaggggacCGGTGACCCAGGCGGCGCACAAG). Il s’agit de la version finale de l’oligo rB qui seront commandé.
Remarque : les formules suivantes peuvent être utilisés avec un logiciel tableur commun pour modifier automatiquement les séquences oligo : = CONCATENATE("TTTTCGTCTCTCACCG",(A2), « GTTTTAGAGCTATGCTGAAAAGCA »), où A2 est la cellule qui contient la séquence de la fA et = Concatenate("TTTTCGTCTCTAAAC",(B2), » CGGTGACCCAGGCGGCGCACAAG »), où B2 est la cellule qui contient la séquence de rB (revcom).
- Créez les oligo fA approprié comme suit.
- Commander les oligonucléotides auprès d’un fournisseur de synthèse de choix. Aucune modifications supplémentaires ne sont nécessaires.
- L’ADN de plasmide préparé permet d’effectuer des PCR avec des amorces de fA et de rB. Il s’attache les deux vers l’avant et l’inverses gRNAs au fragment PCR produit de ce plasmide et volonté permettre à chacun de s’exprimer depuis son propre promoteur (promoteurs U6 et 7SK — des promoteurs différents sont utilisés dans cette conception pour empêcher une recombinaison virale).
- Le protocole de PCR spécial Phusion GC permet de créer le fragment nécessaire : garder le mélange à 98 ° C pendant 1 min (1 cycle), à 98 ° C pendant 15 s, à 53 ° C pendant 15 s, à 65 ° C pendant 2 min et à 72 ° C pendant 4 min (30 cycles) , puis maintenez-le à 4 ° C (tableau 5).
- Exécuter le produit PCR sur un gel d’agarose à 1 % et vérifier que la 1 bande est visible à ~ 490 bp (Figure 2).
- Couper et extraire ce produit de la PCR en utilisant un gel extraction kit de choix. Éluer l’ADN dans 15 μL de tampon TE (10 mM Tris, pH 7,5 ; 10 mM Tris, pH 8,0) ou de l’eau distillée.
- Mesurer la concentration du produit extrait ainsi que celle du vecteur pSB700 avec un spectrophotomètre pour le calcul de molarité de l’ADN. Normaliser le produit de la PCR et le vecteur à une concentration de 40 femtomoles/μL.
Remarque : Plusieurs sites Internet est disponibles pour aider avec le calcul de la molarité d’une solution d’ADN donnée basée sur la longueur de l’ADN et sa concentration en solution (par exemple, Promega : http://www.promega.com/a/apps/biomath/index.html?calc=ugpmols). Le calculateur utilise la formule :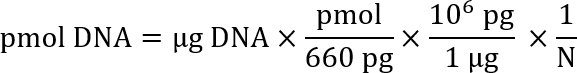
Ici, N est la longueur de la séquence nucléotidique.
- Mettre en place une réaction de digestion et ligature restriction simultanées utilisant le protocole décrit aux étapes 8-8,4 pour cloner le fragment PCR dans un vecteur de pSB700.
- Au lieu d’ajouter 1 μL de solution d’amorce de la réaction, ajouter 1 μL de 40 fmole/μl du produit PCR. En outre, utiliser 1 μL du vecteur pSB700 à une concentration de 40 fmole/μL.
Remarque : Rapports molaires égales conduisent à des résultats conformes, même si même dans les cas où les rapports exacts ne sont pas utilisés, les colonies peuvent être obtenus.
- Au lieu d’ajouter 1 μL de solution d’amorce de la réaction, ajouter 1 μL de 40 fmole/μl du produit PCR. En outre, utiliser 1 μL du vecteur pSB700 à une concentration de 40 fmole/μL.
- Après avoir terminé le processus de réaction du Golden Gate (étapes 8-8.4), procéder à la vérification de séquence et de la transformation (étapes 9 - 10.2.3).
Résultats
Les méthodes décrites dans le présent protocole sont pour la création de deux vecteurs d’expression gRNA simple ou jumelé. GRNA unique exprimant les vecteurs peut être créée en soit predigesting l’épine dorsale de vecteur (Figure 1) suivie il ligaturant dans une série de courts oligonucléotides ou à l’aide de Golden Gate clonage pour digérer simultanément l’épine dorsale de vecteur et ligaturer dans un série de courts oligonucléotides en une seule réaction. Également fourni est une méthode de production de vecteurs qui contiennent 2 gRNAs, chacun conduit par son propre promoteur indépendant, en clonant un fragment PCR personnalisé (Figure 2).
Un clonage réussi pour les protocoles décrits se traduira par l’apparition de colonies beaucoup plus pour les transformations avec l’insertion appropriée d’ADN que sur la plaque de contrôle non-insert (Figure 3).
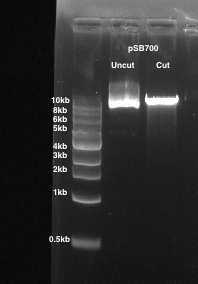
Figure 1 : la digestion d’un vecteur d’expression gRNA pSB700. gel d’agarose à 1 % est utilisé. Piste 1 : uncut pSB700. Voie 2 : pSB700 coupé avec BsmBI.
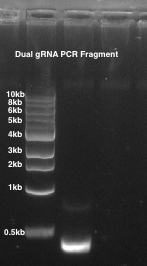
Figure 2 : jumelé gRNA PCR. gel d’agarose à 1 % est utilisé. Piste 1 : un guide appariés PCR fragment de ~ 490 bp.
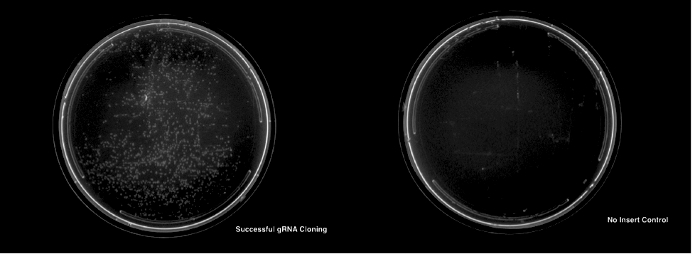
Figure 3 : le clonage réussi et la transformation d’un plasmide gRNA. Le panneau de gauche montre un LB et plaque ampicilline avec transformé avec succès des colonies. Le panneau de droite montre une plaque de contrôle non-insert n’indiquant aucune colonie. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| vecteur d’expression pSB700 guide | 1-5 μg |
| Tampon de NEB 3.1 | 4 ΜL |
| BsmBI | 1 ΜL |
| Eau distillée | jusqu'à 40 μL |
| Volume total | 40 ΜL |
Tableau 1 : La digestion de restriction d’un vecteur d’expression gRNA pSB700 avec BsmBI.
| Recuit gRNA oligos (réaction simple ou groupée) | 1 ΜL |
| Vecteur d’expression digérés BsmBI pSB700 guide | 1 μL (~ 100-250 ng) |
| 10 x T4 DNA Ligase tampon de réaction | 2 μL (1 x concentration finale) |
| T4 DNA Ligase | 1 μL (120 unités) |
| Eau distillée | 15 ΜL |
| Volume total | 20 μl |
Tableau 2 : Une réaction de ligature d’oligonucléotides gRNA dans un vecteur d’expression gRNA pSB700 prédigérées.
| Réactif | Volume (1 x) |
| H2O | 6 ΜL |
| Ligase T4 | 0,5 ΜL |
| ATP | 1 ΜL |
| BsmBI | 0,5 ΜL |
| Tampon de NEB 3.1 | 1 ΜL |
| Vecteur (par exemple, pSB700) (40 fmol) | 1 μlL |
| Insertion - vers l’avant et d’inverser les oligos ou fragment PCR pour double guide (40fmol) | 1 μL (0,5 μL forward et reverse 0,5 μL) |
Tableau 3 : Une seule étape BsmBI restriction et la réaction de ligature gRNA mélangent.
| Pour 1 guide | colonies de la séquence 3 |
| Pour les 2 guides | séquence 5-10 colonies |
| Pour les 3 guides | séquence 10-15 colonies |
| Pour les 4 guides | 15-20 colonies de séquence |
Tableau 4 : Le nombre de colonies à séquencer pour recommandés mis en commun gRNA clonage des réactions.
| Composant PCR | Réaction de 50 µL |
| Primer avant 10 µM | 2,5 ΜL |
| 10 µM amorce inverse | 2,5 ΜL |
| 5 x Phusion HF ou tampon de GC | 10 ΜL |
| dNTPs 10 mM | 1 ΜL |
| Modèle de l’ADN | 100 ng |
| Phusion ADN polymérase | 0,5 ΜL |
| Eau exempte de nucléase | Jusqu'à 50 µL |
Tableau 5 : Un mélange PCR de gRNA appariés.
Discussion
Un certain nombre de modifications de gain de temps et de coût ont été apportée à la construction de vecteur gRNA expression. Un protocole de restriction et de ligature seule étape est décrite ainsi qu’une méthode de construction de vecteur expression gRNA appariés. L’expression gRNA appariés est obtenue par une amplification par PCR en utilisant des oligonucléotides contenant une séquence cible de gRNA vers l’avant (n20) et le complément inverse d’une autre cible (n20). Cela introduit ensuite un promoteur RNA Pol III secondaire (7SK) ainsi qu’une queue de sgRNA en exprimant conventionnellement gRNA simples plasmides d’expression.
Une conception minutieuse oligonucléotide assurera un ACP réussi pour la construction de paires gRNA comme une ligature collant-fin. Suite à la restriction de la seule étape et la réaction de la ligature, l’ajout de plus de BsmBI assurera que tous les vecteurs d’expression non modifiés lors de la réaction sont coupés. Cela permettra de réduire considérablement l’arrière-plan lors de la transformation. À l’aide de NEB-Stable compétentes d' Escherichia coli et une croissance à 30 ° C augmentera le rendement d’une transformation réussie.
Les avantages de que cette technique a sur les pratiques courantes incluent une simplification du processus d’oligonucléotide recuit, une restriction de la seule étape du vecteur d’expression gRNA et la ligature des oligonucléotides et la possibilité d’utiliser classiques vecteurs d’expression gRNA unique pour l’expression des guides appariés. Alors que le protocole décrit ici se concentre sur un ensemble de vecteurs de mammifères, la stratégie générale est en plastique et est applicable à tout organisme, à condition que le vecteur gRNA approprié est disponible. Dans l’ensemble, le protocole décrit gagner du temps et coûts.
Toutefois, il convient de noter que la procédure décrite de l’achat d’oligonucléotides individuels ne s’adapte pas bien pour la génération de bibliothèques contenant des milliers de gRNAs. À ces fins, des sources alternatives de synthèse d’oligonucléotide comme la synthèse de puce oligo sont recommandés.
Il est utile d’inclure un contrôle non-insert lors du clonage gRNAs. Cette réaction peut être facilement mises en place en parallèle avec les réactions d’intérêt et peut être utilisée pour déterminer si une digestion incomplète du vecteur départ a contribué aux colonies observées à la fin de la procédure. En outre, si un des protocoles de clonage ci-dessus a échoué en raison d’une épine dorsale vector incomplètement digérés ou l’efficacité de la ligature des pauvres, nous suggère d’essayer l’alternative clonage méthode que nous présentons.
Lorsque vous utilisez Golden Gate clonage pour digérer le vecteur et ligaturer dans les oligonucléotides petits au sein d’une seule réaction simultanément, il est important de vérifier que le gRNA être clonés dans le vecteur n’a pas un site de BsmBI à l’intérieur, comme cela entraînera t gRNA il a été coupé et l’absence de colonies sur la transformation.
Le gRNA clonage stratégie que nous présentons permet une génération rapide et rentable de gRNAs ~ 10 US $ par guide, avec la plus grande partie des coûts provenant de la synthèse d’oligonucléotides et la vérification de séquence. Alors que la méthode décrite est conçue pour permettre aux utilisateurs de générer gRNAs pour utilisation avec SpCas9, le protocole peut être facilement adapté pour être utilisé avec Cas9 orthologues ou autres endonucléases guidée RNA tels que Cpf1 ou C2C2, avec de légères modifications à la colonne vertébrale de vecteur et la surplomb de l’oligonucléotide séquences16,17.
Le protocole décrit ci-dessus fournira gRNA vérifier à la séquence des plasmides d’expression en 3 d (en commençant par oligonucléotides conçues), qui est nettement plus rapide que les méthodes actuelles. Cela comprend la conception de gRNA de 1 h (mesures 1-2.3), la dilution et l’aliquote des oligonucléotides de 10 min (étapes 3-5.1), la digestion et la purification du vecteur d’expression gRNA pSB700 de 2 h (étapes 6 à 6,4), le clonage des oligonucléotides gRNA dans un predi vecteur d’expression gRNA Gested pSB700 nuit à température ambiante (étapes 7 à 7,3), la ligature de restriction seule étape BsmBI de 3 h et 40 min (étapes 8-8.4), la transformation de 16 h (étapes 9 à 9,6) et la validation de la séquence du plasmide gRNA expression de 24 h (avec la durée selon la disponibilité de séquençage sanger et la vitesse suivant la présentation de la colonie bactérienne ; l’étape 10). La conception gRNA appariés et la modification de la séquence prend 1 h (étapes 11 à 13). Le paire gRNA PCR prend 3,5 h (étapes 14-14,4). Le clonage du fragment PCR dans un vecteur de pSB700 prend 3h et 40 min (étape 15-16).
Les questions plus probables qui peuvent être recouvertes de ce protocole se rapportent à l’inefficacité dans l’Assemblée du Golden Gate et de la transformation. Inclure un contrôle non-insert lors de l’assemblage du Golden Gate pour visualiser l’efficacité de l’Assemblée. Au cours de la transformation, le contrôle positif de puc19 fournira un contrôle d’efficacité de transformation. NEB-Stable, e. coli doit être utilisé pour des gènes compatibles plasmides et exigent fréquemment jusqu'à 16 h > à 30 ° C, pour produire des colonies visibles.
Déclarations de divulgation
George M. Church a équité Editas et Caribou Biosciences, qui visent à commercialiser le génome CRISPR-Cas9 technologie d’édition (pour une liste de divulgation complète, voir http://arep.med.harvard.edu/gmc/tech.html).
Remerciements
Sathiji Nageshwaran est pris en charge par l’Alliance de recherche ataxie de Friedreich (07340305 - 01) et National Ataxia Foundation bourses (7355538-01). Alejandro Chavez a été financé par la subvention du National Cancer Institute 5T32CA009216-34 et le Burroughs Wellcome Fund Career Award pour les scientifiques médicaux. George M. Church est pris en charge par l’US National Institutes of Health (NIH) subvention RM1 HG008525 de la National Human Genome Research Institute et l’Institut Wyss inspiré le génie biologique. James J. Collins reconnaît le soutien de la subvention de la Defense Threat Reduction Agency HDTRA1-14-1-0006 et le groupe de frontières de Paul G. Allen. Alejandro Chavez a développé la méthode de clonage de double-guide. Sathiji Nageshwaran, Alejandro Chavez et Nan Cher Yeo a écrit le manuscrit avec la participation de tous les auteurs.
matériels
| Name | Company | Catalog Number | Comments |
| BsmBI | New England Biolabs | R0580L | |
| T4 DNA ligase | Enzymatic/New England Biolabs | L6030-LC-L/M0202S | |
| Buffer 3.1 | New England Biolabs | B7203S | |
| Adenosine 5'-Triphosphate (ATP) | New England Biolabs | P0756S | |
| QIAprep spin miniprep kit | Qiagen | 27104 | |
| Chemically competent E. coli | New England Biolabs | C3019l, C2987l, or C3040H | |
| Standard microcentrifuge tubes, 1.5 mL | Eppendorf | 0030 125.150 | |
| Axygen 8-Strip PCR tubes | Fischer Scientific | 14-222-250 | |
| Thermocycler with programmable temperature-stepping control | BioRad, | 1851148 | |
| UV spectrophotometer (NanoDrop 2000c) | Thermo Scientific | ||
| pSB700 plasmid | Addgene | #64046 | |
| NEB Stable Competent E. coli (High Efficiency) | New England Biolabs | c3040 | |
| Lysogeny broth (LB) | |||
| Ampicillin | |||
| TE buffer (1 mM EDTA, 10 mM Tris-Cl, pH 7.5) | |||
| pSN007 plasmid | Addgene | 102440 |
Références
- Gasiunas, G., Barrangou, R., Horvath, P., Siksnys, V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proceedings of the National Academy of Sciences of the United States of America. 109 (39), E2579-E2586 (2012).
- Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J., Charpentier, E. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity. Science. 337 (6096), 816-821 (2012).
- Shalem, O., Sanjana, N., Zhang, F. High-throughput functional genomics using CRISPR-Cas9. Nature Reviews Genetics. 16 (5), 299-311 (2015).
- Chavez, A., et al. Highly efficient Cas9-mediated transcriptional programming. Nature Methods. 12 (4), 326-328 (2015).
- Gilbert, L., et al. CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes. Cell. 154 (2), 442-451 (2013).
- Yang, L., Yang, J., Byrne, S., Pan, J., Church, G. CRISPR/Cas9-Directed Genome Editing of Cultured Cells. Current Protocols in Molecular Biology. , 31.1.1-31.1.17 (2014).
- Yang, L., Mali, P., Kim-Kiselak, C., Church, G. CRISPR-Cas-Mediated Targeted Genome Editing in Human Cells. Methods in Molecular Biology. 1114, 245-267 (2014).
- Vidigal, J., Ventura, A. Rapid and efficient one-step generation of paired gRNA CRISPR-Cas9 libraries. Nature Communications. 6, 8083 (2015).
- Joung, J., et al. Genome-scale CRISPR-Cas9 knockout and transcriptional activation screening. Nature Protocols. 12 (4), 828-863 (2017).
- Kabadi, A., Ousterout, D., Hilton, I., Gersbach, C. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Research. 42 (19), e147 (2014).
- Sakuma, T., Nishikawa, A., Kume, S., Chayama, K., Yamamoto, T. Multiplex genome engineering in human cells using all-in-one CRISPR/Cas9 vector system. Scientific Reports. 4 (1), (2014).
- Chari, R., Yeo, N., Chavez, A., Church, G. sgRNA Scorer 2.0: A Species-Independent Model To Predict CRISPR/Cas9 Activity. ACS Synthetic Biology. 6 (5), 902-904 (2017).
- Doench, J., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nature Biotechnology. 32 (12), 1262-1267 (2014).
- Konermann, S., et al. Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex. Nature. 517 (7536), 583-588 (2014).
- Engler, C., Marillonnet, S., Valla, S., Lale, R. Golden Gate Cloning. DNA Cloning and Assembly Methods. , 119-131 (2013).
- Zetsche, B., et al. Cpf1 Is a Single RNA-Guided Endonuclease of a Class 2 CRISPR-Cas System. Cell. 163 (3), 759-771 (2015).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon