Method Article
CRISPR 가이드 RNA 포유류 시스템 복제
* 이 저자들은 동등하게 기여했습니다
요약
여기, 간단 하 고, 효율적인, 그리고 sgRNA 복제의 비용 효율적인 방법 설명입니다.
초록
개요 프로토콜 Cas9 관련 가이드 RNAs의 효율적이 고 경제적인 세대를 위한 효율적인된 방법을 설명합니다. 가이드 RNA (gRNA) 복제에 대 한 두 개의 대체 전략 호환 벡터의 세트와 함께 결합에서 형식을 IIS 제한 효소 BsmBI의 사용에 따라 설명 되어 있습니다. 생성 된 벡터를 확인 하기 위해 생어 시퀀싱 서비스에 대 한 액세스, 외부 아무 특별 한 장비나 시 약이 표준 현대 분자 생물학 실험실에 그 이외에도 필요 합니다. 개요 메서드는 주로 한 번에 하나의 단일 gRNA 또는 한 쌍된 gRNA 표현 하는 벡터를 복제에 대 한 것입니다. 이 절차는 gRNAs의 수천을 포함 하는 라이브러리의 생성을 위해 잘 확장 되지 않습니다. 그 목적에 대 한 oligonucleotide 종합 oligo 칩 합성 등의 다른 소스는 것이 좋습니다. 마지막으로,이 프로토콜은 포유류 벡터의 세트에 초점을 맞추고, 하는 동안 일반적인 전략 플라스틱 이며 적절 한 gRNA 벡터 사용할 수 있는 경우 모든 유기 체에 적용 됩니다.
서문
CRISPR 관련 단백질 9 (Cas9)은 RNA 기반 endonuclease 때 적절 하 게 설계 된 작은 가이드 RNA (gRNA)1,2complexed 원하는 게놈 목표를 향해 감독 이다. gRNAs은 게놈 대상 시퀀스에 보완 20-뉴클레오티드 순서 (protospacer)으로 구성 됩니다. 게놈 대상 다음 순서는 3' protospacer 관련 된 모티브 (PAM), Cas9 바인딩을 위해 필요한입니다. 연쇄 상 구 균 Pyogenes Cas9의 경우 (SpCas9), 이것은 NGG 시퀀스. DNA 대상 바인딩 시 Cas9 함으로써 관심의 장소를 수정 하려면 악용 될 수 있는 복구 메커니즘을 자극 하는 DNA의 두 가닥을 앞. 오류가 아닌-동종 끝 결합 (NHEJ) 통로의 활성화는 대상 유전자의 파괴를 일으킬 수 있습니다. 또는, 수리 만든 통해 동종 재결합 자극 수 있습니다 원하는 DNA 시퀀스의 대상된 통합 기증자 템플릿을 제공6. Nuclease 죽은 Cas9 (dCas9) 이체는 endonucleolytic 활동에 필수적인 Cas9 내 잔류물을 변경 하 여 생성 된3 를 수도 있습니다. dCas9는 DNA 바인딩 유능한 남지만 바인딩된 목표를 잘라 하지 않습니다. 다양 한 이펙터 도메인 dCas9 융합 하 고 유전자의 transcriptional 시작 사이트 근처 감독, 선택적 유전자 유도 또는 부분적인 유전자 침묵4,5dCas9는 사용할 수 있습니다.
엄청나게 강력 하 고, 관심의 게놈 시퀀스를 대상으로 Cas9를 사용 하는 기능이 합니다 사용자 먼저 대상 사이트에 고유한 gRNA를 생성 하는. 다양 한 식 벡터 gRNA을 구축 하기 위한 방법 설명, 다양 한 효율성의 많은 고 비용6,7,8이전 있다. 독립형 PCR amplicons 빠른 심사, 몇 시간; transfection oligonucleotide 배달에서 거 대 한 gRNAs로 사용할 수 있습니다. 그러나,이 요구 한다 Ultramer (100 bp) 비싼9올리고 합성. 그것은 또한 gBlocks Ultramers 보다 더 많은 비용을 구입 가능입니다. Cas9 현대 분자 생물학 툴킷의 필수 구성 되 고 급속 하 게, gRNA 복제, 저렴, 간단 하 고 매우 효율적인 방법 필드에 보탬이 될 것 이다. 여기 설명 하는 방법은 우리의 그룹과 협력 연구소는 지난 몇 년 동안 2000 고유 gRNAs4를 생성에 고용 되었다.
개요 방법 lentiviral 호환 벡터를 포함 하는 단일 gRNA 또는 최대 2 개의 gRNAs의 복제 기술에 초점을 맞추고. 생성의 두 개 이상의 gRNAs를 포함 하는 플라스 미드 또는 gRNAs의 도서관을,에 대 한 대체 방법은9,10,,1112권장 됩니다.
프로토콜
참고: 다음 프로토콜 gRNA 디자인이이 원고에 대 한 자세한 gRNA 플라스 미드의 모든 방법에 일반적인 온라인 도구 (1.1-1.4 단계)를 사용 하 여 수행 하는 방법을 설명 합니다. 원하는 gRNAs을 확인 한 식 벡터 (예, pSB700)에 oligonucleotides 도입에 대 한 여러 가지 다른 방법을 함께 필요한 oligonucleotides 주문에 대 한 단계를 설명 합니다. 제시 하는 것은 predigested 식 벡터 (단계 2-7.3)에 어느 결 찰 또는 골든 게이트 (단계 8-8.4)를 복제 하는 단일 가이드 표현 벡터 클로닝을 위한 2 방법입니다. 추가 설명 복제 쌍된 가이드 표현 벡터 연쇄 반응 (PCR) 골든 게이트 (단계 11-16)을 복제 하 여 다음을 사용 하 여에 대 한 전략이 이다. 마지막으로, 대장균 화학 변환 (단계 9-9.6) 식 벡터 시퀀스 확인 (단계 10 10.2.3)을 수행 하기 위한 일반적인 방법 또한 설명 되어 있습니다.
- 디자인 gRNA oligonucleotides 온라인 도구를 사용 하 여 다음과 같습니다.
- SgRNA 득점 2.0 온라인 도구 (https://crispr.med.harvard.edu/sgRNAScorerV2/)13 같은 온라인 도구 또는 광범위 한 sgRNA 디자인 도구 (http://portals.broadinstitute.org/gpp/public/analysis-tools/와 같은 대안을 사용 하 여 디자인 gRNAs sgrna-디자인)14 그리고 몇 개의 다른15.
- 잠재적인 gRNA 시퀀스를 생성 하는 유전자 이름, 기호, 또는 원시 DNA 대상 시퀀스를 사용 합니다.
참고: 유전자 또는 제공 된 시퀀스에 대 한 모든 잠재적인 gRNAs와 스프레드시트 (.csv/.xls) 파일이 만들어집니다. 잠재적인 gRNAs의 품질 보고 됩니다 또는 %에 대상 효율성 점수 sgRNA 득점 2.0 온라인 도구를 사용 하는 경우로 광범위 한 sgRNA 디자인 도구 사용 하는 경우. 두 측정 대상에 절단 활동 기반에서 파생 됩니다. - 순위는 gRNAs gRNA 선택에서 대상에서 활동을 고려 하십시오.
참고: 최적의 가이드 그 위대한 대상에 효율성과 이상 오프 대상 활동은. 활성화 (CRISPRa), gRNAs는 transcriptional 시작 사이트 (TSS)4,15의 상류 1-200 bp에서 영역을 대상으로 설계 되었습니다. 억제 (CRISPRi), gRNAs 50에서 지역 대상 디자인 300까지 TSS의 bp 상류 하류 TSS5의 혈압. Cas9 절단을 사용 하 여 유전자를 사용 하지 않으려면 gRNAs 하류 시작 codon (gRNAs 유전자의 3' 끝 덜 효과적인 것으로 표시 되었습니다 대상)으로13의 코딩 시퀀스의 첫 번째 10-50%를 대상으로 설계 되었습니다. - 단련된 oligonucleotides에서 발생이 없는 내부 BsmBI 사이트 oligonucleotides 골든 게이트 복제에 사용 되는 경우 확인13소화 되 고.
- 게놈 대상 시퀀스를 선택 하 고 제거 3' NGG 팸 (protospacer 시퀀스만 떠나는) 단일 gRNA oligonucleotide 순서 수정에 대 한 (예를 들어, 시작 하는 순서: CGCGTGCTCTCCCTCATCCATGG).
참고: 스프레드시트를 사용 하 여 다음 수식을 제거 됩니다 3' NGG: =LEFT(A2,LEN(A2)-3), a 2 셀에가 포함 된 대상 시퀀스와 PAM.- CACCG 는 올리고의 5' 끝에 추가 합니다.
참고: pSB700 백본 결 찰, 시이 시퀀스는 3' 끝은 gRNA의 전사를 운전 U6 발기인의 구성 된다. "CACC" 시퀀스는 올리고 BsmBI 소화 pSB700 벡터의 돌출부와 호환을 보장 합니다. "G"는 중 합 효소 III 발기인의 요구 하 고는 gRNA의 전사의 효율적인 개시 되도록 합니다. 다음 수식을 스프레드시트에서 사용 하 여이 작업을 수행: =CONCATENATE("CACCG",(B2)), B2 셀이 protospacer 시퀀스가 포함 된 [예를 들어, 추가 5' CACCG는 protospacer 순서: CACCGCGCGTGCTCTCCCTCATCCA (이 순서가 마지막 앞으로 올리고)]. - Protospacer 시퀀스의 반전 보수 (rc)를 만듭니다.
참고: 예를 들어 앞서 언급 한 protospacer의 역방향 보완 TGGATGAGGGAGAGCACGCG입니다. - AAAC rc protospacer의 5' 끝에 추가 합니다. 추가 C rc protospacer (역방향 올리고)의 3' 끝에 추가 합니다.
참고: "AAAC" 시퀀스는 올리고 BsmBI 소화 pSB700 벡터에 클로닝을 위한 호환 됩니다 보장 합니다. 3' 끝에 추가적인 "C" 앞으로 올리고에 추가 시작 "g" 시퀀스 anneal 필요 합니다. 이 수행 하는 스프레드시트에 다음과 같은 수식을 사용 하 여 작업 =CONCATENATE("AAAC",(C2),"C"), c 2 셀에는 [예를 들어, AAACTGGATGAGGGAGAGCACGCGC (이것은 이다 마지막 역 올리고 역방향 보완 시퀀스가 포함 된 주문)].
- CACCG 는 올리고의 5' 끝에 추가 합니다.
- oligonucleotides에 추가 수정 없이 oligonucleotides 주문.
- 순서 올리고 필요한, 단지 아주 작은 양의 복제 반응에 필요한 최소한의 금액입니다.
- 1 테 버퍼 (10 mM Tris Cl, pH 7.5 1 mm EDTA) x 100 μ M의 최종 농도에 동결 건조 된 뇌관을 희석.
- Aliquot 1:1 앞으로 역 oligonucleotides (예를 들어, 10 μ 각) PCR 스트립 캡 튜브로.
참고:이 다중 채널 피 펫을 사용 하 여 한 번에 많은 gRNAs의 급속 한 클로닝을 허용할 것 이다.- 소용돌이 스핀 아래로 올리고 혼합물 (100 x g 15 s). 결 찰을 설정 하기 전에 5 분 동안 실내 온도에 반응을 품 어.
참고: 그것은 열 하 고 다음 그들의 어 닐 링을 촉진 하기 위하여 올리고 혼합물을 냉각 하는 데 필요한 아니다. 그것은 3-4 쌍 gRNA oligonucleotides의 풀링 하 하 단일 반응에서 단련 된 수 있습니다 (예:앞으로의 혼합 3 μ,의 3 μ 반전 oligonucleotides 함께 24 μ의 총 볼륨을 주는 4 gRNA 올리고 쌍에서). 사용자의 요구를 수용 하기는 어 닐 링 사용 oligonucleotides의 볼륨을 조정할 수 있다.
참고: 단계 6-7.3 pSB700의 predigestion를 설명합니다. 다른 방법, 8, 단계 단일 단계 BsmBI 제한 결 찰 설명 참조.
- 소용돌이 스핀 아래로 올리고 혼합물 (100 x g 15 s). 결 찰을 설정 하기 전에 5 분 동안 실내 온도에 반응을 품 어.
- 1-5 μ g BsmBI 선택한 pSB700 가이드 식 벡터의 소화 (0.5 μ 1 μ g 당) 55 ° C15에서 1 h. PSB700 gRNA 식 벡터 40 μ (표 1)의 총 볼륨의 소화를 실시 합니다.
- 1.5% (wt/vol) 낮은 녹는 agarose 젤에 소화 제품을 실행 합니다.
- 소화 벡터 백본 밴드 ~ 9 kb 크기에서의 조각에 대응 하 고 젤 조각 1.5 mL microcentrifuge 튜브 (그림 1)에 배치.
- 상업적인 젤 정화 키트를 사용 하 여 제조업체의 지침에 따라 agarose 젤에서 DNA를 추출.
- (10 mM Tris, pH 7.5, 10 mM Tris, pH 8.0)를 집중된 eluate 테 버퍼의 10-15 μ로 DNA을 elute.
- BsmBI 소화 pSB700 가이드 식 벡터 20 μ 반응 (표 2)에서 4 단계에서 단련된 gRNA oligonucleotides 미리 소화 pSB700 식 벡터에 gRNA oligonucleotides의 복제에 대 한 선.
- 첫째, 물, 버퍼, 그리고 DNA, 소용돌이 혼합물을 추가 하 고 효소, 효소 및 솔루션 다운 스핀을 추가한 후 1 마지막 시간 소용돌이 추가 (100 x g 15 s). 하룻밤 실 온에서 반응을 품 어.
- BsmBI 소화 벡터 단련된 gRNA 올리고 삽입 없이 혼자는 아니 삽입 부정적인 제어 반응 포함. 물 1 μ 없음 삽입 부정적인 제어를 위한 gRNA oligonucleotides의 1 μ 대신 사용할 수 있습니다.
- 변환 (9 단계)로 이동 합니다.
참고: 8 단계 6-7.3 단계에 설명 된 대로 pSB700의 predigestion 대체 방법입니다.
- 골든 게이트 단일 단계 BsmBI 제한 결 찰에 대 한 복제를 사용 하 여 pSB700 벡터에 gRNA oligonucleotides (단계 1-5.1에서에서 설명)을 소개 합니다.
- 마스터 믹스 (1x) 조립-여러 gRNAs 복제 되는 경우 삽입 oligonucleotides 추가 (표 3) 없이 마스터 믹스를 준비. Aliquot 마스터 PCR 튜브에 혼합 하 고 멀티 채널 피 펫을 사용 하 여 gRNA oligonucleotides 단계 4.2에서에서 추가. 물 1 μ를 사용 하 여 없음 삽입 컨트롤을 포함 합니다.
- 포함 하 여 BsmBI 효소와 같은 반응 내에서 T4 DNA 리가, 동시 제한 소화 및 결 찰 달성 된다 (즉, 골든 게이트 복제). 다음과 같은 간단한 게이트 프로토콜을 사용 하 여 벡터를 소화 하 고 1 반응에 삽입 선을: 2 시간, 10 분, 15 분, 15 분, 80 ° C에서 65 ° C에서 50 ° C에서 37 ° C에서 반응 계속 그리고 마지막으로 4 ° c.에서 개최
- 노트, oligonucleotides는이 메서드를 사용 하기 전에 BsmBI 사이트를 포함 하지 않는 확인 합니다. 복제 되는 gRNAs BsmBI 제한 사이트를 포함 하는 경우 그들은 BsmBI의 추가 따라 소화 될 것입니다. 이 모든 transformants를 얻기에서 사용자를 방지 합니다.
- 초기 간단한 게이트 반응 후 각 반응에 BsmBI 효소의 추가 0.5 μ를 추가 하 고 다시 1 h 55 ° C에서 그들을 배치. 소화, 후 4 ° C에서 반응을 개최 하거나 변환할 준비까지 그것을 동결. 제한 효소 외피의이 두 번째 라운드 제거 어떤 소화 되지 않은 또는 religated 야생-타입 pSB700 벡터 반응 혼합물에서 백본 올리고 삽입 받은 유일한 벡터 그대로 유지 하 고 transformants를 얻을 것입니다.
- 변환 (9 단계)로 이동 합니다.
- 반응 혼합물의 0.5 μ의 유능한 대장균 [예를 들어, 코 DH5a (109 cfu / µ g pUC19 DNA의 x 1-3) 또는 코 안정 1-3 x 109 cfu / µ g pUC19 DNA의) 8 μ로 변환. Lentiviral 플라스 미드에 대 한 안정적인 코 셀 보다 일관 된 플라스 미드 수익률을 제공할 것입니다.
- -80 ° C에 저장에서 대장균 을 제거 하 고 5-10 분 동안 얼음에 녹여.
- 반응 혼합의 0.5 μ의 유능한 대장균 8 μ를 추가 하 고 30 분 동안 얼음에 혼합물을 유지.
- 열 충격 45 42 ° C에 혼합물 s.
- 2 분 동안 얼음에 그것을 휴식.
- 코 DH5a 37 ° C에서와 코 마구간에 30 ° C에서 1 시간을 위한 SOC 미디어의 250 μ에 회전 통에 문화를 복구 합니다.
- 플레이트는 적절 한 항생제 저항 Lysogeny 국물 (파운드) 접시에 문화의 80 μ와 하룻밤 코 DH5a 37 ° C에서와 코 마구간에 30 ° C에서 그것을 품 어 [예를 들어, pSB700는 도금 파운드에 암 피 실린 (100 μ g/mL) 접시] (그림 3).
- GRNA 식 플라스 미드의 순서를 확인: 생어 시퀀싱 뇌관 5'-GAGGGCCTATTTCCCATGATTCC-3를 사용 하 여 각 식민지의 순서를 확인 ' U6 발기인 상류에 소수 gRNA oligo의 삽입.
- (표 4)을 시퀀싱에 대 한 반응 당 2-3 식민지를 선택 하십시오.
참고: 여러 시퀀싱 공급자 제공 서비스를 이제 생어 수행할 수 크게 시퀀싱 전에 플라스 미드 정화 하는 필요를 제거 함으로써 시간과 비용을 감소 시키는 세균성 식민지에서 직접 시퀀싱. 또한, 개별 세균성 클론에서 플라스 미드 DNA를 복구 하 플라스 미드 분리 키트를 사용할 수 있습니다. 순화 된 플라스 미드는 시퀀싱에 대 한 다음 제출할 수 있습니다. 풀링된 결 찰 반응을 수행 하는 경우를 선택 해야 및 시퀀싱에 대 한 식민지의 수에 대 한 가이드로 표 4 를 사용 합니다. - 시퀀스 확인 다음 gRNA 식 플라스 미드를 분리.
- 살 균 피 펫 팁을 사용 하 여 원하는 식민지 파운드 매체 포함 하는 pSB700 식 벡터에 대 한 암 피 실린의 100 μ g/mL의 5 mL 문화에 접종.
- 37 ° C에서 하룻밤 (30 ° C 코 마구간을 사용 중인 경우) 100 rpm 로타리 인큐베이터에서 세포 성장.
- 플라스 미드 DNA 플라스 미드 준비 키트, 다음 제조 업체의 프로토콜을 사용 하 여 문화에서 분리.
참고: 위의 방법을 사용자가 단일 gRNA 포함 된 벡터를 만들 수를 사용 하는 동안이 프로토콜 하면 사용자가 그들의 자신의 RNA 중 합 효소 III 발기인에 의해 구동 각각 2 gRNAs를 포함 하는 벡터를 만들 수 있습니다.
- (표 4)을 시퀀싱에 대 한 반응 당 2-3 식민지를 선택 하십시오.
- 짝된 gRNA 디자인 (단계 1.1-1.4) 위에서 설명한 sgRNA 디자인 도구에서 출력 파일을 사용 하 여 고의 2 가이드를 선택 합니다.
- 적어도 30 가이드의 쌍 선택 활성화 또는 억압에 대 한 nt 떨어져.
- 절단을 위해 사용 하는 gRNAs에 대 한 대상으로 유전자 내에서 2 다른 exons 가이드를 선택 합니다.
- 아래 지침에 대 한 gRNA-A 배열에서 첫 번째 gRNA와 짝된 gRNA oligonucleotide 시퀀스 수정 만들 배열 gRNA-b, 두 번째 gRNA를 지정 합니다.
참고: gRNA A를 만드는 데 사용 하는 올리고 fA, 라는 것입니다 그리고 gRNA-B를 소개 하는 데 사용 하는 역방향 올리고 rB로 참조 됩니다. 아래 복제 메서드는 자동으로 시작 G 5'는 gRNAs의 각각의 끝에 추가합니다.- 다음과 같이 적절 한 fA oligo를 만듭니다.
참고: gRNA gRNA A 지에 대 한 시퀀스를 대상으로 구성 된 20 뉴클레오티드는 다음 단계 빌드됩니다 (예를 들어, protospacer-aggggctacaccactcattg) 초기 fA 시퀀스를 구성 합니다.- FA (예를 들어, 시퀀스 TTTTCGTCTCTCACCGaggggctacaccactcattg)의 5' 끝에 TTTTCGTCTCTCACCG를 추가 합니다.
- FA (예를 들어, 시퀀스 TTTTCGTCTCTCACCGaggggctacaccactcattgGTTTTAGAGCTATGCTGAAAAGCA)의 3' 끝에 GTTTTAGAGCTATGCTGAAAAGCA 를 추가 합니다. 이것은 fA oligo 주문 될 것 이다 그의 마지막 버전입니다.
- 다음과 같이 필요한 rB oligo를 만듭니다.
참고: gRNA b gRNA 대상 시퀀스를 구성 하는 20 뉴클레오티드는 다음 단계 빌드됩니다 (예를 들어, 시작 순서 gtcccctccaccccacagtg의) 초기 rB 시퀀스를 창설할 것 이다.- RB의 반전 보수를 받아 (revcom) = rB (예, cactgtggggtggaggggac).
- 추가 (revcom)의 5' 끝에 TTTTCGTCTCTAAAC rB (예., TTTTCGTCTCTAAACcactgtggggtggaggggac).
- CGGTGACCCAGGCGGCGCACAAG (revcom)의 3' 끝에 추가 (예:TTTTCGTCTCTAAACcactgtggggtggaggggacCGGTGACCCAGGCGGCGCACAAG) rB. RB oligo 주문 될 것 이다 그의 마지막 버전입니다.
참고: 다음 수식을 자동으로 올리고 시퀀스를 편집 하려면 일반적인 스프레드시트 소프트웨어와 함께 사용할 수 있습니다: = CONCATENATE("TTTTCGTCTCTCACCG",(A2), "GTTTTAGAGCTATGCTGAAAAGCA"), a 2은 전 순서, 및 포함 된 셀 = CONCATENATE("TTTTCGTCTCTAAAC",(B2),"CGGTGACCCAGGCGGCGCACAAG"), B2 (revcom) rB 시퀀스를 포함 하는 셀입니다.
- 다음과 같이 적절 한 fA oligo를 만듭니다.
- 선택의 종합 공급 업체 로부터 oligonucleotides 주문. 아니 추가 수정이 필요 합니다.
- 준비 된 플라스 미드 DNA를 사용 하 여 fA와 rB 뇌관으로 PCR을 수행. 이 모두 앞으로 연결 됩니다 그리고이 플라스 미드 및 것에서 생성 된 PCR 파편에 역 gRNAs 각각 그것의 자신의 발기인에서 표현 될 수 있도록 (U6 및 7SK 발기인-다른 발기인 바이러스 재조합을 방지 하기 위해이 디자인에 사용 됩니다).
- Phusion GC 특별 한 PCR 프로토콜을 사용 하 여 필요한 조각 만들: 15 98 ° C에서 1 분 (1 사이클), 98 ° C에 혼합물을 유지 15 53 ° c s s 2 분, 65 ° C에서 4 분 (30 주기)에 대 한 72 ° C에서 누르고 다음 4 ° c (표 5).
- 1 %agarose 젤에 PCR 제품을 실행 하 고 그 1 밴드 ~ 490에서 볼 확인 bp (그림 2).
- 잘라내어이 PCR 제품 선택의 젤 추출 키트를 사용 하 여 추출. TE 버퍼 (10 mM Tris, pH 7.5, 10 mM Tris, pH 8.0)의 15 μ로 DNA을 elute 증류수 또는.
- DNA 몰 계산에 대 한 분 광 광도 계와 함께 pSB700 벡터의 추출된 제품의 농도 측정 합니다. PCR 제품 및 벡터 40 femtomoles/μ의 농도를 정상화.
참고: 여러 웹 사이트의 DNA와 솔루션에서의 농도의 길이에 따라 주어진된 DNA 솔루션 몰의 계산을 지원 하기 위해 사용할 수 있습니다 (예를 들어, Promega: http://www.promega.com/a/apps/biomath/index.html?calc=ugpmols). 계산기는 수식을 사용 하 여: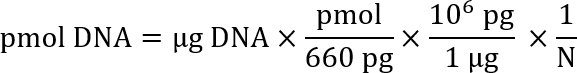
여기서, N은 뉴클레오티드 시퀀스의 길이입니다.
- 동시 제한 소화 및 결 찰 반응 pSB700 벡터에 PCR 파편을 복제할 단계 8 8.4에에서 설명 된 프로토콜을 사용 하 여 설정 합니다.
- 반응에 뇌관 솔루션의 1 μ를 추가 하는 대신 1 μ μ PCR 제품의 fmole/40 일의 추가 합니다. 또한, pSB700 벡터의 1 μ를 사용 하 여 40 fmole/μ의 농도에.
참고: 같은 어 금 니 비율 이어질 일관 된 결과, 비록 정확한 비율 사용 되지 않습니다 경우에도 식민지를 얻을 수 있다.
- 반응에 뇌관 솔루션의 1 μ를 추가 하는 대신 1 μ μ PCR 제품의 fmole/40 일의 추가 합니다. 또한, pSB700 벡터의 1 μ를 사용 하 여 40 fmole/μ의 농도에.
- 골든 게이트 반응 과정 (단계 8-8.4), 완료 되 면 변환 및 시퀀스 확인 (단계 9-10.2.3)를 진행 합니다.
결과
이 프로토콜에서 설명 하는 방법 중 하나 또는 짝 gRNA 식 벡터의 생성에 대 한 있습니다. 벡터를 표현 하는 단일 gRNA 짧은 oligonucleotides의 시리즈에서 ligating 또는 벡터 등뼈를 동시에 소화 하 고에 그것을 위하여 복제 하는 골든 게이트를 사용 하 여 벡터 백본 (그림 1)를 predigesting에 의해 만들 수 있는 단일 반응에 짧은 oligonucleotides의 시리즈입니다. 또한 각 사용자 지정 PCR 파편 (그림 2)를 복제 하 여 그것의 자신의 독립적인 발기인에 의해 구동 2 gRNAs를 포함 하는 벡터를 생성 하는 방법이 이다.
명시 된 프로토콜에 대 한 성공적인 복제 하는 것은 아니 삽입 컨트롤 (그림 3)에 보다 적절 한 삽입 DNA로 변환에 대 한 훨씬 더 많은 식민지의 모양 귀 착될 것 이다.
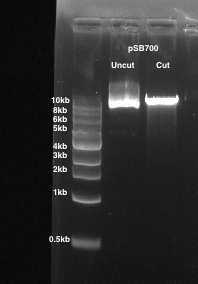
그림 1: pSB700 gRNA 식 벡터의 소화. 1 %agarose 젤 사용 됩니다. 레인 1: 포경된 pSB700입니다. 레인 2: pSB700 BsmBI로 잘라.
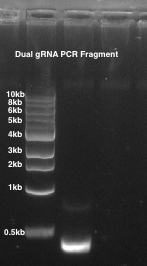
그림 2: gRNA PCR 짝. 1 %agarose 젤 사용 됩니다. 레인 1: 짝된 가이드 PCR 파편 ~ 490의 혈압.
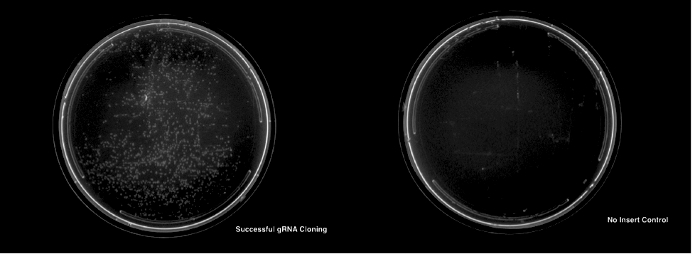
그림 3: 성공적인 복제 및 gRNA 플라스 미드의 변화. 왼쪽된 패널 표시는 파운드와 암 피 실린 접시는 성공적으로 식민지를 변형. 오른쪽 패널 없음 삽입 컨트롤 플레이트 없는 식민지를 보여주는 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| pSB700 가이드 식 벡터 | 1-5 μ g |
| 코 버퍼 3.1 | 4 Μ |
| BsmBI | 1 Μ |
| 증류수 | 최대 40 μ |
| 총 볼륨 | 40 Μ |
표 1: BsmBI와 pSB700 gRNA 식 벡터의 제한 소화.
| 단련된 gRNA oligos (단일 또는 풀링된 반응) | 1 Μ |
| BsmBI 소화 pSB700 가이드 식 벡터 | 1 μ (100 ~ 250 ng) |
| T4 DNA 리가 반응 버퍼 x 10 | 2 μ (최종 농도 x 1) |
| T4 DNA 리가 | 1 μ (120 대) |
| 증류수 | 15 Μ |
| 총 볼륨 | 20 μ |
표 2: 한 결 찰 반응의 gRNA oligonucleotides predigested pSB700 gRNA 식 벡터에.
| 시 약 | 볼륨 (1x) |
| H2O | 6 Μ |
| T4 리가 | 0.5 Μ |
| ATP | 1 Μ |
| BsmBI | 0.5 Μ |
| 코 버퍼 3.1 | 1 Μ |
| 벡터 (예, pSB700) (40 fmol) | 1 μlL |
| 삽입-앞으로 및 역방향 oligos 또는 듀얼 가이드 (40fmol)에 대 한 PCR 파편 | 1 μ (0.5 μ 앞으로 및 역방향 0.5 μ) |
표 3: 단일 단계 BsmBI 제한 및 gRNA 결 찰 반응 혼합.
| 1 가이드에 대 한 | 시퀀스 3 식민지 |
| 2 가이드 | 5-10 식민지 순서 |
| 3 가이드에 대 한 | 10-15 식민지 순서 |
| 4 가이드 | 15-20 식민지 순서 |
표 4: 풀링된 gRNA 반응 복제에 대 한 시퀀스에 식민지의 권장된 수입니다.
| PCR 구성 요소 | 50 µ L 반응 |
| 10 µ M 앞으로 뇌관 | 2.5 Μ L |
| 10 µ M 역 뇌관 | 2.5 Μ L |
| 5 x Phusion HF 또는 GC 버퍼 | 10 Μ L |
| 10mm dNTPs | 1 Μ L |
| 템플릿 DNA | 100 ng |
| Phusion DNA 중 합 효소 | 0.5 Μ L |
| Nuclease 무료 물 | 최대 50 µ L |
표 5: 쌍된 gRNA PCR 혼합물입니다.
토론
다양 한 시간 및 비용 절약 수정 gRNA 식 벡터 건설 되었습니다. 단일 단계 제한 및 결 찰 프로토콜 짝된 gRNA 식 벡터 건축의 방법 뿐만 아니라 요약. 짝된 gRNA 식 oligonucleotides 포함 하 앞으로 gRNA 대상 시퀀스 (n20)와 다른 대상 (n20)의 반전 보수를 사용 하 여 PCR 증폭을 통해 이루어집니다. 이 다음 통상 단일 gRNA 식 플라스 미드 표현으로 sgRNA 꼬리 뿐만 아니라 보조 RNA Pol III 발기인 (7SK)를 소개 합니다.
주의 oligonucleotide 디자인 스티커-엔드 결 찰으로 서 짝된 gRNA 건설에 대 한 성공적인 PCR을 지킬 것 이다. 단일 단계 제한 및 결 찰 반응, 더 BsmBI의 추가 반응에서 수정 되지 않은 식 벡터를 모두 잘라 하는 것을 지킬 것 이다. 이렇게 크게 변환 시 배경을 줄어듭니다. 30 ° C에서 코 안정 유능한 대장균 및 성장을 사용 하 여 성공적인 변환의 수익률을 증가 합니다.
이 기술은 일반적인 사례는 장점 oligonucleotide 어 닐 링, gRNA 식 벡터의 단일 단계 제한과 oligonucleotides, 그리고 기존의 활용 능력의 결 찰 하는 과정의 단순화 단일 gRNA 식 벡터 쌍된 가이드의 표현에 대 한 스 프로토콜 설명 여기 포유류 벡터의 세트에 초점을 맞추고, 하는 동안 일반적인 전략 플라스틱 이며 제공 하는 적절 한 gRNA 벡터 사용할 수 있는 모든 유기 체에 적용 됩니다. 전반적으로, 설명 하는 프로토콜 시간 및 비용을 절약할 수 있습니다.
그러나, 그것은 잘 gRNAs의 수천을 포함 하는 라이브러리의 생성에 대 한 개별 oligonucleotides 구매의 개요 절차 규모 하지 않습니다 주목 해야한다. 그 목적에 대 한 oligonucleotide 종합 oligo 칩 합성 등의 다른 소스는 것이 좋습니다.
GRNAs 복제 때 없음 삽입 컨트롤을 포함 도움이 됩니다. 이 반응은 설정할 수 있습니다 쉽게 관심의 반응 동시에 고 시작 벡터의 불완전 한 소화는 절차의 끝에서 관찰 하는 식민지에 기여 하 고 있는지 여부를 확인 하기 위해 사용할 수 있습니다. 또한, 위의 복제 프로토콜 중 하나를 불완전 하 게 소화 벡터 백본 또는 가난한 결 찰 효율 실패, 우리가 설명 하는 메서드를 복제 하는 대안을 시도 하는 것이 좋습니다.
골든 게이트 동시에 벡터를 소화 하 고 단 하나 반응 내에서 작은 oligonucleotides에 선 복제를 사용할 때 그것은이 t로 이어질 것입니다 벡터에 복제 되는 gRNA는 BsmBI 사이트에 확인 하는 것이 중요 그 gRNA 절단 되 고 변환에 식민지의 부재.
우리가 설명 하는 전략을 복제 gRNA oligonucleotide 종합 및 시퀀스 확인에서 오는 비용의 일괄 가이드, 당 ~ 10 달러에 gRNAs의 신속 하 고 비용 효율적인 세대 수 있습니다. 프로토콜 쉽게 Cas9 orthologues 또는 벡터 등뼈에 약간의 수정을 Cpf1 또는 C2C2, 같은 다른 RNA 기반 endonucleases 함께 사용 하기 위해 적용할 수 개요 메서드는 SpCas9와 함께 사용 하기 위해 gRNAs를 생성 하는 사용자를 허용 하도록 설계 되었지만, 고 oligonucleotide 오버행 시퀀스16,17.
위에서 설명한 프로토콜 제공 합니다 시퀀스 확인 gRNA 3 d (적절 하 게 설계 된 oligonucleotides 맨먼저), 플라스 미드 식은 현재 방법 보다 훨씬 빠릅니다. 1 h (단계 1-2.3), 희석 및 10 분 (단계 3-5.1), 소화 및 2 h (단계 6-6.4)는이에 gRNA oligonucleotides의 복제의 pSB700 gRNA 식 벡터의 정화의 oligonucleotides의 약 수의 gRNA 디자인 포함 gested pSB700 gRNA 식 벡터 실내 온도 (단계 7-7.3), 3 시간 및 40 분 (단계 8-8.4)의 단일 단계 BsmBI 제한 결 찰, 16 h (단계 9-9.6)의 변환 및 gRNA 식 플라스 미드의 시퀀스의 유효성 검사에서 하룻밤 24 h의 (생어 시퀀싱 가용성 및 세균성 식민지;의 제출 다음 속도 따라 기간 10 단계). 짝된 gRNA 디자인 및 시퀀스 수정 1 h (11-13 단계) 걸립니다. 짝된 gRNA PCR 3.5 h (단계 14-14.4) 걸립니다. PSB700 벡터에 PCR 파편의 클로닝은 3 시간 및 40 분 (단계 15-16).
이 프로토콜에 직면 수 있습니다 가장 가능성이 문제는 골든 게이트 어셈블리에 변환 효율 관계. 골든 게이트 어셈블리는 어셈블리의 효율성을 시각화 하는 동안 없음 삽입 컨트롤을 포함 합니다. 변환 하는 동안 puc19 긍정적인 컨트롤 변환 효율 제어를 제공 합니다. 코-안정 대장균 lentiviral 호환 플라스 미드 사용 해야 하 고 자주 필요 > 16 h까지 보이는 식민지를 30 ° C에서.
공개
조지 M. 교회는 Editas 및 CRISPR Cas9 게놈 편집 기술 상용화를 목표로 순 록 생명과학 주식 (전체 공개 목록 참조 하십시오 http://arep.med.harvard.edu/gmc/tech.html).
감사의 말
Sathiji Nageshwaran 프리의 증 연구 동맹에 의해 지원 됩니다 (07340305-01) 및 국가 증 재단 연구비 (7355538-01). 알 레 한 드 차베스는 의료 과학자에 대 한 국립 암 연구소의 그랜트 5T32CA009216-34 그리고 버로우즈 Wellcome 기금 경력 수상에 의해 투자 되었다. 조지 M. 교회는 지원 미국 국립 보건원 (NIH)에 의해 국가 인간 게놈 연구소 그랜트 RM1 HG008525와 생물학적 영감 공학 Wyss 연구소. 제임스 J. 콜린스 인정 방위 위협 감소 기관 그랜트 HDTRA1-14-1-0006와 폴 G. 앨런 프론티어 그룹에서 지원 합니다. 알 레 한 드 차베스 듀얼 가이드 복제 방법을 개발. Sathiji Nageshwaran, 알 레 한 드 차베스와 앤 쉐어 여 모든 작성자에서 입력 원고를 썼다.
자료
| Name | Company | Catalog Number | Comments |
| BsmBI | New England Biolabs | R0580L | |
| T4 DNA ligase | Enzymatic/New England Biolabs | L6030-LC-L/M0202S | |
| Buffer 3.1 | New England Biolabs | B7203S | |
| Adenosine 5'-Triphosphate (ATP) | New England Biolabs | P0756S | |
| QIAprep spin miniprep kit | Qiagen | 27104 | |
| Chemically competent E. coli | New England Biolabs | C3019l, C2987l, or C3040H | |
| Standard microcentrifuge tubes, 1.5 mL | Eppendorf | 0030 125.150 | |
| Axygen 8-Strip PCR tubes | Fischer Scientific | 14-222-250 | |
| Thermocycler with programmable temperature-stepping control | BioRad, | 1851148 | |
| UV spectrophotometer (NanoDrop 2000c) | Thermo Scientific | ||
| pSB700 plasmid | Addgene | #64046 | |
| NEB Stable Competent E. coli (High Efficiency) | New England Biolabs | c3040 | |
| Lysogeny broth (LB) | |||
| Ampicillin | |||
| TE buffer (1 mM EDTA, 10 mM Tris-Cl, pH 7.5) | |||
| pSN007 plasmid | Addgene | 102440 |
참고문헌
- Gasiunas, G., Barrangou, R., Horvath, P., Siksnys, V. Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria. Proceedings of the National Academy of Sciences of the United States of America. 109 (39), E2579-E2586 (2012).
- Jinek, M., Chylinski, K., Fonfara, I., Hauer, M., Doudna, J., Charpentier, E. A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity. Science. 337 (6096), 816-821 (2012).
- Shalem, O., Sanjana, N., Zhang, F. High-throughput functional genomics using CRISPR-Cas9. Nature Reviews Genetics. 16 (5), 299-311 (2015).
- Chavez, A., et al. Highly efficient Cas9-mediated transcriptional programming. Nature Methods. 12 (4), 326-328 (2015).
- Gilbert, L., et al. CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes. Cell. 154 (2), 442-451 (2013).
- Yang, L., Yang, J., Byrne, S., Pan, J., Church, G. CRISPR/Cas9-Directed Genome Editing of Cultured Cells. Current Protocols in Molecular Biology. , 31.1.1-31.1.17 (2014).
- Yang, L., Mali, P., Kim-Kiselak, C., Church, G. CRISPR-Cas-Mediated Targeted Genome Editing in Human Cells. Methods in Molecular Biology. 1114, 245-267 (2014).
- Vidigal, J., Ventura, A. Rapid and efficient one-step generation of paired gRNA CRISPR-Cas9 libraries. Nature Communications. 6, 8083 (2015).
- Joung, J., et al. Genome-scale CRISPR-Cas9 knockout and transcriptional activation screening. Nature Protocols. 12 (4), 828-863 (2017).
- Kabadi, A., Ousterout, D., Hilton, I., Gersbach, C. Multiplex CRISPR/Cas9-based genome engineering from a single lentiviral vector. Nucleic Acids Research. 42 (19), e147 (2014).
- Sakuma, T., Nishikawa, A., Kume, S., Chayama, K., Yamamoto, T. Multiplex genome engineering in human cells using all-in-one CRISPR/Cas9 vector system. Scientific Reports. 4 (1), (2014).
- Chari, R., Yeo, N., Chavez, A., Church, G. sgRNA Scorer 2.0: A Species-Independent Model To Predict CRISPR/Cas9 Activity. ACS Synthetic Biology. 6 (5), 902-904 (2017).
- Doench, J., et al. Rational design of highly active sgRNAs for CRISPR-Cas9-mediated gene inactivation. Nature Biotechnology. 32 (12), 1262-1267 (2014).
- Konermann, S., et al. Genome-scale transcriptional activation by an engineered CRISPR-Cas9 complex. Nature. 517 (7536), 583-588 (2014).
- Engler, C., Marillonnet, S., Valla, S., Lale, R. Golden Gate Cloning. DNA Cloning and Assembly Methods. , 119-131 (2013).
- Zetsche, B., et al. Cpf1 Is a Single RNA-Guided Endonuclease of a Class 2 CRISPR-Cas System. Cell. 163 (3), 759-771 (2015).
- Abudayyeh, O., et al. C2c2 is a single-component programmable RNA-guided RNA-targeting CRISPR effector. Science. 353 (6299), (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유