Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
En utilisant les outils de compilation FishSim Animation pour enquêter sur le comportement du poisson : une étude de cas sur la copie de-choix d’un partenaire en Sailfin Mollies
Dans cet article
Résumé
En utilisant les nouveaux outils de compilation FishSim Animation, nous présentons un protocole pour une manipulation visuelle non invasif de l’information dans le contexte du choix d’un partenaire copie dans sailfin mollies. FishSim Animation Toolchain fournit un cadre facile à utiliser pour la conception, l’animation et la présentation de stimuli poisson animation par ordinateur pour les expériences comportementales poissons vivants.
Résumé
Durant la dernière décennie, employant des animations informatiques pour la recherche sur le comportement animal a augmenté en raison de sa capacité à manipuler non invasive l’apparence et le comportement des stimuli visuels, par rapport à la manipulation des animaux vivants. Nous présentons ici la FishSim Animation Toolchain, un cadre logiciel mis au point pour fournir aux chercheurs une méthode facile à utiliser pour l’application des animations 3D par ordinateur dans des expériences comportementales avec poissons. Les outils de compilation propose des modèles pour créer des stimuli 3D virtuels de cinq espèces de poissons différents. Stimuli sont personnalisables en apparence et en taille, basée sur des photographies prises de poissons vivants. Plusieurs stimuli peuvent être animés en enregistrant la natation des chemins dans un environnement virtuel à l’aide d’un contrôleur de jeu vidéo. Pour accroître la normalisation du comportement simulé, le chemin d’accès de natation préenregistrés peut-être être relu avec différents stimuli. Plusieurs animations plus tard peuvent être organisées en playlist et présentées sur les écrans au cours d’expériences avec des poissons vivants.
Dans une étude de cas avec sailfin mollies (Poecilia latipinna), nous fournissons un protocole sur la façon de mener une expérience de copie-choix d’un partenaire avec FishSim. Nous utilisé cette méthode pour créer et animer virtuels mâles et femelles de mannequin virtuel et ensuite présenté ces pour vivre les femmes focales dans une expérience de choix binaire. Nos résultats démontrent que l’animation par ordinateur peut-être être utilisée pour simuler des poissons virtuels dans une expérience de copie-choix d’un partenaire pour enquêter sur le rôle des femelles gravides taches comme une indication de qualité pour une femme modèle à la copie choix d’un partenaire.
En appliquant cette méthode n’est pas limitée aux expériences de copie-choix d’un partenaire, mais peut être utilisé dans différents modèles expérimentaux. Pourtant, sa facilité d’utilisation dépend des capacités visuelles de l’espèce étudiée et a tout d’abord besoin de validation. Dans l’ensemble, animations informatiques offrent un degré élevé de contrôle et de normalisation dans les expériences et garder le potentiel pour « réduire » et « remplacer » animaux vivants relance ainsi quant à « affiner » les procédures expérimentales.
Introduction
Récemment, utilisant des techniques modernes pour la création de stimuli artificiels, tels que des animations informatiques et réalité virtuelle, a trouvé sa popularité en recherche1. Ces méthodes offrent plusieurs avantages par rapport aux approches expérimentales classiques avec stimulation vivants animaux1,2. Animation par ordinateur permet une manipulation non invasif de l’aspect (taille, couleur) et le comportement des animaux virtuels stimulus d’expérimentation. Par exemple, l’ablation chirurgicale de l’épée en xiphophore vert mâle (Xiphophorus helleri) pour tester les préférences de compagnon dans les femelles3 rendait inutile à l’aide d’animation par ordinateur dans une étude ultérieure sur cette espèce4. En outre, animations informatiques peuvent créer des phénotypes qui sont rarement rencontrés dans la nature,5. Caractéristiques morphologiques des animaux virtuels peuvent même être modifiés au-delà de l’aire de répartition naturelle de cette espèce4. En particulier, la possible manipulation systématique du comportement est un avantage majeur de l’animation par ordinateur, puisqu’il est presque impossible avec animaux vivants6,7.
Diverses techniques existent à ce jour pour créer des animations informatiques. En général, des animations (2D) deux dimensions simples dérivent d’une photo d’un stimulus se déplaçant dans les deux seules dimensions et peuvent être créées avec un logiciel commun comme MS PowerPoint8 ou Adobe After Effects9. Les animations (3D) en trois dimensions, qui nécessitent plus sophistiqués graphiques 3D logiciel de modélisation, activez le stimulus être déplacé en trois dimensions, augmentant les possibilités de mouvement physique réaliste et complexe6,7 , 10 , 11 , 12. même de réalité virtuelle qui simulent un environnement 3D où naviguer dans les animaux vivants ont été utilisé13,14. Dans un récent examen Thuly-Chouinard et al. 2 discuter ces techniques une par une et mettre en évidence les avantages et les inconvénients sur leur mise en œuvre dans la recherche, qui dépend notamment de la portée de l’étude et les capacités visuelles de l’animal (voir « Discussion »). En outre, Powell et Rosenthal15 donner des conseils sur la conception expérimentale appropriée et quelles questions peuvent être adressées en utilisant des stimuli artificiels dans la recherche sur le comportement animal.
Étant donné que la création d’animation par ordinateur peut être longue et difficile, le besoin de logiciels faciliter et uniformiser le processus de conception de l’animation est née. Dans cette étude, nous introduisons la libre et open-source Toolchain Animation FishSim 16 (abrégé : FishSim ; https://bitbucket.org/EZLS/fish_animation_toolchain/), une approche multidisciplinaire combinant biologie et en sciences informatiques pour répondre à ces besoins. Semblable au plus tôt publié outil anyFish17,18, le développement de la chaîne d’outils de suivi le but de fournir aux chercheurs une méthode facile à utiliser pour la mise en œuvre des stimuli 3D animés dans des expériences avec des poissons. Notre logiciel est constitué d’un ensemble d’outils qui peut être utilisé pour : (1) créer des poissons virtuels 3D (FishCreator), (2) animer les chemins de nage des poissons virtuels avec un contrôleur de jeu vidéo (FishSteering) et (3) organisent et présentent préenregistrés animations sur les moniteurs de vivre poissons focal (FishPlayer). Notre chaîne d’outils fournit diverses fonctionnalités qui sont particulièrement utiles pour tester dans une situation de choix binaire mais également applicables à d’autres modèles expérimentaux. De plus, l’animation possible de deux ou plusieurs poissons virtuels permet la simulation de bancs ou de parade nuptiale. Les animations ne sont pas liées à un stimulus spécifique mais peuvent être rejouées avec autres stimuli permettant de modifier l’apparence d’un stimulus, mais garder son comportement constant. La nature open source de la chaîne de compilation, ainsi que le fait qu’il repose sur le système d’exploitation de robot ROS (www.ros.org), fournir la grande modularité du système et offrent des possibilités presque infinies pour inclure des dispositifs de rétroaction externe (comme le contrôleur ou un système de suivi) et d’adapter les outils de compilation pour ses propres besoins dans la recherche. Outre le molly sailfin, quatre autres espèces sont actuellement utilisables : l’Atlantique molly Poecilia mexicana, le guppy Poecilia reticulata, l’épinoche à trois épines Gasterosteus aculeatus et un cichlidé Haplochromis spp. Nouvelles espèces peuvent être créés dans un graphisme 3D modélisation outil (p. ex., Blender, www.blender.org). Pour illustrer le flux de travail avec FishSim et de fournir un protocole sur la façon de mener une expérience de copie-choix d’un partenaire avec l’animation par ordinateur, nous avons réalisé une étude de cas avec sailfin mollies.
Choix d’un partenaire est l’une des décisions plus importantes animaux font dans leur histoire de vie. Animaux ont développé des stratégies différentes pour trouver les meilleurs partenaires de l’accouplement. Ils peuvent se prévaloir des informations personnelles lors de l’évaluation de potentiel accouplement partenaires indépendamment, éventuellement selon les préférences de génétiques prédéterminés pour un certain caractère phénotypique19,20. Mais elles peuvent aussi observer le choix d’un partenaire de leurs congénères et ainsi utiliser l’information21. Si l’observateur décide alors de choisir le même maté (ou le même phénotype) comme le conspécifiques observés — le « modèle » — choisi précédemment, il s’agit alors la copie choix d’un partenaire (ci-après abrégé en MCC)22,23. Choix d’un partenaire copie est une forme d’apprentissage social et, partant, une stratégie de choix d’un partenaire dépendant24, qui a été observé dans les deux vertébrés25,26,27,28, 29 et invertébrés30,31,32. Jusqu'à présent, CMC a été étudié principalement dans le poisson et se trouve sous le laboratoire conditions33,34,35,36,37,38 et en le sauvage39,40,41,42. Choix d’un partenaire la copie est particulièrement utile pour un particulier, si deux ou plusieurs partenaires potentiels d’accouplements sont apparemment semblables en qualité et un choix d’un « bon » partenaire — en termes de maximisation de remise en forme, est difficile de faire43. La qualité d’un modèle féminin elle-même peut affecter si les femelles focales copier son choix ou pas44,45,46,47. Respectivement, modèle « bonne » ou « mauvaise » qualité féminine a été attribuée à son étant plus ou moins connu dans le choix d’un partenaire, par exemple en ce qui concerne la taille et l’âge44,45,46, ou par son être un congénère ou un hétérospécifiques47. Dans sailfin mollies que copier le choix d’un partenaire de leurs congénères39,48,49,50,51, on a constaté que les femelles focales même copier le rejet d’un mâle52 . Étant donné que le MCC est censé jouer un rôle important dans l’évolution des caractères phénotypiques ainsi que la spéciation et hybridation21,23,53,54, les conséquences de la copie une » » faux dilemme peut être considérable dans la réduction de l’aptitude du copieur55. Si un individu décide de copier le choix d’un autre individu, qu'il est important d’évaluer si le modèle observé est une source fiable d’information, c'est-à-dire que le modèle lui-même fait un « bon » choix à cause de lui ou elle est bien connu dans Second choix. Ici se pose la question : Quelles sont les caractéristiques visuelles susceptibles de caractériser un modèle fiable pour copier à partir chez les femelles de sailfin molly ?
Une particularité visuelle sailfin femelle mollies et autres Poeciliidae est l’endroit gravide (également connu sous le nom de « anal spot », « plaque incubatrice » ou « grossesse spot »). Cette zone fortement pigmentée dans leur région anale dérive de mélanisation du tissu tapissant le sac ovarien56. La taille et la présence de la tache gravide varient à travers les femelles conspécifiques et peuvent changer plus individuellement au cours de la progression des cycles ovariens56,,57. Taches gravides peuvent servir à attirer les mâles et faciliter l’orientation de l’intromission pour insémination interne58 ou comme moyen de publicité fertilité59,60. Compte tenu du lien entre l’endroit gravide et statut reproductif de la femelle, nous avons prédit que l’endroit gravide sert comme un signe de la qualité des modèles féminins en fournissant des informations sur son état actuel de reproduction pour observer les femelles focales. Nous avons étudié deux hypothèses de rechange. Tout d’abord, si l’endroit gravide est un signe général de maturité, tel que prédit par Farr et Travis59, il dénote un modèle sans doute fiable et expérimenté par rapport à un modèle immature (sans la tache). Ici, les femmes focales sont plus susceptibles de copier le choix d’un modèle avec une tache, mais pas celle d’un modèle sans un endroit. Deuxièmement, si l’endroit gravide marque non-réceptivité à cause déjà des couvées, tel que prédit par Sumner et al. 60, le modèle est sans doute moins fiable puisqu’une femelle non réceptive serait considérée moins exigeants. Dans ce cas, focales femelles ne copiera pas leur choix mais celui de modèles sans tache. Jusqu’ici, le rôle du spot gravide pour MCC chez les femelles de sailfin molly a jamais été testé, ni manipulé expérimentalement.
Nous permettant de réaliser une expérience MCC en présentant des stimulus virtuel mâles et femelles de le mannequin virtuel sur des écrans d’ordinateur au lieu d’utiliser la stimulation direct et le modèle poisson tel qu’utilisé dans la procédure expérimentale classique49,50 FishSim ,51,,61. La facilité d’utilisation générale de notre logiciel a été préalablement validée pour tester des hypothèses sur le choix d’un partenaire en sailfin mollies12. Ici, nous avons vérifié si l’absence ou la présence d’une tache gravide chez les femelles mannequin virtuel influe sur le choix d’un partenaire d’observer les femelles focales direct. Nous laissons tout d’abord les femelles focales s’acclimater à la cuve d’essai (Figure 1.1) et laissez-les choisir entre deux mâles différents stimulus virtuel dans un test de second choix (Figure 1.2). Par la suite, au cours de la période d’observation, le préalable mâle virtuel non préférés a été présenté avec une femme mannequin virtuel (Figure 1.3). Dans un essai subséquent de choix d’un partenaire deuxième, focales femelles a choisi à nouveau entre les mâles mêmes (Figure 1.4). Nous avons analysé si focales femelles avaient copié le choix d’un partenaire de la femelle modèle observée en comparant sa décision choix d’un partenaire dans le critère de choix d’un partenaire premier et deuxième. Nous avons effectué deux différents traitements expérimentaux dans lequel nous avons manipulé visuellement la qualité de la femelle du mannequin virtuel. Au cours de la période d’observation, nous avons présenté soit le préalable non préférés virtuel mâle (1) avec une femme mannequin virtuel avec une tache gravide (traitement « spot ») ; ou (2) avec une femme mannequin virtuel sans un endroit gravide (traitement « sans tache »). En outre, dans un contrôle sans n’importe quelle femelle modèle, nous avons vérifié si les femelles focales choisi systématiquement quand aucune information publique a été fournie.
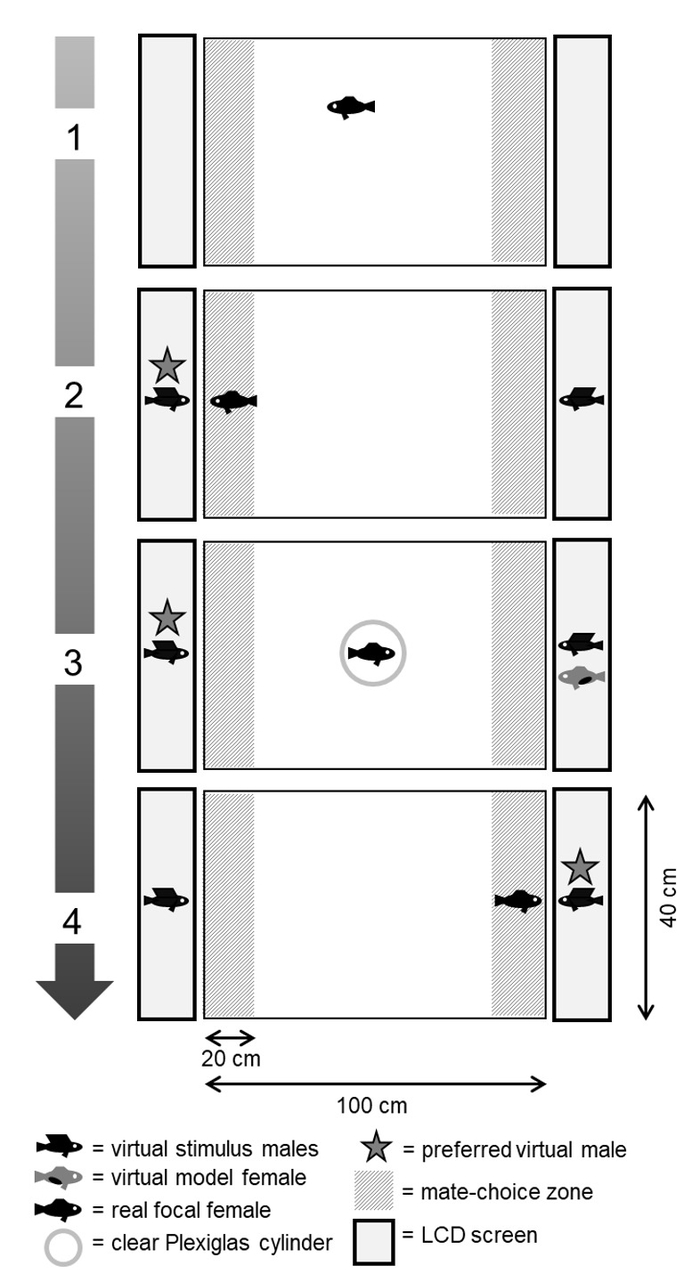
Figure 1. Aperçu général des mesures expérimentales plus importantes pour une expérience MCC à l’aide de stimuli poissons virtuels. (1) période d’acclimatation. Test de second choix (2) : femelle focale direct choisit entre mâles virtuels stimulation. Période d’observation (3) : focal montres préalable non préférés mâle avec une femelle de modèle virtuel avec spot gravides. (4) -choix d’un partenaire deuxième essai : la femelle focale choisit à nouveau entre mâles de stimulation virtuelle. Dans cet exemple, elle copie le choix du modèle. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
Les expériences effectuées et la manutention du poisson étaient conformes à la législation du bien-être Animal allemand (Deutsches Tierschutzgesetz) et approuvé par le directeur du bien-être animal interne Dr Urs Gießelmann, Université de Siegen et les autorités régionales ( Kreisveterinäramt Siegen-Wittgenstein ; Numéro de permis : 53,6 55-05).
1. virtuel poisson Design
Remarque : Trouver une liste du matériel et du logiciel dans la liste des documents complémentaires. On trouvera une description détaillée des fonctionnalités générales de FishSim et autres conseils et astuces dans le manuel de l’utilisateur (https://bitbucket.org/EZLS/fish_animation_toolchain/).
-
Préparation des textures de corps de la femme avec et sans tache gravides
- Démarrez GIMP et cliquez sur le fichier >> Ouvrir pour ouvrir l’image de texture du corps de la femme « PLF_body_6. png » depuis le dossier modèles dans le répertoire «fishsim_animation_toolchain». Utiliser cette image comme une référence pour toutes les nouvelles textures de corps féminin créé avec spot gravides. Sélectionnez la zone de spot gravide sombre de l’image de référence avec l' outil de sélection libre et coupez-le (cliquez sur Modifier >> coupé).
Remarque : GIMP (disponible à www.gimp.org) est une image libre outil, similaire à Adobe Photoshop, ce qui peut être utilisé pour manipuler des graphiques et des images numériques d’édition. - Ouvrir un second fichier de texture de corps de la femme dans GIMP (par exemple, « PLF_body_7.png ») et de transférer la zone spot sur la deuxième texture corps en insérant (Edit >> Coller dedans) préalable coupe spot zone comme un nouveau calque flottant. Ajustez la position de la tache gravide dans la deuxième photo et fusionner les couches en cliquant sur couche >> couche d’ancrage.
Remarque : S’assurer que la zone du spot gravide a la même taille et la position identique sur chaque femme mannequin virtuel (Figure 2) ! - Exporter (Edit >> Exporter en tant que) la nouvelle texture « spot » sous un nouveau nom (par exemple, PLF_body_7_S. png) dans le dossier modèles . Fermer toutes les photo fenêtres ouvertes dans GIMP.
Remarque : Ne font pas d’autres changements (p. ex., mise à l’échelle) à la texture fichiers puisqu’ils sont spécialement édités pour être plus tard mappés sur les poissons 3D. - Créez une deuxième texture corps sans un endroit gravide, utilisant le même fichier de texture de corps féminin original une seconde fois (par exemple, « PLF_body_7.png »). Maintenant, couvrir les taches gravides déjà existantes dans le fichier d’origine avec l’aide de GIMP.
- Ouvrez la texture du corps féminin dans GIMP et sélectionnez l' outil Cloner. Sélectionnez le modèle de la zone abdominale (sans pigmentation foncée) en appuyant sur Ctrl + clic gauche et utilisez cette sélection pour couvrir la pigmentation foncée existante en peignant dessus avec l’outil Cloner (Figure 2).
- Exporter le nouvellement créé « sans tache » texture sous un nouveau nom (par exemple, PLF_body_7_NS.png) dans le dossier modèles . Fermez GIMP.
- Démarrez GIMP et cliquez sur le fichier >> Ouvrir pour ouvrir l’image de texture du corps de la femme « PLF_body_6. png » depuis le dossier modèles dans le répertoire «fishsim_animation_toolchain». Utiliser cette image comme une référence pour toutes les nouvelles textures de corps féminin créé avec spot gravides. Sélectionnez la zone de spot gravide sombre de l’image de référence avec l' outil de sélection libre et coupez-le (cliquez sur Modifier >> coupé).
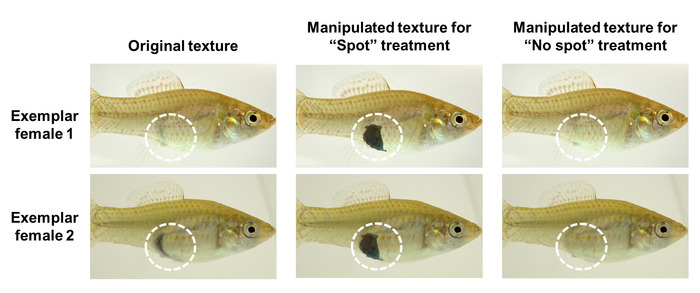
Figure 2 : images exemplaire du corps féminin textures avant (original) et après manipulation de « spot » et de « sans tache » traitement à l’aide de la retouche photo outil GIMP. Le cercle en pointillé marque la zone qui a été manipulée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Réglage du point de vue et le « décor » pour l’animation
- Démarrez FishSim en cliquant sur l’icône FishSim dans le lanceur sur le côté gauche du Bureau. Configurer la résolution pour les écrans de présentation, puis cliquez sur lancer.
Remarque : Il est recommandé de procéder aux ajustements suivants (mesures 1.2.2\u20121.2.4) sur l’écran de l’un des moniteurs présentation (si moniteur dimensions et résolutions diffèrent). - Appuyez sur F1 sur le clavier pour changer de mode au mode d’édition (bascule entre l’affichage et le mode de modification en appuyant sur F1) d’affichage.
Remarque : Passer en mode édition permet le montage de la barre d’outils en haut de la fenêtre. La scène comme on le voit dans le mode d’affichage représente ce qui sera présenté à l’écran pendant les expériences. - Ajuster le point de vue doit correspondre aux dimensions des moniteurs présentation en ajustant l’angle de la caméra. Faire pivoter la caméra en maintenant le bouton gauche de la souris et déplacez le curseur. Déplacer la caméra en maintenant enfoncé le bouton droit de la souris et en déplaçant le curseur. Zoomer et dézoomer en tenant le milieu de la souris (ou les deux boutons de la souris) et en déplaçant le curseur.
- Cliquez sur paramètres de la caméra dans la barre d’édition (icône d’appareil photo), puis cliquez sur Copy to cam statique pour définir le point de vue. Cliquez sur fichier >> enregistrer la scène pour enregistrer la scène ajustée comme la nouvelle scène par défaut. Pour ce, remplacer le fichier « default_scene.scene » dans le dossier de scènes du répertoire FishSim .
Remarque : La scène par défaut s’affiche à chaque démarrage de FishSim et comme la scène de départ en FishPlayer. En FishPlayer la scène par défaut sert également une pause au cours d’expériences (Figure 3 a). La scène de réglage doit être fait qu’une seule fois.
- Démarrez FishSim en cliquant sur l’icône FishSim dans le lanceur sur le côté gauche du Bureau. Configurer la résolution pour les écrans de présentation, puis cliquez sur lancer.

Figure 3 : captures d’écran d’une scène en FishSim. (A) la scène par défaut vide sans un poisson, (B) une scène montrant un homme seul, (C) une scène montrant que même mâle avec une femelle de modèle avec un spot et (D) une scène montrant le mâle identique et le modèle identique femelle sans un endroit. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Conception d’un stimulus mâle virtuel pour présentation lors des tests choix d’un partenaire
Remarque : Préparer des stimuli masculins virtuels qui seront plus tard animés et présentés pour vivre les femmes focales lors des essais choix d’un partenaire.- Si ce n’est déjà ouvert, commencer à FishSim. Appuyez sur F1 pour passer en mode édition.
- Cliquez sur fichier >> modèle de poisson de charge du menu déroulant et charge le défaut sailfin mâle molly modèle «default_PLM.x» en le sélectionnant dans le dossier modèles.
- Gauche, cliquez deux fois sur le poisson chargé pour le sélectionner. Il sera surligné dans un maillage. Cliquez sur l’icône d’engrenage dans la barre d’outils pour ouvrir la boîte à outils poisson. Une boîte s’affiche avec les options d’édition utilisées pour personnaliser le mâle virtuel. Décocher la case Show mesh pour une meilleure visibilité des poissons.
- Remplacez le nom masculin.
Remarque : Le nom du mâle est importante et représente le « rôle » il jouera plus tard au cours de l’animation. Ce nom doit être identique pour chaque mâle virtuel nouvellement créé qui sera utilisé plus tard au cours des expériences. - Modifier l' échelle (dimensions) du mâle en changeant les valeurs de x, y et z, si nécessaire et cliquez sur appliquer.
- Modifier texture du mâle en cliquant dans la Boîte à outils modifierdes Textures . Cliquez sur une fonctionnalité du poisson (corps, dorsale, caudale) pour le changer.
Remarque : La zone Choisissez une texture pour sautera vers le haut avec tous les fichiers .png qui peuvent être utilisées comme textures. Textures apparaîtront avec des noms tel qu’il figure dans le dossier modèles . - Cliquez sur une texture affichée dans la liste (à droite), et il apparaîtra directement et remplacer la texture préalable sur le poisson.
- Lorsque le mâle désiré est créé, cliquez sur appliquer sous configuration dans la Boîte à outils modifieret cliquez sur enregistrer le poisson sur le disque. Enregistrez le nouveau mâle sous « Male_A.fish » dans le dossier modèles .
- En outre, enregistrer toute la scène (fichier >> enregistrer la scène) y compris qu’un mâle dans le dossier de scènes . Ici, il est recommandé d’utiliser le nom « Male_A_alone.scene » (Figure 3 b).
- Cliquez sur fichier >> scène de charge à charger la scène vide par défaut et répétez les étapes 1.3.2 à 1.3.9 créer autant des mâles virtuels différents selon les besoins et enregistrer chacune nouvellement créés mâles sous un nom unique dans le dossier modèles et comme un nouveau fichier .scene dans le dossier de la scène .
-
Conception de modèle virtuel femelle pour présentation au cours de la période d’observation
- Cliquez sur fichier >> scène de charge à charger la scène par défaut. Suivez l’étape 1.3.1 et cliquez sur fichier >> modèle de poisson de charge pour charger le modèle féminin par défaut « default_PLF.x » dans le dossier modèles .
- À gauche, double-cliquez sur la femelle chargée pour le sélectionner et ouvrir le jeu d’outils de poissons. Remplacez le nom « femelle ». L’échelle de la femelle si nécessaire comme indiqué au point 1.3.5.
Remarque : Nom et l’échelle doivent être identiques pour toutes les femmes aux fins de cette expérience. - Remplacer la texture du corps féminin par défaut avec le « spot » créé précédemment-corps texture (répertorié dans la zone de droite) comme décrit aux étapes 1.3.6 à 1.3.7.
- Cliquez sur appliquer sous Config dans la Modifier la boîte à outils, puis enregistrez le poisson disque en cliquant sur Enregistrer et créer un fichier « Female_1S.fish » (S = endroit).
- Cliquez sur fichier >> scène de charge à charger la scène par défaut. Répétez les étapes 1.4.1 à 1.4.4 pour créer au moins un (ou autant que nécessaire), mais féminin modèle identique sans le gravides repérer et nommez-le « Female_1NS.fish » (NS ne = aucune tache). Enregistrez chaque poisson dans le dossier de modèles .
Remarque : Pour la période d’observation de l’expérience MCC, scènes dont un mâle et une femelle doivent être créées et enregistrées. - Cliquez sur fichier >> scène de charge à charger la scène vide par défaut. Cliquez sur fichier >> modèle de poisson de charge d’insérer un mâle virtuel « Male_A.fish » dans le dossier modèles . Cliquez sur fichier >> modèle de poisson de charge pour ajouter le virtuel modèle féminin « Female_1S.fish » à la scène. Changer la position de chaque poisson en modifiant leur x, y et z les coordonnées afin que leurs corps ne se chevauchent pas.
Remarque : Supprimer un poisson de la scène en double-cliquant dessus et en appuyant sur supprimer du clavier. - Enregistrer la scène comme mâle et femelle de modèle en cliquant sur fichier >> Save Scene comme « Male_A_with_Female_1S.scene » (Figure 3).
- Répétez les étapes 1.4.6 à 1.4.7 pour créer trois scènes supplémentaires pour : (1) Male_A Female_1NS (voir Figure 3D), Male_B (2) avec Female_1S et Male_B (3) avec Female_1NS.
2. l’animation des poissons virtuels Stimuli
Remarque : Chaque type d’animation nécessaire pour l’expérience doit être préparé en utilisant qu’une seule fois une scène de sexe masculine exemplaire et scène une observation exemplaire (mâle et femelle ensemble d’animation). Au cours du processus d’animation, un chemin de natation pour chaque poisson est créé qui peuvent plus tard être relus par n’importe quel poisson, aussi longtemps que le nom est identique (voir étape 1.3.4).
-
Animations mâles virtuelles pour présentation lors des tests choix d’un partenaire
Remarque : Préparer deux animations d’un mâle virtuel : (1) un chemin de natation avec une durée de 7,5 min et (2) un chemin de natation avec une durée de 5 min.- Branchez le contrôleur de jeu (par exemple, Sony Play Station 3) dans le port USB de l’ordinateur d’exploitation.
- Ouvrez FishSim et cliquez sur fichier >> scène de charge à charger la scène d’un mâle à partir du dossier des scènes, par exemple, « Male_A_alone.scene ». Démarrez FishSteering en cliquant sur l’icône FishSteering .
- Configurer les paramètres du contrôleur dans une fenêtre séparée.
Remarque : FishSim et FishSteering s’exécutent simultanément et poissons peuvent soit être piloté dans les vues de mode, comme indiqué au cours d’expériences, ou en mode d’édition en appuyant sur F1. - Pour animer le poisson (mâle), sélectionnez-le dans le menu déroulant du panneau de direction . Noms de modèles ici correspondent au nom donné dans la Boîte à outils modifier (voir étape 1.3.4).
- Cliquez sur Démarrer la mise en place et utiliser le contrôleur pour placer le poisson pour toute position de départ dans le réservoir virtuel. Cliquez sur arrêter la mise en place.
- Démarrer l’enregistrement chemin de nage du poisson en cliquant sur Démarrer l’enregistrement. Le contrôleur permet de déplacer les poissons autour de la scène.
Remarque : La durée de l’enregistrement est donnée dans le coin inférieur droit du panneau direction. - Cliquez sur arrêter l’enregistrement. Sur le lecteur (par exemple, sur le bureau), cliquez sur Enregistrer pour enregistrer le chemin de la piscine sous forme de fichier .bag (un « enregistrement »). Choisissez le nom du fichier pour représenter la durée de l’enregistrement, par exemple, « 7_30_min_male_alone.bag ».
Remarque : Une fois que l’enregistrement est terminé, il n’est pas possible de modifier la durée totale à nouveau. - Modifier l’enregistrement pour ajouter du mouvement de la nageoire dorsale du mâle pour imiter le comportement de mâles lors des essais choix d’un partenaire. Sélectionnez la nageoire dorsale dans le menu déroulant dans la fonction Edit (seule fonctionnalité peut être éditée à la fois).
- Sélectionnez Start édition et le chemin d’accès complet de natation seront relus. Appuyez sur le bouton L1 sur le contrôleur pour déclencher la nageoire dorsale à des points précis dans le temps. Cliquez sur Enregistrer pour enregistrer la version éditée de la trajectoire de la natation comme un nouveau . sac-fichier.
- Répétez les étapes 2.1.8 et 2.1.9 mais sélectionnez le gonopodium ajoute son mouvement. Enregistrer la version définitive pour une utilisation ultérieure dans FishPlayer. Proche FishSteering.
Remarque : Il est recommandé de sauvegarder les fichiers-sac pour chaque étape de montage sous un nom unique. En cela, il est toujours possible de revenir à une version antérieure de l’animation, si quelque chose dans le processus d’édition va mal.
-
Virtuelle animation femelle mâle et modèle pour présentation au cours de la période d’observation
Remarque : Préparer une animation avec un virtuel mâle et la femelle de modèle virtuel en parade nuptiale, ainsi sexuellement interagissent entre eux, d’une durée totale de 10 min.- Ouvert FishSim. Appuyez sur F1 pour passer en mode édition, cliquez sur fichier >> scène de charge de charger une scène avec mâles et femelles, par exemple, « Male_A_with_Female_1S.scene ». Commencer FishSteering.
- Sélectionnez tour à tour mâle et femelle à placer (en cliquant sur Start/Stop plaçant) dans le réservoir virtuel.
- Pour l’enregistrement, sélectionnez d’abord le poisson femelle dans le menu déroulant du panneau de direction et créez un chemin de natation avec une durée de 10 min suivant étapes 2.1.5 à 2.1.6.
Remarque : Le chemin de la nage du poisson qu’une seule à la fois peut être enregistré. Après animant les premiers poissons, le chemin d’accès de nage des poissons deuxième peut être inclus en utilisant la fonction modifier alors que le poisson précédemment articulé sont relu aux côtés pendant toute la durée de l’animation. - Cliquez sur arrêter l’enregistrement et Enregistrer le chemin de la natation sur le lecteur, par exemple, comme « 10_00_min_male_with_female.bag ». Puis successivement modifier chemin de natation du mâle, le mouvement de la nageoire dorsale et mouvement gonopodium comme indiqué aux paragraphes 2.1.8 à 2.1.10. Enregistrer la version définitive pour une utilisation ultérieure dans FishPlayer.
3. préparer l’Animation Playlists pour l’expérience MCC
Remarque : Utilisez FishPlayer pour présenter des animations sur deux moniteurs à vivre les femmes focales. Organiser la liste de lecture pour chaque moniteur séparément simuler la procédure de l’expérience MCC (Figure 1). L’outil se compose d’une fenêtre principale montrant la playlist record pour chaque moniteur (Figure 4) et une fenêtre d’animation distincte pour chaque moniteur de présentation.
-
Fonctionnalités générales et l’agencement des scènes et enregistrements
- Fermez toutes les fenêtres et ouvrez FishPlayer en cliquant sur l’icône correspondante. Configurer le programme d’installation pour l’utilisation avec deux moniteurs pour la présentation (gauche et droite), puis cliquez sur lancer.
Remarque : La scène par défaut créée à l’étape 1.2.4 (enregistré dans scenes/default_scene.scene) est toujours chargée et affichée sur les deux écrans comme les lieux de départ et lors d’une commande de pause. - Ajouter des entrées à la liste de lecture pour chaque moniteur séparément. Cliquez sur Add charge scène pour ajouter la scène de p. ex. mâle A, dans le dossier de scènes dans le répertoire FishSim . Cliquez sur Add vynile pour ajouter un enregistrement à partir du disque, par exemple, le record de 7,5 min pour un homme seul.
Remarque : La scène et l’enregistrement suivant seront alors liés par le logiciel et le mâle virtuel représenté dans la scène sera animé tel que défini dans l’enregistrement correspondant. - Cliquez sur pause Add pour ajouter une commande de pause d’une durée précise (minutes/secondes) montrant la scène par défaut sans poissons comme une pause pour les poissons de manutention entre les enregistrements.
Remarque : Durée de la pause devrait dépendent généralement du temps nécessaire pour les poissons de manutention. Cliquez sur une entrée et faire glisser pour modifier sa commande dans la liste. Entrées sélectionnées sont marquées en rouge. Supprimer un enregistrement dans la liste de lecture en sélectionnant l’entrée, puis en cliquant sur Supprimer la sélection. - Cliquez sur Play/Stop pour démarrer et arrêter une présentation. Arrêter se terminera toujours la playlist complète, par exemple, il n’y a aucun moyen pour faire une pause au milieu d’une liste de lecture une fois en cours d’exécution.
Remarque : Playlists toujours partir de la première entrée et exécuté de haut en bas. Par conséquent, le bon ordre de toutes les entrées doit être réglé avant l’expérience et ne peut être modifié par la suite sans s’arrêter à la présentation. Une minuterie au bas de la fenêtre indique la durée et l’heure réelle de la liste de lecture courante.
- Fermez toutes les fenêtres et ouvrez FishPlayer en cliquant sur l’icône correspondante. Configurer le programme d’installation pour l’utilisation avec deux moniteurs pour la présentation (gauche et droite), puis cliquez sur lancer.
-
Arrangement de playlist pour les deux traitements et le contrôle de l’expérience MCC
Remarque : En ce qui concerne l’arrangement de l’entrée, l’expérience de la MCC est divisé en deux parties : (1) le test de second choix et (2) la période d’observation, suivi de l’essai de deuxième-choix d’un partenaire. Par conséquent, pour chaque traitement et le contrôle, les listes de lecture ont être disposés en deux ordres différents.- Lors de l’exécution de l’expérience, d’abord, préparer une playlist pour le test de second choix.
- Deuxièmement, dans le processus de l’expérience en cours d’exécution, modifier la disposition de la sélection pour la période d’observation subséquente et le deuxième test choix d’un partenaire selon laquelle mâle virtuel a été préféré par la femelle focale dans le test de second choix.
-
Arrangement de playlist spécifique pour le traitement « spot »
- Pour le test choix d’un partenaire de premier traitement 1, commandez la playlist exactement tel que représenté sur la Figure
- Après le test de second choix, faire pause pour calculer quel mâle virtuel a été préféré (voir étape ci-dessous 5,9). Ensuite réorganiser les playlists pour la période d’observation, dans laquelle l’information est fournie à la femelle focale en montrant le préalable mâle non préférés ainsi que de la femelle de modèle.
- Organiser la liste de lecture pour l’observation et le second test de-choix d’un partenaire suivant selon la Figure 5.
- Pour la période d’observation, associer une scène montrant le prieur préféré masculin seul le record de 10 min (homme et modèle femme ensemble).
Remarque : Dans ce cas, que le chemin de natation du mâle s’affichera et, parce qu’il est absent de la scène, la femelle modèle virtuel seront absente. - La liste de lecture avec le mâle non préférés, liez le record de 10 min à la scène comme le préalable mâle non préférés ainsi que de la femelle de modèle. Choisissez les scènes dont une femelle de modèle avec un spot gravide (S) pour ce traitement.
Remarque : Contrairement à 3.3.2, ici, l’enregistrement identique est relu, mais la femelle modèle est maintenant visible.
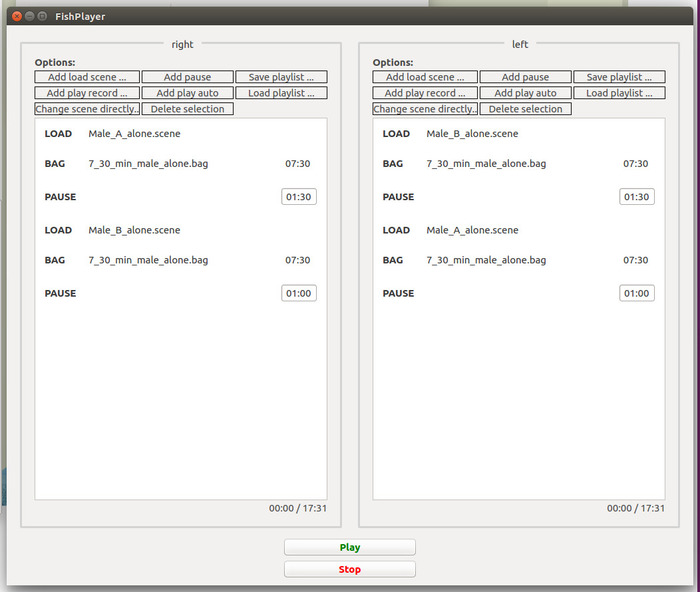
Figure 4 : capture d’écran montrant les playlists de FishPlayer pour les moniteurs de gauche et de droite dans la première partie (i. e., le choix d’un partenaire de premier-test) de l’expérience de la MCC. Les entrées de liste de lecture sont classées selon les besoins du test de second choix dans traitement 1. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
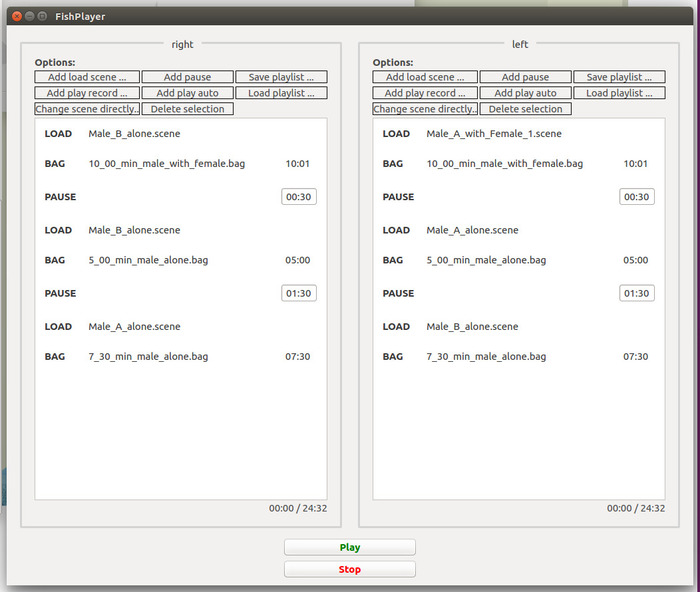
Figure 5 : capture d’écran montrant les playlists de FishPlayer pour les moniteurs de gauche et de droite dans la deuxième partie (période d’observation et de deuxième choix d’un partenaire test) de l’expérience de la MCC. Les entrées de liste de lecture sont classées selon les besoins pour la période d’observation et le deuxième test choix d’un partenaire en traitement 1. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
-
Arrangement de playlist spécifique pour le traitement « sans tache »
- Pour traitement 2, commander les playlists comme pour le traitement 1 (Figures 4 et 5), mais utilise plutôt la scène dont la femme mannequin virtuel sans un endroit gravide (NS) durant l’observation.
-
Arrangement de playlist spécifique pour le contrôle de la cohérence des choix
Remarque : Dans le contrôle de la cohérence des choix, entrées de playlist pour le test choix d’un partenaire sont identiques aux traitements 1 et 2 (Figure 4). Au cours de la période d’observation, cependant, aucune information publique est fournie aux femelles focales et, par conséquent, aucune femelle modèle n’est visible.- Ordonner les listes de lecture, tel qu’illustré à la Figure 5 , mais combiner les scènes pour chaque mâle seul ainsi que le record de 10 min.
Remarque : Dans ce cas, que le chemin de la nage des poissons mâles s’affichera et, parce qu’il est absent de la scène, la femelle modèle seront absente des deux côtés.
- Ordonner les listes de lecture, tel qu’illustré à la Figure 5 , mais combiner les scènes pour chaque mâle seul ainsi que le record de 10 min.
4. expérimental
- Place ordinateur deux écrans chacun aux extrémités opposées d’un bassin d’essai. Ajuster les écrans pour couvrir la plupart des parois de verre de la citerne de test et d’avoir 1,5 cm d’espace entre les écrans et les parois du réservoir. Fournir un éclairage à la cuve par le haut.
- Couvrir le fond de la cuve avec une fine couche de gravier et remplissez-la d’eau approprié pour les poissons vivants à la hauteur des écrans. Marquer une zone de choix avec une ligne verticale à une profondeur de 20 cm de chaque extrémité sur l’extérieur de la cuve. Avoir sous la main une bouteille de verre acrylique et deux chronomètres.
- Connectez les moniteurs pour l’alimentation et à l’ordinateur d’exploitation, placé au moins 1 m éloigné de la citerne de test, par exemple, sur une petite table (Figure 6).

Figure 6 : montage expérimental pour l’expérience de la MCC avec animation par ordinateur. Le mode d’ordinateur se connecte à deux moniteurs de présentation (moniteur 1 et 2) qui relire des animations à vivre focales femelles à l’intérieur de la cuve d’essai. À titre d’illustration, les deux écrans LCD sont inclinées pour montrer une scène animée. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
5. exécution de l’expérience MCC
Remarque : Suivez la marche à suivre ci-dessous pour effectuer un essai de traitement 1, 2 de traitement ou le contrôle expérience MCC à l’aide d’une seule femelle focale direct (voir Figure 1).
- Ouvrez FishPlayer sur l’ordinateur d’exploitation et organiser les listes de lecture pour le test de second choix comme par exemple, pour le traitement 1 (Figure 4). Assurez-vous que les moniteurs de présentation sont en cours d’exécution et qu’ils montrent la scène vide par défaut.
- Placer une femelle focale direct dans le bassin d’essai. Lui laisser nager librement et de s’acclimater à la citerne et la présentation des citernes vides sur les deux écrans pour une durée de 20 min.
- Après acclimatation, placez la femelle focale dans un cylindre acrylique clair au milieu du réservoir de test afin d’assurer une distance égale à deux moniteurs et exécuter les listes de lecture sur les deux moniteurs simultanément en cliquant sur jouer, commençant par le premier lieutenant-choix test.
Remarque : La femelle focale est autorisée à regarder tant les hommes de stimulation virtuelle de l’intérieur du cylindre pour environ 2,5 min. - Avant que la minuterie atteint 02:30 min, aller lentement vers le réservoir expérimental et libérer la femelle focale de la bouteille en la soulevant doucement vers le haut tout droit sorti de l’eau, par exemple, à 02:15 min.
Remarque : Ici, la chronologie exacte dépend de la distance entre l’ordinateur d’exploitation et le bassin d’essai et devrait être déterminée au cours des séries de tests préalables. Il est essentiel d’agir lentement et doucement pour éviter d’endommager le poisson. Étant donné que les poissons peuvent agir très vite, il est recommandé d’avoir déjà un chronomètre à portée de main tout en libérant la femelle pour directement commencer à mesurer le temps de l’association (voir étape 6.1). - Revenez vers l’ordinateur d’exploitation. Observer la femelle focale et ont deux chronomètres à portée de main à temps association mesure avec chaque mâle de stimulation virtuelle (voir étape 6.1).
Remarque : La femelle focale est autorisée à nager librement et de choisir entre les deux hommes pendant 5 min. - Arrêter de mesurer le temps de liaison lorsque la minuterie atteint à 07:30 min. L’entrée de pause fonctionnera alors pour 1,5 min. utilisation la pause car temps de manutention, encore une fois, la femelle focale à l’intérieur de la bouteille et notez l’heure pour chaque mâle virtuel sur une feuille de données.
Remarque : Après la pause, le deuxième 07:30 entrée minutes va commencer et la femelle focale pouvez regarder tant les hommes à 02:30 minutes. Position de sexe masculine est maintenant passée entre gauche et droite pour contrôler un biais secondaires possibles chez les femelles focales (voir étape 6.3). - Avant que la minuterie atteint 11:30 min, libérer la femelle focale de la bouteille. Temps de liaison mesure pour les prochaine 5 min.
- Arrêter de mesurer le temps de liaison lorsque la minuterie atteint 16:30 min. L’entrée de pause se déroulera pendant 1 min. utilisation cette fois de manipulation pour placer la femelle focale à l’intérieur de la bouteille.
- Écrire le temps de l’association pour la deuxième mesure. Pour chaque homme, résumer fois association des deux moitiés de l’essai de second choix (avant et après que les hommes sont passés). Calculer si la focale femelle avait un biais de côté et quel mâle a été préféré par la femelle focale (voir étapes 6.1 à 6.3).
Remarque : Il n’est pas un problème si la pause est terminée avant que le calcul est fait, depuis la sélection à sa fin et arrêter a besoin de passer à l’étape suivante. - Réorganiser les playlists (faire pas fermer FishPlayer!) comme illustré à la Figure 5 (selon le traitement actuel) afin que le prieur préféré mâle sera animé seul au cours de la période d’observation et le mâle préalable non préférés sera animé avec le mannequin virtuel femelle.
Remarque : Les modifications apportées à des sélections ne sont pas visibles à la femelle de focale. - Cliquez sur jouer pour poursuivre que la deuxième partie de l’expérience et les entrées peuvent être lus du haut vers le bas à partir de la période d’observation de 10 min.
Remarque : Au cours de la période d’observation, la focale femelle reste à l’intérieur de la bouteille, mais est en mesure de regarder les deux présentations. - Après la période d’observation, une pause de 0,5 min commence. Avant que la minuterie atteint 10:30 min, libérer la femelle focale du cylindre et commencer la deuxième - choix d’un partenaire d’essai avec le record de 5 min pour chaque mâle. Mesurer les temps de liaison pour les prochaine 5 min.
- Arrêter de mesurer le temps de liaison lorsque la minuterie atteint 15:30 min. L’entrée de pause alors courir pour 1,5 min. Place la focale femelle à l’intérieur de la bouteille et notez le temps chronométré pour chaque homme virtuel.
Remarque : Après la pause, le prochain 07:30 min entrée va commencer et la femelle focale peuvent regarder tant les hommes (dont la position est à nouveau passé entre gauche et droite) pour 2,5 min. - Avant que la minuterie atteint 19:30 min, relâchez la femelle focale du cylindre et mesurer le temps d’association pour les 5 dernières minutes.
- Arrêter de mesurer le temps de liaison lorsque la minuterie atteint 24 h 30 min et mettre fin à l’expérience. Écrire le temps de l’association pour les deux mâles virtuels et procéder à l’analyse.
6. mesure de données
- Mesurer le temps de l’association au cours de la première et la deuxième partie (avant et après les stimuli sont commutés) de chaque test choix d’un partenaire, quand la femelle focale est autorisée à choisir entre les deux mâles.
Remarque : Commencer à mesurer lorsque la femelle croise la ligne de la zone de choix avec sa tête et l’opercule de confinement. Arrêter la mesure lorsque sa tête et son opercule sont hors de la zone de choix. - Association temps mesuré pour chaque mâle dans la première et la deuxième partie d’un critère de choix d’un partenaire en résumé et déterminer quel mâle a été préféré.
Remarque : Le mâle préféré est déterminé comme celui la femelle focale a passé plus de 50 % du temps total qu'elle a passé dans les deux zones de choix au sein d’un test choix d’un partenaire. Pour l’analyse, temps de l’association est souvent traduit dans les scores de préférence (valeur relative des-choix d’un partenaire), qui est défini comme le temps passée de focale femelle avec un mâle divisé par le temps passé avec les deux hommes dans les zones choix d’un partenaire. - Calculer si focales femelles présentent un biais de côté pendant le test de second choix et excluent des femelles biaisées de l’analyse finale.
Remarque : Focales femelles sont réputées être influencé par les côté s’ils passaient plus de 90 % du temps total (les deux moitiés de l’essai de second choix) dans la même zone de choix, même après que le poste masculin a été changé. Son choix pour un mâle est alors considérée comme côté biaisée et le procès est terminé. - Mesurer la longueur standard de chaque femelle focal (SL).
Remarque : Pour empêcher les poissons de stress au cours d’expériences, les mesures sont toujours faites après la fin de l’essai expérimental.
Access restricted. Please log in or start a trial to view this content.
Résultats
Suite au protocole, nous avons utilisé FishSim pour créer des animations d’ordinateur virtuel sailfin molly mâles et femelles. Plus loin, nous avons utilisé les outils de compilation de présenter des animations à vivre les femmes focales dans une situation de choix binaire pour réaliser une expérience MCC conformément à la procédure expérimentale décrite dans la Figure 1 et l’étape 5 du protocole.
Access restricted. Please log in or start a trial to view this content.
Discussion
L’endroit gravide chez les femelles de sailfin molly a été décrit précédemment pour servir comme moyen de publicité de fertilité vers mâles conspécifiques59,60. Si une tache gravide peut-être aussi fournir des informations aux femelles conspécifiques dans le cadre du choix d’un partenaire n'avait pas été testé jusqu'à présent. Dans la présente étude de cas, nous avons examiné le rôle potentiel d’un spot gravide comme source d’informati...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par la Deutsche Forschungsgemeinschaft DFG (WI 1531/12-1 KW et SG) et KU 689/11-1 à KDK, KM et JMH. Nous remercions sincèrement le programme DAAD RISE Allemagne pour offre et organisation d’un stage de stage de recherche entre SG et DB (financement-ID : 57346313). Nous sommes reconnaissants à Mitacs pour financement DB avec une bourse de stage de recherche de lieu-Globalink (FR21213). Nous vous prions remercier Aaron Berard pour nous invitant à présenter FishSim le lectorat de JoVE et Alisha DSouza ainsi que trois évaluateurs anonymes pour leurs précieux commentaires sur une version antérieure du manuscrit.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Hardware | |||
| 2x 19" Belinea LCD displays | Belinea GmbH, Germany | Model 1970 S1-P | 1280 x 1024 pixels resolution |
| 1x 24" Fujitsu LCD display | Fujitsu Technology Solutions GmbH, Germany | Model B24-8 TS Pro | 1920 x 1080 pixels resolution |
| Computer | Intel Core 2 Quad CPU Q9400 @ 2.66GHz x 4, GeForce GTX 750 Ti/PCIe/SSE2, 7.8 GiB memory, 64-bit, 1TB; keyboard and mouse | ||
| SONY Playstation 3 Wireless Controller | Sony Computer Entertainment Inc., Japan | Model No. CECHZC2E | USB-cable for connection to computer |
| Glass aquarium | 100 cm x 40 cm x 40 cm (L x H x W) | ||
| Plexiglass cylinder | custom-made | 49.5 cm height, 0.5 cm thickness, 12 cm diameter; eight small holes (approx. 5 mm diameter) drillt close to the end of the cylinder lower the amount of water disturbance while releasing the fish | |
| Gravel | |||
| 2x OSRAM L58W/965 | OSRAM GmbH, Germany | Illumination of the experimental setup | |
| 2x Stopwatches | |||
| Name | Company | Catalog Number | Comments |
| Software | |||
| ubuntu 16.04 LTS | Computer operating system; Download from: https://www.ubuntu.com/ | ||
| FishSim Animation Toolchain v.0.9 | Software download and user manual (PDF) from: https://bitbucket.org/EZLS/fish_animation_toolchain | ||
| GIMP Gnu Image Manipulation Program (version 2.8.22) | Download from: https://www.gimp.org/ |
Références
- Witte, K., Gierszewski, S., Chouinard-Thuly, L. Virtual is the new reality. Current Zoology. 63 (1), 1-4 (2017).
- Chouinard-Thuly, L., et al. Technical and conceptual considerations for using animated stimuli in studies of animal behavior. Current Zoology. 63 (1), 5-19 (2017).
- Basolo, A. L. Female preference for male sword length in the green swordtail, Xiphophorus helleri (Pisces: Poeciliidae). Animal Behaviour. 40 (2), 332-338 (1990).
- Rosenthal, G. G., Evans, C. S. Female preference for swords in Xiphophorus helleri reflects a bias for large apparent size. Proceedings of the National Academy of Sciences of the United States of America. 95 (8), 4431-4436 (1998).
- Schlupp, I., Waschulewski, M., Ryan, M. J. Female preferences for naturally-occurring novel male traits. Behaviour. 136 (4), 519-527 (1999).
- Campbell, M. W., Carter, J. D., Proctor, D., Eisenberg, M. L., de Waal, F. B. M. Computer animations stimulate contagious yawning in chimpanzees. Proceedings of the Royal Society B: Biological Sciences. 276 (1676), 4255-4259 (2009).
- Woo, K. L., Rieucau, G. The importance of syntax in a dynamic visual signal: recognition of jacky dragon displays depends upon sequence. Acta Ethologica. 18 (3), 255-263 (2015).
- Balzarini, V., Taborsky, M., Villa, F., Frommen, J. G. Computer animations of colour markings reveal the function of visual threat signals in Neolamprologus pulcher. Current Zoology. 63 (1), 45-54 (2017).
- Tedore, C., Johnsen, S. Visual mutual assessment of size in male Lyssomanes viridis jumping spider contests. Behavioral Ecology. 26 (2), 510-518 (2015).
- Watanabe, S., Troje, N. F. Towards a “virtual pigeon”: a new technique for investigating avian social perception. Animal Cognition. 9 (4), 271-279 (2006).
- Culumber, Z. W., Rosenthal, G. G. Mating preferences do not maintain the tailspot polymorphism in the platyfish Xiphophorus variatus. Behavioral Ecology. 24 (6), 1286-1291 (2013).
- Gierszewski, S., Müller, K., Smielik, I., Hütwohl, J. -M., Kuhnert, K. -D., Witte, K. The virtual lover: variable and easily guided 3D fish animations as an innovative tool in mate-choice experiments with sailfin mollies - II. Validation. Current Zoology. 63 (1), 65-74 (2017).
- Thurley, K., Ayaz, A. Virtual reality systems for rodents. Current Zoology. 63 (1), 109-119 (2017).
- Stowers, J. R., et al. Virtual reality for freely moving animals. Nature. 14 (10), 995(2017).
- Powell, D. L., Rosenthal, G. G. What artifice can and cannot tell us about animal behavior. Current Zoology. 63 (1), 21-26 (2017).
- Müller, K., Smielik, I., Hütwohl, J. -M., Gierszewski, S., Witte, K., Kuhnert, K. -D. The virtual lover: variable and easily guided 3D fish animations as an innovative tool in mate-choice experiments with sailfin mollies-I. Design and implementation. Current Zoology. 63 (1), 55-64 (2017).
- Veen, T., et al. anyFish: an open- source software to generate animated fish models for behavioural studies. Evolutionary Ecology Research. 15 (3), 361-375 (2013).
- Ingley, S. J., et al. anyFish 2. 0: An open-source software platform to generate and share animated fish models to study behavior. SoftwareX. 3, 13-21 (2015).
- Bakker, T. C. M., Pomiankowski, A. The genetic basis of female mate preferences. The Journal of Evolutionary Biology. 8 (2), 129-171 (1995).
- Andersson, M., Simmons, L. W. Sexual selection and mate choice. Trends in Ecology & Evolution. 21 (6), 296-302 (2006).
- Danchin, É, Giraldeau, L. -A., Valone, T. J., Wagner, R. H. Public information: From nosy neighbors to cultural evolution. Science. 305 (5683), 487-491 (2004).
- Pruett-Jones, S. Independent Versus Nonindependent Mate Choice: Do Females Copy Each Other? The American Naturalist. 140 (6), 1000-1009 (1992).
- Witte, K., Kniel, N., Kureck, I. M. Mate-choice copying: Status quo and where to go. Current Zoology. 61 (6), 1073-1081 (2015).
- Witte, K., Nöbel, S. Learning and Mate Choice. Fish Cognition and Behavior. Brown, C., Laland, K. N., Krause, J. , Blackwell Publishing Ltd. 81-107 (2011).
- Waynforth, D. Mate Choice Copying in Humans. Human nature. 18 (3), 264-271 (2007).
- Galef, B. G., White, D. J. Evidence of social effects on mate choice in vertebrates. Behavioural Processes. 51 (1-3), 167-175 (2000).
- Kniel, N., Dürler, C., Hecht, I., Heinbach, V., Zimmermann, L., Witte, K. Novel mate preference through mate-choice copying in zebra finches: sexes differ. Behavioral Ecology. 26 (2), 647-655 (2015).
- Kniel, N., Schmitz, J., Witte, K. Quality of public information matters in mate-choice copying in female zebra finches. Frontiers in Zoology. 12, 26(2015).
- Kniel, N., Müller, K., Witte, K. The role of the model in mate-choice copying in female zebra finches. Ethology. 123 (6-7), 412-418 (2017).
- Mery, F., et al. Public Versus Personal Information for Mate Copying in an Invertebrate. Current Biology. 19 (9), 730-734 (2009).
- Dagaeff, A. -C., Pocheville, A., Nöbel, S., Loyau, A., Isabel, G., Danchin, E. Drosophila mate copying correlates with atmospheric pressure in a speed learning situation. Animal Behaviour. 121, 163-174 (2016).
- Monier, M., Nöbel, S., Isabel, G., Danchin, E. Effects of a sex ratio gradient on female mate-copying and choosiness in Drosophila melanogaster. Current Zoology. 64 (2), 251-258 (2018).
- Dugatkin, L. A., Godin, J. -G. J. Reversal of female mate choice by copying in the guppy (Poecilia reticulata). Proceedings of the Royal Society B: Biological Sciences. 249, 179-184 (1992).
- Widemo, M. S. Male but not female pipefish copy mate choice. Behavioral Ecology. 17 (2), 255-259 (2006).
- Heubel, K. U., Hornhardt, K., Ollmann, T., Parzefall, J., Ryan, M. J., Schlupp, I. Geographic variation in female mate-copying in the species complex of a unisexual fish, Poecilia formosa. Behaviour. 145 (8), 1041-1064 (2008).
- Bierbach, D., et al. Male fish use prior knowledge about rivals to adjust their mate choice. Biology Letters. 7 (3), 349-351 (2011).
- Munger, L., Cruz, A., Applebaum, S. Mate choice copying in female humpback limia (Limia nigrofasciata, family Poeciliidae). Ethology. 110 (7), 563-573 (2004).
- Frommen, J. G., Rahn, A. K., Schroth, S. H., Waltschyk, N., Bakker, T. C. M. Mate-choice copying when both sexes face high costs of reproduction. Evol Ecol. 23 (3), 435-446 (2009).
- Witte, K., Ryan, M. J. Mate choice copying in the sailfin molly, Poecilia latipinna, in the wild. Animal Behaviour. 63 (5), 943-949 (2002).
- Goulet, D., Goulet, T. L. Nonindependent mating in a coral reef damselfish: evidence of mate choice copying in the wild. Behavioral Ecology. 17 (6), 998-1003 (2006).
- Alonzo, S. H. Female mate choice copying affects sexual selection in wild populations of the ocellated wrasse. Animal Behaviour. 75 (5), 1715-1723 (2008).
- Godin, J. -G. J., Hair, K. P. E. Mate-choice copying in free-ranging Trinidadian guppies (Poecilia reticulata). Behaviour. 146, 1443-1461 (2009).
- Nordell, S. E., Valone, T. J. Mate choice copying as public information. Ecology Letters. 1 (2), 74-76 (1998).
- Vukomanovic, J., Rodd, F. H. Size-Dependent Female Mate Copying in the Guppy (Poecilia reticulata): Large Females are Role Models but Small Ones are not. Ethology. 113 (6), 579-586 (2007).
- Dugatkin, L. A., Godin, J. -G. J. Female mate copying in the guppy (Poecilia reticulata): age-dependent effects. Behavioral Ecology. 4, 289-292 (1993).
- Amlacher, J., Dugatkin, L. A. Preference for older over younger models during mate-choice copying in young guppies. Ethology Ecology & Evolution. 17 (2), 161-169 (2005).
- Hill, S. E., Ryan, M. J. The role of model female quality in the mate choice copying behaviour of sailfin mollies. Biology Letters. 2 (2), 203-205 (2006).
- Gierszewski, S., Keil, M., Witte, K. Mate-choice copying in sailfin molly females: public information use from long-distance interactions. Behavioral Ecology and Sociobiology. 72 (2), 26(2018).
- Schlupp, I., Marler, C., Ryan, M. J. Benefit to male sailfin mollies of mating with heterospecific females. Science. 263 (5145), 373-374 (1994).
- Schlupp, I., Ryan, M. J. Male sailfin mollies (Poecilia latipinna) copy the mate choice of other males. Behavioral Ecology. 8 (1), 104-107 (1997).
- Witte, K., Ryan, M. J. Male body length influences mate-choice copying in the sailfin molly Poecilia latipinna. Behavioral Ecology. 9 (5), 534-539 (1998).
- Witte, K., Ueding, K. Sailfin molly females (Poecilia latipinna) copy the rejection of a male. Behavioral Ecology. 14 (3), 389-395 (2003).
- Verzijden, M. N., ten Cate, C., Servedio, M. R., Kozak, G. M., Boughman, J. W., Svensson, E. I. The impact of learning on sexual selection and speciation. Trends in Ecology & Evolution. 27 (9), 511-519 (2012).
- Varela, S. A. M., Matos, M., Schlupp, I. The role of mate-choice copying in speciation and hybridization. Biological Reviews. 93 (2), 1304-1322 (2018).
- Nöbel, S., Danchin, E., Isabel, G. Mate-copying for a costly variant in Drosophila melanogaster females. Behavioral Ecology. , ary095(2018).
- Norazmi-Lokman, N. H., Purser, G. J., Patil, J. G. Gravid Spot Predicts Developmental Progress and Reproductive Output in a Livebearing Fish, Gambusia holbrooki. PLoS One. 11 (1), e0147711(2016).
- Constantz, G. D. Reproductive biology of poeciliid fishes. Ecology and Evolution of livebearing fishes (Poeciliidae). Meffe, G. K., Snelson, F. F. , Prentice Hall. 33-50 (1989).
- Peden, A. E. Variation in Anal Spot Expression of Gambusiin Females and Its Effect on Male Courtship. Copeia. 1973 (2), 250-263 (1973).
- Farr, J. A., Travis, J. Fertility Advertisement by Female Sailfin Mollies, Poecilia latipinna (Pisces: Poeciliidae). Copeia. 1986 (2), 467-472 (1986).
- Sumner, I. T., Travis, J., Johnson, C. D. Methods of Female Fertility Advertisement and Variation among Males in Responsiveness in the Sailfin Molly (Poecilia latipinna). Copeia. 1994 (1), 27-34 (1994).
- Witte, K., Noltemeier, B. The role of information in mate-choice copying in female sailfin mollies (Poecilia latipinna). Behavioral Ecology and Sociobiology. 52 (3), 194-202 (2002).
- R Development Core Team. R: a language and environment for statistical computing. , Available from: http://www.r-project.org (2015).
- Bischoff, R. J., Gould, J. L., Rubenstein, D. I. Tail size and female choice in the guppy (Poecilia reticulata). Behavioral Ecology and Sociobiology. 17 (3), 253-255 (1985).
- Forsgren, E. Predation Risk Affects Mate Choice in a Gobiid Fish. The American Naturalist. 140 (6), 1041-1049 (1992).
- Berglund, A. Risky sex: male pipefishes mate at random in the presence of a predator. Animal Behaviour. 46 (1), 169-175 (1993).
- Kodric-Brown, A. Female choice of multiple male criteria in guppies: interacting effects of dominance, coloration and courtship. Behavioral Ecology and Sociobiology. 32 (6), 415-420 (1993).
- Witte, K., Klink, K. B. No pre-existing bias in sailfin molly females, Poecilia latipinna, for a sword in males. Behaviour. 142 (3), 283-303 (2005).
- Nöbel, S., Witte, K. Public Information Influences Sperm Transfer to Females in Sailfin Molly Males. PLoS One. 8 (1), e53865(2013).
- Pinheiro, J., Bates, D., DebRoy, S., Sarkar, D., Team, R. C. nlme: Linear and Nonlinear Mixed Effects Models. , Available from: http://cran.r-project.org/package=nlme (2015).
- Crawley, M. J. The R Book. , John Wiley & Sons, Ltd. (2007).
- Pinheiro, J. C., Bates, D. M. Mixed-Effects Models in S and S-PLUS. , Springer-Verlag. New York. (2000).
- Zuur, A., Ieno, E. N., Walker, N., Saveliev, A. A., Smith, G. M. Mixed Effects Models and Extensions in Ecology with R. , Springer. New York. (2009).
- De Rosario-Martinez, H. phia: Post-Hoc Interaction Analysis. , Available from: https://cran.r-project.org/web/packages/RVAideMemoire (2015).
- Korner-Nievergelt, F., Roth, T., von Felten, S., Guélat, J., Almasi, B., Korner-Nievergelt, P. Bayesian Data Analysis in Ecology Using Linear Models with R, BUGS, and Stan. , Elsevier Science. (2015).
- Hervé, M. RVAideMemoire: Testing and Plotting Procedures for Biostatistics. , Available from: https://cran.r-project.org/package=RVAideMemoire%0A (2017).
- Travis, J. Ecological genetics of life history traits in poeciliid fishes. Ecology and Evolution of livebearing fishes (Poeciliidae). Meffe, G. K., Snelson, F. F. , Prentice Hall. 185-200 (1989).
- Benson, K. E. Enhanced Female Brood Patch Size Stimulates Male Courtship in Xiphophorus helleri. Copeia. 2007 (1), 212-217 (2007).
- Hurlbert, S. H. Pseudoreplication and the design of ecological field experiments. Ecological Monographs. 54 (2), 187-211 (1984).
- McGregor, P. K. Playback experiments: design and analysis. Acta Ethologica. 3 (1), 3-8 (2000).
- Smielik, I., Müller, K., Kuhnert, K. D. Fish motion simulation. ESM 2015-European Simulation and Modelling (EUROSIS) Conference Proc. , 392-396 (2015).
- Baird, R. C. Aspects of social behavior in Poecilia latipinna (Lesueur). Revista de Biología Tropical. 21 (2), 399-416 (1974).
- Tedore, C., Johnsen, S. Using RGB displays to portray color realistic imagery to animal eyes. Current Zoology. 63 (1), 27-34 (2017).
- Calabrese, G. M., Brady, P. C., Gruev, V., Cummings, M. E. Polarization signaling in swordtails alters female mate preference. Proceedings of the National Academy of Sciences of the United States of America. 111 (37), 13397-13402 (2014).
- Qin, M., Wong, A., Seguin, D., Gerlai, R. Induction of social behavior in zebrafish: live versus computer animated fish as stimuli. Zebrafish. 11 (3), 185-197 (2014).
- Scherer, U., Godin, J. -G. J., Schuett, W. Validation of 2D-animated pictures as an investigative tool in the behavioural sciences A case study with a West African cichlid fish, Pelvicachromis pulcher. Ethology. 123 (8), 560-570 (2017).
- Butkowski, T., Yan, W., Gray, A. M., Cui, R., Verzijden, M. N., Rosenthal, G. G. Automated interactive video playback for studies of animal communication. The Journal of Visualized Experiments. (48), 2374(2011).
- Müller, K., Gierszewski, S., Witte, K., Kuhnert, K. -D. Where is my mate? Real-time 3-D fish tracking for interactive mate-choice experiments. ICPR 2016-23rd International Conference for Pattern Recognition; VAIB 2016, Proc. , 1-5 (2016).
- Müller, K., Schlemper, J., Kuhnert, L., Kuhnert, K. -D. Calibration and 3D ground truth data generation with orthogonal camera-setup and refraction compensation for aquaria in real-time. IEEE 2014 International Conference on Computer Vision Theory and Applications (VISAPP). 3, 626-634 (2014).
- Müller, K., Hütwohl, J. M., Gierszewski, S., Witte, K., Kuhnert, K. D. Fish Motion Capture with Refraction Synthesis. Journal of WSCG. , In press (2018).
- ASAB Guidelines for the treatment of animals in behavioural research and teaching. Animal Behaviour. 135, I-X (2018).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen and Co. Ltd. London. (1959).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon