Method Article
Flash Nanoprécipitation pour l’Encapsulation des composés hydrophobes et hydrophiles en nanoparticules polymériques
Dans cet article
Résumé
Flash Nanoprécipitation (FNP) est une approche évolutive pour produire des nanoparticules polymériques de noyau-enveloppe. Préparations de laboratoire pour l’encapsulation de produits thérapeutiques hydrophobes ou hydrophiles sont décrites.
Résumé
La formulation d’un composé thérapeutique en nanoparticules (NPs) peut conférer des propriétés uniques. Pour les médicaments faiblement solubles dans l’eau, les formulations de NP peuvent améliorer la biodisponibilité et modifier la distribution des médicaments dans le corps. Pour les médicaments hydrophiles comme les peptides ou protéines, encapsulation STPN peut également fournir protection de mécanismes de dégagement naturel. Il existe peu de techniques pour la production de polymères NPs qui sont évolutives. Flash Nanoprécipitation (FNP) est un procédé qui utilise sous mélange géométries pour produire NPs avec les distributions de taille étroite et tailles réglables entre 30 et 400 nm. Ce protocole fournit des instructions sur la production de laboratoire de nanoparticules polymériques noyau-enveloppe d’une taille de cible à l’aide des FNP. Le protocole peut être implémenté pour encapsuler des composés hydrophiles ou hydrophobes avec seulement quelques légères modifications. La technique peut être facilement utilisée en laboratoire à l’échelle de milligramme aux formulations de l’écran. Hits de plomb peuvent directement être transposés à l’échelle gramme et kilogramme. Comme un processus continu, intensification implique plus de mélange temps de processus d’exécution plutôt que de traduction aux bateaux neufs de processus. SNP produites par des FNP est très chargées avec thérapeutique, disposent d’une brosse de polymère stabilisante dense et ont une reproductibilité de la taille de ± 6 %.
Introduction
Depuis la fin des années 1990, il y a eu une augmentation constante du nombre d’essais cliniques utilisant des nanomatériaux1,2. L’intérêt grandissant reflète la promesse des nanomatériaux pour améliorer la biodisponibilité des médicaments hydrophobes et pour activer le ciblage préférentiel au sein du corps3. Les nanoparticules polymériques (dénommés nanoparticules ou NPs ici) représentent une proportion croissante de cette classe de matériaux2. SNP ont suscité d’intérêt parce qu’ils ont des propriétés hautement accordables comme taille, composition et fonctionnalisation de surface4. Lorsqu’il est appliqué à l’administration de médicaments peu solubles, NPs ont souvent une structure de noyau-enveloppe où la thérapeutique est encapsulé dans le noyau hydrophobe et la coquille se compose d’une brosse de polymère hydrophile. Un moyen simple de générer cette structure emploie un copolymère à deux blocs amphiphiles (BCP) consistant en un bloc hydrophobe dégradable, qui s’inscrit dans le noyau de la particule, et bloquer un poly(ethylene glycol) hydrophile (PEG), qui constitue la brosse de polymère et confère une stabilisation stérique4,5.
Nanoprécipitation est une technique courante de fabrication de nanoparticules polymériques parce qu’il est simple et pas d’énergie intensif6. Dans sa forme la plus simple, nanoprécipitation comporte ajout de composants de NP dans un solvant organique comme l’acétone pour un excès de volume d’eau brassé à l’aide d’une pipette. Le changement dans un solvant d’une solution aqueuse diluée provoque la précipitation de la composante de base insoluble. Le stabilisateur assemble sur cette surface de particules croissant, réalisé par adsorption du bloc hydrophobe effondré7,8,9,10. Une granulométrie uniforme est obtenue lorsque le solvant et l’eau mélangent rapidement pour former une solution homogène. Mélange qui est plus lent que la nucléation et Assemblée des composants résultats dans un plus grand, plus polydispersés population de particules. Bien que facilement accessible pour un simple test, l’approche de lot agité se traduit par une grande variabilité en raison de l’incohérence de mélange et n’est pas favorable à l’intensification6,11. Microfluidique est apparus comme une autre voie à la production de NP qui peut être exécutée en continu. Ce mode de production a été récemment examiné par Ding et al. 11 . Une approche commune utilise mise au point pour réduire l’échelle de longueur solvant aux valeurs Sub-micronique à flux laminaire. Mélange de l’antisolvent ne se produit par diffusion, dimensions de faible débit sont essentielles assurer des particules uniformes11,12. Parallélisation des chambres multiples de microfluidique pour l’intensification est problématique pour les volumes de production de grande taille.
Les conditions de mélange rapides qui favorisent la nanoprécipitation uniforme en microfluidique alternativement peuvent être produites en clos, écoulements turbulents. Flash Nanoprécipitation (FNP) emploie des géométries mélange spéciales pour atteindre ces conditions dans des débits volumétriques supérieurs que possible avec la microfluidique. Flux d’entrée entrer dans une chambre de mélange dans des conditions turbulentes qui mènent à la génération de tourbillons, afin que les lamelles de solvant/anti-solvent se forment sur l’échelle de la longueur de diffusion11,13. Ainsi, un mélange homogène sur une échelle de temps plus courte que la nucléation et la croissance de la thérapeutique est atteint. La géométrie confinée de la table de mixage ne permet pas de stream contournant la région où dissipation d’énergie turbulent se produit et l’ensemble du système subit le même processus histoire13. Nucléation se produit uniformément dans la chambre de mélange et croissance des particules produit jusqu'à arrêtée par l’Assemblée de la BCP sur la surface9,14. Le flux mixte contenant des particules stables peut-être ensuite être dilué avec antisolvent supplémentaire pour réprimer Ostwald maturation des particules15,16,17.
Un mélangeur à jet (CIJ) incidente confiné est la conception la plus simple table de mixage pour les FNP et permet le mélange des deux cours d’eau de façon continue et évolutive, comme le montre la Figure 1 a13. Un vortex d’entrée multiples (MIVM) a été développé pour permettre jusqu'à quatre entrées de différents cours d’eau tout en permettant le micromélange rapide requis pour la formation de particules uniformes, comme illustré à la Figure 1 b18. FNP permet le dépistage de formulation simple qui peut facilement être traduit à la production à l’échelle commerciale. En raison du caractère continu du processus, grandes tailles de lot ne nécessitent pas de nouveaux navires mais plutôt durées, permettant une traduction simple de production à l’échelle kilogramme dans le même train de matériel.
Des composés hydrophiles tels que des peptides et des protéines (« produits biologiques ») peuvent également être encapsulés dans un processus appelé inverse Flash Nanoprécipitation (iFNP). La technique nécessite un amphiphiles BCP où un pâté de maisons est hydrophobe et l’autre est un polyacide19. La première étape implique un mélange rapide de stream diméthyl sulfoxyde (DMSO) contenant du biologique et du BCP contre un solvant lipophile comme le dichlorométhane ou le chloroforme. Cela se traduit par la formation de particules stabilisées avec le pinceau de bloc hydrophobe. Ici, une telle architecture sera qualifier une NP « inversé ». Le noyau contient le polyacide, qui est ensuite ioniquement réticulé en utilisant une cations multivalentes. Cela stabilise les particules à la transformation en milieu aqueux sous forme de microparticules ou PEG-enduit de nanoparticules par des techniques qui ont été signalés dans la littérature19,20,21.
Ce protocole peut être utilisé pour la production de laboratoire de nanoparticules de noyau-enveloppe polymères encapsulation composés hydrophobes ou hydrophiles. Les sous-sections du protocole fournissent des instructions sur l’utilisation des deux classes de mélangeur - la CIJ et la MIVM. Le lecteur doit être en mesure d’adapter le protocole pour les composants de base roman et reproductible générer des nanoparticules d’une taille désirée à l’aide de la table de mixage appropriée pour les entrées de flux. Trois formulations d’exemple à l’aide des FNP et iFNP sont présentées ci-dessous. Deux emploient le mélangeur de la CIJ et on exige le MIVM15,22. La première formulation montre encapsulation d’un modèle hydrophobe composé par les FNP. La deuxième formulation montre encapsulation d’un modèle hydrophile composé par iFNP dans un mélangeur de la CIJ. La formulation finale fournit un exemple d’encapsulation de protéine par iFNP utilisant un MIVM. Le protocole pour cette troisième formulation décrit l’utilisation d’un MIVM à petite échelle, poche, appelé le « μMIVM ». La conception de la table de mixage est plus petite afin de permettre le dépistage formulation simplifiée, mais le comportement de mise à l’échelle est bien compris et le mixeur n’est pas un dispositif de microfluidique22. La section finale du protocole inclut quelques notes sur l’intensification des formulations de plomb identifiés au préalable. Ces formules sont destinées à fournir des points d’accès pour le processus d’apprentissage et par conséquent utiliser non dégradables poly (styrène)-base de polymères. Stabilisateurs alternatifs ont été décrits dans la littérature, avec un certain nombre d’options commerciales biocompatible disponible14,23,24.
Protocole
1. encapsulation des composés hydrophobes en polymères NPs à l’aide d’un mélangeur de la CIJ
- Préparer et nettoyer le matériel.
- Acquérir et valider un mélangeur de la CIJ.
Remarque : Voir Information supplémentaire d’orientation de la construction de l’article 1. Fichiers CAO sont également disponibles à titre d’Information supplémentaire . - Avant chaque utilisation, assurez-vous que tous les raccords sur la robinetterie de la CIJ sont bien ajustées et le tube de sortie n’est pas plié ou coincé.
- Sous une hotte, fixez une seringue de verrouillage luer de 5 mL contenant de 2 à 3 mL de solvant à chaque carte d’admission. Sélectionnez un solvant (p. ex., acétone) qui va nettoyer tout composés récemment utilisés dans la table de mixage.
Remarque : Les sélections typiques sont l’acétone ou le tétrahydrofurane (THF). Seulement utilisation de seringues en polypropylène pour éviter les problèmes de compatibilité solvant tels que lessivage. N’utilisez pas de seringues avec pistons de joint d’étanchéité joint torique en caoutchouc. - Définir l’assemblage de la CIJ dans un conteneur à déchets.
Remarque : Un ballon avec une ouverture plus petite que le corps de la CIJ fonctionne bien car cela prend en charge la table de mixage et permet une utilisation facile des seringues. - Appuyer régulièrement sur les pistons de seringue pour vider le contenu par le biais de la chambre de mélange pendant quelques secondes. Enlever les seringues.
Remarque : Seringues peuvent être conservés et réutilisés pour plusieurs cycles de nettoyage entre les exécutions de la FNP. - Sécher les CIJ mélangeur internes à l’aide d’un flux de2 N. Un adaptateur luer mâle à l’extrémité d’une ligne de2 N est efficace.
Remarque : Si le solvant de nettoyage n’est pas volatile (p. ex., DMSO), répétez les étapes 1.1.3-1.1.5 avec l’acétone ou le THF avant de procéder à l’étape 1.1.6. Il est essentiel d’enlever le solvant résiduel par souci de cohérence run-to-run.
- Acquérir et valider un mélangeur de la CIJ.
- Préparer le flux de solvants et antisolvent à des compositions de cible.
- Dissoudre le composé hydrophobe (c.-à-d., vitamine E) dans le THF non stabilisée à 10 mg/mL en quantité suffisante pour compléter le nombre désiré de passages de la FNP. Préparer un peu plus que nécessaire par course.
Remarque : Autres solvants peuvent être utilisés dans les étapes suivantes, sous réserve des contraintes dans la section « Discussion ». Si employant THF, exempt de stabilisant de solvant est recommandée car butylhydroxytoluène a faible solubilité dans l’eau. Soyez prudent afin d’éviter l’accumulation de peroxyde (y compris peroxyde stable) et sachez que les faibles niveaux de peroxydes peuvent interférer avec certaines applications NP (p. ex., blanchiment des colorants). - Mélanger la solution de vitamine E sur un vortex jusqu'à dissolution.
Remarque : Pour certains composés, sonication bain pendant 1-2 min peut aider à générer une solution dissoute. Il est important que tous les composants du NP sont dissous moléculairement. - Dissoudre le stabilisateur de copolymère bloc (c'est-à-dire, poly(styrene) -b- poly(ethylene glycol), PS1,6 k-b-PEG5 k) dans le THF à 10 mg/mL à environ le même volume comme au point 1.2.1 pour former la solution de polymère.
Remarque : Autres solvants peuvent être utilisés, sous réserve des contraintes décrites en détail dans la section « Discussion ». - Mélanger la solution de polymère avec un vortex jusqu'à dissolution. Si nécessaire, placer la solution dans un bain de sonication pendant 1-2 min aider à la dissolution des solides.
Remarque : Le polymère ne peut pas être dans une forme micellaire. Diffusion dynamique de la lumière (DLS) peut être un outil utile pour déterminer si une nouvelle composition de flux répond à ce critère. - Créer le flux d’entrée solvant contenant 5 mg/mL de vitamine E et le stabilisateur (50 % vitamine E chargement) en première pipetage 0,25 mL de la solution de vitamine E dans un tube à centrifuger 1,5 mL. Pipetter puis 0,25 mL de la solution de polymère dans le même tube.
Remarque : Volume supérieur à 0,5 mL par course est réalisables avec des tailles différentes de seringue. Supérieures au volume d’entrée de 10 mL, il est pratique d’utiliser une pompe à seringue. - Mélangez bien sur un vortex pour 5-10 s. éventuellement, centrifuger le tube à 1000 x g pendant 5 à 10 s récupérer n’importe quel liquide collé à la PAC, qui améliore la reproductibilité entre les exécutions de la CIJ.
- Pipetter 0,525 mL d’eau désionisée dans un tube à centrifuger 1,5 mL deuxième comme le flux antisolvent.
Remarque : Il est préférable d’avoir des excès antisolvent, ce qui garantit que le flux de solvant pénètre jamais dans la chambre de mélange sans antisolvent présent. Dans certains cas, lorsque la solubilité de sel dans le mélange solvant/antisolvent n’est pas limité, les systèmes aqueux dans la mémoire tampon peuvent être utilisés. - Pipetter 4 mL d’eau désionisée dans un flacon de 20 mL à scintillation ou autre récipient approprié comme un bain de trempe. Placer une barre de petite agitation magnétique dans le flacon.
Remarque : Le bain de trempe réduit la Ostwald maturation en abaissant la teneur en solvant finale à 10 % en volume15,17. Ce volume peut être ajusté pour résoudre les problèmes de processus et peut être mesuré directement avec le volume du flux d’entrée.
- Dissoudre le composé hydrophobe (c.-à-d., vitamine E) dans le THF non stabilisée à 10 mg/mL en quantité suffisante pour compléter le nombre désiré de passages de la FNP. Préparer un peu plus que nécessaire par course.
- Produire le NPs de FNP en utilisant le mélangeur de la CIJ.
- Placer le flacon de bain trempe ouvert sous la table de mixage CIJ nettoyé sur une plaque de remuer dans une hotte de laboratoire. Une configuration pratique utilise un bloc de support de tube à essai de 50 mL pour soutenir le mélangeur CIJ avec le flacon ci-dessous et le tube de sortie réalisé dans le flacon. Consultez la Figure 1 a pour l’orientation.
- Begin en remuant la trempe bain via la barre magnétique remuer autour de 75 % de la vitesse max.
- À l’aide d’une seringue de 1 mL en polypropylène munie d’une aiguille à pointe arrondie, dessiner tout le volume du tube antisolvent.
Remarque : N’utilisez pas de seringues qui contiennent un joint de joint torique en caoutchouc pour éviter tout problème de compatibilité. Pour les plus gros volumes d’admission, utiliser une seringue de fluxsol luer lock. La prise de la seringue doit être centrée sur l’axe de la seringue ou il sera instable au cours de la dépression. - Soigneusement, enlever toutes les bulles d’air de la seringue et retirer l’aiguille pointe émoussée, jetant dans un conteneur d’objets coupants.
- Amorcer le piston pour que le flux vient juste pour l’ouverture de la seringue. Connecter la seringue à l’un des raccords d’aspiration CIJ.
- Répétez les étapes 1.3.3-1.3.5 pour la solution de solvant.
- Rapidement, facilement et uniformément enfoncer les seringues en même temps en plaçant le ballon de la main, la paume de la main ou un seul doigt de chaque sur les sommets des plongeurs selon vos préférences personnelles. Recueillir l’effluent dans le flacon de bain de trempe.
Remarque : Un 0,5 mL d’entrée doit être enfoncé en moins de 0,5 s. - Mettre de côté la CIJ mélangeur avec les seringues encore attachés. Retirer la barre de mélanger et boucher le flacon, qui contient maintenant la dispersion NP avec une structure de la particule de noyau-enveloppe (Figure 1).
- Tenir la table de mixage sur un récipient de solution déchets et enlever les seringues. Le hold-up de volume (environ 0,25 mL) est ensuite vidangés. Jeter les seringues usagées et répéter l’étape de nettoyage 1.1 avant le FNP suivante du procès.
Remarque : Ne permettent pas le volume de hold-up de se jeter dans le flacon contenant les NPs que cela affectera négativement homogénéité de l’échantillon.
- Effectuer une analyse et post-traitement de la dispersion de la NP.
- Pour caractériser la taille NP à l’aide de listes de distribution, distribuer 100 μL de la dispersion de NP dans une cuvette en plastique et ajouter 900 μL du solvant de bain de trempe (p. ex., eau).
Remarque : Plus petits volumes sont utilisables pour des cuvettes de faible volume. Une dilution de 10 fois est généralement suffisante. - Mélangez bien en pipettant également de haut en bas ou en secouant doux. Suivez les instructions spécifiques pour analyser l’échantillon.
Remarque : Techniques de caractérisation alternatives telles que l’analyse du potentiel zêta ou microscopie électronique peut être effectuée comme nécessaire. La dispersion de la NP peut être traitée plus en détail dans les limites de l’application et examinée dans la section « Discussion ».
- Pour caractériser la taille NP à l’aide de listes de distribution, distribuer 100 μL de la dispersion de NP dans une cuvette en plastique et ajouter 900 μL du solvant de bain de trempe (p. ex., eau).
2. encapsulation des composés hydrophiles dans NPs inversées à l’aide d’un mélangeur de la CIJ
- Préparer le solvant, antisolvent et étancher les solutions sous hotte.
- Effectuer les procédures de nettoyage et de préparation décrits à l’étape 1.1, à l’aide de DMSO comme solvant de nettoyage et adhérant à la note à l’étape 1.1.6 pour compléter un second rinçage avec du THF.
- Dissoudre le composé hydrophile (c.-à-d., maltodextrine (MD) avec dextrose équivalent (DE) de poids moléculaire moyen de 4-7, 3 275 g/mol, « 3 k MD ») dans le DMSO à 10 mg/mL dans un volume suffisant pour compléter le nombre désiré de FNP s’exécute.
Remarque : Autres solvants peuvent être utilisés, sous réserve des contraintes décrites dans la section Discussion. - Mélanger la solution de maltodextrine avec un vortex jusqu'à dissolution. Si nécessaire, placer la solution dans un bain de sonication pendant 1-2 min aider à la dissolution des solides.
- Créer un stabilisateur de copolymère bloc (c'est-à-dire, poly(styrene) -b- poly (acide acrylique), PS5 k-b- PAA4,8 k) solution dans le THF à 11,1 mg/mL à environ le même volume comme au point 2.1.2 pour former la solution de polymère en stock .
Remarque : Les autres solvants et les concentrations de stabilisateur peuvent être utilisées. DMSO peut facilement être utilisé comme solvant en remplacement de THF. - Mélanger la solution de polymère avec un vortex jusqu'à dissolution. Si nécessaire, placer la solution dans un bain de sonication pendant 1-2 min aider à la dissolution des solides.
Remarque : L’entrée de polymère ne peut pas être dans une forme micellaire. DLS peut servir à déterminer si une nouvelle composition de flux répond à ce critère. - Préparer l’entrée de flux de solvant (0,5 mL) en combinant ce qui suit, par ordre, dans un tube à centrifuger 1,5 mL : 0,250 mL de la solution de k MD 3, 0,225 mL de solution de polymère et 0,025 mL d’eau désionisée.
Note : La teneur en eau de ce ruisseau a un fort impact sur la taille de NP et de polydispersité. Généralement, il est préférable d’opérer dans les 2,5 à 10 % vol rang20. Sur le haut de gamme de la gamme des valeurs peuvent aider encapsulation de grands composés de poids moléculaire. - Mélangez bien sur un vortex pour 5-10 s.
- Éventuellement, centrifuger le tube à 1000 x g pendant 5 à 10 s récupérer n’importe quel liquide collé à la PAC, qui améliore la reproductibilité entre les exécutions de la CIJ.
- Préparer une solution de reticulation de dihydrate de chlorure de calcium (CaCl2) dans le méthanol à 25,0 microgrammes par millilitre.
Note : La reticulation sera ajoutée à un rapport de 1:1 charge aux groupes acides dans le bloc de l’AAP. Ajuster la concentration en conséquence si une reticulation différente est utilisée ou si un autre AAP bloc taille ou polymère concentration utilisé20,21. - Préparer le flux antisolvent de pipetage 0,5 mL de chloroforme et 0,05 mL de la solution de reticulation (0,55 mL au total) dans un tube de microcentrifuge.
Remarque : Autres antisolvents acceptables sont dictées par le choix de copolymère bloc et comprennent généralement le dichlorométhane ou l’acétone. La reticulation peut-être plutôt être ajoutée pour le bain de trempe, avec un vieillissement supplémentaire de la dispersion de NP permettant de relier la formation20. - Mélangez bien sur un vortex pour 5-10 s.
- Éventuellement, centrifuger le tube à 1000 x g pendant 5 à 10 s récupérer n’importe quel liquide collé à la PAC, qui améliore la reproductibilité entre les exécutions de la CIJ.
- Ajouter 4 mL de l’antisolvent (c.-à-d., chloroforme) pour un flacon de 20 mL à scintillation pour former le bain de trempe. Placer une barre de petite agitation magnétique dans le flacon.
Remarque : Ce volume peut être ajusté pour résoudre les problèmes de processus.
- Compléter le protocole pour la formation de NP comme indiqué au point 1.3.
- Effectuer une analyse et post-traitement de la dispersion de la NP.
- Pour caractériser la taille NP à l’aide de listes de distribution, distribuer 100 μL de la dispersion de NP dans une cupule de verre et ajouter 900 μL du solvant utilisé pour le bain de trempe.
- Mélangez bien en pipettant également de haut en bas ou en légère agitation de la cuvette. Suivez les instructions de logiciel pour analyser l’échantillon.
Remarque : Réticulation de la SNP peut être évaluée qualitativement par DLS utilisant un bon solvant comme le DMSO ou le diméthylformamide (DMF) comme diluant DLS20. Les particules qui sont stablement réticulé exposera une fonction d’autocorrélation dans le solvant avec un changement minime dans la taille des particules. Les particules faiblement réticulé gonflent et présentent une fonction d’autocorrélation faible et diffusion force21. - Ajouter éventuellement une base, comme l’ammoniaque, à conduire de complexation ionique et renforcer la réticulation dans le noyau de la particule.
- Vous pouvez également préparer une solution de 3,48 mg/mL d’ammoniaque dans le méthanol par gravimétrie à l’aide de solution d’hydroxyde d’ammonium (typiquement, 30 wt % d’ammoniac). Ajouter 50 μL (c.-à-d., 0,6 équivalents en ce qui concerne les groupes acides sur le polymère) goutte à goutte en agitant.
Note : Les équivalents peuvent être ajustés si vous le souhaitez en faisant varier soit la concentration ou le volume ajouté25. - Éventuellement, l’âge pas moins de 30 min sous agitation légère pour la réticulation de se produire.
- Vous pouvez également préparer une solution de 3,48 mg/mL d’ammoniaque dans le méthanol par gravimétrie à l’aide de solution d’hydroxyde d’ammonium (typiquement, 30 wt % d’ammoniac). Ajouter 50 μL (c.-à-d., 0,6 équivalents en ce qui concerne les groupes acides sur le polymère) goutte à goutte en agitant.
- Processus de la dispersion de NP pour produire des microparticules ou enduits NPs comme décrit dans la littérature19,20,21.
3. encapsulation d’ovalbumine dans NPs inversées à l’aide d’un μMIVM
- Préparer des solutions de solvants et antisolvent.
- Préparer une solution de 50 mg/mL d’ovalbumine dans l’eau désionisée (« OVA »).
- Se préparer à 0,75 mL de la Solution A dans un tube à centrifuger 1,5 mL en diluant à 75 μL de la solution d’ovules avec 0,675 mL de DMSO pour générer une solution de 5 mg/mL d’ovules dans le DMSO contenant 10 % d’eau par volume. Bien mélanger et centrifuger brièvement comme décrit plus haut.
Remarque : Reportez-vous à l’étape 2.1.6 quant aux effets de l’eau. Comme dans les sections précédentes, les volumes de solution peuvent évoluer vers le haut ou vers le bas pour ajustement besoins matériels. - Préparer la solution B en dissolvant le stabilisateur de copolymère bloc (c'est-à-dire, poly(styrene) -b- poly (acide acrylique), PS5 k-b- PAA4,8 k) dans le DMSO à 6 mg/mL. Bien mélanger et laisser agir pour dissoudre si nécessaire. Pipetter 0,75 mL dans un tube à centrifuger 1,5 mL.
- Pipetter 0,75 mL de THF (Solution C) dans un tube à centrifuger 1,5 mL.
- Pipetter 1,85 mL de chloroforme (Solution D) dans un flacon en verre de scintillation.
- Préparer un 60,0 mg/mL de chlorure de calcium dihydraté reticulation solution dans le méthanol. Mélanger à l’aide d’un agitateur vortex.
- Préparer un 4,17 mg/mL de solution d’ammoniaque dans le méthanol comme indiqué au point 2.3.4.
- Ajouter 5,25 mL de chloroforme dans un tube à centrifuger 15 mL comme le bain de trempe.
- Préparer l’Assemblée mélangeur et d’éligibilité.
- Recueillir le récepteur inférieur, mélange géométrie disque, le disque supérieur, le tourne-écrou et un joint torique. Voir la Figure 2 pour schéma de composants et de la terminologie de stand mixer.
Remarque : Détails sur la construction de MIVM se trouvent dans Des informations supplémentaires (Section 1) et dans la littérature22. Fichiers CAO sont également disponibles à titre d’Information supplémentaire . - Placer le joint torique dans la rainure, veillant à ce qu’il va bien et qu’il n’y a aucun signe d’usure ou d’endommagement.
Remarque : Fonctionnement Normal conduira à joints usés ou gonflés par solvant. Si le joint torique semble tendu ou déformé, permettent à l’air sec pendant une nuit avant utilisation. Si la forme ne récupère pas du jour au lendemain, jetez le joint torique. Conserver un stock important, car il s’agit d’une partie consommable. - Avec précaution, aligner les trous de disque mélangeur avec les chevilles sur le haut de la page disque et pousser ensemble. S’assurer que le joint torique ne pas devenir déplacé en vérifiant que les deux pièces affleurer.
- Inverser les deux pièces et les assembler manuellement avec le récepteur inférieur. Veiller à ce que le raccord de tubulure de sortie a été desserré pour que cela n’interfère pas avec le serrage complet du disque.
Remarque : Si les threads prises lors du montage, soigneusement démonter et appliquez une qualité alimentaire ou pharmaceutique anti-grippage à l’enfilage pour éviter les écorchures. - Après le serrage manuel, monter la clé pour les chevilles du haut de la page disque et bien serrer l’ensemble. Ensuite, serrez le raccord de tubulure de prise afin qu’elle soit fermement contre la face inférieure de la géométrie de mélange. Assurez-vous que les raccords de la seringue sur le haut de la page disque sont bien au chaud.
- Placer le mélangeur monté sur le trépied de table de mixage pour que le tube de sortie s’étend sous la plaque de soutien. Soutenir la plaque mobile afin qu’il est suspendu éloignés de l’espace de travail.
- Éventuellement, pour vérifier l’alignement de la butée mécanique, fixez d’abord les seringues de verre vide aux entrées du mitigeur.
Remarque : Les débits volumétriques sont variées à l’aide de seringues de baril de différents diamètres, car les seringues sont enfoncés simultanément à la même vitesse linéaire. Les hauteurs verticales initiaux et finaux doivent être les mêmes pour toutes les seringues et peuvent être ajustées à l’aide de vis de réglage puisés dans l' axe de piston22. Les butées mécaniques veiller à ce que des dommages excessifs pour les seringues de verre ne se produisent pas.- Éventuellement, abaisser la plaque mobile c’est vient reposer sur les butées mécaniques. S’assurer que ceux-ci sont alignés pour que la plaque aussi s’immobilise immédiatement avant de contacter les seringues vides (comme on le voit à la Figure 2).
- Éventuellement, desserrer les butées mécaniques et les repositionner, si nécessaire. Enlever les seringues de verre et réinitialiser la plaque mobile de la route.
Remarque : Pour un fonctionnement avec des seringues en plastique, les butées mécaniques ne sont pas nécessaires.
- Placez le bain de trempe ouvert sous le tube de sortie à recueillir l’effluent.
- Dessiner la Solution A dans une seringue de 1 mL étanche à l’aide d’une aiguille à pointe émoussée. Enlever toutes les bulles d’air et de disposer de l’aiguille. Amorcer la solution à l’extrémité du raccord seringue luer. Répétez ce processus pour les Solutions B et C.
- Dessiner une Solution D une seringue étanche de 2,5 mL à l’aide d’une aiguille à pointe émoussée. Enlever toutes les bulles d’air et de disposer de l’aiguille. Amorcer la solution à l’extrémité du raccord seringue luer.
Remarque : Ces volumes ont été choisies afin que les hauteurs de piston de seringue initiale sont les mêmes. Si les volumes sont changés, ils doivent encore atteindre ce niveau de hauteur. - Assemblez les quatre seringues sur la table de mixage de manière dans le sens horaire dans l’ordre alphabétique. Voir Figure 1 b pour l’aspect final et l’orientation de seringue schématique.
Remarque : Vérifiez qu’aucune hauteur de seringue n’est sensiblement différente des autres et dépanner au besoin.
- Recueillir le récepteur inférieur, mélange géométrie disque, le disque supérieur, le tourne-écrou et un joint torique. Voir la Figure 2 pour schéma de composants et de la terminologie de stand mixer.
- Effectuer les opération de mélangeur et le nettoyage.
- Poignée du logement du roulement des deux côtés de la plaque mobile. Ne pas placer les doigts sur la face inférieure du boîtier car il s’agit d’un risque de pincement contre les butées mécaniques. Abaissez lentement la plaque mobile afin qu’il repose uniformément, mais à peine toucher les seringues.
- Progressivement et en douceur, appuyer sur la plaque, l’ambition de parachever l’opération à environ 0,5 à 1 s pour ces flux volumes22.
- Enlevez et le capuchon du tube de bain trempe qui contient maintenant la dispersion du NP.
- Prendre la table de mixage avec les seringues encore attachés et sur un conteneur à déchets. Enlever les seringues, permettant ainsi le volume de hold-up de s’écouler dans le récipient. Tenir l’ensemble de la table de mixage à l’envers et démonter la table de mixage à l’aide de la clé.
- À l’aide d’un vaporisateur, rincer le tube de sortie avec plusieurs millilitres de solvant (acétone,par exemple ) et sécher à l’air ou d’azote.
- Rincer la géométrie mélange avec un bon solvant (eaupar exemple, eau désionisée ou le DMSO) et rincer ensuite avec de l’acétone à l’aide de plusieurs millilitres d’un flacon pulvérisateur. Sec avec un flux d’air ou d’azote.
- Rincez le joint torique dans un courant d’eau déminéralisée et sécher.
- Rincez le disque haut fond avec plusieurs millilitres d’acétone à l’aide d’une bouteille de solvant jusqu'à ce que visuellement propre. Sécher avec un flux d’air ou d’azote, la surface et l’aménagement de la seringue.
- Rincer chaque seringue avec plusieurs millilitres d’un bon solvant (eaupar exemple, eau désionisée ou acétone) provenant d’une bouteille de solvant. Appliquer un rinçage final de plusieurs millilitres d’acétone et laisser sécher avant de l’utiliser.
- Effectuer le post-traitement et analyse.
- Ajouter 50 μL de la solution de reticulation chlorure de calcium dihydraté goutte à goutte tout en remuant à environ 75 % vitesse maximale.
- Ajouter 50 μL de la solution d’ammoniaque goutte à goutte tout en remuant à la vitesse maximale de 75 %. Âge d’au moins 30 min.
- Caractériser la taille NP comme décrit aux points 2.3.1 et 2.3.2.
- Processus de la dispersion de NP pour produire des microparticules ou enduits NPs comme décrit dans la littérature19,20,21.
4. les modifications de Formulation mesurent-vers le haut
- Préparer les solutions solvables et antisolvent comme décrit aux étapes 1, 2 ou 3 à la composition souhaitée et à un volume suffisant pour la taille de la formulation requise.
- Éventuellement, si nécessaire, nettoyer et stériliser le mélangeur en place en utilisant un protocole approprié avant la formation du NP.
Remarque : Rinçages séquentielles de CIP 100, eau (à pH neutre), CIP 200, eau (à pH neutre) et un solvant approprié ont été employées dans le passé. En outre, les filtres stériles peuvent être attachés aux entrées de la table de mixage dans les cas où la taille des particules finales s’oppose à une stérilisation par filtration. - Charger les solutions dans des seringues étanche de volume approprié et raccorder le tube de polytétrafluoroéthylène (PTFE) avec un adaptateur luer sur la fin. Réamorcer la pompe manuellement les solutions à l’extrémité de la tubulure.
- Charger les seringues dans un pousse-seringue et fixer les seringues à des entrées de table de mixage sur la CIJ ou le MIVM, tel que requis.
Remarque : Alternativement, régulateurs de débit permet au laboratoire ou à échelle pilote pour fournir des capacités de volume plus grandes qu’un pousse-seringue. Opération réussie exige flux constant et suffisant chute de pression, ce qui signifie que les vaisseaux sous pression avec la mesure de débit à la sortie est la sélection la plus appropriée pour la production à grande échelle.
- Charger les seringues dans un pousse-seringue et fixer les seringues à des entrées de table de mixage sur la CIJ ou le MIVM, tel que requis.
- Placer un récipient contenant un bain de trempage d’un volume suffisant, si nécessaire, sous le tube de sortie.
- Les débits volumétriques pour correspondre à ceux réalisés manuellement la valeur (par exemple, environ 30 à 60 mL/min par flux).
Remarque : Si vous utilisez de la CIJ, les débits de la pompe doivent être identiques. Si vous utilisez le MIVM, entrées différentes peuvent avoir des débits différents. - En même temps commencer les pompes. Recueillir environ 5-10 mL d’effluents comme un déchet dans un petit flacon (il s’agit d’un volume de « start-up ») et ensuite commencer à percevoir dans le bain de trempe.
- Caractériser et traiter comme décrit dans la section correspondante de formulation ci-dessus.
Résultats
Dépistage des formulations NP avec FNP est rapide et nécessite de petites quantités de matières (l’ordre de 1 à 10 mg). Le protocole des FNP pour encapsuler des composés hydrophobes tels que de la vitamine E (étape 1) entraîne une dispersion de NP stable, claire ou légèrement opalescente. Diffusion dynamique de la lumière (DLS) fournit un moyen robuste pour caractériser la taille des particules. Comme illustré à la Figure 3, le processus produit NPs avec une faible polydispersité de façon reproductible. L’indice de polydispersité typique (PDI) est inférieur à 0,20, indiquant une relativement monodisperses population. Le PDI est obtenu à partir de la fonction d’autocorrélation et est souvent implémenté dans le logiciel de l’instrument. C’est un ratio du second au premier moment, où les valeurs de 0,1 sont généralement obtenues pour monodispersés particules26. Pour les quatre vitamine E/p-b-PEG formulation réplicats signalés, la valeur est 0,12 ± 0,02 et le diamètre moyen était de 107 nm ± 7. Un typique « ratés » en raison soit dépression inégale des seringues ou vitesse lente de la dépression sont également signalé à la Figure 3. La polydispersité n’est pas affectée, mais la taille est légèrement plus grande (135 nm). Cet exemple, les nouvelles mesures pour la taille des particules sont 113 ± 14 nm. Une raté se traduit par une période où la chambre contient uniquement un type de flux unique. Il est important que l’intégralité du flux subit la même histoire de processus et les volumes relatifs des flux organiques et aqueuses dans le mélangeur. Sans stabilisateur, une solution opaque avec agrégats visibles est produite. La fonction d’autocorrélation DLS pour cet exemple est non monotone et délabre pas en douceur, comme on le voit dans l’encart de la Figure 3 .
Contrôle de taille de particule de FNP est illustrée dans la Figure 4, où les relatives des quantités variables de moignons – poly(styrene)1,8 k dans ce cas – et PS -b-PEG stabilisateur a donné lieu à des tailles de particules allant de 49-152 nm. Ces tailles de particules ont été générés avec des flux THF contenant une concentration de masse totale du noyau et stabilisateur de 20 mg/mL, où 25 %, 50 % ou 75 % de la masse était le matériel de noyau de poly(styrene). La polydispersité des nanoparticules a toujours été inférieur à 0,15. On trouvera une discussion approfondie des effets des paramètres sur la taille des particules produites par les FNP dans la littérature10. Le chargement peut être réglé en maintenant constantes les volume de solvant et en variant le volume relatif des solutions stocks principales et le stabilisateur. De même, la concentration massique totale peut varier par la préparation des solutions mères à des valeurs autres que 10 mg/mL. Sous certaines conditions, il est possible d’observer une population de micelle vide par DLS27. Cela n’a pas un effet préjudiciable, autres que l’élargissement de la distribution granulométrique mesurée. Lorsque les tailles sont similaires, cela peut se manifester comme un pic large unique plutôt que deux sommets distincts.
La table de mixage même CIJ permet également d’encapsuler des composés hydrophiles par iFNP, illustré à l’étape 2 du protocole. Les particules produites lors de la formulation signalée sont environ 65 nm avec une faible polydispersité de 0,08. La granulométrie peut être vu dans la Figure 5 a (lignes pointillées). L’effet de la réticulation, les résidus d’acide carboxylique AAP sur la stabilité des particules est démontrée par l’analyse des listes de distribution dans un solvant fort comme le DMSO, tel qu’illustré à la Figure 5 b. La fonction d’autocorrélation de puits-réticulé de particules devrait commencer près d’une valeur de 1 et de la chute brusquement à 0 à la fois caractéristique liée à la taille des particules (trait plein). Particules qui gonflent largement ou dissolvent sont pas réticulé et signal minimal d’autocorrélation (ligne pointillée). Pour iFNP, essais ayant échouées manifestent de façon semblable comme pour le FNP ci-dessus. Agrégats visibles peuvent être vu ou mauvaise forme de fonction DLS autocorrélation peut être observée. Le MIVM peut être utilisé pour les FNP ou iFNP lorsque plus de deux flux d’entrée sont nécessaires en raison des contraintes du système comme la solubilité ou incompatibilité chimique. Une version à petite échelle de la MIVM (la μMIVM) avec son stand de mixage est montrée à la Figure 2. Comme avec la CIJ, cette table de mixage peut être utilisé pour encapsuler les composés hydrophobes ou hydrophiles22. À l’étape 3, un protocole pour l’encapsulation d’une protéine hydrophile, ovules, par iFNP a été décrite. La granulométrie est montrée dans la Figure 5 a (trait plein). La taille est d’environ 125 nm avec un PDI de 0,16. Un protocole général pour le fonctionnement de la pompe seringue à grande échelle est fourni à l’étape 4.
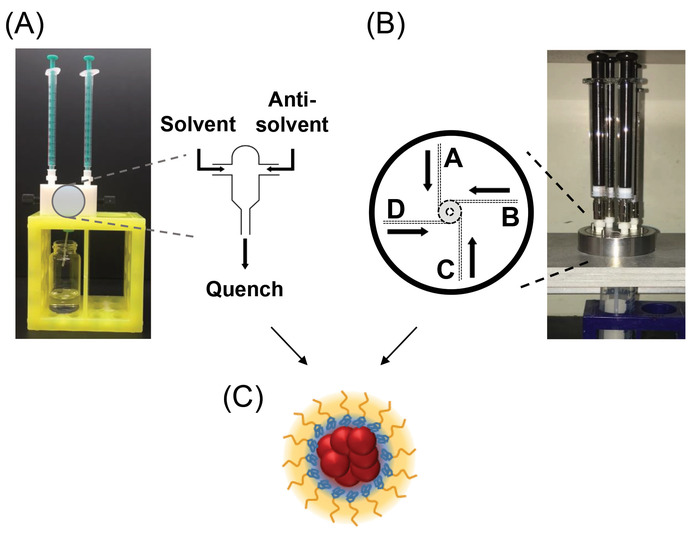
Figure 1 : Assemblée de mélangeur et écoulements internes motif schémas. (A) le clos empiétant jets (CIJ) mélangeur avec des seringues ci-joint est positionné au-dessus du bain de trempe. Ne pas sur la photo sont un bar de remuer dans le flacon de bain de trempe et d’une plaque de remuer. La mélange de la géométrie est représentée dans la vue développée montrant les entrées de deux cours d’eau qui empiètent dans le centre de la chambre. (B) une multi-entrée agitateur vortex (le μMIVM) est montré avec des seringues de verre et positionné dans le stand au-dessus d’un bain de trempe. La plaque mobile et des butées mécaniques ont été coupées de l’image. La vue développée montre schématiquement la chambre vortex et les canaux d’entrée. (C) une représentation schématique du noyau-enveloppe NPs produites par les FNP. Sphères rouges représentent la thérapeutique qui, combiné avec le bloc bleu de polymère s’est effondré, constituent le noyau de la NP. Le bloc de polymère jaune constitue la couche de brosse conférant la stabilisation stérique à la SNM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 : μMIVM terminologie et composants pour l’assemblage. La μMIVM exige un stand mixer pour permettre une dépression uniforme des quatre seringues. Dans ce cas, les hauteurs de piston de seringue doivent tous être uniformes pour assurer un mélange uniforme. Alternativement, il peut être utilisé à l’aide de pompes à seringue. Le stand de mixage avec composants marqués est indiqué à gauche de la figure. Sur la droite est le mélangeur démonté avec le joint torique en place sur le disque mélange de géométrie. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
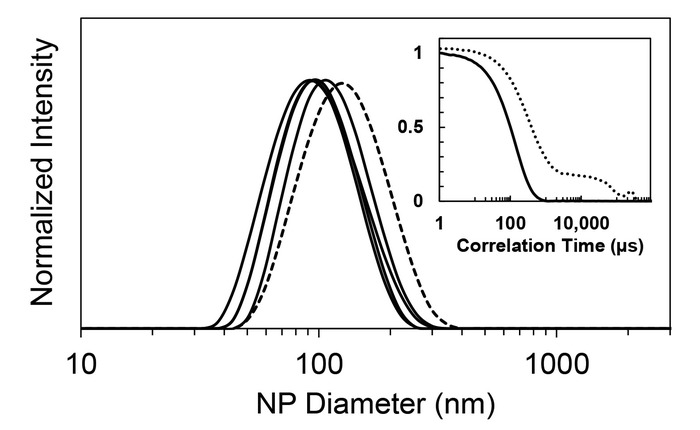
Figure 3 : Particle size distribution des nanoparticules polymériques contenant un noyau de vitamine E et stabilisé par PS -b-PEG. Diffusion dynamique de la lumière (DLS) prévoit des distributions de taille intensité pondérée qui indiquent la distribution des diamètres NP. Les courbes sont la moyenne des analyses en triple pour chaque essai et ont été redimensionnés pour produire des hauteurs maximales identiques. Les quatre réplicats (lignes pleines) indiquent la grande reproductibilité de la méthode (écart-type = 7 nm). Représentante raté (ligne pointillée), tels que la vitesse plus lente de seringue ou de dépression inégale des deux seringues, qui se traduit par le plus grand diamètre de particules est également inclus. La déviation standard de la taille de NP, y compris les ratés d’allumage a été de 14 nm. (En médaillon) Sans le PS -b-stabilisateur de cheville, grands agrégats à l’échelle du micron (ou gouttelettes, dans le cas d’une huile comme la vitamine E) sont formés. La fonction d’autocorrélation DLS d’un parcours sans le stabilisateur (ligne pointillée) est illustrée avec une autocorrélation représentative d’un réplicat de nanoparticules (trait plein). La fonction d’autocorrélation montre un certain nombre d’échelles de temps caractéristiques pour l’échantillon de contrôle, ce qui indique une population de polydispersité. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
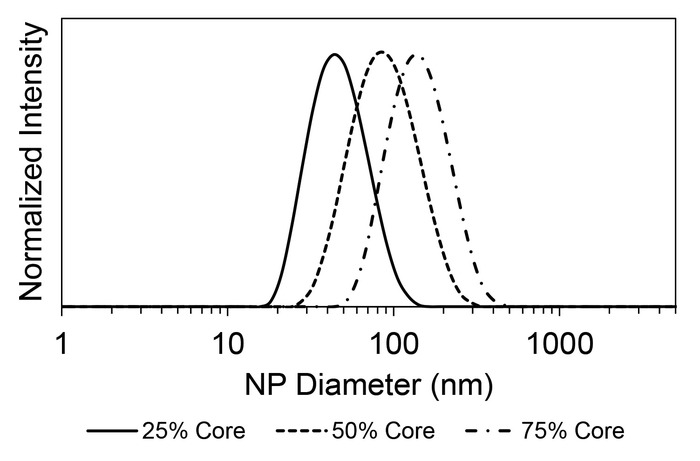
Figure 4 : contrôle de la particule taille de FNP à travers différents ratios relatives du matériau à stabilisateur core. Les distributions de taille intensité pondérée en fonction des trois formulations avec un noyau poly(styrene) stabilisé par PS -b-PEG sont représentés. La concentration massique totale dans le THF était de 20 mg/mL et l’antisolvent avait de l’eau. Les formulations ont été préparées dans un mélangeur de la CIJ. La fraction de la masse composée du matériel du noyau est répertoriée dans la légende. Par exemple, l’échantillon 25 % contenue 5 mg/mL poly(styrene) et 15 mg/mL PS -b-PEG. La taille moyenne de 25 % (ligne continue), 50 % (ligne pointillée) et 75 % (ligne pointillée mixte) charges de base était 49 nm, 96 nm et 152 nm, respectivement. Toutes les valeurs PDI étaient inférieurs à 0,15. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
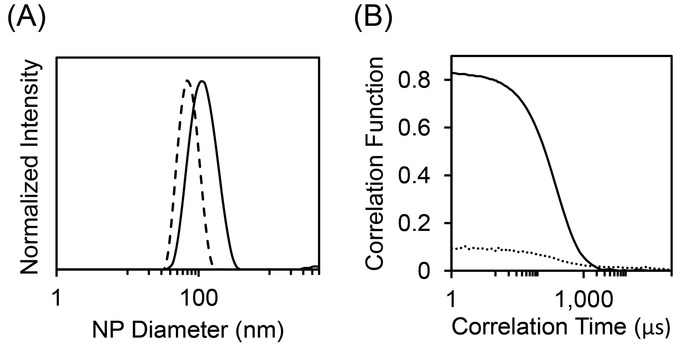
Figure 5 : caractérisation de NPs inversés dans un mélangeur de la CIJ ou μMIVM. (A), DLS courbes sont la moyenne des analyses en triple pour chaque formulation. La ligne pointillée indique la distribution granulométrique des particules de MD k 3 fait dans le mélangeur de la CIJ, tandis que la ligne continue est la distribution granulométrique des particules d’ovules dans le μMIVM. (B) la force de la réticulation peut être évaluée par DLS utilisant le DMSO comme le diluant. La fonction d’autocorrélation DLS indique la force de réticulation par le biais de la valeur initiale d’autocorrélation et l’observation d’une transition propre à une valeur de zéro. La ligne pointillée représente la fonction d’autocorrélation pour une particule avec aucun reticulation montrant un faible signal initial et un temps de décroissance large. La ligne continue représente l’autocorrélation après addition d’une forte reticulation (dans ce cas, tétraéthylènepentamine), qui montre un fort signal initial et une échelle de temps de désintégration définis. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
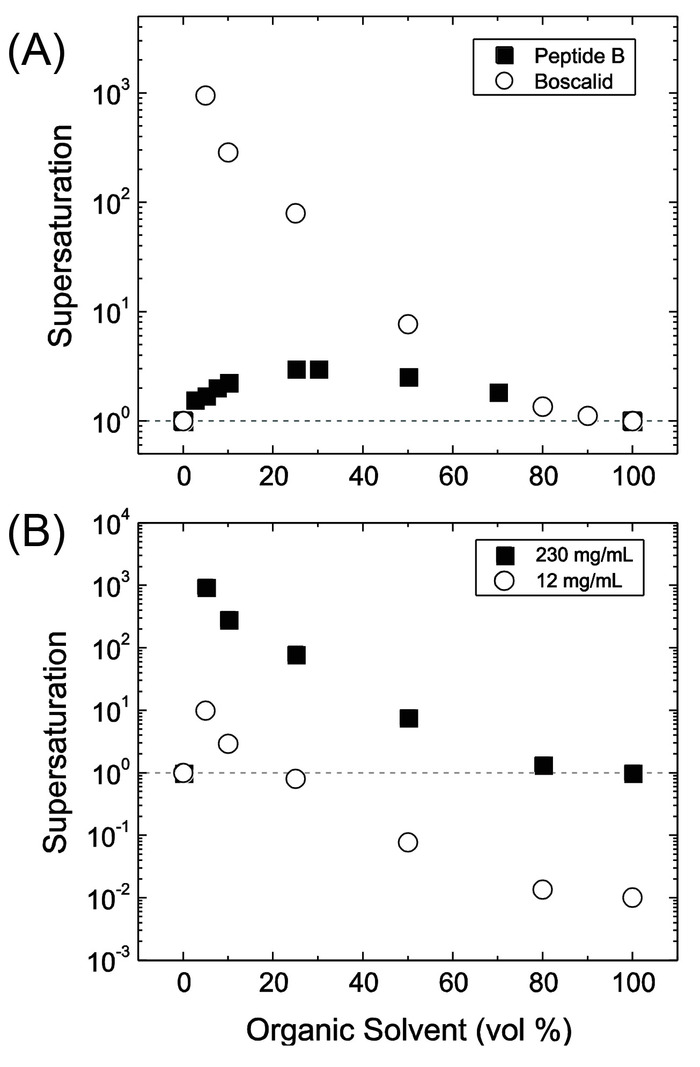
Figure 6 : sursaturation, S, en fonction des relatives rapports de mélange de solvants organiques dans l’eau. (A) comparaison du plus haute atteignable sursaturation pour (○) boscalid, un pesticide et (■) le peptide B, un peptide de sept résidus modèle. Le flux organique contient boscalid à une concentration de 230 mg/mL et le peptide B à 200 mg/mL, leur concentration de saturation. Il y a une sursaturation maximale qui dépend de chaque ingrédients pharmaceutiques actifs (API) / solvant système. (B) lorsque la concentration de boscalid dans le flux organique est diminuée de 20 fois, les conditions au cours de laquelle la sursaturation et nanoprécipitation sont atteints deviennent limitées. Ce chiffre est reproduit avec la permission de Elsevier9. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
L’encapsulation des composés hydrophobes tels que la vitamine E, comme dans l’étape 1 du protocole, a été largement décrit9,14,28. Relativement monodispersés particules sont produites parce que l’échelle de temps pour le mélange est plus courte que l’échelle de temps pour l’agrégation et la croissance des particules. Plus précisément, la mélange solvant/antisolvent de solution rapidement devient homogène, qui permet de nucléation se produire uniformément. Assemblée du copolymère bloc à la surface de la particule puis fournit la stabilisation stérique qui stoppe la croissance de particules5. Temps de mélange dans la chambre (turbulence) étant une fonction des débits d’entrée à la CIJ ou le MIVM, il y a un taux d’admission, qui se produit après le passage à un mélange turbulent, où la taille des particules est essentiellement constante13. Cela donne une robustesse supplémentaire au processus comme certains lot de variation dans le débit d’aspiration (c.-à-d., la vitesse de dépression seringue) pouvant être tolérée sans impact significatif de la taille finale du NP, comme on le voit dans la Figure 3. Vitesses d’aspiration plus lent ou irrégulier peuvent entraîner des particules plus grandes ou plus polydispersés distributions, comme on le voit par l’exemple de ratés. FNP a également été étendue pour encapsuler des composés hydrophiles de nanoparticules par inverse Nanoprécipitation Flash. Ces inversé des nanoparticules peuvent ensuite être utilisés pour créer des microparticules ou être recouvert de PEG pour créer des nanoparticules eau-dispersible25. Les principes sous-jacents de l’Assemblée restent les mêmes, bien qu’il y a la complexité supplémentaire de réticulation le noyau de la particule. Cela est nécessaire pour la stabilisation de la particule dans un milieu aqueux. En général, un rapport de 1:1 charge par rapport au bloc polyacide est suffisant, même si les interactions ioniques peuvent être promues par l’ajustement du pH par l’ajout d’une base de19. Dans ce protocole, que la première étape de processus de forme inversée NPs a été décrite.
En plus de mélange rapide, formulation réussie par les FNP ou iFNP est limitée aux cas où plusieurs conditions peuvent être remplies9,14. Tout d’abord, tous les flux entrées doivent être miscibles. Alors que les émulsions ont servi à produire le NPs, FNP demande une phase de solution uniforme dans le mélangeur. Deuxièmement, la composante de base doit être quasiment insoluble dans les conditions de solvants dans la table de mixage (par la CIJ, un mélange 50/50 par volume) pour piloter la nucléation rapide. Dans le cas contraire, une grande partie restera capsulée ou précipitera après dilution supplémentaire avec antisolvent. Le MIVM permettent à teneur plus élevée en antisolvent dans la chambre de mélange de répondre aux principales matières solubilité limites. Il est souvent utile générer des courbes de sursaturation de données de solubilité en fonction de la composition du solvant pour guider le processus de conception9. La figure 6 montre les courbes représentatives des deux composés. Sursaturation basses aux conditions chambre mélange mérite fonctionnant à des compositions différentes, généralement à l’aide de la MIVM. Sursaturation plus élevée favorise la nucléation de la composante de base sur la croissance des particules mais un décalage dans le temps de montage du matériel du noyau et le stabilisateur peut entraîner des grands agrégats de la thérapeutique. D'Addio et Prud'homme ont examiné l’application de ces courbes de sursaturation en détail9. Enfin, le BCP doit être dissous moléculairement dans le flux de solvant et le flux d’antisolvent doit être sélectif pour un pâté de maisons. Le BCP doit être suffisamment amphiphile pour fournir les deux un solvophobic moteur du bloc effondré pour ancrer le stabilisateur sur la surface de la particule et pour le bloc solvatés conférer une stabilité stérique de la particule. Solvants autres que celles décrites dans le protocole peuvent être utilisés pour autant qu’ils respectent ces contraintes.
Pratique fonctionnement manuel seringue peut améliorer le taux de réussite au cours de l’examen préalable. Tel que noté ci-dessus, opération au-dessus de la transition à des conditions de mélange homogènes et turbulentes signifie que de faibles variations de débit sont tolérées dans le processus de28. Intensification des résultats de flux axées sur la pompe, contrôlé par ordinateur des gains encore plus en cohérence en raison les débits d’entrée reproductible. A tout moment pendant le post-traitement des particules, examen visuel ou analyse des listes de distribution peut-être indiquer la présence de gros agrégats qui peuvent être dus à l’instabilité de poussières ou particules fortuite. Lorsque cela est nécessaire, le flux peut être filtré avec une taille de pore de filtre approprié. En l’absence d’agrégats, nous avons constaté que moins de 5 % masse disparaît généralement lorsque vous filtrez des nanoparticules PEG-enduit si la taille du filtre nominale est supérieure à la distribution granulométrique. Lorsque vous filtrez des agrégats, détermination expérimentale de la masse perdue au cours du processus est nécessaire. Quantification de la perte de masse est réalisable dans l’une des deux façons suivantes. La masse de solides totaux dans un volume donné peut être déterminée par analyse thermogravimétrique avant et après la filtration pour identifier l’ampleur du changement (voir Complément d’Information , article 2). Sinon, les particules peuvent être récupérées (par exemple, par lyophilisation) et dissous dans un solvant bon. La concentration du matériel du noyau peut ensuite directement mesurée par une technique appropriée telle que la spectrophotométrie UV-visible ou chromatographie en phase.
Pour les FNP, résiduel 10 vol % solvant organique (par exemple, THF) doit être enlevé de la dispersion aqueuse. Cela peut être fait par distillation par évaporation14,29, dialyse30ou tangentiels filtration31,32. Des considérations pratiques pour chaque étape de traitement sont décrites dans les citations fournies. Pour la dialyse, membranes typiques sont kDa 3,5 ou 6-8 kDa seuils, bien que les grandes options sont disponibles. Ce seuil de poids moléculaire est suffisante pour l’enlèvement de solvant lorsque dialysée pendant 24 h à l’aide de plusieurs changements de salle de bain. L’utilisation de filtration à flux tangentiel entraîne certains processus de développement qu’il faut pour éviter d’induire l’agrégation en raison de la polarisation de concentration à la surface de la membrane. Nous avons trouvé que réduire la composition du solvant organique au-dessous d’une valeur dépendant du système, généralement 2 à 10 % en volume, élimine l’agrégation à la surface de la membrane. Après le traitement, la concentration de nanoparticules est facilement déterminée par analyse thermogravimétrique (voir Complément d’Information , article 2). Il est souvent souhaitable de transporter ou de stocker des particules dans une forme très stable. Dispersions aqueuses peuvent simplement être congelées rapidement en utilisant un mélange de glace et d’acétone et puis stockées à-80 ° C. Alternativement, les poudres sèches peuvent être obtenus par lyophilisation33,34 ou pulvériser séchage24. Fréquemment, un cryoprotecteur doit être ajouté pour réduire l’agrégation de nanoparticules au cours de la congélation ou le séchage. Sucres (saccharose, tréhalose, etc.), poly(ethylene glycol) ou cyclodextrines peuvent projeté pour une efficacité sur une gamme de concentrations en contrôlant la taille par DLS35,36,37, 38. Des problèmes de stabilité NP communs au cours du traitement sont souvent associées à la séparation de phase ou la solubilité dans le noyau résultant dans le réarrangement vers un état d’énergie plus faible dans des conditions où la mobilité est augmentée. Utilisation de matériaux d’âme co, stabilisateurs alternatifs ou mis à jour le solution externe composition peut aider à améliorer la stabilité14,16,17,39,40, 41.
Tel que noté ci-dessus, le MIVM permet à teneur plus élevée en antisolvent dans la chambre de mélange lorsque requis atteint sursaturation haute. Il peut également permettre la séparation physique des espèces dans plus de deux cours d’eau lorsque les contraintes de réactivité ou de la solubilité dans l’exigent. Un exemple est la formation de nanoparticules de zein protéine-stabilisé de l' antibiotique clofazimine24. La clofazimine hydrophobe est introduit dans un flux de l’acétone ; Zein est introduit dans un flux aqueux solution éthanolique de 60 % ; caséine, quels complexes avec zein, est porté avec un flux de mémoire tampon aqueux, et le quatrième flux est un tampon supplémentaire pour augmenter le rapport de l’eau à l’acétone et l’éthanol. Deux flux de solvants sont tenus clofazimine et zein n’étant pas solubles dans un solvant. Ce processus ne pourrait être achevée dans une table de mixage deux jet CIJ. Cette formulation stabilisée protéine montre également que le PNF n’est pas limitée aux stabilisateurs BCP. Particules de Janus ont été produites sans stabilisateur42 et une gamme de stabilisateurs de faible coût ont été démontrés pour les demandes orales24. Notamment, copolymères tels que hydroxypropylméthylcellulose peuvent être utilisés en remplacement de copolymères bloc24. Matériaux d’âme peuvent faire plus hydrophobes par un certain nombre de techniques. Appariement d’ions hydrophobes a été appliqué pour encapsuler un large éventail de composés qui ont la solubilité intermédiaire43,44,45. Promédicaments extrêmement hydrophobes ont été générés et ensuite encapsulé46. Acides nucléiques ont été encapsulées par complexation avec les lipides cationiques47. Ce qui est important, ces études ont montré que les FNP peut produire une gamme des chimies surface de particules. Stabilisateurs en outre, mixtes, contenant une fraction de BCP qui a été modifié avec un ligand de ciblage sur l’extrémité de la chaîne ont été utilisés. Cela permet un contrôle précis sur le contenu du ligand sur la surface puisque la composition des particules reflète les flux d’entrée composition23,48. De même, il est possible d’insérer plusieurs éléments de base, y compris les colorants et les nanoparticules inorganiques3,8.
Nanoprécipitation flash est une approche évolutive aux nanoparticules polymériques, composés d’un noyau hydrophile ou un hydrophobe. Si les critères énumérés ci-dessus sont remplies, généralement plus 95 % du matériel du noyau se résume à une fraction massique élevée dans la particule. Les trois exemples présentés ici ont été réalisées à l’échelle de banc, nécessitant quelques milligrammes de matière et environ 0,5 mL dans chaque ruisseau tributaire. Cela permet un dépistage rapide des conditions de particules pour l’optimisation de la formulation. Intensification des formulations de plomb pour les grandes tailles de lot est une question de l’exécution du processus pendant plus longtemps, qui peut être facilement accompli par l’utilisation de pompes à seringue ou régulateurs de débit. En revanche, l’intensification des nanoprécipitation ajout en bloc fait face à des défis bien documentés dans le maintien de micromélange suffisant au moment de l’addition et de comptabilité pour effet de modifier la géométrie de navire49. Il s’agit d’un obstacle de taille, car il est crucial pour la fabrication de particules de façon cohérente pour répondre aux exigences de FDA50. Microfluidique techniques peuvent également produire des nanoparticules uniformes et reproductibles, mais seulement permettre la production de l’ordre du milligramme. Par exemple, Karnik et coll. ont signalé des taux de production de 0,25 mg/min pour une libération du médicament étudient51. Nouvelle intensification consiste généralement à parallélisation à12du coût en capital élevé. Avec le PNF, c’est simple obtenir 1 gramme de nanoparticules à 600 mg/min avec un pousse-seringue et quelques accessoires pour se connecter aux entrées du mitigeur. Par conséquent, FNP représente un outil de dépistage laboratoire accessible tant une approche évolutive pour production de NP pour travail translationnelle.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par un financement de Optimeos Sciences de la vie, la National Science Foundation (CBET 1605816), la Bill et Melinda Gates Foundation (Melinda Gates, OPP1150755) et la National Science Foundation recherche bourse d’études supérieures (DGE-1656466) attribué à K.D.R.
matériels
| Name | Company | Catalog Number | Comments |
| Confined Impinging Jets Mixer | NA | NA | See supplemental information for engineering drawings. Review text for new mixer validation |
| Luer fitting | Idex Health & Science | P-604 | Assemble on CIJ or MIVM mixer inlet with corresponding threads |
| Plug fitting | Idex Health & Science | P-309 | Assemble on CIJ mixer sides (seal access point from drilling) |
| Outlet fitting - CIJ | Idex Health & Science | P-205 | Assemble with ferrule and tubing on CIJ chamber outlet |
| Outlet ferrule - CIJ | Idex Health & Science | P-200 | Assemble with outlet fitting (large end flush with tubing) |
| Outlet tubing - CIJ | Idex Health & Science | 1517 | Use tubing cutter for clean ends. Ensure extra tubing doesn't protrodue into mixing chamber |
| Tetrahydrofuran (THF) | Fisher Scientific | T425-4 | Use stabilizer-free THF to avoid solubility limits of BHT. Peroxides may interfere in some applications. |
| Norm-ject syringe (3 ml) | VWR | 53548-017 | |
| Vitamin E (α-tocopherol) | Sigma-Aldrich | 90669-50G-F | Store cold |
| poly(styrene-b-ethylene glycol), PS1.6k-b-PEG5k | Polymer Source | P13141-SEO | Other block sizes acceptable depending on application |
| poly(styrene)1.8k | Polymer Source | P2275-S | Example hydrophobic core material |
| Scintillation vial | DWK Lifesciences | 74504-20 | |
| Luer-slip plastic syringes, 1ml (100 pk) | National | S7510-1 | |
| Maltodextrin DE 4-7 | Sigma-Aldrich | 419672-100G | |
| poly(styrene-b-acrylic acid), PS5k-b-PAA4.8k | Polymer Source | P5917-SAA | Other block sizes acceptable depending on application |
| Dimethyl Sulfoxide (DMSO) | Fisher Scientific | D159-4 | |
| Calcium chloride dihdyrate | Sigma-Aldrich | 223506-25G | Hygroscopic. |
| Methanol | Fisher Scientific | A452-4 | |
| Ammonium Hydroxide | Fisher Scientific | AC423300250 | |
| Albumin from chicken egg white (Ovalbumin, OVA) | Sigma-Aldrich | A5503-1G | |
| Multi-Inlet Vortex Mixer | NA | NA | See supplemental information for engineering drawings. Review text for new mixer validation |
| Outlet fitting - MIVM | Idex Health & Science | P-942 | Combination with ferrule |
| Outlet tubing - MIVM | NA | NA | Fit to ferrule ID. |
| O-ring (MIVM) | C.E. Conover | MM1.5 35.50 V75 | Order bulk - consumable part. Ensure solvent compatibility if using an alternative source. |
| Mixer stand | NA | NA | See Markwalter & Prud'homme for design.17 |
Références
- Bobo, D., Robinson, K. J., Islam, J., Thurecht, K. J., Corrie, S. R. Nanoparticle-Based Medicines: A Review of FDA-Approved Materials and Clinical Trials to Date. Pharmaceutical Research. 33 (10), 2373-2387 (2016).
- D'Mello, S. R., et al. The evolving landscape of drug products containing nanomaterials in the United States. Nature Nanotechnology. 12 (6), 523-529 (2017).
- Gindy, M. E., Prud'homme, R. K. Multifunctional nanoparticles for imaging, delivery and targeting in cancer therapy. Expert Opinion on Drug Delivery. 6 (8), 865-878 (2009).
- Chen, G., Roy, I., Yang, C., Prasad, P. N. Nanochemistry and Nanomedicine for Nanoparticle-based Diagnostics and Therapy. Chemical Reviews. 116 (5), 2826-2885 (2016).
- Johnson, B. K., Prud'homme, R. K. Mechanism for Rapid Self-Assembly of Block Copolymer Nanoparticles. Physical Review Letters. 91 (11), 118302-118302 (2003).
- Schubert, S., Delaney, J. J. T., Schubert, U. S. Nanoprecipitation and nanoformulation of polymers: from history to powerful possibilities beyond poly(lactic acid). Soft Matter. 7 (5), 1581-1588 (2011).
- Lebouille, J. G. J. L., Stepanyan, R., Slot, J. J. M., Cohen Stuart, M. A., Tuinier, R. Nanoprecipitation of polymers in a bad solvent. Colloids and Surfaces A: Physicochemical and Engineering Aspects. , 225-235 (2013).
- Akbulut, M., et al. Generic method of preparing multifunctional fluorescent nanoparticles using flash nanoPrecipitation. Advanced Functional Materials. 19 (5), 718-725 (2009).
- D'Addio, S. M., Prud'homme, R. K. Controlling drug nanoparticle formation by rapid precipitation. Advanced Drug Delivery Reviews. 63 (6), 417-426 (2011).
- Pagels, R. F., Edelstein, J., Tang, C., Prud'homme, R. K. Controlling and Predicting Nanoparticle Formation by Block Copolymer Directed Rapid Precipitations. Nano Letters. 18 (2), 1139-1144 (2018).
- Ding, S., Anton, N., Vandamme, T. F., Serra, C. A. Microfluidic nanoprecipitation systems for preparing pure drug or polymeric drug loaded nanoparticles: an overview. Expert Opinion on Drug Delivery. 13 (10), 1447-1460 (2016).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Johnson, B. K., Prud'homme, R. K. Chemical processing and micromixing in confined impinging jets. AIChE Journal. 49 (9), 2264-2282 (2003).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Han, J., et al. A simple confined impingement jets mixer for flash nanoprecipitation. Journal of Pharmaceutical Sciences. 101 (10), 4018-4023 (2012).
- Kumar, V., Wang, L., Riebe, M., Tung, H. H., Prud'homme, R. K. Formulation and stability of itraconazole and odanacatib nanoparticles: Governing physical parameters. Molecular Pharmaceutics. 6 (4), 1118-1124 (2009).
- Liu, Y., Kathan, K., Saad, W., Prud'homme, R. K. Ostwald Ripening of β -Carotene Nanoparticles. Physical Review Letters. 98 (3), 036102-036102 (2007).
- Liu, Y., Cheng, C., Liu, Y., Prud'homme, R. K., Fox, R. O. Mixing in a multi-inlet vortex mixer (MIVM) for flash nano-precipitation. Chemical Engineering Science. 63, 2829-2842 (2008).
- Pagels, R. F., Prud'homme, R. K. Polymeric nanoparticles and microparticles for the delivery of peptides, biologics, and soluble therapeutics. Journal of Controlled Release. 219, 519-535 (2015).
- Pagels, R. F., Prud'homme, R. K. Ch. 11. Control of Amphiphile Self-Assembling at the Molecular Level: Supra-Molecular Assemblies with Tuned Physicochemical Properties for Delivery Applications Vol. 1271 ACS Symposium Series. , 249-274 (2017).
- Markwalter, C. E., Prud'homme, R. K. Ch. 12. Control of Amphiphile Self-Assembling at the Molecular Level: Supra-Molecular Assemblies with Tuned Physicochemical Properties for Delivery Applications Vol. 1271 ACS Symposium Series. , 275-296 (2017).
- Markwalter, C. E., Prud'homme, R. K. Design of a Small-Scale Multi-Inlet Vortex Mixer for Scalable Nanoparticle Production and Application to the Encapsulation of Biologics by Inverse Flash NanoPrecipitation. Journal of Pharmaceutical Sciences. 107 (9), 2465-2471 (2018).
- Gindy, M. E., Ji, S., Hoye, T. R., Panagiotopoulos, A. Z., Prud'Homme, R. K. Preparation of poly(ethylene glycol) protected nanoparticles with variable bioconjugate ligand density. Biomacromolecules. 9 (10), 2705-2711 (2008).
- Zhang, Y., et al. Design and Solidification of Fast-Releasing Clofazimine Nanoparticles for Treatment of Cryptosporidiosis. Molecular Pharmaceutics. 14 (10), 3480-3488 (2017).
- Pagels, R. F. . Polymeric Nanoparticles and Microparticles for the Delivery of Hydrophobic and Hydrophilic Therapeutics. , (2018).
- Frisken, B. J. Revisiting the method of cumulants for the analysis of dynamic light-scattering data. Applied Optics. 40 (24), 4087-4091 (2001).
- Budijono, S. J., Russ, B., Saad, W., Adamson, D. H., Prud'homme, R. K. Block copolymer surface coverage on nanoparticles. Colloids and Surfaces A: Physicochemical and Engineering Aspects. 360 (1-3), 105-110 (2010).
- Johnson, B. K., Prud'homme, R. K. Flash NanoPrecipitation of Organic Actives and Block Copolymers using a Confined Impinging Jets Mixer. Australia Journal of Chemistry. 56, 1021-1024 (2003).
- Kumar, V., Prud'homme, R. K. Nanoparticle stability: Processing pathways for solvent removal. Chemical Engineering Science. 64 (6), 1358-1361 (2009).
- Shi, L., Shan, J., Ju, Y., Aikens, P., Prud'homme, R. K. Nanoparticles as delivery vehicles for sunscreen agents. Colloids and Surfaces A: Physicochemical and Engineering Aspects. , 122-129 (2012).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of Diafiltration and Tangential Flow Filtration for Purification of Nanoparticle Suspensions. Pharmaceutical Research. 22 (12), 2152-2162 (2005).
- Pansare, V. J., Tien, D., Thoniyot, P., Prud'homme, R. K. Ultrafiltration of nanoparticle colloids. Journal of Membrane Science. 538, 41-49 (2017).
- D'Addio, S. M., et al. Novel Method for Concentrating and Drying Polymeric Nanoparticles: Hydrogen Bonding Coacervate Precipitation. Molecular Pharmaceutics. 7 (2), 557-564 (2010).
- Abdelwahed, W., Degobert, G., Stainmesse, S., Fessi, H. Freeze-drying of nanoparticles: Formulation, process and storage considerations. Advanced Drug Delivery Reviews. 58 (15), 1688-1713 (2006).
- Correa, S., et al. Highly Scalable, Closed-Loop Synthesis of Drug-Loaded, Layer-by-Layer Nanoparticles. Advanced Functional Materials. 26 (7), 991-1003 (2016).
- Figueroa, C. . Engineering Nanoparticles for Pharmaceutical Applications: Formulation and Freeze-drying Techniques. , (2014).
- Harada, A., Li, J., Kamachi, M. Preparation and properties of inclusion complexes of polyethylene glycol with alpha-cyclodextrin. Macromolecules. 26 (21), 5698-5703 (1993).
- Troiano, G., Song, Y. -. H., Zale, S., Wright, J., Van Geen Hoven, C. Stable Formulations for Lyophilizing Therapeutic Particles. United States patent. , (2013).
- Kumar, V., Adamson, D. H., Prud'homme, R. K. Fluorescent polymeric nanoparticles: Aggregation and phase behavior of pyrene and amphotericin B molecules in nanoparticle cores. Small. 6 (24), 2907-2914 (2010).
- Budijono, S. J., et al. Synthesis of stable block-copolymer-protected NaYF4:Yb3+, Er3+up-converting phosphor nanoparticles. Chemistry of Materials. 22 (2), 311-318 (2010).
- Chen, T., et al. Protected peptide nanoparticles: Experiments and brownian dynamics simulations of the energetics of assembly. Nano Letters. 9 (6), 2218-2222 (2009).
- Sosa, C., et al. Soft Multifaced and Patchy Colloids by Constrained Volume Self-Assembly. Macromolecules. 49 (9), 3580-3585 (2016).
- Pinkerton, N. M., et al. Formation of stable nanocarriers by in situ ion pairing during block-copolymer-directed rapid precipitation. Molecular Pharmaceutics. 10 (1), 319-328 (2013).
- Lu, H. D., Rummaneethorn, P., Ristroph, K. D., Prud'homme, R. K. Hydrophobic Ion Pairing of Peptide Antibiotics for Processing into Controlled Release Nanocarrier Formulations. Molecular Pharmaceutics. 15 (1), 216-225 (2018).
- Lu, H. D., et al. Encapsulation of OZ439 into Nanoparticles for Supersaturated Drug Release in Oral Malaria Therapy. ACS Infectious Diseases. 4 (6), 970-979 (2018).
- Ansell, S. M., et al. Modulating the Therapeutic Activity of Nanoparticle Delivered Paclitaxel by Manipulating the Hydrophobicity of Prodrug Conjugates. Journal of Medicinal Chemistry. 51 (11), 3288-3296 (2008).
- Gindy, M. E., et al. Mechanism of macromolecular structure evolution in self-assembled lipid nanoparticles for siRNA delivery. Langmuir. 30 (16), 4613-4622 (2014).
- D'Addio, S. M., et al. Optimization of cell receptor-specific targeting through multivalent surface decoration of polymeric nanocarriers. Journal of Controlled Release. 168 (1), 41-49 (2013).
- . . Perry's Chemical Engineers' Handbook. , 19-20 (2007).
- Torrice, M. Does nanomedicine have a delivery problem?. ACS Central Science. 2 (7), 434-437 (2016).
- Karnik, R., et al. Microfluidic Platform for Controlled Synthesis of Polymeric Nanoparticles. Nano Letters. 8 (9), 2906-2912 (2008).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon