Method Article
Protocole et Guidelines for Point-of-Care poumon échographie dans le diagnostic des maladies pulmonaires néonatales basés sur un Consensus d’experts internationaux
Dans cet article
Résumé
L’échographie pulmonaire est un outil non invasif et précieux pour chevet évaluation des maladies pulmonaires néonatales. Cependant, un manque relatif d’étalons de référence, des protocoles et des directives peut limiter son application. Ici, nous visons à développer un protocole de diagnostic échographie pulmonaire néonatale normalisés à utiliser dans la prise de décisions clinique.
Résumé
L’échographie est un outil d’imagerie chevet sécuritaire qui permet d’éviter l’utilisation de procédures de diagnostic de rayonnements ionisants. En raison de sa commodité, l’échographie pulmonaire a reçu une attention croissante de médecins néonatales. Néanmoins, dégager des étalons de référence et limites de la directive sont nécessaires pour une application précise de cette modalité de diagnostique. Ce document a pour but de résumer les opinions d’experts et à fournir des conseils précis pour aider à faciliter l’utilisation de l’échographie pulmonaire dans le diagnostic des maladies pulmonaires néonatales.
Introduction
La radiographie pulmonaire (CXR) et/ou la tomodensitométrie thoracique (poitrine CT) sont les principaux outils d’imagerie dans le diagnostic des maladies pulmonaires. Pendant longtemps, l’échographie pulmonaire (UGB) était considéré comme une « zone interdite » dans le diagnostic des affections pulmonaires car les ondes ultrasoniques sont reflète totalement lorsqu’il rencontre l’air. Cependant, en utilisant des ultrasons artefacts formés par différents changements pathologiques chez les adultes, enfants et nouveau-nés1,2,3,4,5, cette « zone interdite » a été échographie pulmonaire attaquée et point-of-care (POC-UGB) a été utilisée avec succès pour le diagnostic des maladies pulmonaires. Certains auteurs ont recommandé POC-LUS comme une modalité privilégiée d’imagerie dans l’évaluation des maladies pulmonaires en raison de sa plus grande précision, la fiabilité, la facilité d’exécution et le manque de potentiels effets indésirables (par exemple, radiation)5,6 , 7. dans certaines unités de soins intensifs néonatales (UNSI), POC-UGB a remplacé CXR et devenir l’approche de la première ligne utilisée pour le diagnostic et diagnostic différentiel des différentes pulmonaire néonatale maladies5,6, 7 , 8 , 9.
Néanmoins, l’utilisation de POC-UGB reste limitée en raison de l’absence de protocoles, normes diagnostiques et des directives de fonctionnement. Pour promouvoir l’utilisation appropriée de POC-LUS dans le domaine néonatal, la Division de périnatologie de la société de pédiatrie chinoise et la Division de néonatale Ultrasound Society de l’Association chinoise de néonatologiste en association avec le collège de chinois de Critique par ultrasons ont organisé un groupe d’experts internationaux pour examiner les dernières publications sur UGB néonatale. Le panneau a résumé ces expert-avis et mis au point le présent LUS protocoles et les lignes directrices pour son utilisation. L’objectif principal est de populariser l’application de POC-LUS en UNSI est réduire le nombre de CXR et évitant ainsi les effets nocifs potentiels induits par la radiation. Comme une technique d’imagerie en temps réel, l’UGB est facile à utiliser, facile à apprendre et facile à reproduire avec une formation appropriée.
Les patients et le calendrier de l’examen de l’UGB
Les indications de l’examen initial de POC-LUS comprennent : (i) un nouveau-né admis pour suspicion (ii) prénatale de détresse respiratoire de lésions pulmonaires et (iii) un nouveau-né avec une soudaine détérioration de l’état respiratoire.
Les indications d’un examen suivi de POC-LUS comprennent : (i) contribuer à orienter l’assistance respiratoire (dans des mains expérimentées, assisté par échographie le sevrage de la ventilation mécanique peut considérablement réduire la durée de la ventilation mécanique et réduit échec de l’extubation.) ; (ii) aider à guider les changements dans le niveau d’assistance respiratoire après l’accouchement agent tensio-actif, ainsi que pour déterminer la nécessité d’un traitement de surfactant répéter ; (iii) suivi de l’évolution d’une maladie respiratoire lorsque nécessaire ; (iv) après les changements dans le volume pulmonaire ou le degré d’atélectasie dans la période de lavage bronchoalvéolaire-post (c'est-à-dire, pour les enfants avec le syndrome d’inhalation méconiale, pneumonie sévère ou atélectasie) ainsi que pour améliorer la visualisation de la thérapeutique effets de la ponction pleurale (pneumothorax ou un épanchement pleural)10,11.
Terminologie de l’échographie pulmonaire
Ligne pleural et pulmonaires coulissant 12 , 13: une ligne pleurale est un reflet de hyperechogene formé par la différence d’impédance acoustique entre l’interface surface pleurale-lung. Il apparaît comme une ligne lisse, régulière et relativement rectiligne hyperéchogènes (la Figure 1). Flou, irrégularités, interruption de la continuité ou l’absence de la ligne pleurale indique des anomalies. Une échographie en temps réel, la ligne pleurale se déplace dans un à - et bof-pattern, synchronisé avec le mouvement respiratoire. Ce genre de mouvement est appelé poumon coulissant (vidéo 1). L’absence du poumon coulissant est toujours pathologique.
A-line 12 , 13: un trapèze est un type d’artefact de réverbération causée par des réflexions multiples de la plèvre, lorsque la sonde est perpendiculaire aux côtes pour la numérisation. A-lignées sont situés au-dessous de la ligne pleurale et présentent comme une série de lignes parallèles hyperéchogènes lisse, claire, régulière et équidistants. Les échos de l’A-lines diminuent peu à peu comme ils se déplacent plus profondément dans le champ du poumon où ils disparaissent au bout du compte (la Figure 2).
B-line, ligne B confluente et syndrome alvéolo-interstitielles 13 , 14 , 15: basé sur la littérature actuelle et notre expérience clinique dans le domaine des maladies pulmonaires néonatales, nous avons défini ces termes comme suit : une seule ligne-B est un type de réflexion hyperéchogènes linéaires d’un artefact causé par une vague d’échographie rencontrant l’interface liquide-gaz alvéolaire. B-lignes proviennent et sont à peu près verticales de la ligne pleurale. Ils se propager vers le bas jusqu’au bord de l’écran sans décoloration et se déplacent en synchronie avec poumon coulissant. B-ligne confluente est défini comme tout l’espace intercostal rempli de B-lines (fusion de B-line, reflétant B-lignes qui sont difficiles à distinguer et de compter) entre deux ombres acoustiques des nervures. Syndrome alvéolo-interstitielles (AIS) est défini comme des espaces intercostaux séquentielles deux ou plusieurs B-lignes confluentes dans toute zone de lecture optique (Supplemental Figure 3).
B-lignes compactes et poumon blanc 15 , 16: lorsque la sonde est utilisée pour balayer perpendiculairement aux nervures, la présence de B-lignes concentrées peut provoquer l’ombre acoustique des côtes à disparaître au sein de toute la zone de numérisation. Ce type de la ligne B est appelé une B-série compact-line. Un poumon blanc est présent lors de chaque zone de balayage des deux côtés du poumon présente comme compact B-lines. B-lignes compactes et un poumon blanc sont des manifestations d’un oedème pulmonaire sévère (Supplemental Figure 4).
Consolidation de poumon et shred signe 17 , 18: sur UGB, champs pulmonaires peuvent avoir une densité de tissu (tissu pulmonaire « hepatization »), qui représente habituellement la consolidation pulmonaire. Consolidation de poumon peut être accompagnée d’air bronchogrammes, fluide aériques ou aériques air dynamique même dans les cas les plus graves (Video 2). Lorsque la frontière entre le tissu de poumon consolidé et le tissu pulmonaire aéré n’est pas claire, les signes d’ultrasons hyperéchogènes formés entre les deux zones sont appelés signes shred (Supplemental Figure 5).
Pouls du poumon 19: si la consolidation pulmonaire est suffisamment grande et près des bords du coeur, le poumon consolidé peut sembler être palpitante synchronisé avec le rythme cardiaque quand observée par échographie en temps réel. Ce signe s’appelle le pouls du poumon (vidéo 3).
Point de poumon 13 , 18 , 20: sous échographie en temps réel, l’apparence d’un espace alternatif où le poumon coulissant est présent et puis absente est appelé un point de poumon. Le point du poumon est un signe spécifique d’un pneumothorax et peut localiser avec précision la position de la limite de gaz quand un pneumothorax de légère à modérée est présent (Supplemental Figure 6).
Poumon double point 21: en raison des différences dans la sévérité et/ou la nature des lésions dans différent domaine des poumons, une nette différence entre les champs pulmonaires supérieures et inférieures a pu être trouvée avec les scans perpendiculaires, qui constitue un seuil sharp point entre le champ de poumon supérieur et inférieur un point double (Supplemental Figure 7).
Sandy beach et signe de la stratosphère 20 , 21 , 22: sous échographie mode M, une série de lignes ondulées echo au-dessus de la ligne pleurale et de l’écho uniforme granulaire dot (généré par le glissement de poumon) au-dessous de la ligne pleurale peut forment ensemble un signe comme plage connu comme une plage de sable fin ou signe de bord de mer. Lorsque le poumon glissant disparaît, les échos dot granulaire sont remplacés par une série de lignes parallèles horizontales. Ce genre de signe par ultrasons est connu comme une stratosphère ou signe de codes à barres (Supplemental Figure 8).
Protocole
Ce travail a été approuvé par le Comité d’éthique de recherche de Pékin Chaoyang District Commission of Science & Technology et le Comité d’éthique du District de Chaoyang Beijing maternelle et enfant Healthcare Hospital, et que le protocole établi conformément aux directives du comité d’éthique de la recherche humaine de l’hôpital.
1. préparation à l’examen par ultrasons
- Sélection de sonde
- Sélectionnez une sonde linéaire de haute fréquence (≥9.0 MHz) pour les POC-LUS assurer haute résolution.
Remarque : Une sonde linéaire de la fréquence plus élevée est utilisée pour assurer une résolution plus élevée. Pour les bébés qui ont un âge gestationnel inférieur ou de faible poids de naissance, une sonde de fréquence plus élevée est requise. Lorsque la pénétration n’est pas assez, diminuer la fréquence ou mettre en place une sonde de doublure de fréquence inférieure. Si aucune sonde linéaire approprié n’est disponible, pensez à utiliser une sonde convexe de haute fréquence (≥8.0 MHz).
- Sélectionnez une sonde linéaire de haute fréquence (≥9.0 MHz) pour les POC-LUS assurer haute résolution.
- Désinfection de la sonde
- Désinfecter la sonde avant et après l’examen de patients afin d’éviter les infections nosocomiales et des contaminations croisées.
NOTE : Le plus simple, plus pratique et efficace de désinfection méthode sont l’utilisation des lingettes de désinfection particulière. Alternativement, gants poudres ou sonde couvre également envisageable.
- Désinfecter la sonde avant et après l’examen de patients afin d’éviter les infections nosocomiales et des contaminations croisées.
- Préréglage sélection
- Choisissez une préconfiguration de l’UGB.
- Optimiser l’image de poumon de numérisation s’il n’y a aucun UGB préréglé.
- Sélectionnez un des préréglages de Petites pièces .
- Modifier les paramètres pour effectuer le balayage de poumon. Réglez le bouton de profondeur pour faire 4-5 cm.
- Appuyez sur le bouton de la Zone de mise au point d’avoir 1-2 se concentre et ajuster la position de foyer près du niveau de la ligne pleurale. Allumez le bouton SRI (réduction de Speckle Imaging) et sélectionnez niveau 2-3 pour réduire le bruit speckle.
- Activer les CRI (traverse) et sélectionnez niveau 2 afin d’améliorer la résolution de contraste. Activer les harmoniques pour améliorer le rapport signal-bruit ou d’utiliser la fréquence fondamentale de la plus nette A-lines ou B-lignes.
- Application de gel d’échographie
- Le gel d’échauffement.
- Appliquer une couche de gel sur le transducteur. Assurez-vous d’éviter les bulles d’air entre le transducteur et la surface de la peau.
2. positionnement infantile
- Maintenir l’enfant dans un état de calme.
- Emmailloter bébé exposer uniquement la zone à examiner.
- Placer le bébé dans la position couchée, sujette ou position latérale avant et pendant le processus d’examen.
Remarque : en général, nous ne recommandons pas l’utilisation de sédatifs tandis que l’utilisation de la sucette est encouragée. Positionnement en décubitus dorsal est pratique pour la numérisation de la poitrine antérieure et latérale. Positionnement enclin ou latérale est pratique pour la numérisation de l’arrière et le coffre latéral.
3. poumon partitionnement
- Méthode 6-région
- Diviser chaque poumon en trois zones : zone pulmonaire antérieure, latérale et postérieure. Pour ce faire, utilisez la ligne axillaire antérieure et la ligne axillaire postérieure comme limites. Diviser les deux poumons en un total de six régions.
- Méthode de douze-région
- À l’aide de la ligne qui relie les mamelons, diviser chaque poumon en champs pulmonaires supérieures et inférieures, soit un total de 12 régions sur les deux côtés des poumons.
NOTE : Analyser soigneusement les champs de l’ensemble du poumon. Chacun des domaines de 6 ou 12 devrait être analysé séparément pour assurer une couverture complète et pour réduire le risque de rater les lésions pulmonaires existant.
- À l’aide de la ligne qui relie les mamelons, diviser chaque poumon en champs pulmonaires supérieures et inférieures, soit un total de 12 régions sur les deux côtés des poumons.
4. sélection du mode de balayage
- Échographie mode B
- Appuyez sur le bouton 2D sur l’interface utilisateur pour lancer la numérisation mode B.
NOTE : B-mode de balayage est le plus important et le mode plus couramment utilisé dans l’obtention d’images de l’UGB. La majorité des maladies pulmonaires peut être diagnostiquée à B-mode de balayage.
- Appuyez sur le bouton 2D sur l’interface utilisateur pour lancer la numérisation mode B.
- M-mode ultrasons
- Appuyez sur la touche M sur l’interface utilisateur pour lancer le M mode balayage si nécessaire.
Remarque : Mode M l’échographie est utile pour une confirmation supplémentaire de la possibilité d’un pneumothorax.
- Appuyez sur la touche M sur l’interface utilisateur pour lancer le M mode balayage si nécessaire.
- Échographie Doppler couleur ou énergie
- Appuyez sur la touche C ou PD sur l’interface utilisateur de commencer l’examen Doppler couleur ou puissance si nécessaire.
Remarque : L’échographie Doppler est utilisé occasionnellement pour évaluer le débit sanguin dans les grandes surface de consolidations de poumon ou de distinguer les bronches des vaisseaux sanguins.
- Appuyez sur la touche C ou PD sur l’interface utilisateur de commencer l’examen Doppler couleur ou puissance si nécessaire.
5. méthodes d’analyse
- Perpendiculaire à balayage
- Placez le capteur perpendiculairement aux nervures et déplacez le curseur de la ligne médiane vers le côté latéral sur l’axe large pour effectuer le balayage perpendiculaire.
- Après que la zone initiale du poumon est scanné, le transducteur de jusqu'à descendre et balayer les zones restantes jusqu'à ce que tous les champs pulmonaires sont examinés.
Remarque : La numérisation perpendiculaire est la méthode de balayage plus importante. Maintenir le transducteur perpendiculaire aux côtes est la clé pour obtenir des résultats précis et fiables.
- Balayage parallèle
- Faire pivoter le transducteur 90° après avoir terminé la numérisation perpendiculaire. Gardez le transducteur parallèles aux nervures et faites-le glisser le long de l’axe étroit pour réaliser l’analyse parallèle.
- Après que la zone initiale du poumon est scannée, abaisser le transducteur de jusqu'à à numériser les zones restantes jusqu'à ce que tous les champs pulmonaires sont examinés.
- Transdiaphragmatic balayage
- Placer la sonde sous la xiphoïde et le capteur d’angle du côté à côté de scanner le diaphragme et le bas des poumons par le foie, comme la fenêtre acoustique.
NOTE : Augmenter la profondeur et allumez virtuel analyse convexe pour élargir la zone loin champ si nécessaire.
- Placer la sonde sous la xiphoïde et le capteur d’angle du côté à côté de scanner le diaphragme et le bas des poumons par le foie, comme la fenêtre acoustique.
Résultats
L’objectif principal du présent protocole et de la ligne directrice est d’instruire les utilisateurs sur comment utiliser LUS de diagnostiquer et de différencier des maladies pulmonaires néonatales courantes. Il s’agit d’un syndrome de détresse respiratoire (SDR), tachypnée transitoire du nouveau-né (TTN), pneumonie, syndrome d’aspiration méconiale (Sam), hémorragie pulmonaire, atélectasie pulmonaire et un pneumothorax, etc.. Ainsi, les caractéristiques normales d’UGB néonatales et les critères diagnostiques de l’UGB de maladies pulmonaires différentes sont décrites en détail.
Échographie normale pulmonaire néonatale
Le champ de néonatale pulmonaires normales apparaît hypoéchogènes sur une échographie mode B. Pleurales lignes et A-lines sont lisses, réguliers et droites. Tel que mentionné précédemment, A-lines sont hyperéchogènes, disposées en parallèle et équidistant d’un l’autre, qui forment ensemble une sorte de bambou-comme l’aspect connu comme le signe du bambou. A-line échos diminuent progressivement jusqu'à ce qu’ils disparaissent de la faible profondeur de la partie profonde des champs pulmonaires. Pas n’importe quel B-lines (trois à sept jours après la naissance) ou peut-être quelques B-lignes (dans les trois à sept jours après la naissance) dans les champs pulmonaires. Cependant, il n’y a pas de AIS, un épanchement pleural ou consolidation de poumon. Poumon coulissant est détectable par échographie en temps réel, alors qu’en M-mode d’imagerie, un dessin linéaire apparaît dans les tissus superficiels de la ligne pleurale, et une configuration granuleuse ou sable apparaît au-dessous de la ligne pleurale, créant le signe de la mer (Figure 1),23 ,,24.
Caractéristiques de l’UGB et critères de Diagnostic pour les maladies pulmonaires le chez le nouveau-né
Syndrome de détresse respiratoire (SDR) du nouveau-né
RDS se réfère à une maladie pulmonaire, où les principales manifestations cliniques sont tachypnée, rétractions, grognant et cyanose. Il présente dès la naissance. RDS est due à un déficit primaire ou secondaire du surfactant pulmonaire chez les nouveau-nés prématurés et à terme, respectivement. Absence de surfactant provoque le développement d’atélectasie pulmonaire et pulmonaire faible volumes25,26,27. Actuellement, le diagnostic de RDS est basé sur l’histoire, les manifestations cliniques et les résultats de la radiographie pulmonaire. Cependant, RDS peut également être diagnostiqué facilement et précisément par UGB. Une méta-analyse incluant 673 nouveau-nés avec RDS a montré que la sensibilité et la spécificité d’UGB dans le diagnostic des RDS était à 99 % et 96 %, respectivement28.
Diagnostic LUS de RDS est basé sur le suivant conclusions16,28,29,30,31,32,33,34. (i) consolidations de poumon accompagnées d’air-aériques sont la plus importante manifestation de LUS de RDS, qui se caractérise par ce qui suit : (a) Consolidations sont plus souvent observés dans les parties postérieures des poumons. Le degré de consolidation est lié à la sévérité de la maladie. (b) les consolidations sont limite uniquement à la région sous la plèvre chez RDS doux. À l’inverse, les zones de regroupement peuvent s’étendre à des parties plus profondes des champs pulmonaires dans RDS plus sévère. (c), consolidations sont généralement visibles dans les champs pulmonaires différents bilatéralement. Néanmoins, ils peuvent être limités à certains espaces intercostaux sur un côté du poumon. Les zones consolidées montrent une qualité inégale hypoéchogènes et la limite avec le tissu de poumon environnant est clair et facile à distinguer. d air-aériques montrent des formes denses, mouchetés ou de flocon de neige. (ii) la ligne pleurale est anormale, et l’A-lines disparaissent. (iii) les zones non consolidée peuvent apparaître comme AIS. (iv) 15 à 20 % des patients peuvent avoir différents degrés d’épanchement pleural unilatéral ou bilatéral.
En outre, les changements d’état pulmonaire peuvent être efficacement suivis par UGB. Améliorations dans les résultats de l’UGB sont souvent d’abord observées dans les zones pulmonaires antérieur parce que ces zones sont non-dépendants et mieux ventilé. Transition de consolidation à l’émission induite par l’agrégation (AIE), AIE d’oedème interstitiel (IE), et IE sur un normal modèle UGB ou vice versa sont visibles. Cette qualité d’UGB permet pour l’estimation de l’effet de la thérapie de remplacement de surfactant (Figure 2).
Tachypnée transitoire du nouveau-né (TTN)
TTN est également connu sous le nom « poumon humide » du nouveau-né. C’est une des maladies respiratoires plus fréquentes chez le nouveau-né. TTN est spontanément résolutive avec la plupart des patients récupérant en 24-72 heures sans aucune intervention particulière. Rarement, elle peut conduire à une détresse respiratoire sévère, hypoxémie, pneumothorax ou même la mort de35,36. TTN est souvent sous-diagnostiquée, surtout chez les enfants prématurés. Il a été signalé que 62 à 77 % des bébés qui ont été diagnostiqués cliniquement avec RDS a effectivement eu TTN selon les critères diagnostiques traditionnels36,37. UGB peut éliminer ces mauvais car TTN peut être facilement différencié de RDS et autres maladies pulmonaires par UGB.
La principale caractéristique du TTN est œdème pulmonaire sans consolidations de poumon, et il est diagnostiquée basée sur le suivant résultats21,30,31,38,39. i nit doux se manifeste principalement par AIS et un point double poumon. TTN grave dans la période aiguë se manifeste essentiellement comme une B-série compact-line, poumon blanc ou AIS sévères, alors qu’un point double pulmonaires peut-être apparaître avec récupération de la maladie. (ii) TTN légère ou sévère se caractérise par des anomalies de la ligne pleurale, disparition a-line et différents degrés d’un épanchement pleural dans l’un ou le côté bilatéral de poitrine. (iii) aucune consolidation n’est observée dans les champs pulmonaires (Figure 3).
P neumonia du nouveau-né
La pneumonie se réfère à l’inflammation du parenchyme pulmonaire, notamment en ouvrant le terminal airway, alvéolaire et zones interstitielles pulmonaires. Elle est causée par des micro-organismes infectieux ou des facteurs physiques ou chimiques. Pathologiquement, oedème, hyperémie et alvéolaires exudats inflammatoires sont présents. En cas de nécrose de cellules de l’épithélium bronchiolaire, des débris cellulaires et mucus dans la lumière peuvent causer une atélectasie et piégeage aérien régional. La pneumonie est responsable de plus de 1/3 de tous les nouveau-nés hospitalisations et comptes de pneumonie infectieuse pour plus de 1/4 de tous les décès néonatals surtout dans les pays en développement monde40,41. Une méta-analyse a montré une sensibilité supérieure à 96 % et une spécificité supérieure à 93 % lors de l’UGB est utilisé pour diagnostiquer une pneumonie tant chez les adultes et les enfants42,43.
Caractéristiques d’imagerie LUS de pneumonie incluent les suivants43,44,45,46,47,48. (i) consolidations de poumon accompagnées d’air-aériques ou fluide-aériques ; Consolidations de poumon sont la principale caractéristique de l’imagerie par ultrasons de pneumonie, qui sont caractérisés par ce qui suit : (a) la taille de la consolidation dans la pneumonie sévère est généralement grande avec limites irrégulières ou en escalier. Le signe de l’ombre est visible sur les bords des zones consolidées et les dynamique-aériques sont souvent visibles chez les patients sévères. (b) consolidations peuvent se trouve à une ou plusieurs positions dans les champs pulmonaires et domaines consolidées peuvent différer en taille et en forme dans les champs pulmonaires différents. (ii) la ligne pleurale est anormale et A-lignées disparaissent. (iii) B-lines ou AIS sont visibles dans les zones non consolidés. (iv) différents degrés d’épanchement pleural unilatéral ou bilatéral sont visibles chez certains nourrissons. (v) les principales manifestations de la pneumonie légère ou précoce peuvent être présentées comme sous-pleurales petite focale consolidations et AIS (Figure 4).
Syndrome d’aspiration méconiale (MAS) du nouveau-né
MAS est due à l’hypoxie foetale conduisant à la défécation et l’inhalation de méconiale du liquide amniotique par l’enfant avant ou pendant le processus de livraison. Méconium particules causent une obstruction mécanique des bronchioles terminales et des alvéoles ainsi que l’inflammation chimique et carence en surfactant secondaire. Ces changements plus conduisent à air-piégeage, atélectasie et oedème pulmonaire alvéolaire ou interstitiel. Les nourrissons atteints de grave MAS présentent souvent des signes de détresse respiratoire sévère, y compris une cyanose, tachypnée, nasale torchage et rétractations et grognements dans les heures suivant la naissance. MAS est une comptabilité de maladies pulmonaires graves pour environ 10 % des cas d’insuffisance respiratoire néonatale. Parmi ces patients, 10 à 20 % connaîtront un pneumothorax et la mortalité peut être aussi élevée que 39 % dans le développement et récemment industrialisés pays49,50.
Les bases pour le diagnostic de l’UGB de MAS Voici51,52,53: consolidations (i) poumon accompagnées d’air-aériques sont le sonogramme plus importante caractéristique du MAS. Le périmètre de consolidation est relié au degré de la maladie. Les bords de la zone de consolidation sont irréguliers ou en escalier et le signe de l’ombre est visible. Les degrés de consolidation peuvent différer entre les deux parties du poumon. De même, différentes tailles de consolidation peuvent être présents sur le même côté du poumon. (ii) la ligne pleurale est anormale, et disparaît de la ligne a. (iii) les B-lignes ou AIS sont visibles dans la zone non consolidée. (iv) certains patients peuvent avoir différents degrés d’épanchement pleural unilatéral ou bilatéral. Il est difficile de différencier les MAS et pneumonie uniquement basé sur les manifestations de l’échographie. Par conséquent, pour obtenir un diagnostic définitif il est souvent nécessaire de combiner les résultats de l’échographie avec histoire périnatale, l’examen physique et des examens de laboratoire (Figure 5).
Hémorragie pulmonaire du nouveau-né (PHN)
PHN n’est pas une maladie des poumons indépendant. En général, c’est une complication tardive d’autres maladies, son apparition est soudaine et l’enfant détériore rapidement causant PHN avoir un taux élevé de mortalité. Pathologiquement, NPZ peuvent présenter comme une hémorragie focale, régionale ou diffuse, généralement avec des dommages structuraux alvéolaire. La zone interstitielle du poumon peut également être affectée. PHN se produit souvent dans les premiers jours après la naissance avec près de 90 % de NPH qui se produisent au sein de la première semaine de vie54,,55.
Les principales caractéristiques de l’UGB dans PHN Voici56,57: (i) le moindre signe est le plus commun et le plus important signe LUS de NPH. (ii) le degré de consolidations de poumon accompagné d’air-aériques sont étroitement liées à la gravité des maladies primaires. (iii) plus de 80 % des patients ont des degrés différents d’épanchement pleural unilatéral ou bilatéral. Ponction pleurale confirme généralement que l’épanchement est le saignement. Dans les cas graves, fibreux, cordlike, objets flottants formés par la dégénérescence de fibrine sont visibles au sein de l’épanchement. Ces objets peuvent être vu, flottant dans l’effusion avec mouvement respiratoire par échographie en temps réel. (iv) divers signes comprennent des anomalies de la ligne pleurale, a-line disparition et AIS (Figure 6).
Atélectasie pulmonaire du nouveau-né
Aération inadéquate résultant de l’effondrement du tissu pulmonaire auparavant élargi est définie comme une atélectasie49,50. Atélectasie peut être divisée en atélectasie obstructive et compression basée sur la physiopathologie. Il peut aussi être divisé en atélectasie complète et incomplète atélectasie selon le degré d’atélectasie. Il est non seulement une maladie indépendante, mais plutôt une complication fréquente de plusieurs maladies. Atélectasie est une cause fréquente de détresse respiratoire néonatale et contribue souvent à une maladie prolongée ou difficultés de sevrage de l’assistance ventilatoire. Bon diagnostic et le traitement approprié à amélioration des résultats58,59. UGB a une grande valeur diagnostique dans les cas d’atélectasie pulmonaire.
Caractéristiques incluent des UGB60,,du6162: (i) la consolidation pulmonaire accompagnée d’air bronchogrammes, ou même dynamique aériques ou air parallèle aériques sont visibles dans les cas graves. (ii) les bords de la zone de consolidation sont relativement claires et régulières en grave grande surface atélectasie pulmonaire. Si l’atélectasie est limitée à une petite région, les bords de la zone de consolidation n’est peut-être pas évidents. (iii) la ligne pleurale dans le domaine de la consolidation est anormale et A-lignées disparaissent. (iv) dans les premiers stades de l’atélectasie sévère ou grande surface, le pouls du poumon peut être visible, tandis que le poumon glissant disparaît souvent sous échographie en temps réel. (v) le débit sanguin pulmonaire peut être visible dans les zones consolidées par couleur ou puissance échographie Doppler. Si une atélectasie persiste (les étapes finales de l’atélectasie), tant le bronchogrammes dynamique et la circulation sanguine vont disparaître (Figure 7, Figure 8, 4 vidéo, la vidéo 1, 2 vidéo supplémentaire).
Pneumothorax du nouveau-né
Une accumulation anormale d’air dans la cavité pleurale est définie comme un pneumothorax. C’est une maladie néonatale relativement commune mais critique associée à taux élevé de morbidité et de mortalité, surtout chez les nouveau-nés prématurés63,,64. Échographie le diagnostic d’un pneumothorax est très sensible et spécifique. Meta-analyse et prospectives études contrôlées ont montré que LUS est plus précis que la radiographie pulmonaire pour la détection de pneumothorax66,67.
Un pneumothorax est diagnostiqué basée sur les suivants LUS signes20,65,66,67,68: (i) la disparition du poumon coulissant est le signe plus important dans le diagnostic par ultrasons du pneumothorax. Si le poumon coulissant est présent, un pneumothorax peut essentiellement être exclu. (ii) il n’y a aucun signe de queue B-line ou comète, si présent pneumothorax peut également être exclu. (iii) la présence manifeste du point du poumon est un signe spécifique pour le diagnostic par ultrasons de pneumothorax légère à modérée. Toutefois, rien ne sert du poumon dans un pneumothorax sévère. La spécificité du poumon point pour diagnostiquer un pneumothorax est 100 % tandis que la sensibilité d’environ 70 % ou plus de21. (iv) la ligne pleurale et A-lines sont présents. Un pneumothorax peut être exclu si ces lignes disparaissent. (v) sur M-mode d’imagerie de la plage de sable, signes sont remplacés par les signes de la stratosphère (Figure 9, Figure 10, vidéo, 5, 6 de vidéo).
Pour les débutants, les étapes suivantes peuvent être prises si doute clinique. (i) tout d’abord, observez la ligne pleurale et la ligne a : s’ils sont absents, le pneumothorax peut être exclu. (ii) si la ligne pleurale et A-lines sont présent (ce qui est apparence pulmonaires normales sous échographie mode B), observer les poumon glissant sous échographie en temps réel. Si elle est présente, un pneumothorax peut être exclu. (iii) si le poumon glissant disparaît, observer le signe de queue B-line ou comète. Si un est présent, un pneumothorax peut être exclu. (iv) si le poumon glissant disparaît et il n’y a aucune ligne B, observer le poumon point. Si elle est présente, puis un pneumothorax légère à modérée est essentiellement confirmé. Si elle est absente, puis un pneumothorax grave est survenu. (v) sur l’imagerie en mode M, si le signe de la plage est remplacé par un signe de la stratosphère, l’existence d’un pneumothorax est confirmée. La procédure de diagnostic de pneumothorax est illustrée à la Figure 11.
Œdème pulmonaire en cas d’insuffisance cardiaque
Causes de l’oedème pulmonaire chez les nouveau-nés sont similaires à celles de la population adulte. Outre les nouveaux-nés avec une cardiopathie congénitale ou d’insuffisance cardiaque, de nombreux nouveau-nés prématurés présentant une dysplasie bronchopulmonaire (DBP) peut montrer des signes qui sont compatibles avec un oedème pulmonaire69,70. Occasionnellement, LUS montre une augmentation bilatérales B-lines ou liquide interstitiel avant même que la radiographie pulmonaire. Ce modèle peut améliorer cardiaque traitement médical ou chirurgical.
Examiner la position et la pose correcte des ETT
Dans les populations pédiatriques et néonatales, des études ont montré que POC-États-Unis est un outil possible qui a été utilisé en clinique pour vérifier les placement correct tube endotrachéal (ETT) et une pointe ETT acceptable du poste71,72, 73,,du7475. Un placement correct ETT inclut l’intubation trachéale et une position de pointe ETT acceptable. Visualisation de la pointe de l’ETT à une distance variant de 0,5 à 1,0 cm de la bordure supérieure de la crosse aortique suggère que l’ETT n’est pas trop profond. Cette méthode a été validée dans plusieurs études73. Une étude récente a confirmé ces conclusions et a conclu que l’échographie a fourni des images plus rapidement que la radiographie pulmonaire (moyenne 19,3 vs 47 minutes, respectivement)72. La concordance du POC-US avec CXR reconnaître conseils ETT peu profondes et profondes était de 95 %. La sensibilité d’UGB de détecter profondément positionnées ETT astuces sur x-Ray était de 86 % (spécificité de 96 %),73. D’autres études ont évalué la distance entre la pointe de l’ETT et l’aspect supérieur de l’artère pulmonaire principale qui anatomiquement correspond au niveau de la carène et a trouvé une bonne corrélation entre cette technique et radiographie75, 76.
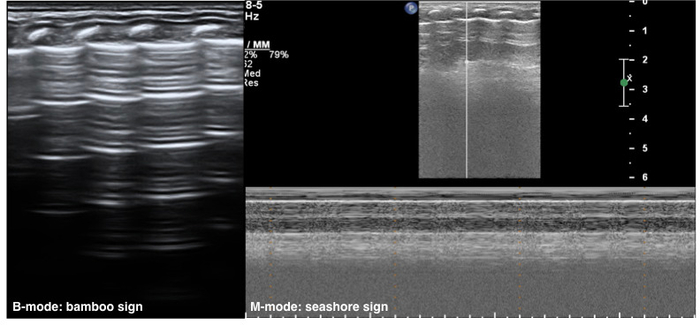
Figure 1 : Néonatale LUS des caractéristiques normales.
Sur l’imagerie en mode B, la ligne pleurale et l’a-line voir la lisse, lignes régulières et hyperéchogènes disposées en parallèles et équidistants entre eux, c’est signe de bambou. Les échos d’une ligne diminuent progressivement jusqu'à disparaître. En mode M, un signe de la mer est présent. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
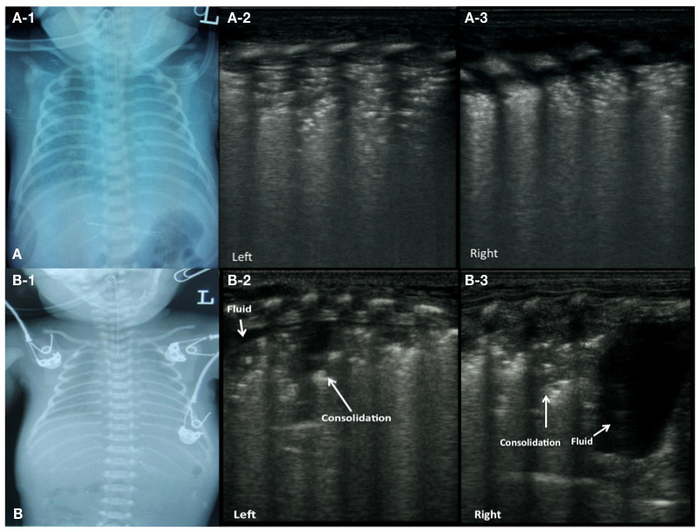
Figure 2 : UGB image caractéristiques des patients RDS.
CXR (A) d’un patient avec grade II-III RDS (a-1). UGB présente consolidation pulmonaire avec air bronchogrammes dans le champs pulmonaires bilatérales, disparition de la ligne pleurale et A-lines (A-2 : poumon gauche, A-3 : poumon droit).
CXR (B) d’un patient avec grade III RDS (B-1). UGB présente une vaste zone de consolidation et un petit épanchement dans le poumon gauche (B-2), la consolidation significative dans le champ supérieur et une grande quantité d’un épanchement pleural dans le champ inférieur du poumon droit (B-3). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : UGB image caractéristiques des patients TTN.
(A) poumon Double point. Point de coupure claires et nettes entre les champs pulmonaires supérieures et inférieures. Il est formé lorsqu’il existe des différences dans les degrés des changements pathologiques. Ce signe est souvent observé en TTN doux.
UGB (B) montre une disparition de la ligne pleurale et A-lines, ainsi que AIS dans les champs pulmonaires.
(C) une zone de liquide dans le poumon droit, indiquant un épanchement pleural.
(D) la ligne-B du dense provoque l’ombre acoustique des côtes à disparaître de la zone balayée ensemble. Ce type de la ligne B est appelé une B-série compact-line. Poumon blanc est défini comme l’existence de compacts B-lignes dans chaque champ de poumon. B-lignes compactes tant poumon blanc sont des signes communs d’échographie de TTN sévère. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
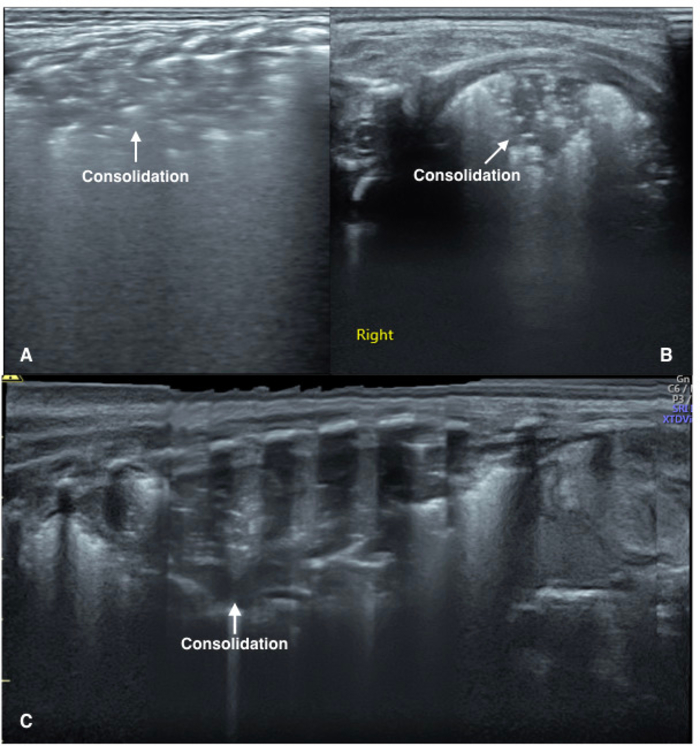
Figure 4 : UGB image caractéristiques des malades de la pneumonie.
Balayage Vertical (A) : l’image montre de grandes zones de consolidation pulmonaire avec air bronchogrammes dans le domaine du poumon. La zone de consolidation a des limites irrégulières.
(B) analyse parallèle : l’image montre de grandes zones de consolidation pulmonaire avec bronchogrammes atmosphérique importante dans le domaine du poumon.
(C) Extended découvre : un patient de pneumonie sévère. La vue étendue affiche un aspect entier de la regroupement impliquant le poumon gauche. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
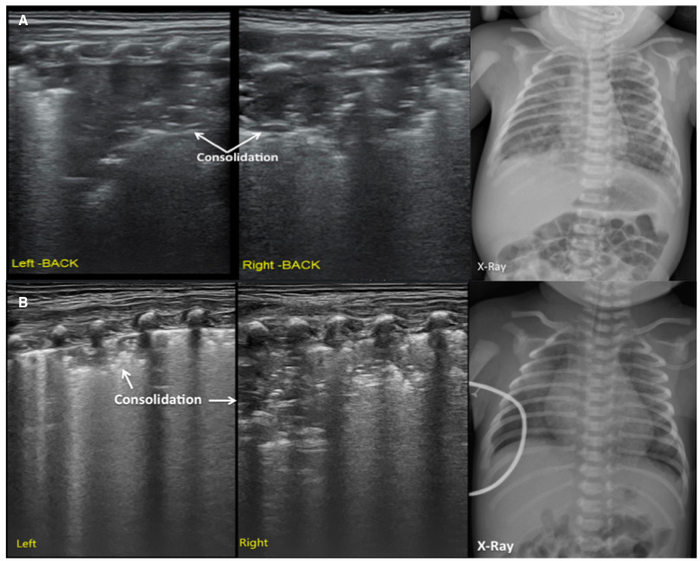
Figure 5 : UGB image caractéristiques des patients de MAS.
(A) LUS montre de grandes zones de consolidation pulmonaire avec des bords irréguliers, en particulier dans le poumon droit. Cette conclusion est conforme à la radiographie pulmonaire.
UGB (B) montre le regroupement de gros poumon avec l’air bronchogrammes, bords irréguliers, ligne pleurale anormal et l’absence d’A-lines. La radiographie pulmonaire montre des opacités inégales qui vous suggère fortement de MAS. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
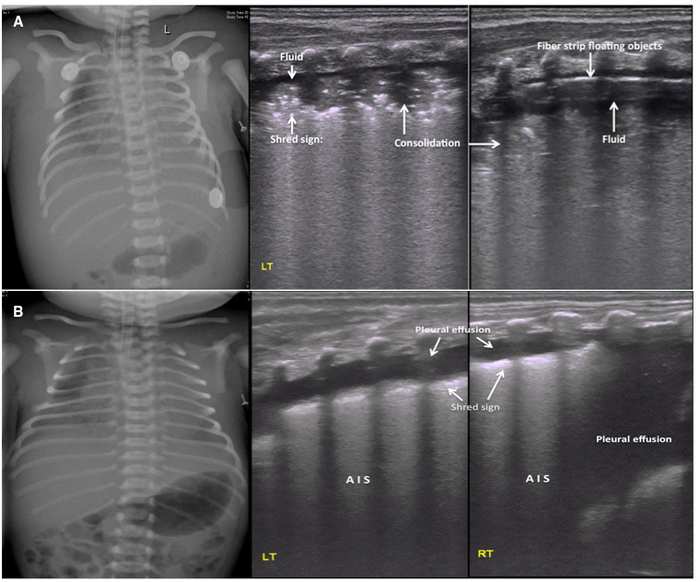
Figure 6 : UGB image caractéristiques de NPH.
(A) résultats d’échographie chez un patient de NPH sévère. CXR affiche les champs pulmonaires flou bilatéral avec des volumes faibles pulmonaires et des épanchements pleuraux. Milieu et de droite : UGB montre une large zone de consolidation pulmonaire avec un air bronchographie, déchiqueter signe au bord de la consolidation et les épanchements pleuraux dans les deux côtés des poumons. L’épanchement pleural a confirmé être hémorragique par ponction pleurale. La ligne pleurale et trapèze sont absents. On observe des dépôts de protéines fibreuses comme cordlike objets flottants à l’échographie en temps réel.
(B) un épanchement Pleural comme l’échographie principale trouver chez NPH. UGB montre un épanchement pleural significatif des deux côtés de la poitrine (plus sévère sur la droite). Cette conclusion est conforme à la radiographie pulmonaire. Le liquide a été confirmé par ponction pleurale pour être sanglante. Les autres conclusions sont AIS et signes doux shred. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
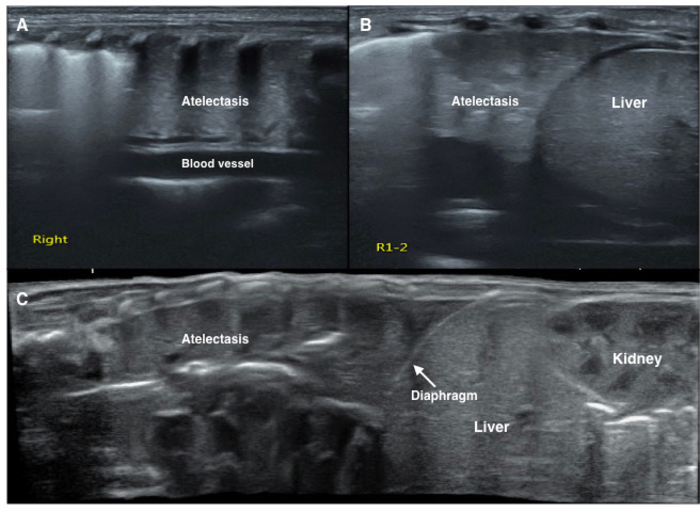
Figure 7 : Caractéristiques LUS de l’image d’atélectasie pulmonaire du nouveau-né.
UGB affiche une zone de grande consolidation avec bords réguliers dans le poumon droit (A, B, C). L’échogénicité du tissu pulmonaire consolidée est similaire à celle du tissu du foie adjacent (B, C). Atmosphérique importante aériques sont observés (C). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
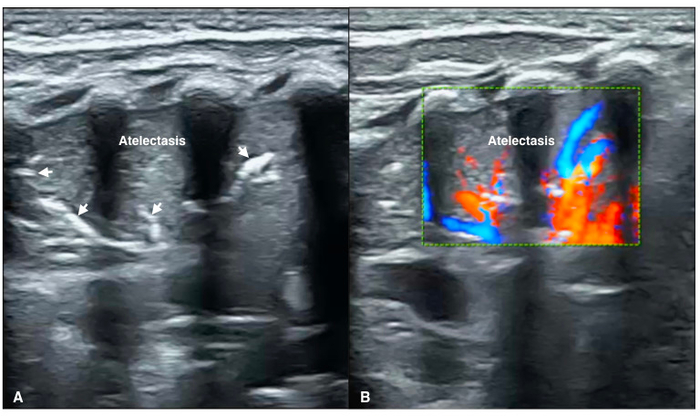
Figure 8 : La circulation sanguine au sein de l’atélectasie
LUS de mode B (A) montre le regroupement de grande surface avec un air important-aériques (flèche) les marges ainsi que normaux, présentés comme une atélectasie.
(B) couleur Doppler échographie montre alimentation artérielle significative dans consolidated zone du poumon (vidéo 4). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
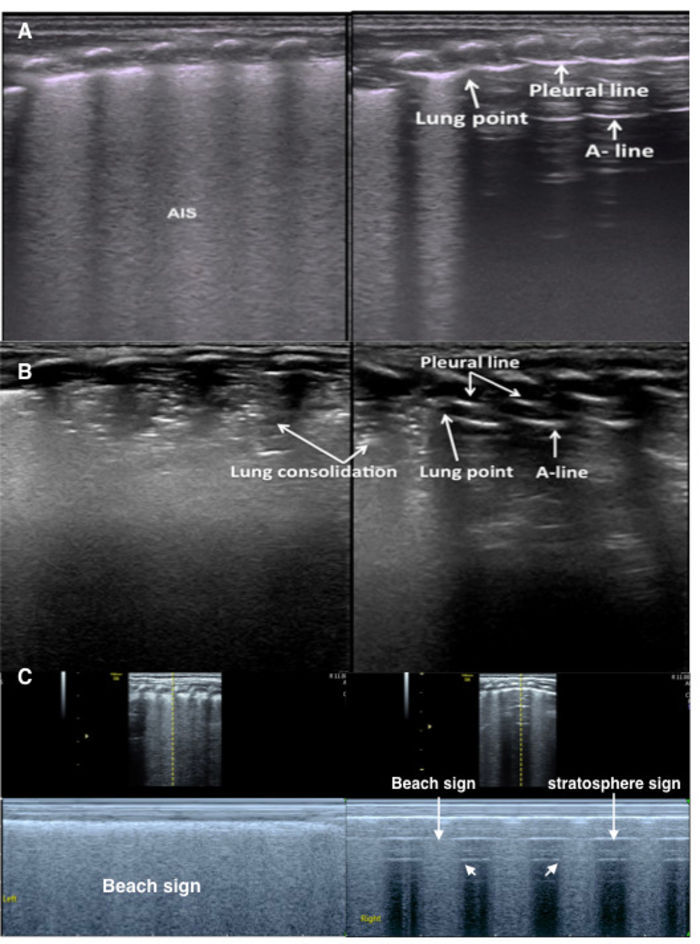
Figure 9 : Point de poumon dans un pneumothorax légère à modérée
(A) TTN patient avec pneumothorax. Le mode B LUS affiche une ligne pleurale anormale, AIS et disparait A-lines dans le poumon gauche. Poumon droit montre un point de poumon. Poumon glissement se produit dans la région de la ligne B mais est absent dans la zone a-line à l’échographie en temps réel (vidéo 5).
(B) RDS patient avec pneumothorax. Mode B LUS montre le regroupement de gros poumon avec bronchogrammes d’air dans le poumon gauche et une petite consolidation dans le poumon droit. La ligne pleurale et A-lines sont présents sur le côté droit du poumon droit.
(C) poumon point sous échographie mode M. Poumon gauche montre le signe de la plage. Poumon droit indique le point de poumon (le point entre plage et signe de la stratosphère), confirmant un pneumothorax doux. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
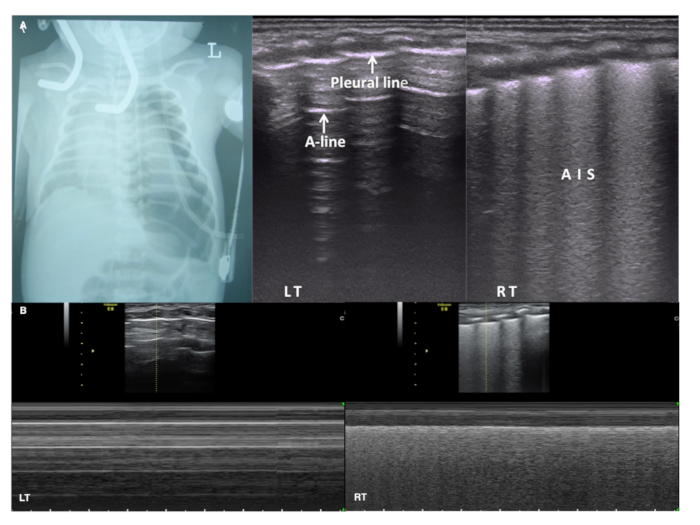
Figure 10 : LUS dans un pneumothorax massif
(A), à la radiographie pulmonaire montre un pneumothorax sévère dans le poumon gauche. La ligne pleurale et A-lines sont présents sur le poumon gauche, mais aucun point du poumon est détecté. UGB présente AIS dans le poumon droit. Poumon glissant disparaît dans le domaine du poumon gauche ensemble en cas de présence sur l’échographie sur en temps réel (vidéo 6).
(B) sous échographie mode M le poumon droit montre un signe de la plage, tandis que le poumon gauche présente un stratosphère signe (également connu sous le nom un code à barres). Cela confirme un pneumothorax sévère dans l’hémithorax gauche. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
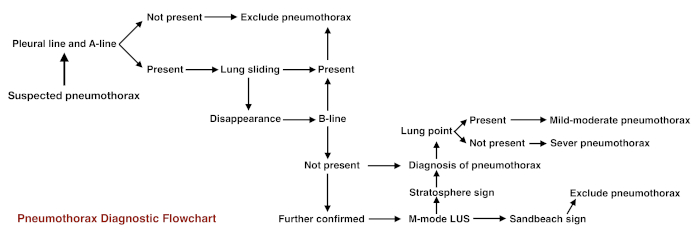
Figure 11 : diagramme de flux pour la procédure de diagnostic de pneumothorax S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Vidéo 1 : Poumon coulissant
La ligne pleurale se déplace en synchronisme avec la respiration. S’il vous plaît cliquez ici pour voir cette vidéo. (Clic droit pour télécharger.)
Vidéo 2 : Dynamic air aériques
Lorsque la consolidation pulmonaire grave est présente air-aériques se déplacent avec la respiration. Ce genre d’air-bronchographie est également connu sous le nom air dynamique-bronchographie. S’il vous plaît cliquez ici pour voir cette vidéo. (Clic droit pour télécharger.)
Vidéo 3 : Pouls du poumon
Si la zone de consolidation pulmonaire est assez grande, le poumon consolidé vibre en même temps que les battements de coeur, ce genre de pulsation est appelé le pouls du poumon. S’il vous plaît cliquez ici pour voir cette vidéo. (Clic droit pour télécharger.)
Vidéo 4 : Approvisionnement en sang dans la zone de l’atélectasie
L’approvisionnement de sang riche se trouvent sous échographie Doppler couleur. S’il vous plaît cliquez ici pour voir cette vidéo. (Clic droit pour télécharger.)
Vidéo 5 : Point de poumon chez un patient de pneumothorax légère à modérée
Poumon glissement se produit dans la région de la ligne B mais est absent dans la zone a-line à l’échographie en temps réel. S’il vous plaît cliquez ici pour voir cette vidéo. (Clic droit pour télécharger.)
Clip 6 : Disparu poumon coulissantes chez un patient de pneumothorax sévère
Poumon coulissant a disparu dans le domaine de l’ensemble du poumon droit. Elle est présentée dans le poumon gauche. S’il vous plaît cliquez ici pour voir cette vidéo. (Clic droit pour télécharger.)
Supplemental Figure 1 : Ligne pleurale
Sous échographie mode B, la ligne pleurale apparaît comme une lignes hyperéchogènes lisse et régulière. S’il vous plaît cliquez ici pour télécharger ce fichier.
La Figure 2 : A-lines
A-lignées sont situés au-dessous de la ligne pleurale. Elles se présentent comme une série de lignes parallèles hyperéchogènes linéaire. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplemental Figure 3 : Ligne B, anastomosé B-line et AIS
(A) B-lines. B-lignes proviennent et sont à peu près verticales de la ligne pleurale.
(B) B-lignes de confluentes. B-lignes confluentes se produisent lorsque l’ensemble de l’espace intercostal regorge de B-lignes intenses, mais l’ombre acoustique des côtes est toujours clairement affichée.
(C) le syndrome alvéolo-interstitielles. AIS est définie par la présence de deux ou plusieurs séquentielles espaces intercostaux avec B-lignes confluentes dans toute zone de lecture optique. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplemental Figure 4 : Compact B-lines.
B-lignes compactes se référer à la concentration de B-lignes qui provoque une ombre acoustique des côtes à disparaître au sein de la zone de numérisation. Poumon blanc se produit lorsque chaque zone de balayage des deux côtés du poumon présente comme compact B-lines. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplémentaire Figure 5 : signe de consolidation et déchiqueter poumon .
(A) consolidation pulmonaire. Sur les tissus pulmonaires LUS donne l’apparence de la densité de tissu, également appelée « hepatization » du poumon.
(B) broyer sign. Lorsque la frontière entre le poumon consolidé et le tissu de poumon aéré n’est pas claire le signe de l’échographie formé entre les deux zones est appelé un signe moindre. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplémentaire Figure 6 : Point de poumon
Le point de transition de la région de la ligne B à la plèvre pariétale et aire déjà trapèze est le point de poumon. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplemental Figure 7 : Double point de poumon.
Différences dans le degré ou les changements pathologiques entre champs pulmonaires supérieures et inférieures indiquent un point double poumon. S’il vous plaît cliquez ici pour télécharger ce fichier.
Supplemental Figure 8 Sandy beach et signe de la stratosphère
Sous échographie mode M, la partie A renferme la plage de sable signe (pneumothorax généralement exclu) tandis que la partie B montre le signe de la stratosphère (généralement vu dans un pneumothorax). S’il vous plaît cliquez ici pour télécharger ce fichier.
Vidéo supplémentaire 1 : Pouls du poumon chez un patient présentant une atélectasie sévère
Atélectasie sévère dans le poumon gauche. Mouvement du poumon atelectatic peut être observé avec les pulsations cardiaques par échographie en temps réel ; ce mouvement est appelé le pouls du poumon. S’il vous plaît cliquez ici pour télécharger ce fichier.
Vidéo supplémentaire 2 : Bronchogrammes Dynamic air chez un patient présentant une atélectasie sévère
Air aériques sont observés avec mouvement respiratoire par échographie en temps réel. Ce genre de mouvement est connu comme une bronchographie air dynamique et est un signe commun d’échographie chez les patients de l’atélectasie sévère. S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
POC-UGB est une méthode de diagnostic possible et pratique qui peut être effectuée à l’USIN au chevet du malade. Il est très sensible et fiable pour le diagnostic de tous les types de de maladies pulmonaires néonatales77. En outre, il présente de nombreux avantages sur les CXR et la tomodensitométrie comme précision, fiabilité, faible coût, simplicité et aucun risque d’effets indésirables dus au rayonnement. Par conséquent, nous encourageons l’utilisation d’UGB à l’USIN. Lors de l’apprentissage de cette modalité d’imagerie, les questions suivantes doivent être soigneusement examinées : (1) examinateurs exigent au moins 6-8 semaines d’entraînement. Ils doivent évaluer les patients de 20-30 avec chaque type de maladie pulmonaire pour maîtriser la technique. La séquence de diagnostique pour un pneumothorax, c’est plus difficile chez le nouveau-né par rapport aux enfants plus âgés ou adultes. Nous suggérons que, dans ce cas, les stagiaires reçoivent temps d’entraînement supplémentaire. (2) examinateurs exploitée en stricte conformité avec les modalités de fonctionnement de l’appareil d’échographie. (3) examinateurs devraient réduire la stimulation indésirable du nouveau-né autant que possible. L’échographie doit être effectuée à des moments opportuns, particulièrement chez les nourrissons à haut risque. (4) l’examen s’effectue idéalement avec un nouveau-né tranquille et calm. Aucun sédatifs ne sont nécessaires pour effectuer la vérification. (5) il faut pour réchauffer le nouveau-né. Gel ultrasonique doit être préchauffé. (6) respecter les procédures de stérilisation et l’isolement. Les opérateurs devraient se laver les mains, nettoyer soigneusement et stériliser la sonde et un embout en plastique protecteur permet d’éviter la contamination croisée.
Balayage perpendiculaire est le plus important et plus couramment utilisé de méthode de balayage. Puisque le tissu pulmonaire sup-pleural est situé à l’extrémité distale de l’approvisionnement en sang et bronchique, il est plus probable d’être affectés par des maladies pulmonaires différents. Par conséquent, balayage perpendiculaires peut délimiter près l’anatomie de l’ensemble du poumon chez les nouveau-nés. Certes, balayage parallèle est également très utile pour détecter les lésions pulmonaires bénins (c'est-à-dire des changements pathologiques impliquant seulement 1-2 les espaces intercostaux et limitée dans les régions sous-pleurales) ou à identifier le point de « poumon » quand un pneumothorax de légère à modérée est soupçonnés de10. Lorsque les lésions concernent principalement la partie inférieure des poumons bilatérales, balayage peut-être être effectuée sous le diaphragme par le foie comme une fenêtre acoustique. Ce type d’analyse permet également d’examiner l’intégrité de la membrane et la présence des épanchements pleuraux.
Dans la pratique clinique, cependant, l’examen LUS ne devrait pas se limiter à une séquence fixe de balayage. L’analyse peut être effectuée à l’endroit plus pratique basé sur la position du bébé lors de l’examen. À partir de LUS de balayage de l’arrière est acceptable et facile à exécuter. Il évite aussi interference de cœur et les gros vaisseaux. Davantage d’analyse dans d’autres domaines des poumons doit être effectuée dans n’importe quel enfant en bas âge avec forte suspicion d’une lésion pulmonaire dans une situation où numérisation du dos ne révèle aucune anomalie.
Occasionnellement, nous pouvons utiliser la fonction de vue étendue (XTD-View). La fonction XTD-View peut construire une image étendue de trames d’images individuelles comme l’opérateur glisse le transducteur sur l’axe étroit de la sonde. XTD-View permet les médecins évaluer les endroits intéressants et voisins des structures entièrement (Figure 4). Pour ce faire, nous devrions orienter le parallèle du transducteur à la direction du mouvement de transducteur avant d’activer le bouton XTD-View. Il faut faire glisser le transducteur vers l’encoche et garder le capteur perpendiculairement aux côtes lors de la numérisation de tout.
UGB a quelques limitations. (1) il est très opérateur dépendant. Par conséquent, il est nécessaire d’acquérir une expérience suffisante pour bien comprendre les principes de base d’UGB avant de procéder à des examens. (2) sous-cutanée emphysème affecte la qualité d’image ainsi que la précision des résultats, donc il peut interférer avec la numérisation. (3) le rôle d’UGB dans l’emphysème, Pneumomédiastin et le diagnostic de dysplasie bronchopulmonaire demeure incertain. (4) certains cas bénins peuvent manquer si le balayage n’est pas effectué avec soin. (5) il a été signalé qu’UGB a une valeur limitée comme outil de diagnostic pour les maladies rares pulmonaires kystiques, tels que lymphangioleiomyomatosis, histiocytose à cellules pulmonaire et Birt-Hogg-Dubé syndrome78.
Les littératures actuelles offrent bien conçu, systématique et des recherches approfondies dans le domaine de l’UGB. Résultats de la recherche ont été validés et confirmés dans la pratique clinique. Notre protocole et les lignes directrices ont été développés après un examen approfondi de factuelle des données actuellement disponibles par un panel d’experts internationaux dans ce domaine.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous reconnaissons tous les experts et les auteurs qui ont participé à la rédaction du manuscrit. Ce travail a été soutenu par la fondation de Beijing Chaoyang District Commission des sciences et de technologie (CYSF1820) et de la clinique recherche spéciale fonds de Wu Jieping Medical Foundation (320. 6750. 15072).
Nous reconnaissons la Division de périnatalogie, la société de pédiatrie de l’Association médicale chinoise et la Division de la société échographie néonatale, l’Association chinoise de néonatologiste ainsi que le collège de chinois de l’échographie critique pour l’organisation ce travail.
Nous reconnaissons l’ensemble du personnel qui a travaillé pour le département de néonatalogie et l’USIN, District de Chaoyang Beijing maternelle et enfant Healthcare Hospital, en particulier le groupe de soins infirmiers qui a donné grand assistant à ce travail, en particulier pendant le processus de la enregistrement vidéo.
matériels
| Name | Company | Catalog Number | Comments |
| Ultrasound machine | GE Healthcare | H44792LW | Ultrasound machine,Voluson S10 BT16,Probe ML6-15 & 9L |
| Ultrasound machine | GE Healthcare | H48701UZ | Ultrasound machine,Voluson E10 BT18 OLED,Probe ML6-15 & 9L |
| Ultrasound machine | Philips Healthcare | US818C0258 | Ultrasound machine,EpiQ5,Probe L18-5 |
| Ultrasound machine | Philips Healthcare | US715F1270 | Ultrasound machine,Affiniti70,Probe eL4-18 |
| Ultrasound gel | Tianjin Xiyuansi Company | TM20160195 | Aquasonic 100 ultrasound transmission gel |
| Disinfection wipe | Nantong Sirui Company Ltd. | YZB0016-2013 | Benzalkonium Bromide Patches |
Références
- Chavez, M. A., et al. Lung ultrasound for the diagnosis of pneumonia in adults: a systematic review and meta-analysis. Respiratory Research. 15, 50 (2014).
- Yilmaz, H. L., Özkaya, A. K., Gökay, S. S., Kendir, &. #. 2. 1. 4. ;. T., Şenol, H. Point-of-care lung ultrasound in children with community acquired pneumonia. The American Journal of Emergency Medicine. 35 (7), 964-969 (2017).
- Volpicelli, G., et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Medicine. 38 (4), 577-591 (2012).
- Hiles, M., Culpan, A. M., Watts, C., Munyombwe, T., Wolstenhulme, S. Neonatal respiratory distress syndrome: chest X-ray or lung ultrasound? A systematic review. Ultrasound. 25 (2), 80-91 (2017).
- Liu, J., Cao, H. Y., Wang, X. L., Xiao, L. J. The significance and the necessity of routinely performing lung ultrasound in the neonatal intensive care units. The Journal of Maternal-Fetal & Neonatal Medicine. 29 (24), 4025-4030 (2016).
- Cattarossi, L., Copetti, R., Poskurica, B. Radiation exposure early in life can be reduced by lung ultrasound. Chest. 139 (3), 730-731 (2011).
- Kurepa, D., Zaghloul, N., Watkins, L., Liu, J. Neonatal lung ultrasound exam guidelines. Journal of Perinatology. 38 (1), 11-22 (2018).
- Chen, S. W., Fu, W., Liu, J., Wang, Y. Routine application of lung ultrasonography in the neonatal intensive care unit. Medicine. 96 (2), e5826 (2017).
- Lichtenstein, D. A., Mauriat, P. Lung ultrasound in the critically ill neonate. Current Pediatric Reviews. 8 (3), 217-223 (2012).
- Liu, J., Ren, X. L., Fu, W., Liu, Y., Xia, R. M. Bronchoalveolar lavage for the treatment of neonatal pulmonary atelectasis under lung ultrasound monitoring. The Journal of Maternal-Fetal & Neonatal Medicine. 30 (19), 2362-2366 (2016).
- Liu, J., Ren, X. L., Li, J. J. POC-LUS Guiding Pleural Puncture Drainage to Treat Neonatal Pulmonary Atelectasis Caused by Congenital Massive Effusion. The Journal of Maternal-Fetal & Neonatal Medicine. , (2018).
- Lichtenstein, D. A., Menu, Y. A bedside ultrasound sign ruling out pneumothorax in the critically ill. Chest. 108 (5), 1345-1348 (1995).
- Piette, E., Daoust, R., Denault, A. Basic concepts in the use of thoracic and lung ultrasound. Current Opinion in Anaesthesiology. 26 (1), 20-30 (2013).
- Volpicelli, G., et al. Detection of sonographic B-lines in patients with normal lung or radiographic alveolar consolidation. Medical Science Monitor. 14 (3), 122-128 (2008).
- Dietrich, C. F., et al. Lung B-line artefacts and their use. Journal of Thoracic Disease. 8 (6), 1356-1365 (2016).
- Copetti, R., Cattarossi, L., Macagno, F., Violino, M., Furlan, R. Lung ultrasound in respiratory distress syndrome: a useful tool for early diagnosis. Neonatology. 94 (1), 52-59 (2008).
- Lichtenstein, D. A., Lascols, N., Mezière, G., Gepner, A. Ultrasound diagnosis of alveolar consolidation in the critically ill. Intensive Care Medicine. 30 (2), 276-281 (2004).
- Touw, H. R., Tuinman, P. R., Gelissen, H. P., Lust, E., Elbers, P. W. Lung ultrasound: routine practice for the next generation of internists. Netherlands Journal of Medicine. 73 (3), 100-107 (2015).
- Lichtenstein, D. A., Lascols, N., Prin, S., Mezière, G. The "lung pulse": an early ultrasound sign of complete atelectasis. Intensive Care Medicine. 29 (12), 2187-2192 (2003).
- Lichtenstein, D., Mezière, G., Biderman, P., Gepner, A. The "lung point": an ultrasound sign specific to pneumothorax. Intensive Care Medicine. 26 (10), 1434-1440 (2000).
- Copetti, R., Cattarossi, L. The double lung point: an ultrasound sign diagnostic of transient tachypnea of the newborn. Neonatology. 91 (3), 203-209 (2007).
- Lichtenstein, D. A., et al. Ultrasound diagnosis of occult pneumothorax. Critical Care Medicine. 33 (6), 1231-1238 (2005).
- Liu, J. Lung ultrasonography for the diagnosis of neonatal lung disease. Journal of Maternal-Fetal Neonatal Medicine. 27 (8), 856-861 (2014).
- Chen, S. W., Zhang, M. Y., Liu, J. Application of Lung Ultrasonography in the Diagnosis of Childhood Lung Diseases. Chinese Medical Journal. 128 (19), 2672-2678 (2015).
- Koivisto, M., et al. Changing incidence and outcome of infants with respiratory distress syndrome in the 1990s: a population-based survey. Acta Paediatrica. 93 (2), 177-184 (2004).
- Ayachi, A., et al. Hyaline membrane disease in full-term neonates. Archives de Pediatrie. 12 (20), 156-159 (2005).
- Liu, J., et al. Clinical characteristics, diagnosis and management of respiratory distress syndrome in full-term neonates. Chinese Medical Journal. 123 (19), 2640-2644 (2010).
- Zhang, Y., Li, P. Meta-analysis of lung ultrasound for the diagnosis of neonatal respiratory distress syndrome. China Medical Herald. 14 (24), 139-142 (2017).
- Lovrenski, J. Lung ultrasonography of pulmonary complications in preterm infants with respiratory distress syndrome. Upsala Journal of Medical Sciences. 117 (1), 10-17 (2012).
- Lovrenski, J., Sorantin, E., Stojanovic, S., Doronjski, A., Lovrenski, A. Evaluation of surfactant replacement therapy effects: a new potential role of lung ultrasound. Srpski Arhiv za Celokupno Lekarstvo. (11-12), 669-675 (2015).
- Liu, J., Cao, H. Y., Wang, H. W., Kong, X. Y. The role of lung ultrasound in diagnosis of respiratory distress syndrome in newborn infants. Iranian Journal of Pediatrics. 24 (2), 147-154 (2014).
- Liu, J., Cao, H. Y., Liu, Y. Lung ultrasonography for the diagnosis of neonatal respiratory distress syndrome: a pilot study. Chinese Journal of Pediatrics. 51 (3), 205-210 (2013).
- Liu, J., Wang, Y., Fu, W., Yang, C. S., Huang, J. J. Diagnosis of neonatal transient tachypnea and its differentiation from respiratory distress syndrome using lung ultrasound. Medicine. 93 (27), e197 (2014).
- Vergine, M., Copetti, R., Brusa, G., Cattarossi, L. Lung ultrasound accuracy in respiratory distress syndrome and transient tachypnea of the newborn. Neonatology. 106 (2), 87-93 (2014).
- Abu-Shaweesh, J. M., Martin, R. J., Fanaroff, A. A., Walsh, M. C. Respiratory disorder in preteen and term infants. Fanaroff and Martin's Neonatal-Perinatal. , 1141-1170 (2011).
- Greenough, A., Greenough, A., Milner, A. D. Transient tachypnea of the newborn. Neonatal Respiratory Disorder. , 272-277 (2003).
- Rocha, G., Rodrigues, M., Guimarães, H. Respiratory distress syndrome of the preterm neonate-placenta and necropsy as witnesses. Journal of Maternal-Fetal & Neonatal Medicine. 24 (1), 148-151 (2011).
- Liu, J., et al. Lung ultrasonography to diagnose transient tachypnea of the newborn. Chest. 149 (5), 1269-1275 (2016).
- Liu, J., et al. Value of lung ultrasound on diagnosing transient tachypnea of the newborn. Journal of Applied Clinical Pediatrics. 31 (2), 93-96 (2016).
- Duke, T. Neonatal pneumonia in developing countries. Archives of Disease in Childhood - Fetal and Neonatal Edition. 90 (3), 211-219 (2005).
- Rao, Y. Analysis of death reasons in 1509 newborn infants. Zhongguo Fuyou Jiankang Yanjiu. 20 (5), 686-688 (2009).
- Chavez, M. A., et al. Lung ultrasound for the diagnosis of pneumonia in adults: a systematic review and meta-analysis. Respiratory Research. 15, (2014).
- Pereda, M. A., et al. Lung ultrasound for the diagnosis of pneumonia in children: a meta-analysis. Pediatrics. 135 (4), 714-722 (2015).
- Caiulo, V. A., et al. Lungultrasound characteristics of community-acquired pneumonia in hospitalized children. Pediatric Pulmonology. 48 (3), 280-287 (2013).
- Reissig, A., et al. Lung Ultrasound in the Diagnosis and Follow-up of Community-Acquired Pneumonia: A Prospective, Multicenter, Diagnostic Accuracy Study. Chest. 142 (4), 965-972 (2012).
- Liu, J., Liu, F., Liu, Y., Wang, H. W., Feng, Z. C. Lung ultrasonography for the diagnosis of severe neonatal pneumonia. Chest. 146 (2), 383-388 (2014).
- Liu, J., et al. Value of lung ultrasound in diagnosing infectious pneumonia of newborns. Chinese Journal of Perinatal Medicine. 17 (7), 468-472 (2014).
- Rodríguez-Fanjul, J., Balcells, C., Aldecoa-Bilbao, V., Moreno, J., Iriondo, M. Lung ultrasound as a predictor of mechanical ventilation in neonates older than 32 weeks. Neonatology. 110 (3), 198-203 (2016).
- Swarnam, K., Soraisham, A. S., Sivanandan, S. Advances in the management of meconium aspiration syndrome. International Journal of Pediatrics. 2012, 359571 (2012).
- Van Ierland, Y., De Beaufort, A. J. Why does meconium cause meconium aspiration syndrome? Current concepts of MAS pathophysiology. Early Human Development. 85 (10), 617-620 (2009).
- Piastra, M., et al. Lung ultrasound findings in meconium aspiration syndrome. Early Human Development. 90, S41-S43 (2014).
- Liu, J., Cao, H. Y., Fu, W. Lung ultrasonography to diagnose meconium aspiration syndrome of the newborn. Journal of International Medical Research. 44 (6), 1534-1542 (2016).
- Liu, J., et al. Lung ultrasonography for the diagnosis of meconium aspiration syndrome of the newborn infants. Chinese Journal of Applied Clinical Pediatrics. 31 (16), 1227-1230 (2016).
- Zahr, R. A., Ashfaq, A., Marron-Corwin, M. Neonatal pulmonary hemorrhage. NeoReviews. 13 (5), e302-e306 (2012).
- Berger, T. M., Allred, E. N., Van Marter, L. J. Antecedents of clinically significant pulmonary hemorrhage among newborn infants. Journal of Perinatology. 20 (5), 295-300 (2000).
- Liu, J., et al. The diagnosis of neonatal pulmonary hemorrhage using lung ultrasound. Chinese Journal of Pediatrics. 55 (1), 46-49 (2017).
- Ren, X. L., Fu, W., Liu, J., Liu, Y., Xia, R. M. Lung ultrasonography to diagnose pulmonary hemorrhage of the newborn. The Journal of Maternal-Fetal & Neonatal Medicine. 30 (21), 2601-2606 (2017).
- Johnston, C., Carvalho, W. B. Atelectasis: mechanisms, diagnosis and treatment in the pediatric patient. Revista da Associação Médica Brasileira. 54 (5), 455-460 (2008).
- Nakos, G., Tsangaris, H., Liokatis, S., Kitsiouli, E., Lekka, M. E. Ventilator-associated pneumonia and atelectasis: evaluation through bronchoalveolar lavage fluid analysis. Intensive Care Medicine. 29 (4), 555-563 (2003).
- Liu, J., et al. Lung ultrasound for diagnosis of neonatal atelectasis. Chinese Journal of Pediatrics. 51 (9), 644-648 (2013).
- Liu, J., et al. The diagnosis of neonatal pulmonary atelectasis using lung ultrasonography. Chest. 147 (4), 1013-1019 (2015).
- Lichtenstein, D., Mezière, G., Seitz, J. The dynamic air bronchogram. A lung ultrasound sign of alveolar consolidation ruling out atelectasis. Chest. 135 (6), 1421-1425 (2009).
- Duong, H. H., et al. Pneumothorax in neonates: trends, predictors and outcomes. Journal of Neonatal-Perinatal Medicine. 7 (1), 29-38 (2014).
- Bhatia, R., Davis, P. G., Doyle, L. W., Wong, C., Morley, C. J. Identification of pneumothorax in very preterm infants. The Journal of Pediatrics. 159 (1), 115-120 (2011).
- Alrajab, S., et al. Pleural ultrasonography versus chest radiography for the diagnosis of pneumothorax: review of the literature and meta-analysis. Critical Care. 17, R208 (2013).
- Cattarossi, L., Copetti, R., Brusa, G., Pintaldi, S. Lung ultrasound diagnostic accuracy in neonatal pneumothorax. Canadian Respiratory Journal. 2016, 6515069 (2016).
- Raimondi, F., et al. Lung ultrasound for diagnosing pneumothorax in the critically ill neonate. The Journal of Pediatrics. 175, 74-78 (2016).
- Liu, J., et al. Lung ultrasonography to diagnose pneumothorax of the newborn. The American Journal of Emergency Medicine. 35 (9), 1298-1302 (2017).
- Rodríguez-Fanjul, J., Moreno Hernando, L., Sánchez-de-Toledo, J. Lung ultrasound for cardiogenic shock in VA-ECMO. Revista Española de Cardiología (English Edition). 71 (5), 393 (2017).
- Rodríguez-Fanjul, J., et al. Usefulness of lung ultrasound in neonatal congenital heart disease (LUSNEHDI): lung ultrasound to assess pulmonary overflow in neonatal congenital heart disease. Pediatric Cardiology. 37 (8), 1482-1487 (2016).
- Quintela, P. A., et al. Usefulness of bedside ultrasound compared to capnography and X-ray for tracheal intubation. Anales de Pediatría. 81 (5), 283-288 (2014).
- Oulego-Erroz, I., Alonso-Quintela, P., Rodríguez-Blanco, S., Mata-Zubillaga, D., Fernández-Miaja, M. Verification of endotracheal tube placement using ultrasound during emergent intubation of a preterm infant. Resuscitation. 83 (6), e143-e144 (2012).
- Chowdhry, R., Dangman, B., Pinheiro, J. M. B. The concordance of ultrasound technique versus X-ray to confirm endotracheal tube position in neonates. Journal of Perinatology. 35 (7), 481-484 (2015).
- Sethi, A., Nimbalkar, A., Patel, D., Kungwani, A., Nimbalkar, S. Point of care ultrasonography for position of tip of endotracheal tube in neonates. Indian Pediatrics. 51 (2), 119-121 (2014).
- Sharma, D., Tabatabaii, S. A., Farahbakhsh, N. Role of ultrasound in confirmation of endotracheal tube in neonates: a review. The Journal of Maternal-Fetal & Neonatal Medicine. , (2017).
- Dennington, D., Vali, P., Finer, N. N., Kim, J. H. Ultrasound confirmation of endotracheal tube position in neonates. Neonatology. 102 (3), 185-189 (2012).
- Sharma, D., Farahbakhsh, N. Role of chest ultrasound in neonatal lung diseases: a review of current evidences. The Journal of Maternal-Fetal & Neonatal Medicine. 32 (2), 310-316 (2019).
- Davidsen, J. R., Bendstrupd, E., Henriksen, D. P., Graumanne, O., Laursena, C. B. Lung ultrasound has limited diagnostic value in rare cystic lung diseases:a cross-sectional study. European Clinical Respiratory Journal. 4 (1), 1330111 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon