Method Article
Cathéter de lumière à tir latéral intra-cardiaque pour la surveillance du métabolisme cellulaire à l'aide de la spectroscopie d'absorption transmurale des cœurs de mammifères perfusés
Dans cet article
Résumé
Ici, nous introduisons une méthode pour l'utilisation d'un cathéter optique intra-ventriculaire dans les cœurs perfus pour effectuer la spectroscopie absorbante à travers la paroi cardiaque. Les données obtenues fournissent des informations solides sur la tension de l'oxygène tissulaire ainsi que l'utilisation du substrat et le potentiel membranaire simultanément avec des mesures de performance cardiaque dans cette préparation omniprésente.
Résumé
La spectroscopie absorbant du muscle cardiaque fournit l'évaluation non destructive de l'oxygénation cytosolique et mitochondriale par l'intermédiaire de myoglobine et d'absorption cytochrome respectivement. En outre, de nombreux aspects du statut métabolique mitochondrial tels que le potentiel de membrane et l'entrée de substrat peuvent également être estimés. Pour effectuer la spectroscopie optique de transmission de mur cardiaque, un cathéter de fibre optique à tir latéral disponible dans le commerce est placé dans le ventricule gauche du coeur perfusé isolé comme source de lumière. La lumière passant à travers la paroi cardiaque est recueillie avec une fibre optique externe pour effectuer la spectroscopie optique du cœur en temps quasi réel. L'approche de transmission évite de nombreuses interférences de diffusion de surface dans les approches de réflexion largement utilisées. Les changements dans les spectres d'absorption transososicoïdes ont été décongestionnés à l'aide d'une bibliothèque de spectres de référence chromophore, fournissant des mesures quantitatives de tous les chromophores cardiaques connus simultanément. Cette approche de déconvolution spectrale a éliminé les erreurs intrinsèques qui peuvent résulter de l'utilisation de méthodes communes de longueur d'onde double appliquées aux spectres d'absorption qui se chevauchent, ainsi que fourni une évaluation quantitative de la bonté de l'ajustement. Un programme personnalisé a été conçu pour l'acquisition et l'analyse de données, ce qui a permis à l'enquêteur de surveiller l'état métabolique de la préparation pendant l'expérience. Ces ajouts relativement simples au système standard de perfusion cardiaque fournissent un aperçu unique de l'état métabolique de la paroi cardiaque en plus des mesures conventionnelles de contraction, perfusion, et extraction de substrat/oxygène.
Introduction
La spectroscopie optique d'absorption pour la surveillance de la biochimie intacte d'organe est une approche largement utilisée due à sa nature intrinsèque et non destructive1,2,3,4,5, 6,7,8,9. L'absorption de myoglobine fournit une mesure de la tension moyenne d'oxygène cytosolique10,11,12. Les cytochromes mitochondriaux fournissent des informations concernant l'entrée de substrat au niveau des flavines, le potentiel de membrane du cytochrome bL:bH13, et la livraison d'oxygène aux mitochondries dans la cellule de l'oxidase cytochrome (COX ) état redox14. Glancy et coll. ont démontré que les activités de chaque complexe peuvent être déterminées en mesurant le potentiel de la membrane mitochondriale et le taux métabolique15. Par conséquent, à l'aide de la spectroscopie optique, une mine d'informations peut être obtenue sans avoir besoin de sondes exogènes ou de modifications majeures des systèmes d'étude actuels. L'objectif de cet article est de présenter une méthode robuste pour la collecte des spectres optiques de transmission dans les préparations cardiaques perfusées conventionnelles avec la seule modification majeure étant l'exécution d'études dans un environnement obscurci.
La spectroscopie d'absorption de réflexion a été employée avec succès pour exécuter la spectroscopie optique du coeur perfusé3,6,16,17,18,19 aussi bien comme le cœur in vivo1. La spectroscopie réfléchissante consiste à empiéter la lumière sur la surface du cœur et à recueillir la lumière dispersée dans le cœur ainsi que la lumière réfléchie diffuse et spéculaire. Ainsi, la lumière recueillie dans cette approche est un composite de mécanismes de diffusion multiples ainsi que les absorbances de chromophore tissulaire d'intérêt. En raison du mouvement et de la surface complexe du cœur, la réflexion de la lumière sur la surface du cœur est particulièrement problématique, modifiant la profondeur de pénétration et la quantité de lumière purement réfléchie.
Les limites de la spectroscopie d'absorption de réflectification présentée ci-dessus ont été résolues en introduisant un cathéter optique dans la cavité ventriculaire gauche, permettant la collecte de la lumière transmise à travers le mur libre de ventricule gauche20. Les avantages de la spectroscopie de transmission pour ce type d'étude ont été appréciés dans les études invasives tôt par Tamura et autres9 La mise en œuvre courante fournit une analyse très robuste de spectroscopie d'absorption de transmission du coeur intact avec en ce qui concerne l'oxygénation cytosolique et l'état de redox de mitochondries dans une série de conditions21. Ces études initiales ont utilisé un cathéter spécialement fabriqué avec une LED alimentée sur la pointe orientée pour générer un modèle de tir latéral de la lumière blanche à travers le myocarde. Cependant, le cathéter à pointe LED relativement grand est seulement approprié pour l'usage sur les coeurs moyens de taille (lapin, cobaye, etc.) et a exigé la fabrication faite sur commande. Dans la présente étude, une méthode d'utilisation d'une fibre optique à tir latéral de 200 microns disponible dans le commerce comme guide lumineux est présentée. Au lieu d'une LED câblée à la pointe, le cathéter avec la pointe de 500 micro redirige la lumière d'une source externe augmentant la polyvalence du système. Cette approche permet l'utilisation d'une grande variété de sources de lumière externes, y compris des lasers pour des applications telles que la spectroscopie de diffusion Raman. Pour quantifier ces données, une analyse spectrale multicomposante en ligne utilisant des spectres de référence connus pour améliorer la précision de la détermination spectroscopique des chromophores cardiaques est présentée comme précédemment décrite20,22. Le code source de cette analyse sera fourni par les auteurs sur demande. En utilisant cette approche, l'information sur la biochimie cardiaque et la fonction mitochondriale peut être obtenue simultanément avec les paramètres fonctionnels cardiaques conventionnels avec peu ou pas d'impact sur la préparation cardiaque. Comme le cœur est gravement dépendant de la fonction mitochondriale et de la livraison d'oxygène, cet ajout technique au système cardiaque perfusé classique améliorera considérablement l'interprétation et l'utilité de cet important modèle de performance cardiaque.
Protocole
Tous les protocoles sur les animaux ont été approuvés par le National Heart, Lung, and Blood Institute Animal Care and Use Committee et exécutés conformément aux lignes directrices décrites dans la Loi sur les soins aux animaux et le bien-être social (7 USC 2142 et 13).
1. Système cardiaque perfusé isolé et perfusate
REMARQUE: Cette préparation est très similaire aux publications précédentes23.
- Faire 4 litres de Krebs-Henseleit perfusate modifié composé de (en mmol/L) 137,0 NaCl, 5,4 KCl, 1,8 CaCl2, 0.5 MgCl2, 1.0 Na2HPO4, 10.0 glucose, 1.0 lactate, et 10.0 HEPES.
- pH le perfusate à 7,4 à 37 oC avec NaOH et HCl.
- Filtrer le perfusat e à travers une membrane de 1 m de pores.
- Rincer tous les tubes et les chambres du système cardiaque perfusé en faisant fonctionner et en drainant l'eau purifiée à travers le système.
- Transférer le perfusate dans le réservoir et oxygéner avec 100% O2 avec le bulleur tout en maintenant la température à 37 oC à l'aide d'un bain d'eau circulant chauffé.
- Ajoutez 2 filtres à membrane de 12 pores et amorcez le système avec le perfusate tout en recirculant en mode Langendorff.
- Fixez une pince à tubes sur le tube juste au-dessus de la canule aortique et ajustez la vis de sorte que le débit aortique tombe à environ 10 ml/min.
2. Excision et perfusion de coeur de lapin
- Excision de coeur
- Anesthésier les lapins blancs mâles néo-zélandais (environ 3 kg) par injection intramusculaire de 1,5 ml de mélange kétamine/acépromazine (10:1).
- Environ 10 à 15 minutes plus tard, administrer 3% d'isoflurane par inhalation pour un effet anesthésique complet.
- Confirmer la profondeur appropriée de l'anesthésie par pincement des orteils, puis placer une ligne dans la veine d'oreille marginale pour l'administration des médicaments suivants.
- Injecter 1 500 unités (ou 1,5 ml de 1 000 unités/ml) d'héparine et laisser circuler pendant 3 minutes.
- Vérifier à deux fois la profondeur appropriée de l'anesthésie, puis euthanasier avec 6 mEq (ou 3 ml de 2 mEq/mL) de KCl.
- Ouvrez rapidement la poitrine, localisez le sommet du cœur et l'aorte. Enlever le cœur en coupant l'aorte aussi loin que possible du cœur et en coupant les veines pulmonaires aussi près que possible des poumons.
REMARQUE : L'enlèvement des poumons à ce stade précoce est différent de la publication précédente23, mais n'a pas d'impact sur la préparation. - Placez le cœur dans un petit bécher de perfusate (même perfusate que l'étape 1.3) assis dans un seau de glace pour le transport de la chirurgie à la perfusion.
- Cœur cannulation
- Cannuleet et attacher l'aorte en toute sécurité, en veillant à ne pas inclure de bulles dans la ligne aortique.
- Initier le débit à une pression de perfusion de 70 mmHg en enlevant la pince à tubes sur la ligne aortique et maintenir cette pression pendant le reste de la chirurgie et le cannulation du vaisseau.
- Séparez l'artère pulmonaire de l'aorte et d'autres vaisseaux et ligate la veine véna cavae et pulmonaire. Enlever la graisse et le tissu conjonctif encore présents.
- Cannulate l'artère pulmonaire pour fournir une mesure du débit des sinus coronaire et la tension de l'oxygène.
- Jetez le flux initial hors du cœur (pendant environ 10 minutes) pendant la préparation pour éliminer le sang et les débris chirurgicaux. Après cette période, recirculer le perfusate.
3. Side-Firing Fiber Optic Placement
- Connectez le cathéter à fibres optiques à une source de lumière blanche À DEL à haute puissance pour faciliter la visualisation et fournir la lumière pour la spectroscopie une fois dans le cœur.
- Couper un petit appendice de l'oreillette gauche, insérer le cathéter dans le ventricule gauche via la valve mitrale, puis le faire pivoter pour obtenir un mur libre de ventricule gauche illuminé.
- Placez la fibre optique de ramassage directement en face de la région d'illumination maximale du ventricule gauche à environ 1 cm du cœur.
- Connectez l'autre extrémité de la fibre de ramassage à un spectromètre à balayage rapide.
4. Spectroscopie optique
- Éteignez les lumières dans la zone expérimentale pour obtenir l'obscurité complète.
- Démarrez le programme personnalisé, en intégrant des pilotes de spectromètre pour effectuer l'acquisition de données et l'analyse en temps réel de la lumière transmise.
REMARQUE : Une version exécutable de la version consolidée du programme d'acquisition et d'analyse spectrale est fournie sous forme de fichier de codage supplémentaire. Le code source est disponible sur demande aux auteurs. - Naviguez à travers toutes les invites, en sélectionnant des options pour le mode d'acquisition de spectroscopie cardiaque perfused. À la page suivante, indiquez si la collecte de données auxiliaires est en cours. Enfin, entrez les paramètres d'acquisition, y compris l'emplacement des spectres de référence des chromophores et des données à enregistrer.
- Entrez une bande passante de 490 à 630 nm.
- Entrez un taux d'échantillonnage de 2 Hz (c.-à-d. 2 échantillons/sec).
- Recueillir un courant sombre, ou zéro lumière, spectre pour corriger les niveaux de signal de fond en étournant la source de lumière.
- Cliquez pour sélectionner les références chromophore souhaitées pour être utilisées dans la routine d'ajustement.
- Dans la page Acquire Data, ajustez la position du cathéter et de la fibre de ramassage pour maximiser la lumière transmise affichée sur le logiciel avec une attention particulière à l'amplitude du signal dans la région de 500 nm, où la myoglobine oxygénée absorbent doivent être observés.
- Assurez-vous que la lumière transmise ne sature pas le détecteur dans la région de 600 nm.
- Assurez-vous qu'aucune source de lumière externe ne contribue au spectre collecté en désuichant l'éclairage du cathéter et en confirmant qu'aucune lumière n'est maintenant détectée.
- Lancez la collecte de données en cliquant sur le bouton Enregistrer Spectra.
- Cliquez sur Set as Control pour visualiser le spectre d'absorption de la différence des spectres futurs au spectre actuel de « contrôle ».
- Effectuer toute perturbation physiologique comme vous le souhaitez.
- Protocole 1 : Effet du cyanure sur la performance cardiaque et l'absorption des chromophores
- Arrêtez de recirculer le liquide de la perfusion cardiaque.
- À l'aide d'une pompe à seringues, injecter du cyanure (2,5 à 75 mm au pH 7) à des taux différents dans le perfusat juste avant la canule aortique pour atteindre les concentrations désirées de cyanure (0,025 à 1 mM, calculée à partir du débit aortique) dans le perfusat qui coule dans le cœur tout en la surveillance de la fonction cardiaque et des propriétés optiques.
- Arrêtez la pompe de seringue de cyanure quand les effets sur le flux coronaire et la fréquence cardiaque avec la transmission optique par la paroi cardiaque sont à l'état régulier.
- Protocole 2 : Ischémie/Hypoxie
- Arrêtez l'infusion de cyanure.
- Après 5 minutes, passer le gaz bouillonnant de 100% d'oxygène à 100% d'azote pour enlever l'oxygène du système.
- Après environ 10 minutes, arrêter le flux pour simuler une condition ischémique/hypoxique totale.
- Protocole 1 : Effet du cyanure sur la performance cardiaque et l'absorption des chromophores
5. Analyse des données spectrales
- Exécutez le programme en mode analyse cardiaque perfused.
- Sélectionnez le spectromètre approprié.
- Entrez le chemin du fichier de données et le fichier spectra de référence et sélectionnez la source de lumière du cathéter, qui charge le spectre pré-enregistré de la source lumineuse du cathéter.
- Sélectionnez Lire les données Bin.
- Sélectionnez Set Min et Max Wavelength.
- Entrez la bande passante pour l'analyse de données en tant que 490-630 nm.
- Sélectionnez Retour au menu principal.
- Sélectionnez Lire les références.
- Confirmer les spectres de référence à utiliser dans l'analyse.
- Sélectionnez Retour au menu principal.
- Sélectionnez les points de temps dans le menu principal.
- Sélectionnez un point de temps T0 comme contrôle et fixez la plage à 100 points.
- Sélectionnez un point de temps T1 comme période expérimentale à une plage de 100 points.
- Observez le spectre de différence brute dans l'onglet Spectrum Averaged.
- Sélectionnez Calculez les coefficients d'ajustement, puis cliquez sur l'onglet Coefficients Fit pour observer le cours du temps de l'ajustement des spectres de référence.
- Retournez au menu principal et sélectionnez Calculer Les abs de différence.
- Sélectionnez T0 et T1 à toutes les positions. Observez le spectre ajusté dans la fenêtre Du spectre de différence et les éléments d'ajustement dans la fenêtre de poids de référence.
- Répétez cette procédure pour comparer d'autres points de temps dans l'expérience.
- Retour au menu principal.
- Enregistrez les données et l'analyse dans un rapport de feuille de calcul en tapant un nom désiré et en sélectionnant Save Data pour une analyse plus approfondie avec d'autres programmes.
REMARQUE : si aucun nom n'est tapé, le rapport est enregistré avec le même nom que le fichier d'entrée. Le rapport est enregistré dans un dossier nommé Excel Analysis Files, situé dans le même dossier que le fichier d'entrée d'origine.
Résultats
Le système utilisé est un système de perfusion de petits animaux hors de l'étagère, mais a été fortement modifié pour une utilisation avec un cœur de lapin. Les modifications étaient principalement d'augmenter la taille de forage de tous les tubes pour assurer une livraison adéquate de débit au cœur de lapin. Un grand soin a été fait pour assurer, aux pressions de perfusion utilisées, le débit du système de perfusion indigène a dépassé le flux avec le cœur attaché par au moins 5 fois. Des filtres à membrane de pores de 2 à 12 m ont été placés en parallèle entre la pompe à liquide et la chambre de piège à bulles préchargeale aortique pour enlever les débris du cœur.
Lumière transmise par le cœur de lapin
La figure 1 présente le spectre du cathéter (Figure 1A) et le spectre brut de la lumière transmise par la paroi sans cœur du lapin (Figure 1B). Ces données révèlent une très grande atténuation de la lumière dans la région bleue du spectre, mais les bandes d'absorption de la myoglobine et les cytochromes mitochondriaux peuvent être directement observées entre 490 et 580 nm dans l'insert. Il est important dans ces études de s'assurer que suffisamment de lumière transmise est détectée dans la région de 490 à 630 nm pour obtenir des informations sur les chromophores cardiaques métaboliquement sensibles. Le positionnement des fibres externes et internes est ajusté avant d'enregistrer des données pour maximiser l'intensité lumineuse mais ne pas saturer le détecteur dans la région de 625 nm.
Référence Réduit moins Spectra oxydé de Chromophores de référence dans le cœur.
La figure 2 présente les spectres de référence utilisés pour s'adapter aux spectres de différence recueillis dans ces études. Ces références incluent la myoglobine, cytochrome aa3 (alternativement cytochrome un605 et cytochrome un607, selon le type de perturbation22), cytochrome un580, cytochrome bL, cytochrome bH , cytochrome c, cytochrome c1, FAD, une représentation absorbante de la lumière incidente (noté I0, qui est utilisé pour rendre compte de la lumière tamisée, c'est-à-dire, des photons qui ont traversé le tissu sans être absorbés), et une ligne (avec des variations pente et d'interception pour tenir compte de la dispersion, qui n'est pas indiquée à la figure 2). Certains spectres sont bruyants, car la concentration du matériau de référence pur était très faible22.
Cours temporel des spectres de référence s'adapte pendant l'expérience totale
La figure 3 représente le cours temporel d'une expérience typique calculée à l'étape 5.15 du protocole. Il s'agit d'une phase de contrôle, suivie d'une phase d'injection de cyanure, suivie d'un lavage de cyanure, suivie d'une phase de désoxygénation, et enfin d'une ischémie. Les changements dans les chromophores individuels (myoglobine, cytochrome aa3, et cytochrome c) au fil du temps sont tracés au fil du temps avec le débit coronaire. Le changement de densité optique de chaque chromophore est estimé en multipliant le coefficient d'ajustement obtenu à partir de la routine linéaire des moindres carrés et le pic représentatif du chromophore (ou l'absorption maximale dudit chromophore). Par exemple, pour la myoglobine, le coefficient d'ajustement de la référence à la myoglobine est multiplié par la valeur du spectre de référence de la myoglobine à 580 nm. Notez que l'oxygénation rapide de la myoglobine à l'ajout de cyanure est compensée par l'augmentation du débit, mais est avant la réduction significative des cytochromes. Cet effet est partiellement récupéré avec le lavage du cyanure. Enfin, la réduction complète des cytochromes et la désoxygénation de la myoglobine est obtenue avec l'ischémie. Ces données démontrent que des données dynamiques concernant l'état métabolique du cœur peuvent facilement être obtenues avec cette méthodologie. La position des spectres utilisés pour les spectres de différence sont indiquées sur ce cours de temps comme : ligne de base C, injection de cyanure cN, Lavage de cyanure CNW, Hypoxie H N2 (azote étant bullé dans le perfusat au lieu de l'oxygène), et hi Aucune ischémie de flux (aucun perfusate qui coule à travers le cœur).
Spectre de différence du traitement de cyanure contre le contrôle et l'ajustement du spectre de différence de cyanure du coeur de lapin.
Pour obtenir un spectre de différence, deux spectres absolus sont soustraits. Chaque spectre absolu est obtenu en prenant une moyenne de plusieurs (généralement 100) spectres pour optimiser le rapport signal/bruit. Figure 4 A représente le spectre de différence du cœur traité de contrôle (C) et de cyanure (CN). À l'aide des spectres de référence décrits à la figure2, le spectre d'ajustement est calculé. Le spectre résiduel est la soustraction de l'ajustement à partir des données brutes. Le même schéma est utilisé pour toutes les présentations spectrales suivantes. Figure 4 B présente les amplitudes spectrales des spectres de référence (illustrés dans la figure 2) utilisés pour s'adapter à la figure 4A. De fortes augmentations de l'absorption de la plupart des cytochromes sont observées que le flux d'électrons dans la chaîne cytochrome a été bloqué par le cyanure dans l'état stable. En outre, l'absorption de la myoglobine oxygénée a augmenté pendant que la consommation d'oxygène a été éliminée par le cyanure. Figure 4 C présente les spectres de différence et l'ajustement du spectre de différence de CNW et de CN, révélant l'inversion partielle de l'effet de cyanure. Pour ce faire, il a été possible de sélectionner des points de temps à l'étape 5.18 du protocole, en déplaçant T0 vers le CNW et le T1 vers la région du CN du cours du temps. Figure 4 D présente le spectre de différence de HI et C, qui représente l'état entièrement désoxygéné et réduit du cytosol et des mitochondries par rapport à l'état de contrôle. Encore une fois, cela a été effectué à l'étape du protocole 5.18, en déplaçant T0 à C et T1 à HI.
Cours de temps initial des effets de cyanure sur le flux coronaire et les chromophores
Figure 5 A montre un exemple de l'initiation de l'effet cyanure sur le tissu. Les ajustements pour la myoglobine, cytochrome un605 et cytochrome c avec le flux coronaire sont présentés pour un seul cœur. Ces cours de temps ont été créés à l'étape du protocole 5.15 pour l'expérience de cyanure. La différence individuelle par rapport à la ligne de base (position 1) est indiquée à la figure 5B. Les spectres ont été générés à partir du nombre de position correspondant (1-4) sur le parcours temporel. Cela a été accompli à l'étape du protocole 5.18, où T0 était toujours en position 1, et par la suite différents spectres (2-4) ont été créés en déplaçant T1 à la position 2, 3, et 4 respectivement. L'observation selon laquelle le débit et l'oxygénation de la myoglobine ont augmenté avant des changements significatifs dans l'état de redox cytochrome était quelque peu surprenant. L'initiation des changements dans le débit et l'absorption de chromophore ont été estimées par extrapolation linéaire du taux initial de changement de la ligne de base. En utilisant cette approche, et en fixant le changement dans le flux coronaire comme temps zéro, l'augmentation de l'oxygénation de myoglobine a commencé 1,71 min - 0,39 min après le changement de débit, tandis que cytochrome a605 et cytochrome c absorbance étaient presque identiques, mais beaucoup plus lent à 4,24 min 0,76 min et 4,34 min et 0,77 min, respectivement (n ' 8). Ces données suggèrent que le cyanure détend le tonus vasculaire24 avant qu'un changement majeur dans l'état métabolique de muscle cardiaque se produise. Cet effet est probablement causé par la rencontre du cyanure du muscle vasculaire lisse avant d'atteindre une dose efficace autour des myocytes cardiaques.
Estimations de l'oxygénation de la myoglobine dans les cœurs témoins
En utilisant les données de cyanure comme estimation de l'oxygénation totale de myoglobine et des données d'ischémie pour la myoglobine entièrement désoxygénée, nous estimons que dans des conditions de contrôle la myoglobine n'était que de 88,2 % - 1,0 % (n - 10) oxygénée, conformément aux études antérieures20 , 21 Ans, états-unis , 25.
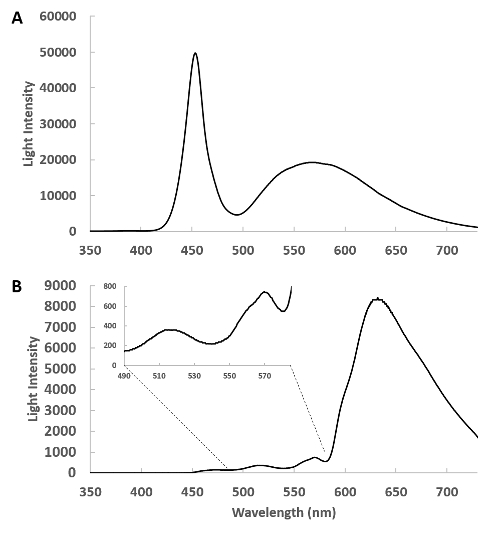
Figure 1 : Spectre du cathéter optique à tir latéral. (A) Il s'agit d'un spectre de la lumière émise par la source de lumière à distance à travers le cathéter détecté avec la fibre de ramassage à environ 1 cm du cathéter. Dans cette géométrie, le cœur est absent et l'intensité de la source lumineuse est réglée de sorte que le détecteur ne sature pas. (B) Le cathéter à tir latéral est inséré dans le ventricule gauche et la lumière transmise du cœur est recueillie et montrée. L'encart montre la région de 400 à 580 nm élargie, révélant la transmission complexe de la lumière de cette région. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Spectres de référence des chromophores cardiaques utilisés pour l'ajustement spectral. Les spectres ont été recueillis par diverses méthodes22 et sont de réduction - oxydé (pour les cytochromes) et désoxygéné - oxygéné (pour la myoglobine). Pour I0, le spectre de la figure 1A est simplement converti en un terme d'absorption pour faire la référence. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Flux et changements optiques au fil du temps. Le changement de densité optique de chaque chromophore est simplement le spectre du chromophore individuel équipé à son absorption maximale. Les fréquences maximales d'absorption étaient comme précédemment décrit20,26. Le cours de temps présenté est pour une expérience, montrant une ligne de base, suivie par l'injection de cyanure (0,10 mM au débit maximal de perfusate), le lavage de cyanure, l'hypoxie d'azote effectuée en remplaçant l'oxygène par l'azote, puis l'ischémie complète. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
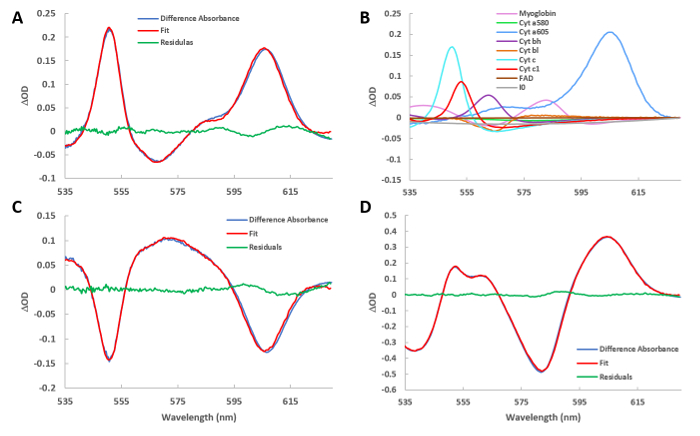
Figure 4 : Spectres de différence ajustés de différentes conditions. (A) Spectre de l'injection de cyanure moins la ligne de base. Le spectre d'ajustement obtenu à partir de la routine la moins carrée est également tracé. Le spectre résiduel est la différence entre les spectres bruts et les spectres d'ajustement. (B) Les spectres de référence utilisés pour créer l'ajustement présenté dans la figure 4A. Le programme échelle les références à la figure 2 à leur contribution relative dans le spectre de la différence actuelle. (C) Même que dans A, mais montrant le spectre de différence de lavage par rapport à l'injection de cyanure. (D) Même que dans A, mais montrant le spectre de différence de l'ischémie par rapport à la ligne de base. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Résolution temporelle élevée de l'effet d'infusion de cyanure sur certains cytochromes, myoglobine et flux cardiaque. (A) Cours temporel du flux cardiaque, de la déoxymyoglobine, de la cytochrome réduite de605, et de la réduction du cytochrome c. Les nombres se réfèrent à la position des spectres prises par rapport à la ligne de base dans la figure 5B. (B) Spectres de différence pour les 4 positions étiquetées dans la figure 5A par rapport au contrôle (position 1). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
La préparation cardiaque perfusée rétrograde ou de travail isolée est un pilier dans l'étude de la physiologie cardiaque ainsi que dans l'étude préclinique des techniques et des médicaments sur le cœur. La clé de son utilisation a été la facilité de préparation, les caractéristiques fonctionnelles robustes et le contrôle des paramètres expérimentaux ainsi que la capacité de mesurer de nombreux paramètres fonctionnels du cœur battant. La spectroscopie optique d'absorption fournit un aperçu de l'oxygénation de tissu aussi bien que des activités métaboliques de mitochondries. La spectroscopie optique a principalement mené dans les études cardiaques perfused isolées dans le mode de réflectation qui est difficile à interpréter en raison des complications de diffusion de mouvement et de lumière.
Nous avons introduit la spectroscopie optique de transmission de mur ventriculaire (VWTOS) pour fournir une méthode robuste de surveillance des chromophores métaboliques de tissu cardiaque. Dans une publication précédente, nous avons démontré qu'une LED câblée à la pointe du câble coaxial20 fait une source de lumière latérale intracardiaque unique qui peut être utilisée pour les cœurs perfusés VWTOS. Le tir latéral fait référence à la projection de lumière perpendiculaire à l'axe long du cathéter, idéal pour éclairer le mur libre de ventricule. Le cathéter LED était assez petit pour ne pas avoir d'impact sur la fonction cardiaque, mais nécessitait une fabrication spécialisée en laboratoire. La présente étude présente l'utilisation d'un cathéter commercial à cuisson latérale de 500 microns qui peut être couplé à n'importe quelle source lumineuse compatible avec la fibre optique. Ces cathéters optiques à tir latéral ont été développés commercialement pour l'ablation laser perpendiculaire au long axe de la fibre. Naturellement, nous utilisons la puissance légère beaucoup plus faible que nécessaire pour la photoablation. De plus petites fibres sont disponibles pour une utilisation sur de plus petites préparations telles que le coeur perfused de souris27. Ce système de fibre optique a fourni l'éclairage proportionnel par la paroi de coeur dans la gamme de longueur d'onde où les chromophores cardiaques absorbent (450-630 nm). À l'aide d'une fibre optique de ramassage à l'extérieur du cœur, l'absorption des cytochromes de la myoglobine et des mitochondries peut être surveillée avec une excellente résolution temporelle et spectrale (voir figure 5). L'approche de fibre optique à tir latéral présente plusieurs avantages par rapport au cathéter LED pour VWTOS, y compris un profil transversal beaucoup plus petit du cathéter qui minimise l'impact du cathéter sur le cœur, une réduction plus souple de l'impact sur la valve cardiaque et performances ventriculaires, pas de connexions électriques qui peuvent raccourcir dans le perfusat salin, et enfin un cathéter qui utilise une source de lumière externe qui augmente la flexibilité de la sélection de source lumineuse pour VWTOS.
En raison de la forte absorption du cœur en dessous de 490 nm, il est difficile de générer beaucoup d'informations sur la bande Soret des cytochromes dans la région de 410-445 nm ou NADH à 340 nm. Ainsi, la large absorption de la DAF à 450 nm est l'absorption de fréquence la plus basse qui est observée, bien que le pic d'absorption entier de ce chromophores ne soit pas échantillonné. En utilisant VWTOS le rapport signal/bruit est très élevé car le mur entier est échantillonné contrairement à la spectroscopie de réflexion de surface, couramment utilisée20, qui ne prélève que la surface du cœur avec de nombreux problèmes de diffusion. VWTOS échantillonnage de la paroi cardiaque entière est plus analogue à nuclear Magnetic Resonance Spectroscopy (NMRS) mesures de nombreux métabolites cardiaques tels que 31P détecté adénosine triphosphate et phosphate de créatine28, 13C détecté les métabolites étiquetés29,30 comprenant les étiquettes hyperpolarisées31,32, et 1H ont détecté des métabolites33. Comme le VWTOS peut être effectué à l'aide d'appareils non magnétiques, il est tout à fait possible que nMR et VWTOS puissent être effectués simultanément. VWTOS ne se limite pas aux chromophores endogènes et pourrait être utilisé pour surveiller l'absorption des sondes optiques pour le pH, Ca2 ,et le potentiel de membrane plasmatique.
Nous utilisons 2 Hz (c.-à-d. 2 échantillons/sec) qui fournit un excellent signal de spectre unique au bruit. Bien que des taux d'échantillonnage plus élevés puissent être atteints qui permettent l'analyse du cycle cardiaque, des études antérieures ont démontré qu'il n'y a pas de battement pour battre la variation de l'absorption du chromophore, donc aucun effort pour recueillir sélectivement la lumière en fonction du cycle cardiaque a été fait34. En raison de la géométrie VWTOS, la détection de la lumière dépend moins du mouvement des tissus que des méthodes de réflexion, puisque les événements complexes de diffusion de surface sont éliminés. Nous constatons que le mouvement sévère peut perturber ces mesures, mais l'analyse spectrale en temps réel révèle rapidement des transitions spectrales incompatibles avec les transitions de chromophore tissulaire. Encore une fois, cela ne se produit que lorsque le cœur se déplace grossièrement loin de la fibre de collecte de façon spectaculaire réduisant la quantité de lumière transmise collectée.
Les données DE VWTOS sont analysées à l'aide d'une routine d'ajustement spectral complet basée sur une bibliothèque de référence de spectres de chromophores cardiaques et le spectre de la source lumineuse tel que décrit précédemment20,22,27, 35 avec une approche linéaire simple des moindres carrés. Cette procédure d'ajustement spectral compensait le chevauchement du spectre absorbant et ne repose pas sur des longueurs d'onde « isobestiques ». Cette analyse complète du spectre élimine les artefacts associés à l'analyse à double faisceau commun (c.-à-d. deux longueurs d'onde)1,3,6 qui s'est avérée problématique20. L'avantage supplémentaire de l'analyse spectrale complète est la génération d'une bonté d'ajustement à partir des résidus, non disponible dans les protocoles à double faisceau.
Dans cette étude, nous nous sommes concentrés sur l'effet du cyanure sur les propriétés optiques du cœur. Comme le cyanure bloque l'oxidase cytochrome, il inhibe la consommation d'oxygène et entraîne essentiellement une réduction nette de tous les cytochromes que les électrons de retour dans la chaîne cytochrome. Cependant, le potentiel membranaire reste apparemment élevé, car les changements de redox dans bL et bH sont très petits par rapport au cytochrome c13. Avec l'arrêt de la consommation d'oxygène, la tension d'oxygène dans le tissu devrait approcher le perfusat e et nous avons noté une augmentation tôt de la myoglobine oxygénée avec le cyanure compatible avec la notion que le coeur perfusé salin, même dans la perfusion rétrograde modes, n'est pas entièrement oxygéner la myoglobine dans le cytosol19,20,21,36. La comparaison de l'effet maximal du cyanure sur la myoglobine oxygénée avec le spectre entièrement désoxygéné obtenu avec l'ischémie indique une oxygénation de myoglobine de seulement environ 88%, compatible aux études précédentes.
Il est important de noter dans cette étude que les effets de cyanure sur l'oxygénation de myoglobinet et la réduction de cytochrome ont été temporellement résolus. Il est surprenant que les effets du cyanure aient été observés pour la première fois sur le flux coronaire et la myoglobine avant que de grands changements dans l'état de redox cytochromes du coeur aient été observés. L'augmentation marquée tôt du flux suggère qu'un effet sur le muscle lisse artériel24,37 puisse se produire avant que des effets métaboliques bruts dans les cellules cardiaques soient observés. L'augmentation du débit, potentiellement avec une diminution induite par le cyanure modeste de la respiration, a probablement des résultats dans l'augmentation immédiate de la myoglobine oxygénée provoquée par l'augmentation de la livraison d'oxygène. Avec la propagation de l'inhibition du cyanure aux myocytes, une nouvelle augmentation du flux coronaire est observée (voir la région marquée 3 à la figure 5a), probablement entraînée par de nombreux facteurs métaboliques38. Le grand impact tôt du cyanure sur le flux suggère que le métabolisme du muscle lisse vasculaire puisse être plus puissant en modifiant le tonus vasculaire que le métabolisme des myocytes. Ces données soutiennent la notion bien établie que la myoglobine a une affinité beaucoup plus faible pour l'oxygène que COX, même dans le coeur intact, car l'oxygénation de myoglobine s'est produite bien avant que les changements dans l'état de redox de mitochondries (figure 5). Ce niveau élevé de myoglobine désoxygénée dans des conditions de contrôle est compatible avec des études antérieures suggérant que le coeur perfusé salin isolé peut être partiellement hypoxique même dans des conditions de contrôle9,19, 20,21,27,36, soulignant l'importance de surveiller l'oxygénation des tissus cardiaques lors de l'utilisation de ce modèle important en physiologie cardiaque.
Nous présentons ici les détails expérimentaux pour mener la spectroscopie d'absorption de transmission sur le coeur perfused d'isolement. Nous avons réussi à adapter cette technique pour une utilisation sur les cœurs du lapin à la souris en utilisant une mince fibre optique intracardiaque à tir latéral. Utilisant l'état de l'art des routines d'ajustement spectral complet, l'interaction optique complexe des chromophores cardiaques peut être facilement extraite fournissant, une mesure presque en temps réel des éléments critiques du métabolisme myocardique simultanément avec conventionnel mesures fonctionnelles.
Déclarations de divulgation
Aucun conflit d'intérêts n'a été déclaré.
Remerciements
Ce travail a été entièrement appuyé par le programme intra-muros de l'NHLBI (Projet ZIA HL00460131).
matériels
| Name | Company | Catalog Number | Comments |
| BIOPAC data acquisition system | BIOPAC | MP150 | Analog to digitial conversion |
| BIOPAC general purpose transducer amplifiers | BIOPAC | DA100C | Pressure monitoring |
| BIOPAC System skin temperature amplifier | BIOPAC | SKT100B | temperature monitoring |
| Compact Universal 1- and 2- Channel LED Controllers | Mightex | SLC-MA02-U | External light source power supply |
| Disposable pressure sensors | BIOPAC | RX104A | Pressure monitoring |
| Dual Syringe, Infusion Pump | KdScientific | KDS 200 / 200P LEGACY SYRINGE PUMP | drug injection |
| Flow-through probes | Transonic | 4PXN | perusate flow monitoring |
| Glass Syringe | FORTUNA Optima | 30 CC | Air tight fluid injection |
| High power fiber-coupled LED white light source | Mightex | Type-A FCS-0000 | External light source |
| Perfused heart system | Radnoti | 120101BEZ | This system was heavily modified to provide adequate flow (see manuscript) |
| Phase fluorimeter | Ocean Optics | NeoFox-GT | oxygen concentration |
| Pickup fiber optic | Thor labs | BF20HSMA01 | Fiber for collecting transmitted light (pick up fiber) |
| PowerLab unit | AD Instruments | PowerLab 8/35 | Analog to digitial conversion |
| Pressure transducers | BIOPAC | TSD104A | pressure monitoring |
| Programming environment | LABViEW | N/A | Software for driving spectrometer, digitiziing data and analysis. Code available on request |
| Rapid scanning spectrophotometer | Ocean Optics | QE65PRO | Rapid scanning spectrometer for spectral analysis |
| Side firing fiber optic | Polymicro Technologies Molex, LLC 18019 North 25th Av, Phoenic AZ 85023-1200 | JTFLH200230500/1.5M | side firing fiber optic 200 microns core |
| Sodium cyanide | Sigma-Aldrich | 380970 | Metabolic inhibitor |
| Temperature probe | BIOPAC | TSD102A | temperature monitoring |
| Tubing flow modules | Transonic | TS410 | perusate flow monitoring |
Références
- Arai, A. E., Kasserra, C. E., Territo, P. R., Gandjbakhche, A. H., Balaban, R. S. Myocardial oxygenation in vivo: optical spectroscopy of cytoplasmic myoglobin and mitochondrial cytochromes. American Journal of Physiology. 277, 2 Pt 2 683-697 (1999).
- Epstein, F. H., Balaban, R. S., Ross, B. D. Redox state of cytochrome aa3 in isolated perfused rat kidney. American Journal of Physiology. 243 (4), 356-363 (1982).
- Hassinen, I. E., Hiltunen, J. K., Takala, T. E. S. Reflectance spectrophotometric monitoring of the isolated perfused heart as a method of measuring the oxidation-reduction state of cytochromes and oxygenation of myoglobin. Cardiovascular Research. 15, 86-91 (1981).
- Makino, N., Kanaide, H., Yoshimura, R., Nakamura, M. Myoglobin oxygenation remains constant during the cardiac cycle. American Journal of Physiology. 245 (14), 237-243 (1983).
- Takahashi, E., Doi, K. Visualization of oxygen level inside a single cardiac myocyte. American Journal of Physiology. 268, 6 Pt 2 2561-2568 (1995).
- Heineman, F. W., Kupriyanov, V. V., Marshall, R., Fralix, T. A., Balaban, R. S. Myocardial oxygenation in the isolated working rabbit heart as a function of work. American Journal of Physiology. 262, 255-267 (1992).
- Arakaki, L. S., Burns, D. H., Kushmerick, M. J. Accurate myoglobin oxygen saturation by optical spectroscopy measured in blood-perfused rat muscle. Applied Spectroscopy. 61 (9), 978-985 (2007).
- Bose, S., French, S., Evans, F. J., Joubert, F., Balaban, R. S. Metabolic network control of oxidative phosphorylation: multiple roles of inorganic phosphate. Journal of Biological Chemistry. 278 (40), 39155-39165 (2003).
- Tamura, M., Oshino, N., Chance, B., Silver, I. A. Optical measurements of intracellular oxygen concentrations of rat heart in vitro. Archives of Biochemistry and Biophysics. 191, 18-22 (1978).
- Wright, T. J., Davis, R. W. Myoglobin oxygen affinity in aquatic and terrestrial birds and mammals. The Journal of Experimental Biology. 218, Pt 14 2180-2189 (2015).
- Wright, T. J., Davis, R. W. Myoglobin extraction from mammalian skeletal muscle and oxygen affinity determination under physiological conditions. Protein Expression and Purification. 107, 50-55 (2015).
- Shibata, T., et al. Relationship between oxygen affinity and autoxidation of myoglobin. Inorganic Chemistry. 51 (21), 11955-11960 (2012).
- Kim, N., Ripple, M. O., Springett, R. Measurement of the mitochondrial membrane potential and pH gradient from the redox poise of the hemes of the bc1 complex. Biophysical Journal. 102 (5), 1194-1203 (2012).
- Oshino, N., Jamieson, D., Sugano, T., Chance, B. Mitochondrial function under hypoxic conditions: The steady states of cytochrome a,a3 and their relation to mitochondrial energy states. Biochimica et Biophysica Acta. 368, 298-310 (1974).
- Glancy, B., Willis, W. T., Chess, D. J., Balaban, R. S. Effect of calcium on the oxidative phosphorylation cascade in skeletal muscle mitochondria. Biochemistry. 52 (16), 2793-2809 (2013).
- Figulla, H. R., Hoffmann, J., Lubbers, D. W. Evaluation of reflection spectra of the isolated heart by multicomponent spectra analysis in comparison to other evaluating methods. Advances in Experimental Medicine and Biology. 169, 821-830 (1984).
- Hoffmann, J., Lubbers, D. W., Heise, H. M. Applicability of the Kubelka-Munk theory for the evaluation of reflectance spectra demonstrated for haemoglobin-free perfused heart tissue. Physics in Medicine and Biology. 43 (12), 3571-3587 (1998).
- Fabel, H., Lubbers, D. W. Measurements of Reflection Spectra of Beating Rabbit Heart in Situ. Biochemische Zeitschrift. 341 (4), 351(1965).
- Schenkman, K. A., Beard, D. A., Ciesielski, W. A., Feigl, E. O. Comparison of buffer and red blood cell perfusion of guinea pig heart oxygenation. American Journal of Physiology - Heart and Circulatory Physiology. 285 (5), 1819-1825 (2003).
- Femnou, A. N., et al. Intracardiac light catheter for rapid scanning transmural absorbance spectroscopy of perfused myocardium: measurement of myoglobin oxygenation and mitochondria redox state. American Journal of Physiology - Heart and Circulatory Physiology. 313 (6), 1199-1208 (2017).
- Kuzmiak-Glancy, S., et al. Cardiac performance is limited by oxygen delivery to the mitochondria in the crystalloid-perfused working heart. American Journal of Physiology - Heart and Circulatory Physiology. 314 (4), 704-715 (2018).
- Chess, D. J., et al. Optical spectroscopy in turbid media using an integrating sphere: mitochondrial chromophore analysis during metabolic transitions. Analytical Biochemistry. 439 (2), 161-172 (2013).
- Lou, Q., Li, W., Efimov, I. R. Multiparametric optical mapping of the Langendorff-perfused rabbit heart. Journal of Visualized Experiments. (55), (2011).
- Coburn, R. F., Grubb, B., Aronson, R. D. Effect of cyanide on oxygen tension-dependent mechanical tension in rabbit aorta. Circulation Research. 44 (3), 368-378 (1979).
- Schenkman, K. A., Marble, D. R., Burns, D. H., Feigl, E. O. Myoglobin oxygen dissociation by multiwavelength spectroscopy. Journal of Applied Physiology. 82 (1), 86-92 (1997).
- Femnou, A. N., et al. Intracardiac light catheter for rapid scanning transmural absorbance spectroscopy of perfused myocardium: measurement of myoglobin oxygenation and mitochondria redox state. American Journal of Physiology - Heart and Circulatory Physiology. 313 (6), 1199-1208 (2017).
- Giles, A. V., et al. Paradoxical Arteriole Constriction Compromises Cytosolic and Mitochondrial Oxygen Delivery in the Isolated Saline-Perfused Heart. American Journal of Physiology - Heart and Circulatory. , (2018).
- Matthews, P. M., et al. A 31P-NMR study of some metabolic and functional effects of the inotropic agents epinephrine and ouabain, and the ionophore R02- 2985 (X537A) in the isolated, perfused rat heart. Biochimica et Biophysica Acta. 720, 163-171 (1982).
- Lewandowski, E. D., Damico, L. A., White, L. T., Yu, X. Cardiac responses to induced lactate oxidation: NMR analysis of metabolic equilibria. American Journal of Physiology. 269, 1 Pt 2 160-168 (1995).
- Lewandowski, E. D., et al. Multiplet structure of 13C NMR signal from glutamate and direct detection of tricarboxylic acid (TCA) cycle intermediates. Magnetic Resonance in Medicine. 35 (2), 149-154 (1996).
- Ball, D. R., et al. Hyperpolarized butyrate: a metabolic probe of short chain fatty acid metabolism in the heart. Magnetic Resonance in Medicine. 71 (5), 1663-1669 (2014).
- Mariotti, E., et al. Modeling non-linear kinetics of hyperpolarized [1-(13)C] pyruvate in the crystalloid-perfused rat heart. NMR in Biomedicine. 29 (4), 377-386 (2016).
- Pisarenko, O. I., Khlopkov, V. N., Ruuge, E. K. A 1H NMR study of succinate synthesis from exogenous precursors in oxygen-deprived rat heart mitochondria. Biochemistry International. 12 (1), 145-153 (1986).
- Kuzmiak-Glancy, S., et al. Cardiac performance is limited by oxygen delivery to the mitochondria in the crystalloid-perfused working heart. American Journal of Physiology - Heart and Circulatory Physiology. 314 (4), 704-715 (2018).
- Schenkman, K. A., Marble, D. R., Burns, D. H., Feigl, E. O. Myoglobin oxygen dissociation by multiwavelength spectroscopy. American Journal of Physiology. 82 (1), 86-92 (1997).
- Beard, D. A., Schenkman, K. A., Feigl, E. O. Myocardial oxygenation in isolated hearts predicted by an anatomically realistic microvascular transport model. American Journal of Physiology - Heart and Circulatory Physiology. 285 (5), 1826-1836 (2003).
- Paul, R. J. Section II: The Cardiovascular System, Vol II, Vascular Smooth Muscle. Handbook of Physiology. Bohr, D. E., Somlyo, A. P., Sparks, H. V. , American Physiological Society. 201-252 (1980).
- Feigl, E. O. Coronary physiology. Physiological Reviews. 63, 1-205 (1983).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon