Method Article
교란 성 포유류 심장의 경부 흡광도 분광학을 사용하여 세포 대사를 모니터링하기위한 심장 내 측 발사 라이트 카테터
요약
여기에서 우리는 심혼에 있는 심실 광학 카테터를 심장 벽을 가로질러 흡광도 분광학을 능력을 발휘하기 위하여 공류된 심혼에 이용하는 방법을 소개합니다. 얻은 데이터는 조직 산소 장력뿐만 아니라 기질 활용 및 멤브레인 잠재력에 대한 강력한 정보를 이 유비쿼터스 제제에서 심장 성능 측정과 동시에 제공합니다.
초록
심장 근육의 흡광도 분광법은 각각 미오글로빈과 시토크롬 흡광도를 통해 세포증 및 미토콘드리아 산소화에 대한 비파괴적 평가를 제공합니다. 또한, 막 전위 및 기질 진입과 같은 미토콘드리아 대사 상태의 수많은 양상도 추정될 수 있다. 심장 벽 투과 광학 분광법을 수행하기 위해, 시판되는 측면 발사 광섬유 카테터는 광원으로서 단경된 교좌의 좌심실에 배치된다. 심장벽을 통과하는 빛은 거의 실시간으로 심장의 광학 분광법을 수행하기 위해 외부 광섬유로 수집됩니다. 투과 방식은 널리 사용되는 반사 접근 방식에서 발생하는 수많은 표면 산란 간섭을 방지합니다. 교란 흡광도 스펙트럼의 변화는 발색단 기준 스펙트럼의 라이브러리를 사용하여, 동시에 알려진 모든 심장 염색체의 정량적 측정을 제공, deconvvolved했다. 이 스펙트럼 데코볼루션 접근법은 중첩된 흡광도 스펙트럼에 적용되는 일반적인 이중 파장 방법을 사용하여 발생할 수 있는 본질적인 오류를 제거하고 적합성의 장점을 정량화하여 평가했습니다. 사용자 지정 프로그램은 데이터 수집 및 분석을 위해 설계되었으며, 이를 통해 조사자가 실험 중에 준비의 대사 상태를 모니터링할 수 있었습니다. 표준 심장 관류 시스템에 이러한 비교적 간단한 추가 수축, 관류 및 기질 /산소 추출의 전통적인 측정 뿐만 아니라 심장 벽의 대사 상태에 독특한 통찰력을 제공 합니다.
서문
그대로 기관 생화학을 모니터링하기위한 광학 흡광도 분광법은 본질적, 비파괴적 특성1,2,3,4,5로인해 널리 사용되는 접근 법입니다. 6,7,8,9. 미오글로빈 흡광도는 평균 세포산소장력10,11,12의척도를 제공한다. 미토콘드리아 시토크롬은 플라빈 수준에서 기질 진입에 관한 정보를 제공하며, 시토크롬 b L:bH13에서막 전위, 세포내 미토콘드리아로의 산소 전달(COX) ) 레독스 상태14. Glancy 외. 각 복합체의 활동은 미토콘드리아 막 전위 및 대사율15를측정하여 결정될 수 있음을 입증하였다. 따라서 광학 분광법을 사용하면 외인성 프로브나 현재 연구 시스템의 주요 수정 없이도 풍부한 정보를 얻을 수 있습니다. 이 논문의 목적은 어두운 환경에서 연구를 수행하는 유일한 주요 변형과 기존의 관공 심장 제제에서 전송 광학 스펙트럼을 수집하기위한 강력한 방법을 제시하는 것입니다.
반사 흡수 분광법은 성공적으로 뿐만 아니라 관이 심장 의 광학 분광법을 수행하는 데 사용되었습니다 3, 6,6,16,17,18,19뿐만 아니라 생체 내 의 심장으로1. 반사 분광법은 심장 표면에 빛을 충돌하고 심장을 통해 흩어져있는 빛을 수집하는 것뿐만 아니라 확산 및 반사 반사 광으로 구성됩니다. 따라서, 이러한 접근법에서 수집된 빛은 관심있는 조직 발광광뿐만 아니라 다중 산란 메커니즘의 복합체이다. 심장의 움직임과 복잡한 표면으로 인해 심장 표면에서 반사되는 빛은 특히 문제가 되어 침투 깊이와 순수하게 반사된 빛의 양을 변경합니다.
상기 제시된 반사흡수분광학의 한계는 좌심실 캐비터내로 광학카테터를 도입하여, 좌심실 자유벽(20)을 가로질러 투과된 빛의 수집을 허용함으로써 해결되었다. 이러한 유형의 연구에 대한 전송 분광법의 이점은 Tamura et al.9에 의한 초기 침습 연구에서 평가되었습니다.9 현재 구현은 손상되지 않은 심장의 매우 강력한 전송 흡수 분광학 분석을 제공합니다. 다양한 조건하에서 세포산산화 및 미토콘드리아 레독스 상태에 관한21. 이러한 초기 연구는 심근을 통해 백색광의 측면 발사 패턴을 생성하기 위해 팁 지향에 전원 LED가있는 특수 제작 된 카테터를 사용했습니다. 그러나 상대적으로 큰 LED 팁 카테터는 중간 크기의 하트 (토끼, 기니 피그 등)에 사용하기에만 적합하며 사용자 정의 제작이 필요합니다. 현재 연구에서는, 광 가이드로서 시판되는 200 미론 코어 측 발사 광섬유를 사용하는 방법이 제시된다. 팁의 유선 LED 대신 500마이크로 팁이 있는 카테터는 외부 소스의 빛을 리디렉션하여 시스템의 다기능성을 높입니다. 이 접근법은 라만 산란 분광법과 같은 응용 분야에 레이저를 포함한 다양한 외부 광원을 사용할 수 있게 합니다. 이 데이터를 정량화하기 위해, 심장 크로모포어의 분광 측정의 정확도를 향상시키기 위해 공지된 기준 분광을 이용한 온라인 전체 다성분 분광 분석은 앞서 설명한 바와 같이 제시된다20,22. 이 분석에 대한 소스 코드는 요청 시 작성자가 제공합니다. 이 접근법을 사용하여 심장 생화학 및 미토콘드리아 기능에 대한 정보는 심장 제제에 거의 또는 전혀 영향을 미치지 않는 기존의 심장 기능 파라미터와 동시에 얻을 수 있습니다. 심장은 미토콘드리아 기능과 산소 전달에 크게 의존하기 때문에, 고전적인 공복 심장 시스템에 이 기술적 추가는 심장 성능의 이 중요한 모형의 해석 그리고 유용성을 크게 향상할 것입니다.
프로토콜
모든 동물 프로토콜은 국립 심장, 폐 및 혈액 연구소 동물 관리 및 사용 위원회의 승인을 받았으며 동물 관리 및 복지법(7 USC 2142 § 13)에 설명된 지침에 따라 수행되었습니다.
1. 고립 된 퍼퓨즈 심장 시스템과 향수
참고: 이 준비는 이전 간행물23과매우 유사합니다.
- (mmol/L) 137.0 NaCl, 5.4 KCl, 1.8 CaCl2,0.5 MgCl2,1.0 Na2HPO 4, 10.0글루코스, 1.0 락테이트 및 10.0 HEPES로 구성된 수정된 크렙스-헨셀라이트 이향수 4리터를 만드십시오.
- pH 는 NaOH 및 HCl을 사용하여 37°C에서 7.4로 향수를 내포한다.
- 1 μm 기공 막을 통해 향수를 걸러.
- 시스템을 통해 정제 수를 실행하고 배수하여 관류 심장 시스템의 모든 튜브와 챔버를 헹구십시오.
- 가열된 순환 수조를 사용하여 37°C에서 온도를 유지하면서 배버너로 100% O2로 배뇨및 산소를 탱크로 이송한다.
- 12 μm 모공 멤브레인 필터 중 2개에 추가하고 랑엔도르프 모드에서 재순환하면서 향수로 시스템을 프라이밍합니다.
- 대동맥 캐뉼라 바로 위의 튜브에 튜브 클램프를 부착하고 대동맥 흐름이 약 10 mL/min으로 떨어지도록 나사를 조정합니다.
2. 토끼 심장 절제 및 관류
- 심장 절제
- 케타민/아세프로마진 혼합물(10:1)의 1.5 mL 근육 내 주사를 통해 수컷 뉴질랜드 흰 토끼(약 3kg)를 마취시다.
- 약 10-15 분 후, 완전한 마취 효과를 위해 흡입을 통해 3 %의 이소플루란을 투여하십시오.
- 발가락 꼬집어에 의하여 마취의 적당한 깊이를 확인하고 후속 약의 관리를 위한 한계 귀 정맥에 선을 두는 하십시오.
- 헤파린 1,500유닛(또는 1,000 단위/mL의 1.5mL)을 주입하고 3분간 순환시키세요.
- 마취의 적절한 깊이를 다시 확인한 다음 KCl의 6 mEq (또는 2 mEq / mL의 3 mL)로 안락사하십시오.
- 가슴을 빠르게 열고 심장의 정점과 대상자를 찾습니다. 가능한 한 심장에서 대동맥을 절단하고 폐에 가능한 한 가까운 폐 정맥을 절단하여 심장을 제거합니다.
참고: 이 초기 단계에서 폐를 제거하는 것은 이전 간행물23과 다르지만 준비에 영향을 미치지 않습니다. - 심장을 향수의 작은 비커에 놓습니다 (단계 1.3과 동일한 향수) 수술에서 관류로 운반하기 위해 얼음 양동이에 앉아 있습니다.
- 심장 통조림
- 대동맥을 단단히 고정하고 묶어 대동맥 라인에 거품이 포함되지 않도록하십시오.
- 대동맥 선에 튜브 클램프를 제거하여 70 mmHg 관류 압력에서 흐름을 시작하고 수술 및 용기 통조림의 나머지 동안이 압력을 유지합니다.
- 대동맥과 다른 혈관에서 폐 동맥을 분리하고 정맥 과 폐 정맥을 제거하십시오. 여전히 존재하는 지방과 결합 조직을 제거하십시오.
- 관상 동맥 의 유량 및 산소 장력의 측정을 제공하기 위해 폐 동맥을 칸넬화.
- 혈액과 수술 파편을 제거하기 위해 준비하는 동안 심장에서 초기 흐름을 폐기하십시오 (약 10 분 동안). 이 기간 이후에 는 향수를 재순환시다.
3. 측면 발사 광섬유 배치
- 광섬유 카테터를 고출력 섬유 결합 LED 백색 광원에 연결하여 시각화를 돕고 심장에 한 번 분광법을 위한 빛을 제공합니다.
- 왼쪽 심방의 작은 부속기를 자르고 승모판막을 통해 좌심실로 카테터를 삽입 한 다음 회전하여 조명된 좌심실 무료 벽을 달성하십시오.
- 픽업 광섬유를 심장에서 약 1cm 떨어진 좌심실의 최대 조명 영역 바로 맞은편에 놓습니다.
- 픽업 파이버의 다른 쪽 끝을 빠른 스캐닝 분광기에 연결합니다.
4. 광학 분광법
- 완전한 어둠을 얻기 위해 실험 영역에서 조명을 끕니다.
- 분광계 드라이버를 통합하여 전송된 광의 데이터 수집 및 실시간 분석을 수행하는 사용자 지정 프로그램을 시작합니다.
참고: 스펙트럼 수집 및 분석 프로그램의 통합 버전의 실행 가능한 버전은 추가 코딩 파일로 제공됩니다. 소스 코드는 작성자 요청에 의해 사용할 수 있습니다. - 모든 프롬프트를 탐색하여 심혼 분광법 획득 모드에 대한 옵션을 선택합니다. 다음 페이지에서 보조 데이터 수집이 발생하는지 여부를 나타냅니다. 마지막으로, 크로모포레스 참조 스펙트럼과 저장할 데이터의 위치를 포함하여 수집 매개변수를 입력합니다.
- 490-630 nm의 대역폭을 입력합니다.
- 2Hz의 샘플링 속도를 입력합니다(예: 초당 2개의 샘플).
- 광원을 끄고 배경 신호 레벨을 보정하기 위해 어두운 전류 또는 제로 라이트 스펙트럼을 수집합니다.
- 피팅 루틴에서 사용하려는 염색체 참조를 선택하려면 클릭합니다.
- 데이터 획득 페이지에서 카테터와 픽업 섬유의 위치를 조정하여 소프트웨어에 표시되는 투과광을 최대화하여 500 nm 영역의 신호 진폭에 특별한 주의를 기울여 산소를 공급한 미오글로빈을 관찰해야 한다.
- 송신된 빛이 600nm 영역에서 검출기를 포화시키지 않는지 확인합니다.
- 카테터 조명을 끄고 이제 빛이 감지되지 않았는지 확인하여 외부 광원이 수집된 스펙트럼에 기여하지 않도록 합니다.
- 스펙트럼 저장 단추를 클릭하여 데이터 수집을 시작합니다.
- 컨트롤로 설정을 클릭하여 향후 스펙트럼에서 현재 "제어" 스펙트럼에 대한 차이 흡광도 스펙트럼을 봅니다.
- 원하는 대로 생리적 교란을 수행합니다.
- 프로토콜 1: 시안화물이 심장 성능과 염색체 흡수에 미치는 영향
- 심장 관류에서 액체를 재순환하는 것을 중단하십시오.
- 주사기 펌프를 사용하여, 시안화물 (pH 7에서 2.5 ~ 75 mM)을 대동맥 캐뉼라 직전에 다른 속도로 주입하여 원하는 농도의 시안화물 (0.025 to 1 mM, 대동맥 유량에서 계산)을 심장으로 흐르는 퍼서에 주입합니다. 심장 기능 및 광학 적 특성을 모니터링합니다.
- 심벽을 통한 광학 전달과 함께 관상 동맥 유동 및 심박수에 미치는 영향이 정상 상태일 때 시안화물 주사기 펌프를 중지합니다.
- 프로토콜 2: 허혈/저산소증
- 시안화물 주입을 중지합니다.
- 5분 후 버블링 가스를 100% 산소에서 100% 질소로 전환하여 시스템에서 산소를 제거합니다.
- 약 10분 후, 전체 허혈성/저산소 상태를 시뮬레이션하기 위해 흐름을 중지합니다.
- 프로토콜 1: 시안화물이 심장 성능과 염색체 흡수에 미치는 영향
5. 스펙트럼 데이터 분석
- 퍼퓨비드 심장 분석 모드에서 프로그램을 실행합니다.
- 적절한 분광계를 선택합니다.
- 데이터 파일 경로 및 참조 스펙트럼 파일을 입력하고 카테터 광원의 미리 저장된 스펙트럼을 로드하는 카테터 광원을 선택합니다.
- 빈 데이터읽기를 선택합니다.
- 최소 및 최대 파장 설정을 선택합니다.
- 데이터 분석을 위한 대역폭을 490-630 nm로 입력합니다.
- 주 메뉴로 돌아가기를선택합니다.
- 참조읽기를 선택합니다.
- 분석에 사용할 참조 스펙트럼을 확인합니다.
- 주 메뉴로 돌아가기를선택합니다.
- 주 메뉴에서 시간 점을 선택합니다.
- T0 시간점을 컨트롤로 선택하고 범위를 100포인트로 설정합니다.
- T1 시점을 100포인트 범위에서 실험 기간으로 선택합니다.
- 평균 복근 스펙트럼 탭에서 원시 차이 스펙트럼을 관찰합니다.
- 맞춤 계수 계산을 선택한 다음 계수 맞춤 탭을 클릭하여 참조 스펙트럼 맞춤의 시간 과정을 관찰합니다.
- 주 메뉴로 돌아가서 차이 복근계산을 선택합니다.
- 모든 위치에서 T0 및 ΔT1을 선택합니다. 차이 스펙트럼 창에서 피팅된 스펙트럼과 기준 중량 창의 피팅 요소를 관찰합니다.
- 이 절차를 반복하여 실험의 다른 시간 점을 비교합니다.
- 메인메뉴로 돌아갑니다.
- 원하는 이름을 입력하고 다른 프로그램과 추가 분석을 위해 데이터 저장을 선택하여 스프레드시트 보고서에 데이터 및 분석을 저장합니다.
참고: 이름을 입력하지 않으면 보고서는 입력 파일과 동일한 이름으로 저장됩니다. 보고서는 원래 입력 파일과 동일한 폴더에 있는 Excel 분석파일이라는 폴더에 저장됩니다.
결과
사용되는 시스템은 작은 동물 관류 심장 시스템을 꺼내지만 토끼 심장과 함께 사용하기 위해 크게 수정되었습니다. 수정은 주로 토끼 심장에 적절한 흐름 전달을 보장하기 위해 모든 튜브의 보어 크기를 증가시키는 것이 되었다. 사용되는 관류 압력에서 네이티브 관류 시스템의 유속이 적어도 5 배에 의해 부착 된 심장으로 흐름을 초과했다는 것을 보장하기 위해 세심한 주의를 기울였습니다. 2-12 μm 기공 멤브레인 필터는 유체 펌프와 대동맥 예압 버블 트랩 챔버 사이에 병렬로 배치되어 심장에서 어떤 이물질을 제거합니다.
토끼 심장에서 전달된 빛
도 1은 카테터의 스펙트럼(도1A)과 토끼 심장 자유벽으로부터 투과된 빛의 원시 스펙트럼을 나타낸다(도1B). 이러한 데이터는 스펙트럼의 청색 영역에서 빛의 매우 큰 감쇠를 드러내지만, 미오글로빈과 미토콘드리아 시토크롬의 흡광도 밴드는 삽입에서 490~580nm 사이에서 직접 관찰할 수 있습니다. 대사 반응하는 심장 크로모포에 대한 정보를 얻기 위해 490에서 630 nm까지 영역에서 충분한 투과 된 빛이 검출되도록하는 것이 이러한 연구에서 중요합니다. 625 nm 영역에서 검출기를 포화시키지 않고 광 강도를 최대화하기 위해 데이터를 저장하기 전에 외부 및 내부 섬유의 위치 조정이 조정됩니다.
참조 는 심장에서 참조 크로모포어의 산화 된 스펙트럼을 뺀.
도 2는 이러한 연구에서 수집된 차이 스펙트럼에 맞게 사용되는 기준 스펙트럼을 제시한다. 이러한 참조는 미오글로빈, 시토크롬 aa3 (대안적으로 시토크롬a 605 및 시토크롬 a607,교란의 종류에 따라22),시토크롬 a580,시토크롬 bL,시토크롬 b H를 포함한다. , 시토 크롬 c,시토 크롬 c 1, FAD, 입사 빛의 흡광도 표현 (체질 빛을 설명하는 데 사용되는 I0,즉, 흡수되지 않고 조직을 통과 한 광자), 및 라인 (다양한 기울기 및 가로채면 도2에 나와 있지 않은 산란을 고려합니다. 일부 스펙트럼은 순수한 기준 물질의 농도가22로매우 낮았기 때문에 시음이 적입니다.
총 실험 중 기준 스펙트럼의 시간 과정
도 3은 프로토콜의 5.15단계에서 계산된 전형적인 실험의 시간 과정을 나타낸다. 이것은 통제 단계, 시안화물 주입 단계, 그 뒤에 시안화물 세척, 탈산소 단계 및 마지막으로 허혈로 이루어져 있습니다. 시간이 지남에 따라 개별 크로모포레 (미오글로빈, 시토 크롬 aa3및 시토 크롬 c)의 변화는 관상 동맥 유량과 함께 시간이 지남에 따라 플롯됩니다. 각 염색체의 광학 밀도 변화는 선형 최소 제곱 루틴 및 염색체의 대표적인 피크(또는 말했다 염색체의 최대 흡광도)로부터 얻어진 맞춤 계수를 곱하여 추정된다. 예를 들어, 미오글로빈의 경우, 미오글로빈 기준의 맞춤 계수에 580 nm에서 미오글로빈 기준 스펙트럼의 값을 곱합니다. 시안화물의 첨가에 미오글로빈의 급속한 산소화는 유량의 증가와 일치하지만 시토크롬의 현저한 감소 전이다. 이 효과는 시안화물의 세척으로 부분적으로 회복됩니다. 마지막으로, 시토 크롬의 전체 감소 및 미오글로빈의 탈산소는 허혈로 얻어진다. 이 데이터는 심혼의 신진 대사 상태에 관하여 동적 데이터가 이 방법론으로 쉽게 장악될 수 있다는 것을 보여줍니다. 차이 스펙트럼에 사용되는 스펙트럼의 위치는 이 코스에서 다음과 같이 표시됩니다: C 기준선, CN 시안화 주입, CNW 시안화물 워시아웃, H N2 저산소증 (산소 대신 이복에 기포되는 질소), 및 HI No 흐름 허혈 (없음) 심장을 통해 흐르는 향수).
토끼 심장에서 시안화 차이 스펙트럼의 제어 및 적합 대 시안화 치료의 차이 스펙트럼.
차이 스펙트럼을 얻으려면 두 개의 절대 스펙트럼이 빼게 됩니다. 각 절대 스펙트럼은 신호 대 잡음 비를 최적화하기 위해 많은(일반적으로 100) 스펙트럼의 평균을 취함으로써 얻어진다. 그림 4 A는 대조군(C) 및 시안화물(CN) 처리된 심장의 차이 스펙트럼을 나타낸다. 그림2에 설명된 참조 스펙트럼을 사용하여 맞춤 스펙트럼이 계산됩니다. 잔류 스펙트럼은 원시 데이터에서 맞춤을 빼는 것입니다. 동일한 구성표는 이후의 모든 스펙트럼 프레젠테이션에 사용됩니다. 그림 4 B는 도 4A에맞게 사용되는 참조 스펙트럼의 스펙트럼 진폭을 제공합니다(그림 2에표시됨). 대부분의 시토크롬의 흡광도의 강한 증가는 사이토크롬 사슬 아래로 전자의 흐름이 일정한 상태에서 시안화물에 의해 차단됨에 따라 관찰된다. 또한, 산소의 소비가 시안화물에 의해 제거됨에 따라 산소화된 미오글로빈의 흡광도가 증가하였습니다. 그림 4 C는 CNW 및 CN에서 차이 스펙트럼의 차이 스펙트럼과 적합도를 제시하여 시안화 효과의 부분 반전을 드러냅니다. 이는 프로토콜 단계 5.18에서 타임포인트를 선택하고 T0을 CNW 및 T1에서 시간 코스의 CN 영역으로 이동시킴으로써 달성되었습니다. 그림 4 D는 HI 및 C의 차이 스펙트럼을 제시하며, 이는 세포졸 및 미토콘드리아의 완전 탈산소 및 감소된 상태를 대조하여 대조군 조건을 나타낸다. 다시, 이것은 프로토콜 단계 5.18에서 수행되었고, T0을 C및 T1에서 HI로 이동했다.
관상 동맥 흐름과 크로모포에 대한 시안화물 효과의 초기 시간 과정
그림 5 A는 조직에 대한 시안화물 효과의 개시의 예를 나타낸다. 관상 동맥 흐름과 함께 미오글로빈, 시토크롬a 605 및 시토크롬 c에 맞는 단일 심장에 대해 제공됩니다. 이러한 시간 과정은 시안화물 실험을 위한 프로토콜 단계 5.15에서 생성되었다. 기준선(위치 1)과 비교한 개별 차이는 그림 5B에나와 있습니다. 스펙트럼은 시간 코스에서 해당 위치 번호(1-4)로부터 생성되었다. 이는 T0이 항상 위치 1에 있는 프로토콜 단계 5.18에서 수행되었으며, 이후에 다른 스펙트럼(2-4)은 T1을 위치 2, 3 및 4로 각각 이동하여 만들어졌습니다. 다소 놀라운 것은 시토크롬 산화 상태의 유의한 변화 이전에 유동및 미오글로빈 산소화가 증가했다는 관측이었다. 흐름 및 염색체 흡광도의 변화의 개시는 기준선으로부터의 초기 변화 속도의 선형 외삽에 의해 추정되었다. 이러한 접근법을 사용하여 관상 동맥 흐름의 변화를 시간 제로로 설정하고, 미오글로빈 산소화의 증가는 유동 변화 후 1.71분 ±0.39분, 시토크롬 a605 및 시토크롬 c 흡광도는 거의 동일하지만 4.24분 ±에서 훨씬 느려졌다. 각각 0.76분 및 4.34분 ±0.77분(n=8). 이 데이터는 시안화물이 심장 근육 신진 대사 상태에 있는 중요한 변경이 생기기 전에 혈관 톤24를 이완한다는 것을 건의합니다. 이 효과 가능성이 심장 근세포 주위 효과적인 복용량에 도달 하기 전에 혈관 평활근 발생 시안화물에 의해 발생.
대조군 심혼에 있는 Myoglobin 산소화의 추정
시안화물 데이터를 완전히 탈산소된 미오글로빈에 대한 총 미오글로빈 산소화 및 허혈 데이터를 추정한 결과, 우리는 통제 조건 하에서 미오글로빈이 88.2% ± 1.0% (n = 10) 산소화되었다고 추정하며, 이전 연구20과 일치합니다. , 21세 , 25.
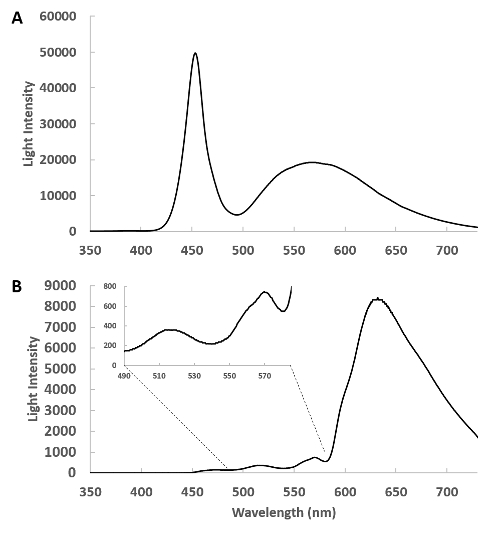
그림 1 : 측면 소성 광학 카테터의 스펙트럼. (A) 이것은 카테터로부터 약 1cm에서 픽업 섬유로 검출된 카테터를 통해 원격 광원으로부터 방출되는 빛의 스펙트럼이다. 이 지오메트리에서는 심장이 없고 광원의 강도가 조정되어 검출기가 포화되지 않습니다. (B) 좌심실에 측면 소성 카테터를 삽입하고 심장으로부터 투과된 빛을 수집하고 도시한다. 인서트가 400~580nm 영역을 확장하여 이 영역에서 빛의 복잡한 투과를 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 스펙트럼 피팅에 사용되는 심장 크로모포의 참조 스펙트럼. 스펙트럼은 다양한 방법을 통해 수집되었다22 감소 – 산화 (시토 크롬에 대한) 및 탈산소 – 산소화 (myoglobin에 대한). I0의경우, 도 1A의 스펙트럼은 단순히 흡광도 용어로 변환되어 참조를 만듭니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : 시간이 지남에 따라 흐름 및 광학 변화. 각 염색체의 광학 밀도 변화(ΔOD)는 단순히 최대 흡광도에서 장착된 개별 염색체의 스펙트럼입니다. 최대 흡광도 주파수는 앞서 설명한대로 20,26이었다. 제시된 시간 과정은 기준선을 보여주는 한 실험에 대한 것이며, 시안화물 주입 (최대 침투 흐름에서 0.10 mM), 시안화물 세척, 질소 저산소증이 산소를 질소로 대체하여 수행된 다음 완전한 허혈을 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
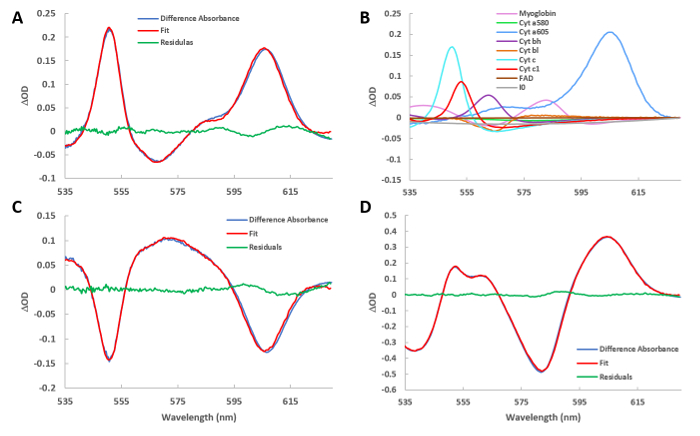
그림 4 : 다양한 조건의 장착 차특성. (A) 시안화물 주입의 스펙트럼에서 기준선을 뺀 값입니다. 최소 제곱 루틴에서 얻은 맞춤 스펙트럼도 플롯됩니다. 잔류 스펙트럼은 원시 스펙트럼과 맞춤 스펙트럼의 차이입니다. (B) 그림 4A에제시된 맞춤을 만드는 데 사용되는 참조 스펙트럼. 이 프로그램은 그림 2의 참조를 현재 차이 스펙트럼의 상대적 기여도로 확장합니다. (c) A에서와 동일하지만 시안화 주입에 비해 세척의 차이 스펙트럼을 나타낸다. (D) A에서와 동일하지만 허혈의 스펙트럼과 기준선의 차이를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5 : 선택한 시토크롬, 미오글로빈 및 심장 흐름에 대한 시안화물 주입 효과의 높은 시간적 분해능. (a) 심장 흐름의 시간 과정, deoxymyogin, 감소 된 시토 크롬 a605,및 감소 된 시토크롬 c. 숫자는 도 5B에서기준선에 비해 촬영 스펙트럼의 위치를 참조. (B) 도5A에 표시된 4개 위치에 대한 차이 스펙트럼 대 제어(위치 1). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
고립 된 역행 또는 작동 관류 심장 준비는 심장 생리학의 연구뿐만 아니라 심장에 기술과 약물의 전임상 조사의 주류입니다. 그것의 사용의 열쇠는 준비의 용이성, 강력한 기능적 특성 및 실험 적 매개 변수의 제어뿐만 아니라 박동 심장의 많은 기능적 매개 변수를 측정 할 수있는 능력이었다. 광학 흡광도 분광법은 미토콘드리아 대사 활동뿐만 아니라 조직 산소화에 대한 통찰력을 제공합니다. 광학 분광법은 주로 움직임과 광 산란 합병증으로 인해 해석하기 어려운 반사 모드에서 분리된 투과 심장 연구에서 수행되었습니다.
우리는 심장 조직 신진 대사 염색체를 모니터링하는 강력한 방법을 제공하기 위해 심실 벽 전달 광학 분광법 (VWTOS)을 도입했습니다. 이전 간행물에서, 우리는 동축 케이블(20)의 끝에 유선 LED가 VWTOS 퍼퓨즈 하트에 사용할 수있는 독특한 심장 내 측면 발사 광원을 만든다는 것을 입증했다. 측면 소성은 카테터의 긴 축에 수직으로 빛의 투영을 말하며, 심실 없는 벽을 조명하는 데 이상적입니다. LED 카테터는 심장 기능에 영향을 미치지 않을 정도로 작지만 실험실에서 특수 제작이 필요했습니다. 현재 연구는 광섬유와 호환되는 모든 광원에 결합 될 수있는 500 미크로네의 상용 측면 발사 카테터의 사용을 제시한다. 이러한 측면 발사 광학 카테터는 섬유의 긴 축에 수직으로 레이저 절제용으로 상업적으로 개발되었다. 당연히 광도화에 필요한 것보다 훨씬 낮은 광전력을 사용하고 있습니다. 더 작은 섬유는 패복 마우스 심장(27)과같은 더 작은 제제에 사용할 수 있다. 이 광섬유 시스템은 심장 염색체가 흡수하는 파장 범위의 심장 벽을 통해 적절한 조명을 제공했습니다 (450-630 nm). 심장 의 외부에 픽업 광섬유를 사용하여, 미오글로빈과 미토콘드리아 시토크롬의 흡광도는 우수한 시간 및 스펙트럼 분해능으로 모니터링 할 수 있습니다 (그림 5참조). 측면 소성 광섬유 접근법은 심장에 카테터의 충격을 최소화하는 카테터의 훨씬 작은 단면 프로파일을 포함하여 VWTOS용 LED 카테터에 비해 몇 가지 장점이 있으며, 심장 판막에 미치는 영향을 보다 유연하게 감소시키고 심실 성능, 식염수 에서 단락 할 수있는 전기 적 연결이 없으며 마지막으로 VWTOS의 광원 선택의 유연성을 증가시키는 외부 광원을 사용하는 카테터.
490 nm 이하의 심장의 강한 흡광도로 인해 340 nm에서 410-445 nm 또는 NADH 의 영역에서 시토 크롬의 소레트 밴드에 많은 정보를 생성하기가 어렵습니다. 따라서, 450 nm에서 FAD의 넓은 흡광도는 관찰되는 가장 낮은 주파수 흡광도이지만, 이 크로모포레스의 전체 흡수 피크는 샘플링되지 않는다. VWTOS를 사용하여 전체 벽이 표면 반사 분광법과 대조적으로 샘플링되기 때문에 신호 대 잡음 비율이 매우 높으며, 일반적으로 사용되는20은수많은 산란 문제로 심장 표면을 샘플링합니다. 전체 심장 벽을 샘플링하는 VWTOS는 31P와 같은 많은 심장 대사 산물의 핵 자기 공명 분광법 (NMRS) 측정과 더 유사하다 아데노신 삼인산과 크레아틴 인산염28, 13C 검출 표지된 대사산물29, 30[31]31,32,1H 검출대사산물33. VWTOS는 비자기 장치를 사용하여 수행 될 수 있기 때문에 NMR과 VWTOS가 동시에 수행 될 수 있다는 것은 완전히 가능합니다. VWTOS는 내인성 크로모포에 국한되지 않으며 pH,Ca2+및 플라즈마 멤브레인 전위를 위한 광학 프로브로부터의 흡수를 모니터링하는 데 사용될 수 있습니다.
우리는 노이즈에 우수한 단일 스펙트럼 신호를 제공하는 2 Hz (즉, 2 샘플 / 초)를 사용합니다. 더 높은 샘플링 속도는 심장 주기 분석을 허용하는 달성될 수 있더라도, 이전 연구 결과는 염색체 흡광도에 있는 변이를 이길 이길 이길 이길 이의 여지가 없다는 것을 보여주었습니다, 그래서 심장 주기의 함수로 선택적으로 빛을 수집하는 아무 노력도 없었습니다 만든34. VWTOS 기하학으로 인해 복잡한 표면 산란 이벤트가 제거되기 때문에 빛의 검출은 반사 방법보다 조직 운동에 덜 의존합니다. 우리는 가혹한 운동이 이 측정을 중단할 수 있다는 것을 것을을 발견합니다, 그러나 실시간 스펙트럼 분석은 조직 염색체 전이와 일치하지 않는 스펙트럼 전이를 빨리 제시합니다. 다시 말하지만, 이것은 심장이 수집 섬유에서 심하게 멀리 움직일 때만 발생하며 수집된 투과된 빛의 양을 극적으로 감소시킵니다.
VWTOS 데이터는 앞서 설명한 바와 같이 심장 크로모포의 스펙트럼 및 광원의 스펙트럼의 참조 라이브러리를 기반으로 전체 스펙트럼 피팅 루틴을 사용하여분석20,22,27, 35는 간단한 선형 최소 제곱 접근 방식입니다. 이 스펙트럼 피팅 절차는 겹치는 흡광도 스펙트럼을 보상하고 "등이 대"파장에 의존하지 않습니다. 이 전체 스펙트럼 분석은 일반적인 이중 빔(즉, 2개의 파장)분석 1,3,6과 관련된 아티팩트를 제거하며, 이는 문제가 있는20으로나타났습니다. 전체 스펙트럼 해석의 추가 적인 장점은 이중 빔 프로토콜에서 사용할 수 없는 잔차에서 적합의 생성입니다.
이 연구에서는 시안화물이 심장의 광학적 특성에 미치는 영향에 중점을 두어 왔습니다. 시안화물블록으로 시토크롬 산화효소는 산소 소비를 억제하고 본질적으로 모든 시토크롬의 순 감소를 초래하며, 전자가 시토크롬 사슬에서 백업됨에 따라 모든 시토크롬의 순 감소를 초래합니다. 그러나, 멤브레인 잠재력은 분명히 높게 남아, bL 및 bH의 산화환원 변화는 시토크롬 c13에비해 매우 작기 때문에. 산소 소비의 중단으로, 조직에 있는 산소 긴장은 향수에 접근해야 하고 우리는 식염수 가 심장을 관념과 일치하는 시안화물로 산소화된 myoglobin에 있는 초기 증가를 주의했습니다, 역행 관류에서조차 모드는 시토졸19,20,21,36에서미오글로빈을 완전히 산소화하지 않습니다. 산소화 된 미오글로빈에 대한 시안화물의 최대 효과를 허혈로 얻은 완전히 탈산소 스펙트럼과 비교하면 이전 연구와 일치하는 약 88 %의 미오글로빈 산소가 밝혀졌습니다.
이 연구에서 는 미오글로빈 산소화 및 시토크롬 감소에 대한 시안화물 효과가 일시적으로 해결되었다는 점에 유의하는 것이 중요합니다. 시안화물의 효과가 먼저 관상 동맥 흐름과 미오글로빈에서 관찰된 후 심장의 시토크롬 산화반소 상태의 큰 변화가 관찰되었다는 것은 놀라운 사실입니다. 흐름의 초기 현저한 증가는 심장 세포에서 총 대사 효과가 관찰되기 전에 동맥 평활근24,37에 대한 효과가 발생할 수 있음을 시사한다. 흐름의 증가, 잠재적으로 겸손한 시안화물 유도 호흡의 감소, 가능성이 산소 전달의 증가에 의해 발생 된 산소화 myoglobin의 즉각적인 증가 결과. 시안화물 억제가 근세포에 확산되면서 관상 동맥 흐름의 추가 증가가 관찰됩니다(도 5에서3으로 표시된 영역 참조), 수많은 대사 인자38에의해 구동될 가능성이 있다. 흐름에 시안화물의 큰 초기 영향은 혈관 평활근의 대사가 근세포의 대사보다 혈관 톤을 변경하는 데 더 강력 할 수 있음을 시사한다. 이러한 데이터는 미오글로빈이 미토콘드리아 레독스 상태의 변화 이전에 잘 발생했기 때문에, 그대로 심장에서도 COX보다 산소에 대한 친화력이 훨씬 낮다는 잘 확립된 개념을 뒷받침한다(그림 5). 제어 조건하에서 탈산소된 미오글로빈의 이 높은 수준은 단리된 식염수 관류가 통제 조건 하에서도 부분적으로 저산소일 수 있음을 시사하는 이전 연구와 일치한다9,19, 20,21,27,36, 심장 생리학에서이 중요한 모델을 사용할 때 심장 조직 산소 화 모니터링의 중요성을 강조합니다.
우리는 여기에서 고립된 관능된 심혼에 전송 흡수 분광학을 수행하기 위한 실험적인 세부사항을 제시합니다. 우리는 성공적으로 얇은 측면 발사 심장 내 광섬유를 사용하여 마우스에 토끼에서 마음에 사용하기 위해이 기술을 적응했다. 최첨단 전체 스펙트럼 피팅 루틴을 활용하여, 심장 크로모포어의 복잡한 광학 상호 작용은 종래와 동시에 심근 대사의 중요한 요소의 거의 실시간 측정 제공, 쉽게 추출 될 수있다 기능 적 조치.
공개
이해 상충이 선언되지 않았습니다.
감사의 말
이 작품은 NHLBI 교내 프로그램 (프로젝트 # ZIA HL00460131)에 의해 완전히 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| BIOPAC data acquisition system | BIOPAC | MP150 | Analog to digitial conversion |
| BIOPAC general purpose transducer amplifiers | BIOPAC | DA100C | Pressure monitoring |
| BIOPAC System skin temperature amplifier | BIOPAC | SKT100B | temperature monitoring |
| Compact Universal 1- and 2- Channel LED Controllers | Mightex | SLC-MA02-U | External light source power supply |
| Disposable pressure sensors | BIOPAC | RX104A | Pressure monitoring |
| Dual Syringe, Infusion Pump | KdScientific | KDS 200 / 200P LEGACY SYRINGE PUMP | drug injection |
| Flow-through probes | Transonic | 4PXN | perusate flow monitoring |
| Glass Syringe | FORTUNA Optima | 30 CC | Air tight fluid injection |
| High power fiber-coupled LED white light source | Mightex | Type-A FCS-0000 | External light source |
| Perfused heart system | Radnoti | 120101BEZ | This system was heavily modified to provide adequate flow (see manuscript) |
| Phase fluorimeter | Ocean Optics | NeoFox-GT | oxygen concentration |
| Pickup fiber optic | Thor labs | BF20HSMA01 | Fiber for collecting transmitted light (pick up fiber) |
| PowerLab unit | AD Instruments | PowerLab 8/35 | Analog to digitial conversion |
| Pressure transducers | BIOPAC | TSD104A | pressure monitoring |
| Programming environment | LABViEW | N/A | Software for driving spectrometer, digitiziing data and analysis. Code available on request |
| Rapid scanning spectrophotometer | Ocean Optics | QE65PRO | Rapid scanning spectrometer for spectral analysis |
| Side firing fiber optic | Polymicro Technologies Molex, LLC 18019 North 25th Av, Phoenic AZ 85023-1200 | JTFLH200230500/1.5M | side firing fiber optic 200 microns core |
| Sodium cyanide | Sigma-Aldrich | 380970 | Metabolic inhibitor |
| Temperature probe | BIOPAC | TSD102A | temperature monitoring |
| Tubing flow modules | Transonic | TS410 | perusate flow monitoring |
참고문헌
- Arai, A. E., Kasserra, C. E., Territo, P. R., Gandjbakhche, A. H., Balaban, R. S. Myocardial oxygenation in vivo: optical spectroscopy of cytoplasmic myoglobin and mitochondrial cytochromes. American Journal of Physiology. 277, 2 Pt 2 683-697 (1999).
- Epstein, F. H., Balaban, R. S., Ross, B. D. Redox state of cytochrome aa3 in isolated perfused rat kidney. American Journal of Physiology. 243 (4), 356-363 (1982).
- Hassinen, I. E., Hiltunen, J. K., Takala, T. E. S. Reflectance spectrophotometric monitoring of the isolated perfused heart as a method of measuring the oxidation-reduction state of cytochromes and oxygenation of myoglobin. Cardiovascular Research. 15, 86-91 (1981).
- Makino, N., Kanaide, H., Yoshimura, R., Nakamura, M. Myoglobin oxygenation remains constant during the cardiac cycle. American Journal of Physiology. 245 (14), 237-243 (1983).
- Takahashi, E., Doi, K. Visualization of oxygen level inside a single cardiac myocyte. American Journal of Physiology. 268, 6 Pt 2 2561-2568 (1995).
- Heineman, F. W., Kupriyanov, V. V., Marshall, R., Fralix, T. A., Balaban, R. S. Myocardial oxygenation in the isolated working rabbit heart as a function of work. American Journal of Physiology. 262, 255-267 (1992).
- Arakaki, L. S., Burns, D. H., Kushmerick, M. J. Accurate myoglobin oxygen saturation by optical spectroscopy measured in blood-perfused rat muscle. Applied Spectroscopy. 61 (9), 978-985 (2007).
- Bose, S., French, S., Evans, F. J., Joubert, F., Balaban, R. S. Metabolic network control of oxidative phosphorylation: multiple roles of inorganic phosphate. Journal of Biological Chemistry. 278 (40), 39155-39165 (2003).
- Tamura, M., Oshino, N., Chance, B., Silver, I. A. Optical measurements of intracellular oxygen concentrations of rat heart in vitro. Archives of Biochemistry and Biophysics. 191, 18-22 (1978).
- Wright, T. J., Davis, R. W. Myoglobin oxygen affinity in aquatic and terrestrial birds and mammals. The Journal of Experimental Biology. 218, Pt 14 2180-2189 (2015).
- Wright, T. J., Davis, R. W. Myoglobin extraction from mammalian skeletal muscle and oxygen affinity determination under physiological conditions. Protein Expression and Purification. 107, 50-55 (2015).
- Shibata, T., et al. Relationship between oxygen affinity and autoxidation of myoglobin. Inorganic Chemistry. 51 (21), 11955-11960 (2012).
- Kim, N., Ripple, M. O., Springett, R. Measurement of the mitochondrial membrane potential and pH gradient from the redox poise of the hemes of the bc1 complex. Biophysical Journal. 102 (5), 1194-1203 (2012).
- Oshino, N., Jamieson, D., Sugano, T., Chance, B. Mitochondrial function under hypoxic conditions: The steady states of cytochrome a,a3 and their relation to mitochondrial energy states. Biochimica et Biophysica Acta. 368, 298-310 (1974).
- Glancy, B., Willis, W. T., Chess, D. J., Balaban, R. S. Effect of calcium on the oxidative phosphorylation cascade in skeletal muscle mitochondria. Biochemistry. 52 (16), 2793-2809 (2013).
- Figulla, H. R., Hoffmann, J., Lubbers, D. W. Evaluation of reflection spectra of the isolated heart by multicomponent spectra analysis in comparison to other evaluating methods. Advances in Experimental Medicine and Biology. 169, 821-830 (1984).
- Hoffmann, J., Lubbers, D. W., Heise, H. M. Applicability of the Kubelka-Munk theory for the evaluation of reflectance spectra demonstrated for haemoglobin-free perfused heart tissue. Physics in Medicine and Biology. 43 (12), 3571-3587 (1998).
- Fabel, H., Lubbers, D. W. Measurements of Reflection Spectra of Beating Rabbit Heart in Situ. Biochemische Zeitschrift. 341 (4), 351(1965).
- Schenkman, K. A., Beard, D. A., Ciesielski, W. A., Feigl, E. O. Comparison of buffer and red blood cell perfusion of guinea pig heart oxygenation. American Journal of Physiology - Heart and Circulatory Physiology. 285 (5), 1819-1825 (2003).
- Femnou, A. N., et al. Intracardiac light catheter for rapid scanning transmural absorbance spectroscopy of perfused myocardium: measurement of myoglobin oxygenation and mitochondria redox state. American Journal of Physiology - Heart and Circulatory Physiology. 313 (6), 1199-1208 (2017).
- Kuzmiak-Glancy, S., et al. Cardiac performance is limited by oxygen delivery to the mitochondria in the crystalloid-perfused working heart. American Journal of Physiology - Heart and Circulatory Physiology. 314 (4), 704-715 (2018).
- Chess, D. J., et al. Optical spectroscopy in turbid media using an integrating sphere: mitochondrial chromophore analysis during metabolic transitions. Analytical Biochemistry. 439 (2), 161-172 (2013).
- Lou, Q., Li, W., Efimov, I. R. Multiparametric optical mapping of the Langendorff-perfused rabbit heart. Journal of Visualized Experiments. (55), (2011).
- Coburn, R. F., Grubb, B., Aronson, R. D. Effect of cyanide on oxygen tension-dependent mechanical tension in rabbit aorta. Circulation Research. 44 (3), 368-378 (1979).
- Schenkman, K. A., Marble, D. R., Burns, D. H., Feigl, E. O. Myoglobin oxygen dissociation by multiwavelength spectroscopy. Journal of Applied Physiology. 82 (1), 86-92 (1997).
- Femnou, A. N., et al. Intracardiac light catheter for rapid scanning transmural absorbance spectroscopy of perfused myocardium: measurement of myoglobin oxygenation and mitochondria redox state. American Journal of Physiology - Heart and Circulatory Physiology. 313 (6), 1199-1208 (2017).
- Giles, A. V., et al. Paradoxical Arteriole Constriction Compromises Cytosolic and Mitochondrial Oxygen Delivery in the Isolated Saline-Perfused Heart. American Journal of Physiology - Heart and Circulatory. , (2018).
- Matthews, P. M., et al. A 31P-NMR study of some metabolic and functional effects of the inotropic agents epinephrine and ouabain, and the ionophore R02- 2985 (X537A) in the isolated, perfused rat heart. Biochimica et Biophysica Acta. 720, 163-171 (1982).
- Lewandowski, E. D., Damico, L. A., White, L. T., Yu, X. Cardiac responses to induced lactate oxidation: NMR analysis of metabolic equilibria. American Journal of Physiology. 269, 1 Pt 2 160-168 (1995).
- Lewandowski, E. D., et al. Multiplet structure of 13C NMR signal from glutamate and direct detection of tricarboxylic acid (TCA) cycle intermediates. Magnetic Resonance in Medicine. 35 (2), 149-154 (1996).
- Ball, D. R., et al. Hyperpolarized butyrate: a metabolic probe of short chain fatty acid metabolism in the heart. Magnetic Resonance in Medicine. 71 (5), 1663-1669 (2014).
- Mariotti, E., et al. Modeling non-linear kinetics of hyperpolarized [1-(13)C] pyruvate in the crystalloid-perfused rat heart. NMR in Biomedicine. 29 (4), 377-386 (2016).
- Pisarenko, O. I., Khlopkov, V. N., Ruuge, E. K. A 1H NMR study of succinate synthesis from exogenous precursors in oxygen-deprived rat heart mitochondria. Biochemistry International. 12 (1), 145-153 (1986).
- Kuzmiak-Glancy, S., et al. Cardiac performance is limited by oxygen delivery to the mitochondria in the crystalloid-perfused working heart. American Journal of Physiology - Heart and Circulatory Physiology. 314 (4), 704-715 (2018).
- Schenkman, K. A., Marble, D. R., Burns, D. H., Feigl, E. O. Myoglobin oxygen dissociation by multiwavelength spectroscopy. American Journal of Physiology. 82 (1), 86-92 (1997).
- Beard, D. A., Schenkman, K. A., Feigl, E. O. Myocardial oxygenation in isolated hearts predicted by an anatomically realistic microvascular transport model. American Journal of Physiology - Heart and Circulatory Physiology. 285 (5), 1826-1836 (2003).
- Paul, R. J. Section II: The Cardiovascular System, Vol II, Vascular Smooth Muscle. Handbook of Physiology. Bohr, D. E., Somlyo, A. P., Sparks, H. V. , American Physiological Society. 201-252 (1980).
- Feigl, E. O. Coronary physiology. Physiological Reviews. 63, 1-205 (1983).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유