Method Article
Laboratoire Remote Management : Diagnostics Virus respiratoire
Dans cet article
Résumé
Un laboratoire-projetables, au loin-grille a été conçu et construit pour paramètres globaux distants, aux ressources limitées. Les caractéristiques et les aspects critiques des modules laboratoire améliorée sur le plan logistique, extensible, multifonctions sont explorés. Une liste de contrôle pour un flux de travail de laboratoire de base et un protocole pour un test de diagnostic respiratoire viral sont mis au point et présenté.
Résumé
Une légère hausse en récente souligne pandémies (Ebola, Zika, MERS, grippe, etc.) la nécessité d’une plus « agile, » coordonné réponse qui aborde une multitude de questions allant de transports, accès, installations, équipements et de la communication au fournisseur formation. Pour répondre à ce besoin, nous avons développé une installation innovante, évolutive, logistique améliorée, mobile, laboratoire d’urgence et les épidémies dans les paramètres globaux aux ressources limitées. Utilisant une formation en opérations cliniques comme un centre médical d’universitaire, nous a conçu une rapidement déployables, modulaire BSL-2 et niveau de biosécurité 3 installation avec le logiciel facile à utiliser pour le suivi et la gestion des médicaments et des fournitures dans les régions éloignées au cours des épidémies et flambées. Nous présentons ici nos unités laboratoire contenant d’expédition intermodal, mobile et extensible. La conception du laboratoire facilite son utilisation hors réseau en minimisant la consommation d’énergie et en permettant des sources d’eau de rechange. Informations de l’unité, plate-forme de communication technology (ICT) fournit une documentation d’axée sur la tablette (i) facile à utiliser, (ii) amélioré de suivi des patients et des fournitures et (iii) intégrées communication sur place avec des capacités de télésanté intégrée. Pour assurer la qualité dans des milieux éloignés, nous avons élaboré une liste de contrôle pour un flux de travail de laboratoire de base et d’un protocole pour le diagnostic respiratoire viral à l’aide de la réaction en chaîne par polymérase de transcription inverse (RT-PCR). Comme indiqué, cette approche globale et innovante permet la fourniture des capacités des laboratoires dans les environnements globales de ressources limitées.
Introduction
Diagnostics rapides est un instrument essentiel dans le contrôle de l’infection virale en temps opportun, surtout si la symptomatologie précoce ne se distingue pas à une variété de maladies de l’infection. La récente épidémie d’Ebola (2014-2015) en Afrique de l’ouest1,2, les épidémies de virus de Zika (2015-2016) en Asie et en Amérique latine,3,4, l’émergence du coronavirus du Syndrome respiratoire Middle East (MERS) les infections5,6et les épidémies d’exceptionnellement mortel grippe (influenza) (2017-2018) dans l’US7,8 mis au jour la nécessité pour les installations de laboratoire rapidement déployables, qui portent sur une multitude de problèmes de transports, accès, installations, équipements et de la communication.
Capacité hors réseau (puissance autonome et l’approvisionnement en eau, etc.) est cruciale dans paramètres globaux rural, aux ressources limitées9,10,11. Notre expérience dans les opérations cliniques et programmes mondiaux au Baylor College of Medicine a été utilisé pour concevoir et construire un laboratoire mobile axées sur le conteneur avec des capacités pour faciliter leur déploiement, installation et utilisation multifonctionnelle (BSL-2 et niveau de biosécurité 3). Images de cette installation de laboratoire polyvalent, sur le plan logistique améliorée est illustré à la Figure 1.
Ce rapidement déployables, laboratoire a un design extensible semblable à la clinique de conteneur décrit précédemment (le « Pod Smart d’urgence »)12,13,14, développé par le Baylor College of Medicine et parrainé par l’USAID. Une seule unité emballée (en Mode de Transport) a des dimensions de 9 pieds 9 pouces x 8 pieds x 8 pieds (Figure 1 a, B) et s’étend à une superficie de 170 pieds carrés (15,75 m2) (Figure 1, D). L’unité peut être déployée par deux à quatre personnes en moins de dix minutes.
Le laboratoire est conçu pour une installation de laboratoire BSL-2 (Figure 2 a) d’une cuisine séparée, modulaire, cintreuse, unité BSL-3 (Figure 2 b) conçu pour le travail avec les agents infectieux qui peuvent causer des maladies graves ou potentiellement mortelles par inhalation et 15. la connectivité des modules deux laboratoire permet l’optimisation des flux de travail expérimentation, partage des ressources et des économies (Figure 2C-E).
Les modules sont étanche à l’air et étanche à l’eau pour créer un confortable, abri mobile efficace de l’énergie. Chauffage, ventilation et climatisation (CVC) système est utilisée pour les unités centralisées et température contrôlée. En général, la conception des unités laboratoire minimise la consommation d’énergie par l’usage de leurs propres sources d’énergie alternative tels que panneaux solaires ou un générateur électrique indépendant. Chaque unité comprend un évier et oculaire, alimentation électrique et connecteurs de l’eau (Figure 3 a-C). La plateforme TIC offre une option, axée sur la tablette (téléphone/tablette Android ou iPhone/iPad) documentation app pour le suivi de l’approvisionnement et de la documentation de résultat de laboratoire (Figure 3D) développé en partenariat avec de Baylor Information Technology (IT) groupe de recherche qui est expérimentée en travaillant dans des environnements distants avec connectivité limitée. Le système peut fonctionner à l’aide de signaux cellulaires ou sans fil et permet la documentation sans connectivité, avec sauvegarde immédiate ou transmission à un serveur de base secure-nuage lorsque la connexion est rétablie.
Le laboratoire dispose de plusieurs fonctionnalités clés de prévention des infections, y compris : (a) négatif de pression air flow, (b) une boîte à gants ou prévention des risques biotechnologiques, (c) une gestion du risque santé système de rangement : un germicide ultraviolet (UV-C) système d’éclairage 4 hiérarchies de défense prouvée pour éliminer 99,7 % des pathogènes qui causent des infections liées aux soins de santé. L’installation est facilement désinfectée à l’aide de peroxyde d’hydrogène ou de l’hypochlorite de sodium (eau de Javel) systèmes de décontamination efficace. 16
L’assurance qualité des résultats des laboratoires repose sur un engagement d’évaluer tous les aspects de la procédure de test diagnostique ensemble. Nous présentons ici une liste de contrôle pour le flux de travail de laboratoire BSL-2 et de niveau de biosécurité 3 et un protocole de test de diagnostic rapide de virus respiratoires. Le projet de diagnostic des maladies virales s’appuie sur la détection d’ARN ou d’ADN viral dans le spécimen (lavage nasal, sang, selles et urine, etc.) par le biais de PCR en temps réel transcription inverse (RT-PCR). La capacité d’estimer rapidement la charge virale dans un échantillon fait PCR un outil efficace pour maladie virale présélection17,18. La mise en œuvre du roman, des épreuves diagnostiques moléculaires permet l’expansion des capacités de diagnostic de virus comme Ebola19,20,21, grippe8,22et la tuberculose (TB )23.
L’objectif de ce travail est de valider une installation nouveau laboratoire modulaire et rapidement déployables et fournir un guide de formation pour le personnel de laboratoire travaillant dans des environnements distants, faibles ressources pendant une épidémie, catastrophe naturelle ou d’autres secours d’urgence situation. Nous présentons ici un protocole pour le diagnostic de grippe respiratoire dans ce laboratoire innovant, portable.
Protocole
1. l’installation
NOTE : Seulement 2-4 personnes sont nécessaires pour déployer l’unité de laboratoire « Lego-like ». Une configuration optimale, 4 individus seraient utilisés pour déployer, mais c’est possible avec seulement 2.
- Utiliser un chariot élévateur (Figure 1 a,B) ou autre dispositif de levage approprié pour gérer le conteneur. Utiliser un chariot élévateur au moins sept tonnes de capacité de levage pour gérer les deux types de conteneurs24.
- Pour mettre en place une unité de laboratoire, sélectionnez un patch d’environ 90 x 60 pieds carrés (27,4 x 18,3 m2) sur un paysage plat pour assurer qu'aucun obstacle n’entrave la mise en page correcte. S’assurer que le site a un sol bien drainé pour assurer le drainage du site car cela pourrait causer des problèmes potentiels avec la dissipation de l’eau après la pluie tombent. Utilisez des motifs qui ont été précédemment nivelé et qui sont dur sol compacté d’une résistance à la compression minimale de 10 kN/dm2. La zone environnante devrait permettre l’accès au matériel nécessaire pour le déchargement de l’unité de son dispositif de transport et accueillir l’équipement de soutien nécessaire pour accomplir la tâche.
- Placez l’unité ou les unités en son Mode « Transport » au centre du site sélectionné et ajuster le niveau. Chaque unité est équipée de quatre prises de mise à niveau pour permettre une implantation sur un site qui a une pente maximale de 6,5 % (~ 4 degrés). L’altitude minimale pour les conteneurs est ~ 6 pouces pour s’assurer que les siphons de sol et les tubulures fonctionnent correctement. N’étendez pas prises plus de 12 pouces. Fixer le support sur le bras du cric. S’assurer que le réservoir est le niveau en plaçant un niveleur de bulle au centre de chaque traverse. Ne développez pas l’unité jusqu'à ce qu’il a été correctement positionné !
- Développez l’unité en ouvrant les panneaux pour ces fonctionnalités. Commencez par rechercher le poteau de soutien en deux pièces. Reliez le pôle de soutien pour que sa hauteur est presque aussi élevé que l’unité du réservoir. Le pôle permet à l’utilisateur d’ouvrir le panneau et de supporter le poids du panneau toit comme on ouvre les portes de côté. Il y a un clip de sécurité qui agit comme une épingle pour tenir les panneaux verrouillés. Retirer le clip de sécurité tout d’abord, puis soulevez et retirez la goupille de verrouillage cam du trou. Placer la goupille derrière le levier et hors de la voie le levier de verrouillage cam situées sur les côtés (extensible) du fond du récipient.
- Levage du toit panneau 1 étant donné que ce panneau a gaz struts et une fois que les portes sont déverrouillées, les boudins sortiront. Cela permettra à l’utilisateur de levage du toit (panneau 1) en utilisant le poteau de soutien en deux pièces. Déplacez la pointe du mât de l’appui sous le panneau de toit pour le soutenir temporairement (Figure 4 a).
- Tout en tenant le panneau de toit avec le soutien de poke, trouver la chaîne de sécurité, situé en haut à gauche du conteneur. Avec l’aide de 2-3 personnes, soigneusement glisser vers le bas de panneau 2 jusqu'à ce que la chaîne de sécurité est droite, avec le poids du panneau 2 et s’est engagé.
- Connectez la courroie de sangle de treuil pour le montage de la patte à la main en l’enroulant autour de l’extérieur du vérin à gaz. Remarque s’il n’y a aucun outil de treuil, l’étape précédente peut être complété manuellement avec au moins deux personnes de chaque côté du panneau manuellement maintenant et abaissant.
Attention : Le poids du panneau est de 260 lb !
- S’assurer il n’y a pas de personnes ou éléments obstacle Panel 2 et à l’aide du treuil et percer, aller de l’avant pour abaisser le panneau (Figure 4 b). Lorsque le panneau 2 est complètement abaissé, couper la sangle de treuil et moulinet il de nouveau dans le treuil. Retirez le treuil et placez-le sur le côté opposé du conteneur en préparation pour l’emploi. Les deux côtés de l’appareil sont identiques et suivent les mêmes étapes ci-dessus pour l’autre côté de l’appareil.
- Pour terminer l’installation de la première face, atteindre au panneau (qui est actuellement le plancher) et avec au moins deux personnes de chaque côté, lever manuellement 3 panneau vers le haut en place car la porte et la façade du côté (Figure 4). Les deux personnes resteront pour tenir le panneau 3, tandis que la troisième personne enlève le poteau de soutien.
Attention : personne ne doit être à l’intérieur de l’unité ou sous le toit jusqu'à ce que le Panel 3 mur est en place ! - Depuis l’intérieur du panneau 3, repérez les deux verrous et les bloquer à l’aide de la sangle de sécurité. Assurez-vous que les joints de caoutchouc noir toit panneau sont arrachées à l’intérieur des unités de visage. Cela doit être fait pour empêcher la pluie et autres infiltrations d’eau dans l’appareil.
- Depuis l’intérieur du conteneur, déverrouiller le panneau 4. Une fois déverrouillé, pousser 4 panneau (Figure 4) afin que lors de l’ouverture comme une porte. Sécurité de verrouillage les deux verrous situés à l’intérieur du mur. 5 panneau de déblocage et répétez les mêmes étapes pour panneau 4. Fixez ce panneau avec même loquets de sécurité interne. Une fois l’intérieur de l’unité entière a été verrouillé, resserrer le tendeur à vis jusqu'à ce que les murs de l’étage et la fin sont scellés.
- Une fois que les deux côtés du conteneur sont développées en toute sécurité, vérifiez les prises et apporter les modifications nécessaires de se déplacer qui aurait pu se produire. Vérifier l’abri pour être de niveau chaque semaine. Après les intempéries (pluie ou vent) inspecter prises sur les conteneurs et ajuster en conséquence.
- Développez le conteneur de second si les modules de laboratoire connectables sont prévues pour une utilisation (Figure 5).
- Connecter les unités de source d’alimentation et d’approvisionnement en eau. Une instruction détaillée sur l’installation d’une génératrice diesel reliée aux unités via un disjoncteur se trouvent dans le manuel selon24.
Remarque : L’unité de laboratoire est maintenant déployée. Le volume intérieur semi-rigide de l’appareil permet de stocker au moins la fourniture de matériel et de laboratoire nécessaire pour les tests de diagnostic particuliers. Installation du système de pressurisation pour BSL-3 module est décrit en détail24 et nécessite un contrôle qualité supplémentaire. 24
2. liste de contrôle pour la protection des personnels et des flux de travail de laboratoire de base
Remarque : Une erreur dans l’une de la sécurité générale et les phases de l’exigence d’essais en laboratoire peut invalider les résultats de tout le processus de test.
- Avant de préparer saisir le laboratoire installé, s’assurer que toutes les exigences de sécurité BSL-2 ou de niveau de biosécurité 3 sont prises en compte : s’habiller avec bon équipement de protection (EPI), se laver les mains, porter des gants et décontamination des espaces de travail doit être utilisé.
- Suivre la liste de vérification dans le tableau 1 qui contient des exigences de sécurité pour protection personnelle au cours de tests effectués dans le laboratoire BSL-2 et le module de niveau de biosécurité 3 (la boîte à gants assemblé chambre - pression négative et salle de PCR - surpression).
- Décontaminer les alimentations en laboratoire et en espace de travail. Si l’intention d’utiliser la solution d’hypochlorite de sodium (0,5 %), également connu sous le nom de Javel, à la décontamination de l’espace de travail et le matériel, utilisez également l’éthanol à 70 % pour nettoyer toutes les zones exposées pour blanchir, comme l’eau de Javel peut mélanger avec d’autres produits chimiques dans l’espace de travail pour créer des fumées toxiques. Jeter tous les produits de l’eau de Javel dans leur propre poubelle désigné.
- Avant de commencer à travailler à l’unité de laboratoire, se familiariser avec son agencement et mise en page. Des règles strictes s’appliquent pour le traitement des échantillons dans la salle de la boîte à gants (GB). La chambre de GB est une pression négative ! Pour utiliser une boîte à gants, vérifiez les instructions du fabricant. Plusieurs sources fournissent des tutoriels détaillés sur la boîte à gants opération25.
Remarque : Le but de ce test est d’extraire et de purifier l’acide ribonucléique (ARN) ou l’acide désoxyribonucléique (ADN), le cas échéant, d’après des échantillons. L’ARN/ADN extraite sera testée par une RT-PCR en temps réel pour détecter la présence ou l’absence de pathogènes viraux ciblées - influenza (INF).
3. diagnostics de virus de grippe rapide par RT-PCR dans un laboratoire BSL-2
- Recevoir et d’enregistrer
- Appliquer la liste de contrôle pour EPI (voir Section 2). INF est un agent de classe 2, nécessitant une pratique BSL-2. Les EPI approprié pour la pratique de la BSL-2 est nécessaire. En outre, porter des lunettes de sécurité et revers manches blouses pour minimiser l’exposition potentielle de la peau.
- Selon l’organisation mondiale de la santé (OMS) recommandations26, utilisez le Dacron stérile ou écouvillons rayonne avec tige plastique pour l’échantillonnage dans les voies respiratoires.
NOTE : Coton écouvillons d’alginate de calcium ou de tampons avec des bâtons en bois peuvent contenir des composés qui inhibent la PCR inactivent certains virus test26,27. - Comme écouvillons échantillon proviennent de patients, les transporter à l’installation du laboratoire de champ ou de la clinique. Échantillons de transfert via la fenêtre de transmission ; impossible d’ouvrir cette fenêtre des deux côtés.
- Dans la fenêtre pass-through, pulvériser les tubes contenant les échantillons avec eau de Javel pendant 1 min, suivie de l’éthanol à 70 % et essuyer afin d’assurer la décontamination adéquate avant d’entrer dans l’appareil de laboratoire. Suite à la submersion, le technicien de laboratoire à l’intérieur de l’unité ouvrira la fenêtre pass-through et recueillir les échantillons dans le conteneur d’eau de Javel à enregistrer. Habituellement, la personne faire passer l’échantillon et l’extraction de l’échantillon ne sont pas les mêmes.
- Ouvrez la fenêtre pass-through et collecter les échantillons pour être enregistré. Essuyez tous les échantillons qui ont été désinfectés à l’eau de Javel et l’éthanol. Nettoyer l’intérieur de la fenêtre pass-through avec eau de Javel suivie de solution d’éthanol à 70 %. Enregistrer un échantillon dans le système interactif basé sur tablette ou un ordinateur portable. Identifier un échantillon avec les informations suivantes :
-Date de collection
-Date de début
-Sexe et âge patient
-Type d’échantillon (p. ex.., écouvillon nasal)
-Uniques identifiers
-Tout autre renseignement pertinent - Utiliser des codes à barres pour l’étiquetage des tubes. Ajouter code à barres à chaque tube d’échantillon et quatre tubes vides désignés pour parties aliquotes. Déplacez les échantillons à la hotte de ventilation. Analyser un code à barres sur chaque tube et s’assurer que les informations d’identification d’échantillon approprié apparaissent sur l’écran de portable ou système axée sur la tablette. Si des codes à barres ne sont pas disponibles, utilisez un marqueur résistant à l’alcool. Toujours marquer le flacon lui-même, jamais le bouchon comme ceci peut obtenir passé lors de la manipulation ! Compléter le processus d’inscription.
- Aliquote d’échantillon
- Une fois que les éprouvettes ont été étiquetées, utiliser une armoire de biosécurité certifiée classe 2 pour manipuler les échantillons et faire des aliquotes d’échantillons. Une aliquote peut être utilisée pour les tests immédiats et les autres retenues pour fin de référence ou de nouveaux essais.
- Que les spécimens arrivent avec l’embout nasal dans le milieu de transport viral, attiser l’embout de l’écouvillon dans le milieu pour 30 s et presser contre le côté de la cuvette. Puis retirez-le de la moyenne et la jeter avec un protocole déchets matières infectieuses (convenablement jeter, autoclave ou accrocher dans la solution de chlore de 1/100).
NOTE : Le plus petit volume de liquide qui doit être conservé est de 0,5 mL. Ainsi, un échantillon de 3 mL peut être divisé en six parties aliquotes (sous-échantillons). Utiliser 1 mL cryo-stockage tube pour chaque échantillon de 0,5 mL à fournir volume supplémentaire pour les moyennes surgelées. - Lorsque vous prenez des aliquotes, utiliser des pipettes jetables ou stériles fraîches pour chaque échantillon et jetez-les dans les conteneurs à déchets biologiques afin d’éviter la contamination croisée. Assurez-vous que chaque tube est hermétiquement scellé et fermé.
- Utiliser une aliquote par spécimen pour l’extraction immédiate et stocker n’importe quel autres aliquotes dans le congélateur (à-80 ° C, car il est un spécimen respiratoire) pour une utilisation future.
- Avant de passer à la station de travail, nettoyer toutes les surfaces de l’espace de travail et équipement avec eau de Javel suivie de solution d’éthanol à 70 %.
- Extraction et purification
- Qui garantit une qualité d’essai, déménagement le barcoded PCR échantillon aliquotes de spécimen manutention zone pour le poste de travail (armoire de sécurité BSL-2) désigné pour l’extraction. Cette armoire de sécurité dispose d’un ensemble distinct de pipettes pour le traitement de l’échantillon.
- Utilisez le kit de mini ARN viral pour l’extraction des échantillons d’ARN. Suivez les instructions du fabricant pour la purification d’ARN viral par protocole de spin. Préparer le mélange maître selon le nombre d’échantillons qui doivent être extraites. Laissez le mélange principal tampon échantillon et lyse à température ambiante.
- Préparer le nombre d’échantillons qui doivent être extraites. Étiqueter les 1,5 mL tubes à centrifuger-micro avec les numéros de codes à barres ou un identificateur unique.
- Ensemble la pipette à 560 µL. appliquer une pointe de pipette propre. Ajouter 560 µL de la mémoire tampon de lyse dans chaque tube marqué. Jeter le bout. Appliquer une pointe de pipette propre. Ajouter 140 µL de l’échantillon. Jeter le vieux et appliquer une pointe de pipette propre. Répéter l’opération avec l’autre échantillon. Appliquer une pointe de pipette propre. Ajouter 140 µL de tampon tube témoin négatif. Fermez solidement chaque tube.
- Impulsion-vortex échantillon 1 aliquote avec le tampon de lyse pour 15 s. Repeat avec échantillon aliquote 2 et le tube de contrôle. Micro centrifugeuse-chaque échantillon pour 5 s. incuber les échantillons pendant 10 min à température ambiante.
- Après 10 min d’incubation, re-centrifuger les tubes pour enlever des gouttes d’à l’intérieur de chaque couvercle du tube. Ajouter 560 µL de solution d’éthanol à l’échantillon. Changer l’embout de la pipette. Répéter l’opération avec des échantillons restants ou supplémentaires. Bien fermer chaque tube d’échantillon et impulsion-vortex chaque échantillon pour 15 s. Micro-centrifuger les échantillons pendant 5 s.
- Appliquer le mélange sur la colonne. Obtenir des tubes de prélèvement propre de 2 mL. Ajouter des colonnes à centrifuger et marquez-les pour faire correspondre les échantillons. Transfert 630 µL de l’échantillon à la colonne correspondante, en conséquence.
- Fixer des caps et passer à la centrifugeuse. Répartir uniformément les échantillons dans la centrifugeuse. Centrifuger à 6 000 × g pendant 1 min retirer le tampon de lyse. Retour à la station de travail. Remplacer les tubes de prélèvement. Ajouter le tampon de lyse restants et répétez l’étape de centrifugation. Jeter les tubes de prise aliquote original.
- Jeter l’éluat et laver la colonne avec deux tampons. Appliquer 500 µL de tampon AW1. Répéter l’opération avec chaque échantillon. Remettez en place les bouchons de chaque échantillon et centrifuger à 6 000 × g pendant 1 minute. Répéter l’opération avec le deuxième AW2 tampon et centrifuger à 20 000 x g pendant 3 min.
- Éluer enfin l’ARN en ajoutant le tampon d’élution. Placer la colonne dans un tube propre 1,5 mL, ouvrir la colonne et ajouter 60 µL de tampon AVE. incuber à température ambiante pendant 1 min et centrifuger à 6 000 x g pendant 1 min. Les échantillons sont maintenant prêts pour l’analyse PCR.
- Détection et amplification PCR
- Effectuer l’amplification par PCR dans une zone séparée, désignée pour l’ACP. Procéder à l’amplification par PCR de la cible virale avec protocole PCR pour une procédure selon les instructions du fabricant. Noter, un mélange principal s’effectue à l’aide d’amorces spécifiques virales, sondes, 2 tampons de RT-PCR x et enzyme RT-PCR. Ajouter le mélange maître à plaques ou tubes puis ajouter et mélanger les échantillons individuels (voir Section 4.4).
- La plaque de transfert à la machine PCR et exécuté selon les conditions d’amplification virale cible. Une fois que les échantillons sont chargés sur l’appareil de PCR, il faut environ 90 minutes pour terminer la course.
- Entretien après l’utilisation du matériel
- Effectuer l’entretien régulier et périodique après l’usage de l’équipement selon le tableau 2.
4. diagnostic de virus de grippe rapide par RT-PCR dans un laboratoire de niveau de biosécurité 3
Remarque : Dans des conditions de niveau de biosécurité 3, le protocole expérimental resteront les mêmes, mais des mesures de sécurité aura la priorité au-dessus de toute autre chose. Avant d’entrer dans le laboratoire de niveau de biosécurité 3, regardez par la fenêtre transparente pour être sûr en qu’une pression négative a été établie dans l’unité de la boîte à gants. Il est évident que la pression négative a été établie lorsqu’une balle rose dans un mur est visible.
- Recevoir et d’enregistrer
- Une fois que la pression négative a été mis en place, ouvrez la porte et dans l’appareil. Laver immédiatement les mains et continuez avec le PPE. Demander la liste de vérification EPI et workflow BSL-3 (voir Section 2).
- Procéder à la mise sur la PPE dans l’ordre suivant : sous gants, robe, couvre-chaussures, masque, masque de protection, deuxième paire de gants. Vêtue d’une robe complète qui protège l’ensemble du corps est recommandée.
- Allumez la machine et attendez que la pression dans la boîte à gants pour stabiliser. Utilisez une solution de pulvérisation d’eau de Javel pour décontaminer toutes les zones et les fournitures à utiliser à l’intérieur et à l’extérieur de la boîte à gants. Jeter les déchets eau de Javel dans un récipient seule eau de Javel. Utilisation de l’éthanol 70 % solution pour enlever les points à l’eau de Javel a été utilisée.
- Transférer l’échantillon via la fenêtre pass-through.
Remarque : Avant une chute à passer par la fenêtre, désinfecter les tubes contenant les échantillons en immergeant dans un bain d’hypochlorite pendant 1-2 min. en particulier, pulvériser des échantillons avec une solution d’eau de Javel et laisser seul pendant au moins 1 min transmission avant de recevoir leur à l’intérieur de l’unité BSL-3. La personne en passant de l’échantillon de l’extérieur et la personne qui reçoit, extraction de l’échantillon à l’intérieur du laboratoire BSL-3 faut pas les mêmes. - Recevoir les échantillons à l’intérieur de l’unité BSL-3 et nettoyez-les avant de procéder à l’enregistrement et étiquetage des étapes.
- Enregistrer un échantillon avec le système interactif axée sur la tablette ou un ordinateur portable. Identifier un échantillon avec les informations suivantes (voir la Section 3.1.5).
- Utiliser des codes à barres pour l’étiquetage des tubes. Si des codes à barres ne sont pas disponibles, utilisez un marqueur résistant à l’alcool.
NOTE : Toujours marquer le flacon lui-même, jamais le bouchon car cela peut obtenir activé lors de la manipulation !
- Aliquote d’échantillon
- Une fois que les échantillons sont enregistrés et tubes a été critiquée, placer les échantillons dans la boîte à gants certifiée par l’intermédiaire de la barre d’état verrouillé air pour récupérer les échantillons provenant de l’intérieur de la boîte à gants. Ferme la porte. Ensuite, ouvrez l’autre porte, par le biais de la boîte à gants pour récupérer les échantillons. Ne pas ouvrir les deux portes en même temps. Ouvrez et fermez chaque porte en deux étapes différentes pour les consignes de sécurité. Allumez la lumière UV-C.
- Une fois que les échantillons ont été déplacés en toute sécurité à l’intérieur de la boîte à gants, suivez les étapes décrites précédemment pour créer des aliquotes d’échantillon dans une boîte à gants. Une partie aliquote d’échantillon peut être utilisée pour les tests immédiats et les autres retenues pour fin de référence ou de nouveaux essais. Spécimens arrivent avec l’embout nasal dans le milieu de transport viral. Prendre des échantillons et en mettre un dans chaque flacon. Remuer l’embout de l’écouvillon dans le milieu pour 30 s et presser contre le côté de la cuvette avant désolidarisé du milieu et de l’élimination il utilisant un protocole déchets matières infectieuses (convenablement jeter, autoclave ou accrocher dans la solution de chlore de 1/100).
NOTE : Le plus petit volume de liquide qui doit être conservé est de 0,5 mL, flacons de 1 mL utilisation à cette fin. Ainsi, un échantillon de 3 mL peut être divisé en six parties aliquotes (sous-échantillons). - Utiliser des pipettes jetables ou stériles fraîches pour chaque échantillon et jetez-les comme déchets biologiques dangereuses. Une fois les échantillons aliquotés, placez les échantillons dans le récipient hermétique. Fermer les flacons avec protection et retirer de la boîte à gants.
- Dans la boîte à gants, fermez le sac à déchets biohazard et préparer un nouveau sac à déchets pour éviter la contamination croisée. Décontaminer l’espace de travail de boîte à gants appliquant l’eau de Javel pour 5 min et solution d’éthanol à 70 % par la suite.
- Utiliser une aliquote par échantillon d’analyse immédiate et d’autres stocker au congélateur à-80 ° C, car c’est un spécimen respiratoire. Après décontamination conservent une partie aliquote d’essai, déplacez tous les échantillons de la boîte à gants pour le stockage au congélateur-80 ° C.
- Extraction et purification
- Après décontamination, déplacer les aliquotes d’échantillon avec code à barres nécessaires à l’analyse PCR du spécimen zone de manutention dans la boîte à gants.
- Dans la boîte à gants, effectuez toutes les étapes de la lyse de la procédure d’extraction. Utilisez le kit de mini ARN viral pour l’extraction des échantillons d’ARN selon les instructions du fabricant. Suivez les instructions étape par étape pour la purification d’ARN viral par protocole de spin dans les instructions du fabricant.
- Préparer le nombre d’échantillons qui doivent être extraites. Étiqueter les 1,5 mL tubes à centrifuger micro avec les numéros de codes à barres ou un identificateur unique.
- Ajouter 560 µL de tampon de la lyse à 140 µL de l’échantillon et le pouls vortex. Incuber pendant 10 minutes à température ambiante.
Remarque : La procédure d’inactivation peut varier selon le type de niveau de biosécurité 3 pathogène qui est en cours d’extraction et dans certains cas l’inactivation supplémentaire peut être nécessaire. - Après l’étape de lyse, étroitement les couronnements sur chaque échantillon et placez dans le passage de l’air comprimé verrouillé (si la centrifugeuse est placée à l’extérieur de la boîte à gants). Transférer les échantillons lysés dans l’armoire pour le reste de la procédure de prévention des risques biotechnologiques.
Remarque : La procédure d’extraction et de purification de l’ARN peut être complétée dans la boîte à gants ou dans une boîte à gants suivie par le cabinet de sécurité biologique selon le niveau de biosécurité 3 pathogène et protocoles nécessaires. - Veillez à décontaminer l’espace de travail et le matériel dans la boîte à gants à l’aide de Javel, et 70 % de solution d’éthanol à nettoyer toutes les surfaces exposées précédemment pour blanchir.
- Suivez les étapes dans la Section 3.3.6 - 3.3.10 pour le lavage et la purification de l’ARN.
- Après extraction, transférer les échantillons vers la fenêtre pass-through pour une analyse par PCR.
- Après que les échantillons a été enlevé et transféré, décontaminer l’espace de travail de laboratoire à l’extérieur de la boîte à gants, conformément à l’article 2.
- Avant d’enlever le PPE attendre jusqu'à ce que la circulation de l’air dans l’appareil a atteint en toute sécurité le bon nombre de cycles avant de commencer à retirer le PPE de filtrage. Immédiatement après l’enlèvement et élimination de tous les EPI dans le PPE conteneur à déchets, continuer à se laver les mains dans le laboratoire avec l’eau et du savon avant de quitter l’appareil, conformément à l’article 2.
- Détection et amplification PCR
Remarque : L’amplification PCR s’effectue dans un local séparé désigné pour PCR et liée à la zone de la boîte à gants via la fenêtre pass-through. L’espace de travail et le matériel doit être décontaminés avant le test.- Supprimer les échantillons d’ARN extraits de la fenêtre pass-through.
- Effectuer l’amplification PCR virale cible protocole PCR en une étape. Préparer un mélange maître en utilisant des amorces spécifiques virales, sondes, 2 tampons de RT-PCR x et enzyme RT-PCR. Utiliser un tube de 1,5 mL avec le composant suivant pour chaque série de tests ciblé : eau, amorces et sondes, tampon de x 2 et enzyme RT-PCR. Vortex et spin master mix.
- Aliquote master mix dans chacun des tubes de la bande. Retourner le kit PCR pour l’entreposage à la température recommandée une fois le mélange maître a été établi.
- Ajouter les échantillons individuels dans chacun des tubes de bande en utilisant un embout séparé entre le tube de chaque bande. Faites tourner la plaque de l’échantillon ou les tubes à 1 500 tr/min pendant 1 min. Les échantillons sont prêtes à être chargées dans l’appareil PCR en temps réel.
- Transférer la plaque avec des échantillons à l’appareil de PCR et faire fonctionner la machine selon les conditions d’amplification virale cible. Il faut environ 90 min pour compléter une seule fois.
- Avant la collecte des résultats et en laissant le laboratoire, retirez les EPI et décontaminer adéquatement chaque poste de travail et la préparation pour le prochain test de diagnostic, conformément à l’article 2.
- Entretien après l’utilisation du matériel
- Effectuer l’entretien régulier et périodique après l’usage de l’équipement selon le tableau 2.
NOTE : Le délai global diagnostic est environ 4 heures. Temps d’extraction et de PCR mis en place le temps peuvent varier selon le nombre d’échantillons, et le test de diagnostic peut prendre 4-5 heures ou plus, proportionnellement.
- Effectuer l’entretien régulier et périodique après l’usage de l’équipement selon le tableau 2.
Résultats
L’objectif de cette étude est de démontrer que les installations projetées de laboratoire mobile BSL-2 et de niveau de biosécurité 3 fournissent un environnement adéquat permettant les tests diagnostiques avec résultats représentatifs virus respiratoire identiques aux tests effectués en qualité laboratoires fixes. Les installations de laboratoire sont conçues pour satisfaire aux exigences du critère figurant dans les recommandations d’hygiène et de sécurité au travail (SST). Dès que le laboratoire distant est déployée (Figure 4) et tous les équipements et fournitures sont installés (Figure 5), les tests de laboratoire peuvent être exécutés.
Conformément au laboratoire des procédures de fonctionnement standards, PPE (blouses, chaussures de protection, gants, avancée de masque, des lunettes de protection, etc.) appropriées pour pratique de BSL-2 est nécessaire. Pour la pratique de niveau de biosécurité 3, le module de laboratoire PCR d’une pression négative est équipé d’une boîte à gants certifiée. Les unités de laboratoire sont mis à niveau par les fenêtres extérieures de pass-through pour protéger le personnel à l’étape de la réception de l’échantillon. Le processus d’inscription peut être simplifié avec application tablette développée précédemment (Figure 3D). Autres demandes acceptables qui s’exécutent sur un ordinateur portable peuvent être utilisés aussi bien.
Ce test de diagnostic virus respiratoire particulière peut être effectué dans les modules de laboratoire connectés pour séparer les étapes de la procédure diagnostique exprès pour éviter toute interférence de contamination ou potentiel entre réactifs biochimiques, qui peuvent affecter la résultats des tests. Afin de maximiser la qualité du diagnostic, la pratique du test de diagnostic rapide utilise (i) tant la base laboratoire BSL-2 et la chambre PCR traverse connecté (Section 3) ou (ii) les chambres Go et PCR reliés par fenêtre pass-through (Section 4). Le diagramme du flux de travail laboratoire proposé est présenté sur la Figure 6 et met l’accent sur la protection des personnels. Le diagramme reconnaît l’importance de chaque étape indiquée pour la protection du personnel, surtout si le personnel du laboratoire en région éloignée est formé au minimum.
Le test de diagnostic rapide de la grippe est effectué via la technique RT-PCR. La procédure contient quatre étapes principales. Notez que les espaces de travail individuels sont assignés à chaque étape du protocole.
La première étape consiste à prélever un échantillon et il subdiviser en plusieurs parties aliquotes. Les aliquotes soient marqués avec des codes à barres pour améliorer l’efficacité du contrôle des données et stockés dans le congélateur pour complément d’enquête. La deuxième étape consiste à inactiver un échantillon dans un tampon de lyse par centrifugation et le chauffage. Les premières et deuxième étapes doivent effectuer dans les armoires de la prévention des risques biotechnologiques. Utilisent des ensembles de pipette individuel et du matériel. Un test PCR est proposé sera effectué dans la salle de la PCR, le cas échéant. La troisième étape est la documentation des résultats. La quatrième étape est l’entretien après l’utilisation du matériel et le rappel de la protection des personnes à la fin de l’expérience.
Si l’échantillon est censé être qualifiées de BSL-3 + (e.g.,Ebola, Zika, MERS, TB) l’installation de la boîte à gants doit être utilisée. Dans le laboratoire, la salle GB possède sa propre fenêtre pass-through pour recevoir des échantillons et un ordinateur portable ou tablette pour l’enregistrement de l’échantillon. L’échantillon aliquote et l’inactivation virale doivent être effectuées dans la chambre de la boîte à gants. Éclairage UV-C est recommandé pour éviter la contamination au cours de la procédure. Après inactivation d’un échantillon, d’autres étapes pour le protocole sont semblables au laboratoire de base BSL-2 et test de niveau de biosécurité 3 et suit Checklist partie III (tableau 1, Figure 6).

La figure 1. Prototype usine laboratoire. (A, B) Mode de transport ; (C) mode de déployée : extérieur ; (D) déployée mode : intérieur. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 2 . Schémas. (A), le laboratoire de base BSL-2 ; (B) le niveau de biosécurité 3 module comprend la boîte à gants et les laboratoires PCR, qui ont une fenêtre directe commune pour le transfert de spécimens protégés ; Des installations de laboratoire connectés (C) (A) et (B) avec les utilitaires partagés. (D,E) Photographies des appareils reliés de deux côtés opposés. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

La figure 3. (A) l’intérieur de l’installation de niveau de biosécurité 3 a (1) une fenêtre de transmission, un évier et (2) un poste de lavage oculaire à l’entrée ; (B) connecteurs électriques, connecteurs de l’eau (C) ; (D) logiciel Tablet pour résultat de laboratoire et suivi approvisionnement documentations. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
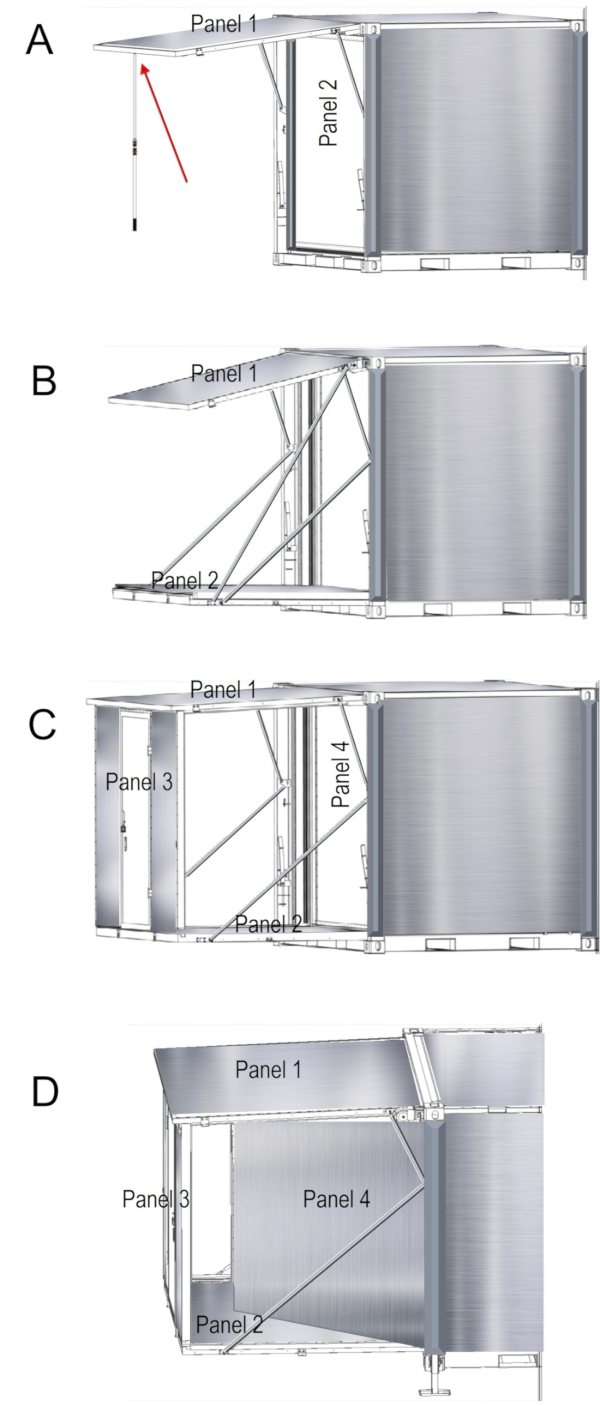
Figure 4 . Déploiement de l’installation du laboratoire. Instruction pour les panneaux qui se déroulent sur un côté de l’appareil, tel qu’illustré (A-D). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
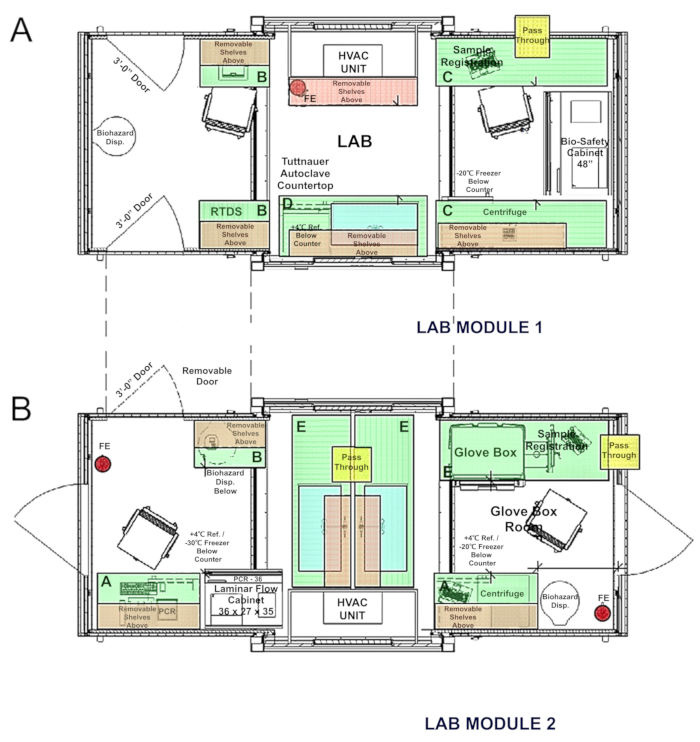
Figure 5 . Schémas du laboratoire connectable : (A) BSL-2 module 1 ; Module 2 boîte à gants (B) et la PCR. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 . Organigramme pour un test de RT-PCR diagnostic virus respiratoire dans les installations de laboratoire distance. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Distance de laboratoire BSL-2 | Distance de laboratoire BSL-3 |
| Partie I | Partie I |
| i. tech laboratoire d’entrer par la porte marquée d’entrée et mis en blouse de laboratoire, ce qui est accroché sur la grille à côté de la porte d’entrée. Chaussures ouvertes sont interdites, les avancées de masque et des lunettes de protection sont encouragés. | i. tech lab se pencher sur la fenêtre de la boîte à gants d’à l’extérieur de l’appareil pour assurer une pression négative est activé. (Balle rose doit être visible dans l’unité pour montrer que la pression négative travaille). |
| II. Lab tech se laver les mains dans l’évier, mettez des gants jetables et commencent par la prise d’échantillons. | II. si une pression négative fonctionne, tech lab pour entrer par la porte seule et mettre sur la blouse de laboratoire, ce qui est accroché sur la grille à côté de la porte d’entrée. Chaussures ouvertes sont interdites, avancées de masque et des lunettes de protection sont souhaitables. |
| III. les échantillons qui ont trempé dans le bain d’hypochlorite avant larguées à fenêtre directe sont assis dans la traversent pour tech lab. | III. Lab tech se laver les mains dans l’évier, mettez des gants jetables, PPE et commencent par la prise d’échantillons. |
| IV. a reçu à la réception de l’échantillon. | IV. les échantillons qui ont été préalablement trempés dans le bain d’hypochlorite avant larguées à passer par la fenêtre sont assis dans la traversent pour tech lab. |
| Partie II | v. a reçu à la réception de l’échantillon. |
| v. Selon procédure diagnostique, spécimens s’installe à la prévention des risques biotechnologiques armoire puis inactivés. | Partie II |
| VI. les échantillons préparée pour la microscopie, centrifugeuse ou pourritures. | VI. les échantillons inactivés dans boîte à gants. |
| VII. les tests de diagnostic a exécuter. | VII. les spécimens exécutés pour l’isolement de l’acide nucléique. |
| VIII. stocker des spécimens à 4° C réfrigérateur ou congélateur approprié. | VIII. après l’extraction, les spécimens s’installe à fenêtre pass-through. |
| Partie III | tech Lab IX. pénètre par l’entrée à côté PCR de l’appareil (pression positive). |
| IX. utiliser le récepteur pour coloration & lavage des éléments. | x. tech Lab pour mettre sur la blouse de rack à côté de l’entrée, se laver les mains dans l’évier, mettez des gants. |
| x. utilisation ordinateur portable & counterpace pour effectuer des analyses et la documentation. | XI. recevoir des échantillons dans les pièces de boîte à gants de fenêtre pass-through. |
| XI. stériliser le matériel par autoclave en cours d’exécution. | XII. si les échantillons nécessaires préparée à flux laminaire. |
| XII. jeter tous les déchets biologiques dangereuses dans le conteneur à déchets biohazard. | XIII. approprié diagnostic tests exécutés. |
| XIII. se laver les mains dans l’évier. | XIV. stocker des spécimens à 4° C réfrigérateur ou congélateur approprié. |
| XIV. raccrocher blouse retour sur la grille. | Partie III |
| XV. sortir par la même porte. | XV. utiliser le récepteur pour coloration & lavage des éléments. |
| XVI. utiliser ordinateur portable & counterpace pour effectuer des analyses et la documentation. | |
| XVII. transférer les flacons dans la fenêtre SQL directe à salle de PCR et stérilisation de l’équipement en exécutant autoclave. | |
| XVIII. jeter tous les déchets biologiques dangereuses dans le conteneur à déchets biohazard. | |
| XIX. se laver les mains dans l’évier. | |
| XX. sortir par la même porte d’entrée. |
Le tableau 1. Liste de vérification pour le workflow de diagnostic PCR.
| Entretien et étalonnage | ||
| Systèmes PCR en temps réel | Mensuel | Étalonnages fond chaque mois |
| 18 mois | Effectuer le fond, spatiale et étalonnages de teinture tous les 18 moise | |
| Centrifugeuse | 1 an | Calibrer pour tours / minute et de la température par le biais de services d’étalonnage externe ou interne |
| Boîte à gants | Tous les jours | Inspecter visuellement les éléments, en particulier pour les dommages sur les surfaces exposées des filtres HEPA, gants, joints et tuyaux. Assurez-vous que conduit pinces sont serrés et en place. Effectuer le test de pression de fuite. Tester l’alarme de pression. |
| 6 mois | Changer le filtre HEPA | |
| 1 an | Calibrer le système | |
| Autoclave | Hebdomadaire | Nettoyer le réservoir d’eau et les grilles à l’aide d’un détergent non abrasif doux |
| 3 mois | Calibrer la minuterie et jauges | |
| 1 an ou tous les 50 cycles | Inspecter, nettoyer, tester et calibrer | |
| Réfrigérateur et Freeezer | 6 mois | Vérifier moteur, évaporateur ventiloconvecteurs, aspirateur condensation bobines et filtres de condenseur et remplacez-les au besoin |
| 1 an | Calibrer le congélateur par le biais de services d’étalonnage interne ou externe | |
Le tableau 2. Entretien de l’équipement des PCR en temps réel.
| Obligatoire | Recommandé |
| Blouse, chaussures de protection, gants | Blouse, chaussures de protection, gants, masques, lunettes de soleil |
| Réfrigérateur 4 ° C, congélateur-20 ° C | Réfrigérateur 4 ° C, congélateur-20 ° C, congélateur-80 ° C |
| Une seule série de pipettes automatiques | Trois séries de pipettes automatiques |
| Centrifugeuse, shaker, thermocycleur | Système robotisé |
| Machine de RT-PCR, bain de glace | RT-PCR avec contrôle de température, glacière sans glace |
| Sacs de déchets Biohazard | Autoclave pour éliminer les déchets de biohazard |
Tableau 3. Exigences minimales pour le virus respiratoire de RT-PCR diagnostic test BSL-2.
Discussion
Le service de laboratoire distant décrit plus haut est axée sur la logistique, extensible, rapidement déployable, multifonctionnel et basée sur des concepts de design centré sur l’homme qui ont été conçus pour protéger l’efficacité du personnel et l’espace de travail de laboratoire. Le protocole détaillé pour la mise en place rapide de laboratoire et l’isolement du virus respiratoires sécuritaire et le diagnostic a été élaboré et présenté.
Pour l’équipement optimal de fonctionnement, les conditions suivantes doivent être maintenues dans les unités de laboratoire : température ambiante de 21 ± 2 ° C, température admissible de 5 à 40 ° C, humidité de 14 ± 5 % HR, l’humidité relative maximale admissible de 80 % RH (sans condensation), et à une altitude comprise entre 0 et 2 000 m d’altitude.
Consommation d’énergie est l’un des paramètres plus importants pour la gestion d’un laboratoire d’au loin-grille. Pour trépans de laboratoire, l’efficacité énergétique peut différer de 15 à 40 % ; Toutefois, la consommation moyenne d’énergie est estimée ici pour offrir un service adéquat. Le taux de puissance plus élevé (1 500 - 2 000 W) concerne le climatiseur, le système de boîte à gants, la machine PCR et le stérilisateur autoclave. Compte tenu des 8 heures de travail accomplies les protocole et 16 heures le contrôle d’environnement de laboratoire, la consommation quotidienne d’énergie des unités du laboratoire est d’environ 36 kWh/jour pour le BSL-2, environ 43 kWh/jour pour BSL-3 et 73 kWh/jour pour les connectés BSL-2/BSL-3 + installations. D’une seule unité, nous vous recommandons de fournir une source d’alimentation électrique avec une capacité de courant continu/course ≥8 kW, surtension/démarrage puissance ≥ 10 kW ; pour l’installation connectée, courant continu/course ≥12 kW et surtension/démarrage ≥14 kW de puissance. Notez, dans le laboratoire de niveau de biosécurité 3, qu'une source d’énergie de sauvegarde est fortement recommandée d’éviter une panne accidentelle et garantir un emploi stable de la boîte à gants et le système de pression négative lors d’un test diagnostique.
Un générateur électrique à essence est une solution économique pour l’approvisionnement énergétique d’urgence. Supposer que la consommation de carburant d’une génératrice à essence est environ 1,5 gallons / heure à 100 % de charge. Ensuite, si la consommation d’énergie quotidienne moyenne est charger 8 heures de 40 % et 16 heures de charge de 10 %, le laboratoire BSL-2 ou niveau de biosécurité 3 est alimenté par 7-9 gallons de carburant par jour, parallèlement, et l’installation connectée a besoin d’environ 15 gal/jour.
Les unités de laboratoire à distance sont conçues pour s’adapter à des systèmes de panneau solaire hors réseau. Panneaux solaires ne nécessitent pas de carburant supplémentaire et peut fonctionner avec une productivité élevée dans les régions tropicales et subtropicales d’Afrique, Asie et Amérique latine en raison de l’irradiation solaire élevée. Actuellement, une unité d’un système disponible dans le commerce de panneau solaire permet une utilisation quotidienne de la puissance de jusqu'à 44 kWh/jour.
Quel que soit le type de source alternative d’énergie électrique, filtres d’électricité sale sont fortement recommandés et préinstallés dans les installations de laboratoire pour améliorer la qualité de l’énergie et de protéger l’équipement de laboratoire. Maintenir le système PCR loin des sources de rayonnements électromagnétiques forts et non blindé car fort rayonnement électromagnétique risquent d’interférer avec le fonctionnement correct de l’appareil. Il est également important n’utilisez pas le système PCR près de fortes vibrations sources, comme une fronde ou une pompe, parce que les vibrations excessives affectera les performances de l’instrument. L’équipement de laboratoire peut-être uniquement être installé dans un environnement qui a non conductrice polluants, comme les particules de poussière ou de copeaux de bois. S’assurer que la chambre est loin de n’importe quel évents qui pourraient expulser des matières particulaires sur les composants de l’instrument.
La consommation d’eau de laboratoire dépend du nombre de tests de diagnostic fonctionnement quotidien et des techniciens de laboratoire travaillant dans l’établissement. Nucléase eau libre est nécessaire pour la préparation des mélangeurs au cours de la procédure diagnostique, notamment l’extraction et le test PCR et doit être livré à l’avance que d’autres fournitures et produits chimiques. Au moins 50 mL d’eau libre nucléase est nécessaire pour exécuter un test de diagnostic ; le volume requis d’eau libre nucléase dépend de la charge de travail (le nombre d’échantillons). L’eau distillée est nécessaire pour exécuter le stérilisateur autoclave. Consommation d’eau en un seul cycle de autoclave est 160-180 mL ; l’autoclave est recommandé pour une utilisation quotidienne. La plupart des matières plastiques (tubes, embouts, etc.) sont jetable, mais certains sont réutilisables et doivent être lavés (grands contenants, supports, etc.). L’eau ordinaire est utilisé pour se laver les mains entre les procédures et son volume minimal est estimé à 15 à 20 L par jour. L’eau doit être pompée à la pression ; système de pré-filtre sédiments est recommandé pour protéger les appareils de l’eau contre les effets néfastes du sédiment et d’améliorer la qualité de l’eau courante.
Pour l’entreposage au froid, au moins un 5,1 pi3 réfrigérateur (+ 4 ° C) et un congélateur de 4,9 pieds cubes (-20 ° C à-30 ° C) sont tenus dans chaque unité de laboratoire pour stocker les échantillons / RNA.
Décontamination de laboratoire comprend plusieurs niveaux : nettoyage > antisepsie > désinfection > stérilisation. Nettoyage simple peut être effectué à l’aide de savon et eau tout en frottant avec une brosse ou une main gantée. Antisepsie comprend le lavage avec chimique liquide antimicrobien afin d’inhiber la croissance et la multiplication des germes. Solutions d’alcool (70 %) peut être utilisé comme un liquide antiseptique. La désinfection est l’application d’un produit chimique liquide pour éliminer presque tous les microorganismes pathogènes (à l’exception des spores bactériennes) sur les surfaces de travail et du matériel. Temps d’exposition aux produits chimiques, température et concentration de désinfectant sont importants. Solution d’hypochlorite de sodium (0,5 %), ou eau de Javel, est un désinfectant efficace à grande échelle pour la purification de l’eau et la purification de surface. L’irradiation ultraviolette germicide est une autre méthode de désinfection. Une lampe germicide produit des rayons UV-C et conduit à l’inactivation des bactéries et des virus. Stérilisation emploie une procédure physique ou chimique pour détruire toute vie microbienne--y compris les spores bactériennes très résistants. La stérilisation peut être effectuée avec un stérilisateur autoclave.
Tous les déchets de laboratoire doivent être séparés au moment de la génération. Place des déchets solides, non tranchants, infectieuses dans des sacs étanches marqués comme biohazard. Si les déchets produits soient forte, il doit être placé dans des contenants résistant à la perforation. Collecter les déchets liquides potentiellement infectieux dans des contenants biorisques correctement étiquetées pour liquides. Conteneurs et sacs de ne devraient pas être remplis plus de 2/3 du volume. La disposition de tous les produits de blanchiment doit être triée dans leur propre poubelle désigné. Déchets de laboratoire doivent être manipulés délicatement pour éviter de générer des aérosols et la rupture des sacs ou contenants. Collection sacs/bacs à déchets biohazard doit être scellés et externes surfaces décontaminés après utilisation avec la solution d’hypochlorite de sodium à 0,5 %. Stériliser tous les déchets de laboratoire en autoclave à 121 ° C pendant 30 minutes avant d’être incinérées. Se référer au manuel de fonctionnement pour la bonne utilisation d’un autoclave. Si possible, ajoutez un indicateur chimique ou biologique à l’autoclave pour stérilisation adéquate. Tous les déchets solides et liquides stérilisés à l’autoclave doivent être clairement étiquetés comme stérilisé à la création, la date, l’heure et l’opérateur. Les déchets étiquetés doivent ensuite être placée dans un quartier sûr et séparé avant d’être incinérées.
Comme prévu, les flux de travail de test de diagnostic dépend de la maladie et le spécimen. Si il est recommandé pour l’identification des virus recueillir des échantillons de sang (p. ex., Ebola19), les portions de l’échantillon peuvent être stockées à-20 ° C au lieu de-80 ° C (nécessaire pour les virus respiratoires). Il est toujours préférable de prendre plus d’un spécimen lors du prélèvement d’un patient qu’aux spécimens de lotir plus tard. Si possible, pour chaque type d’échantillon au moins deux spécimens il faut tubes échantillon distinct. Échantillons doivent être subdivisées si prélèvement supplémentaire n’est pas possible.
Si d’autres spécimens ne peuvent être entreposés à une température appropriée (p. ex., aucun congélateurs ne sont disponibles), écouvillons doivent être stockés en pur (100 %) éthanol ou 99 % alcool dénaturé (additifs méthanol uniquement). Dans ce cas, l’embout doit être mis dans un flacon avec 1 à 2 mL d’éthanol. Notez que ces spécimens ne conviennent qu’aux PCR. Notez également qu’un test bien établi est nécessaire pour chaque virus particulier diagnostic8,23et échantillons de virus inconnus doivent être transmis aux laboratoires affectées pour autres enquêtes19,20, 21.
Exigences obligatoires et recommandées à la liste du matériel de laboratoire pour les tests de PCR diagnostic virus respiratoire doivent être reconnues. Tableau 3 souligne basiques et avancé minimalement matériel (recommandé) et les exigences pour le test de diagnostic de RT-PCR. Pour pratique de niveau de biosécurité 3, protection de pression négative supplémentaire (p. ex., boîte à gants) du personnel est essentiel et nécessaire.
Les modules de laboratoire connectés sont préférables pour augmenter le nombre de personnes impliquées dans les essais en laboratoire et d’accélérer le temps requis pour un seul test. Remplacer l’extraction de l’ARN manuelle fastidieuse est possible avec le qPCR automatisé (par exemple, QiaCube). Bien que cet instrument est lourd (largeur 65 cm, longueur 62 cm, hauteur 86 cm), il peut s’adapter à l’espace de travail de laboratoire mobile après réarrangement des meubles dans BSL-2 ou niveau de biosécurité 3 unités.
Travaux futurs se concentrera sur le développement de la réalité augmentée (AR) et des formations de réalité virtuelle (VR). Les lunettes AR/VR servira à fournir une plateforme interactive pour enseigner les compétences requises pour devenir un travailleur de laboratoire bien formés. Conseils utiles pour effectuer certaines des procédures difficiles, plusieurs étapes dans les tests de diagnostic de laboratoire doivent figurer dans le guide du logiciel. Cette approche de la formation du personnel devrait améliorer la qualité du test diagnostique performance et au laboratoires distants, surtout à distance et les zones de ressources limitées.
Déclarations de divulgation
Baylor College of Medicine est titulaire d’une demande de brevet provisoire aux États-Unis pour les cliniques mobiles (US Patent Application no 15/523 126, # 620078924). Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrente.
Remerciements
Le contenu de cet article ne reflète pas nécessairement les vues ou les politiques de la nous Department of Health and Human Services ou des institutions affiliées avec les auteurs. Cette recherche a été financée par Paul G. Allen Family Foundation « Enhanced sans Impact, Pod Smart d’urgence ». Nous apprécions tous les débats fructueux et collaboration avec les collègues du Baylor College of Medicine, GSS santé, Johnson Space Center de la NASA. Nous sommes sincèrement reconnaissants à Thermo Fisher scientifiques et ses représentants pour un prêt de la machine, centrifugeuse et pipettes automatiques RT-PCR pour effectuer un test de diagnostic de virus respiratoire dans les installations de laboratoire. Les auteurs sont reconnaissants à Marta Storl-Desmond et Sidney Stephen Sorrell pour leur aide dans la rédaction de manuscrits et la vidéographie.
matériels
| Name | Company | Catalog Number | Comments |
| Autoclave Sterilizer 'BioClave' | Benchmark Scientific, Edison, NJ, USA | B4000-16 | 16 liter, Benchtop, Dims: 22x17.5x15.7 in, Fully automatic, Extremely Compact |
| Barcode Scanner | Zebra Technologies ZIH Corp., Lincolnshire, IL, USA | Symbol LS2208 | Handheld, lightweight |
| Breaker Box Panelboard Enclosure | Square D (Schneider Electric), France | MH62WP | NEMA 3R/5/12, Dims: 20 W x 62 H x 6-1/2 in. D, Electrical distribution board |
| Centrifuge - Microcentrifuge 17,000 x g | Thermo Fisher Scientific, Carlsbad, CA, USA | 75002440 | Holds 24 x1.5 or 2 ml tubes, Dims: 8.9x9.6x13.8 in |
| Class II Biological Safety Cabinet | NuAire, Inc., Plymouth, MN, USA | NU-602-400 | 4 Ft. Class II Type A2 Cage Changing Biological Safety Cabinet, 12" Access Opening, HEPEX Pressure Duct |
| Class III Biological Safety Cabinet (Glove box) | Germfree Laboratories, Ormond Beach, FL, USA | Model #PGB-36, Serial #C-2937 | Glove box, Portable, 36", Class III BSC. Dims: 36x20x23.75 in, Includes 2 interior outlets |
| Cryo Coolers | VWR, Radnor, PA, USA | 414004-286 | 0.5 or 1.5 ml tube benchtop coolers |
| Freezer (30°C freezer) | Thermo Fisher Scientific, Carlsbad, CA, USA | Model ULT430A | To occupy 4.9 Cubic feet |
| Laminar Flow Cabinet | NuAire, Inc., Plymouth, MN, USA | NU-126-300 | 3 Ft. Vertical Laminar Airflow Cabinet, 8" Access Opening, HEPA filter supply, 99.99% |
| Mini Centrifuge | Thermo Fisher Scientific, Carlsbad, CA, USA | 75004061 | Dims: 4.1x5.0x6.0 in |
| Pipettes automated | VWR, Radnor, PA, USA | 05-403-151 | Pipet 4-pack (2.5,10, 100 and 1,000μL volume) |
| Pipettes automated 'Finnpipette' | Thermo Fisher Scientific, Carlsbad, CA, USA | 4700880 | Pipet 4-pack (2, 20, 200 and 1,000μL volume), Advanced Volume Gearing(AVG), Ultra durable |
| Power Generator | Cummins Power Generation, Minneapolis, MN, USA | C60 D6 | 60 kW, 60 Hz, 1 Phase, 120/240V, Diesel |
| Refrigerator | BioMedical Solutions, Inc., Stafford, TX, USA | BSI-HC-UCFS-0504W | Standard Undercounter Refrigerators & Freezers |
| Refrigerator | Thermo Fisher Scientific, Carlsbad, CA, USA | 05LRAETSA | To occupy 5.1 Cubic feet |
| RT-PCR machine 'Step-one plus' | Thermo Fisher Scientific, Carlsbad, CA, USA | 4376598 | Holds 96 samples, Dims: 9.7x16.8x20.2 in |
| Vortex Mix | Thermo Fisher Scientific, Carlsbad, CA, USA | 88880017TS | Dims: 6.1x8.3x3.3 in |
| Chemicals | |||
| AgPath-ID One-Step RT-PCR Reagents | Applied Biosystems, Foster City, CA, USA | 4387391 | |
| Ethanol Koptec Pure 200 Proof | Decon Labs, Inc., King of Prussia, PA, USA | V1001 | |
| Nuclease-free Water | Ambion, Inc., Carlsbad, CA, USA | AM9906 | |
| QIAamp Viral RNA Mini Kit | Qiagen, Hilden, Germany | 52906 | |
| SuperScript III Platinum One-Step qRT- PCR Kit | Invitrogen, Carlsbad, CA, USA | 11732-088 | |
| Disposable | |||
| 1 mL cryogenic tubes | Thermo Fisher Scientific, Carlsbad, CA, USA | 03-337-7X | |
| 1.5 mL tubes | VWR, Radnor, PA, USA | 10025-726 | |
| 10 µL Filter Tips | Neptune, VWR, Radnor, PA, USA | Neptune, BT10XLS3 | |
| 20 µL Filter Tips | Multimax, BioExpress, VWR, Radnor, PA, USA | MultiMax, P-3243-30X | |
| 200 µL Filter Tips | ART, Thermo Fisher Scientific, Carlsbad, CA, USA | ART, 2770 | |
| 1000 µL Filter Tips | Phenix Research Products, Candler, NC, USA | TS-059BR | |
| AB custom probes | Thermo Fisher Scientific, Carlsbad, CA, USA | N/A | Custom probes |
| Combitips | Eppendorf, Hauppauge, NY, USA | 89232-972 | |
| Integrated DNA Technology (IDT) custom probes and primer | IDT | N/A | Custom probes |
| MicroAmp Fast Optical 96-Well Reaction Plate | Thermo Fisher Scientific, Carlsbad, CA, USA | 490003-978 CS | |
| MicroAmp Fast Reaction Tubes (8 tubes/strip) | Thermo Fisher Scientific, Carlsbad, CA, USA | 4358293 | |
| MicroAmp Optical 8-Cap Strip | Thermo Fisher Scientific, Carlsbad, CA, USA | 4323032 | |
| MicroAmp Optical Adhesive Film | Thermo Fisher Scientific, Carlsbad, CA, USA | 4311971 | |
| Supplies | |||
| Biohazard waste bags | VWR, Radnor, PA, USA | 14220-046 | 20.3 x 30.5 cm Biohazard bags |
| Gloves | Denville Scientific, Holliston, MA, USA | G4162-250 | Small, meduim or large Nitrile or latex gloves |
| Lab coat | N/A | N/A | Customizable |
| Masks | VWR, Radnor, PA, USA | 414004-663 | Advanced protection mask |
| Protective shoes | N/A | N/A | Customizable |
Références
- World Health Organization (WHO) Ebola Response Team. Ebola virus disease in West Africa - the first 9 months of the epidemic and forward projections. New England Journal of Medicine. 371 (2), 1481-1495 (2014).
- World Health Organization (WHO). . Media Center: Ebola Virus Disease Fact Sheet No. 103. , (2014).
- Fauci, A. S., Morens, D. M. Zika Virus in the Americas - yet another arbovirus threat. New England Journal of Medicine. 374 (7), 601-604 (2016).
- Campos, G. S., Bandeira, A. C., Sardi, S. I. Zika virus outbreak, Bahia, Brazil. Emerging Infectious Diseases. 21 (10), 1885-1886 (2015).
- Aly, M., Elrobh, M., Alzayer, M., Aljuhani, S., Balkhy, H. Occurrence of the Middle East Respiratory Syndrome Coronavirus (MERS-CoV) across the Gulf Corporation Council countries: Four years update. PLoS ONE. 12 (10), e0183850 (2017).
- World Health Organization (WHO). Middle East respiratory syndrome coronavirus (MERS-CoV) - Oman. Media Center: Disease outbreak news. Mar 18. , (2018).
- Ducharme, J., Johnson, D. This flu map shows how the biggest influenza outbreak in years spread across the U.S. Time, Time Health: Public Health. , (2018).
- Gaglani, M., et al. Influenza vaccine effectiveness against 2009 pandemic influenza A(H1N1) virus differed by vaccine type during 2013-2014 in the United States. Journal of Infectious Diseases. 213 (10), 1546-1556 (2016).
- Gates, B. The next epidemic - lessons from Ebola. New England Journal of Medicine. 372 (15), 1381-1384 (2015).
- Mills, A. Health care systems in low- and middle-income countries. New England Journal of Medicine. 370 (15), 552-557 (2014).
- Wölfel, R., et al. Mobile diagnostics in outbreak response, not only for Ebola: a blueprint for a modular and robust field laboratory. Euro Surveillance. 20 (44), 30055 (2015).
- Connelly, S. Through innovation, education and collaboration, Baylor Global Initiatives seeks to transform health and patient care worldwide. TMC Pulse, Global Perspective. , (2015).
- Hersh, D. USAID funds Ebola 'smart pod' project. Federal Times. , (2015).
- Waite, A. Emergency Smart Pods - Transforming Containers into Modern Medical Clinics. DipNote, U.S. Department of State Official Blog. , (2018).
- . . Guide to US Department of Health and Human Services Regulations. , (2015).
- Center for Disease Control and Prevention (CDC). . Website: Clean up after a Disaster. , (2017).
- Flannery, B., et al. Enhanced genetic characterization of influenza A(H3N2) viruses and vaccine effectiveness by genetic group, 2014-2015. Journal of Infectious Diseases. 214 (7), 1010-1019 (2016).
- Spencer, S., et al. Factors associated with real-time RT-PCR cycle threshold values among medically attended influenza episodes. Journal of Medical Virology. 88 (4), 719-723 (2016).
- Cherpillod, P., et al. Ebola virus disease diagnosis by real-time RT-PCR: A comparative study of 11 different procedures. Journal of Clinical Virology. 77, 9-14 (2016).
- Dedkov, V. G., et al. Development and evaluation of a real-time RT-PCR assay for the detection of Ebola virus (Zaire) during an Ebola outbreak in Guinea in 2014-2015. Journal of Virological Methods. 228, 26-30 (2016).
- Cnops, L., et al. Developement, integration of a quantitative reverse-transcription polymerase chain reaction diagnostic test for Ebola virus on a molecular diagnostics platform. Journal of Infectious Diseases. 214 (3), S192 (2016).
- Keitel, W. A., et al. Rapid research response to the 2009 A(H1N1)pdm09 influenza pandemic (Revised). BMC Research Notes. 6, 177 (2013).
- Parsons, L. M., et al. Laboratory diagnosis of tuberculosis in resource-poor countries: challenges and opportunities. Clinical Microbiology Reviews. 24 (6), 314-350 (2011).
- . . Expandable Bicon Shelter. Commercial Manual. Sea Box. , (2019).
- . Lab Safety. Operating the Glovebox. JoVE Science Education Database. , (2018).
- World Health Organization (WHO). . Collecting, preserving and shipping specimens for the diagnosis of avian influenza A(H5N1) virus infection. , (2006).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. Journal of Visualized Experiments. (63), e3998 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon