Method Article
Gerenciamento remoto do laboratório: Diagnósticos de vírus respiratório
Neste Artigo
Resumo
Um laboratório rapidamente destacáveis, fora da rede foi projetado e construído para configurações globais remotas, com recursos limitados. São explorados as características e aspectos críticos dos módulos de laboratório avançado logisticamente, expansível, multifuncional. Uma lista de verificação para um fluxo de trabalho básico de laboratório e um protocolo para um teste de diagnóstico viral respiratório são desenvolvidos e apresentados.
Resumo
Um pequeno aumento na recente sublinha pandemias (Ebola, Zika, MERS, gripe, etc.) a necessidade de um mais 'ágeis' coordenado resposta que aborda uma multiplicidade de questões que vão desde transporte, acesso, instalações, equipamentos e comunicação ao provedor formação. Para atender a essa necessidade, temos desenvolvido um mecanismo de laboratório inovadoras, escalável, logística avançada, móvel, para emergências e epidemias em configurações globais com recursos limitados. Utilizando um fundo em operações clínicas como um centro médico acadêmico, projetamos uma rapidamente destacáveis, modular BSL-2 e BSL-3 instalação com software de fácil utilização para monitoramento e gerenciamento de medicamentos e suprimentos em regiões remotas durante epidemias e surtos. Aqui, apresentamos nossas unidades intermodais, móvel, expansível contentor laboratório. O projeto do laboratório facilita o uso da fora-grade, minimizando o consumo de energia e permitindo que as fontes de água alternativas. Informações da unidade, plataforma de comunicação (TIC) fornece documentação baseada em tablet (i) user-friendly, (ii) aprimorado acompanhamento de pacientes e suprimentos e (iii) integrado no local de comunicação com recursos internos de Telessaúde. Para garantir qualidade em ambientes remotos, nós desenvolvemos uma lista de verificação para um fluxo de trabalho básico de laboratório e um protocolo para diagnóstico viral respiratório, usando a reação em cadeia da polimerase transcrição reversa (RT-PCR). Conforme descrito, esta abordagem inovadora e abrangente permite o fornecimento de capacidade de laboratório em ambientes globais de recursos limitados.
Introdução
Diagnóstico rápido é um instrumento fundamental no controle da infecção viral oportuna, especialmente se a sintomatologia inicial é indistinguível de uma variedade de doenças de infecção. O recente surto de Ebola (2014-2015) na África Ocidental1,2, epidemias de vírus Zika (2015-2016) na Ásia e na América Latina,3,4, o surgimento do coronavirus de síndrome respiratória Oriente (MERS) infecções5,6e as epidemias de gripe invulgarmente mortal (gripe) (2017-2018) em os E.U.7,8 descobriram a necessidade de rapidamente destacáveis, instalações laboratoriais que abordam uma infinidade de problemas de comunicação, acesso, instalações, equipamentos e transporte.
Capacidade da fora-grade (poder autónomo e abastecimento de água, etc.) é crucial no rural, com recursos limitados de configurações globais de10,9,11. Nossa experiência em operações clínicas e programas globais no Baylor College of Medicine foi usada para projetar e construir um laboratório móvel baseada em recipiente com capacidade para facilitar a implantação, instalação e uso multifuncional (BSL-2 e BSL-3). Imagens desta instalação versátil, logisticamente aprimorado laboratório é mostrado na Figura 1.
Neste rapidamente destacáveis, a instalação de laboratório tem um design expansível semelhante para a clínica de contêiner descrito anteriormente (a ' emergência inteligente Pod')12,13,14, desenvolvido pela Baylor College of Medicine e patrocinado pela USAID. Uma única unidade embalada (no modo de transporte) tem as dimensões de 9 pés 9 polegadas x 8 pés x 8 pés (figura 1A, B) e se expande para uma área de 170 pés quadrados (15,75 m2) (Figura 1, D). A unidade pode ser implantada por duas a quatro pessoas em menos de dez minutos.
O laboratório remoto é construído para uma instalação de laboratório BSL-2 (Figura 2A), com um separado, modular, penhorável, unidade BSL-3 (Figura 2B) projetado para trabalho com agentes infecciosos que podem causar doenças graves ou potencialmente letais através da inalação 15. a conectividade dos módulos dois laboratório permite a otimização de fluxos de trabalho de experimentação, compartilhamento de recursos e custos (Figura 2-C-E).
Os módulos são estanques ao ar e à prova d'água para criar um confortável, abrigo móvel eficiente de energia. Aquecimento, ventilação e ar condicionado sistema (AVAC) é usado para unidades centralizadas e temperatura controlada. Em geral, o design das unidades de laboratório minimiza o consumo de energia pelo uso de suas próprias fontes de energia alternativas como painéis solares e/ou um gerador elétrico independente. Cada unidade inclui um coletor e estação de colírio, energia elétrica e conectores de água (Figura 3A-C). A plataforma de TIC oferece um opcional, baseado em tablet (telefone/Tablet Android ou iPhone/iPad) documentação app para abastecimento de acompanhamento e documentação de resultados de laboratório (Figura 3D) desenvolvido em parceria com a Baylor tecnologia da informação (TI) grupo de pesquisa que é bem experiente em trabalhar em ambientes remotos com conectividade limitada. O sistema pode funcionar usando sinais de celulares ou sem fios e permite a documentação sem conectividade, com reforços imediatos ou transmissão para um servidor baseado em nuvem segura quando a conectividade é restabelecida.
O laboratório conta com várias características de chave de controle de infecção, incluindo: (a) negativo pressão ar fluxo, (b) uma caixa de luva ou biossegurança do armário, (c) um gerenciamento de riscos de saúde sistema: um germicida ultravioleta (UV-C) sistema de iluminação usando 4 hierarquias de defesa comprovada para eliminar a 99,7% de agentes patogénicos que causam infecções relacionadas com cuidados de saúde. A instalação é facilmente desinfectada utilizando sistemas de hipoclorito de sódio (água sanitária) ou peróxido de hidrogênio para descontaminação eficiente e eficaz. 16
A garantia de resultados de laboratório de qualidade depende de um compromisso para avaliar todos os aspectos do processo de teste diagnóstico de totalidade. Aqui, apresentamos uma lista de verificação para o fluxo de trabalho laboratório BSL-2 e BSL-3 e um protocolo para teste de diagnóstico rápido de vírus respiratório. O diagnóstico proposto de doenças virais baseia-se na detecção de ADN ou RNA viral na amostra (lavagens nasais, sangue, fezes e urina, etc.) através da reação em cadeia da polimerase de reverso-transcrição em tempo real (RT-PCR). A capacidade de rapidamente estimar cargas virais em um espécime torna PCR uma ferramenta eficiente para doença viral triagem17,18. A implementação do romance, ensaios de diagnósticos moleculares permite expansão de capacidades de diagnóstico de vírus como o Ebola19,20,21, gripe8,22e tuberculose (TB )23.
O objetivo deste trabalho é validar uma instalação romance laboratório modular e rapidamente destacáveis e fornecer um guia de treinamento para pessoal de laboratório que trabalham em ambientes remotos, poucos recursos durante uma epidemia, desastres naturais ou outras emergências situação. Aqui, apresentamos um protocolo para diagnóstico de gripe respiratória neste laboratório inovador, portátil.
Protocolo
1. instalação
Nota: Apenas 2-4 pessoas são necessários para implantar a unidade de laboratório "Lego-como". Idealmente, 4 indivíduos seriam usados para implantar, mas é possível com apenas 2.
- Utilize uma empilhadeira de garfo (figura 1A,B) ou outro dispositivo de levantamento adequado para lidar com o recipiente. Use uma empilhadeira de garfo pelo menos sete toneladas de capacidade de elevação para lidar com os dois tipos de recipientes24.
- Para montar uma unidade de laboratório, selecione um patch de aproximadamente 90 x 60 pés quadrados (27,4 x 18.3 m2) em uma paisagem plana para garantir que não há obstruções impedem o layout adequado. Certifique-se de que o site tem um solo bem drenado para assegurar a drenagem local pois isso pode causar problemas potenciais com dissipação de água após a chuva cair. Utilize o pó de isso ter sido redistribuído anteriormente e que são de difícil solo compactado de uma força compressiva mínima de 10 kN/dm2. A área circundante deve permitir o acesso aos equipamentos necessários para a unidade de seu dispositivo de transporte de descarga e acomodar os equipamentos de suporte necessários para realizar a tarefa.
- Coloque a unidade ou unidades no seu modo de transporte' ' no centro do site selecionado e ajustar o nível. Cada unidade é equipada com quatro Valetes de nivelamento para permitir a implantação em um site que tem um grau máximo de 6,5% (~ 4 graus). A altitude mínima para os recipientes é ~ 6 polegadas para garantir que os drenos e tubos de descarga funcionem corretamente. Não se estendem tomadas mais de 12 polegadas. Fixe o suporte de apoio para o braço do macaco. Certifique-se de que o recipiente está nível colocando um nivelador de bolha no centro de cada trilho inferior. Não expanda a unidade até que ele tenha sido posicionado corretamente!
- Expanda a unidade, abrindo os painéis para funcionalidade completa. Primeiro localize o polo de apoio de duas peças. Ligue o Polo de apoio para que sua altura é quase tão alta como a unidade de contêiner. O polo permite que o usuário abra o painel e suportar o peso do painel do telhado como as portas estão abertas. Há um clipe de segurança que age como um alfinete para manter os painéis trancados. Retire o grampo de segurança em primeiro lugar, em seguida, levante e puxe o pino de trava de came do buraco. Coloque o pino para trás a alavanca e do caminho a alavanca de bloqueio de came localizado nas laterais (expansível) inferior do recipiente.
- Levante o telhado dos suportes do painel 1, Considerando que este painel tem gás e uma vez que as portas de painel são desbloqueadas, struts irá liberar. Isto permitirá ao usuário levantar o telhado (painel 1) usando o polo de apoio de duas peças. Mova a ponta do polo de apoio sob o painel de telhado temporariamente a apoiá-lo (Figura 4A).
- Enquanto segurando o painel do telhado com o apoio de poke, encontrar a corrente de segurança, localizado na parte superior esquerda do recipiente. Com o auxílio de 2-3 indivíduos, cuidadosamente arraste para baixo o painel 2 até que a corrente de segurança é reto, segurando o peso do painel 2 e dedicou-se.
- Conectar-se a correia de guincho para a montagem do talão manualmente por envolvê-lo em torno do exterior de strut a gás. Observe que se não há nenhuma ferramenta de guincho, etapa anterior pode ser completada manualmente com pelo menos duas pessoas de cada lado do painel segurando e abaixá-la manualmente.
Atenção: O peso do painel é de 260 lb!
- Assegurar que não existem pessoas ou itens no caminho do painel 2 e usando o guincho e perfurar, proceder a baixa do painel (Figura 4B). Quando painel 2 é completamente abaixada, desconecte a cinta de guincho e carretel-lo de volta para o guincho. Remover o guincho e coloque-o no lado oposto do recipiente em preparação para o uso. Ambos os lados da unidade são idênticos e sigam os mesmos passos acima para o outro lado da unidade.
- Para a completa implantação do primeiro lado, alcançar o painel (que é atualmente o chão) e pelo menos duas pessoas de cada lado, manualmente levantar painel 3 para cima no lugar como a porta e a parede frontal do lado (Figura 4). As duas pessoas que permanecerão segurar o painel 3, enquanto a terceira pessoa remove o polo de apoio.
Atenção: ninguém deve ficar dentro da unidade ou sob o teto até o painel 3 parede está no lugar! - De dentro do painel 3, localize as duas presilhas e bloqueá-los no lugar, usando o cinto de segurança. Certifique-se que as juntas de borracha do painel de teto preto são puxadas para rosto dentro das unidades. Isso deve ser feito para evitar a chuva e outra penetração de água na unidade.
- De dentro do recipiente, desbloquear painel 4. Uma vez desbloqueado, expulsar painel 4 (Figura 4) para que ele se abre como uma porta. Segurança do fechamento as duas travas parede interna. Desbloquear painel 5 e repita as mesmas etapas para painel 4. Fixe este painel com travas de segurança interna mesmo. Uma vez que o interior da unidade inteira foi bloqueado, re-apertar o tensor até o chão e paredes estão seladas.
- Uma vez que ambos os lados do recipiente são expandidos com segurança, verifique as tomadas e fazer os ajustes necessários de deslocamento que podem ter ocorrido. Verifique o abrigo para ser nível semanalmente. Depois de condições meteorológicas extremas (chuva ou vento) inspecionar tomadas em recipientes e ajustar de acordo.
- Expanda o contêiner segundo se os módulos de laboratório conectável são planejados para uso (Figura 5).
- Conecte as unidades de fonte de energia e água. Uma instrução detalhada sobre a instalação de um gerador diesel conectado às unidades através de uma caixa de disjuntor pode ser encontrada no manual de acordo com24.
Nota: A unidade remota laboratório agora é implantada. O volume interno não-dobráveis da unidade permite armazenar o mínimo, o fornecimento de equipamentos e laboratório necessário para testes de diagnóstico específico. Instalação de sistema de pressurização para BSL-3 módulo é descrita em detalhe24 e requer adicional de controle de qualidade. 24
2. lista de verificação para proteção pessoal e fluxo de trabalho básico de laboratório
Nota: Um erro em qualquer uma das fases de exigência de exames laboratoriais e segurança geral pode invalidar os resultados de todo o processo de teste.
- Antes de preparar-se para inserir a unidade de laboratório instalado, certifique-se de que todos os requisitos de segurança BSL-2 ou BSL-3 são contabilizados: vestir equipamento de proteção pessoal adequada (PPE), lavar as mãos, usando luvas e descontaminação de quaisquer espaços de trabalho que são para ser usado.
- Siga a lista de verificação na tabela 1 que contém os requisitos de segurança para proteção pessoal durante testes executados no laboratório BSL-2 e o módulo de BSL-3 (pressão positiva quarto - pressão negativa e PCR sala - a caixa de luva montada).
- Descontaminar todo espaço de trabalho e suprimentos no laboratório. Se planear utilizar solução de hipoclorito de sódio (0,5%), também conhecido como líquido alvejante, para descontaminar a área de trabalho e suprimentos, também usar etanol a 70% para limpar todas as áreas expostas para branquear, como água sanitária pode misturar com outros produtos químicos na área de trabalho para criar gases tóxicos. Elimine todos os produtos de lixívia em seu próprio lixo designado.
- Antes de começar a trabalhar na unidade de laboratório, familiarize-se com o seu arranjo e disposição. Estritas regras aplicam-se para o processamento de amostras na sala de porta-luvas (GB). A sala de GB é a pressão negativa! Para operar um porta-luvas, verifique as instruções do fabricante. Várias fontes fornecem tutoriais detalhados sobre luvas operação25.
Nota: O propósito deste teste é extrair e purificar o ácido ribonucleico (RNA) ou Ácido desoxirribonucleico (DNA), se presente, de espécimes. O DNA/RNA extraído será testado por um RT-PCR em tempo real para detectar a presença ou ausência de patógenos virais alvo - gripe (INF).
3. diagnóstico de vírus de gripe rápida por RT-PCR em uma instalação de laboratório BSL-2
- Receber e registrar
- Aplicar a lista de verificação para PPE (ver secção 2). INF é um agente de classe 2, exigindo práticas BSL-2. EPI apropriado para a prática de BSL-2 é necessário. Além disso, use óculos de segurança e jalecos de manga algemado para minimizar o potencial de exposição da pele.
- De acordo com as recomendações da Organização Mundial de saúde (OMS)26use Dacron estéril ou swabs de rayon com hastes plásticas para amostragem do tracto respiratório.
Nota: Algodão ou cotonetes de alginato de cálcio ou cotonetes com varas de madeira podem conter compostos que inativar alguns vírus e inibem a PCR teste26,,27. - Esfregaço de amostra é extraídos de pacientes, transportá-los para as instalações de laboratório de campo ou clínica. Amostras de transferência através da janela de passagem; Esta janela não pode ser aberta de ambos os lados.
- Na janela do pass-through, pulverizar os tubos contendo as amostras com água sanitária para 1 min, seguido por 70% de etanol e seque a fim de proporcionar a descontaminação adequada antes de entrar a unidade de laboratório. Após a submersão, o técnico de laboratório dentro da unidade irá abrir a janela de passagem e coletar as amostras do recipiente de água sanitária para ser registrado. Geralmente, a pessoa passando a amostra e a extração da amostra não são os mesmos.
- Abra a janela de passagem e coletar as amostras para ser registrado. Limpe qualquer amostras que foram desinfectadas em lixívia e etanol. Limpe o interior da janela do pass-through com lixívia, seguida por solução de etanol 70%. Registre uma amostra dentro de sistema interativo baseado em tablet ou um laptop. Identifica uma amostra com as seguintes informações:
-Data coleção
-Data início
-Sexo e idade paciente
-Tipo de amostra (ex.., swab nasal)
-Exclusivo identificadores
-Outras informações pertinentes - Use os códigos de barras para etiquetar os tubos. Adicione o código de barras para cada tubo de amostra e com quatro tubos vazios designados para alíquotas. Mova as amostras para a capa do respiradouro. Digitalizar um código de barras em cada tubo e verifique se as informações de identificação da amostra adequada aparecem a tela de sistema ou laptop baseado em tablet. Se os códigos de barras não estiverem disponíveis, use um marcador resistente ao álcool. Sempre marca o frasco em si, nunca a tampa como isto pode ficar ligado durante a manipulação! Complete o processo de registro.
- Alíquota de amostra
- Uma vez que os tubos de ensaio foram rotulados, use um gabinete de segurança biológica classe 2 certificado para manipular amostras e fazer alíquotas de amostras. Uma alíquota pode ser usada para testes imediatos e os outros retidos para fins de referência ou refazer o teste.
- Como espécimes chegam com a ponta do swab nasal no meio de transporte viral, agitar a ponta do cotonete no meio por 30 s e aperte-o contra o lado do frasco. Em seguida, removê-lo do médio e elimine-os em com um protocolo de resíduos biológicos perigoso (adequadamente descartar, autoclave ou pendurar em solução de cloro de 1: 100).
Nota: O menor volume de meio que deve ser armazenado é de 0,5 mL. Assim, uma amostra de 3 mL pode ser dividida em seis alíquotas (subamostras). Use tubo de cryo-armazenamento de 1 mL para cada amostra de 0,5 mL para fornecer volume extra para meio congelado. - Quando tomar as alíquotas, usar pipetas estéreis ou descartáveis frescas para cada amostra e descartá-las em contentores de resíduos biológicos perigosos para evitar contaminação cruzada. Certifique-se de cada tubo é hermeticamente selado e fechado.
- Utilizar uma alíquota por espécime para extração imediata e armazenar qualquer outras alíquotas no freezer (a-80 ° C, como ele é um espécime respiratório) para uso futuro.
- Antes de ir para a estação de trabalho, limpe todas as superfícies de trabalho e equipamentos com lixívia, seguida por solução de etanol a 70%.
- Extração e purificação
- Para garantir a qualidade do teste, mover o código de barras da PCR amostra alíquotas de manipulação a área para a estação de trabalho (BSL-2 de segurança) designada para extração de amostra. Esta câmara de segurança tem um conjunto distinto de pipetas para manipulação da amostra.
- Use o kit de mini do RNA viral para extração de amostras do RNA. Siga as instruções do fabricante para a purificação de RNA viral pelo protocolo de rotação. Prepare a mistura principal de acordo com o número de amostras que precisam ser extraídos. Manter a amostra e o lysis buffer mestre mistura à temperatura ambiente.
- Prepare o número de amostras que precisam ser extraídos. Rotule a 1,5 mL tubos de microcentrífuga com os números de código de barras ou o identificador exclusivo.
- Conjunto a pipeta para 560 µ l. aplicar uma ponta de pipeta limpa. Adicione 560 µ l da lise a cada tubo rotulado. Dica de descarte. Aplica uma ponta de pipeta limpa. Adicione 140 µ l da amostra. Descartar o velho e aplique uma ponta de pipetas. Repita com a outra amostra. Aplica uma ponta de pipeta limpa. Juntar 140 µ l de tampão para tubo controle negativo. Feche cada tubo firmemente.
- Pulso-vórtice da amostra 1 alíquota com a Lise para 15 s. repetição com alíquota de amostra 2 e o tubo de controle. Microcentrífuga de cada amostra para 5 s. Incubar as amostras durante 10 minutos à temperatura ambiente.
- Após 10 minutos de incubação, re-centrifuga os tubos para remover quaisquer gotas de dentro de cada tampa do tubo. Adicione 560 µ l de solução de etanol a amostra. Mude a ponta da pipeta. Repita com a colheita de amostras restante ou adicional. Feche cada tubo de amostra com segurança e pulso-vórtice cada amostra para Microcentrífuga de 15 s. as amostras para 5 s.
- Aplique a mistura para a coluna de rotação. Obter limpa mL 2 tubos de colheita. Adicionar colunas de rotação e classificá-los para coincidir com as amostras. Transferi 630 µ l de amostra para a coluna correspondente, em conformidade.
- Fixar as tampas e mover para a centrífuga. Distribua uniformemente as amostras na centrífuga. Centrifugar a 6.000 × g por 1 min remover o tampão de Lise. Retornar para a estação de trabalho. Substitua os tubos para colheita. Adicione o restante do lysis e repita a etapa de centrifugação. Descarte os tubos de amostra alíquota original.
- Elimine o eluato e lavar a coluna com dois buffers de rotação. Aplica 500 µ l de Buffer AW1. Repita com cada amostra. Prenda as tampas de cada amostra e centrifugar a 6.000 × g por 1 minuto. Repita com o segundo Buffer AW2 e centrifugar a 20.000 × g por 3 min.
- Finalmente, Eluir o RNA pela adição de tampão de eluição. Colocar a coluna em um tubo limpo 1,5 mL, abra a coluna e adicionar 60 µ l de Buffer AVE. Incubar à temperatura ambiente por 1 min e centrifugar 6.000 x g por 1 min. As amostras estão agora prontas para análise PCR.
- Deteção e amplificação por PCR
- Execute a amplificação por PCR em uma área separada, designada para o PCR. Realize a amplificação por PCR do viral de destino usando o protocolo PCR para um procedimento de etapa, de acordo com as instruções do fabricante. Note, uma mistura de mestre é feita utilizando primers específicos virais, sondas, buffer de RT-PCR 2 x e enzima de RT-PCR. Adicione a mistura de mestre para placas ou tubos e, em seguida, adicione e misture amostras individuais (ver secção 4.4).
- Transferir a placa para a máquina PCR e executar de acordo com as condições de amplificação viral alvo. Uma vez que as amostras são carregadas o instrumento PCR leva aproximadamente 90 minutos para completar a corrida.
- Manutenção após o uso de equipamento
- Execute a manutenção regular e periódica após o uso de equipamento de acordo com a tabela 2.
4. diagnóstico de vírus de gripe rápida por RT-PCR em uma instalação de laboratório BSL-3
Nota: Em condições de BSL-3, o protocolo experimental permanecerá o mesmo, mas as medidas de segurança terão prioridade acima de tudo. Antes de entrar no laboratório BSL-3, olhe através da janela transparente para ter certeza que pressão negativa foi estabelecida na unidade caixa de luva. É evidente que a pressão negativa tem sido estabelecida quando uma bola-de-rosa em uma parede é visível.
- Receber e registrar
- Uma vez que a pressão negativa tem sido estabelecida, abra a porta e insira a unidade. Lave imediatamente as mãos e então prosseguir com o PPE. Aplicar a lista de verificação para EPI e fluxo de trabalho BSL-3 (ver secção 2).
- Prossiga para vestir EPI na seguinte ordem: sob luvas vestido, tampas da sapata, máscara, protetor facial, segundo par de luvas. Vestindo um vestido completo que protege o corpo inteiro é recomendado.
- Ligar a máquina e permitir que a pressão no porta luvas para estabilizar. Use uma solução de pulverização de água sanitária para descontaminar todas as áreas e suprimentos para ser usado dentro e fora da caixa de luva. Descarte de resíduos de água sanitária em um recipiente único de lixívia. Solução de etanol a 70% de uso para limpar todas as áreas para lixívia tem sido utilizada.
- Transferi a amostra através da janela de passagem.
Nota: Antes da beija na passagem através da janela, desinfectar tubos contendo amostras particularmente submergindo em um banho de hipoclorito para 1-2 min., amostras de pulverizar com uma solução de água sanitária e deixar sozinho pelo menos 1 min e passagem antes de recebê-los dentro da unidade de BSL-3. A pessoa que passa a amostra do exterior e a pessoa que recebe, extrair a amostra dentro de laboratório BSL-3 não deve ser o mesmo. - Receber as amostras dentro da unidade de BSL-3 e limpá-los antes de proceder para o registro e rotulagem passos.
- Registar-se uma amostra com o sistema interativo baseado em tablet ou um laptop. Identificar uma amostra com as seguintes informações (veja a seção 3.1.5).
- Use os códigos de barras para etiquetar os tubos. Se os códigos de barras não estiverem disponíveis, use um marcador resistente ao álcool.
Nota: Sempre marca o frasco em si, nunca a tampa como isto pode ficar ligado durante a manipulação!
- Alíquota de amostra
- Depois de amostras são registradas e tubos tem sido rotulado, coloca as amostras no caixa de luva certificada através a bandeja de ar bloqueado para recuperar as amostras de dentro da caixa de luva. Feche a porta. Em seguida, abra a outra porta, através da caixa de luva para recuperar as amostras. Não abra as duas portas ao mesmo tempo. Abrir e fechar cada porta em duas etapas diferentes para as precauções de segurança. Vire na iluminação UV-C.
- Uma vez que as amostras foram movidas com segurança para o interior do porta-luvas, siga as etapas descritas anteriormente para a criação de alíquotas de amostra em uma caixa de luva. Uma alíquota da amostra pode ser usada para testes imediatos e os outros retidos para fins de referência ou refazer o teste. Espécimes chegam com a ponta do swab nasal no meio de transporte viral. Tirar amostras e coloque um em cada frasco. Agitar a ponta do cotonete no meio por 30 s e aperte-o contra o lado do frasco antes de removê-lo do meio e descarte-lo utilizando um protocolo de resíduos biológicos perigoso (adequadamente descartar, autoclave ou pendurar em solução de cloro de 1: 100).
Nota: O menor volume de meio que deve ser armazenado é de 0,5 mL, frascos de 1 mL uso para esta finalidade. Assim, uma amostra de 3 mL pode ser dividida em seis alíquotas (subamostras). - Usar pipetas estéreis ou descartáveis frescas para cada amostra e descartá-los como resíduos biológicos perigosos. Uma vez que as amostras aliquotadas, mova as amostras em recipiente hermético. Feche os frascos com a proteção e remover da caixa de luva.
- Dentro da caixa de luva, feche o saco de resíduos de risco biológico e preparar uma nova bolsa de resíduos para evitar a contaminação cruzada. Descontaminar o espaço de trabalho caixa de luva aplicando água sanitária por 5 min e solução de etanol 70% depois disso.
- Utilizar uma alíquota por amostra para análise imediata e outros armazenar em freezer a-80 ° C, como um espécime respiratório. Após descontaminação reter uma alíquota para testes, mova todas as amostras, luvas para armazenamento em freezer-80 ° C.
- Extração e purificação
- Após a descontaminação, mova as alíquotas de amostra de código de barras necessárias para análise PCR do espécime manipulação área volta para a caixa de luva.
- Na caixa de luva, execute todas as etapas de Lise para o procedimento de extração. Use o kit de mini do RNA viral para extração de amostras do RNA de acordo com as instruções do fabricante. Siga as instruções passo a passo para a purificação de RNA viral pelo protocolo de rotação nas instruções do fabricante.
- Prepare o número de amostras que precisam ser extraídos. Rotule a 1,5 mL a tubos de centrífuga de micro com os números de código de barras ou o identificador exclusivo.
- Adicione 560 µ l da lise a 140 µ l de amostra e pulso vórtice. Incube durante 10 minutos à temperatura ambiente.
Nota: O procedimento de inactivação pode variar dependendo do tipo de patógeno BSL-3 que está sendo extraído e em alguns casos a inativação adicional pode ser necessária. - Após a etapa de Lise, firmemente selar as tampas em cada amostra e colocar a passagem de ar pressurizado bloqueado (se o centrifugador é colocado fora da caixa de luva). Transferi as amostras lisadas em Biossegurança do armário para o restante do processo.
Nota: O procedimento de extração e purificação de RNA pode ser concluído no porta luvas, ou em uma caixa de luva, seguido pelo gabinete de bio-segurança, dependendo do patógeno BSL-3 e protocolos necessários. - Certifique-se de descontaminar a área de trabalho e suprimentos no porta luvas novamente usando água sanitária, e solução de etanol 70% para limpar todas as áreas expostas anteriormente a lixívia.
- Siga os passos na secção 3.3.6 - 3.3.10 para lavagem e purificação do RNA.
- Após a extração, transferi as amostras para a janela de passagem para análise PCR.
- Depois que as amostras foram retirados e transferidos, descontaminar o espaço de trabalho do laboratório fora da caixa de luva, de acordo com a seção 2.
- Antes de remover o PPE Espere até que a circulação de ar na unidade com segurança atingiu o número correto de filtragem ciclos antes de começar a remover o EPI. Imediatamente após a remoção e eliminação de todos os EPI em EPI recipiente de resíduos, proceder à lavagem de mãos no laboratório com água e sabão antes de sair da unidade, de acordo com a seção 2.
- Deteção e amplificação por PCR
Nota: A amplificação por PCR é realizada em uma área separada designada para PCR e conectado com a área da caixa de luva através da janela de passagem. O espaço de trabalho e o material tem que ser descontaminados antes de um teste.- Remova as amostras de RNA extraídas da janela pass-through.
- Execute a amplificação por PCR do viral de destino usando o protocolo PCR de uma etapa. Prepare uma mistura de mestre utilizando primers específicos virais, sondas, buffer de RT-PCR 2 x e enzima de RT-PCR. Use um tubo de 1,5 mL com o seguinte componente para cada ensaio alvo: água, primers e sondas, buffer de 2 x e enzima de RT-PCR. Vórtice e girar o mestre mix.
- O mestre mix em cada um dos tubos de faixa de alíquota. Retorne o kit PCR para o armazenamento à temperatura recomendada, uma vez que a mistura de mestre foi elaborada.
- Adicione as amostras individuais para cada um dos tubos de tira usando uma dica separada entre cada tubo da tira. Gire a placa da amostra ou tubos a 1.500 rpm durante 1 min. As amostras estão prontas para ser carregado na unidade de PCR em tempo real.
- Transferir a placa com as amostras para o instrumento PCR e executar a máquina de acordo com as condições de amplificação viral alvo. Demora aproximadamente 90 min para completar uma corrida.
- Antes de coletar os resultados e deixar o laboratório, remover o PPE e descontaminar adequadamente cada estação de trabalho e preparação para o próximo teste de diagnóstico, de acordo com a seção 2.
- Manutenção após o uso de equipamento
- Execute a manutenção regular e periódica após o uso de equipamento de acordo com a tabela 2.
Nota: O tempo de retorno total diagnóstico é de aproximadamente 4 horas. Tempo de extração e definir o tempo PCR podem variar dependendo do número de amostras, e o teste de diagnóstico pode levar 4-5 horas ou mais, correspondentemente.
- Execute a manutenção regular e periódica após o uso de equipamento de acordo com a tabela 2.
Resultados
O objetivo deste estudo é demonstrar que as instalações de laboratório móvel de BSL-2 e BSL-3 propostas fornecem ambiente adequado permitindo testes de diagnóstico com resultados representativos vírus respiratório idêntico para testes realizados em alta qualidade laboratórios estacionários. As instalações do laboratório são projetadas para cumprir com os requisitos de teste dados nas recomendações de saúde ocupacional e segurança (SOS). Assim que a instalação do laboratório remoto é implantado (Figura 4) e todos os equipamentos e suprimentos são instalados (Figura 5), testes de laboratório podem ser executados.
Em conformidade com o laboratório os procedimentos operacionais padrão, PPE (jalecos, sapatos de proteção, luvas, avançado, máscara, óculos de proteção, etc.) adequadas para prática de BSL-2 é necessária. Para práticas BSL-3, o módulo do laboratório PCR de pressão negativa é equipado com uma caixa de luvas certificada. As unidades do laboratório são atualizadas pelo windows passagem externas para proteger o pessoal na etapa de recebimento de amostra. O processo de registro pode ser simplificado com previamente desenvolvido aplicativo baseado em tablet (Figura 3D). Outras aplicações aceitáveis que são executados em um computador portátil podem ser usadas também.
Esse teste de diagnóstico de vírus respiratórios em particular pode ser executado nos módulos de laboratório conectado para separar as etapas do processo de diagnóstico com o propósito de evitar a contaminação ou potencial interferência entre reagentes bioquímicos, que pode afetar o os resultados dos testes. Para maximizar a qualidade de diagnóstico, a prática de teste de diagnóstico rápido utiliza (i) tanto o laboratório básico BSL-2 e o quarto PCR transversal conectado (secção 3) ou (ii) os GB e PCR quartos conectados por janela pass-through (secção 4). O diagrama de fluxo de trabalho do laboratório proposto é apresentado na Figura 6 e enfatiza a proteção pessoal. O diagrama reconhece a importância de cada passo indicado para proteção de pessoal, especialmente se o pessoal de laboratório em áreas remotas é minimamente treinado.
O teste de diagnóstico rápido da gripe é realizado através da técnica de RT-PCR. O procedimento contém quatro etapas principais. Observe que os espaços de trabalho individuais são atribuídos para cada estágio do protocolo.
O primeiro passo é obter uma amostra e sub dividi-lo em várias alíquotas. As alíquotas podem ser marcadas com códigos de barras para melhorar a eficácia do controlo de dados e armazenadas no congelador para mais investigações. A segunda etapa é para inactivar uma amostra em tampão de Lise por centrifugação e aquecimento. As primeiras e segunda etapas devem ser efectuadas em armários de biossegurança. Utilize conjuntos de pipeta individual e equipamento. Um teste PCR é proposto a ser realizada na sala de PCR, se disponível. O terceiro passo é a documentação dos resultados. Quarto passo é a manutenção após o uso de equipamento e lembrete de proteção pessoal ao final do experimento.
Se o espécime é esperado para ser classificado como BSL-3 + (e.g.,Ebola, Zika, MERS, TB) a instalação de caixa de luva deve ser usada. No laboratório remoto, o quarto de GB tem sua própria passagem janela para receber amostras e um laptop ou tablet para o registo de amostra. A alíquota de amostra e inativação de vírus devem ser executadas na câmara de luvas. Iluminação UV-C é recomendada para evitar a contaminação durante o procedimento. Após a inativação de uma amostra, mais são etapas para protocolo semelhantes ao laboratório básico BSL-2 e teste de BSL-3 e segue lista de parte III (tabela 1, Figura 6).

Figura 1. Protótipo de instalações laboratoriais. (A, B) Modo de transporte; (C) modo implantados: lá fora; (D) modo implantados: interior. Clique aqui para ver uma versão maior desta figura.

Figura 2 . Os esquemas. (A), o laboratório básico BSL-2; (B) a BSL-3 módulo inclui luvas e laboratórios PCR, que tem uma janela de passagem comum para transferência de amostra protegida; (C) instalações de laboratório conectado (A) e (B) com utilitários compartilhados. (D,E) Fotografias das unidades conectadas de lados opostos. Clique aqui para ver uma versão maior desta figura.

Figura 3. (A) Interior da facilidade BSL-3 tem (1) uma janela pass-through, uma pia e (2) uma estação de colírio na entrada; (B) energia elétrica, conectores de água (C); (D) software baseado em Tablet para resultado de laboratório e controle de fornecimento de documentações. Clique aqui para ver uma versão maior desta figura.
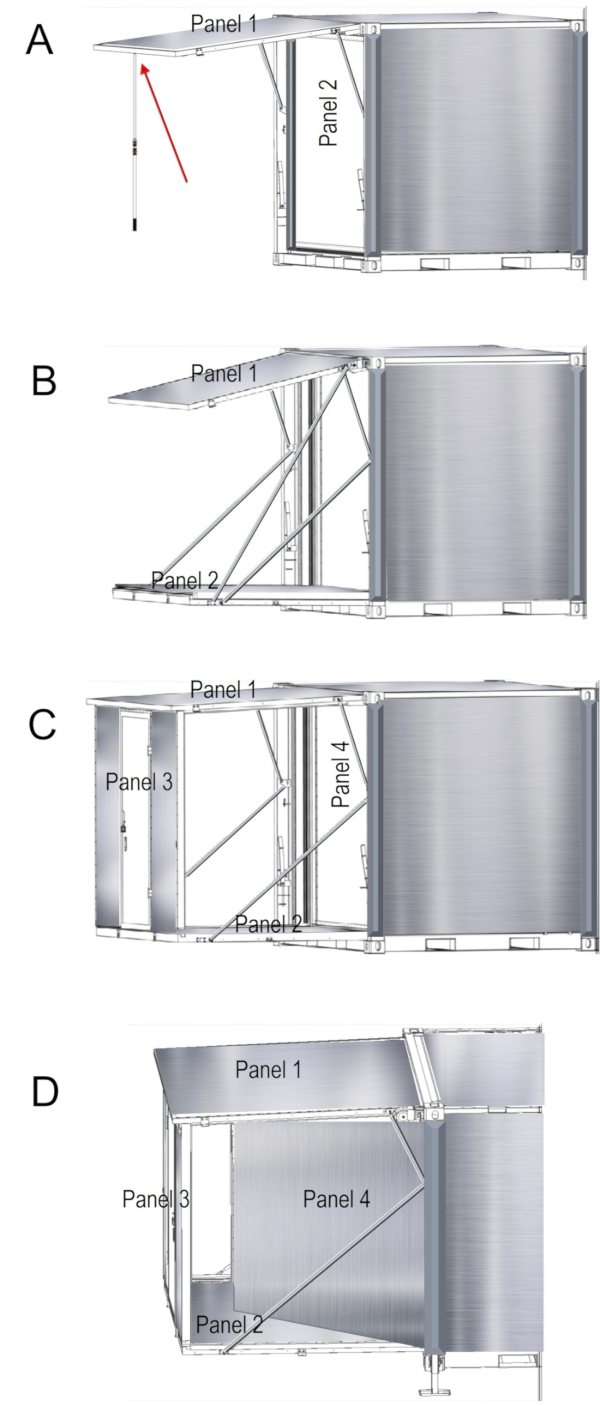
Figura 4 . Implantação das instalações laboratoriais. Instrução para painéis de desdobramento de um lado da unidade, conforme ilustrado (A-D). Clique aqui para ver uma versão maior desta figura.
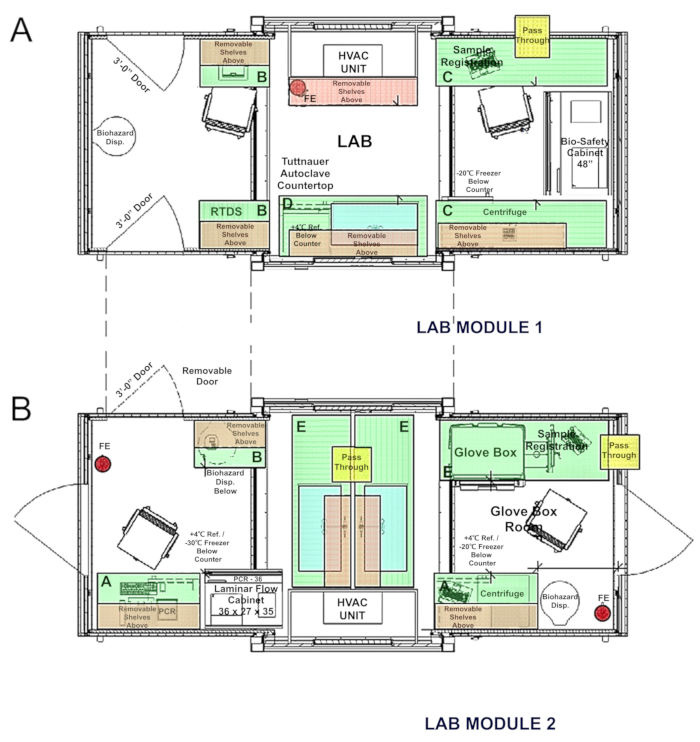
Figura 5 . Esquemas do laboratório conectável: (A) BSL-2 módulo 1; (B) luvas e PCR módulo 2. Clique aqui para ver uma versão maior desta figura.

Figura 6 . Fluxograma para um teste de RT-PCR de diagnóstico de vírus respiratórios na instalação de laboratório remoto. Clique aqui para ver uma versão maior desta figura.
| Laboratório remoto BSL-2 | Laboratório remoto BSL-3 |
| Parte I | Parte I |
| i. técnico de laboratório para entrar pela porta rotulado entrada e veste o jaleco, que está pendurado na prateleira ao lado da porta de entrada. Sapatos abertos são proibidos, avançada máscara e óculos de proteção são incentivados. | i. técnico de laboratório de a olhar para a janela da caixa de luva de fora da unidade para segurar a pressão negativa é ativado. (Bola-de-rosa deve estar visível na unidade para mostrar que a pressão negativa está trabalhando). |
| II. o analista de lavar as mãos na pia, Coloque luvas descartáveis e começar com a ingestão de amostras. | II. se a pressão negativa está funcionando, técnico de laboratório para entrar pela única porta e vestir o jaleco, que está pendurado na prateleira ao lado da porta de entrada. Sapatos abertos são proibidos, avançada máscara e óculos de proteção são desejáveis. |
| III. as amostras que foram mergulhadas em banho de hipoclorito antes beija na janela de passagem estão sentados na passagem para o técnico de laboratório. | III. laboratório técnico para lavar as mãos na pia, Coloque luvas descartáveis, EPI e começar com a ingestão de amostras. |
| IV. recebido na recepção da amostra. | IV. as amostras que foram previamente mergulhadas em banho de hipoclorito antes beija na passagem através da janela estão sentados na passagem para o técnico de laboratório. |
| Parte II | v. recebido na recepção da amostra. |
| v. dependendo do procedimento diagnóstico, espécimes mudou-se para o gabinete de biossegurança e inativada. | Parte II |
| vi. espécimes preparados para microscopia, centrifugação ou apodrece. | vi. as amostras inactivadas no porta-luvas. |
| executar testes de diagnóstico VII. apropriado. | VII. executadas para isolamento de ácidos nucleicos de amostras. |
| VIII. armazenar amostras em geladeira de 4° C ou congelador apropriado. | VIII. após a extração, espécimes mudou-se para a janela de passagem. |
| Parte III | IX. o analista entra pela entrada no lado do PCR da unidade (pressão positiva). |
| IX. Use a pia para coloração & lavagem de itens. | x. técnico de laboratório, vestir a bata de laboratório da prateleira ao lado da entrada, lave as mãos na pia, colocar as luvas. |
| x. usar portátil & counterpace para realizar análises e documentação. | XI. receber amostras de quarto de luvas em janela de passagem. |
| XI. Esterilize equipamentos executando autoclave. | XII. se necessário amostras preparadas em fluxo Laminar. |
| XII. descarte de resíduos biológicos perigosos num recipiente de resíduos de risco biológico. | XIII. apropriado diagnóstico testes executados. |
| XIII. lavar as mãos na pia. | XIV. armazenar espécimes em refrigerador de 4° C ou no congelador apropriado. |
| XIV. Desligue jaleco volta na prateleira. | Parte III |
| XV. saia pela mesma porta. | XV. Use a pia para coloração & lavagem de itens. |
| XVI. usar portátil & counterpace para realizar análises e documentação. | |
| XVII. transferir os frascos para janela de passagem à sala PCR e esterilizar equipamentos executando autoclave. | |
| XVIII. descarte de resíduos biológicos perigosos num recipiente de resíduos de risco biológico. | |
| XIX. lavar as mãos na pia. | |
| XX. saia pela mesma porta de entrada. |
Tabela 1. Lista de verificação para o fluxo de trabalho do diagnóstico PCR.
| Manutenção e calibração | ||
| Sistemas PCR em tempo real | Mensal | Realizar calibrações de fundo todo mês |
| 18 meses | Executar o plano de fundo, espacial e tingir calibrações em 18 meses deth | |
| Centrífuga | 1 ano | Calibrar de rotações por minuto e temperatura através de serviços de calibração interno ou externo |
| Caixa de luva | Diário | Inspecione visualmente os elementos, nomeadamente danos às superfícies expostas do HEPA Filtros, luvas, anéis e mangueiras. Certifique-se de grampos de duto são firme e no lugar. Realize teste de pressão de vazamento. Teste o alarme de pressão. |
| 6 meses | Mudar o filtro HEPA | |
| 1 ano | Calibrar o sistema | |
| Autoclave | Semanal | Limpar o tanque de água e racks com detergente neutro não abrasivo |
| 3 meses | Calibrar o temporizador e bitolas | |
| 1 ano ou a cada 50 ciclos | Inspecionar, limpe cuidadosamente, testar e calibrar | |
| Geladeira e Freeezer | 6 meses | Verificar o motor, bobinas de evaporador ventilador, aspiração de bobinas de condensação e condensador filtros e substitua as pilhas conforme necessário |
| 1 ano | Calibrar o congelador através de serviços de calibração interna ou externa | |
Tabela 2. Manutenção de equipamentos de PCR em tempo real.
| Obrigatório | Recomendado |
| Jaleco, sapatos de proteção, luvas | Jaleco, sapatos de proteção, luvas, máscaras, óculos |
| Frigorífico congelador-20 ° C, 4 ° C | Frigorífico 4 ° C, congelador-20 ° C, congelador-80 ° C |
| Um conjunto de pipetas automáticas | Três conjuntos de pipetas automáticas |
| Centrífuga, agitador, thermocycler | Sistema robótico |
| Máquina de RT-PCR, banho de gelo | RT-PCR com controle de temperatura, livre de gelo do refrigerador |
| Sacos de resíduos de risco biológico | Autoclave para eliminar resíduos de risco biológico |
Tabela 3. Requisitos mínimos para o vírus respiratório de RT-PCR diagnóstico teste BSL-2.
Discussão
O recurso do laboratório remoto descrito acima é logisticamente orientada, expansível, rapidamente destacável, multifuncional e com base em conceitos de design centrado no humano que tem sido orientados para proteger a eficiência pessoal e espaço de trabalho de laboratório. O protocolo detalhado para diagnóstico e isolamento de vírus respiratório seguro e set-up rápido laboratório foi desenvolvido e apresentado.
Para funcionamento de equipamento ideal, as seguintes condições devem ser mantidas nas unidades laboratoriais: temperatura ambiente de 21 ± 2 ° C, temperatura admissível de 5 a 40 ° C, umidade de 14 ± 5% RH, umidade máxima admissível de 80% RH (sem condensação), e uma altitude entre 0 e 2.000 m acima do nível do mar.
Consumo de energia é um dos parâmetros mais importantes para a gestão de um laboratório fora da grade. Para equipamento de laboratório do núcleo, a eficiência de energia pode diferir 15-40%; no entanto, o consumo médio de energia é estimado aqui para entregar um serviço adequado. A maior taxa de alimentação (1.500-2.000 W) se relaciona com o condicionador de ar, o sistema de porta-luvas, a máquina PCR e o esterilizador autoclave. Considerando 8 horas de trabalho intensivo, realização do protocolo e 16 horas do laboratório de controle de ambiente, o consumo diário de energia de unidades de laboratório é de aproximadamente 36 kWh/dia para BSL-2, cerca de 43 kWh/dia para BSL-3 e 73 kWh/dia para os conectados BSL-2/BSL-3 + instalações. Para uma única unidade, recomenda-se fornecer uma fonte de energia elétrica com capacidade de poder correr/contínua ≥ 8 kW, impulso/arranque de potência ≥ 10 kW; para as instalações conectadas, poder correr/contínuo ≥12 kW e impulso/arranque ≥14 kW de potência. Observe, na instalação de laboratório BSL-3, que uma fonte de energia de backup é altamente recomendável para evitar queda de energia acidental e garantia de trabalho constante do sistema de pressão negativa e luvas durante um teste de diagnóstico.
Um gerador a gasolina psto elétrico é uma solução econômica para o fornecimento de energia de emergência. Suponha que a eficiência de combustível de um gerador a gasolina é aproximadamente 1,5 galões por hora, 100% de carga. Então, se o consumo diário médio de energia é carga de 8 horas de 40% e 16 horas de carga de 10%, exige que a unidade de laboratório BSL-2 ou BSL-3 7-9 galões de combustível por dia, correspondentemente, e as instalações conectada precisa ~ 15 galões/dia.
As unidades do laboratório remoto são projetadas para caber recursos de sistemas do painel solar da fora-grade. Os painéis solares não exigem combustível adicional e pode ser operados com alta produtividade em regiões tropicais e subtropicais da África, Ásia e América Latina devido a alta incidência de radiação solar. Atualmente, uma unidade de um sistema comercialmente disponível do painel solar permite um uso diário de energia de até 44 kWh/dia.
Independentemente do tipo de fonte de energia elétrica alternativa selecionado, filtros de eletricidade suja são fortemente recomendados e pré-instalado nas instalações de laboratório para melhorar a qualidade da energia e a proteger os equipamentos de laboratório. Manter o sistema PCR longe de fontes de radiação eletromagnética forte e não blindada porque forte radiação electromagnética pode interferir com o funcionamento do dispositivo. É também importante não use o sistema PCR, perto de forte vibração fontes, tais como uma centrífuga ou da bomba, porque vibração excessiva afetará o desempenho do instrumento. O equipamento de laboratório poderá ser instalado somente em um ambiente com poluentes não condutora, como partículas de poeira ou lascas de madeira. Certifique-se que o quarto é longe de quaisquer aberturas que podem expelir material particulado sobre os componentes do instrumento.
O uso de água de laboratório depende do número de testes de diagnóstico executando diariamente e o número de técnicos de laboratório que trabalham nas instalações. Água livre de nuclease é necessária para preparação de misturadores durante procedimento diagnóstico, incluindo a extração e teste PCR e deve ser entregues com antecedência como outros suprimentos e produtos químicos. Pelo menos 50 mL de água livre de nuclease é necessário para executar um teste de diagnóstico; o volume necessário de água livre de nuclease depende da carga de trabalho (ou seja, no número de amostras). Água destilada é necessária para executar o esterilizador autoclave. Consumo de água da autoclave em um ciclo é de 160-180 mL; a autoclave é recomendado para uso diário. A maioria dos plásticos (tubos, pontas de pipetas, etc.) são descartáveis, mas alguns são reutilizáveis e devem ser lavadas (grandes contentores, racks, etc.). Água corrente regular é usada para a lavagem de mãos entre procedimentos e seu volume mínimo é estimado em 15-20 L diariamente. A água precisa ser bombeado para a pressão; sistema de pré-filtro de sedimentos é recomendado para proteger os aparelhos de água do efeito prejudicial do sedimento e para melhorar a qualidade da água a correr.
Para armazenamento de frio, pelo menos uma geladeira de 5,1 pés cúbicos (+ 4 ° C) e um congelador de 4,9 pés cúbicos (-20 ° C a-30 ° C) são necessários em cada unidade do laboratório para armazenar amostras / RNA.
Descontaminação de laboratório inclui vários níveis: limpeza > anti-sepsia > desinfecção > esterilização. Simples limpeza pode ser realizada usando água e sabão enquanto esfrega com uma mão enluvada ou escova. Antisepsia inclui lavagem com líquido antimicrobiano química para inibir o crescimento e multiplicação de germes. Soluções de álcool (70%) pode ser usado como um líquido anti-séptico. Desinfecção é a aplicação de um produto químico líquido para eliminar quase todos os microorganismos patogênicos (exceto esporos bacterianos) em superfícies de trabalho e equipamentos. Tempo de exposição a substâncias químicas, temperatura e concentração de desinfetante são importantes. Solução de hipoclorito de sódio (0,5%), ou água sanitária, é um desinfetante eficaz em grande escala para a purificação da superfície de água e purificação. Ultravioleta irradiação germicida é um outro método de desinfecção. Uma lâmpada germicida produz luz UV-C e leva para a inativação de bactérias e vírus. Esterilização emprega um processo físico ou químico para destruir toda a vida microbiana, incluindo esporos bacterianos altamente resistentes. Esterilização pode ser realizada com um esterilizador autoclave.
Todos os resíduos de laboratório devem ser segregado no momento da geração. Lugar resíduos sólidos, não sustenido, infecciosos em sacos de lixo à prova de vazamento marcado como risco biológico. Se os resíduos gerados são nítido, devem ser colocado em recipientes resistente a perfurações. Recolha resíduos líquidos potencialmente infecciosos em recipientes de biohazard corretamente etiquetados para líquidos. Sacos e recipientes devem não ser preenchidos mais de 2/3 do volume. A eliminação de todos os produtos de lixívia deve ser classificada em seu próprio lixo designado. Resíduos de laboratório devem ser manuseado com cuidado para evitar a geração de aerossóis e ruptura dos sacos e contentores. Coleção sacos/caixas com resíduos de risco biológico deve ser seladas e externas superfícies descontaminadas após o uso com solução de hipoclorito de sódio 0,5%. Esterilizar todos os resíduos de laboratório em autoclave a 121 ° C por 30 minutos antes da incineração. Consulte o manual de funcionamento para o uso correto de autoclave. Se possível, adicione um indicador químico ou biológico para autoclave para garantir uma esterilização adequada. Todos os resíduos sólidos e líquidos autoclavado devem ser claramente rotulado como esterilizados com o ajuste, data, hora e operador. Os resíduos etiquetados então devem ser colocado em uma área segura e separada antes da incineração.
Como esperado, fluxo de trabalho de teste de diagnóstico depende da doença e o espécime. Se é recomendável para a identificação de vírus coletar amostras de sangue (por exemplo, Ebola19), alíquotas de amostra podem ser armazenadas a-20 ° C em vez de-80 ° C (necessário para vírus respiratórios). É sempre melhor levar mais de uma amostra quando a amostragem de um paciente que ao subdividir os espécimes mais tarde. Se possível, para cada tipo de amostra devem ser tomadas pelo menos duas amostras em tubos de amostra separada. Amostras devem ser subdivididas se amostragem adicional não é possível.
Se amostras alternativas não podem ser armazenadas a temperaturas adequadas (por exemplo, não congeladores estão disponíveis), cotonetes devem ser armazenadas em puro (100%) etanol ou 99% metílico (apenas aditivos de metanol). Neste caso, a ponta do cotonete deve ser colocada em um frasco com 1 a 2 mL de etanol. Observe que esses espécimes são adequados apenas para o PCR. Além disso, observe que um ensaio bem estabelecido é necessário para cada vírus específico diagnóstico8,23, e amostras de vírus desconhecidos devem ser enviadas aos laboratórios designados para mais investigações19,20, 21.
Requisitos obrigatórios e recomendados para a lista de equipamento de laboratório para testes de PCR diagnóstico do vírus respiratório devem ser reconhecidos. Tabela 3 ressalta básicos e minimamente avançados equipamentos (recomendado) e requisitos para o teste de diagnóstico de RT-PCR. Para práticas BSL-3, protecção de pressão extra negativa (por exemplo, caixa de luva) do pessoal é crucial e necessário.
Os módulos de laboratório conectado são preferíveis para aumentar o número de pessoal envolvido em testes laboratoriais e acelerar o tempo necessário para um único teste. Substituindo a extração de RNA manual demorada é possível com qPCR automatizado (por exemplo, QiaCube). Enquanto este instrumento é pesado (largura 65 cm, comprimento 62cm, altura 86 cm), pode caber no espaço de trabalho do laboratório móvel após rearranjo dos móveis em BSL-2 ou BSL-3 unidades.
Trabalho futuro será focado no desenvolvimento da realidade aumentada (AR) e treinamentos de realidade virtual (VR). Os óculos VR/AR serão usados para fornecer uma plataforma interativa para ensinar habilidades necessárias necessárias para se tornar um trabalhador de laboratório bem treinado. Dicas úteis para executar alguns procedimentos difícil, multipasso em testes de diagnóstico de laboratório serão incluídas na guia software. Esta abordagem para o treinamento de pessoal deveria melhorar a qualidade de desempenho de teste de diagnóstico e de gestão nas áreas de recursos restringida e instalações de laboratório remoto, especialmente remotas.
Divulgações
Baylor College of Medicine detém um pedido provisório de patente dos EUA de clínicas móveis (E.U. patente aplicação n. º 15/523.126, # 620078924). Os autores declaram que não têm nenhum interesse financeiro concorrente.
Agradecimentos
O conteúdo deste artigo não necessariamente reflete as opiniões ou políticas do nos departamento de saúde e serviços humanos ou das instituições afiliadas com os autores. Esta pesquisa foi apoiada por Paul G. Allen Family Foundation "Enhanced Zero-impacto, Pod inteligente de emergência". Agradecemos profundamente a todos os debates frutíferos e colaboração com os colegas de faculdade Baylor de medicina, saúde GSS, Johnson Space Center da NASA. Nós somos sinceramente gratos a Thermo Fisher Scientifics e seus representantes para um empréstimo de máquina a RT-PCR, centrífuga e pipetas automáticas para realizar um teste de diagnóstico de vírus respiratórios na instalação de laboratório remoto. Os autores são gratos a Marta Storl-Desmond e Sidney Stephen Sorrell por sua assistência na preparação de manuscrito e videografia.
Materiais
| Name | Company | Catalog Number | Comments |
| Autoclave Sterilizer 'BioClave' | Benchmark Scientific, Edison, NJ, USA | B4000-16 | 16 liter, Benchtop, Dims: 22x17.5x15.7 in, Fully automatic, Extremely Compact |
| Barcode Scanner | Zebra Technologies ZIH Corp., Lincolnshire, IL, USA | Symbol LS2208 | Handheld, lightweight |
| Breaker Box Panelboard Enclosure | Square D (Schneider Electric), France | MH62WP | NEMA 3R/5/12, Dims: 20 W x 62 H x 6-1/2 in. D, Electrical distribution board |
| Centrifuge - Microcentrifuge 17,000 x g | Thermo Fisher Scientific, Carlsbad, CA, USA | 75002440 | Holds 24 x1.5 or 2 ml tubes, Dims: 8.9x9.6x13.8 in |
| Class II Biological Safety Cabinet | NuAire, Inc., Plymouth, MN, USA | NU-602-400 | 4 Ft. Class II Type A2 Cage Changing Biological Safety Cabinet, 12" Access Opening, HEPEX Pressure Duct |
| Class III Biological Safety Cabinet (Glove box) | Germfree Laboratories, Ormond Beach, FL, USA | Model #PGB-36, Serial #C-2937 | Glove box, Portable, 36", Class III BSC. Dims: 36x20x23.75 in, Includes 2 interior outlets |
| Cryo Coolers | VWR, Radnor, PA, USA | 414004-286 | 0.5 or 1.5 ml tube benchtop coolers |
| Freezer (30°C freezer) | Thermo Fisher Scientific, Carlsbad, CA, USA | Model ULT430A | To occupy 4.9 Cubic feet |
| Laminar Flow Cabinet | NuAire, Inc., Plymouth, MN, USA | NU-126-300 | 3 Ft. Vertical Laminar Airflow Cabinet, 8" Access Opening, HEPA filter supply, 99.99% |
| Mini Centrifuge | Thermo Fisher Scientific, Carlsbad, CA, USA | 75004061 | Dims: 4.1x5.0x6.0 in |
| Pipettes automated | VWR, Radnor, PA, USA | 05-403-151 | Pipet 4-pack (2.5,10, 100 and 1,000μL volume) |
| Pipettes automated 'Finnpipette' | Thermo Fisher Scientific, Carlsbad, CA, USA | 4700880 | Pipet 4-pack (2, 20, 200 and 1,000μL volume), Advanced Volume Gearing(AVG), Ultra durable |
| Power Generator | Cummins Power Generation, Minneapolis, MN, USA | C60 D6 | 60 kW, 60 Hz, 1 Phase, 120/240V, Diesel |
| Refrigerator | BioMedical Solutions, Inc., Stafford, TX, USA | BSI-HC-UCFS-0504W | Standard Undercounter Refrigerators & Freezers |
| Refrigerator | Thermo Fisher Scientific, Carlsbad, CA, USA | 05LRAETSA | To occupy 5.1 Cubic feet |
| RT-PCR machine 'Step-one plus' | Thermo Fisher Scientific, Carlsbad, CA, USA | 4376598 | Holds 96 samples, Dims: 9.7x16.8x20.2 in |
| Vortex Mix | Thermo Fisher Scientific, Carlsbad, CA, USA | 88880017TS | Dims: 6.1x8.3x3.3 in |
| Chemicals | |||
| AgPath-ID One-Step RT-PCR Reagents | Applied Biosystems, Foster City, CA, USA | 4387391 | |
| Ethanol Koptec Pure 200 Proof | Decon Labs, Inc., King of Prussia, PA, USA | V1001 | |
| Nuclease-free Water | Ambion, Inc., Carlsbad, CA, USA | AM9906 | |
| QIAamp Viral RNA Mini Kit | Qiagen, Hilden, Germany | 52906 | |
| SuperScript III Platinum One-Step qRT- PCR Kit | Invitrogen, Carlsbad, CA, USA | 11732-088 | |
| Disposable | |||
| 1 mL cryogenic tubes | Thermo Fisher Scientific, Carlsbad, CA, USA | 03-337-7X | |
| 1.5 mL tubes | VWR, Radnor, PA, USA | 10025-726 | |
| 10 µL Filter Tips | Neptune, VWR, Radnor, PA, USA | Neptune, BT10XLS3 | |
| 20 µL Filter Tips | Multimax, BioExpress, VWR, Radnor, PA, USA | MultiMax, P-3243-30X | |
| 200 µL Filter Tips | ART, Thermo Fisher Scientific, Carlsbad, CA, USA | ART, 2770 | |
| 1000 µL Filter Tips | Phenix Research Products, Candler, NC, USA | TS-059BR | |
| AB custom probes | Thermo Fisher Scientific, Carlsbad, CA, USA | N/A | Custom probes |
| Combitips | Eppendorf, Hauppauge, NY, USA | 89232-972 | |
| Integrated DNA Technology (IDT) custom probes and primer | IDT | N/A | Custom probes |
| MicroAmp Fast Optical 96-Well Reaction Plate | Thermo Fisher Scientific, Carlsbad, CA, USA | 490003-978 CS | |
| MicroAmp Fast Reaction Tubes (8 tubes/strip) | Thermo Fisher Scientific, Carlsbad, CA, USA | 4358293 | |
| MicroAmp Optical 8-Cap Strip | Thermo Fisher Scientific, Carlsbad, CA, USA | 4323032 | |
| MicroAmp Optical Adhesive Film | Thermo Fisher Scientific, Carlsbad, CA, USA | 4311971 | |
| Supplies | |||
| Biohazard waste bags | VWR, Radnor, PA, USA | 14220-046 | 20.3 x 30.5 cm Biohazard bags |
| Gloves | Denville Scientific, Holliston, MA, USA | G4162-250 | Small, meduim or large Nitrile or latex gloves |
| Lab coat | N/A | N/A | Customizable |
| Masks | VWR, Radnor, PA, USA | 414004-663 | Advanced protection mask |
| Protective shoes | N/A | N/A | Customizable |
Referências
- World Health Organization (WHO) Ebola Response Team. Ebola virus disease in West Africa - the first 9 months of the epidemic and forward projections. New England Journal of Medicine. 371 (2), 1481-1495 (2014).
- World Health Organization (WHO). . Media Center: Ebola Virus Disease Fact Sheet No. 103. , (2014).
- Fauci, A. S., Morens, D. M. Zika Virus in the Americas - yet another arbovirus threat. New England Journal of Medicine. 374 (7), 601-604 (2016).
- Campos, G. S., Bandeira, A. C., Sardi, S. I. Zika virus outbreak, Bahia, Brazil. Emerging Infectious Diseases. 21 (10), 1885-1886 (2015).
- Aly, M., Elrobh, M., Alzayer, M., Aljuhani, S., Balkhy, H. Occurrence of the Middle East Respiratory Syndrome Coronavirus (MERS-CoV) across the Gulf Corporation Council countries: Four years update. PLoS ONE. 12 (10), e0183850 (2017).
- World Health Organization (WHO). Middle East respiratory syndrome coronavirus (MERS-CoV) - Oman. Media Center: Disease outbreak news. Mar 18. , (2018).
- Ducharme, J., Johnson, D. This flu map shows how the biggest influenza outbreak in years spread across the U.S. Time, Time Health: Public Health. , (2018).
- Gaglani, M., et al. Influenza vaccine effectiveness against 2009 pandemic influenza A(H1N1) virus differed by vaccine type during 2013-2014 in the United States. Journal of Infectious Diseases. 213 (10), 1546-1556 (2016).
- Gates, B. The next epidemic - lessons from Ebola. New England Journal of Medicine. 372 (15), 1381-1384 (2015).
- Mills, A. Health care systems in low- and middle-income countries. New England Journal of Medicine. 370 (15), 552-557 (2014).
- Wölfel, R., et al. Mobile diagnostics in outbreak response, not only for Ebola: a blueprint for a modular and robust field laboratory. Euro Surveillance. 20 (44), 30055 (2015).
- Connelly, S. Through innovation, education and collaboration, Baylor Global Initiatives seeks to transform health and patient care worldwide. TMC Pulse, Global Perspective. , (2015).
- Hersh, D. USAID funds Ebola 'smart pod' project. Federal Times. , (2015).
- Waite, A. Emergency Smart Pods - Transforming Containers into Modern Medical Clinics. DipNote, U.S. Department of State Official Blog. , (2018).
- . . Guide to US Department of Health and Human Services Regulations. , (2015).
- Center for Disease Control and Prevention (CDC). . Website: Clean up after a Disaster. , (2017).
- Flannery, B., et al. Enhanced genetic characterization of influenza A(H3N2) viruses and vaccine effectiveness by genetic group, 2014-2015. Journal of Infectious Diseases. 214 (7), 1010-1019 (2016).
- Spencer, S., et al. Factors associated with real-time RT-PCR cycle threshold values among medically attended influenza episodes. Journal of Medical Virology. 88 (4), 719-723 (2016).
- Cherpillod, P., et al. Ebola virus disease diagnosis by real-time RT-PCR: A comparative study of 11 different procedures. Journal of Clinical Virology. 77, 9-14 (2016).
- Dedkov, V. G., et al. Development and evaluation of a real-time RT-PCR assay for the detection of Ebola virus (Zaire) during an Ebola outbreak in Guinea in 2014-2015. Journal of Virological Methods. 228, 26-30 (2016).
- Cnops, L., et al. Developement, integration of a quantitative reverse-transcription polymerase chain reaction diagnostic test for Ebola virus on a molecular diagnostics platform. Journal of Infectious Diseases. 214 (3), S192 (2016).
- Keitel, W. A., et al. Rapid research response to the 2009 A(H1N1)pdm09 influenza pandemic (Revised). BMC Research Notes. 6, 177 (2013).
- Parsons, L. M., et al. Laboratory diagnosis of tuberculosis in resource-poor countries: challenges and opportunities. Clinical Microbiology Reviews. 24 (6), 314-350 (2011).
- . . Expandable Bicon Shelter. Commercial Manual. Sea Box. , (2019).
- . Lab Safety. Operating the Glovebox. JoVE Science Education Database. , (2018).
- World Health Organization (WHO). . Collecting, preserving and shipping specimens for the diagnosis of avian influenza A(H5N1) virus infection. , (2006).
- Lorenz, T. C. Polymerase Chain Reaction: Basic Protocol Plus Troubleshooting and Optimization Strategies. Journal of Visualized Experiments. (63), e3998 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados