Method Article
Matrice entièrement humaine basée sur la tumeur dans l’essai d’invasion de sphéroïdes en trois dimensions
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le microenvironnement tumoral est une partie essentielle de la croissance du cancer et de l’invasion. Pour imiter la progression du carcinome, une matrice humaine biologiquement pertinente est nécessaire. Ce protocole introduit une amélioration pour le test in vitro d’invasion de sphéroïdes en trois dimensions en appliquant une matrice humaine à base de leiomyoma. Le protocole introduit également une analyse d’invasion cellulaire basée sur ordinateur.
Résumé
Les essais à base de culture cellulaire en deux dimensions sont couramment utilisés dans la recherche sur le cancer in vitro. Cependant, ils manquent de plusieurs éléments de base qui forment le microenvironnement tumoral. Pour obtenir des résultats in vitro plus fiables, plusieurs essais de culture cellulaire en trois dimensions (3D) ont été introduits. Ces dosages permettent aux cellules cancéreuses d’interagir avec la matrice extracellulaire. Cette interaction affecte le comportement des cellules, tels que la prolifération et l’invasion, ainsi que la morphologie des cellules. En outre, cette interaction pourrait induire ou supprimer l’expression de plusieurs molécules Pro-et anti-tumorigènes. Le test d’invasion sphéroïde a été développé pour fournir une méthode in vitro 3D appropriée pour étudier l’invasion de cellules cancéreuses. Actuellement, les matrices dérivées d’animaux, telles que la matrice dérivée du sarcome de souris (MSDM) et le collagène de type I de queue de rat, sont principalement utilisées dans les essais d’invasion de sphéroïdes. Prenant en considération les différences entre le microenvironnement tumoral humain et les matrices dérivées d’animaux, une matrice dérivée de myome humain (HMDM) a été développée à partir du tissu de leiomyoma de l’utérus Bénin. Il a été démontré que HMDM induit la migration et l’invasion des cellules de carcinome mieux que MSDM. Ce protocole a fourni un test d’invasion de sphéroïdes à base de tumeurs humaines 3D simple, reproductible et fiable à l’aide de la matrice HMDM/fibrine. Il contient également des instructions détaillées sur l’imagerie et l’analyse. Les sphéroïdes poussent dans une plaque de fixation ultra-faible en forme de U dans la matrice HMDM/fibrine et l’envahissent. L’invasion est imagée quotidiennement, mesurée et analysée à l’aide du logiciel ilastik et Fiji ImageJ. La plate-forme de dosage a été démontrée à l’aide de lignées cellulaires de carcinome épidermes cellulaires primaires et métastatiques du larynx humain. Cependant, le protocole est également approprié pour d’autres lignées cellulaires cancéreuses solides.
Introduction
Les études de culture cellulaire bidimensionnelle (2D) conventionnelles ont considérablement contribué à la recherche sur le cancer. Actuellement, les chercheurs se déplacent davantage vers des essais de culture cellulaire en trois dimensions (3D) pour mieux imiter les conditions in vivo1. La culture de cellules cancéreuses 3D reflète plus fidèlement le microenvironnement tumoral complexe en termes d’interactions cellule-cellule et cellule-matrice, profils d’expression génique, sensibilité médicamenteuse, et activité de signalisation de la voie2,3.
Plusieurs modèles de culture de cellules 3D sont utilisés dans la recherche sur le cancer comme explant de tissu tumoral, tumeur sur une puce, et les sphéroïdes de tumeur multicellulaires3,4. Les sphéroïdes de tumeurs multicellulaires sont maintenant largement utilisés, car ils imitent plusieurs caractéristiques des conditions in vivo dans les tumeurs humaines1,5. Lorsque le diamètre du sphéroïde est supérieur à 500 μm, il a même des régions hypoxiques et un centre nécrotique, ce qui représente donc la situation tumorale in vivo2.
De nombreuses matrices synthétiques (p. ex., polydiméthylsiloxane) et dérivées d’animaux (p. ex., le collagène de type I de queue de rat et la matrice dérivée de sarcome de souris, Matrigel, appelée msdm) ont été développées pour les essais de culture cellulaire 3D3,6, 7,8. Jusqu’à présent, aucune des matrices disponibles dans le commerce n’est originaire du tissu tumoral humain. Par conséquent, ils manquent les caractéristiques du microenvironnement tumoral humain, qui a des effets significatifs sur les processus d’invasion des cellules cancéreuses8.
Myogel (matrice dérivée de myome humain, appelée HMDM) est extraite du tissu tumoral de l’utérus humain leiomyoma9. Il a été démontré que la teneur en protéines du HMDM diffère significativement de celle de la MSDM. En fait, 66% des protéines HMDM sont différentes des protéines MSDM. D’autre part, certaines protéines, telles que la laminine, le collagène de type IV, les protéoglycanes de sulfate d’héparan, le nidogène et le facteur de croissance épidermique, sont présentes dans les deux matrices10. En outre, la souris diffère de l’humain dans le contenu enzymatique, avec des humains ayant 78 moins de protéases que les souris11.
La fibrine a été largement utilisée seule ou en combinaison avec d’autres matériaux comme matériau d’échafaudage12. Dans les essais de culture cellulaire 3D, le fibrinogène humain disponible dans le commerce et la thrombine sont combinés pour former un hydrogel de fibrine12.
Ce protocole décrit une amélioration du test d’invasion de sphéroïdes de tumeur 3D précédemment introduit7. Ce nouveau protocole applique la matrice dérivée de tumeur humaine au lieu de la matrice de tumeur dérivée de souris. Il implique également des techniques d’imagerie et d’analyse en utilisant ilastik et Fiji ImageJ logiciel. Ce protocole pourrait être utilisé pour le dosage sphéroïde de plusieurs lignées cellulaires cancéreuses solides différentes. Il offre un outil biologiquement pertinent pour développer de nouvelles thérapies anticancéreuses et pour étudier les effets de molécules spécifiques sur l’invasion de cellules cancéreuses.
Protocole
1. génération de sphéroïdes de tumeurs multicellulaires
Remarque: Le protocole est illustré ici avec les lignées cellulaires UT-SCC-42A et-42B, mais il peut également être appliqué à l’aide d’autres lignées cellulaires.
- Laver les cellules UT-SCC-42A et-42B avec 6 mL de solution saline tamponnée au phosphate (PBS), ajouter 0,05% de trypsine-EDTA (3 mL pour le flacon de 75 cm2 ) et placer le flacon dans un incubateur de culture cellulaire (37 ° c, 5% co2, 95% d’humidité) pendant 2-5 min.
- Vérifiez que les cellules se sont détachées sous un microscope. Ajoutez ensuite le support d’Eagle (DMEM) modifié de Dulbecco (DMEM + 10% de sérum bovin fœtal, 100 U/ml de pénicilline, 100 μg/mL de streptomycine, 250 ng/mL d’amphotéricine B, 0,4 μg/mL d’hydrocortisone et 50 μg/mL d’acide ascorbique) pour neutraliser l’enzyme (6 mL pour 75 cm 2 flacon) et transférer la suspension cellulaire dans un tube conique de 15 ml.
Remarque: sélectionnez le milieu de culture de cellules qui convient aux cellules étudiées. - Centrifuger la suspension cellulaire à 200 x g pendant 5 min.
- Retirer le surnageant et suspendre le culot de la cellule dans 2-5 mL de DMEM complet.
- Comptez les cellules et diluez la suspension cellulaire avec le DMEM complet jusqu’à une concentration finale de 20 000 cellules/mL.
Remarque: Le nombre optimal de cellules doit être déterminé pour chaque ligne de cellule. - Distribuer 50 μL de la suspension cellulaire dans chaque pièce d’attache ultra-faible 96-plaque de fond ronde bien pour une concentration finale de 1 000 cellules par puits.
- Transférer la plaque à l’incubateur de culture cellulaire (37 ° c, 5% CO2, 95% d’humidité). Quatre jours plus tard, confirmer visuellement la formation de sphéroïdes de tumeur avec un microscope inversé et procéder au dosage. Assurez-vous qu’il n’y a qu’un seul sphéroïde par puits.
Remarque: Le temps pris pour former un sphéroïde varie entre les différentes lignées cellulaires.
2. essai d’invasion de sphéroïdes tridimensionnels
Remarque: Préparez 2x solution parce que le gel sera dilué 1:1 lorsqu’il est ajouté dans les puits.
- Décongeler HMDM sur glace et solution de fibrinogène dans un bain d’eau maintenu à 37 ° c. Ne pas déranger le fibrinogène jusqu’à ce qu’il soit complètement solubilisé et ne pas mettre la solution sur la glace; précipitations se produiront.
- Mélanger ensemble le volume approprié de chaque réactif: 1 mg/mL de HMDM (concentration finale: 0,5 mg/mL), 0,6 U/mL de thrombine (concentration finale: 0,3 U/mL), 66,6 mg/mL d’aprotinine (concentration finale: 33,3 ug/mL) et 1 mg/mL de fibrinogène (concentration finale: 0,5 mg/mL ).
Remarque: Ajouter le fibrinogène juste avant de distribuer le mélange dans les puits et de travailler rapidement; Il formera un gel en quelques minutes. Ne traitez que quelques puits à la fois. - Ajouter 50 μL de gel dans chaque puits. Dirigez la pointe vers la paroi intérieure du puits et pipettant lentement. Évitez les bulles d’air (en utilisant la technique de pipetage inverse) et essayez de ne pas déplacer le sphéroïde du centre du puits.
- Retournez la plaque à l’incubateur de culture cellulaire et laissez la matrice HMDM/fibrine se solidifier pendant 30 min, et ajoutez délicatement 100 μL de DMEM complet dans chaque puits sur le dessus du gel.
3. l’imagerie
- Image les sphéroïdes quotidiennement à l’aide d’un microscope à lumière inversée. Vous pouvez également utiliser des systèmes d’imagerie automatique.
4. segmentation d’image avec Ilastik
- Ouvrez ilastik et sélectionnez workflow de classification des pixels (figure 1A). Il classifie les pixels en fonction des annotations effectuées par l’utilisateur. Enregistrez le projet ilastik (. ILP) sur l’ordinateur.
- Ajoutez des images pour les analyses. Cliquez sur données d’entrée et Ajoutez nouveau , puis choisissez des images (figure 1B).
-
Pour la sélection d’entités, cliquez sur sélection des entités et sélectionnez entités (figure 1C, rectangle rouge).
Remarque: les entités sélectionnées doivent correspondre à peu près aux propriétés visuelles qui séparent les objets de l’arrière-plan, et ils seront utilisés pour la formation du classifieur.- Sélectionnez les entités en cliquant sur les cases. Les cases sélectionnées vont tourner en vert (figure 1C, rectangle bleu).
Remarque: Ici, l’utilisateur peut choisir parmi plusieurs types d’entités et échelles différents. La couleur/l’intensité doit être sélectionnée pour séparer les objets en fonction de la couleur ou de la luminosité. L’arête doit être sélectionnée pour séparer les objets en fonction de la luminosité ou des dégradés de couleurs. La texture est une caractéristique importante si les objets de l’image ont un aspect texture spécial. Pour ce dosage, la couleur/l’intensité (Sigma 0) et le bord (Sigma 6) sont utilisés.
- Sélectionnez les entités en cliquant sur les cases. Les cases sélectionnées vont tourner en vert (figure 1C, rectangle bleu).
-
Pour la formation, cliquez sur formation et dans la section formation il y a deux étiquettes: l’étiquette 1 et l’étiquette 2 (figure 1D, rectangle rouge). S’il n’y a qu’une seule étiquette, ajoutez une nouvelle étiquette en appuyant sur Ajouter une étiquette (figure 1D, rectangle bleu).
- Marquez l’arrière-plan avec l’une des étiquettes (figure 1d, jaune) et les cellules avec l’autre étiquette (figure 1d, bleu).
- Formez le logiciel pour les 10 premiers% des images. Choisissez l’image suivante dans la vue actuelle.
- Une fois que les cellules et l’arrière-plan sont marqués (de la première image), appuyez sur mise à jour en direct (figure 1D, Rectangle violet).
Remarque: avec l’image suivante, ilastik effectuera automatiquement l’analyse en fonction des images précédentes.
- Après l’entraînement est fait et ilastik a analysé toutes les images, cliquez sur l' exportation de prédiction. Choisissez segmentation simple à partir de la source; Ne choisissez pas de probabilités ou autre chose (figure 1E).
- Choisissez le format de fichier de sortie désiré à partir de choisir exporter les paramètres d’image... dans la section exportation de prédiction (figure 1E). Exportez les résultats de l’étiquetage en cliquant sur Exporter tout (figure 1F). Les fichiers seront exportés dans le même dossier avec les images originales.
Remarque: dans cette expérience, le format. H5 est utilisé.
5. analyse de la zone avec les Fidji ImageJ
-
Réglage de l’échelle
- Ouvrez l’image d’origine avec une barre d’échelle à Fidji ImageJ (figure 2a). Assurez-vous que l’image a la même taille et la même dimension que les images analysées. Utilisez l’outil Sélection de ligne pour tracer une ligne d’une longueur connue (figure 2B).
Remarque: Ce protocole est exécuté à l’aide de Fidji ImageJ 1,51 (64-bit) et ilastik-1.3.2 RC. - Cliquez sur analyser et définir l’échelle (figure 2C). Définissez la distance connue dans le champ distance connue et définissez l’unité appropriée et cliquez sur Global (figure 2D).
- Ouvrez l’image d’origine avec une barre d’échelle à Fidji ImageJ (figure 2a). Assurez-vous que l’image a la même taille et la même dimension que les images analysées. Utilisez l’outil Sélection de ligne pour tracer une ligne d’une longueur connue (figure 2B).
-
Installation de la macro
- Si un plugin ilastik n’est pas installé, procédez comme suit: cliquez sur aide, mettre à jour.... Sur la fenêtre ouverte ImageJ Updater, cliquez sur gérer les sites de mise à jour. Dans la fenêtre ouvrir gérer les sites de mise à jour, cliquez sur suivant pour ilastik , puis cliquez sur Fermer. Cliquez ensuite sur appliquer les modifications dans la fenêtre ImageJ Updater. Ce processus peut prendre un certain temps. La fenêtre suivante sera l' information avec le texte mis à jour avec succès. Cliquez sur OK et redémarrez ImageJ.
- Cliquez sur plugins, macroset install (figure 3A). Ensuite, choisissez le fichier Counter. IJM (voir informations supplémentaires) et cliquez sur ouvrir.
Remarque: La macro a été écrite spécialement pour la mesure de la zone. La macro doit être installée chaque fois que le logiciel est ouvert.
-
Analyse de zone
- Analysez les images lorsque tous les plugins sont installés. Cliquez sur plugins et faites défiler jusqu’à ilastik (figure 3C). Choisissez Import HDF5, choisissez le fichier avec le format. H5, cliquez sur ouvrir et chargez et appliquez lut (figure 3C, D).
- Appuyez sur la touche a du clavier (macro) et la zone apparaîtra dans la fenêtre récapitulative comme surface totale (figure 3E).
Résultats
Quatre jours après l’ensemencement de cellules de l’UT-SCC-42B (métastatique laryngée de la lignée cellulaire SCC), la matrice (HMDM/fibrine, MSDM ou collagène) a été ajoutée sur les sphéroïdes formés (jour 0) et l’invasion a été surveillée pendant trois jours. Les images ici ont été obtenues quotidiennement à l’aide d’un microscope inversé (figure 4).
Une fois incorporées, les cellules de la matrice HMDM/fibrine ont commencé à envahir rapidement après une journée et étendues dans la matrice (figure 4A). Les cellules du MSDM n’ont pas envahi la matrice environnante, formant plutôt une structure asymétrique (figure 4B). D’autre part, les cellules du collagène envahissent légèrement, mais en raison du rétrécissement de la matrice, l’analyse est difficile (figure 4C). Dans certains puits de collagène, les sphéroïdes ont même disparu après trois jours (figure 4C).
La figure 5 illustre la quantification de l’invasion cellulaire en hmdm/fibrine de la lignée de cellules du larynx primaire du SCC ut-SCC-42A et de la lignée de cellules métastatiques ut-SCC-42B correspondante. La vidéo (film 1) prise à l’aide d’un système d’analyse de cellules vivantes du sphéroïde hmdm/fibrine montre le mouvement des cellules du SCC dans la matrice où elles forment des brins suivis par les autres cellules.
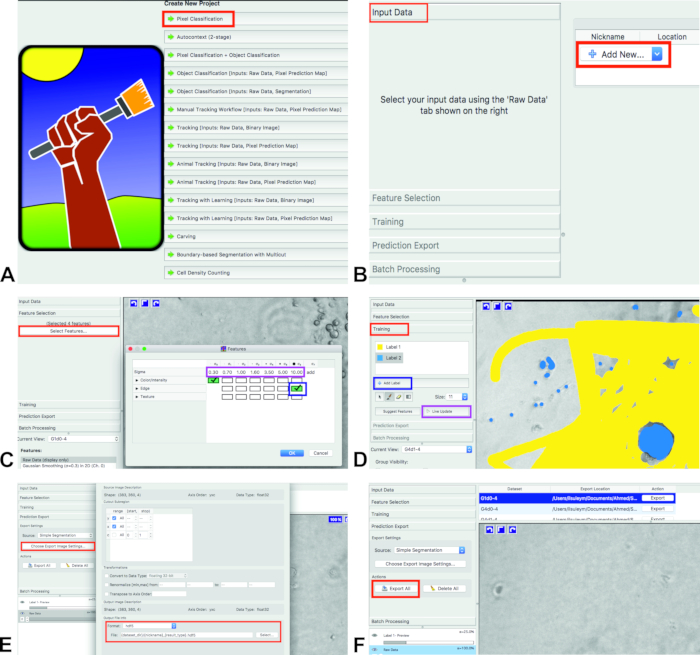
Figure 1 : Segmentation d’image. Étapes sélectionnées de segmentation d’image en utilisant ilastik. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
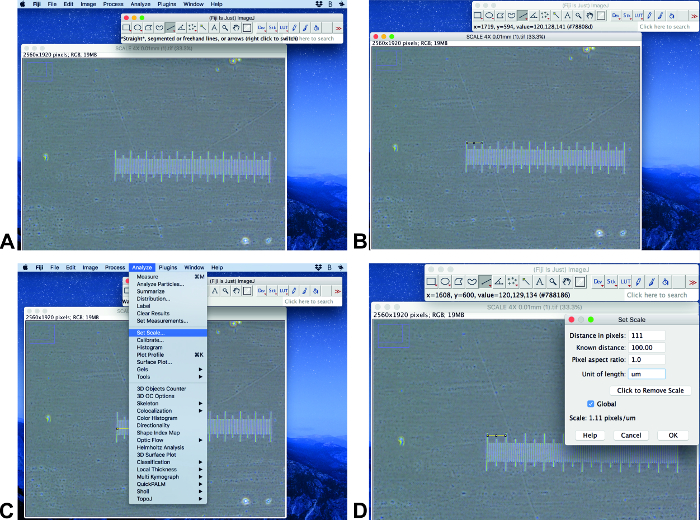
La figure 2 : Réglage de l’échelle. Étapes sélectionnées de la mise à l’échelle à l’aide de Fiji ImageJ. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
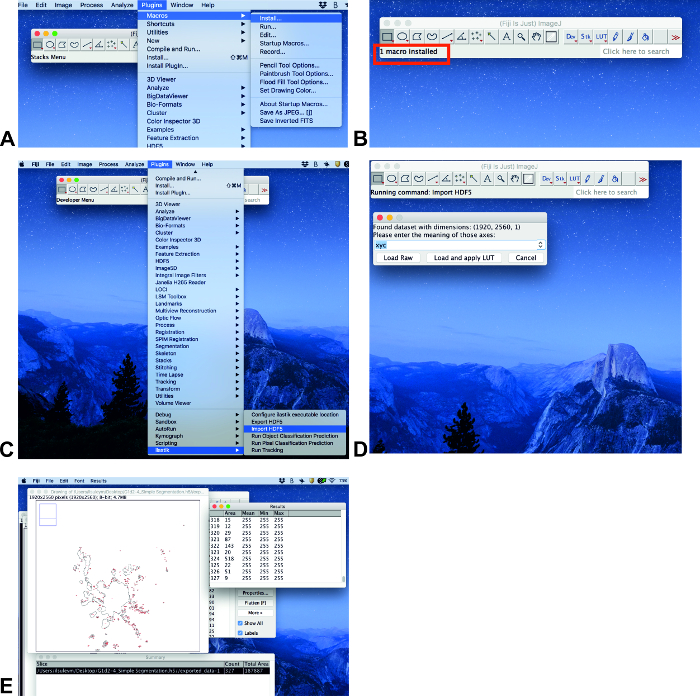
Figure 3 : Analyse d’invasion avec ImageJ. Étapes sélectionnées de l’analyse d’image à l’aide de Fiji ImageJ. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
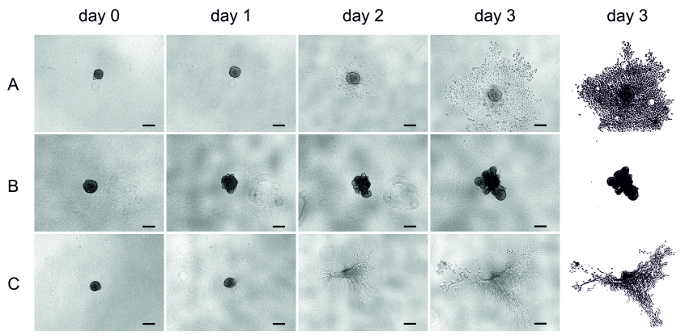
Figure 4 : Invasion de cellules ut-SCC-42B dans trois matrices différentes. Images représentatives de l’invasion de cellules SCC dans les sphéroïdes 3D. L’invasion a été suivie pendant trois jours et des images ont été prises quotidiennement à l’aide d’un microscope inversé. (A) hmdm/fibrine, (B) msdm, (C) collagène. La dernière colonne représente la clarification de l’invasion du jour 3. Barre d’échelle = 200 μm. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
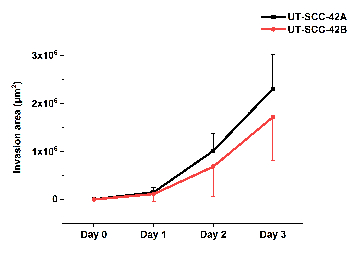
Figure 5 : Quantification de l’invasion des cellules du SCC en HMDM/fibrine. Le larynx primaire UT-SCC-42A et l’invasion de la lignée cellulaire du larynx métastatique UT-SCC-42B du SCC ont été analysés à l’aide du logiciel ImageJ d’ilastik et de Fiji. Les résultats représentent une moyenne ± écart-type de trois expériences indépendantes, chacune en triplicate. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Vidéo 1: Mouvement SCC Cell au sein du HMDM/fibrine pendant trois jours. S’il vous plaît cliquez ici pour voir cette vidéo. (Cliquez avec le bouton droit de la souris pour télécharger.)
Discussion
La méthode présentée fournit une analyse 3D basée sur la tumeur humaine pour évaluer l’invasivité des cellules cancéreuses au sein de la matrice de imitant de microenvironnement de tumeur humaine. L’invasion de cellules cancéreuses peut être facilement mesurée par imagerie quotidienne avec un microscope standard et en utilisant le logiciel d’analyse d’image. La méthode démontre l’invasion cellulaire plutôt que la simple prolifération.
Contrairement à MSDM, la matrice HMDM/fibrine ne nécessite aucun contrôle de température. Cette méthode est facile à réaliser, en particulier sans qu’il soit nécessaire de transférer les sphéroïdes d’une plaque à une autre. Il n’a qu’une seule étape techniquement sensible, l’addition de fibrinogène à la matrice. Comme le fibrinogène commence à se gel après quelques minutes, l’ajout de fibrinogène nécessite un pipetage et un traitement robustes de seulement quelques puits à la fois. Il y a également un risque de déranger le sphéroïde et de le déplacer de sa position centrale dans le puits en forme de U si le pipetage est fait de manière haute pression. La dislocation du sphéroïde peut compliquer l’imagerie et éventuellement l’analyse.
Le dosage peut être modifié en altérant la concentration de HMDM ou de fibrinogène. Les cellules peuvent également être fixées et colorées pour les études moléculaires ultérieures. Même si cette méthode peut être modifiée à une forme entièrement automatisée, elle peut également être réalisée avec un microscope normal et deux logiciels open source, sans besoin d’équipement coûteux.
Comparé aux tests 3D traditionnels basés sur MSDM, ce test pourrait afficher mieux les propriétés d’invasion de cellules. Les sphéroïdes cultivés dans une matrice de sous-sol contenant une membrane riche en laminine, comme la MSDM, pourraient avoir plus de prolifération des cellules cancéreuses que l’invasion réelle, ce qui le rend impropre aux essais d’invasion dans plusieurs lignées cellulaires cancéreuses en raison de leur faible capacité d’invasion. Une autre matrice fréquemment utilisée, le collagène de type I, tend à rétrécir à partir des bords pendant la culture 3D, ce qui affecte la localisation sphéroïde et l’imagerie des puits. En outre, on a démontré les différences entre les propriétés invasives intrinsèques des lignées cellulaires de carcinome de langue agressive (HSC-3) et moins (SCC-25), en utilisant des modèles de microenvironnement tumoral humain imitant le modèle (disques de myome et sa forme soluble Matrix)10,13.
Le dosage est également plus éthique que l’utilisation de MSDM puisque HMDM est extraite du matériel restant de la tumeur de leiomyoma humain. Actuellement, le hmdm est le seul produit d’ECM dérivé de tumeur humaine disponible qui semble convenir à de nombreux essais in vitro liés au cancer,8,10. À l’avenir, les matrices dérivées de tissus animaux pourraient être remplacées par des matrices humaines à base de tumeurs pour réduire le besoin de sacrifier les animaux pour la production matricielle.
Le remplacement des tests de culture de cellules 2D par des méthodes 3D fournit des informations plus précises sur le comportement des cellules cancéreuses. Actuellement, il existe plusieurs modèles 3D et des matrices commerciales, mais, malheureusement, aucun ne convient à toutes les lignées cellulaires cancéreuses. Les chercheurs devraient choisir la matrice la plus appropriée pour leur dosage particulier. L’appariement optimal du dosage et de la matrice peut être difficile, mais il pourrait considérablement augmenter la fiabilité des résultats.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs remercient les bailleurs de fonds de cette étude: la Fondation Sigrid Jusélius, la société du cancer de la Finlande et l’Université d’Helsinki Centre de recherche de l’hôpital central. Les auteurs reconnaissent l’unité d’imagerie Biomedicum à l’Université d’Helsinki pour obtenir de l’aide technique.
matériels
| Name | Company | Catalog Number | Comments |
| Amphotericin B solution | Merck | A2942 | |
| Aprotinin from bovine lung | Merck | A6279 | Measure the protein concentration before use. |
| Ascorbic acid | Applichem | A1052 | |
| BioLite Cell Culture Treated Flasks | Thermo Scientific | 130190 | |
| DMEM/F-12 | Gibco by Life Technologies | 31330-038 | |
| DS-Fi2 Digital Camera | Nikon Instruments | ||
| DS-U3 Digital Camera Controller | Nikon Instruments | ||
| Eclipse TS100 Inverted Microscope | Nikon Instruments | ||
| Fetal bovine serum (FBS) | Gibco by Life Technologies | 10270106 | Heat inactivate for 30 min at 56 °C in waterbath before use. |
| Fibrinogen, Plasminogen-Depleted, Human Plasma | Merck | 341578 | Solubility: 25 mg/ml in H2O. Warm the H2O and the fibrinogen to 37 °C prior to dissolution. Do not disturb until the fibrinogen is completely solubilized. Stock solutions stored at -70 °C should be thawed in a water bath maintained at 37 °C. |
| Fiji ImageJ 1.51 image processing program | Freeware, NIH | ||
| Hydrocortisone | Merck | H0888 | |
| Ilastik software for image classification and segmentation | Freeware | ||
| IncuCyte Zoom Live-Cell Analysis System | Essen BioScience | ||
| Myogel | Lab made | ||
| Penicillin-Streptomycin | Gibco by Life Technologies | 15140-122 | |
| Phosphate buffered saline (PBS) | Lab made | ||
| Scepter 2.0 Cell Counter | Merck | PHCC20040 | |
| Scepter Cell Counter Sensors, 60 µm | Merck | PHCC60050 | |
| Thrombin from human plasma | Merck | T6884-100UN | |
| Trypsin-EDTA (0.5%) 10x, no phenol red | Gibco by Life Technologies | 15400054 | |
| Ultra-Low Attachment 96-Well Plate | Corning | 7007 | |
| UT-SCC-42A and UT-SCC-42-B cell lines | The cell lines were established at the Department of Otorhinolaryngology-Head and Neck Surgery, Turku University Hospital (Turku, Finland). |
Références
- Jung, H., et al. Cell Spheroids with Enhanced Aggressiveness to Mimic Human Liver Cancer In vitro and In Vivo. Scientific Reports. 7, 10499-10514 (2017).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology and Therapeutics. , 94-108 (2016).
- Albanese, A., Lam, A. K., Sykes, E. A., Rocheleau, J. V., Chan, W. C. W. Tumour-on-a-chip provides an optical window into nanoparticle tissue transport. Nature Communications. 4, 2718 (2013).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4, 309-324 (2009).
- Berens, E. B., Holy, J. M., Riegel, A. T., Wellstein, A. A Cancer Cell Spheroid Assay to Assess Invasion in a 3D Setting. Journal of Visualized Experiments. (105), e53409 (2015).
- Vinci, M., Box, C., Eccles, S. A. Three-Dimensional (3D) Tumor Spheroid Invasion Assay. Journal of Visualized Experiments. (99), e52686 (2015).
- Salo, T., et al. A novel human leiomyoma tissue derived matrix for cell culture studies. BMC Cancer. 15, 981 (2015).
- Nurmenniemi, S., et al. A novel organotypic model mimics the tumor microenvironment. The American Journal of Pathology. 175, 1281-1291 (2009).
- Salo, T., et al. Organotypic three-dimensional assays based on human leiomyoma-derived matrices. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 373 (1737), 20160482 (2018).
- Overall, C. M., Blobel, C. P. In search of partners: linking extracellular proteases to substrates. Nature Reviews Molecular Cell Biology. 8, 245-257 (2007).
- Ahmed, T. A. E., Dare, E. V., Hincke, M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Engineering Part B: Reviews. 14 (2), 199-215 (2008).
- Hoornstra, D., et al. Fermented Lingonberry Juice Inhibits Oral Tongue Squamous Cell Carcinoma Invasion In vitro Similarly to Curcumin. In Vivo. 32, 1089-1095 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon