Method Article
Полностью человека опухоли на основе матрицы в трехмерном Сфероидных вторжения анализ
* Эти авторы внесли равный вклад
В этой статье
Резюме
Микросреда опухоли является неотъемлемой частью роста и вторжения рака. Для имитации прогрессирования карциномы необходима биологически соответствующая человеческая матрица. Этот протокол вводит улучшение для экстракорпорального трёхмерного вторжения сфероидных проб путем применения человеческой лейомиомы на основе матрицы. Протокол также вводит компьютерный анализ вторжения ячейки.
Аннотация
Двумерные клетки культуры на основе анализа, как правило, используются в пробирке исследований рака. Однако, им не хватает нескольких основных элементов, которые формируют микросреду опухоли. Чтобы получить более надежные результаты в пробирке, были введены несколько трехмерных (3D) клеточных анализов культуры. Эти анализы позволяют раковым клеткам взаимодействовать с внеклеточной матрицей. Это взаимодействие влияет на поведение клеток, например, на размножение и вторжение, а также на морфологию клеток. Кроме того, это взаимодействие может вызвать или подавить экспрессию нескольких про-и анти-туморигенных молекул. Сфероидных вторжения анализ был разработан, чтобы обеспечить подходящий 3D в пробирке метод для исследования вторжения раковых клеток. В настоящее время, животных, полученных матриц, таких как мышь саркома-производные матрицы (MSDM) и крысиный хвост типа I коллаген, в основном используется в ходе сфероидных вторжения анализов. Принимая во внимание различия между микросредой опухоли человека и матрицей, полученной из животных, была разработана человеческая миома-полученная матрица (HМДМ) от доброкачественной ткани лейомиома матки. Было показано, что ХМДМ индуцирует миграцию и вторжение в клетки карциномы лучше, чем MSDM. Этот протокол предоставил простой, воспроизводимость, и надежный 3D человека опухоли основе сфероидных вторжения анализа с использованием матрикса HМДМ/фибрат. Он также содержит подробные инструкции по визуализации и анализу. Сфероиды растут в U-образной ультра-низкой пластине крепления в матрице ХМДМ/фибрат и вторгаются через него. Вторжение ежедневно отображаемого, измеряется, и анализируется с использованием ilastik и Фиджи iiiieiiiieieie Пробирная платформа была продемонстрирована с помощью человеческого гортани первичных и метастатических плоскоклеточный рак клеточных линий. Тем не менее, протокол подходит и для других линий твердых раковых клеток.
Введение
Традиционные двухмерные (2D) исследования культуры клеток значительно способствовали исследованию рака. В настоящее время исследователи переходят к трехмерным (3D) клеток культуры анализов лучше имитировать в условиях естественных условий1. Культура 3D раковых клеток более точно отражает сложную микросреду опухоли в терминах клеточных и клеточных матричных взаимодействий, профилей экспрессии генов, чувствительности к лекарственным препаратом и сигнализирующий путь деятельности2,3.
Несколько моделей 3D клеток культуры используются в исследованиях рака, таких как опухоль ткани эксфолиант, опухоль на чипе, и многоклеточные сфероиды опухоли3,4. Многоклеточные сфероиды опухоли в настоящее время широко используются, поскольку они имитируют несколько особенностей в условиях естественных условий в опухолях человека1,5. Когда диаметр сфероида превышает 500 мкм, он даже имеет гипоксические регионы и Некротический центр, представляя, таким образом, в естественных условиях опухоль2.
Многие синтетические (например, полидиметилсиласана) и животного происхождения (например, Крысиный хвост типа I коллаген и мышь саркома-производные матрицы, матригель, именуемый MSDM) матрицы были разработаны для 3D клеток культуры анализов3,6, 7,8. До сих пор ни одна из коммерчески доступных матриц не возникла из ткани человека опухоли. Таким образом, им не хватает особенностей микроокружения опухоли человека, что оказывает существенное влияние на процессы вторжения раковых клеток8.
Myogel (человеческая миома, полученная матрица, именуемый HМДМ) извлекается из человеческой матки лейомиома опухолевой ткани9. Показано, что содержание белка в МДМ существенно отличается от содержания MSDM. На самом деле, 66% белков HМДМ отличаются от белков MSDM. С другой стороны, некоторые белки, такие как ламининин, IV типа коллагена, гепариан сульфат протеогликанов, nidogen, и эпидермальный фактор роста, присутствуют в обеих матрицах10. Кроме того, мышь отличается от человека в содержании фермента, с людьми, имеющими 78 меньше протеаз, чем мышей11.
Фибрат был широко использован отдельно или в комбинации с другими материалами как эшафот материал12. В 3D клеточных анализов культуры, коммерчески доступных человека фифиноген и тромбин объединяются, чтобы сформировать Фиброин Гидрогель12.
Этот протокол описывает улучшение ранее введенных 3D опухоли сфероидных вторжения анализ7. Этот новый протокол применяет человеческую матрицу, полученную из опухоли, вместо матрицы опухоли, полученной из мышей. Она также включает методы визуализации и анализа с использованием программного обеспечения ilastik и Фиджи. Этот протокол может быть использован для сфероидных анализа нескольких различных твердых клеточных линий рака. Он предлагает биологически соответствующий инструмент для разработки новых противораковых методов лечения и для изучения влияния конкретных молекул на вторжение раковых клеток.
протокол
1. Генерация многоклеточных сфероидов опухоли
Примечание: Протокол демонстрируется здесь с линиями ячеек UT-ГКС-42 а и-42 в, но он также может применяться с помощью других клеточных линий.
- Промыть UT-ГКС-42 а и-42 в клетки с 6 мл фосфата-буферизованные физиологический раствор (PBS), добавить 0,05% трипсин-ЭДТА (3 мл для 75 см2 колбы), и поместите колбу в инкубаторе культуры клеток (37 ° c, 5% CO2, 95% влажность) для 2-5 мин.
- Убедитесь, что клетки отделились под микроскопом. Затем добавьте средний (ДМЭМ) модифицированный Орлиный носитель (дмем + 10% фетальной бычьей сыворотки, 100 U/mL пенициллин, 100 мкг/мл стрептомицина, 250 нг/мл амфотерицина B, 0,4 мкг/мл гидрокортизона и 50 мкг/мл аскорбиновой кислоты) для нейтрализации фермента (6 мл для 75 2 колба) и перенести клеточную подвеску в 15 мл конической трубки.
Примечание: выберите среду клеточной культуры, которая подходит для изучаемых клеток. - Центрифуга ячейки подвески на 200 x g в течение 5 мин.
- Удалить супернатант и приостановить ячейки гранул в 2-5 мл полного дм.
- Подсчитайте клетки и разбавить клеточную подвеску с полным Дэм до конечной концентрации 20 000 клеток/мл.
Примечание: Для каждой клеточной линии необходимо определить оптимальное количество клеток. - Обойтись 50 мкл клеточной суспензии в каждой ультра-низкой привязанности 96-хорошо круглый нижней пластины хорошо для окончательной концентрации 1 000 клеток на хорошо.
- Передача пластины в инкубатор культуры клеток (37 ° c, 5% CO2, 95% влажности). Четыре дня спустя визуально подтверждают формирование сфероидных опухолей с перевернутым микроскопом и приступаем к пробирку. Убедитесь, что есть только один сфероид на хорошо.
Примечание: Время, принятое для формирования сфероида варьируется между различными линиями ячейки.
2. трехмерное сфероид вторжение анализ
Примечание: Подготовьте 2x раствор, потому что гель будет разбавлен 1:1 при добавлении в скважины.
- Оттепель ГХМДМ на льду и фифиноген на складе раствор в водяной бане поддерживается при температуре 37 ° c. Не тревожьте фифиноген, пока он не будет полностью растворен и не поставит раствор на лед; осадков будет происходить.
- Смешать соответствующий объем каждого реагента: 1 мг/мл ХМДМ (окончательная концентрация: 0,5 мг/мл), тромбин 0,6 U/mL (окончательная концентрация: 0,3 U/mL), 66,6 мг/мл апротинина (окончательная концентрация: 33,3 мкг/мл), и 1 мг/мл фиброногена (окончательная концентрация: 0,5 мг/мл ).
Примечание: Добавить фифиноген незадолго до дозирования смеси в скважины и работать быстро; Он сформируйте гель в немного минут. Лечить только несколько скважин за раз. - Добавить 50 мкл геля в каждый колодец. Прямая наконечник к внутренней стене колодца и пипетки медленно. Избегайте пузырьков воздуха (используя обратную технику пипетки) и старайтесь не перемещать сфероид из центра колодца.
- Верните тарелку обратно в инкубатор клеточной культуры и дайте матрице HМДМ/фифину затвердевать в течение 30 минут и аккуратно добавьте 100 мкл полного ДМЭМ в каждый колодец поверх геля.
3. Визуализация
- Изображение сфероидов ежедневно с помощью перевернутого светового микроскопа. Кроме того, используйте автоматические системы визуализации.
4. изображение сегментации с Иластик
- Откройте иластик и выберите рабочий процесс классификации пикселей (Рисунок 1A). Он классифицирует Пиксели на основе аннотаций, сделанных пользователем. Сохранить проект ilastik (. ILP) к компьютеру.
- Добавление изображений для анализов. Нажмите входные данные и Добавить новые , а затем выбрать изображения (Рисунок 1B).
-
Для выбора компонентов щелкните Выбор функции и выберите особенности (Рисунок 1C, красный прямоугольник).
Примечание: выбранные функции должны приблизительно соответствовать визуальным свойствам, которые отделяют объекты от фона, и они будут использоваться для подготовки классификатора.- Выберите функции, нажав на ящики. Выбранные ящики станут зелеными (Рисунок 1C, синий прямоугольник).
Примечание: Здесь пользователь может выбрать из нескольких различных типов функций и весов. Цвет/интенсивность должны быть выбраны для отдельных объектов на основе цвета или яркости. Край должен быть выбран для разделения объектов на основе яркости или градиентов цвета. Текстура является важной особенностью, если объекты в изображении имеют особый текстурный внешний вид. Для этого анализа, цвет/интенсивность (сигма 0) и EDGE (сигма 6) используются.
- Выберите функции, нажав на ящики. Выбранные ящики станут зелеными (Рисунок 1C, синий прямоугольник).
-
Для обучения, нажмите обучение и в секции обучения есть два ярлыка: метка 1 и метка 2 (Рисунок 1D, красный прямоугольник). Если есть только один ярлык, добавить новый ярлык, нажав добавить ярлык (Рисунок 1D, синий прямоугольник).
- Отметьте фон одной из меток (Рисунок 1d, желтый цвет) и ячейки с другой этикеткой (рис. 1d, Blue).
- Тренируйте программное обеспечение для первых 10% изображений. Выберите следующее изображение из текущего представления.
- После того, как камеры и фона отмечены (первого изображения), нажмите Live Update (Рисунок 1D, фиолетовый прямоугольник).
Примечание: при следующем изображении, иластик будет автоматически выполнять анализ в соответствии с предыдущими изображениями.
- После тренировки сделано и ilastik проанализировал все изображения, нажмите Прогноз экспорт. Выберите простую сегментирование из источника; Не выбирайте вероятности или что-нибудь еще (рис. 1E).
- Выберите желаемый формат выходного файла из выберите параметры экспортного изображения... в разделе Экспорт прогнозов (рис.1е). Экспортировать результаты маркировки, нажав на Экспорт все (рис.1F). Файлы будут экспортироваться в ту же папку с оригинальными изображениями.
Примечание: в этом эксперименте используется формат ндо.
5. Анализ местности с фиджийским имиджей
-
Настройка масштаба
- Откройте исходное изображение с баром масштаба на Фиджи имадж (рис.2a). Убедитесь, что изображение имеет тот же размер и измерение, что и анализируемые изображения. Используйте инструмент выделения линии, чтобы нарисовать линию известной длины (Рисунок 2B).
Примечание: Этот протокол выполняется с использованием фиджийского имиджи 1,51 (64-bit) и иластик-1.3.2 RC. - Нажмите анализ и установить масштаб (Рисунок 2C). Установите известное расстояние в известном поле расстояния и установите правильную единицу и щелкните глобальный (Рисунок 2D).
- Откройте исходное изображение с баром масштаба на Фиджи имадж (рис.2a). Убедитесь, что изображение имеет тот же размер и измерение, что и анализируемые изображения. Используйте инструмент выделения линии, чтобы нарисовать линию известной длины (Рисунок 2B).
-
Установка макроса
- Если плагин ilastik не установлен, выполните следующие действия: нажмите справки, обновление.... На открытое окно имиджи АПДЕЙТЕР, нажмите кнопку управления обновление сайтов. На открытом окне управлять обновление сайтов, нажмите кнопку рядом с ilastik , а затем нажмите кнопку Закрыть. Затем нажмите Применить изменения в окне имиджей АПДЕЙТЕР. Этот процесс может занять некоторое время. Следующее окно будет информация с текстом обновляется успешно. Щелкните о'кей и перезагрузите Iieej.
- Нажмите плагины, макросыи установки (рис. 3а). Затем выберите счетчик. IJM файл (см. дополнительную информацию) и нажмите кнопку Open.
Примечание: Макрос был написан специально для измерения площади. Макрос должен быть установлен каждый раз, когда программное обеспечение открыто.
-
Анализ местности
- Проанализируйте изображения при установке всех плагинов. Нажмите плагины и прокрутите вниз до иластик (Рисунок 3C). Выберите Импорт hdf5, выберите файл с. Н5 формат, нажмите кнопку Открыть и загрузить и применить Лут (Рисунок 3C, D).
- Нажмите кнопку с клавиатуры (макро) и область появится в окне сводки как Общая площадь (Рисунок 3E).
Результаты
Через четыре дня после UT-ГТК-42 б (метастатического гортани ГТК) ячейки посева, матрицы (HМДМ/фибрат, MSDM, или коллаген) был добавлен на сформированных сфероидов (день 0) и вторжение контролируется в течение трех дней. Изображения здесь были получены ежедневно с помощью перевернутого микроскопа (рис. 4).
После встраиваемых клеток в матрице ХМДМ/фибрат начал быстро вторгаться после одного дня и расширен в матрицу (рис. 4A). Клетки в MSDM не вторгаются в окружающие матрицы, а формируют асимметричную структуру (Рисунок 4B). С другой стороны, клетки в коллагене вторглись незначительно, но из-за матрицы усадки анализ был трудным (Рисунок 4C). В некоторых коллагеновых скважинах, сфероиды даже исчезли через три дня (рис. 4C).
На рисунке 5 показано количественное определение клеточного вторжения в хмдм/фифине основной клеточной линии ГОРТАНИ ГТК ут-ЦКС-42 а и соответствующая метастатическая клеточная линия UT-ТК-42 б. Видео (фильм 1), принятое с использованием системы анализа живых клеток в СФЕРОИД хмдм/фибрат, показывает движение клеток ГТК внутри матрицы, где они образуют нити, за которыми следуют другие клетки.
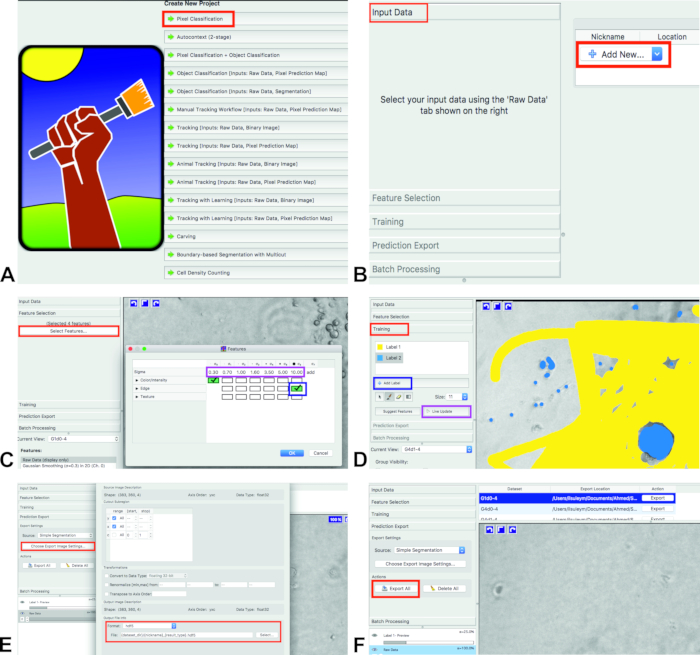
Рисунок 1 : Сегментация изображения. Выбранные этапы сегментации изображений с использованием иластик. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
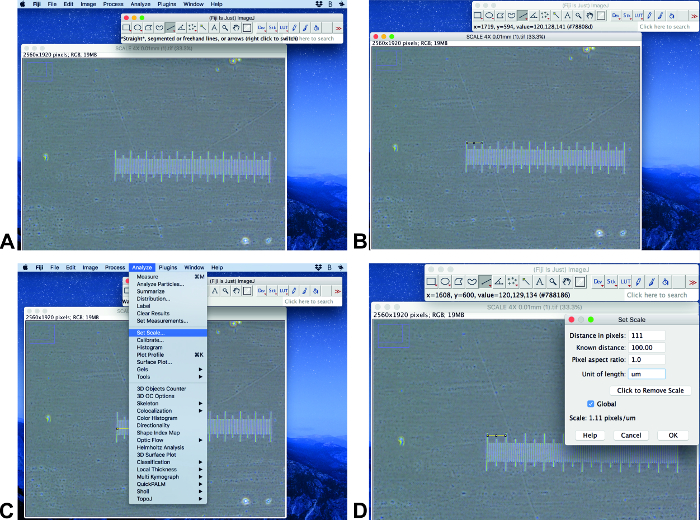
Рисунок 2 : Настройка масштаба. Выбранные этапы настройки масштаба с использованием фиджийского имиджей. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
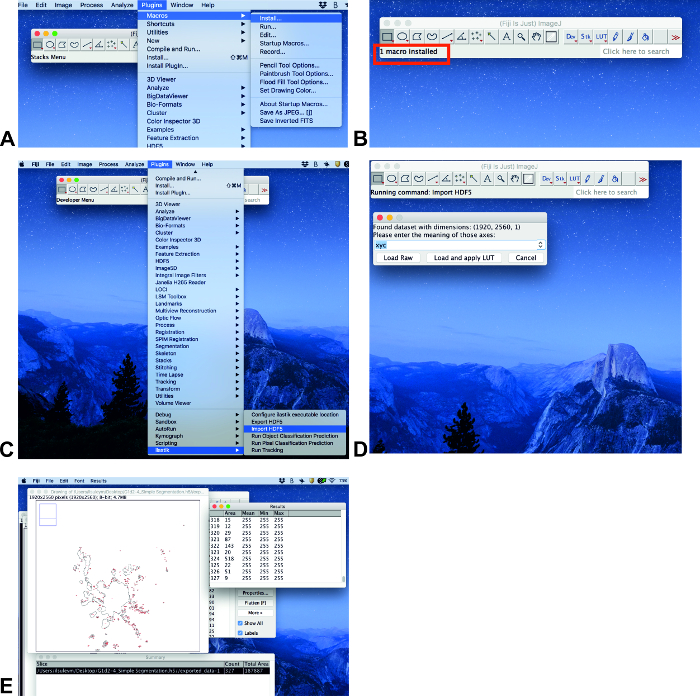
Рисунок 3 : Анализ вторжения с использованием имиджей. Выбранные этапы анализа изображения с использованием фиджийского имиджей. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
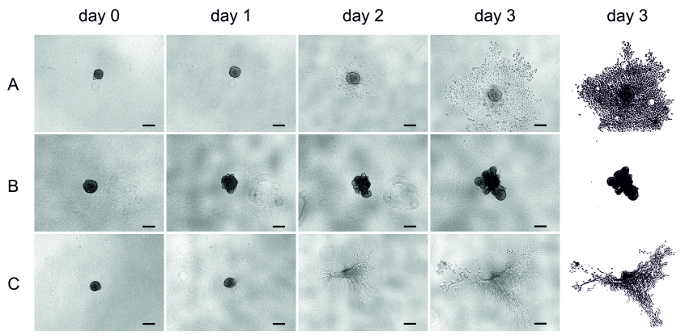
Рисунок 4 : UT-ГТК-42 в ячейки вторжения в трех различных матриц. Представительные образы вторжения клеток ГТК в 3D сфероиды. Вторжение последовало в течение трех дней и изображения были взяты ежедневно с помощью перевернутого микроскопа. (A) хмдм/фибрат, (B) MSDM, (C) коллаген. Последняя колонка представляет уточнение вторжения в день 3. Шкала планка = 200 мкм. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.
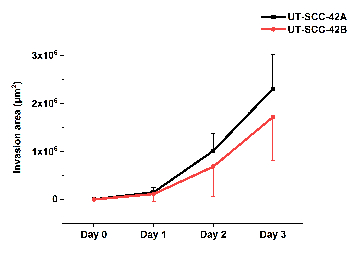
Рисунок 5 : Количественное определение вторжения клеток ГТК в МДМ/фибрат. Первичный Ларин ут-ККС-42 а и соответствующий метастатический Ларин ут-ГТК-42 b ГТК вторжение клеточной линии было проанализировано с использованием ilастик и Фиджи Iiiij программного обеспечения. Результаты представляют среднее ± стандартное отклонение от трех независимых экспериментов, каждая из которых имеет три в трех экземплярах. Пожалуйста, нажмите здесь, чтобы посмотреть увеличенном варианте этой фигуры.

Видео 1: Движение ГТК Cell в пределах хмдм/фибрата в течение трех дней. Пожалуйста, нажмите здесь, чтобы посмотреть это видео. (Щелкните правой кнопкой мыши для скачивания.)
Обсуждение
Представленный метод обеспечивает 3D человека опухоли на основе анализа для оценки инвазивности раковых клеток внутри человека опухоли микроокружения подражая матрицы. Нашествие клетки рака можно легко измерить ежедневным изображениями с стандартным микроскопом и с помощью програмного обеспечения анализа изображения. Метод демонстрирует клеточного вторжения, а не просто распространения.
В отличие от MSDM, матрица HМДМ/фибрата не требует контроля температуры. Этот метод прост в выполнении, в частности, без необходимости переноса сфероидов с одной пластины на другую. Он имеет только один технически чувствительный шаг, добавление фифиногена к матрице. Так как фифиноген начинает гель через несколько минут, добавление фифиногена требует крепкого пипетки и лечения лишь нескольких скважин за один раз. Существует также риск возникновения тревожной сфероида и перемещение его от центрального положения в U-образный хорошо, если петтинг делается в высоком давлении образом. Дислокации сфероида может осложнить визуализации и в конечном итоге анализа.
Анализ может быть изменен путем изменения концентрации ХМДМ или фифиногена. Клетки также могут быть фиксированными и окрашенных для последующего молекулярного исследования. Даже при том, что этот метод может быть изменен в полностью автоматизированной форме, он также может быть осуществлен с нормальным микроскопом и двумя открытыми исходными программами, без необходимости в дорогостоящем оборудовании.
По сравнению с традиционными MSDM на основе 3D-тестов, этот анализ может отображать лучше свойств ячейки вторжения. Сфероидов, выращенных в подвале мембраны содержащих ламининин богатых матрицы, таких как MSDM, может иметь более пролиферацию раковых клеток, чем фактическое вторжение, что делает его непригодным для вторжения анализов в нескольких клетках рака линии из-за их низкой мощности вторжения. Другая часто используемая матрица, коллаген типа I, имеет тенденцию сокращаться по краям при выращивании в 3D, что влияет на локализацию сфероидов и изображение скважин. Кроме того, различия между внутренними инвазивными свойствами более (HSC-3) и менее (ГТК-25) агрессивный язык клеточных линий карциномы были продемонстрированы с помощью человека опухоли микросреды имитирующей модели (миома дисков и ее растворимой форме матрица)10,13.
Анализ также более этичен, чем использование MSDM, так как HМДМ извлекается из оставшегося материала опухоли лейомиомы человека. В настоящее время, hмдм является единственным доступным человека опухоль-производные ег продукт, который, как представляется, подходит для многих связанных с раком в пробирке исследования8,10. В будущем, животные ткани производные матрицы могут быть заменены человека опухоли на основе матрицы, чтобы уменьшить необходимость пожертвовать животных для матричных производства.
Замена исследования культуры 2D клеток с помощью 3D-методов обеспечивает более точную информацию о поведении раковых клеток. В настоящее время существует несколько 3D моделей и коммерческих матриц, но, к сожалению, никто не подходит для всех раковых клеток линии. Исследователи должны выбрать наиболее подходящую матрицу для их конкретного анализа. Оптимальное согласование анализа и матрицы может быть сложным, но это может значительно повысить надежность результатов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарят спонсоров этого исследования: Фонд Сигрид Юстилюс, общество рака Финляндии и фонды исследований Центральной больницы Хельсинкского университета. Авторы признают подразделение по визуализации Биомедикума в Хельсинкском университете для технической помощи.
Материалы
| Name | Company | Catalog Number | Comments |
| Amphotericin B solution | Merck | A2942 | |
| Aprotinin from bovine lung | Merck | A6279 | Measure the protein concentration before use. |
| Ascorbic acid | Applichem | A1052 | |
| BioLite Cell Culture Treated Flasks | Thermo Scientific | 130190 | |
| DMEM/F-12 | Gibco by Life Technologies | 31330-038 | |
| DS-Fi2 Digital Camera | Nikon Instruments | ||
| DS-U3 Digital Camera Controller | Nikon Instruments | ||
| Eclipse TS100 Inverted Microscope | Nikon Instruments | ||
| Fetal bovine serum (FBS) | Gibco by Life Technologies | 10270106 | Heat inactivate for 30 min at 56 °C in waterbath before use. |
| Fibrinogen, Plasminogen-Depleted, Human Plasma | Merck | 341578 | Solubility: 25 mg/ml in H2O. Warm the H2O and the fibrinogen to 37 °C prior to dissolution. Do not disturb until the fibrinogen is completely solubilized. Stock solutions stored at -70 °C should be thawed in a water bath maintained at 37 °C. |
| Fiji ImageJ 1.51 image processing program | Freeware, NIH | ||
| Hydrocortisone | Merck | H0888 | |
| Ilastik software for image classification and segmentation | Freeware | ||
| IncuCyte Zoom Live-Cell Analysis System | Essen BioScience | ||
| Myogel | Lab made | ||
| Penicillin-Streptomycin | Gibco by Life Technologies | 15140-122 | |
| Phosphate buffered saline (PBS) | Lab made | ||
| Scepter 2.0 Cell Counter | Merck | PHCC20040 | |
| Scepter Cell Counter Sensors, 60 µm | Merck | PHCC60050 | |
| Thrombin from human plasma | Merck | T6884-100UN | |
| Trypsin-EDTA (0.5%) 10x, no phenol red | Gibco by Life Technologies | 15400054 | |
| Ultra-Low Attachment 96-Well Plate | Corning | 7007 | |
| UT-SCC-42A and UT-SCC-42-B cell lines | The cell lines were established at the Department of Otorhinolaryngology-Head and Neck Surgery, Turku University Hospital (Turku, Finland). |
Ссылки
- Jung, H., et al. Cell Spheroids with Enhanced Aggressiveness to Mimic Human Liver Cancer In vitro and In Vivo. Scientific Reports. 7, 10499-10514 (2017).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10, 29 (2012).
- Nath, S., Devi, G. R. Three-dimensional culture systems in cancer research: Focus on tumor spheroid model. Pharmacology and Therapeutics. , 94-108 (2016).
- Albanese, A., Lam, A. K., Sykes, E. A., Rocheleau, J. V., Chan, W. C. W. Tumour-on-a-chip provides an optical window into nanoparticle tissue transport. Nature Communications. 4, 2718 (2013).
- Friedrich, J., Seidel, C., Ebner, R., Kunz-Schughart, L. A. Spheroid-based drug screen: considerations and practical approach. Nature Protocols. 4, 309-324 (2009).
- Berens, E. B., Holy, J. M., Riegel, A. T., Wellstein, A. A Cancer Cell Spheroid Assay to Assess Invasion in a 3D Setting. Journal of Visualized Experiments. (105), e53409 (2015).
- Vinci, M., Box, C., Eccles, S. A. Three-Dimensional (3D) Tumor Spheroid Invasion Assay. Journal of Visualized Experiments. (99), e52686 (2015).
- Salo, T., et al. A novel human leiomyoma tissue derived matrix for cell culture studies. BMC Cancer. 15, 981 (2015).
- Nurmenniemi, S., et al. A novel organotypic model mimics the tumor microenvironment. The American Journal of Pathology. 175, 1281-1291 (2009).
- Salo, T., et al. Organotypic three-dimensional assays based on human leiomyoma-derived matrices. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. 373 (1737), 20160482 (2018).
- Overall, C. M., Blobel, C. P. In search of partners: linking extracellular proteases to substrates. Nature Reviews Molecular Cell Biology. 8, 245-257 (2007).
- Ahmed, T. A. E., Dare, E. V., Hincke, M. Fibrin: a versatile scaffold for tissue engineering applications. Tissue Engineering Part B: Reviews. 14 (2), 199-215 (2008).
- Hoornstra, D., et al. Fermented Lingonberry Juice Inhibits Oral Tongue Squamous Cell Carcinoma Invasion In vitro Similarly to Curcumin. In Vivo. 32, 1089-1095 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены