Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dépistage cinétique de l'activité nucléane à l'aide de sondes d'acide nucléique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L'activité altérée de nucléase a été associée à différentes conditions humaines, sous-jacenteà son potentiel en tant que biomarqueur. La méthodologie modulaire et facile à mettre en œuvre de criblage présentée dans ce document permet la sélection des sondes spécifiques d'acide nucléique pour exploiter l'activité de nucléane comme biomarqueur de la maladie.
Résumé
Les nucléases sont une classe d'enzymes qui décomposent les acides nucléiques en catalysant l'hydrolyse des liaisons phosphodiester qui relient les sucres ribose. Les nucléases présentent une variété de rôles physiologiques vitaux dans les organismes procaryotes et eucaryotes, allant du maintien de la stabilité du génome à la protection contre les agents pathogènes. L'activité modifiée de nucléase a été associée à plusieurs conditions pathologiques comprenant des infections bactériennes et le cancer. À cette fin, l'activité de nucléane a montré un grand potentiel d'exploitation comme biomarqueur spécifique. Cependant, une méthode de dépistage robuste et reproductible basée sur cette activité demeure hautement souhaitable.
Ici, nous introduisons une méthode qui permet le criblage pour l'activité de nucléane utilisant des sondes d'acide nucléique comme substrats, avec la portée de différencier entre les conditions pathologiques et saines. Cette méthode offre la possibilité de concevoir de nouvelles bibliothèques de sondes, avec une spécificité croissante, d'une manière itérative. Ainsi, plusieurs séries de criblage sont nécessaires pour affiner la conception des sondes avec des caractéristiques améliorées, en profitant de la disponibilité d'acides nucléiques chimiquement modifiés. Le potentiel considérable de la technologie proposée réside dans sa flexibilité, sa haute reproductibilité et sa polyvalence pour le dépistage de l'activité nucléase associée aux maladies. On s'attend à ce que cette technologie permette le développement d'outils diagnostiques prometteurs avec un grand potentiel dans la clinique.
Introduction
Les nucléases sont une classe d'enzymes capables de ciquer les liaisons phosphodiester qui forment la structure dorsale des molécules d'acide nucléique. La grande diversité des nucléases rend leur classification assez difficile. Cependant, certains critères communs sont utilisés pour décrire les nucléases, comme la préférence pour le substrat (acide désoxyribonucléique (ADN) ou acide ribonucléique (ARN), le site de clivage (endonucleases ou exonuclées), ou la dépendance aux ions métalliques, entre autres1. Les nucléases sont des enzymes catalytiques hautement conservées qui ont des rôles fondamentaux dans les organismes procaryotes et eucaryotes et ont été utilisées, et continuent d'être utilisées, comme outils d'édition de gènes2. Ils sont également des acteurs fondamentaux dans l'entretien et la réplication de l'ADN, aidant à maintenir la stabilité du génome et participant aux processus de relecture3. Chez les bactéries, par exemple, les nucléases ont été identifiées comme des facteurs de virulence importants, capables de promouvoir la survie bactérienne en réduisant l'efficacité du système immunitaire de l'hôte4,5,6,7 ,8. Chez les mammifères, on a suggéré que les nucléases soient impliquées dans l'apoptose9, la biogenèse et l'entretien mitochondriaux10 et la médiation des réponses immunitaires innées antibactériennes et antivirales11. Comme on pouvait s'y attendre, des altérations de l'activité nucléane, qu'elles soient améliorées ou en l'absence, ont été impliquées dans un large éventail de maladies humaines. Ces maladies vont d'une grande variété de cancers12,13 à l'hypertrophie cardiaque10 ou les maladies auto-immunes14. Par conséquent, les nucléases sont devenues des candidats intéressants comme biomarqueurs pour un groupe hétérogène de conditions humaines. En fait, les nucléases ont déjà démontré leur potentiel en tant qu'outils de diagnostic efficaces pour la détection des infections causées par des agents bactériens spécifiques, tels que Staphylococcus aureus ou Escherichia coli15, 16. Dans beaucoup de types de cancer, l'expression de la protéine de domaine de nucléase staphylococcique-contenante 1 (SND1) ribonuclease est indicative du pronostic pauvre17. Dans les patients de cancer pancréatique, les niveaux élevés de sérum de ribonuclease I (RNase I) ont été rapportés18 et ont proposé d'être associés aux phénotypes cancéreux de cellules19. Dans les affections cardiaques ischémiques, telles que l'infarctus du myocarde ou l'angine de poitrine instable, les niveaux de sérum de désoxyribonuclease I (DNase I) se sont avérés être un marqueur diagnostique valide20,21.
On a émis l'hypothèse que le plan global de l'activité nucléase peut être différent dans les états sains et les états de maladie. En fait, des rapports récents ont utilisé des différences dans l'activité nucléase pour distinguer entre les phénotypes sains et cancéreux22 ou pour identifier les infections bactériennes pathogènes d'une manière spécifique à l'espèce15,23. Ces résultats ont ouvert une nouvelle voie pour l'utilisation des nucléases comme biomarqueurs de la maladie. Par conséquent, il est nécessaire de mettre au point une méthode de dépistage complète capable d'identifier systématiquement les différences associées à la maladie dans l'activité nucléase, qui peuvent être d'une importance capitale dans le développement de nouveaux outils de diagnostic.
Dans ce cas, nous introduisons et décrivons une nouvelle approche de dépistage in vitro (figure 1) pour identifier les sondes sensibles et spécifiques capables de discriminer entre l'activité nucléase en bonne santé et malsaine, ou l'activité spécifique à un type de cellule ou de bactéries. Profitant de la modularité des acides nucléiques, nous avons conçu une première bibliothèque de sondes oligonucléotides fluorescentes étanchées composées d'un ensemble complet de différentes séquences et chimies, les deux étant des paramètres importants pour la conception de la bibliothèque. Ces sondes d'oligonucléotide sont flanquées d'un fluorophore (fluorescein amidite, FAM) et d'un quencher (tide quencher 2, TQ2) aux 5' et 3' extrémités respectivement (tableau 1). En utilisant cet air fluorométrique basé sur le transfert d'énergie par résonance fluorescente (FRET) pour mesurer la cinétique de la dégradation enzymatique, nous avons pu identifier les sondes candidates ayant le potentiel de discriminer les modèles différentiels d'activité nucléane associés à des états sains ou malades. Nous avons conçu un processus itératif, dans lequel de nouvelles bibliothèques sont créées sur la base des meilleures sondes candidates, qui permet d'identifier des sondes candidates toujours plus spécifiques dans les étapes de dépistage ultérieures. De plus, cette approche tire parti de la nature catalytique des nucléases pour augmenter la sensibilité. Ceci est réalisé en tirant parti de la nature activatable des sondes de reporter et de la capacité des nucléases à traiter continuellement des molécules de substrat, représentant tous deux des avantages clés par rapport aux anticorps alternatifs ou aux méthodes de criblage à base de petites molécules.
Cette approche offre un outil de dépistage hautement modulaire, flexible et facile à mettre en œuvre pour l'identification de sondes d'acide nucléique spécifiques capables de discriminer entre les états sains et les états pathiques, et une excellente plate-forme pour le développement de nouveaux diagnostics qui peuvent être adaptés pour de futures applications cliniques. En tant que tel, cette approche a été utilisée pour identifier l'activité de nucléane dérivée de Salmonella Typhimurium (ci-dessus appelé Salmonella) pour l'identification spécifique de cette bactérie. Dans le protocole suivant, nous rendons compte d'une méthode pour dépister l'activité bactérienne de nucléase utilisant l'analyse cinétique.
Protocole
1. Conception et préparation de la bibliothèque Oligonucleotide
- Conception de bibliothèque
- Sur la base des critères suivants, une bibliothèque de sondes d'oligonucléotides fluorescents étanchéités de 8 à 12 mers de long afin d'éviter la formation de structures secondaires, avec une longueur égale pour toutes les sondes.
- Inclure au moins un ADN et une séquence aléatoire d'ARN contenant une combinaison d'adénine (A), de guanine (G), de cytosine (C) et de thymine (T)/uracil (U)(sondes d'ADN et d'ARN dansle tableau 1 ).
REMARQUE : Les séquences d'ADN et d'ARN décrites dans le tableau 1 ont été utiles comme substrats initiaux pour classer un type inconnu d'activité nucléase, soit DNase ou RNase. Ces deux séquences sont recommandées comme point de départ pour tout dépistage, car elles ont montré une grande capacité à détecter les profils d'activité nucléane dans les bactéries et les échantillons de tissus. Si l'activité de nucléase n'est pas observée avec ces séquences d'ADN et d'ARN, la conception des oligonucléotides supplémentaires est nécessaire. - Inclure des séquences de polynucléotides composées d'un seul type de nucléotide pour déterminer la dépendance à la séquence pour une activité de nucléane donnée (DNA-Poly A, DNA-Poly T, DNA-Poly C, ADN-Poly G, RNA-Poly A, RNA-Poly U, RNA-Poly C et RNA-Poly G dans le tableau 1).
- En utilisant la même séquence de résidus de nucléotides que les séquences initiales d'ADN et d'ARN, incluez des séquences qui contiennent des analogues nucléosides hébergeant des modifications chimiques à la position de 2'-du sucre de ribose, tels que 2'-Fluoro et 2'-O-Methyl, comme une étape rigoureuse pour augmenter la sélectivité des nucléases.
- Inclure des séquences entièrement modifiées composées entièrement d'analogues nucléosides de 2'-Fluoro ou d'analogues nucléosides 2'-O-Methyl (All 2'-F et All 2'-OMe, Tableau 1)
- Inclure des séquences chimériques composées de purines naturelles non modifiées et d'analogues nucléosides de 2'-Fluoro pyrimidine (RNA Pyr-2'F, tableau 1).
- Inclure des séquences chimériques composées de purines naturelles non modifiées et d'analogues nucléodés de pyrimidine 2'-O-Methyl (RNA Pyr-2'OMe, tableau 1).
- Inclure des séquences chimériques composées de pyrimidines naturelles non modifiées et d'analogues nucléodés purines de 2'-Fluoro (ARN Pur-2'F, tableau 1).
- Inclure des séquences chimériques composées de pyrimidines naturelles non modifiées et d'analogues nucléonus purines 2'-O-Methyl (RNA Pur-2'OMe, tableau 1).
- Inclure au moins un ADN et une séquence aléatoire d'ARN contenant une combinaison d'adénine (A), de guanine (G), de cytosine (C) et de thymine (T)/uracil (U)(sondes d'ADN et d'ARN dansle tableau 1 ).
- Sur la base des critères suivants, une bibliothèque de sondes d'oligonucléotides fluorescents étanchéités de 8 à 12 mers de long afin d'éviter la formation de structures secondaires, avec une longueur égale pour toutes les sondes.
- Préparation et stockage de la sonde Oligonucleotide
REMARQUE : Les oligonucléotides sont synthétisés par la méthode de la phosphoramidite. Après synthèse, les oligonucléotides sont purifiés à l'aide d'une chromatographie liquide de haute performance (HPLC) et la masse est mesurée par spectrométrie de masse.- Faites tourner les sondes oligonucléotides lyophilisées à l'aide d'une centrifugeuse et diluez-les dans le tampon Tris-EDTA (TE) pour prévenir la dégradation de la nucléase. Déterminer le volume de dilution en fonction du rendement de chaque sonde pour rendre une solution de stock avec une concentration de 500 pmol/L.
- Conserver les oligonucléotides lyophilisés à 4 oC ou à température ambiante à court terme. Pour le stockage à long terme (de plusieurs mois à des années), entreposez les oligonucléotides lyophilisés à -20 oC. Après la résuspension des oligonucléotides lyophilisés en TE, entreposez les solutions de stock à -20 oC ou, de préférence, à -80 oC.
2. Culture bactérienne
- Prenez une perle de verre poreuse du flacon de stockage cryogénique dans des conditions stériles.
- Pour isoler les colonies bactériennes individuelles (Salmonella et E. coli), utilisez la méthode du quadrant24 en stries/rouler la perle directement sur un plat Petri contenant Tryptic Soy Agar (TSA) moyen complété par des moutons défigétés sang.
- Incuber la culture à 37 oC pendant 24 h.
3. Préparation de supernatant
- Transférer une seule colonie de milieux solides à 50 ml de bouillon de soja tryptique (TSB) et couver à 37 oC pendant 24 h à 200 tr/min.
- Diluer la culture (1:500) dans le BST (sous-culture) et incuber à 37 oC pendant 24 h à 200 tr/min dans un incubateur secouant.
REMARQUE : On s'attend à ce qu'après 24 heures d'incubation les cultures bactériennes soient en phase stationnaire atteignant des valeurs supérieures à 109 CFU/mL. - Après la période d'incubation, transférer les cultures vers des tubes stériles plafonnés et une centrifugeuse à 4 500 x g pendant 30 min.
- Recueillir le supernatant et l'utiliser immédiatement. Vous pouvez également conserver les supernatants à 4 oC ou à -20 oC.
4. Etoiles d'activité nucléane
- Préparation de solutions de travail
- Préparer une solution de travail de 20 l pour chaque sonde dans des tubes microcentrifugesans nucléases de 1,5 ml en diluant (1:10 ratio) la solution de stock (500 pmol/L) pour une concentration de travail finale de 50 pmol/L. À cette fin, mélanger 18 l de phosphate tampon saline (PBS) contenant MgCl2 et CaCl2 avec 2 'L de solution de stock de sonde.
REMARQUE: Soyez conscient que dans la solution de travail, les oligonucléotides sont plus vulnérables à la dégradation des nucléasses, par conséquent, il est recommandé de préparer les solutions de travail juste avant de mettre en place la réaction. - Évitez le contact direct avec la lumière pendant la préparation et gardez-le dans l'obscurité (enveloppé dans du papier d'aluminium), lorsqu'il s'agit de fluorophores.
- Préparer une solution de travail de 20 l pour chaque sonde dans des tubes microcentrifugesans nucléases de 1,5 ml en diluant (1:10 ratio) la solution de stock (500 pmol/L) pour une concentration de travail finale de 50 pmol/L. À cette fin, mélanger 18 l de phosphate tampon saline (PBS) contenant MgCl2 et CaCl2 avec 2 'L de solution de stock de sonde.
- Réaction mise en place
- Préchauffer le fluoromètre (p. ex. Cytation 1) à 37 oC.
- Préparer un ensemble (un tube/sonde) de tubes microcentrifuge sans nucléarité de 1,5 ml pour chaque échantillon (TSB, E. coli et Salmonella)et étiqueter en conséquence.
- Ajouter délicatement 96 L de supports culturels stériles du BST, Salmonella supernatant ou E. coli supernatant (à partir de l'étape 3.4.). Par la suite, ajoutez en conséquence une solution de travail de 4 l/tube de sonde. Effectuez cette étape à température ambiante.
REMARQUE : 10 sondes ont été utilisées pour le premier tour du criblage et 6 sondes pour le deuxième tour. - Bien mélanger en pipetting de haut en bas pour obtenir une solution homogène. Évitez d'introduire des bulles d'air dans les échantillons tout en mélangeant.
- Chargez 95 L de chaque solution (sonde et supernatant ou média culturel) dans un puits séparé d'un fond noir, non traité 96 plaque de puits. Minimisez la formation de bulles dans les puits lors du chargement en distribuant soigneusement avec la pointe près de la paroi du puits.
- Couvrir la plaque avec son couvercle. Inspectez visuellement le couvercle et vérifiez s'il y a des marques de stylo ou une accumulation de particules de poussière qui peuvent introduire des artefacts de mesure. Remplacez le couvercle pour un nouveau si c'est le cas.
- Mesure mise en place
- Ouvrez le logiciel d'acquisition (Gen5 3.05) en cliquant sur l'icône de raccourci logiciel (Figure S1A).
- Sélectionnez Lire maintenant à partir de la fenêtre du gestionnaire de tâches et choisissez Nouveau... pour créer le protocole de mesure cinétique (Figure S1B).
- Cliquez sur La température définie dans la fenêtre de dialogue intitulée Procédure et sélectionnez 37 oC. Confirmer et enregistrer les paramètres en appuyant sur OK (Figure S1C).
- Cliquez sur Démarrer Kinetics dans la fenêtre de dialogue intitulé Procédure. Ensuite, dans la fenêtre de dialogue pop-up, intitulé Étape cinétique, sélectionnez 2 h dans la boîte d'entrée Run Time et 2 min dans la boîte d'entrée Interval. Confirmer et enregistrer les paramètres en appuyant sur OK (Figure S1D).
- Cliquez sur Lire dans la fenêtre de dialogue intitulée Procédure. Ensuite, dans la fenêtre de dialogue pop-up, intitulé Lire la méthode, sélectionnez l'intensité de fluorescence comme méthode de détection, Endpoint / Kinetic comme un type de lecture et filtres comme type optique. Confirmer et enregistrer les paramètres en appuyant sur OK (Figure S1E).
- Dans la fenêtre de dialogue pop-up intitulée Read Step (Kinetic), sélectionnez Vert à partir de l'ensemble de filtre. Confirmer et enregistrer les paramètres en appuyant sur OK (Figure S2A).
- Dans la fenêtre de dialogue intitulée Procédure, sélectionnez utiliser le couvercle et cliquez sur valider pour s'assurer que le protocole créé est valide. Ceci est confirmé par une fenêtre de dialogue pop-up (Figure S2B).
- Sélectionnez le protocole dans la barre de menu et choisissez la procédure (Figure S2C).
- Dans la fenêtre de dialogue intitulée Procédure, définir les puits à mesurer (Figure S2D).
- Entrez le nom de l'expérience dans la boîte d'entrée de nom de fichier (Figure S2E).
- Chargez la plaque avec son couvercle dans le lecteur de plaque. Assurez-vous que la plaque est dans la bonne orientation.
- Démarrer l'acquisition en cliquant sur lire le nouveau bouton dans la barre d'outils ( FigureS2F).
- Analyse des données
- Cliquez sur l'un des puits mesurés dans la fenêtre de dialogue intitulée Plaque 1 (Figure S3A).
- Cliquez sur sélectionner les puits et inclure tous les puits mesurés dans la fenêtre de dialogue de sélection de puits. Confirmer et enregistrer les paramètres en appuyant sur OK. (Figure S3B).
- Sélectionnez les données dans la fenêtre de dialogue intitulée Plate 1 pour visualiser les résultats tabulés (Figure S3C).
- Exporter les données vers une feuille de calcul en sélectionnant l'exportation rapide à partir du menu contextuel (Figure S3C).
- Dans la feuille de calcul, étiquetez les colonnes de données en conséquence pour chaque échantillon et sonde.
- Générer des graphiques cinétiques, en utilisant la ligne avec le style des marqueurs, en traçant les unités de fluorescence relative (RFU) par rapport au temps (x-axe: chronologie de la réaction et y-axe: RFU).
REMARQUE : La description de la génération d'un graphique s'applique à l'utilisation de programmes de feuilles de calcul (p. ex., Excel). Cependant, tous les autres programmes peuvent être utilisés pour générer des graphiques à partir des données brutes obtenues, en traçant RFU par rapport au temps. - Calculer le taux de la réaction enzymatique pour chaque intervalle mesuré
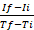 selon la formule suivante25: taux , où Si est RFU au point de temps d'intervalle maximal et Ii est RFU au point de temps d'intervalle minimal, et Tf et Ti sont les points de temps d'intervalle maximum et minimal, respectivement.
selon la formule suivante25: taux , où Si est RFU au point de temps d'intervalle maximal et Ii est RFU au point de temps d'intervalle minimal, et Tf et Ti sont les points de temps d'intervalle maximum et minimal, respectivement. - Sélectionnez le taux avec la valeur la plus élevée (Rmax) pour chaque courbe. S'il y a plus d'un Rmax par échantillon, sélectionnez celui qui se produit au premier point de mesure.
- Calculer le rapport entre Rmax et la valeur moyenne de l'intervalle de temps auquel se produit Rmax : coefficient de taux
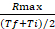
- Calculer la différence de pli (FD) entre le coefficient de taux de Salmonella et E. coli pour chaque sonde.
- Considérez une valeur de différence de pli supérieure à 3 comme significative.
- Considérez les sondes significatives avec les valeurs de différence de pli (FD) les plus élevées comme sondes de candidat et comme base pour la conception de bibliothèque dans la prochaine ronde de sélection.
5. Critères de sélection des rondes de dépistage (figure 1)
- Première série de projections
- Effectuer l'analyse d'activité nucléane (tel que décrit dans la section 4) à l'aide de sondes d'ADN, d'ARN et de polynucléotide.
- Évaluer la préférence pour la chimie de l'ADN ou la chimie de l'ARN en comparant le nombre et la performance (valeur FD) des sondes candidates à l'ADN et à l'ARN.
- Sélectionnez le type de chimie de l'acide nucléique qui rend le plus grand nombre de sondes candidates, comme l'illustre la figure 1.
- Deuxième série de dépistage
- Effectuer l'évaluation de l'activité nucléane (comme décrit à la section 4) à l'aide de sondes entièrement modifiées et de sondes chimériques conçues à partir du substrat d'acide nucléique sélectionné lors de la première ronde de dépistage.
- Évaluer la préférence pour les séquences contenant 2'-Fluoro et 2'-O-Methyl nucléoside analogues en comparant les résultats obtenus pour 2'-Fluoro et 2'-O-Methyl sondes candidat modifiés.
- Sélectionnez le type de modification analogique nucléoside qui rend le plus grand nombre de sondes candidates, comme l'illustre la figure 1.
Résultats
La figure 1 montre le flux de travail de cette méthodologie, qui est divisée en deux cycles de sélection. Dans la première série de dépistage, nous avons utilisé 5 sondes d'ADN (ADN, ADN Poly A, ADN Poly T, ADN Poly C et ADN Poly G) et aussi 5 sondes d'ARN (ARN, ARN Poly A, ARN Poly U RNA Poly C et RNA Poly G). Les données brutes de cette ronde de dépistage se trouvent dans le tableau supplémentaire 1. Au deuxième tour, les sondes modifiées chimiquement ont été...
Discussion
Des modifications de l'activité nucléase ont été associées à une grande variété de phénotypes de la maladie, y compris différents types de cancer et d'infections bactériennes. Ces modifications sont proposées pour être l'agent causal d'une condition14, tandis que dans d'autres cas, elles sont la conséquence d'un événement physiologique préjudiciable20 ou agent pathogène16,26. Comme on pouvait s'y a...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs aimeraient remercier Luiza I. Hernandez (Université de Link-ping) pour sa révision minutieuse du manuscrit et ses précieux conseils. Ce travail a été soutenu par la Fondation Knut et Alice Wallenberg et le Swedish Government Strategic Research Area in Materials Science on Advanced Functional Materials de l'Université Link-ping (Faculty Grant SFO-Mat-LiU no 2009-00971).
matériels
| Name | Company | Catalog Number | Comments |
| Black bottom, non-treated 96 well plate | Fisher Scientific | 10000631 | |
| Cytation1 | BioTek | CYT1FAV | |
| Eppendorf tubes | Thermofisher | 11926955 | |
| Escherichia coli | ATCC | 25922 | |
| Microbank cryogenic storage vial containing beads | Pro-Lab Diagnostics | 22-286-155 | |
| Nucleic acid probes | Biomers.net | # | |
| Phosphate Buffer Saline containing MgCl2 and CaCl2 | Gibco™ | 14040117 | |
| Salmonella enterica subs. Enterica | ATCC | 14028 | |
| Tris-EDTA | Fisher Scientific | 10647633 | |
| Tryptone Soya Agar with defibrinated sheep blood | Thermo Fisher Scientific | 10362223 | |
| Tryptic Soy Broth | Sigma Aldrich | 22092 |
Références
- Yang, W. Nucleases: diversity of structure, function and mechanism. Quarterly Reviews of Biophysics. 44 (1), 1-93 (2011).
- Adli, M. The CRISPR tool kit for genome editing and beyond. Nature Communication. 9 (1), 1911 (2018).
- Mason, P. A., Cox, L. S. The role of DNA exonucleases in protecting genome stability and their impact on ageing. Age (Dordr). 34 (6), 1317-1340 (2012).
- Berends, E. T., et al. Nuclease expression by Staphylococcus aureus facilitates escape from neutrophil extracellular traps. Journal of Innate Immunity. 2 (6), 576-586 (2010).
- Kiedrowski, M. R., et al. Staphylococcus aureus Nuc2 is a functional, surface-attached extracellular nuclease. PLoS One. 9 (4), 95574 (2014).
- Morita, C., et al. Cell wall-anchored nuclease of Streptococcus sanguinis contributes to escape from neutrophil extracellular trap-mediated bacteriocidal activity. PLoS One. 9 (8), 103125 (2014).
- Hasegawa, T., et al. Characterization of a virulence-associated and cell-wall-located DNase of Streptococcus pyogenes. Microbiology. 156, 184-190 (2010).
- Moon, A. F., et al. Structural insights into catalytic and substrate binding mechanisms of the strategic EndA nuclease from Streptococcus pneumoniae. Nucleic Acids Research. 39 (7), 2943-2953 (2011).
- Li, L. Y., Luo, X., Wang, X. Endonuclease G is an apoptotic DNase when released from mitochondria. Nature. 412 (6842), 95-99 (2001).
- McDermott-Roe, C., et al. Endonuclease G is a novel determinant of cardiac hypertrophy and mitochondrial function. Nature. 478 (7367), 114-118 (2011).
- Wang, Y. T., et al. A link between adipogenesis and innate immunity: RNase-L promotes 3T3-L1 adipogenesis by destabilizing Pref-1 mRNA. Cell Death & Disease. 7 (11), 2458 (2016).
- Li, C. L., Yang, W. Z., Shi, Z., Yuan, H. S. Tudor staphylococcal nuclease is a structure-specific ribonuclease that degrades RNA at unstructured regions during microRNA decay. RNA. 24 (5), 739-748 (2018).
- Wan, L., et al. MTDH-SND1 interaction is crucial for expansion and activity of tumor-initiating cells in diverse oncogene- and carcinogen-induced mammary tumors. Cancer Cell. 26 (1), 92-105 (2014).
- Keyel, P. A. Dnases in health and disease. Developmental Biology. 429 (1), 1-11 (2017).
- Hernandez, F. J., et al. Noninvasive imaging of Staphylococcus aureus infections with a nuclease-activated probe. Nature Medicine. 20 (3), 301-306 (2014).
- Flenker, K. S., et al. Rapid Detection of Urinary Tract Infections via Bacterial Nuclease Activity. Molecular Therapy. 25 (6), 1353-1362 (2017).
- Kannan, N., Eaves, C. J. Tipping the balance: MTDH-SND1 curbs oncogene-induced apoptosis and promotes tumorigenesis. Cell Stem Cell. 15 (2), 118-120 (2014).
- Kemmer, T. P., Malfertheiner, P., Buchler, M., Kemmer, M. L., Ditschuneit, H. Serum ribonuclease activity in the diagnosis of pancreatic disease. International Journal of Pancreatology. 8 (1), 23-33 (1991).
- Fernandez-Salas, E., Peracaula, R., Frazier, M. L., de Llorens, R. Ribonucleases expressed by human pancreatic adenocarcinoma cell lines. European Journal of Biochemistry. 267 (5), 1484-1494 (2000).
- Fujibayashi, K., et al. Serum deoxyribonuclease I activity can be a useful diagnostic marker for the early diagnosis of unstable angina pectoris or non-ST-segment elevation myocardial infarction. Journal of Cardiology. 59 (3), 258-265 (2012).
- Kawai, Y., et al. Diagnostic use of serum deoxyribonuclease I activity as a novel early-phase marker in acute myocardial infarction. Circulation. 109 (20), 2398-2400 (2004).
- Hernandez, L. I., Ozalp, V. C., Hernandez, F. J. Nuclease activity as a specific biomarker for breast cancer. Chemical Communication (Cambridge). 52 (83), 12346-12349 (2016).
- Machado, I., et al. Rapid and specific detection of Salmonella infections using chemically modified nucleic acid probes. Analytica Chimica Acta. 1054, 157-166 (2019).
- Sanders, E. R. Aseptic laboratory techniques: plating methods. Journal of Visualized Experiment. (63), e3064 (2012).
- Worthington Biochemical Corporation. . Manual of Clinical Enzyme Measurements. , (1972).
- Burghardt, E. L., et al. Rapid, Culture-Free Detection of Staphylococcus aureus Bacteremia. PLoS One. 11 (6), 0157234 (2016).
- Bibette, J. Gaining confidence in high-throughput screening. Proceedings of the National Academy of Science U. S. A. 109 (3), 649-650 (2012).
- Hernandez, L. I., Machado, I., Schafer, T., Hernandez, F. J. Aptamers overview: selection, features and applications. Current Topics in Medicinal Chemistry. 15 (12), 1066-1081 (2015).
- Pande, J., Szewczyk, M. M., Grover, A. K. Phage display: concept, innovations, applications and future. Biotechnology Advances. 28 (6), 849-858 (2010).
- Skerra, A. Alternative binding proteins: anticalins - harnessing the structural plasticity of the lipocalin ligand pocket to engineer novel binding activities. FEBS Journal. 275 (11), 2677-2683 (2008).
- Ku, T. H., et al. Nucleic Acid Aptamers: An Emerging Tool for Biotechnology and Biomedical Sensing. Sensors (Basel). 15 (7), 16281-16313 (2015).
- Jayasena, S. D. Aptamers: an emerging class of molecules that rival antibodies in diagnostics. Clinical Chemistry. 45 (9), 1628-1650 (1999).
- Gray, B. P., Brown, K. C. Combinatorial peptide libraries: mining for cell-binding peptides. Chemical Reviews. 114 (2), 1020-1081 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon