Method Article
Transformations polyvalentes de CO2 en produits complexes : une stratégie en deux étapes en un seul pot
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les transformations de CO2 sont effectuées en une seule étape pour la synthèse de molécules complexes. Le sélectif 4 e- réduction du CO2 avec un réducteur d'hydroborane offre un intermédiaire bis (boryl)acetal réactif et polyvalent qui est ensuite impliqué dans la réaction de condensation ou la génération de couplage C-C carbene-négociée.
Résumé
Les transformations de CO2 à l'aide d'une méthode en deux étapes sont présentées ici. Le but de la méthode est de donner accès à une variété de produits à valeur ajoutée et notamment de générer des centres chiraux de carbone. La première étape cruciale consiste en la double hydroboration sélective du CO2 catalysé par un complexe d'hydride de fer. Le produit obtenu avec cette réduction 4 e- est un rare bis(boryl)acetal, composé 1, qui est soumis in situ à trois réactions différentes dans une deuxième étape. La première réaction concerne une réaction de condensation avec (diisopropyl)phenylamine offrant l'imine correspondante 2. Dans la deuxième et la troisième réaction, intermédiaire 1 réagit avec le triazol-5-ylidene (carbene d'Enders) pour se permettre des composés 3 ou 4,selon les conditions de réaction. Dans les deux composés, des liaisons C-C sont formées, et des centres chiraux sont générés à partir du CO2 comme seule source de carbone. Le composé 4 présente deux centres chiraux obtenus d'une manière diastereoselective dans un mécanisme de formose-type. Nous avons prouvé que le fragment de boryl restant joue un rôle clé dans ce contrôle stéréo sans précédent. L'intérêt de la méthode se situe sur la nature réactive et polyvalente de 1, donnant lieu à diverses molécules complexes à partir d'un seul intermédiaire. La complexité d'une méthode en deux étapes est compensée par le temps de réaction court global (2 h pour le temps de réaction plus long), et les conditions de réaction douces (25 oC à 80 oC et 1 à 3 atm de CO2).
Introduction
Compte tenu de l'intérêt important pour l'utilisation du CO2 comme source de carbone durable1,2,3, le but de la méthode est de transformer le CO2 en une variété de produits à valeur ajoutée.
Des recherches intenses visent à fonctionnaliser le CO24,5 ou à le réduire en acide formique (2 e- réduction), monoxyde de carbone (2 e- réduction), méthanol (6 e- réduction) ou méthane (8 e- réduction)1,6. L'interception du produit 2 e- réduction avec de l'amine, notamment, donne lieu à la formamide et à la méthylamine7,8,9. Ces domaines de recherche sont les plus avancés à ce jour. Cependant, la portée des fonctions accessibles et la valeur ajoutée des produits formés par rapport aux matériaux de départ restent assez minimes.
Pour contourner cette limitation, nous nous sommes concentrés i) sur les 4 e- réduction du CO2 et ii) sur l'application d'une procédure en deux étapes en un seul pot. L'intérêt de la procédure en deux étapes est de limiter les problèmes de compatibilité entre les deux étapes et, par conséquent, d'élargir le type de réactivité qui pourrait être menée après la première étape de réduction. Nous avons ciblé le 4 e- réduction du CO2 parce que le formaldéhyde -le plus simple 4 e- produit de réduction- est une source de carbone particulièrement réactive et polyvalente10,11. Il est utilisé dans la réaction de condensation comme source de méthylène et peut être polymérisé en glucides. Ce dernier -appelé réaction formose- est une transformation impressionnante générant la chaîne de carbone et les centres de carbone chiral uniquement à partir de formaldéhyde et est d'un intérêt élevé pour synthétique-12,13 et prébiotique-chimie14,15,16. Bien que nous soyons en mesure d'observer le formaldéhyde libre de l'hydroboration17du CO2, sa production sélective dans des conditions homogènes est encore sans précédent. Au lieu du formaldéhyde, nous avons développé la synthèse du composé bis(boryl)acetal 1 de la double hydroboration sélective du CO218,19.
Dans un pot deux processus d'étape, nous prouvons ici que, dans le même pot, ce intermédiaire 1 i) réagit comme un substitut de formaldéhyde dans les réactions de condensation18 ou ii) donne lieu à une réaction modifiée de type formose20. Dans cette dernière réaction, des centres de couplage C-C et de carbone chiral sont obtenus.
Protocole
CAUTION : Veuillez consulter les fiches de données sur la sécurité des matériaux (SDM) des produits chimiques avant utilisation. Veuillez utiliser les pratiques de sécurité appropriées lors de l'exécution des réactions suivantes et de l'équipement de protection individuelle. Une attention particulière doit être accordée à l'utilisation de la conduite de vide et du système de pression de gaz.
1. Synthèse du composé 2 du CO2 dans un tube de résonance magnétique nucléaire (RMN)
- Solution stock de Fe(H)2(dmpe)2: dissoudre 4,6 mg de Fe(H)2(dmpe)221,22 en 1 ml de tétrahydrofuran (THF)-d8.
REMARQUE: dmpe -1,2-bis (dimethylphosphino)ethane - Dans une boîte à gants, chargez un tube RMN avec 15,9 mg de 9-borabicyclo[3.3.1]nonane (9-BBN) et 100 l d'une solution de stock de Fe(H)2(dmpe)2 (1 mol%).
- Ajouter 0,5 ml de tétrahydrofuran (THF)-d8.
- Fermez le tube et apportez-le à l'extérieur de la boîte à gants.
- Connectez le tube à un système de gaz et placez-le à 25 oC pendant 15 minutes pour équilibrer la température de la solution à l'intérieur du tube.
REMARQUE : Le système de gaz relie la bouteille de CO2 à la ligne de vide et au tube RmN. Les connexions sont avec le tube de téflon et les connecteurs de Swadgelock (voir figure 1 pour un schéma de la configuration). Ce système permet d'ajouter la pression définie au régulateur à la température désirée. - Ajouter 1 atm de CO2.
- Laisser reposer 3 min sous une pression dynamique de CO2 et fermer le tube.
- Laisser le tube à 25 oC pendant 45 min.
REMARQUE : À cette étape bis(boryl)acetal 1 est généré à l'intérieur du tube de RMN dans le rendement de 85% (voir les résultats représentatifs pour l'analyse de RMN). - Solution de stock d'amine : dissoudre 177,3 mg de 2,6-(diisopropyl)phenylamine dans 1 mL de THF-d8. Une fois le composé 1 généré, ouvrez le tube RMN à l'intérieur d'une boîte à gants et ajoutez 55 l d'une solution de stock de la phénylamine de 2,6(diisopropyl), correspondant à 1 équivalent de la bis (boryl) générée 1.
- Fermez le tube et secouez-le la main pendant 10 s.
- Après 20 min, confirmer la formation de l'analyse imine 2 par 1H RMN (Figure 2). Utilisez le hexamethylbenzene (environ 10 mol% vs 9-BBN) comme norme interne pour déterminer le rendement de la RMN.
2. Synthèse du composé 3 à partir du CO2 dans un Fisher Porter
- Chargez un Fisher Porter avec 320 mg de 9-BBN, 9,4 mg de Fe(H)2(dmpe)2 et une barre magnétique en remuant21,22.
- Ajouter 10 ml de THF.
- Fermez le Fisher Porter et sortez de la boîte à gants.
- Placez-le à 25 oC pendant 15 min pour équilibrer la température de la solution.
- Connectez le Fisher Porter au réseau de gaz et ajoutez 1 atm de CO2.
REMARQUE : Le système de gaz relie la bouteille de CO2 à la ligne d'aspirateur et au Fisher Porter. Les connexions sont avec le tube de téflon et les connecteurs de Swadgelock (voir figure 1 pour un schéma de la configuration). Ce système permet d'ajouter la pression définie au régulateur à la température désirée. - Laisser reposer 3 min sous une pression dynamique de CO2,fermer le tube et remuer à 25 oC pendant 45 min.
REMARQUE : Cette étape correspond à la génération sélective de bis(boryl)acetal 1 de l'hydroboration de CO2 dans le rendement de 85%. - Après 45 min, ouvrir le Fisher Porter dans une boîte à gants et ajouter une solution de 380 mg de triazol-5-ylidene en 6 ml de THF.
- En dehors de la boîte à gants, chargez le Fisher Porter avec 3 atm de CO2.
- Remuer la solution à 60 oC pendant 60 min sous une pression dynamique de 3 atm de CO2.
- Laissez la solution refroidir à température ambiante.
- Retirer les volatiles sous vide et laver les résidus avec 3x 2 ml de diéthylène (Et2O) à 0 oC pour obtenir le CO2 adduct 3 sous forme de poudre blanche (Figure 3).
- Pour générer des monocristaux, placez une solution concentrée DE THF/pentane à -37 oC pendant 24-48 h.
3. Synthèse du composé 4 à partir du CO2 dans un Fisher Porter
- Dans une boîte à gants, chargez un tube Fisher Porter avec 159 mg de 9-BBN, 4,7 mg (1 mol%) de Fe(H)2(dmpe)2 et une barre magnétique en remuant.
- Ajouter 5 ml de THF.
- Fermez le Fisher Porter et sortez de la boîte à gants.
- Placez-le à 25 oC pendant 15 min pour équilibrer la température de la solution.
- Connectez le Fisher Porter au réseau de gaz et ajoutez 1 atm de CO2.
- Laisser 3 min sous une pression dynamique de CO2,fermer le Fisher Porter et remuer à 25 oC pendant 45 min.
REMARQUE : Cette étape correspond à la génération sélective de bis(boryl)acetal 1 de l'hydroboration de CO2 dans le rendement de 85%. - Après la génération de 1, ouvrez le Fisher Porter dans une boîte à gants et ajoutez 54 mg de triazol-5-ylidene.
- À l'extérieur de la boîte à gants, remuer la solution à 80 oC pendant 40 min pour générer un mélange de composés contenant du composé 4.
- Retirer le solvant et dissoudre une partie du résidu dans 0,6 ml de THF-d8.
- Filtrer la solution à l'égard d'une seringue équipée d'un filtre PTFE (0,2 m) et la placer dans un tube RMN pour analyse. Utilisez le hexamethylbenzene (environ 10 mol% vs 9-BBN) comme norme interne pour déterminer les rendements de la RMN.
4. Synthèse alternative du composé 4 de d,l-Glyceraldéhyde
- Dans une boîte à gants, chargez un tube Schlenk avec 50 mg de d,l-Glyceraldéhyde, 135 mg de 9-BBN et une barre magnétique de remuement.
- Ajouter 4 ml de THF.
CAUTION: À la dissolution du composé, h2 évolution se produit. - Fermez le Schlenk avec un septum et collez une aiguille dedans pour permettre la libération constante de H2 formé.
- Remuer la suspension blanche à température ambiante pendant 24 h à l'intérieur de la boîte à gants.
- Ajouter 165 mg de triazol-5-ylidene.
- Remuer 3 h à température ambiante. Tous les résidus se solubilisent pendant ce temps.
- Retirer les volatiles sous vide.
- Solubiliser les résidus dans une quantité minimale de Et2O (1 ml) et placer la solution à -37 oC pendant 12 h.
- Composé 4 précipite. Retirer le filtrate par filtration et sécher le précipité sous vide.
- Isolez le composé 4 comme poudre blanche dans le rendement de 72%.
Résultats
La génération réussie du composé bis(boryl)actal 1 est évaluée par 1analyse de RMN H avec le choix caractéristique de méthylène à 5,54 ppm dans THF-d8 (Figure 4a). La production réussie du composé 2 est évaluée par 1h NMR analyse avec le signal AB caractéristique (7,73 (d, 1H, 2JH-H - 18,4 Hz, CH2), 7,30 (d, 1H, 2JH-H - 18,4 Hz, CH2) pour les deux protons inéquivalents de la méthylène en THF-d8 ( Figure4b). La production réussie du composé 3 est évaluée par 1analyse H RMN dans THF-d8 (figure 4c). Les signaux les plus notables sont le CHCO2 à 5,34 ppm, et le CH du fragment BBN à 0,26 et -0,65 ppm. La production réussie du composé 4 est évaluée par 1analyse de RMN H dans THF-d8. Comme le montre la figure 4d, composé 4, in situ généré par le CO2, est notamment caractérisé par un doublet à 4,64 ppm (3JH-H - 7,9 Hz, H3) et un pseudo-t à 3,36 (2JH-H - 9,7 Hz, 3JH-H - 9,5 Hz, 1H, H1b). Dans le composé 4 isolé de d,l-Glyceraldéhyde, les quatre signaux de proton de la chaîne C3 sont clairement observés (Figure 4e) et les trois atomes de carbone de la chaîne sont caractérisés dans l'analyse de 13RMN de 1 MD À 1Hà 76,9 (C2), 74,0 (C3) et 71,5 (C1) ppm (Figure 5).
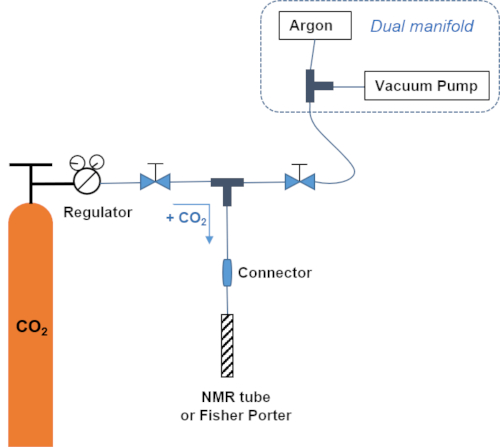
Figure 1 : Système de gaz. Schéma du système de gaz permettant l'ajout d'une pression définie de CO2 à une température donnée. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
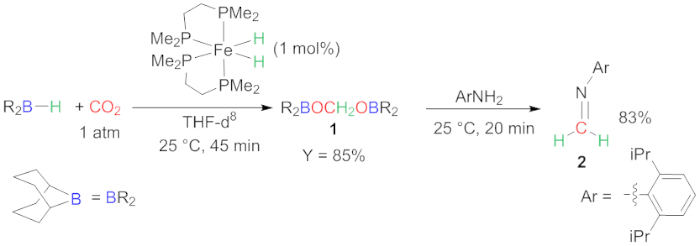
Figure 2 : Fonctionnalisation réductrice du CO2. Synthèse des composés 1 et 2. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
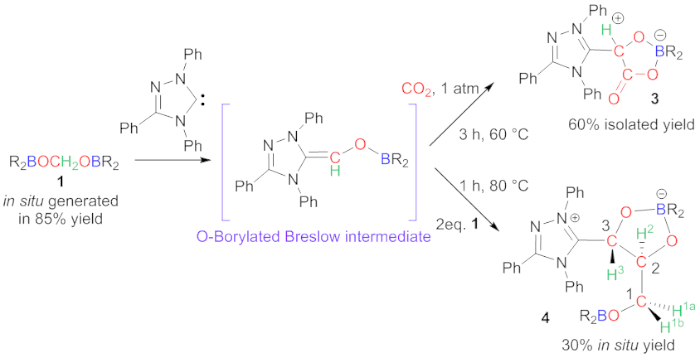
Figure 3 : Formation d'obligations C-C par carbene. Synthèse des composés 3 et 4. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
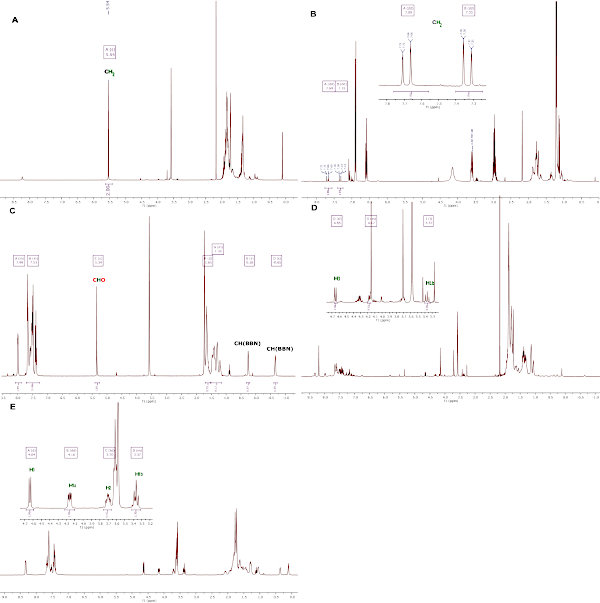
Figure 4 : 1H Des analyses RMN du composé 1-4, enregistrées à température ambiante en THF-d8. (A) Composé in situ généré 1, (B) composé in situ généré 2, (C) composé isolé 3, (D) composé in situ généré 4 à partir de CO2, (E) composé isolé 4 de d,l-Glyceraldéhyde. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
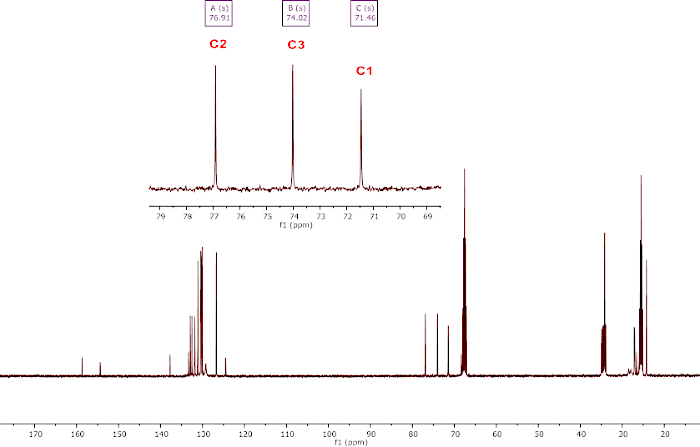
Figure 5 : Caractérisation représentative du composé 4 isolé de d,l-Glyceraldéhyde. 13 (en) L'analyse de la RMN de la RMD delaMAISON 1 a été enregistrée à température ambiante en THF-d8; l'inlet : zoom de la zone C1-C3. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Ici, nous présentons les transformations polyvalentes en deux étapes en un seul pot du CO2 en produits complexes. La première étape de la méthode concerne la réduction sélective de 4 e- co2 avec un réductrice hydroborane. Cette étape est essentielle parce que la sélectivité vers le 4 e- réduction est difficile. Très peu de systèmes ont été rapportés qui décrivent la génération sélective de bis(boryl)acetal23,24,25. Dans notre cas, un complexe d'hydride de fer catalyse ce sélectif 4 e- réduction du CO2 avec 9-BBN, offrant composé 1, dans des conditions douces (25 oC) et avec un temps de réaction très court (45 min) (Figure 2)18. Notre étude montre que les conditions de réaction sont très importantes. Dans notre main, chaque tentative de changer la concentration, le solvant, la pression et la température du CO2 a conduit à la diminution du rendement dans le composé 1. Un temps de réaction plus long est également préjudiciable parce qu'il conduit à une sur-réduction au niveau de méthanol ou l'évolution de la bis(boryl)acetal en plusieurs composés oligomeric. D'après notre expérience, il est nécessaire de vérifier le résultat de cette étape de réduction par in situ 1H NMR caractérisation. La reproductibilité de la méthode doit être sondée sur plusieurs pistes.
La réaction de condensation in situ de l'intermédiaire 1 avec une aniline encombrante donne lieu à l'imine 2 correspondante (Figure 2). Il s'agit d'une méthode simple et composé 2 est facilement formé dans un rendement élevé (83%). Cette réaction peut également être utilisée pour sonder l'efficacité de l'étape de réduction. Cette méthode est la seule méthode permettant la synthèse de la fonction imine à partir de CO2. En outre, intermédiaire 1 s'est avéré être une source polyvalente de méthylène dans diverses réactions de condensation conduisant à la formation de C-N, C-O, C-C et C -C obligations18. Cette méthode offre donc un moyen simple d'utiliser le CO2 comme substitut du formaldéhyde dans les réactions de condensation26.
Intermédiaire 1 réagit avec la carbene d'Ender pour se permettre des composés 3 ou 4, selon les conditions de réaction (Figure 3)20. Avec le soutien d'une étude expérimentale et théorique approfondie, nous avons pu expliquer la réactivité observée. Dans ce cas, le composé 1 ne réagit pas comme formaldéhyde puisque les moieties de boryl restent dans les composés 3 et 4. Cette caractéristique découle de la formation d'un intermédiaire Sans précédent O-Borylated Breslow (Figure 3)27,28,29,30,31,32. Cet intermédiaire n'est pas observé expérimentalement, mais peut agir comme un activateur de base bifonctionnel Lewis acide / Lewis vers le CO2 pour se permettre composé 3 ou conduit à l'homocouplement de deux autres centres de carbone pour se permettre composé 4. Dans les deux produits, les centres chiraux sont générés et dans le cas du composé 4, les deux centres chiraux, C2 et C3, sont obtenus d'une manière diastereoselective, grâce à la présence du fragment de boryl de pontage.
Les avancées présentées ici ont été possibles grâce à la méthode en deux étapes en un seul pot utilisée et à la réactivité élevée et polyvalente des intermédiaires 1 générés à partir de la 4e sélective- réduction du CO2. Suivant une méthode similaire pour améliorer encore la portée et la complexité des molécules synthétisées, des travaux en cours sont consacrés i) pour régler les propriétés de bis(boryl)acetal en utilisant d'autres réducteurs d'hydroborane et ii) pour sonder différentes conditions de couplage en utilisant d'autres organo-catalyseurs.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
S. D. remercie région Midi-Pyrénées et Université Fédérale de Toulouse pour leur doctorat. D. Z. remercie le Chinese Scholarship Council pour sa bourse de doctorat. A. M. remercie COLFUTURO pour sa bourse de doctorat. S. B. remercie le programme ANR JCJC "ICC" et le Professeur A. Leon pour des discussions fructueuses.
matériels
| Name | Company | Catalog Number | Comments |
| Wilmad quick pressure valve NMR tube 5 mm diam. | Sigma-Aldrich | Z562882-1EA | |
| Filtre-seringue PTFE hydrophobe Ø 25 mm pores 0,22 µm | UGAP | 2528593 | |
| Fisher Porter | Home made system | ||
| 9-borabicyclo[3.3.1]nonane dimer | Sigma-Aldrich | 178713 | |
| FeCl2 (anhydrous) | Strem | MFCD00011004 | |
| d,l-Glyceraldehyde | Sigma-Aldrich | G5001 | |
| 2,6-(diisopropyl)phenylamine | Sigma-Aldrich | 374733 | |
| dimethylphosphinoethane | Strem | MFCD00008511 | |
| Tetrahydrofuran | Carlo Erba | solvent | |
| Diethyl ether | Carlo Erba | solvent | |
| Pentane | Carlo Erba | solvent | |
| Tetrahydrofuran D8 | Eurisotop | D149FE |
Références
- Goeppert, A., Czaun, M., Jones, J. P., Surya Prakash, G. K., Olah, G. A. Recycling of carbon dioxide to methanol and derived products - closing the loop. Chemical Society Reviews. 43, 7995-8048 (2014).
- Appel, A. M., et al. Frontiers, Opportunities, and Challenges in Biochemical and Chemical Catalysis of CO2 Fixation. Chemical Reviews. 113 (8), 6621-6658 (2013).
- Aresta, M., Dibenedetto, A., Angelini, A. Catalysis for the Valorization of Exhaust Carbon: from CO2 to Chemicals, Materials, and Fuels. Technological Use of CO2. Chemical Reviews. 114 (3), 1709-1742 (2014).
- Poland, S. J., Darensbourg, D. J. A quest for polycarbonates provided via sustainable epoxide/CO2 copolymerization processes. Green Chemistry. 19, 4990-5011 (2017).
- Kember, M. R., Buchard, A., Williams, C. K. Catalysts for CO2/epoxide copolymerisation. Chemical Communications. 47 (1), 141-163 (2011).
- Klankermayer, J., Wesselbaum, S., Beydoun, K., Leitner, W. Selective Catalytic Synthesis Using the Combination of Carbon Dioxide and Hydrogen: Catalytic Chess at the Interface of Energy and Chemistry. Angewandte Chemie International Edition. 55 (26), 7296-7343 (2016).
- Tlili, A., Blondiaux, E., Frogneux, X., Cantat, T. Reductive functionalization of CO2 with amines: an entry to formamide, formamidine and methylamine derivatives. Green Chemistry. 17, 157-168 (2015).
- Bontemps, S. Boron-mediated activation of carbon dioxide. Coordination Chemistry Reviews. 308 (Part 2), 117-130 (2016).
- Chong, C. C., Kinjo, R. Catalytic Hydroboration of Carbonyl Derivatives, Imines, and Carbon Dioxide. ACS Catalysis. 5 (6), 3238-3259 (2015).
- Reuss, G., Disteldorf, W., Gamer, A. O., Hilt, A. Formaldehyde. Ullmann's Encyclopedia of Industrial Chemistry. , Wiley, Weinheim. (2003).
- Heim, L. E., Konnerth, H., Prechtl, M. H. G. Future perspectives for formaldehyde: pathways for reductive synthesis and energy. Green Chemistry. 19, 2347-2355 (2017).
- Zafar, I., Senad, N. The Formose Reaction: A Tool to Produce Synthetic Carbohydrates Within a Regenerative Life Support System. Current Organic Chemistry. 16 (6), 769-788 (2012).
- Delidovich, I. V., Simonov, A. N., Taran, O. P., Parmon, V. N. Catalytic Formation of Monosaccharides: From the Formose Reaction towards Selective Synthesis. ChemSusChem. 7 (7), 1833-1846 (2014).
- Ruiz-Mirazo, K., Briones, C., de la Escosura, A. Prebiotic Systems Chemistry: New Perspectives for the Origins of Life. Chemical Reviews. 114 (1), 285-366 (2014).
- Ricardo, A., Carrigan, M. A., Olcott, A. N., Benner, S. A. Borate Minerals Stabilize Ribose. Science. 303 (5655), 196(2004).
- Hein, J. E., Blackmond, D. G. On the Origin of Single Chirality of Amino Acids and Sugars in Biogenesis. Accounts of Chemical Research. 45 (12), 2045-2054 (2012).
- Bontemps, S., Vendier, L., Sabo-Etienne, S. Ruthenium-Catalyzed Reduction of Carbon Dioxide to Formaldehyde. Journal of the American Chemical Society. 136 (11), 4419-4425 (2014).
- Jin, G., Werncke, C. G., Escudié, Y., Sabo-Etienne, S., Bontemps, S. Iron-Catalyzed Reduction of CO2 into Methylene: Formation of C-N, C-O, and C-C Bonds. Journal of the American Chemical Society. 137 (30), 9563-9566 (2015).
- Bontemps, S., Vendier, L., Sabo-Etienne, S. Borane-Mediated Carbon Dioxide Reduction at Ruthenium: Formation of C1 and C2 Compounds. Angewandte Chemie International Edition. 51 (7), 1671-1674 (2012).
- Béthegnies, A., et al. Reductive CO2 Homocoupling: Synthesis of a Borylated C3 Carbohydrate. ChemCatChem. 11 (2), 760-765 (2019).
- Dombray, T., et al. Iron-Catalyzed C-H Borylation of Arenes. Journal of the American Chemical Society. 137 (12), 4062-4065 (2015).
- Allen, O. R., et al. Addition of CO2 to Alkyl Iron Complexes, Fe(PP)2Me2. Organometallics. 27 (9), 2092-2098 (2008).
- Das Neves Gomes, C., Blondiaux, E., Thuéry, P., Cantat, T. Metal-Free Reduction of CO2 with Hydroboranes: Two Efficient Pathways at Play for the Reduction of CO2 to Methanol. Chemistry - A European Journal. 20 (23), 7098-7106 (2014).
- Murphy, L. J., et al. Selective Ni-Catalyzed Hydroboration of CO2 to the Formaldehyde Level Enabled by New PSiP Ligation. Organometallics. 36 (19), 3709-3720 (2017).
- Courtemanche, M. A., et al. Intramolecular B/N frustrated Lewis pairs and the hydrogenation of carbon dioxide. Chemical Communications. 51, 9797-9800 (2015).
- Frogneux, X., Blondiaux, E., Thuéry, P., Cantat, T. Bridging Amines with CO2: Organocatalyzed Reduction of CO2 to Aminals. ACS Catalysis. 5 (7), 3983-3987 (2015).
- Berkessel, A., Yatham, V. R., Elfert, S., Neudörfl, J. M. Characterization of the Key Intermediates of Carbene-Catalyzed Umpolung by NMR Spectroscopy and X-Ray Diffraction: Breslow Intermediates, Homoenolates, and Azolium Enolates. Angewandte Chemie International Edition. 52 (42), 11158-11162 (2013).
- DiRocco, D. A., Rovis, T. Catalytic Asymmetric Cross-Aza-Benzoin Reactions of Aliphatic Aldehydes with N-Boc-Protected Imines. Angewandte Chemie International Edition. 51 (24), 5904-5906 (2012).
- Maji, B., Mayr, H. Structures and Reactivities of O-Methylated Breslow Intermediates. Angewandte Chemie International Edition. 51 (41), 10408-10412 (2012).
- Bugaut, X., Glorius, F. Organocatalytic umpolung: N-heterocyclic carbenes and beyond. Chemical Society Reviews. 41 (9), 3511-3522 (2012).
- Paul, M., et al. Breslow Intermediates from Aromatic N-Heterocyclic Carbenes Benzimidazolin-2-ylidenes, Thiazolin-2-ylidenes). Angewandte Chemie International Edition. 57, 8310-8315 (2018).
- Holland, M. C., Gilmour, R. Deconstructing Covalent Organocatalysis. Angewandte Chemie International Edition. 54 (13), 3862-3871 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon