Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Production microfluidique de liposomes sensibles à la température contenant des lysolipides
Dans cet article
Résumé
Le protocole présente les paramètres optimisés pour la préparation des liposomes thermosensibles à l’aide du dispositif microfluidique micromélangeur d’os de hareng décalé. Cela permet également la co-encapsulation de la doxorubicine et de l’indocyanine vert dans les liposomes et la libération photothermique déclenchée de doxorubicine pour la libération contrôlée / déclenchée de médicaments.
Résumé
Le protocole présenté permet une préparation continue à haut débit de liposomes sensibles à basse température (LTSL), qui sont capables de charger des médicaments chimiothérapeutiques, tels que la doxorubicine (DOX). Pour ce faire, un mélange de lipides éthanoliques et une solution de sulfate d’ammonium sont injectés dans un micromélangeur à chevrons décalé (SHM) dispositif microfluidique. Les solutions sont rapidement mélangées par le SHM, offrant un environnement solvant homogène pour liposomes auto-assemblage. Les liposomes collectés sont d’abord annealed, puis dialysés pour enlever l’éthanol résiduel. Un pH-gradient de sulfate d’ammonium est établi par l’échange tampon de la solution externe en utilisant la chromatographie d’exclusion de taille. DOX est ensuite chargé à distance dans les liposomes avec une efficacité d’encapsulation élevée (-gt; 80%). Les liposomes obtenus sont homogènes en taille avec un diamètre moyen Z de 100 nm. Ils sont capables de libérer de DOX encapsulés en rafale séchage à température en présence d’une légère hyperthermie (42 oC). Le vert endocyanine (ICG) peut également être co-chargé dans les liposomes pour la libération de DOX laser-déclenché par l’infrarouge proche. L’approche microfluidique assure une préparation à haut débit, reproductible et évolutive des LTSL.
Introduction
La formulation de LTSL est un produit liposomique cliniquement pertinent qui a été développé pour délivrer la doxorubicine de drogue chimiothérapeutique (DOX) et permet la libération efficace de drogue d’éclatement à l’hyperthermie douce médicalement accessible (T - 41 c)1. La formulation LTSL se compose de 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC), le lysolipid 1-stearoyl-2-hydroxy-sn-glycero-3-phosphatidylcholine (MSPC; M signifie "mono") et plébisémie PEGylated 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyéthylène glycol)-2000] (DSPE-PEG2000). En atteignant la température de transition de phase (Tm 41 oC), le lysolipid et le DSPE-PEG2000 facilitent ensemble la formation des pores membranaires, ce qui entraîne une libération par rafale du médicament2. La préparation des LTSL utilise principalement une approche descendante en vrac, à savoir l’hydratation et l’extrusion de films lipidiques. Il reste difficile de préparer de façon reproductible de grands lots avec des propriétés identiques et en quantités suffisantes pour des applications cliniques3.
La microfluidique est une technique émergente pour la préparation des liposomes, offrant la taille des nanoparticules, la reproductibilité et l’évolutivité3. Une fois les paramètres de fabrication optimisés, le débit pourrait être augmenté par la parallélisation, avec des propriétés identiques à celles préparées à l’échelle de banc3,4,5. Un avantage majeur de la microfluidique par rapport aux techniques conventionnelles en vrac est la capacité de gérer de petits volumes liquides avec une haute maniabilité dans l’espace et le temps grâce à la miniaturisation, permettant une optimisation plus rapide, tout en fonctionnant d’une manière continue et automatisée6. La production de liposomes avec des dispositifs microfluidiques est réalisée par une approche de nanoprécipitation ascendante, qui est plus efficace en temps et en énergie parce que les processus d’homogénéisation tels que l’extrusion et la sonication sont inutiles7. En règle générale, une solution organique (p. ex. l’éthanol) de lipides (et de charge utile hydrophobe) est mélangée à un non-solvant miscible (p. ex. l’eau et la charge utile hydrophile). Comme le solvant organique se mélange avec le non-solvant, la solubilité pour les lipides est réduite. La concentration lipidique atteint finalement une concentration critique au cours de laquelle le processus de précipitation est déclenché7. Les nanoprécipitates des lipides finissent par se développer en taille et se rapprocher dans un liposome. Les principaux facteurs régissant la taille et l’homogénéité des liposomes sont le rapport entre le non-solvant et le solvant (c.-à-d. rapport aqueux-organiques de débit ; FRR) et l’homogénéité de l’environnement solvant lors de l’auto-assemblage des lipides en liposomes8.
Un mélange efficace de fluides en microfluidique est donc essentiel à la préparation de liposomes homogènes, et diverses conceptions de mélangeurs ont été utilisées dans différentes applications9. Le micromélangeur à chevrons décalés (SHM) représente l’une des nouvelles générations de mélangeurs passifs, ce qui permet un débit élevé (à portée de mL/min) avec un faible facteur de dilution. Ceci est supérieur aux dispositifs de mélange hydrodynamique microfluidique s’ils sont traditionnels8,10. Le SHM a modelé des rainures d’os de hareng, qui mélangent rapidement des fluides par advection chaotique9,11. La courte échelle de temps de mélange de SHM (5 ms, soit moins que l’échelle de temps d’agrégation typique de 10 à 100 ms) permet à l’auto-assemblage des lipides de se produire dans un environnement solvant homogène, produisant des nanoparticules avec une distribution de taille uniforme3,12.
La préparation des LTSL avec la microfluidique n’est, cependant, pas aussi simple comparée aux formulations liposomiques conventionnelles dues au manque de cholestérol8, sans lequel les bicouches de lipide sont sensibles à l’interdigitation induite par l’éthanol13,14,15. Jusqu’à présent, l’effet de l’éthanol résiduel se présente lors de la production microfluidique de liposomes n’a pas été bien compris. La majorité des formulations rapportées sont intrinsèquement résistantes à l’interdigitation (contenant du cholestérol ou des lipides insaturés)16, qui, contrairement aux LTSL, sont à la fois saturées et sans cholestérol.
Le protocole présenté ici utilise SHM pour préparer les LTSL pour l’administration de médicaments à libération déclenchée par la température. Dans la méthode présentée, nous nous sommes assurés que les LTSL microfluidiques sont de taille nanométrique (100 nm) et uniformes (dispersité et lt; 0,2) par diffusion dynamique de la lumière (DLS). En outre, nous avons encapsulé DOX en utilisant la méthode de gradient de sulfate d’ammonium transmembrane (également connu sous le nom de chargement à distance)17 comme validation de l’intégrité de la bicouche lipidique LTSL. Le chargement à distance de DOX nécessite le liposome pour maintenir un pH-gradient afin d’atteindre une efficacité d’encapsulation élevée (EE), ce qui est peu probable de se produire sans une bicouche lipidique intacte. Dans cette méthode présentée, distincte des protocoles typiques de préparation microfluidique de liposome, une étape d’annealing est exigée avant que l’éthanol soit enlevé pour permettre la capacité de chargement à distance ; c’est-à-dire pour restaurer l’intégrité de la bicouche lipidique.
Comme nous l’avons mentionné précédemment, les charges utiles hydrophiles et hydrophobes peuvent également être introduites dans les solutions initiales pour l’encapsulation simultanée des charges utiles lors de la formation des LTSL. Comme preuve de concept, le vert endocyanine (ICG), un colorant fluorescent proche infrarouge approuvé par la FDA, qui est également un agent photothermique prometteur, est introduit au mélange lipidique initial et co-chargé avec succès dans les LTSL. Un laser de 808 nm est utilisé pour irradier les LTSL chargés par DOX/ICG et induire avec succès la libération d’éclatement de DOX déclenchée par le chauffage photothermique dans un délai de 5 minutes.
Tous les instruments et matériaux sont disponibles dans le commerce, prêts à l’emploi, et sans nécessité de personnalisation. Étant donné que tous les paramètres de formulation des LTSL ont été optimisés, suivant ce protocole, les chercheurs qui n’ont aucune connaissance préalable de la microfluidique pourraient également préparer les LTSL, qui servent de base à un système d’administration de médicaments thermosensibles.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Configuration de l’équipement
- Assembler les pompes à seringues et SHM comme suit.
- Connectez le port « À l’ordinateur » de la pompe à seringues secondaire (pompe 02, pour une solution aqueuse) au port « To Network » de la pompe à seringues principale (pompe 01, pour la solution lipidique d’éthanol) à l’aide du câble de réseau Pump to Pump (Figure 1, jaune).
- Connectez le port "To Computer" de la pompe principale au port "RS232 Serial" de l’ordinateur à l’aide de PC pour pomper le câble réseau (Figure 1, bleu).
- Connectez les tubes à chacune des entrées et sorties du SHM à l’aide d’un écrou et d’une ferrule. Convertir le terminal de la tuyauterie pour les deux entrées en Femelle Luer en utilisant un autre écrou et ferrule et un assemblage syndical. Le tuyauterie plus long des entrées permet une fixation plus facile aux seringues (Figure 2).
- Configurez le logiciel de commande de pompe.
- Attribuez l’adresse de la pompe à seringue principale et de la pompe à seringuesecondaire à « Ad:01 » et « Ad:02 », respectivement, en utilisant le bouton « Configuration » de la pompe à seringues. Cela n’a besoin que pour la première fois.
- Ouvrez le logiciel de commande de pompe sur l’ordinateur. Les deux pompes à seringues doivent être détectées automatiquement, suivies d’un bip sonore. Sinon, cliquez sur Pompes et Recherchez des pompes pour mettre à jour la connexion. (Figure 3).
- Attribuez le diamètre à 12,45 (mm) en choisissant "HSW Norm-Ject 5 cc (Dia 12.45)".
- Attribuez le taux à 0,25 ml/min pour la pompe 01 (solution lipidique d’éthanol) et à 0,75 ml/min pour la pompe 02 (solution aqueuse). Les débits correspondent à un débit total (TFR) de 1 mL/min et à un taux de débit aqueuse/éthanol (FRR) de 3.
- Attribuez le volume à toutes les valeurs supérieures à 5 ml.
REMARQUE : Le volume d’infusion ciblé est réglé plus grand que le volume liquide chargé compte tenu du volume vide du tube. - Sélectionnez le mode INF (infusion) pour les deux pompes.
- Appuyez sur L’ensemble pour confirmer les paramètres.
2. Préparer les LTSL
- Préparer un mélange lipidique LTSL10 ou LTSL10-ICG (voir tableau 1).
- Retirez 1 ml de mélange lipidique et au moins 3 ml de (NH4)2SO4 solution à l’aide de deux seringues de verrouillage Luer de 5 ml.
- Installez les deux seringues sur les pompes à seringues en position verticale en faisant glisser le flange de la seringue sur le dispositif de retenue de la seringue, et le piston de la seringue jusqu’au bloc poussoir de la pompe (Figure 4).
- Enveloppez l’extrémité du ruban chauffant sur la seringue avec la solution aqueuse. Enveloppez l’autre extrémité du ruban chauffant et la sonde de température du thermostat autour de la seringue avec la solution lipidique. Il est utile de pratiquer cette étape avec des seringues vides en place afin de faciliter le processus d’assemblage (Figure 5A).
- Connectez les deux seringues aux adaptateurs Luer femelles des entrées correspondantes du SHM. Assurez-vous que les seringues contenant le mélange lipidique et (NH4)2SO4 solutions sont connectés à l’inlet d’éthanol et à l’inlet aqueuse, respectivement. Ajuster la position du piston pour enlever les bulles d’air des seringues (Figure 5B).
REMARQUE : Assurez-vous que les seringues sont toujours bien placées sur la retenue de seringue des pompes. - Chauffer les seringues à plus de 51 oC à l’aide du ruban chauffant à l’aide d’une séance de chauffage de 10 s. Laissez le thermostat actualiser la température des seringues. Répétez cette étape dans les étapes suivantes pour maintenir la température pendant l’infusion.
CAUTION: Éteignez le ruban chauffant après 10 s pour éviter la remise des températures et permettre au thermostat de mettre à jour la température réelle. Le ruban chauffant doit également être manipulé avec soin car sa température augmente très rapidement. Le chauffage continu peut endommager l’équipement et les seringues, en raison du délai du thermostat pour la mise à jour de la température mesurée. - Une fois que la température est supérieure à 51 oC, exécutez les pompes à seringues en appuyant sur Run All dans le logiciel de commande de la pompe (Figure 3).
- Assurez-vous que le flux de liquide est exempt de bulles d’air et de toute fuite. Éliminer le volume initial (environ 0,5 ml) de liquide de la prise comme déchets.
REMARQUE : Ce volume initial de déchets n’est pas défini et dépend du volume interne de la configuration, qui est le volume pour que le fluide se déplace des seringues à travers le tube et le SHM jusqu’à la prise. - Recueillir le reste du liquide sous forme d’échantillons de liposome dans un tube microcentrifuge ou un flacon bijou.
- Pause / arrêter l’infusion lorsque le liquide dans l’une des seringues sont presque vides.
REMARQUE : Les pompes doivent être arrêtées manuellement, car les pompes peuvent ne pas détecter avec précision la position lorsque les seringues sont vides. - Placer les solutions liposome collectées dans un bain d’eau de 60 oC pour l’annexer pendant 1,5 h.
REMARQUE : Cette étape est essentielle pour permettre le chargement de médicaments dans les liposomes. - Transférer les solutions aux tubes de dialyse. Dialyser les solutions contre 1 L de 240 mM (NH4)2SO4 à 37 oC pendant au moins 4 h pour obtenir des liposomes purifiés.
REMARQUE: Le protocole peut être mis en pause ici. Liposomes à cette étape sont à 5 mM de phospholipide. Les liposomes purifiés peuvent être stockés à 4 oC. - Pour nettoyer le SHM pour une utilisation répétée, rincer le SHM séquentiellement avec de l’eau déionisée, de l’éthanol et le sécher avec du gaz azoté.
3. Chargement à distance de DOX dans les LTSL par gradient de pH transmembrane
- Échangez un tampon externe de LTSL sur la saline tamponnée HEPES (HBS) en utilisant la chromatographie d’exclusion de taille (SEC) pour établir un gradient de pH transmembrane.
- Ajoutez un total de 25 ml de HBS au sommet d’une colonne SEC pour préparer la colonne. Laisser toute l’élunement s’élifier à travers la colonne et disposer l’éluate.
- Ajouter 1 ml de liposomes dialysés, préparés à partir de l’étape 2.12, à la colonne et disposer l’élute.
- Ajouter 1,5 ml de HBS à la colonne et disposer de l’élute.
- Ajouter 3 mL de HBS à la colonne et recueillir les 3 ml d’elute.
REMARQUE: Le protocole peut être mis en pause ici. Les liposomes sont collectés à cette étape et sont à 1,67 mM de phospholipide. Les liposomes échangés par tampon peuvent être stockés à 4 oC.
- Incuber les LTSL avec de la doxorubicine (DOX) et purifier les LTSL.
- Ajouter la solution DOX en 1:20 DOX-to-phospholipid molar ratio dans 1 mL de solution de liposomes tampon-échange (1,67 mmol) contenue dans un flacon bijou. Pour ce faire, on peut y parvenir en ajoutant une solution DOX de 48,4 l l(ML) (83,4 'mol).
- Placer le flacon de bijou dans un bain d’eau de 37 oC pendant 1,5 h pour permettre le chargement du DOX dans les liposomes.
- Mélanger 10 liposomes avec 170 L de HBS et 20 OL de 1% (v/v) solution Triton X-100 dans une plaque noire de 96 puits. Répéter l’opération pour trois puits. Ces puits correspondent à la teneur DOX « avant purification ».
- En cas de préparation du LTSL10-ICG, mélanger 40 liposomes avec 160 L de DMSO dans une plaque claire de 96 puits. Répéter l’opération pour trois puits. Ces puits correspondent à la teneur en ICG « avant purification ».
- Purifie la solution liposome telle que décrite à l’étape 3.1.
REMARQUE : Pour réutiliser la colonne pour la purification future, nettoyez la colonne de DOX libre en ajoutant d’abord 1 ml de solution NaOH diluée de 0,5 M avant d’effectuer l’étape 3.1.1. DOX gratuit en rouge deviendra violet-bleu et s’élioire rapidement à travers la colonne. - Mélanger 30 ll-L de la solution de liposomes purifiés avec 150 ll de HBS et 20 OL de 1 % (v/v) solution Triton X-100 dans une plaque noire de 96 puits. Répéter l’opération pour trois puits. Ces puits correspondent à la teneur DOX « après purification ».
- Dans le cas de LTSL10-ICG, mélanger 40 L de la solution de liposomes purifiés avec 160 L de DMSO dans une plaque claire de 96 puits. Répéter l’opération pour trois puits. Ces puits correspondent à la teneur en ICG « après purification ».
- Mesurer l’intensité de fluorescence DOX des puits avant (étape 3.2.3) et après (étape 3.2.5) purification, à l’aide d’un lecteur de microplaques(ex 485 nm,em 590 nm).
- Calculez l’efficacité d’encapsulation de DOX (DOX EE) en prenant le rapport des intensités de fluorescence avant et après la purification.
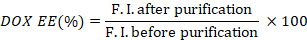
- Mesurer l’absorption ICG des puits avant et après la purification, à l’aide d’un lecteur de microplaques (600 à 1000 nm).
- Calculez l’efficacité d’encapsulation de l’ICG (ICG EE) en prenant le rapport de l’absorption à 792 nm avant et après la purification, en tenant compte du facteur de dilution (3 fois) pendant la purification.

4. Diffusion dynamique de lumière (DLS)
- Ajouter une solution de 50 liposomes (étape 2.12) à 450 oL d’eau déionisée.
- Placez la cuvette à l’intérieur de l’instrument DLS et effectuez la mesure selon les instructions du fabricant.
- Enregistrez le diamètre moyen Z moyen moyen et la dispersion de trois mesures pour chaque échantillon.
5. Calorimétrie différentielle de balayage (DSC)
- Concentrer 1 ml des échantillons de liposomes (étape 2.12) avec une unité de filtre centrifuge à 0,5 ml (concentration lipidique finale de 10 mM). À l’aide d’un rotor à angle fixe, tourner à 7500 x g pendant environ 15 min.
- Transférer 20 'L de (NH4)2SO4 solution et liposomes échantillons à deux casseroles DSC respectives. Scellez les casseroles avec des couvercles hermétiques DSC à l’aide du dossier de presse d’échantillon DSC.
- Mesurer l’échantillon de 30 à 60 oC à un taux de chauffage de 1 oC/min à l’aide d’un calorimètre à balayage différentiel.
- Analyser les données avec un logiciel approprié. Prenez la température de transition de phase (Tm) comme début de la transition de phase (pic de fusion), qui est mesurée par l’interception x de la tangente du point de pente maximale.
6. Sortie de doxorubicine
- Préchauffer le HBS à température désignée (37 ou 42 oC) à l’aide d’un bain d’eau. Préparer un bain d’eau glacée pour éteindre les échantillons.
- Ajouter 100 liposomes purifiés DOX (étape 3.2.5) dans 1,9 mL de HBS dans un tube microcentrifuge. Placez le tube dans le bain d’eau de la température désignée.
- Retirez immédiatement 200 l d’échantillons du tube et placez-les rapidement dans le bain d’eau glacée pour éteindre toute libération de drogue ultérieure. Cet échantillon correspond au point de temps initial (t -0).
- Retirez 200 l d’échantillons aux moments suivants (t 5, 10, 15, 30, 60 min) et placez-les rapidement dans le bain d’eau glacée pour éteindre toute libération de drogue.
- Mélanger 50 l’échantillon de chaque point de temps avec 150 L de HBS dans une plaque noire de 96 puits. Mesurez l’intensité de la fluorescence DOX à l’aide d’un lecteur de plaque.
- Ajouter 20 l de 1 % (v/v) Triton X-100 dans des puits choisis au hasard préparés à l’étape 6.5. Mesurez l’intensité de fluorescence DOX de ces puits à l’aide d’un lecteur de plaques. Ces valeurs correspondent au point de temps entièrement libéré (t ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' ' '
- Calculer et tracer le pourcentage de DOX libéré en interpolant l’intensité de fluorescence de chaque point de temps (I(t)), par rapport à la valeur initiale (I(I(0)), et entièrement libérée (I() ).
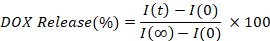
7. Chauffage au laser et libération déclenchée
- Fixer la température du bain d’eau à 37 oC et laisser la température se stabiliser.
- Ajouter 200 L de LDOX chargé LTSL10-ICG ([ICG] - 10 g/mL) à une plaque claire de 96 puits, puis placez-le dans le bain d’eau, gardez le fond immergé dans l’eau.
- Placez le courant du système laser à 2,27 A. Placez le collimateur du système laser à 5 cm verticalement au-dessus de la surface de la plaque de 96 puits, ce qui correspond à un flux d’énergie de 0,5 W/cm2 [Figure 6].
CAUTION: Le système laser doit être exploité conformément aux mesures de sécurité laser pertinentes. - Allumez le laser et surveillez la température chaque minute à l’aide d’une sonde à fibres optiques.
- À 5 et 10 min, retirer 10 liposomes irradiés au laser de la plaque claire de 96 puits et mélanger avec 190 l de HBS pour trois puits dans une plaque noire de 96 puits.
- Mélanger 10 liposomes avec 170 L de HBS et 20 OL de 1 % (v/v) solution Triton X-100 pour trois puits dans une plaque noire de 96 puits. Ces puits correspondent au contenu DOX « libéré à 100 % ». Mesurez l’intensité fluorescente DOX et calculez la version DOX décrite à l’étape 6.7.
Access restricted. Please log in or start a trial to view this content.
Résultats
La préparation des LTSL par microfluidique nécessite la composition lipidique de DPPC/MSPC/DSPE-PEG2000 (80/10/10, rapport molaire; LTSL10). La figure 7A (à gauche) montre l’apparition du LTSL10 préparé à partir de l’étape 2.9, comme un liquide clair et non visqueux. La formulation LTSL10 est développée à partir de la formulation conventionnelle, LTSL4 (DPPC/MSPC/DSPE-PEG2000, 86/10/4, rapport molaire) puis...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le protocole présenté décrit la préparation de liposomes sensibles à basse température (LTSL) à l’aide d’un micromélangeur à chevrons décalé (SHM). La formulation LTSL10 permet la libération de doxorubicine déclenchée par la température dans les 5 minutes à une température hyperthermique cliniquement atteignable de 42 oC. Indocyanine vert (ICG) peut également être co-chargé pour le chauffage photothermique déclenché la libération de DOX. La méthode repose sur : (i) l’auto-assemblage de phosp...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à révéler.
Remerciements
Nous remercions Prostate Cancer UK (CDF-12-002 Fellowship) et le Engineering and Physical Sciences Research Council (EPSRC) (EP/M008657/1) pour leur financement.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
Références
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon