JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
리소리피드 함유 온도 민감성 리포좀의 미세유체 생산
요약
이 프로토콜은 엇갈인된 헤링본 마이크로믹서 미세유체 장치를 사용하여 열감도 리포좀을 준비하기 위한 최적화된 파라미터를 제시합니다. 이것은 또한 리포솜으로 독소루비신과 인도시아닌 녹색의 공동 캡슐화와 통제/트리거된 약물 방출을 위한 독소루비신의 광열 트리거 방출을 허용합니다.
초록
제시된 프로토콜은 독소루비신(DOX)과 같은 화학치료제를 적재할 수 있는 저온 민감성 리포좀(LTSL)의 고처리량 연속 제제를 가능하게 한다. 이를 달성하기 위해, 에타놀릭 지질 혼합물 및 황산암모늄 용액을 엇갈린 헤링본 마이크로믹서(SHM) 미세유체 장치에 주입한다. 용액은 SHM에 의해 빠르게 혼합되어 리포좀 자체 조립을 위한 균일한 용매 환경을 제공합니다. 수집된 리포솜은 먼저 어닐링된 다음 투석하여 잔류 에탄올을 제거합니다. 암모늄 황산염 pH 그라데이션은 크기 배제 크로마토그래피를 사용하여 외부 용액의 완충 교환을 통해 확립된다. DOX는 높은 캡슐화 효율(> 80%)으로 리포솜에 원격으로 로드됩니다. 얻어진 리포솜은 Z 평균 직경 100 nm의 크기에서 균일하다. 그들은 온화한 고열 (42 °C)의 존재에 캡슐화 된 DOX의 온도 트리거 버스트 방출이 가능합니다. 인도시아닌 녹색 (ICG) 또한 근적외선 레이저 트리거 DOX 방출을 위한 리포솜으로 공동 로드될 수 있습니다. 미세 유체 접근 방식은 LtSL의 높은 처리량, 재현성 및 확장 가능한 준비를 보장합니다.
서문
LTSL 제제는 화학요법 약물 인 독소루비신 (DOX)을 전달하기 위해 개발된 임상적으로 관련된 리포좀 생성물이며 임상적으로 달성 가능한 경증 고열 (T °41 °C)에서 효율적인 파열 약물 방출을 허용합니다1. LTSL 제제는 1,2-디팔미토일-sn-글리세로-3-인산콜린(DPPC), 리졸리피드 1-스테아로일-2-하이드록시-sn-글리세로-3-포스파티딜콜린(MSPC; M은 "모노") 및 PEGylated 지질 1,2-distearoyl-sn-글리세로-3-포스포에탄올라민-N-[메톡시(폴리에틸렌 글리콜)-2000](DSPE-PEG2000)를의미합니다. 상 전이 온도(Tm °41°C)에 도달하면, 리소지질 및 DSPE-PEG2000은 함께 막 기공의 형성을 용이하게 하고, 약물의 파열 방출을초래한다 2. LTSLs의 준비는 주로 대량 하향식 접근, 즉 지질 막 수화 및 압출을 사용합니다. 동일한 특성과 임상 적용을 위한 충분한 수량으로 대량 배치를 재현가능하게 준비하는 것은 여전히 어려운 일입니다3.
미세 유체학은 튜닝 가능한 나노 입자 크기, 재현성 및 확장성을 제공하는 리포솜을 준비하기위한 새로운 기술입니다3. 제조 파라미터가 최적화되면, 처리량은 벤치 스케일3,4,5에서준비된 것과 동일한 특성으로 병렬화로 확장할 수 있습니다. 기존의 벌크 기술에 비해 미세 유체의 주요 장점은 소형화를 통해 공간과 공간에서 높은 제어성을 갖춘 작은 액체 볼륨을 처리할 수 있는 능력으로, 연속적이고 자동화된 방식으로 작동하면서 더 빠른 최적화를 가능하게 한다는 것입니다6. 미세 유체 장치를 사용하는 리포좀의 생산은 상향식 나노 침전 접근법에 의해 달성되며, 이는 압출 및 초음파 처리와 같은균질화 공정이 불필요하기 때문에 더 많은 시간과 에너지 효율이 있다. 전형적으로, 지질(및 소수성 페이로드)의 유기 용액(예를 들어 에탄올)은 혼화가능한 비용매(예를 들어 물과 친수성 페이로드)와 혼합된다. 유기 용매가 비 용매와 혼합됨에 따라 지질에 대한 용해도가 감소됩니다. 지질 농도는 결국 강수 과정이 트리거되는 임계 농도에 도달7. 지질의 Nanocipitates 결국 크기에서 성장 하 고 리포솜에 가까운. 리포솜의 크기 및 균질성을 지배하는 주요 인자는 비용매와 용매 사이의 비율(즉, 수성-유기 유량 비율; FRR) 및 지질을 리포좀으로 자가 조립하는 동안 용매 환경의 균질성8.
미세 유체학적에서의 효율적인 유체 혼합은 따라서 균질 리포좀의 제조에 필수적이며, 믹서의 다양한 디자인은 다른 응용 분야에서 사용되어 왔다9. 엇갈린 헤링본 마이크로믹서(SHM)는 낮은 희석 계수로 높은 처리량(mL/min 범위)을 가능하게 하는 새로운 세대의 패시브 믹서 중 하나를 나타냅니다. 이것은 전통적인 미세 유체 유체 역학 혼합 장치8,10보다우수합니다. SHM은 빠르게 혼란 대류9,11에의해 유체를 혼합 헤링본 홈을 패턴했다. SHM의 짧은 혼합 시간 척도(< 5 ms, 10-100 ms의 전형적인 응집 시간 척도 미만)는 균일한 용매 환경에서 지질 자가 조립이 발생하도록 허용하며, 균일한 크기 분포를 가진 나노입자를 생성한다 3,12.
미세 유체학을 가진 LTSL의 준비는, 그러나, 콜레스테롤8의부족 때문에 전통적인 리포좀 제형에 비해 간단하지 않으며, 지질 이중층이 에탄올 유도 된 간 디지털화에 취약하지 않은13,14,15. 지금까지 리포좀의 미세 유체 생산 동안 잔류 에탄올 의 효과는 잘 이해되지 않았다. 보고된 제형의 대다수는 LTSLs와 달리 포화 상태이고 콜레스테롤이 없는 상호 디지털화(콜레스테롤 또는 불포화 지질함유)(16)에본질적으로 내성이 있습니다.
본 원에 제시된 프로토콜은 SHM을 사용하여 온도 트리거 방출 약물 전달을 위한 LTSL을 준비합니다. 제시된 방법에서, 우리는 동적 광 산란(DLS)에 의해 마이크로유체 제조 된 LTSL이 나노 크기 (100 nm) 및 균일 (분산도 < 0.2)되도록 보장하였다. 더욱이, 우리는 LTSL 지질 이중층의 무결성의 검증으로서 막막 암모늄 황산염 그라데이션 방법(원격 로딩이라고도함)(17)을 사용하여 DOX를 캡슐화하였다. DOX의 원격 로딩은 높은 캡슐화 효율(EE)을 달성하기 위해 pH 구배를 유지하기 위해 리포좀이 필요하며, 이는 그대로 지질 이중층 없이는 일어날 가능성이 낮다. 이러한 제시된 방법에서, 전형적인 미세유체 리포솜 제제 프로토콜과 는 별개로, 원격 로딩 기능을 가능하게 하기 위해 에탄올이 제거되기 전에 어닐링 단계가 요구되고; 즉, 지질 이중층의 무결성을 회복한다.
앞서 언급했듯이, 친수성 및 소수성 페이로드는 또한 LTSL 형성 중에 페이로드를 동시에 캡슐화하기 위한 초기 솔루션에 도입될 수 있습니다. 개념 증명으로, indocyanine 녹색 (ICG), FDA 승인 근적외선 형광 염료, 또한 유망한 광열 제, 초기 지질 혼합물에 도입 하 고 성공적으로 LSLs에 공동 로드. 808 nm 레이저는 DOX/ICG 로드 LTSL을 조사하여 5분 이내에 광열 가열 트리거 된 DOX 의 버스트 방출을 성공적으로 유도하는 데 사용됩니다.
모든 계측기와 재료는 시판되고 즉시 사용할 수 있으며 사용자 정의할 필요 없이 사용할 수 있습니다. LSL을 공식화하기 위한 모든 파라미터가 최적화되었기 때문에, 이 프로토콜에 따라 미세 유체에 대한 사전 지식이 없는 연구원들은 열민감성 약물 전달 시스템의 기초가 되는 LTSL을 준비할 수도 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 장비 설정
- 주사기 펌프와 SHM을 다음과 같이 조립합니다.
- 펌프 투 펌프 네트워크케이블(그림 1,노란색)을사용하여 보조 주사기 펌프의 "To Computer" 포트(펌프 02, 수성 용액용)를 마스터 주사기 펌프의 "To Network" 포트에 연결합니다(펌프 01, 에탄올 지질 용액).
- 마스터 펌프의 "To Computer" 포트를 PC를 사용하여 컴퓨터의 "RS232 직렬" 포트에 연결하여 네트워크 케이블을 펌프합니다(그림1,파란색).
- 너트와 페룰을 사용하여 SHM의 각 입구와 콘센트에 튜브를 연결합니다. 다른 너트와 페룰 및 유니온 어셈블리를 사용하여 두 입구에 대한 튜브의 단자를 여성 루어로 변환합니다. 입구의 긴 튜브는 주사기에 쉽게 부착 할 수 있습니다(그림 2).
- 펌프 제어 소프트웨어를 설정합니다.
- 주사기 펌프의 "설정" 버튼을 사용하여 마스터 주사기 펌프와 보조 주사기 펌프의 주소를 각각 "Ad:01" 및 "Ad:02"에 지정합니다. 이 작업은 처음으로 수행해야 합니다.
- 컴퓨터에서 펌프 제어 소프트웨어를 엽니다. 두 개의 주사기 펌프가 자동으로 감지되고 그 다음에 비음이 들립니다. 그렇지 않으면 펌프를 클릭하고 펌프 검색을 클릭하여 연결을 업데이트합니다. (그림3).
- "HSW Norm-Ject 5cc(Dia=12.45)"를 선택하여 지름을 12.45(mm)로 지정합니다.
- 펌프 01(에탄올 지질 용액)의 경우 0.25 mL/min, 펌프 02(수성 용액)의 경우 0.75mL/min에 비율을 할당합니다. 유량은 1mL/min의 총 유속(TFR)과 수성 대 에탄올 유량 비율(FRR)(FRR)에 해당합니다.
- 5mL 이상의 값에 볼륨을 할당합니다.
참고: 대상 주입 부피는 튜브의 보이드 부피를 고려하여 적재된 액체 부피보다 큽니까. - 두 펌프 모두에 대해 INF(주입) 모드를 선택합니다.
- 설정을 확인하려면 설정을 누릅니다.
2. LTSL 준비
- LTSL10 또는 LTSL10-ICG 지질 혼합물을 준비한다(표 1참조).
- 지질 혼합물 1 mL 및 적어도 3 mL의 (NH4)2SO4 용액 을 2 개의 5 mL 루어 잠금 주사기를 사용하여 인출한다.
- 두 개의 주사기를 펌프의 주사기 리테이너에 주사기의 배럴 플랜지를 슬라이딩하여 직립 위치에 주사기 펌프에 두 개의 주사기를 설치하고, 주사기의 플런저를 펌프의 푸셔 블록에설치한다(그림 4).
- 가열 테이프의 끝을 수성 용액으로 주사기에 감쌉니다. 가열 테이프의 다른 쪽 끝과 주사기 주위의 온도 프로브를 지질 용액으로 감쌉니다. 조립 과정을 용이하게 하기 위해 빈 주사기로 이 단계를 연습하는 것이좋습니다(그림 5A).
- 두 주사기를 SHM의 해당 입구의 암 루어 어댑터에 연결합니다. 지질 혼합물과 (NH4)2SO4 솔루션을 포함하는 주사기가 각각 에탄올 입구 및 수성 입구를 연결되었는지 확인한다. 주사기에서 기포를 제거하려면 플런저 위치를조정합니다(그림 5B).
참고: 주사기가 펌프의 주사기 리테이너에 안전하게 고정되어 있는지 확인합니다. - 10s 가열 세션을 사용하여 가열 테이프를 사용하여 주사기를 51 °C 이상으로 가열합니다. 온도 조절장치가 주사기의 온도를 업데이트할 수 있도록 합니다. 주입 중에 온도를 유지하기 위해 다음 단계에서이 단계를 반복하십시오.
주의: 온도 오버슈트를 방지하고 온도 조절장치가 실제 온도를 업데이트할 수 있도록 10s 이후 가열 테이프를 끕니다. 가열 테이프는 온도가 매우 빠르게 상승함에 따라 주의하여 처리해야합니다. 가열은 측정된 온도를 업데이트하기 위한 온도 조절기의 시간 지연으로 인해 장비 및 주사기를 지속적으로 손상시킬 수 있습니다. - 온도가 51°C 이상이면 펌프 제어 소프트웨어에서 모두 실행을 눌러 주사기 펌프를 실행합니다(그림3).
- 유체 흐름에 기포와 누출이 없는지 확인합니다. 출구에서 액체의 초기 부피(약 0.5mL)를 폐기물로 폐기하십시오.
참고 : 이 초기 폐기물 볼륨은 명확하지 않고 유체가 튜브 및 SHM을 통해 주사기에서 출구로 이동하는 체적인 설정의 내부 볼륨에 따라 달라집니다. - 액체의 나머지 부분을 리포솜 샘플로 미세 원심 분리튜브 또는 비쥬 바이알에 수집합니다.
- 주사기 중 하나에 있는 액체가 거의 비어 있을 때 주입을 일시 중지하거나 중지하십시오.
참고: 펌프는 주사기가 비어 있을 때 위치를 정확하게 감지하지 못할 수 있기 때문에 펌프를 수동으로 중지해야 합니다. - 수집된 리포솜 용액을 60°C 수조에 1.5시간 동안 어닐에 놓습니다.
참고: 이 단계는 리포솜으로 약물 로딩을 가능하게 하는 데 필수적입니다. - 투석 튜브에 솔루션을 전송합니다. 정제된 리포솜을 얻기 위해 적어도 4시간 동안 37°C에서 240 mM(NH4)2SO4의 1 L에 대하여 용액을 투석한다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. 이 단계에서 리포솜은 인지질의 5 mM에 있습니다. 정제된 리포솜은 4°C에서 보관할 수 있다. - 반복 사용을 위해 SHM을 청소하려면 SHM을 탈이온수, 에탄올및 질소 가스로 순차적으로 세척하십시오.
3. 막 횡단 pH 그라데이션에 의한 도X를 LSL로 원격 로딩
- 크기 배제 크로마토그래피(SEC)를 사용하여 대막 pH 구배를 확립하여 HEPES 버퍼링 식염수(HBS)로 LTSL의 외부 버퍼를 교환합니다.
- SEC 열의 맨 위에 총 25mL의 HBS를 추가하여 열을 준비합니다. 모든 용리온이 열을 통해 용해되고 용리수용을 폐기할 수 있도록 합니다.
- 2.12 단계에서 준비된 투석 리포솜 1 mL을 기둥에 넣고 용액을 폐기합니다.
- 열에 HBS 의 1.5 mL을 추가하고 용적을 처리합니다.
- 기둥에 HBS 3mL를 추가하고 3 mL의 용적을 수집합니다.
참고: 프로토콜은 여기에서 일시 중지할 수 있습니다. 리포솜은 이 단계에서 수집되고 인지질의 1.67 mM에 있습니다. 버퍼 교환 리포솜은 4°C에서 보관할 수 있다.
- 독소루비신(DOX)으로 LTSL을 배양하고 LTSL을 정화합니다.
- 1:20 DOX-인지질 몰 비율로 DOX 용액을 1 mL의 완충 교환 리포좀 용액(1.67 mmol)에 첨가하여 비쥬 바이알에 함유하였다. 이는 1 mg/mL DOX 용액(83.4 μmol)의 48.4 μL을 첨가함으로써 달성될 수 있다.
- DOX가 리포솜에 적재될 수 있도록 1.5시간 동안 37°C 수조에 비쥬 바이알을 놓습니다.
- 리포솜 10 μL을 HBS 170 μL과 1% (v/v) 트리톤 X-100 용액의 20 μL과 블랙 96 웰 플레이트에 섞습니다. 세 개의 우물에 대해 반복합니다. 이러한 웰은 "정화 전" DOX 함량에 해당합니다.
- LTSL10-ICG를 준비하는 경우, 리포솜의 40 μL을 투명한 96웰 플레이트에 160 μL의 DMSO와 혼합합니다. 세 개의 우물에 대해 반복합니다. 이러한 우물은 "정화 전" ICG 함량에 해당합니다.
- 3.1단계에서 기재된 바와 같이 리포솜 용액을 정제한다.
참고: 향후 정화를 위해 컬럼을 재사용하려면 3.1.1 단계를 수행하기 전에 희석된 0.5M NaOH 용액 1mL를 먼저 추가하여 자유 DOX에서 컬럼을 청소합니다. 빨간색의 무료 DOX는 보라색 파란색으로 바뀌고 열을 빠르게 통해 용해됩니다. - 정제된 리포솜 용액의 30 μL을 HBS 150 μL과 1% (v/v) 트리톤 X-100 용액의 20 μL과 혼합하여 96웰 플레이트에. 세 개의 우물에 대해 반복합니다. 이러한 웰은 "정제 후" DOX 함량에 해당합니다.
- LTSL10-ICG의 경우, 정제된 리포솜 용액의 40 μL을 투명 한 96 웰 플레이트에 160 μL의 DMSO와 혼합하십시오. 세 개의 우물에 대해 반복합니다. 이러한 우물은 "정제 후" ICG 함량에 해당합니다.
- 마이크로플레이트 리더를 사용하여 정제 전(단계 3.2.3) 및 후(단계 3.2.5) 정제 전(단계 3.2.3) 웰의 DOX 형광 강도를 측정합니다(λex = 485 nm, λem = 590 nm).
- 정화 전후의 형광 강도 비율을 취하여 DOX(DOX EE)의 캡슐화 효율을 계산합니다.
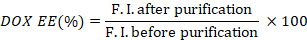
- 마이크로 플레이트 리더 (600 ~ 1000 nm)를 사용하여 정화 전후의 우물의 ICG 흡광도를 측정합니다.
- ICG(ICG EE)의 캡슐화 효율을 정화 전과 후에 792 nm에서 흡광도의 비율을 취하고, 정제 시 희석 계수(3회)를 고려하여 계산한다.

4. 동적 빛 산란 (DLS)
- 50 μL의 리포솜 용액(단계 2.12)을 탈이온수 450 μL에 첨가합니다.
- 굴곡을 DLS 계측기 내부에 놓고 제조업체의 지침에 따라 측정을 수행합니다.
- 각 시료에 대해 평균 Z 평균 직경과 분산도를 기록합니다.
5. 차동 스캐닝 열량계 (DSC)
- 원심 필터 유닛을 0.5 mL(최종 지질 농도 10 mM)로 리포솜 샘플(단계 2.12)의 농축. 고정 각 로터를 사용하여 7500 x g에서 약 15 분 동안 회전합니다.
- (NH4)2SO4 용액 및 리포좀 샘플을 각각의 DSC 팬 2개에 20 μL로 옮니다. DSC 샘플 프레스 키트를 사용하여 DSC 밀폐 뚜껑으로 팬을 밀봉합니다.
- 차동 스캐닝 열량계를 사용하여 1°C/min의 가열 속도로 30°C에서 60°C까지 시료를 측정합니다.
- 적절한 소프트웨어로 데이터를 분석합니다. 위상 전이 온도(Tm)를최대 경사점의 접선의 x-절편으로 측정되는 위상 전이(용융 피크)의 개시로 가져가라.
6. 독소루비신 방출
- 수조를 사용하여 지정된 온도(37 또는 42°C)에서 HBS를 예열합니다. 샘플을 담금질하기 위한 얼음 수조를 준비합니다.
- 정제된 DOX 로드 리포좀 100 μL(단계 3.2.5)을 미세 원심분리튜브에 HBS 1.9 mL에 넣습니다. 지정된 온도의 수조에 튜브를 놓습니다.
- 튜브에서 즉시 200 μL의 샘플을 철회하고 신속하게 얼음 수조에 배치하여 후속 약물 방출을 담급금하십시오. 이 샘플은 초기(t = 0) 시간점에 해당합니다.
- 후속 시점(t = 5, 10, 15, 30, 60 분)에서 200 μL의 샘플을 인출하고 신속하게 얼음 수조에 배치하여 약물 방출을 담급니다.
- 각 시료의 50 μL을 검정 96웰 플레이트에 HBS 150 μL과 혼합합니다. 플레이트 리더를 사용하여 DOX 형광 강도를 측정합니다.
- 6.5단계에서 준비된 무작위 선택된 웰에 1% (v/v) 트리톤 X-100의 20 μL을 추가합니다. 플레이트 리더를 사용하여 이러한 웰의 DOX 형광 강도를 측정합니다. 이러한 값은 완전히 릴리스된(t = ∞; 100% 릴리스) 시간 지점에 해당합니다.
- 초기(I(0))와 비교하여 각 시점(I(t))의 형광 강도를 보간하여 발표된 DOX 의 백분율을 계산하고 플롯하고, 완전히 해제된 값(I(∞)))) 값을 계산하고 플로팅합니다.
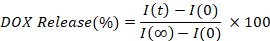
7. 레이저 가열 및 트리거 된 방출
- 수조 온도를 37°C로 설정하고 온도가 안정되도록 합니다.
- DOX 로드 LTSL10-ICG([ICG] = 10 μg/mL)의 200 μL을 투명한 96-well 플레이트에 추가한 다음 수조에 넣고 바닥을 물에 담그십시오.
- 레이저 시스템의 전류를 2.27A로 설정합니다. 레이저 시스템의 콜리메이터를 0.5W/cm2[그림 6]의에너지 플럭스에 해당하는 96웰 플레이트의 표면 위에 수직으로 5cm 위치에 놓습니다.
주의: 레이저 시스템은 관련 레이저 안전 조치에 따라 작동해야 합니다. - 광섬유 온도 프로브를 사용하여 레이저를 켜고 1분마다 온도를 모니터링합니다.
- 5 분 및 10 분에서, 투명 한 96 웰 플레이트에서 레이저 조사 된 리포솜 10 μL을 철회하고 검은 색 96 웰 플레이트에서 3 개의 우물에 대해 190 μL의 HBS와 혼합하십시오.
- 리포솜 10 μL을 HBS 170 μL과 1% (v/v) 트리톤 X-100 용액의 20 μL과 혼합하여 블랙 96웰 플레이트에 3개의 웰을 혼합합니다. 이 우물은 "100% 출시" DOX 콘텐츠에 해당합니다. DOX 형광 강도를 측정하고 6.7단계에서 설명한 대로 DOX 방출을 계산합니다.
Access restricted. Please log in or start a trial to view this content.
결과
미세 유체학에 의한 LTSL의 제제는 DPPC/MSPC/DSPE-PEG2000의 지질 조성을 필요로 한다(80/10/10, 어금니 비; LTSL10). 도 7A(왼쪽)는 2.9단계에서 준비된 LTSL10의 외관을 명확하고 비점성 액체로서 나타낸다. LTSL10 제형은 LTSL4가 젤형 점성 시료를 형성하기 때문에 종래의 제형인 LTSL4(DPPC/MSPC/DSPE-PEG2000,86/10/4, 몰비)로부터개...
Access restricted. Please log in or start a trial to view this content.
토론
제시된 프로토콜은 엇갈인된 헤링본 마이크로믹서(SHM)를 사용하여 저온 민감성 리포좀(LTSL)의 제조를 설명한다. LTSL10 제제는 임상적으로 달성 가능한 42°C의 고열 온도에서 5분 이내에 독소루비신의 온도 트리거 버스트 방출을 가능하게 합니다. 인도시아닌 녹색(ICG)은 또한 DOX의 방출을 촉발한 광열 가열을 위해 공동 로드될 수 있다. 이 방법은 에 의존: (i) SHM11에서에탄올과 황산?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없다.
감사의 말
우리는 전립선 암 영국 (CDF-12-002 펠로우십) 및 공학 및 물리 과학 연구 위원회 (EPSRC) (EP/M008657/1) 자금을 주셔서 감사합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 1,2-dipalmitoyl-sn-glycero-3-phosphocholine (DPPC) | Lipoid | PC 16:0/16:0 (DPPC) | |
| 1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000] (DSPE-PEG2000) | Lipoid | PE 18:0/18:0-PEG 2000 (MPEG 2000-DSPE) | |
| 1-stearoyl-2-hydroxy-sn-glycero-3-phosphocholine (MSPC) | Avanti Polar Lipid | 855775P-500MG | Distributed by Sigma-Adrich; also known as Lyso 16:0 PC (Not to be confused with 14:0/18:0 PC, which is also termed MSPC) |
| 4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid (HEPES) | Sigma-Aldrich | H3375-100G | |
| Adapters, Female Luer Lock to 1/4"-28UNF | IDEX Health & Science | P-624 | Requires 2 units. For the inlets |
| Adapters, Union Assembly, 1/4"-28UNF | IDEX Health & Science | P-630 | Requires 2 units. (One unit included 2 nuts and 2 ferrules) |
| Ammonium Sulfate ((NH4)2SO4) | Sigma-Aldrich | 31119-1KG-M | |
| Bijou vial | VWR | 216-0980 | 7 mL, clear, polystyrene vial |
| Centrifugal Filter Unit | Sigma-Aldrich | UFC801008 | 10 kDa MWCO, Amicon Ultra-4 Centrifugal Filter Unit |
| Centrifuge | ThermoFisher Scientific | Heraeus Megafuge 8R | With HIGHConic III Fixed Angle Rotor |
| Cuvette | Fisher Scientific | 11602609 | Disposable polystyrene cuvette, low volume, for DLS measurement |
| Dialysis Kit - Pur-A-Lyzer Maxi | Sigma-Aldrich | PURX12015-1KT | 12-14 kDa MWCO |
| Dimethyl Sulfoxide (DMSO) | Sigma-Aldrich | 34943-1L-M | |
| DLS Instrument | Malvern Panalytical | Zetasizer Nano ZS90 | |
| Doxorubicin Hydrochloride (DOX) | Apollo Scientific | BID0120 | |
| DSC Instrument | TA Instruments | TA Q200 DSC | |
| DSC Tzero Hermetic Lids | TA Instruments | 901684.901 | For DSC measurement |
| DSC Tzero Pans | TA Instruments | 901683.901 | For DSC measurement |
| DSC Tzero Sample Press Kit | TA Instruments | 901600.901 | For DSC measurement |
| Ethanol | VWR | 20821.330 | Absolute, ≥99.8% |
| FC-808 Fibre Coupled Laser System | CNI Optoelectronics Tech | FC-808-8W-181315 | FOC-01-B Fiber Collimator included. |
| Ferrule, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-200 | For the outlet |
| Fibre Optic Temperature Probe | Osensa | PRB-G40 | |
| Glass Staggered Herringbone Micromixer (SHM) | Darwin Microfluidics | Herringbone Mixer - Glass Chip | |
| Heating Tape | Omega | DHT052020LD | Can be replaced by other syringe heater such as "HTC" or "SRT series" for slower heating. Manual wiring to a 3-pin plug required for 240V models |
| Indocyanine Green | Adooq | A10473-100 | Distributed by Bioquote Limited (U.K.) |
| Luer-lock Syringe, 5 mL | VWR | 613-2043 | Hanke Sass Wolf SOFT-JECT 3-piece syringes, O.D. 12.45 mm |
| Microplate Reader | BMG Labtech | FLUOstar Omega | Installed with 485 nm (exictation) and 590 nm (emission) filters |
| Microplate, 96-well, Black, Flat-bottom | ThermoFisher Scientific | 611F96BK | For fluorescence measurement in microplate reader |
| Microplate, 96-well, Clear, Flat-bottom | Grenier | 655101 | For absorbance measurement microplate reader |
| Nut, 1/4"-28UNF to 1/16" OD | IDEX Health & Science | P-245 | For the outlet |
| PC to Pump Network Cable for Aladdin, 7ft | World Precision Instruments | NE-PC7 | Optional: Syringe pumps can be operated manually |
| Pump control software - SyringePumpPro Software License for 2 | World Precision Instruments | SYRINGE-PUMP-PRO-02 | Optional: Syringe pumps can be operated manually |
| Pump to Pump Network Cable for Aladdin, 7 ft | World Precision Instruments | NE-NET7 | Optional: Syringe pumps can be operated manually |
| Size exclusion chromatography (SEC) column | GE Life Science | 17085101 | Sephadex G-25 resin in PD-10 Desalting Columns |
| Sodium chloride (NaCl) | Sigma-Aldrich | 31434-1KG-M | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | S5881-500G | |
| Syringe Pumps & Cable (DUAL-PUMP-NE-1000) | World Precision Instruments | ALADDIN2-220/AL1000-220 | |
| Thermostat Temperature Controller | Inkbird | ITC-308 | Can be replaced by other syringe heater kit/thermostat |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Tubing, ETFE (1/16" OD) | IDEX Health & Science | 1516 | |
| USB To RS-232 Converter | World Precision Instruments | CBL-USB-232 | Optional: For computer without RS-232 port |
| Water Bath | Grant Instruments Ltd. | JB Nova 12 |
참고문헌
- Needham, D., Park, J., Wright, A. M., Tong, J. Materials characterization of the low temperature sensitive liposome (LTSL): effects of the lipid composition (lysolipid and DSPE-PEG2000) on the thermal transition and release of doxorubicin. Faraday Discussions. 161, 515-534 (2013).
- Ickenstein, L. M., Arfvidsson, M. C., Needham, D., Mayer, L. D., Edwards, K. Disc formation in cholesterol-free liposomes during phase transition. Biochimica et Biophysica Acta - Biomembranes. 1614 (2), 135-138 (2003).
- Valencia, P. M., Farokhzad, O. C., Karnik, R., Langer, R. Microfluidic technologies for accelerating the clinical translation of nanoparticles. Nature Nanotechnology. 7 (10), 623-629 (2012).
- Chen, D., et al. Rapid discovery of potent siRNA-containing lipid nanoparticles enabled by controlled microfluidic formulation. Journal of the American Chemical Society. 134 (16), 6948-6951 (2012).
- Forbes, N., et al. Rapid and scale-independent microfluidic manufacture of liposomes entrapping protein incorporating in-line purification and at-line size monitoring. International Journal of Pharmaceutics. 556, 68-81 (2019).
- Dittrich, P. S., Manz, A. Lab-on-a-chip: microfluidics in drug discovery. Nature Reviews Drug Discovery. 5 (3), 210-218 (2006).
- Capretto, L., Carugo, D., Mazzitelli, S., Nastruzzi, C., Zhang, X. Microfluidic and lab-on-a-chip preparation routes for organic nanoparticles and vesicular systems for nanomedicine applications. Advanced Drug Delivery Reviews. 65 (11-12), 1496-1532 (2013).
- Cheung, C. C. L., Al-Jamal, W. T. Sterically stabilized liposomes production using staggered herringbone micromixer: Effect of lipid composition and PEG-lipid content. International Journal of Pharmaceutics. 566, 687-696 (2019).
- Suh, Y. K., Kang, S. A. Review on Mixing in Microfluidics. Micromachines. 1 (3), 82-111 (2010).
- Jahn, A., Vreeland, W. N., Gaitan, M., Locascio, L. E. Controlled Vesicle Self-Assembly in Microfluidic Channels with Hydrodynamic Focusing. Journal of the American Chemical Society. 126 (9), 2674-2675 (2004).
- Stroock, A. D. Chaotic Mixer for Microchannels. Science. 295 (5555), 647-651 (2002).
- Belliveau, N. M., et al. Microfluidic Synthesis of Highly Potent Limit-size Lipid Nanoparticles for In Vivo Delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37(2012).
- Patra, M., et al. Under the influence of alcohol: The effect of ethanol and methanol on lipid bilayers. Biophysical Journal. 90 (4), 1121-1135 (2006).
- Komatsu, H., Rowe, E. S., Rowe, E. S. Effect of Cholesterol on the Ethanol-Induced Interdigitated Gel Phase in Phosphatidylcholine: Use of Fluorophore Pyrene-Labeled Phosphatidylcholine. Biochemistry. 30 (9), 2463-2470 (1991).
- Lu, J., Hao, Y., Chen, J. Effect of Cholesterol on the in Lysophosphatidylcholine Formation of an Interdigitated Gel Phase and Phosphatidylcholine Binary. Journal of Biochemistry. 129 (6), 891-898 (2001).
- Vanegas, J. M., Contreras, M. F., Faller, R., Longo, M. L. Role of unsaturated lipid and ergosterol in ethanol tolerance of model yeast biomembranes. Biophysical Journal. 102 (3), 507-516 (2012).
- Haran, G., Cohen, R., Bar, L. K., Barenholz, Y. Transmembrane ammonium sulfate gradients in liposomes produce efficient and stable entrapment of amphipathic weak bases. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1151 (2), 201-215 (1993).
- Sadeghi, N., et al. Influence of cholesterol inclusion on the doxorubicin release characteristics of lysolipid-based thermosensitive liposomes. International Journal of Pharmaceutics. 548 (2), 778-782 (2018).
- Lawaczeck, R., Kainosho, M., Chan, S. I. The formation and annealing of structural defects in lipid bilayer vesicles. Biochimica et Biophysica Acta (BBA) - Biomembranes. 443 (3), 313-330 (1976).
- Komatsu, H., Okada, S. Ethanol-induced aggregation and fusion of small phosphatidylcholine liposome: participation of interdigitated membrane formation in their processes. BBA - Biomembranes. 1235 (2), 270-280 (1995).
- Marsh, D., Bartucci, R., Sportelli, L. Lipid membranes with grafted polymers: physicochemical aspects. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1615 (1-2), 33-59 (2003).
- Hood, R. R., Vreeland, W. N., DeVoe, D. L. Microfluidic remote loading for rapid single-step liposomal drug preparation. Lab on a Chip. 14 (17), 3359-3367 (2014).
- Dalwadi, G., Benson, H. A. E., Chen, Y. Comparison of diafiltration and tangential flow filtration for purification of nanoparticle suspensions. Pharmaceutical Research. , (2005).
- Roces, C., Kastner, E., Stone, P., Lowry, D., Perrie, Y. Rapid Quantification and Validation of Lipid Concentrations within Liposomes. Pharmaceutics. 8 (3), 29(2016).
- Kim, S. -H., Kim, J. W., Kim, D. -H., Han, S. -H., Weitz, D. A. Enhanced-throughput production of polymersomes using a parallelized capillary microfluidic device. Microfluidics and Nanofluidics. 14 (3-4), 509-514 (2013).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유