Method Article
Auto-transplantation orthotopique de rein dans un modèle porcin utilisant la conservation d’organe de 24 heures et la télémétrie continue
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les grands modèles animaux jouent un rôle essentiel dans la recherche sur la transplantation préclinique. En raison de ses similitudes avec la configuration clinique, le modèle porcin de l’auto-transplantation orthotopique de rein décrit dans cet article fournit un excellent arrangement in vivo pour l’essai des techniques de conservation d’organe et des interventions thérapeutiques.
Résumé
À l’ère actuelle de la transplantation d’organes avec une grave pénurie d’organes, diverses stratégies sont utilisées pour élargir le bassin d’allogreffes disponibles pour la transplantation rénale (AC). Même si, l’utilisation d’allogreffes provenant de donneurs à critères étendus (DPE) pourrait en partie atténuer la pénurie de donneurs d’organes, les organes de DPE comportent un risque potentiellement plus élevé de résultats inférieurs et de complications postopératoires. Les techniques dynamiques de conservation des organes, la modulation des lésions d’ischémie-reperfusion et de conservation, et les thérapies d’allogreffe sont sous le feu des projecteurs de l’intérêt scientifique dans un effort pour améliorer l’utilisation d’allograft et les résultats patients dans KT.
Les expériences précliniques sur les animaux jouent un rôle essentiel dans la recherche translationnelle, en particulier dans le développement de dispositifs médicaux et de médicaments. L’avantage principal du modèle orthotopique d’auto-transplantation de porcine au-dessus des études ex vivo ou de petit animal se trouve dans les similitudes chirurgicales-anatomiques et physiologiques au cadre clinique. Ceci permet l’étude de nouvelles méthodes et techniques thérapeutiques et assure une traduction clinique facilitée des résultats. Ce protocole fournit une description complète et axée sur les problèmes du modèle orthotopique d’auto-transplantation rénale porcine, en utilisant un temps de conservation de 24 heures et une surveillance par télémétrie. La combinaison de techniques chirurgicales sophistiquées avec des méthodes hautement normalisées et de pointe d’anesthésie, de logement animal, de suivi périopératoire et de surveillance assure la reproductibilité et le succès de ce modèle.
Introduction
Depuis la première transplantation rénale humaine réussie entre jumeaux identiques en 1954, réalisée par le groupe pionnier du chirurgien lauréat du prix Nobel Joseph Murray1, la transplantation rénale (KT) a évolué comme le pilier du traitement pour les patients atteints d’une maladie rénale terminale (ESRD)2. L’AC montre des résultats cliniques et une qualité de vie supérieurs à long terme par rapport à la dialyse2. Les taux de survie à court et à long terme après l’ac se sont améliorés continuellement, en raison des progrès des techniques chirurgicales, de la préservation des organes, de la thérapie immunosuppressrice et des soins intensifs, d’où l’AC est devenu largement disponible àl’échelle mondiale 2,3,4.
En raison de la pénurie critique d’organes, il y a un écart sans cesse croissant entre l’offre et lademande d’allogreffe 3,5,6. En 2018, environ 12 031 patients attendaient l’AC en Allemagne, mais seulement moins de 20% (2 291 patients) pouvaient recevoir un rein de donneur en raison de l’extrême pénurie d’organes pour la transplantation7. Malheureusement, non seulement le nombre absolu de donneurs d’organes, mais aussi la qualité générale des allogreffes offertes pour la transplantation ont diminué au cours desdernières décennies 8,9. Une tendance croissante a été observée dans le nombre d’allogreffes rénales prédamaged ou « marginales » qui ont dû être acceptées pour la transplantation10. L’utilisation des allogreffes de DPE peut réduire le temps d’attente et la morbidité et la mortalité de liste d’attente, elle est, cependant, associée à une incidence accrue des complications greffe-connexes telles que la non-fonction primaire de greffe (PNF) et/ou la fonction retardée de greffe (DGF)8,9,10. D’autres recherches sont essentielles pour optimiser l’utilisation de l’allogreffe, élargir le bassin de donneurs et protéger et reconditionner les allogreffes marginales qui, en fin decompte,peuvent améliorer les résultats pour les patients3,6.
En raison de la nature riche et complexe des grands modèles de transplantation animale, un grand nombre d’études sont réalisées à l’aide de petits animaux ou dans des milieux ex vivo11,12,13,14,15. Bien que ces modèles puissent fournir des données scientifiques importantes, la traduction de ces résultats au milieu clinique est souvent limitée. Le modèle porcin de l’auto-transplantation orthotopique de rein est un modèle bien établi et reproductible qui permet de tester de nouvelles approches de traitement innovatrices dans un arrangement in vivo médicalement pertinent, avec des périodes de suivi potentiellement plus longues et des possibilités abondantes pour la collecte répétitived’échantillon 16,17. Au-delà de l’avantage de la taille comparable, qui permet une traduction relativement directe dans le cadre clinique (en particulier pour le développement de dispositifs médicaux et la posologie des médicaments), les similitudes chirurgicales-anatomiques et physiologiques en termes de réponse aux lésions ischémiques-reperfusion (IRI) et de lésions rénales, soutiennent l’utilisation de ce modèle dans la recherchetranslationnelle 17,18,19. Ce modèle offre également une excellente occasion de formation pour préparer les jeunes chirurgiens greffés aux défis techniques de la transplantation cliniqued’organes 20.
Il existe également de multiples différences par rapport au cadre humain et diverses modifications techniques du modèle peuvent être trouvées dans lalittérature 16,17,19,20,21. Cet article décrit de manière exhaustive les détails techniques, les pièges et les recommandations qui peuvent aider à établir le modèle de l’auto-transplantation orthotopique porcine de rein. La méthode de télémétrie et de surveillance vidéo décrite ainsi que notre installation de logement spécialement conçue permettent une évaluation de la gravité en gros plan et une observation clinique des animaux. L’utilisation d’un cathéter urinaire percutané et de vestes porcines désignées offre la possibilité d’une évaluation détaillée de la fonction rénale sans l’utilisation de cages métaboliques. Ces modifications techniques sont décrites comme des solutions potentielles pour répondre aux défis modernes du principe 3R (remplacement, réduction et raffinement) et améliorer les expériences sur les animaux à l’aide de grands modèlesanimaux 22.
Protocole
La présente étude a été conçue selon les principes des lignes directrices ARRIVE (Animal Research: Reporting of In Vivo Experiments)23. Les expériences ont été réalisées conformément aux directives institutionnelles et à la loi fédérale allemande concernant la protection des animaux. La proposition éthique complète a été approuvée par les autorités responsables (Comité gouvernemental de protection et d’utilisation des animaux, LANUV NRW - « Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen », Recklinghausen, Allemagne, Protocole ID: 81-02.04.2018.A051). Tous les animaux de la présente étude ont reçu des soins humains selon les principes du « Guide pour le soin et l’utilisation des animaux de laboratoire » (8e édition, Publication des NIH, 2011, États-Unis) et de la directive 2010/63/UE sur la protection des animaux utilisés à des fins scientifiques (Journal officiel de l’Union européenne, 2010). Des porcs femelles de race terrestre allemande ont été obtenus à partir d’une installation d’élevage de barrières optimisée hygiéniquement (Heinrichs GbR, Heinsberg, Nordrhein-Westfalen). La figure 1 décrit le résumé du protocole expérimental décrit.
1. Animaux et logement
- Utilisez des porcs femelles de race terrestre allemande (ou comparables) pour ce protocole. Livrer les animaux au centre de recherche 14 jours avant la première chirurgie (implantation de télémétrie) pour acclimatation et les loger dans un environnement barrière à température et humidité contrôlée avec un cycle lumineux et sombre de 12 h ( figure 2).
- Monter deux récepteurs de télémétrie au plafond de la pièce qui permet de transférer les données enregistrées directement sur un PC situé dans la salle d’observation. Veiller à ce que les animaux soient observés visuellement lors des visites régulières des vétérinaires et du gardien des animaux responsable (tous les 8 h et sur demande).
REMARQUE : En outre, dans cette expérience, une séquence de caméra en temps réel avec imagerie thermique intégrée connectée au réseau local a été utilisée. Les détails de l’installation de logement utilisée dans cette étude sont décrits à la figure 2.
2. Techniques de base et procédures communes
- Jeûnez les animaux toute la nuit avant la chirurgie.
- Prémédication par injection intramusculaire initiale d’azaperone (4 mg/kg) et d’atropine (0,1 mg/kg), suivie d’une injection de kétamine (15 mg/kg) 10 minutes plus tard.
- Après la prémédication, pesez l’animal et transférez-le directement de l’établissement d’habitation à la salle centrale de préparation à l’anesthésie de l’installation de la SALLE.
- Cannulate une des grandes veines d’oreille utilisant un cathéter veineux périphérique de 18 G. Surveillez l’animal par un ECG standard et une oxymétrie pulsée.
- Initier l’anesthésie au propofol (3 mg/kg).
- Exposez la corde vocale à l’intérieur d’un laryngoscope et insérez un tube endotracheal de 7,5 mm. Le brassard est bloqué avec de l’air selon les recommandations du fabricant.
- Insérez un tube de drainage oro-gastrique pour éliminer le liquide et l’air de l’estomac.
- Insérer un cathéter urinaire via l’urètre.
- Par la suite, couper la peau dans la zone de l’incision chirurgicale.
- Appliquer l’onguent pour empêcher le séchage de la cornée pendant la chirurgie.
- Après l’intubation orotracheal, maintenir l’anesthésie avec l’isoflurane (expiratory final 1.45-2.0 Vol.%) et le fentanyl (3 -7.5 μg/kg/h).
- Assurer un contrôle actif de la température peropératoire de l’animal par un coussin chauffant et utiliser de l’air réchauffé. Insérer une sonde rectale pour surveiller la température corporelle (température cible 36.5 °C - 37.5 °C).
- Administrer la prophylaxie antibiotique à l’aide de cefuroxime (35 mg/kg i.v.). Infuser la solution Ringer à 4 mL/kg/h et passer à 8 mL/kg/h après incision cutanée. Administrer une dose prophylactique de pantoprazole (40 mg i.v.) sur l’accès à la veine de l’oreille.
- Effectuez toutes les interventions chirurgicales dans des conditions stériles selon les principes généraux de l’asepsie chirurgicale et de l’antisepsie. Désinfecter le champ chirurgical avec la solution povidone-iode et couvrir de rideaux chirurgicaux.
3. Implantation de télémétrie
- Préparer l’animal à la chirurgie en suivant les étapes décrites en vertu de l’article 2 du protocole et confirmer une anesthésie adéquate par une diminution de la fréquence cardiaque et un manque de mouvement conscient de l’animal.
- Recueillir des échantillons de sang et d’urine pour déterminer les valeurs individuelles des laboratoires de base.
- Marquer les sites d’incision à l’aide d’un marqueur permanent.
- Pour implanter le capteur artélial du transpondeur de télémétrie, effectuez une incision de 3 à 4 cm dans l’aine. Exposez et disséquez l’artère à 360°.
- À l’aide d’une pince overholt tirer à travers les boucles de deux navires sous l’artère et les fixer avec des pinces à moustiques.
- Après avoir fait une artériotomie à l’aide #11 scalpel de lame, insérez le capteur artélial. Fermez l’artériotomie à l’aide d’une suture en polypropylène 5-0 avec des sutures à nœud unique et fixez le capteur artélial à l’aide d’une de ces sutures.
- Faire une incision de 3-4 cm de large sur le flanc gauche de l’animal et créer une poche sous-cutanée pour le transpondeur par dissection émoussée.
- Tunnel le transpondeur de télémétrie sur le flanc et le fixer au fascia musculaire (3-0 polypropylène, noeud unique). Tunnel les électrodes ECG rouges et blanches sur le côté droit et gauche du thorax. Faire deux incisions de 1 cm et fixer les électrodes dans le tissu musculaire pour assurer un bon signal ECG avec sutures noeud unique (3-0 polyglactine).
- Commencer l’enregistrement des données de télémétrie et vérifier les divers signaux (p. ex., la température corporelle enregistrée par le corps du transpondeur lui-même, la pression artérielle et les signaux ECG).
- Fermer les incisions dans l’aine, sur le flanc gauche et les deux petites incisions thoraciques à l’aide de sutures musculaires et sous-cutanées (3-0 polyglactine) et fermer la peau à l’aide d’une suture monofilament non absorbable (p. ex., 2-0 Prolène).
- Utilisez un pansement de film de pulvérisation pour sceller les emplacements d’incision.
- À ce moment-là, préparez l’animal à porter une veste porcine désignée que l’animal porte pour le reste de la période d’étude. Remplacez les vestes par une veste propre après chaque intervention chirurgicale.
REMARQUE : Pour enregistrer des données de base stables, les transpondeurs de télémétrie sont implantés 14 jours avant la chirurgie de l’index (néphrectomie gauche, veuillez également consulter discussion).
4. Nephrectomy et récupération de greffe de rein
- Préparer l’animal à la chirurgie de récupération de greffe suivant les procédures décrites à la section 2.
- Après l’induction de l’anesthésie, cannulate la veine jugulaire externe. Après la désinfection stérile du champ chirurgical, une incision de 4 cm est faite sur le côté droit dans la rainure jugulaire.
- Disséquer les tissus et les muscles sous-cutanés pour exposer la veine jugulaire externe.
- Exposez et disséquez la veine à 360°.
- À l’aide d’une pince overholt, tirer à travers les boucles à deux vaisseaux sous la veine et les fixer à l’aide de pinces à moustiques.
- Tunnel le cathéter jugulaire à l’arrière de l’animal. Pour cela, placez le cochon sur son côté gauche. Utilisez la méthode Seldinger pour insérer le cathéter jugulaire.
- Fermer l’ouverture sur la veine et fixer le cathéter à l’aide d’une suture de polypropylène 5-0.
- Fermer l’incision en deux couches (p. ex., polyglactine 3-0 pour le muscle et sous-cutanée et polypropylène 2-0 pour la peau).
- Fixer le cathéter sur la peau avec de multiples sutures (2-0 polypropylène).
- Testez le cathéter jugulaire de veine pour l’aspiration et l’injection libres. Par la suite, passez de la ligne intraveineuse de la canule de veine d’oreille à la ligne veineuse centrale.
- Après désinfection chirurgicale et drapage, effectuer une laparotomie médiane pour ouvrir l’abdomen (25-30 cm). Utilisez un rétracteur abdominal standard pour exposer le champ chirurgical.
- Utilisez des serviettes abdominales humides et chaudes pour couvrir le côlon et les petites entrailles. Demandez au deuxième assistant de tenir l’intestin dans la direction de l’hémi-abdomen droit exposant le rein et ses structures vasculaires.
- Ouvrez la couche péritonéale et disséquez le rein gauche et l’uretéreur de n’importe quel tissu adhérent utilisant la cautérisation monopolisaire, les forceps bipolaires, et les ciseaux fins.
- Ligate et diviser l’uretère gauche (3-0 polyglactine) laissant un segment d’au moins 10 à 12 cm de long.
- Compléter la dissection de la veine rénale gauche (s) et de l’artère à leur origine de vena cava inférieur et aorta, respectivement.
REMARQUE : Évitez les blessures et l’ouverture des grands vaisseaux lymphatiques dans cette région anatomique. Soyez également conscient d’une blessure potentielle à la veine azygo-lombaire se joignant à la veine rénale près de son origine du cava de vena. - Disséquer et ligate la veine azygo-lombaire entre deux ligatures (3-0 polyglactine).
- Préparez-vous à la dissection de la table arrière à l’aide d’un bol de glace et d’une couverture stérile.
- Pour récupérer le rein de greffe, serrez l’artère rénale et la veine rénale près de l’aorte et du cava de vena avec des pinces vasculaires. Retirer la greffe de rein en coupant les vaisseaux à l’aide d’un ciseaux près des pinces, puis remettre le rein à l’équipe de table arrière.
- Fermer la souche de l’artère rénale à l’aide d’une suture de polypropylène 5-0. Fermez la veine rénale à l’aide d’une suture continue à deux couches avec du polypropylène 5-0. Retirer les pinces vasculaires.
- Après avoir vérifié la zone pour les saignements ou les fuites lymphatiques, fermez l’abdomen en 4 couches.
NOTE : Péritoine : suture courante de polyglactine de 3-0 ; fascia: 0 suture en cours d’exécution de polyglactine; couche sous-cutanée : suture courante de polyglactine 3-0 ; peau : agrafeurs de peau après chirurgie de récupération de rein, pour faciliter la réouverture de l’abdomen le jour suivant et sutures simples de noeud de polypropylène de 2-0 après la procédure de transplantation pour la fermeture définitive. - Après avoir appliqué un pansement stérile, retournez l’animal à l’établissement d’habitation et laissez-le récupérer après l’extubation endotracheal. Pour l’analgésie postopératoire, utiliser la buprénorphine (0,05 - 0,1 mg/kg) par voie intramusculaire toutes les 8 h jusqu’à l’auto-transplantation.
5. Conservation de la table arrière et des organes
- Après la récupération de greffe, cannulate immédiatement l’artère rénale utilisant un cathéter périphérique standard de 14 G (orange) et fixez-le à l’aide d’un garrot préparé à partir de polyglactine 3-0.
- Rincer le rein avec une solution de préservation des organes froids.
- Après avoir rincé avec 500 mL de solution de préservation des organes, retirez la canule artérielle, enveloppez la greffe de rein dans des sacs d’organes stériles et rangez-les dans une solution de préservation des organes avec un temps ischémique froid cible (CIT) de 24 h à 4 °C à l’aide d’un circuit de refroidissement contrôlé par ordinateur.
REMARQUE : Une brève chasse d’eau post-conservation est recommandée à l’aide de 500 mL de solution saline normale de 4 °C.
6. Néphrectomie contralatérale et auto-transplantation orthotopique de rein
- Pendant l’opération du receveur, adapter la prémédication et l’anesthésie initiale au métabolisme rénal restreint et éviter l’utilisation de kétamine. L’induction est effectuée avec du propofol (3-5 mg/kg i.v.), du midazolam (0,25 mg/kg i.v.) et de l’atropine (0,1 mg/kg i.m.). Par la suite, la préparation préopératoire est identique aux procédures décrites à la section 2.
- Maintenir l’anesthésie avec l’isoflurane (expiratory final 1.45-2.0 Vol.%) et le fentanyl (3 - 7,5 μg/kg/h) et le propofol (2 - 4 mg/kg/h).
- Vérifiez et surveillez continuellement l’ECG, l’oximétrie des impulsions, la température rectale et la fonction du transpondeur de télémétrie.
REMARQUE : L’anesthésie stricte et le contrôle de tension artérielle sont d’une importance cruciale pendant la procédure d’implantation. - Dans de rares cas où le signal artérielle de tension artérielle enregistré au-dessus du transpondeur de télémétrie n’est pas satisfaisant en raison de la position supine de l’animal, placez un autre cathéter artérique dans l’artère fémorale droite utilisant la ponction percutanée et la technique de Seldinger.
- Après le drapage stérile, rouvrir la laparotomie médiane et exposer le champ chirurgical à l’aide du rétracteur abdominal. Le côlon et les petites entrailles sont placés sur le côté gauche de l’abdomen pour exposer le rein droit intact.
- Semblable à la procédure de donneur, disséquez le rein contra-latéral et ses vaisseaux du tissu environnant. Disséquer la bonne veine rénale et l’artère rénale dans le sens de l’hilum rénal pour assurer une longueur suffisante du vaisseau pour l’anastomose.
- 5 min avant le clampage vasculaire, injecter du natrium-héparine par voie intraveineuse (100 I.U./kg).
- Serrez l’artère rénale droite et la veine rénale droite utilisant des pinces vasculaires. Le rein droit est enlevé. Les navires sont vérifiés pour l’intégrité avant de commencer les anastomoses.
- Placez le rein de greffe préservé dans l’abdomen et commencez les anastomoses veineuses et artérielles.
- À partir de ce point, maintenez la pression artérielle moyenne au-dessus de 80-90 millimètres Hg pour assurer une bonne perfusion tôt de la greffe de rein suivant la reperfusion. Atteindre cet objectif en partie par une gestion adéquate du volume et en partie par l’administration de noradrénaline (0,1 - 1,0 μg/kg/min en infusion continue utilisant la pression artérielle moyenne et la fréquence cardiaque pour surveiller l’efficacité).
- Effectuez une anastomose de bout en bout de la veine rénale :
- Après avoir placé deux points d’angle à l’aide de polypropylène 5-0, suture du mur arrière d’une manière continue.
- Attachez le point d’angle crânien et attachez-le avec le fil utilisé pour le mur arrière.
- Après avoir terminé le mur arrière, utilisez le point d’angle crânien pour suturer le mur avant dans une direction cranio-caudale. Rincer la veine avec une solution saline aheparinized (100 I.U./mL). Attachez le point d’angle caudal.
REMARQUE : En cas d’inadéquation de taille entre le donneur et le receveur, un petit facteur de croissance peut être utilisé pour assurer une anastomose large et suffisante. Il y a beaucoup de variations possibles des branches rénales de veine de porcin. Dans le cas de l’anatomie veineuse complexe, une approche modifiée de l’anastomose est nécessaire (voir la figure 3).
- Effectuez l’anastomose de bout en bout de l’artère rénale :
- Utilisez un point d’angle crânien en polypropylène 6-0 pour effectuer l’anastomose artérielle. Placer un autre point caudal, soutenant le coin qui est plus tard enlevé, est facultatif.
- Suture le mur arrière d’une manière continue en utilisant la technique du parachute. Après être arrivé au coin caudal enlever le deuxième point de coin (le cas échéant).
- Suture du mur avant avec l’autre extrémité de la suture en polypropylène 6-0 à double armée. Rincer l’artère avec une solution saline héparinisée (100 I.U./mL). Attachez les deux fils dans le coin caudal.
- Enregistrez le temps nécessaire pour effectuer les deux anastomoses avec un temps d’ischémie chaud cible de <40 min.
- Réperfusez le rein en ouvrant la pince vasculaire veineuse et par la suite la pince artérielle. Vérifiez s’il y a des saignements importants.
- Si aucun saignement significatif des anastomoses n’est observé, déballez la greffe de rein et versez la solution saline normale chaude dans l’abdomen couvrant la greffe reperfusée.
- Repositionner la greffe, si nécessaire, pour assurer une reperfusion homogène et éviter la congestion.
- Administrer la papaverine topiquement à l’extérieur de l’artère rénale et de l’anastomose artérielle (5 mL non dilué).
- Après la reperfusion, infuser 250 mL de solution de glucose de 20% pour induire la dirésis osmotique suivie de l’administration d’une dose simple de mg 80 de furosémide.
REMARQUE : Par la suite, la production initiale d’urine peut être observée. - Pour assurer le drainage urinaire, passez un cathéter d’urine pédiatrique de 12 Français à travers la paroi abdominale du flanc droit de l’animal, rétroperitoneally.
- Fixer le cathéter dans l’uretère à l’aide de ligatures (2-0 polyglactine) et bloquer le cathéter avec 2 mL salin. D’autres sutures sont utilisées pour adapter et fixer l’uretère au péritoine de la paroi abdominale (polypropylène 2-0). Le cathéter est également fixé à la peau avec au moins deux sutures à nœud unique (2-0 polypropylène).
- Fermer la couche péritonéale sur le rein pour éviter la dislocation de la greffe de rein et le kinking des anastomoses vasculaires (3-0 polyglactine).
- Fermez l’abdomen d’une manière semblable de 4 couches comme décrit plus tôt pour la récupération de greffe.
- Après la fermeture abdominale, maintenez la normothermie sur la table de LA.
REMARQUE : La pression artérielle moyenne doit être maintenue de plus de 80 mm Hg jusqu’à ce que l’animal soit éveillé et soit en position couchée. - Après la fermeture abdominale, utiliser l’échographie Doppler couleur pour assurer une perfusion artérielle et veineuse adéquate de la greffe de rein (Figure 4). Surveillez l’animal de près jusqu’à ce qu’il soit complètement éveillé et puisse marcher et boire spontanément. Les animaux reçoivent 1 L de solution Ringer pendant la phase de récupération.
- Par la suite, retournez l’animal dans sa boîte dans l’établissement d’habitation.
7. Suivi, collecte d’échantillons et de données
- Fournir aux animaux de l’eau ad libitum dès qu’ils peuvent boire spontanément. Fournissez des aliments solides dès le jour 1 postopératoire.
- Pour l’analgésie postopératoire, administrer la buprénorphine (0,05 - 0,1 mg/kg) par voie intramusculaire toutes les 8 h pendant 72 h, donner pantozol (40mg i.v.) une fois par jour pendant 72 h. Fournir un traitement antibiotique (cefuroxime 35 mg/kg i.v. 2x par jour) et une prophylaxie thrombose (500 mg d’acide acétylsalicylique du jour postopératoire 1) pendant toute la période d’observation jusqu’à la fin de l’expérience.
REMARQUE : Si des complications de saignement se produisent, l’aspirine est discontinuée. - Enregistrez les données de télémétrie continue tout au long de la période d’observation. S’assurer que les animaux sont visités au moins toutes les 8 h par l’agent vétérinaire et/ou par un technicien vétérinaire expérimenté et que leur état clinique est évalué à l’aide d’une feuille de pointage qui est utilisée comme base pour mettre fin prématurément à l’expérience si l’état clinique de l’animal l’exige.
REMARQUE : Ces critères dits de point de terminaison humain sont définis comme décrit précédemment24. - Effectuer la collecte quotidienne de l’échantillon à l’aide de la ligne veineuse centrale et du cathéter urinaire percutané. Changer les sacs urinaires (2000 mL) 2 fois par jour.
- Après la collecte d’échantillons ou l’administration de liquides ou de médicaments, bloquez le cathéter veineux central avec une solution saline héparinée (100 I.U./mL) entre chaque utilisation pour éviter l’occlusion et le couvrir d’un nouveau capuchon stérile.
- Après la période d’observation correspondante de 5 à 7 jours, sacrifiez les animaux en anesthésie profonde après la rélaparotomie, la collecte d’échantillons et l’explantation de la greffe de rein. Le sacrifice est effectué à l’aide d’une seule injection de pentobarbital (50 - 60 mg/kg i.v.).
REMARQUE : Conformément au principe de la 3R, les organes et tissus restants des animaux sacrifiés peuvent être utilisés à diverses fins de recherche et d’éducation ex vivo dans des instituts internes.
Résultats
Notre groupe a plusieurs années d’expérience avec des modèles de transplantation d’organes solides chez les petits et grands animaux et a utilisé le modèle orthotopique porcin d’auto-transplantation rénale, obtenant des résultats reproductibles dans divers milieuxexpérimentaux 16,25,26,27. Selon la configuration expérimentale, nous recommandons d’effectuer 3 à 5 auto-transplantations comme expériences préliminaires qui assure une courbe d’apprentissage suffisante de toute l’équipe expérimentale. Dans le contexte actuel, 5 transplantations ont été nécessaires pour former un chirurgien, avec 8 ans d’expérience expérimentale et 5 ans d’expérience chirurgicale clinique dans le domaine de la chirurgie de transplantation, dans l’exécution de ces expériences. Cela peut différer en fonction de l’exposition antérieure du chirurgien à ces techniques.
Dans les cadres de ce protocole, les résultats d’un ensemble de 5 expériences orthotopiques d’auto-transplantation de rein porcin sont démontrés. L’implantation du transpondeur a été couronnée de succès chez chaque animal avec suffisamment de signaux de télémétrie tout au long de la période d’observation (à l’exception d’un animal ayant un dysfonctionnement partiel du transpondeur). L’intervalle couteau à peau pour l’implantation du transpondeur était de 85 min ± 5 min (tableau 1). Après la récupération de la greffe, tous les animaux se sont bien rétablis dans l’établissement d’habitation. L’intervalle couteau-peau pour la chirurgie de récupération était de 135 min ± 32 min (y compris environ 30-45 min pour l’insertion, le tunnelage et la sécurisation du cathéter jugulaire). Le rein gauche a été stocké dans un bain d’eau froide avec un temps cible d’ischémie froide de 24 h (24 h ± 30 min). Le lendemain, après l’induction et la rélaparotomie d’anesthésie, le rein contralatéral (droit) a été enlevé suivi de l’auto-transplantation orthotopique de la greffe gauche stockée froide de rein comme décrit précédemment. L’intervalle couteau-peau pour la chirurgie d’auto-transplantation était 168 min ± 27 min (y compris l’explantation du rein droit). Le temps chaud d’ischémie était 34 min ± 7 min. Chaque greffe de rein implantée a eu une production minimale mais directe d’urine suivant la reperfusion. Après la fermeture abdominale, l’ultrason de Doppler de couleur a montré la perfusion artérielle et veineuse satisfaisante du rein dans tous les cas (figure 4). Tous les animaux récupérés de l’anesthésie et aucune complication significative n’ont été observés tout au long de la période d’observation. Des échantillons quotidiens de sang et d’urine ont été prélevés. Tous les porcs étaient en bon état clinique pendant le suivi et ont été sacrifiés après 5 jours. Les valeurs de créatinine et de potassium de sérum ont culminé sur POD3-4. Le pH sanguin est demeuré dans des fourchettes normales (figure 5). La production d’urine s’est rétablie à des valeurs normales au cours des quatre premiers jours postopératoires. Le nombre de globules blancs a été légèrement augmenté à la fin de la période de suivi (figure 5). La température corporelle, mesurée par une surveillance continue de la télémétrie, a montré de légères fluctuations au cours de la période postopératoire.
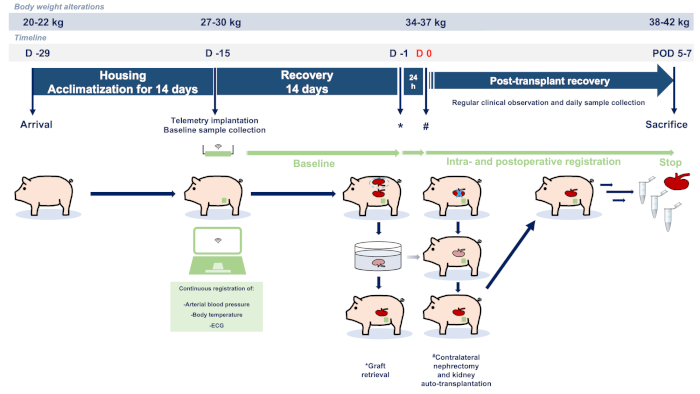
Figure 1 :Étude du débit et du protocole. Abréviations utilisées : jour pod-postopératoire ; ECG-électrocardiographie. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
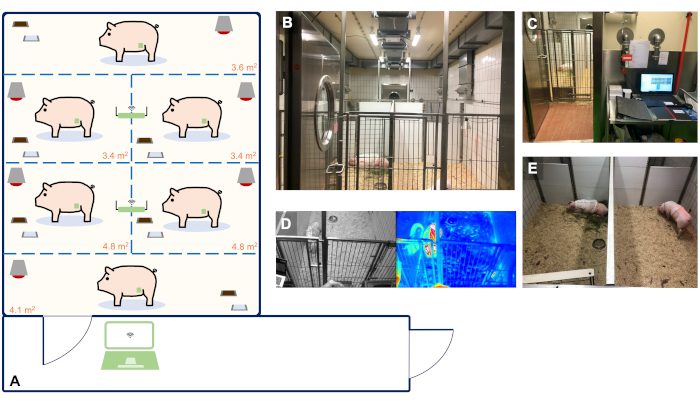
Figure 2: Installation de logement pour animaux avec surveillance en temps réel et en continu de télémétrie de jusqu’à 6 animaux. (A) Schéma directeur de notre installation adapté à la surveillance du logement et de la télémétrie de jusqu’à 6 animaux. La taille des boîtes de détention unique a été déterminée sur la base des lignes directrices de la directive de l’UE 2010/63 et de l’annexe A. Panels A-E de l’ETS montrent des images représentatives de l’organisation de notre installation. (B) Chambre pour animaux pour le logement de 6 animaux. (C) Salle d’observation avec un PC utilisé pour l’enregistrement continu des données de télémétrie. (D) Vidéo en temps réel et des images thermiques des animaux. (E) Tenue individuelle assurant un contact acoustique et olfactif des animaux avec leurs compagnons pour éviter l’isolement social. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3: Auto-transplantation orthotopique des reins et variations anatomiques et possibilités de reconstruction. (A,B) Les étapes du modèle orthotopique d’auto-transplantation rénale en cas d’anatomie vasculaire « standard ». (C) Variation 1: tandis qu’une veine plus grande est livré avec le rein donneur, il ya deux veines sur le côté receveur. Gestion : la veine plus petite est fermée par une ligature et l’anastomose est exécutée de bout en bout entre les veines rénales. (D) Variation 2 : bien qu’une veine plus grosse soit livré avec le rein donneur, il n’y a pas de vaisseau receveur approprié du côté contralatéral (p. ex., inadéquation de la taille). Gestion : anastomose de bout en côté de la veine rénale au cava inférieur de vena. (E) Variation 3 : deux veines de taille similaire des deux côtés. Gestion : reconstruction par deux anastomoses veineuses. (F) Variation 4 : bien que deux veines de taille similaire viennent avec le rein du donneur, il n’y a pas de vaisseau receveur approprié du côté contralatéral. Gestion : anastomosis de bout en côté de la veine rénale au cava inférieur de vena dans le cas de deux veines rénales. (G) Variation 5: un rein donneur est livré avec une veine montrant une bifurcation précoce, alors qu’il ya une grande veine sur le côté contralatéral. Gestion : anastomose de bout en bout du canal commun court de la veine rénale de donneur avec une grande veine du côté destinataire. (H) Variation 6 : bien que le rein du donneur soit livré avec une veine rénale unique avec une bifurcation précoce, il n’y a pas de vaisseau receveur approprié du côté contralatéral. Gestion : anastomosis de bout en côté du canal commun court de la veine rénale de donneur au cava inférieur de vena. Ce chiffre représente une poignée des variations les plus fréquentes et n’est pas statistiquement complet en termes de toutes les variations possibles chez les porcs de race terrestre allemande. Abréviations utilisées : greffe kg-rein; RK-droit rein; Vena cava iVC-inférieure; AO-aorta S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
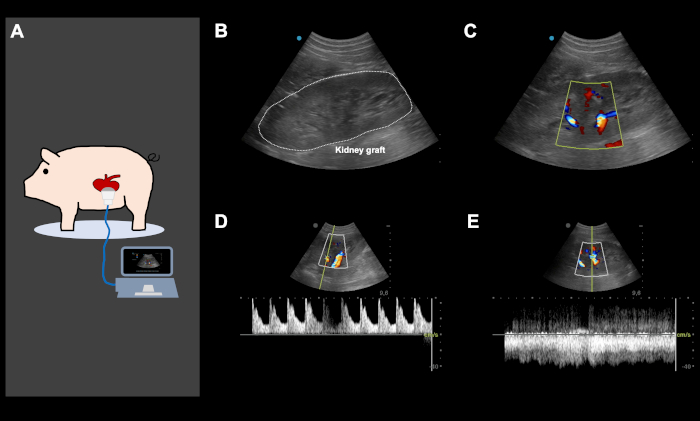
Figure 4 :Images d’ultrasons Doppler de couleur représentative, directement après l’auto-transplantation orthotopique de rein et la fermeture abdominale. (A) L’échographie Color Doppler est effectuée directement après l’implantation de la fermeture rénale et abdominale, afin d’assurer une bonne perfusion artérielle et veineuse de la greffe de rein et de dépister le risque de pliage vasculaire iatrogène. L’échographie a également été utilisée quotidiennement et à la demande, en fonction de la performance clinique de l’animal pour dépister divers problèmes. (B-E) Images représentatives d’ultrason d’une greffe de rein suivant l’implantation. L’image de la greffe de rein avec et sans couleur Doppler (B,C) montre une excellente artère (D) et perfusion veineuse (E). Cette figure montre des images représentatives du même animal. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
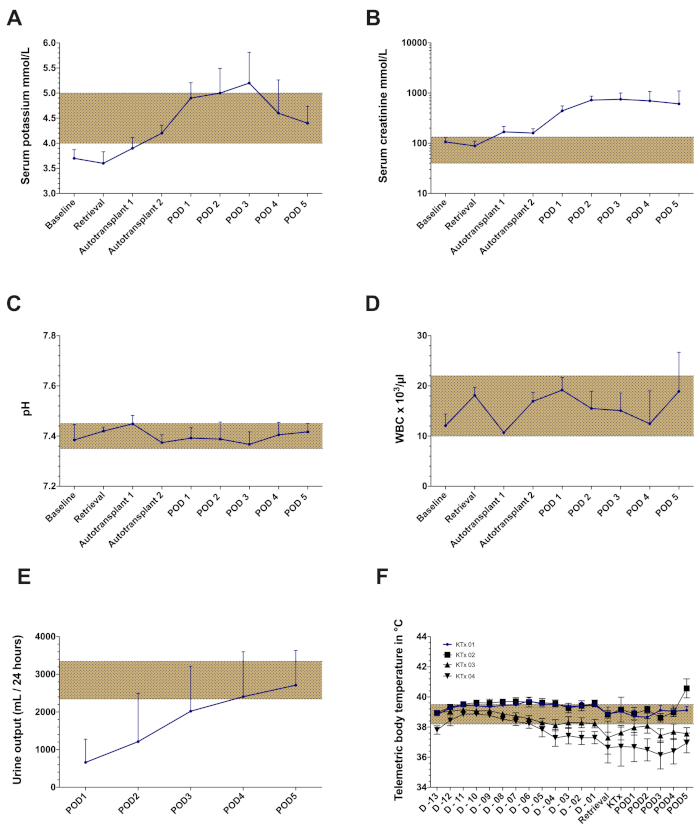
Figure 5 :Résultats de laboratoire représentatifs et données de télémétrie du modèle orthotopique d’auto-transplantation rénale avec un temps d’ischémie froide de 24 h. (A) Valeurs de potassium sérum (B) Valeurs créatinine sérique (C) pH ( D )Nombrede globules blancs (WBC) (E) Production d’urine. (F) Température corporelle moyenne enregistrée par surveillance télémétrique tout au long de la période d’observation dans quatre transplantations rénales consécutives (aucune donnéeprésentée à partir du 5e animal en raison d’un dysfonctionnement partiel du transpondeur). Abréviations utilisées : jour pod-postopératoire. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
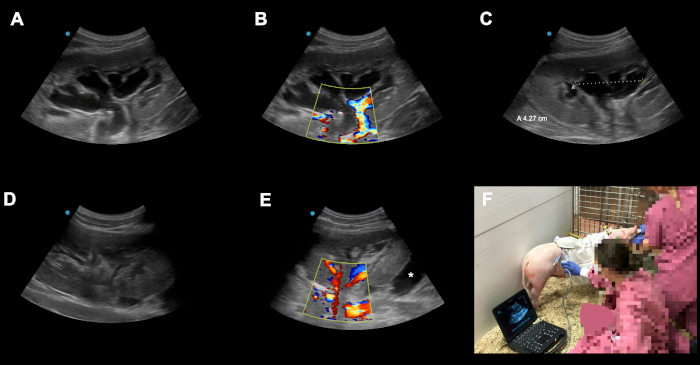
Figure 6: Exemples de complications et d’embûches périopératoires possibles. (A-C) Congestion postopératoire de la greffe rénale transplantée sur POD3 suite à l’auto-transplantation orthotopique kindey. (D) La raison de la congestion a été identifiée comme le cathéter kinking dû à une suture accentuée sur le niveau de la peau. Après avoir réajusté la suture la congestion résolue presque complètement en 24 h. ( E )Iciune autre greffe de rein sur POD2 suivant l’auto-transplantation orthotopique de rein est montrée. Astérix (*) montre une collection fluide autour du sous-pôle de la greffe (collecte sanglante contre lymphocèle). En raison de notre technique avec la fermeture du péritoine sur le rein ces collections sont habituellement autolimitatives en raison des effets avantageux de la compression locale. Les animaux doivent être surveillés de près en fonction de la découverte locale, des signes de saignement ou d’infection. (F) L’échographie Doppler de couleur qualifiée effectuée quotidiennement (et sur demande) dans le logement a, outre son utilisation académique (p. ex., documentation, enregistrement des indices de résistance artérielle), un rôle diagnostique crucial dans la reconnaissance des complications potentielles dans la phase subclinique tôt. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| Tâche/étape expérimentale | Jours | Heure (min) | Chirurgien | Vétérinaire | Technicien vétérinaire | Technicien de laboratoire | Doctorant | Total |
| Nr | ||||||||
| Soins préopératifs | D-29 à D-15 | N.a. | 1 | 1 | 1 | 3 | ||
| Chirurgie d’implantation de télémétrie | D-15 (D-15) | 85±5 | 1 | 1 | 1 | 1 | 1 | 5 |
| Soins postopératoires après l’implantation de la télémétrie | D-15 à D-1 | N.a. | 1 | 1 | 1 | 3 | ||
| Chirurgie de récupération de greffe | D-1 (D-1) | 135±32 | 1 | 2 | 1 | 2 | 2 | 8 |
| Chirurgie d’auto-transplantation rénale | D 0 | 168 ±27 | 1 | 2 | 1 | 2 | 2 | 8 |
| Soins postopératoires après l’auto-transplantation rénale | D 0 à D5 | N.a. | 2 | 1 | 2 | 5 | ||
| Sacrifice | D 5 | N.a. | 2 | 1 | 1 | 4 |
Tableau 1. Description des ressources humaines et des calendriers requis pour effectuer diverses étapes expérimentales du modèle d’auto-transplantation rénale porcine.
Discussion
Le modèle porcin de l’AC permet l’étude de nouvelles approches thérapeutiques et dispositifs médicaux dans un cadre cliniquement pertinent pour lesgrands animaux 15,17,21. Les similitudes anatomiques, pathophysiologiques et chirurgicales-techniques entre le porcin et l’environnement humain peuvent faciliter l’interprétation clinique des données et la traduction rapide des résultats et des techniques en essaiscliniques 15,16,17,18,19,21.
Le modèle d’auto-transplantation orthotopique des reins n’est pas seulement conforme au principe de la 3R en réduisant le nombre d’animaux requis par rapport à l’allo-transplantation, par exemple aucun animal donneur distinct n’est nécessaire, mais offre également une occasion unique d’étudier les effets de l’IRI et des lésions de préservation sans les effets confusionnels de la réponse immunologique et des médicaments immunosuppresseurs17,21.
De légères modifications du protocole permettent de modéliser un large éventail de situations cliniques. Pour imiter l’AC en utilisant le don après la mort circulatoire (DCD) reins, les structures vasculaires sont serrés pendant 30 à 60 min in situ avant la récupération rénale, tandis que les temps prolongés d’ischémie froide (24 heures et plus) peuvent être appliquées pour modéliser les dommages étendus deconservation 16,17,28,29.
Bien que, le modèle d’AC porcin soit chirurgicalement moins difficile que les modèles solides de transplantation d’organe chez de petits animaux (par exemple des rats et des souris)26,il y a de multiples aspects techniques et pièges qui doivent être gardés à l’esprit pour améliorer des résultats et éviter des complications spécifiques17.
Ne pas éviter les grands vaisseaux lymphatiques autour de la véna cava inférieure et de l’aorte pendant la récupération ou l’implantation de greffe due à l’erreur technique ou aux variations anatomiques, peut mener à une fistule lymphatique de sortie élevée et à la collecte abdominale postopératoire de fluide, à l’infection, et à l’échec potentiellement technique. Les vaisseaux lymphatiques doivent être complètement évités pendant la chirurgie ou fermés avec des sutures de polypropylène 5-0 ou 6-0. Il est sage d’éviter également l’utilisation de bipolaire ou tout autre dispositif de coagulation en cas de fuites lymphatiques. Il conduit généralement à l’aggravation de la situation. En cas de fuite lymphatique à faible rendement, notre équipe a une bonne expérience avec l’application de patchs de collagène à base de fibrine (par exemple, Tachosil)30, cependant, leur coût élevé limite leur application dans ce contexte.
Dans le protocole actuel nous démontrons une approche transperitoneal pour la récupération rénale et l’auto-transplantation. Il s’agit d’une différence technique majeure par rapport à la situation clinique, où les greffes rénales sont généralement implantées dans la fossa iliaque en utilisant une approche extrapénitale. Bien que, la plupart des groupes utilisent une approche transperitoneal et orthotopique dans le modèle porcin, la transplantation hétérotopique à la fossa iliaque est également possible chez lesporcs 31. Cependant, en raison du diamètre relativement bas de l’artère iliaque externe dans les porcs de 30-40 kg et de sa tendance au vasospasme le rend parfois difficile d’exécuter l’anastomosis de bout en côté de l’artère rénale à l’artère iliaque externe31. En ce qui concerne le fait que nous récupérons le rein gauche par une approche transperitoneal pour effectuer une auto-transplantation ultérieure, il est plus possible d’effectuer l’implantation en rouvrant la même incision et en utilisant une approche orthotopique straigtforward, en particulier que par protocole, il est également nécessaire d’enlever le rein droit indigène pour s’assurer que l’animal se rétablira avec un seul kindey prédamaged. La description complète de toutes les variantes techniques possibles du modèle dépasse la portée de ce protocole et a été résumée par d’autres articlesd’examen complet 31.
La dislocation de la greffe rénale transplantée et le kinking conséquent des anastomoses vasculaires est une source majeure d’échec dans le modèle de KT porcin, menant rapidement à l’occlusion vasculaire et à l’échec complet de l’expérience, dû à une complication chirurgicale. Pour éviter cela, suite à l’auto-transplantation, nous fermeons la couche péritonéale sur le rein avec une suture en cours d’exécution en utilisant 3-0 polyglactine. En outre, l’ultrason de Doppler de couleur est exécuté directement après l’implantation de la fermeture de rein et abdominale, pour assurer la perfusion artérielle et veineuse bonne de la greffe de rein. L’échographie est également utilisée quotidiennement et à la demande, en fonction de la performance clinique de l’animal, pour dépister la perfusion rénale, les problèmes post-rénaux (p. ex. obstruction ou kinking du cathéter urinaire) et la collecte des liquides en raison d’une fistule lymphatique, d’un saignement ou d’une infection (figure 4 et figure 6).
Comme 24 heures d’ischémie rhume entraînent souvent une déficience fonctionnelle et une fonction de greffe retardée, les animaux peuvent avoir besoin d’une thérapie médicale à la demande si elle est jugée nécessaire par l’agent vétérinaire. Ceci peut inclure la thérapie de perfusion utilisant 5% de glucose et/ou de solution de Ringer administrée par l’intermédiaire de la ligne veineuse centrale, des injections de bolus de furosémide (en cas d’oliguria/anuria selon l’état clinique et les résultats de laboratoire, injections de bolus de mg 60-80 jusqu’à 200 mg/jour), et l’administration orale du sulfonate de polystyrène de sodium (Resonium A) en cas d’hyperkaliémie grave32. Pour éviter les biais expérimentaux, l’agent vétérinaire responsable des soins vétérinaires post-transplantation des animaux doit être aveuglé pour le traitement appliqué et le regroupement.
Bien que, l’anatomie de l’artère rénale est assez simple chez les porcs landrace allemands avec généralement une artère à reconstruire, il ya un large spectre de variations anatomiques des branches veineuses rénales qui nécessitent une certaine créativité chirurgicale au cours de la reconstruction veineuse. Fréquemment, deux branches veineuses rénales (ou plus) se rejoignent à différents niveaux entre l’hilum rénal et le véna cava inférieur. Les variations les plus fréquemment observées et les options de reconstructionpossibles 17 sont indiquées à la figure 3.
Après la première intervention chirurgicale (jour -15, implantation de télémétrie), tous les animaux reçoivent une veste porcine qu’ils portent tout au long de la période des expériences. Cela offre une excellente protection contre les blessures accidentelles et la dislocation des cathéters implantés et offre de la place pour le stockage des sacs de collecte d’urine. L’utilisation de ces vestes est également une solution réalisable pour éliminer le besoin de cages métaboliques pour l’évaluation du dégagement de créatinine comme méthode de raffinement selon le principe 3R.
Notre établissement d’habitation intègre l’utilisation de la télémétrie et de la surveillance périopératoire vidéo. Bien que ces méthodes ne puissent remplacer les visites régulières de l’agent vétérinaire et des techniciens, elles facilitent les interventions rapides et améliorent l’évaluation de la gravité afin d’affiner davantage nos paramètres expérimentaux pour l’avenir. Il existe un large éventail d’indications pour l’utilisation d’un dispositif de télémétrie implantable dans les grands modèlesanimaux 33. Bien que, la surveillance étroite des paramters cliniques suivant la chirurgie majeure telle que l’ECG, la tension artérielle, la température soit considérée comme standard dans le cadre clinique humain d’une unité chirurgicale de soins intensifs et intermédiaires, dans la surveillance expérimentale de chirurgie est la plupart du temps discontinuée quand l’animal se réveille de l’anesthésie33,34,35. Par conséquent, la télémétrie offre un moyen réalisable pour la surveillance continue de ces animaux. Nous croyons que toutes ces données contribuent à la détection précoce de la complication postopératoire possible avec précision et temps (p. ex., choc hémorragique ou septicémie détectée par augmentation de la température, de l’hypotonie et de la tachycardie). Cela peut faciliter une intervention opportune (p. ex., introduction d’une thérapie antibiotique thérapeutique, substitution des fluides, arrêt de l’anticoagulation ou sacrifice de l’animal pour éviter de souffrir). Outre cet aspect de suivi « en temps réel », notre groupe se concentre actuellement sur l’évaluation de la gravité et le raffinement des expériencessur les animaux 36,37,38. L’analyse rétrospective d’une grande quantité de données de télémétrie recueillies dans ces expériences peut nous permettre de mieux stratifier la gravité de ce type d’interventions chirurgicales et d’optimiser les soins périopératoires (p. ex., l’analgésie) chez les animaux de laboratoire.
En ce qui concerne la télémétrie implantable, une période d’au moins 12 jours après l’implantation du système de mesure est recommandée pour assurer des données de mesure stables et optimales (basées sur la communication personnelle). Après avoir discuté de cette question avec divers fabricants fournissant des solutions de télémétrie pour les grands animaux ainsi qu’avec d’autres groupes de recherche utilisant ces systèmes dans divers contextes expérimentaux, nous avons décidé d’intégrer une période de 14 jours entre l’implantation de télémétrie et la transplantation rénale. Au cours des premiers jours, des déviations peuvent encore se produire en raison du mouvement de l’animal que les processus de cicatrisation et de guérison sont encore non accompagnés.
Malgré ses avantages, le modèle décrit ci-dessus a certaines limites. La complexité et les ressources et l’infrastructure requises sont les limites les plus importantes du modèle. Le protocole expérimental fastidieux, les techniques complexes et le suivi périopératoire intense nécessitent la disponibilité d’un logement important et d’une capacité de gestion des ressources ou d’études et nécessitent la participation d’une équipe plus vaste, y compris des boursiers au doctorat, des chirurgiens, des vétérinaires et des techniciens (tableau 1). Par conséquent, d’après nos observations empiriques, il est généralement impossible d’effectuer plus de deux interventions par jour. Un autre inconvénient du modèle porcin par rapport aux modèles de petits animaux est la possibilité limitée d’investigations mécanistes et moléculaires-biologiques. Dans le protocole actuel seulement 5 jours de suivi ont été rapportés. Cela était approprié pour démontrer les caractéristiques expérimentales les plus importantes du modèle, mais ce suivi relativement court peut ne pas être suffisant pour répondre à certaines questions de recherche spécifiques (p. ex. rétablissement à long terme de la fonction par rapport aux dommages aigus). Par conséquent, une extension du suivi liée au projet pourrait être nécessaire. Ce manuscrit décrit notre « meilleure pratique » actuelle dans le cadre expérimental de l’auto-transplantation orthotopique porcine de rein. Bien que certaines étapes soient obligatoires pour établir avec succès ce modèle, les aspects mineurs (p. ex., l’utilisation peropératoire d’un cathéter vésical, le placement du cathéter artérique à l’artère fémorale par rapport à l’artère carotide) sont facultatifs et peuvent être évités ou modifiés à la discrétion des chercheurs. La description et la justification de chaque aspect méthodique dépasseraient la portée du présent protocole et ont été discutées ailleurs31. Enfin, il est également difficile de reproduire la situation clinique exacte de l’ECD KT dans le modèle porcin où les donneurs âgés, les allogreffes souffrant de lésions rénales aiguës et les donneurs atteints de comorbidités multiples et de maladies chroniques telles que l’hypertension, le diabète sucré ou l’artériosclérose représentent une partie importante du bassin marginalde donneurs 8,9.
Malgré les limitations mentionnées ci-dessus ainsi que les défis techniques et logistiques, ce modèle animal bien établi et reproductible de l’AC offre une occasion unique d’étudier de nouvelles thérapies et techniques pour améliorer la préservation des organes et les résultats cliniques et représente une excellente plate-forme pour les jeunes chirurgiens de maîtriser les techniques de transplantation d’organes dans un grand modèle animal.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Les auteurs ont exprimé leur gratitude à Pascal Paschenda, Mareike Schulz, Britta Bungardt, Anna Kümmecke pour leur assistance technique habile.
Les auteurs déclarent être financés en partie par le programme START de la Faculté de médecine de l’Université RWTH d’Aix-la-Chapelle (#23/19 à Z.C.), de la Fondation B.Braun, Melsungen, Allemagne (BBST-S-17-00240 à Z.C.), la Fondation allemande pour la recherche (Deutsche Forschungsgemeinschaft - DFG; FOR-2591, AU 542/5-1, AU 542/6-1; 2016 à R.T. et SFB/TRR57, SFB/TRR219, BO3755/3-1, BO3755/6-1 à P.B.) et le ministère allemand de l’Éducation et de la Recherche (BMBF: STOP-FSGS-01GM1901A à P.B.), sans la participation des bailleurs de fonds à la conception de l’étude, à la collecte de données, à l’analyse des données, à la préparation des manuscrits ou à la décision de publier.
matériels
| Name | Company | Catalog Number | Comments |
| Anesthesia materials, drugs and medications | |||
| Aspirin 500mg i.v., powder for solution for injection | Bayer Vital AG, Leverkusen, Germany | 4324188 | antiplatelet agents |
| Atropine sulfate solution for injection, 100mg | Dr. Franz Köhler Chemie GmbH, Bensheim, Germany | 1821288 | parasympatholytic agent, premedication |
| Bepanthen ointment for eyes and nose | Bayer Vital AG, Leverkusen, Germany | 1578675 | eye ointment |
| BD Discardit II syringes, 2ml, 5ml, 10ml,20ml | Becton Dickinson GmbH, Heidelberg, Germany | 300928, 309050,309110, 300296 | syringes |
| BD Micolance 3 (20G yellow) Cannula | Becton Dickinson GmbH, Heidelberg, Germany | 305888 | venous catheter |
| BD Venflon Pro Safety (20G pink) | Becton Dickinson GmbH, Heidelberg, Germany | 4491101 | venous catheter |
| Buprenorphine (Buprenovet) | Bayer Vital AG, Leverkusen, Germany | 794-996 | analgesia |
| Cefuroxime 750mg, powder for preparing injection solution | FRESENIUS KABI Deutschland GmbH, Bad Homburg, Germany | J01DC02 | antibiotics |
| Covidien Hi-Contour, Endotracheal Tube 7,5 with Cuffed Murphy Eye | Covidien Deutschland GmbH,Neustadt/Donau, Germany | COV-107-75E | endotracheal Tube |
| FENTANYL 0,5 mg Rotexmedica solution for injection | Rotexmedica GmbH Arzneimittelwerk, Trittau, Germany | 4993593 | opioide analgetic agent |
| Furosemide-ratiopharm 250 mg/25 ml solution for injection | Ratiopharm GmbH, Ulm, Germany | 1479542 | loop diuretics |
| Glucose 5% solution for infusion (500ml, 250ml) | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 3705273,03705422 | infusion fluid |
| Glucose 20% solution for infusion | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 4164483 | osmotic diuresis |
| Heparin-Sodium 5000 I.E./ml | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 15782698 | anticoagulant |
| Isoflurane-Piramal (Isoflurane) | Piramal Critical Care Deutschland GmbH, Hallbergmoos, Germany | 9714675 | volatile anaesthetic agent |
| Ketamine (Ketamine hydrochloride) 10% | Medistar Arzneimittelvertrieb GmbH, Ascheberg, Germany | 0004230 | general anaestetic agent |
| MIDAZOLAM 15mg/3ml | Rotexmedica GmbH Arzneimittelwerk, Trittau, Germany | 828093 | hybnotica, sedative agent |
| NaCl 0,9% solution for infusion (500ml,1000ml) | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 864671.8779 | infusion fluid |
| Norepinephrine (Arterenol) | Sanofi-Aventis Deutschland GmbH, Frankfurt, Germany | 16180 | increase in blood pressure |
| Organ preservation solution (e.g. HTK) | Dr. Franz Köhler Chemie GmbH, Bensheim, Germany | should be decided based on preference and experimental design | organ preservation |
| Pantoprazole 40mg/solution for injection | Laboratorios Normon,Madrid, Spain | 11068 | proton pump inhibitor |
| Paveron N 25mg/ml solution for injection (Papaverine Hydrochloride) | LINDEN Arzneimittel-Vertrieb-GmbH, Heuchelheim, Germany | 2748990 | spasmolytic agent for vasodilatation |
| Pentobarbital (Narcoren) | Boehringer Ingelheim vetmedica GmbH, Ingelheim, Germany | 1,204,924,565 | used for euthanasia |
| Propofol 1% (10mg/ml) MCT Fresenius | FRESENIUS KABI Deutschland GmbH, Bad Homburg, Germany | 654210 | general anaesthetic agent |
| Ringer solution | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 1471411 | infusion fluid |
| Sterofundin ISO solution for infusion (1000ml) | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 1078961 | Infusion fluid |
| Stresnil (Azaperone) 40mg/ml | Elanco | 797-548 | sedative |
| Urine catheter ruffle 12CH | Wirutec Rüsch Medical Vertriebs GmbH, Sulzbach, Germany | RÜSCH-180605-12 | transurethral urinecatheter |
| Surgical materials | |||
| Appose ULC Skin Stapler | Covidien Deutschland GmbH,Neustadt/Donau, Germany | 8886803712 | skin stapler |
| Cavafix Certo 375 | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 4153758 | central venous catheter |
| EMKA Easytel +L-EPTA Transponder | emka TECHNOLOGIES S.A.S,Paris,France | L-EEEETA 100 | telemetry transponder |
| EMKA Reciever and Data Analyzer System | emka TECHNOLOGIES S.A.S,Paris,France | Reviever | telemetry receiver |
| Feather Disposable Scapel (11)(21) | Feather, Japan | 8902305.395 | scapel |
| Prolene 2-0, blue monofil VISI-BLACK, FS needle | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | EH7038H | skin |
| Prolene 3-0,blue monofil,FS1 needle | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | EH7694H | skin |
| Prolene 5-0 (simply angulated, C1 needle) blue monofil VISI-BLACK | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | EH7227H | vascular |
| Prolene 5-0 (double armed, C1 needle) 60cm | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | KBB5661H | vascular |
| Prolene 6-0 (double armed, C1 needle) 60cm | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | EH7228H | vascular |
| Sempermed derma PF Surgical Gloves Seril Gr. 7, 7.5, 8 | Semperit investment Asia Pte Ltd, Singapore | 4200782,4200871,4200894 | surgical gloves |
| Sentinex® PRO Surgical Gowns Spunlace XL 150cm | Lohmann & Rauscher GmbH & Co. KG, Neuwied, Germany | 19302 | surgical gown |
| Tachosil | Takeda Pharma Vertrieb GmbH & Co. KG, Berlin, Germany | MAXI 9,5 x 4,8 cm | haemostasis |
| Telasorp Belly wipes (green 45x45cm) | PAUL HARTMANN AG,Heidenheim, Germany | 4542437 | abdominal towel |
| Pediatric urine catheter | Uromed Kurt Drews KG, Oststeinbeck, Germany | PZN 03280856 | used for the uretero-cutaneus stoma |
| VICRYL- 0 MH Plus | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | V324 | fascial closure |
| VICRYL - 3-0, SH1 Plus needle, 75cm | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | W9114 | subcutaneous suture, peritoneal suture, |
| VICRYL - 3-0, SH1 Plus needle, 4*45cm | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | V780 | subcutaneous suture, peritoneal suture, |
| VICRYL - ligatures Sutupak purple braided, 3-0 | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | V1215E | threats for ligature |
| 3M™ Standard Surgical Mask 1810F | 3M Deutschland GmbH, Neuss, Germany | 3M-ID 7000039767 | surgical mask |
| Surgical instruments | |||
| Anatomical forceps Standard | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | PZ0260 | anatomical forceps |
| Atraumatic tweezers steel, De Bakey Tip 1,5mm 8" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | GF0840 | anatmical atraumatic forceps |
| Bipolar forceps 16 cm straight, Branch 0,30 mm pointed, universal fit | Bühler Instrumente Medizintechnik GmbH,Tuttlingen, Germany | 08/0016-A | biopolar forceps |
| Bulldog clamp atraumatic,curved, De bakey 78 mm, 3" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | GF0900 | bulldog clamps |
| DE BAKEY-SATINSKY vascular clamp 215mm | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | GF1661 | vascular clamp |
| Dissecting scissors Mayo,250 mm, 10" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | SC2232 | Scissors for dissection |
| Dissecting scissors Metzenbaum-Fino, 260 mm, 101/4" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | SC2290 | Scissors for dissection |
| Draeger CATO Anesthetic machine with PM8050 Monitor | Dräger, Drägerwerk AG & Co. KGaA, Lübeck, Germany | 106782 | Ventilation System |
| Fine Tweezers, ADSON 180 mm | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | ADSONPZ0571 | fine forceps |
| Gosset abdomenal wall spreader | CHIRU-INSTRUMENTE, Kaierstuhl,Germany | 09-621512 | abdominal retractor |
| HALSTEAD MOSQUITO,curved, surgical 125mm | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | KL2291 | mosquite clamps |
| HF surgical device ICC 300, Electrocautery | Erbe Elektromedizin Gmbh; Tübingen, Germany | 20132-043 | cautery, biopolar |
| MICRO HALSTED-MOSQUITO 100mm, curved | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | KL2187 | mosquite clamps |
| Micro steel needle holder straight 0,5mm, with spring lock | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | MN1324D | microsurgical needle holder |
| Microsurgical/watermaker tweezers LINZ 150mm 6" Ergo round handle | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | MN0087 | fine microsurgical forceps |
| needle holder Mayo-hegar,190 mm, 71/2" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | NH1255 | needle holder |
| Overhold Slimline Fig. 0 8 1/2" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | KL4400 | overholds |
| Sterile Gauze 10X10 | Paul HaRTMANN AG,Heidenheim, Germany | 401725 | sterile gauze |
| Suction tip OP-Flex Handpiece Yankauer | Pfm Medical AG, Köln, Germany | 33032182 | suction |
| surgical forceps Standard 5 3/4" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | PZ1260 | surgical forceps |
| surgical scissors standard pointed-blunt (thread/cloth scissors)175 mm, 7" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | SC1522 | surgical Scissors |
| Titanit vascular scissors POTTS-SMITH,185 mm, 71/4"60° | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | SC8562 | Pott scissors |
| Tunneling instrument | Marina Medical Instruments Inc,Davies,US | MM-TUN06025 | subcutaneous tunneling |
| Vessel loops | Medline International Germany GmbH,Kleve, Germany | VLMINB | hold and adjust the vessel |
| Wound spreaders Weitlander, Stump,110 mm, 41/4" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | WH5210 | wound care |
| Further material | |||
| Heating pad | Eickemeyer - Medizintechnik für Tierärzte KG, Tuttlingen, Germany | 648050 MHP-E1220 | maintain body temperature during surgery |
| Laryngoscope, customized | Wittex GmbH, Simbach, Germany | 333222230 | expose the vocal cord |
| Rectal temperature probe | Asmuth Medizintechnik, Minden, Germany | ASD-RA4 | measure body temperature |
| Spray wound film | Mepro-Dr. Jaeger und Bergmann GmbH, Vechta, Germany | 2830 | keep sterile condition |
| Sterile organ bag | Raguse Gesellschaft für medizinische Produkte, Ascheberg, Germany | 800059 | organ preservation |
| swine jacket small, adult Landrasse swine 30-50kg, customized for Emka Telemetry and urinary catheterization | Lomir Biomedical Inc., United Kingdom | SS J1LAPMP | swine jackets to pretect implanted catheters and store urine bag |
| Ultrasound device, Sonosite Edge-II | FUJIFILM SonoSite GmbH, Frankfurt, Germany | V21822 | ultrasound and color Doppler |
| Urine bag 2000ml Volume | ASID BONZ GmbH, Herrenberg, Germany | 2062578 | disposable urine bag connected to the uretero-cutaneous fistula catheter |
Références
- Watts, G. Joseph Murray: innovative surgeon and pioneer of transplantation. Lancet. 377 (9770), 987(2011).
- Merion, R. M., et al. Deceased-donor characteristics and the survival benefit of kidney transplantation. Journal of the American Medical Association. 294 (21), 2726-2733 (2005).
- Jochmans, I., O'Callaghan, J. M., Pirenne, J., Ploeg, R. J. Hypothermic machine perfusion of kidneys retrieved from standard and high-risk donors. Transplant International. 28 (6), 665-676 (2015).
- Czigany, Z., et al. Machine perfusion for liver transplantation in the era of marginal organs-New kids on the block. Liver International. 39 (2), 228-249 (2018).
- Fabrizii, V., et al. Patient and graft survival in older kidney transplant recipients: does age matter. Journal of the American Soceity of Nephrology. 15 (4), 1052-1060 (2004).
- Jochmans, I., Nicholson, M. L., Hosgood, S. A. Kidney perfusion: some like it hot others prefer to keep it cool. Current Opinion in Organ Transplantation. 22 (3), 260-266 (2017).
- DSO. DSO Jahresbericht. , Available from: https://www.dso.de/SiteCollectionDocuments/DSO_Jahresbericht_2018.pdf (2018).
- Meister, F. A., et al. Hypothermic Oxygenated Machine Perfusion of Extended Criteria Kidney Allografts from Brain Dead Donors: Protocol for a Prospective Pilot Study. JMIR Research Protocols. 8 (10), 14622(2019).
- Meister, F. A., et al. Hypothermic oxygenated machine perfusion-Preliminary experience with end-ischemic reconditioning of marginal kidney allografts. Clinical Transplantation. 33 (10), 13673(2019).
- Siedlecki, A., Irish, W., Brennan, D. C. Delayed graft function in the kidney transplant. American Journal of Transplantation. 11 (11), 2279-2296 (2011).
- Plenter, R., Jain, S., Ruller, C. M., Nydam, T. L., Jani, A. H. Murine Kidney Transplant Technique. Journal of Visualized Experiments. (105), e52848(2015).
- Fabry, G., et al. Cold Preflush of Porcine Kidney Grafts Prior to Normothermic Machine Perfusion Aggravates Ischemia Reperfusion Injury. Scientific Reports. 9 (1), 13897(2019).
- Kalenski, J., et al. Improved preservation of warm ischemia-damaged porcine kidneys after cold storage in Ecosol, a novel preservation solution. Annals of Transplantation. 20, 233-242 (2015).
- Kalenski, J., et al. Comparison of Aerobic Preservation by Venous Systemic Oxygen Persufflation or Oxygenated Machine Perfusion of Warm-Ischemia-Damaged Porcine Kidneys. European Surgical Research. 57 (1-2), 10-21 (2016).
- Kaths, J. M., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. Journal of Visualized Experiments. (101), e52909(2015).
- Schreinemachers, M. C., et al. Improved preservation and microcirculation with POLYSOL after transplantation in a porcine kidney autotransplantation model. Nephrology Dialysis Transplantation. 24 (3), 816-824 (2009).
- Kaths, J. M., et al. Heterotopic Renal Autotransplantation in a Porcine Model: A Step-by-Step Protocol. Journal of Visualized Experiments. (108), e53765(2016).
- De Deken, J., et al. Postconditioning effects of argon or xenon on early graft function in a porcine model of kidney autotransplantation. British Journal of Surgery. 105 (8), 1051-1060 (2018).
- Faure, A., et al. An experimental porcine model of heterotopic renal autotransplantation. Transplantation Proceedings. 45 (2), 672-676 (2013).
- Golriz, M., et al. Do we need animal hands-on courses for transplantation surgery. Clinical Transplantation. 27, Suppl 25 6-15 (2013).
- Gallinat, A., et al. Transplantation of Cold Stored Porcine Kidneys After Controlled Oxygenated Rewarming. Artificial Organs. 42 (6), 647-654 (2018).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. , Methuen. (1959).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412(2010).
- Hagemeister, K., et al. Severity assessment in pigs after partial liver resection: evaluation of a score sheet. Laboratory Animals. 54 (3), (2019).
- Doorschodt, B. M., et al. Hypothermic machine perfusion of kidney grafts: which pressure is preferred. Annals of Biomedical Engineering. 39 (3), 1051-1059 (2011).
- Czigany, Z., et al. Improving Research Practice in Rat Orthotopic and Partial Orthotopic Liver Transplantation: A Review, Recommendation, and Publication Guide. European Surgical Research. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. Journal of Visualized Experiments. (73), e4376(2013).
- Doorschodt, B. M., et al. Evaluation of a novel system for hypothermic oxygenated pulsatile perfusion preservation. The Internation Journal of Artificial Organs. 32 (10), 728-738 (2009).
- Kaths, J. M., et al. Continuous Normothermic Ex Vivo Kidney Perfusion Is Superior to Brief Normothermic Perfusion Following Static Cold Storage in Donation After Circulatory Death Pig Kidney Transplantation. American Journal of Transplantation. 17 (4), 957-969 (2017).
- Tammaro, V., et al. Prevention of fluid effusion in kidney transplantation with the use of hemostatic biomaterials. Transplantation Proceedings. 46 (7), 2203-2206 (2014).
- Golriz, M., et al. Pig kidney transplantation: an up-to-date guideline. European Surgical Research. 49 (3-4), 121-129 (2012).
- Higgins, R., et al. Hyponatraemia and hyperkalaemia are more frequent in renal transplant recipients treated with tacrolimus than with cyclosporin. Further evidence for differences between cyclosporin and tacrolimus nephrotoxicities. Nephrology Dialysis and Transplantation. 19 (2), 444-450 (2004).
- Markert, M., et al. A new telemetry-based system for assessing cardiovascular function in group-housed large animals. Taking the 3Rs to a new level with the evaluation of remote measurement via cloud data transmission. Journal of Pharmacological and Toxicological Methods. 93, 90-97 (2018).
- Längin, M., et al. Perioperative Telemetric Monitoring in Pig-to-Baboon Heterotopic Thoracic Cardiac Xenotransplantation. Annals of Transplantation. 23, 491-499 (2018).
- Willens, S., Cox, D. M., Braue, E. H., Myers, T. M., Wegner, M. D. Novel technique for retroperitoneal implantation of telemetry transmitters for physiologic monitoring in Göttingen minipigs (Sus scrofa domesticus). Comparative Medicine. 64 (6), 464-470 (2014).
- van Dijk, R. M., et al. Design of composite measure schemes for comparative severity assessment in animal-based neuroscience research: A case study focussed on rat epilepsy models. PLoS One. 15 (5), 0230141(2020).
- Zieglowski, L., et al. Severity assessment using three common behavioral or locomotor tests after laparotomy in rats: a pilot study. Laboratory Animals. , (2020).
- Bleich, A., Bankstahl, M., Jirkof, P., Prins, J. B., Tolba, R. H. Severity Assessment in animal based research. Laboratory Animals. 54 (1), 16(2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon