Method Article
Détermination de l’efficacité de la désinfection virale du blanchiment à l’eau chaude
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
En réponse à la pandémie de coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-CoV-2), un protocole de laboratoire a été élaboré pour tester l’efficacité de la désinfection virale du lavage à l’eau chaude des couvre-visages en tissu, des gommages en coton et des pantalons en jean. Le virus Phi6 (bactériophage) a été utilisé comme organisme pour tester l’efficacité de la désinfection.
Résumé
Ce protocole fournit un exemple de processus de laboratoire pour mener des études de blanchiment qui génèrent des données sur la désinfection virale. Bien que le protocole ait été élaboré pour la recherche pendant la pandémie de maladie à coronavirus 2019 (COVID-19), il est destiné à être un cadre adaptable à d’autres études de désinfection virale; Il montre les étapes de préparation du virus test, d’inoculation du matériel d’essai, d’évaluation des changements visuels et d’intégrité des articles lavés en raison du processus de lavage et de quantification de la réduction de la charge virale. De plus, le protocole décrit les échantillons de contrôle de la qualité nécessaires pour s’assurer que les expériences ne sont pas biaisées par la contamination et les mesures/observations qui doivent être enregistrées pour suivre l’intégrité matérielle des articles d’équipement de protection individuelle (EPI) après plusieurs cycles de lavage. Les résultats représentatifs présentés avec le protocole utilisent le bactériophage Phi6 inoculé sur des matériaux de gommage de coton, de denim et de couvre-visage en coton et indiquent que le processus de lavage et de séchage à l’eau chaude a permis de réduire de plus de 3 log (99,9 %) la charge virale pour tous les échantillons (une réduction de 3 log est la mesure de performance du désinfectant dans la ligne directrice 810.2200 sur les tests de performance des produits de l’Environmental Protection Agency des États-Unis). La réduction de la charge virale était uniforme à différents endroits sur les articles d’EPI. Les résultats de ce protocole de test d’efficacité de désinfection virale devraient aider la communauté scientifique à explorer l’efficacité du blanchiment à domicile pour d’autres types de virus de test et de procédures de lavage.
Introduction
La pandémie de maladie à coronavirus 2019 (COVID-19) a provoqué une perturbation sans précédent de la chaîne d’approvisionnement mondiale et a entraîné une pénurie critique de nombreux articles, y compris les équipements de protection individuelle (EPI) essentiels1,2,3. Ceux qui occupaient des professions à haut risque ont dû s’adapter en utilisant les stratégies de capacité de crise recommandées et le public a adopté l’utilisation d’articles non spécialisés tels que les couvre-visages en tissu principalement pour le contrôle à la source, mais aussi pour fournir une certaine protection respiratoire aux porteurs. Aux États-Unis, la protection respiratoire spécialisée (c.-à-d. les masques respiratoires filtrants (FFR) tels que les N95) a été réservée à certaines de ces professions à risque élevé (p. ex. soins de santé) pendant les pénuriesd’approvisionnement 4. Lorsque l’on en savait peu sur la transmission du coronavirus 2 du syndrome respiratoire aigu sévère (SRAS-Cov-2), divers autres types de vêtements ont également été considérés comme une barrière de protection au début de la pandémie5. Avec la diversité des tissus utilisés pour la protection des porteurs, des questions ont été soulevées sur l’utilisation, la réutilisation et la désinfection/décontamination de ces articles. Bien qu’aux États-Unis, il soit généralement admis que le lavage systématique des couvre-visages et d’autres vêtements à domicile rendait les virus non infectieux sur ces surfaces, il existait peu de données pour valider cette affirmation, et il n’y avait pas de protocoles de laboratoire publiés pour les tests. Le but du protocole de recherche présenté ici est de fournir un exemple de processus de laboratoire pour mener des études de blanchiment qui génèrent des données sur la désinfection virale. Bien que le protocole ait été élaboré pour la recherche pendant la pandémie de COVID-19, il est destiné à être un cadre adaptable à d’autres études de désinfection virale.
Le rôle des vêtements dans la transmission des maladies est un concept difficile à quantifier. Le Forum scientifique international sur l’hygiène domestique a entrepris cette tâche difficile en procédant à un examen du rôle des vêtements dans la propagation des maladies infectieuses et à une évaluation des risques des pratiques d’hygiène domestique6. Ce travail comprenait l’examen de plusieurs études scientifiques qui ont examiné la survie de différentes souches virales sur différents types de tissus tels que la laine et le coton 7,8,9,10,11. Chaque étude s’est concentrée sur un type différent de virus, y compris la vaccine, le poliovirus, le virus respiratoire syncytial, l’herpèsvirus et le virus de la grippe. Les temps de survie des différents virus sur les tissus variaient de 30 min à 5 mois selon la combinaison virus-matériel. Plusieurs des études ont également démontré le transfert de la contamination virale du matériau aux mains. Dans le cadre de la publication, le blanchiment efficace a été examiné comme une technique de gestion importante pour réduire la transmission, mais a reconnu que l’ampleur de l’impact du blanchiment sur la réduction de la charge de morbidité dépendait du contaminant viral spécifique et était difficile à quantifier 7,8,9,10,11.
Le processus de lavage détruit les micro-organismes à l’aide de procédés de traitement chimique, physique et thermique. Par exemple, les savons et les détergents peuvent séparer les sols et conférer une certaine action antimicrobienne à médiation chimique. Physiquement, la dilution et l’agitation peuvent aider à réduire la charge virale. Une étude examinant la persistance du coronavirus humain HCoV-OC43 sur des échantillons de coton utilisant des cycles de lavage industriels et domestiques avec et sans température et détergent n’a révélé aucun virus détectable lors du lavage dans de l’eau non chauffée sans détergent, mais qu’en présence d’une charge de sol (salive artificielle), les cycles de lavage domestiques nécessitaient un détergent pour que les échantillons aient des charges virales non détectées12. L’eau chaude elle-même peut également fournir un moyen efficace de détruire certains micro-organismes13,14.
Dans une publication récente résumant l’état des pratiques actuelles de blanchisserie, de nombreux facteurs tels que la composition des tissus, les conditions de stockage, la charge de saleté, la température et le temps de lavage et la température de séchage ont été identifiés comme variant dans les pratiques mondiales de lavage15. Bien que le lavage soit une méthode de nettoyage courante pour un grand pourcentage de la population, cette grande variation dans les pratiques existantes rend difficile et rare la publication de directives détaillées sur la façon de le faire de manière sûre et efficace, lorsqu’un article peut être contaminé par un virus. Pendant la pandémie de COVID-19, les Centers for Disease Control and Prevention (CDC) des États-Unis ont publié des directives sur la façon de blanchir des articles pour les propriétaires16,17. Une grande partie de ces directives sur le blanchiment étaient fondées sur plusieurs études plus anciennes sur la désinfection bactérienne18,19 et appuyées par plusieurs études de paillasse qui ont révélé que les virus enveloppés étaient inactivés dans l’eau avec des détergents20,21. Les conseils peuvent être résumés comme suit 1) suivez les instructions du fabricant pour le détergent, 2) utilisez le réglage d’eau approprié le plus chaud et 3) séchez complètement les articles. La justification de ces recommandations était que le lavage au cycle le plus chaud possible avec un détergent combiné à un séchage complet (avec de la chaleur si possible) tuera le virus SARS-CoV-2.
Le grand nombre de variations possibles dans le processus de blanchiment nécessite un protocole uniforme, tel que présenté ici, pour pouvoir isoler les variables et tester l’efficacité de la désinfection virale de processus spécifiques. L’objectif de ce protocole, associé à une vidéo d’instruction, est de démontrer un processus de lavage à l’eau chaude en laboratoire pour la reproduction dans d’autres études de recherche. De plus, les résultats de ces tests d’efficacité de désinfection virale devraient renforcer la confiance des consommateurs dans l’efficacité du blanchiment à domicile pendant les pandémies virales.
Protocole
Phi6 a été reçu d’un laboratoire collaborateur sous forme d’aliquote congelée de ~1 mL et a été conservé à -80 °C jusqu’à utilisation. Il a d’abord été utilisé pour propager davantage de stocks de virus qui ont ensuite été stockés à -80 ° C jusqu’à leur utilisation. Phi6 a été choisi comme virus de démonstration parce qu’il est couramment utilisé comme modèle de virus enveloppé, peut être propagé à des titres élevés et nécessite un laboratoire de faible niveau de biosécurité pour effectuer les tests22,23,24.
1. Préparez la solution mère de virus
- Propager le bactériophage Phi6 dans l’hôte bactérien Pseudomonas syringae en utilisant une préparation modifiée de gélose au soja tryptique et une méthode de recouvrement de gélose molle comme décrit ci-dessous.
- Préparer la gélose tryptique modifiée en pesant et en mélangeant les ingrédients du tableau 1 dans de l’eau désionisée.
- Préparer une culture de P. syringae pendant la nuit en ajoutant une partie aliquote de 1 mL de P. syringae avec une densité optique (DO 600) entre 0,9 et 1,5, à 100 mL de bouillon de soja tryptique modifié (tableau 1) et en incubant dans un incubateur à agitation à ~260 rpm à température ambiante (20-26 °C).
- Préparer des tubes de gélose souple en plaçant la gélose à soja tryptique modifiée (~ 6 mL) dans des tubes à essai et en la recouvrant d’un bouchon autoclavable. Conserver à 4 °C jusqu’à utilisation. Autoclaver les tubes de gélose souple à 121 °C pendant 15 min pour faire fondre l’agar. Maintenir à 48 °C jusqu’au placage. L’équilibration à 48 °C est importante, sinon le virus peut être inactivé dans le test.
- Ajouter 1 mL de concentré aliquote virale concentré non dilué sur gélose molle et 100 μL d’une culture en phase logarithmique (OD600 entre 0,9 et 1,5) de P. syringae. Verser la gélose molle sur la surface d’une gélose tryptique au soja modifiée solidifiée de 100 mm de diamètre. Pour éviter les bulles et/ou les déversements, agiter doucement les plaques pour répartir uniformément la gélose molle sur la surface de la gélose solide et incuber pendant la nuit à température ambiante.
- Grattez délicatement 25 le contenu des trois plaques à l’aide d’un épandeur de cellules stériles dans un tube conique stérile de 50 mL contenant15 mL de tampon SM. Tubes vortex à réglage maximal pendant 1-2 min pour briser la gélose puis centrifuger à 7 000 x g pendant 15 min.
- Retirer le surnageant et filtrer à travers un filtre à seringue de 0,2 μm. Conserver 1 mL d’aliquotes dans des cryoflacons à -80 °C jusqu’à utilisation.
2. Effectuer une évaluation visuelle pré-test de l’EPI
- Placez chaque EPI sur une surface propre et lisse (p. ex., une paillasse de laboratoire recouverte d’une doublure en papier jetable). Évaluez chaque EPI en trois exemplaires.
- Assurer un éclairage adéquat pendant l’examen de l’EPI. Mesurez et notez la longueur et la largeur des articles non lavés à divers endroits (Figure 1).
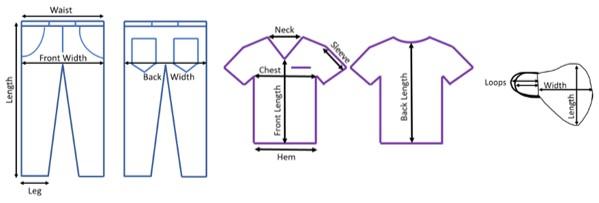
Graphique 1. Lieux de mesure de l’évaluation pré-test de l’EPI. Lieux de denim, de gommage et de couvre-visage où la longueur a été enregistrée pour suivre les changements importants du processus de lavage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Préparez des coupons
- Fabriquez des coupons d’essai de 2 cm x 4 cm en coupant l’EPI, préparez deux coupons par couvre-visage (trois couvre-visages ont été testés), cinq coupons par pantalon en jean (trois pantalons en jean ont été testés) et trois coupons par chemise de gommage (trois coupons ont été testés).
- Préparez un ensemble de coupons vierges de procédure de 2 cm x 4 cm (un ensemble pour un EPI pleine grandeur) pour chaque type de matériau qui ne sera pas inoculé mais qui sera lavé. Préparez deux coupons pour chaque jour d’expériences de couvre-visage, cinq coupons pour chaque jour d’expériences de denim et trois coupons pour chaque jour d’expériences de gommage.
- Préparez un ensemble de coupons de contrôle positif de 2 cm x 4 cm qui seront inoculés, mais pas lavés. Préparez deux coupons pour chaque jour d’expériences de couvre-visage (trois couvre-visages ont été testés), cinq coupons pour chaque jour d’expériences de denim (trois pantalons en denim ont été testés), trois coupons pour chaque jour d’expériences de gommage (trois gommages ont été testés) et trois coupons en acier inoxydable.
REMARQUE : Différents nombres de répétitions ont été sélectionnés en fonction de la taille de l’élément. Par exemple, il est physiquement difficile d’adhérer cinq coupons sur le couvre-visage, et deux coupons représenteraient une zone limitée du pantalon en jean. Les emplacements ont été choisis pour maximiser la couverture et dans des zones qui pourraient être pliées pendant le lavage et être plus difficiles à nettoyer.
4. Effectuer l’inoculation
- Préparer une solution d’extrait de bœuf à 10 % en dissolvant 1 g d’extrait de bœuf dans un volume total de 10 mL de 1x solution saline tamponnée au phosphate. Filtrer stériliser tout le volume à l’aide d’un filtre à seringue de 0,2 μm.
- Décongeler la solution mère de virus préparée au point 1 à température ambiante. Le jour de l’utilisation, ajouter 100 μL du bouillon de Phi6 décongelé à 900 μL de la solution d’extrait de bœuf à 10%.
- Inoculer les coupons d’essai et les coupons de contrôle positif avec ~107 UFP/échantillon en pipetant une gouttelette de solution de 10 μL sur l’EPI et en étalant la gouttelette à l’aide de l’extrémité de la pipette. Selon le matériau de l’EPI, les gouttelettes se sépareront et se réagrégeront différemment.
- Laissez sécher les coupons inoculés dans une enceinte de biosécurité. Détermination du temps de séchage par observation de vos matériaux spécifiques. Pour les résultats présentés ici, les temps suivants ont été utilisés : gommages = 30 min de temps de séchage ; couvre-visage = 60 minutes de temps de séchage; denim = 30 min de temps de séchage; acier inoxydable = 120 min de temps de séchage.
- Attachez des coupons inoculés aux EPI de taille normale conformément à la figure 2 à l’aide d’épingles de sûreté et de techniques aseptiques.
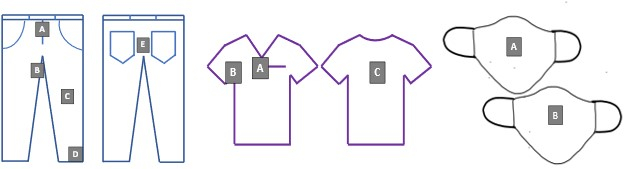
Graphique 2. Testez les emplacements des coupons sur le denim, les gommages et les couvre-visages. Les lettres A-D correspondent aux identificateurs uniques des coupons pour toutes les expériences de blanchiment. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Effectuer le blanchiment
- Préparez le détergent de lavage comme suit.
- Stérilisez l’eau du robinet qui sera utilisée dans la machine à laver et recueillez 10 ml d’eau autoclavée pour un contrôle de stérilité. Pour ce protocole, autoclaver 7 L d’eau du robinet sur un cycle liquide de 60 min.
- Préparer la solution de lavage conformément au mode d’emploi du fabricant. Pour ce protocole, dissoudre 1,54 mL de détergent dans 3,5 L d’eau du robinet stérile. Réchauffer la solution de lavage à 50 °C à l’aide d’une plaque chauffante et d’une barre d’agitation. Mesurer et enregistrer le pH et la température de la solution de lavage. Prélever 10 mL de solution pour le contrôle de la stérilité.
- Verser la solution de lavage dans une laveuse stérilisée (3,25 L). Préstériliser les laveuses en utilisant un cycle de 250 ppm à 4 heures de peroxyde d’hydrogène vaporeux entre les essais.
- Placez les articles d’EPI dans une laveuse stérilisée. Ajoutez un pantalon en jean et une chemise à gommage par laveuse. Ajouter un couvre-visage inoculé et quatre masques de remplissage non contaminés par laveuse; Les masques de remplissage n’avaient pas de coupons attachés.
- Lavez l’EPI pendant 18 min (deux cycles de lavage de 9 min avec agitation normale). Vidangez la laveuse et rincez trois fois avec de l’eau du robinet à température ambiante (5 L à chaque fois) pour enlever la mousse. Ajouter de l’eau du robinet stérilisée à température ambiante dans la laveuse (3,25 L) et effectuer un cycle de rinçage de 9 minutes.
- Déplacez le ou les articles d’EPI dans le côté de l’essorage de la laveuse et faites tourner pendant 5 minutes. Déplacer le(s) EPI) dans la sécheuse et sécher pendant 80 minutes à feu vif (93 °C).
- Déplacez l’EPI de la sécheuse à l’espace de travail stérile et retirez de manière aseptique les coupons de chaque article et placez-les dans des tubes coniques. Préremplir les tubes avec 10 ml de tampon d’extraction de bouillon Dey-Engley à 10 % et les recouvrir de papier d’aluminium.
6. Extraire et dénombrer les charges virales sur les coupons
- Extraire les coupons dans 10 mL de bouillon neutralisant Dey-Engley à 10% en vorant pendant 2 min au réglage maximum de votre équipement.
- Extraits sur plaque à l’aide d’une méthode conventionnelle de recouvrement de gélose à capote26.
- Préparer des tubes de gélose tryptique à soja tryptique modifiée et une culture de P. syringae comme décrit à la section 1. Le jour de l’essai, autoclaver les tubes de gélose souple à 121 °C pendant 15 min pour faire fondre l’agar. Maintenir la gélose molle à 48 °C jusqu’au placage. L’équilibration à 48 °C est importante, sinon le virus peut être inactivé thermiquement dans le test.
- Préparer une série de dilution décuplée dans 1x solution saline tamponnée au phosphate pour chaque échantillon utilisé dans l’étude de blanchiment. Utilisez des aliquotes diluées en série (100 μL) et non diluées (1 mL et 100 μL) pour le placage.
- Ajouter les aliquotes de la prise d’essai dans le tube de gélose molle contenant 6 mL de gélose molle et 100 μL de culture en phase logarithmique de P. syringae (DO600 entre 0,9 et 1,5). Verser la gélose molle sur la surface d’une plaque de gélose de soja tryptique modifiée solidifiée. Répartir uniformément la gélose molle sur la surface solide de la gélose en faisant tourbillonner la plaque.
- Incuber les plaques pendant la nuit à température ambiante et énumérer manuellement le lendemain en comptant les unités formant des plaques sur chaque plaque.
7. Effectuer une évaluation visuelle post-test de l’EPI
- Documenter les éléments suivants dans les divers EPI utilisés pour les tests : signes de décoloration, de décoloration et/ou de dommages (p. ex. déchirure, étirement); Odeurs; petits trous, coupures ou déchirures (utilisez une petite lampe de poche pour rechercher des dommages); séparation des couches, des fils manquants, des zones où la liaison est endommagée; dommages aux coutures ou aux fermetures à glissière; Mesurer et enregistrer l’étirement de l’élastique.
Résultats
Plusieurs types de données et de résultats de contrôle de la qualité sont générés après l’achèvement de ce protocole. Le comptage des plaques de l’unité formant la plaque (UFP) ainsi que le volume d’échantillon extrait permettent de calculer le nombre de PFU par coupon d’essai. Le tableau 2 est un exemple de feuille d’enregistrement des données pour les résultats de dilution/placage en série. À l’aide du facteur de dilution, du volume de l’échantillon et de la numération sur plaque du tableau 1, le tableau 3 présente des résultats représentatifs de récupération virale pour un test de couvre-visage. Notez que ces données comprennent les coupons d’essai et les échantillons de contrôle de la qualité pour l’inoculum, les coupons et l’eau de lavage (avec et sans détergent). Les blancs de procédure et les échantillons de contrôle de la qualité de la stérilité sont importants pour confirmer que les solutions aqueuses et les matériaux EPI n’ont pas été contaminés par Phi6. L’indication d’une contamination entraînerait des calculs erronés de l’efficacité de la désinfection et nécessiterait la répétition du test. Les échantillons témoins positifs visent à vérifier que la solution mère du virus ne s’est pas dégradée naturellement ou environnementalement pendant les expériences, gonflant ainsi l’effet du processus de blanchiment sur la réduction de la charge virale. Ces échantillons doivent rester à moins de 1 log PFU des témoins d’inoculum pour accepter les résultats du coupon d’essai. Une réduction importante de l’UFP des échantillons témoins positifs indique également que toutes les étapes de l’inoculation du coupon doivent être soigneusement examinées pour s’assurer que l’analyste exécute le protocole avec des techniques de pipetage et d’épandage appropriées.
Ce protocole fournit également de l’information pour évaluer les changements apportés aux propriétés matérielles des vêtements en raison de l’information sur le blanchiment et le contrôle de la qualité liés au protocole (tableau 4 et figure 3). Ces données sont utiles pour plusieurs raisons. L’enregistrement des tendances dans les mesures des articles EPI permet d’identifier un article présentant un défaut de fabrication. Cette identification peut aider à expliquer les données microbiennes aberrantes et à contextualiser la variation du comportement du produit. La prise de notes sur les odeurs ou les dommages peut également indiquer si la laveuse ou la sécheuse fonctionnait de manière sous-optimale pendant une expérience et si les essais doivent être répétés ou l’équipement entretenu. De plus, si le plan de test prévoit plusieurs cycles de lavage du même EPI, les données peuvent aider à déterminer combien de temps les EPI conservent leur intégrité pour être utilisés lors du lavage. La tenue d’un registre du pH de la solution de détergent fournit une alerte aux changements dans la source d’eau ou le produit détergent. La tenue d’un journal chronologique des étapes de lavage garantit que la minuterie de la laveuse et de la sécheuse ne provoque pas de variations dans le protocole expérimental.
En fin de compte, ces données sont utilisées pour rapporter l’efficacité de la désinfection de la procédure de blanchiment à l’eau chaude contre un substitut pour les agents pathogènes viraux. L’efficacité de la désinfection du lavage (Eqn. 1) est calculée en soustrayant le log 10 récupération moyen du virus du coupon d’analyse EPI du log10 récupération moyen du virus à partir des résultats de contrôle positif EPI (figure 4). Pour les résultats de coupons d’essai qui ne sont pas détectés, lelogarithme 10 de la limite de détection est utilisé dans le calcul de l’efficacité de la désinfection. Il est courant de déclarer l’efficacité de la désinfection sous forme de valeurs logarithmiques à des fins de comparaison avec d’autres techniques et normes de désinfection virale.
Efficacité de la désinfection = log moyen 10 (témoins positifs) - logmoyen 10 (coupons d’essai) (éqn. 1)
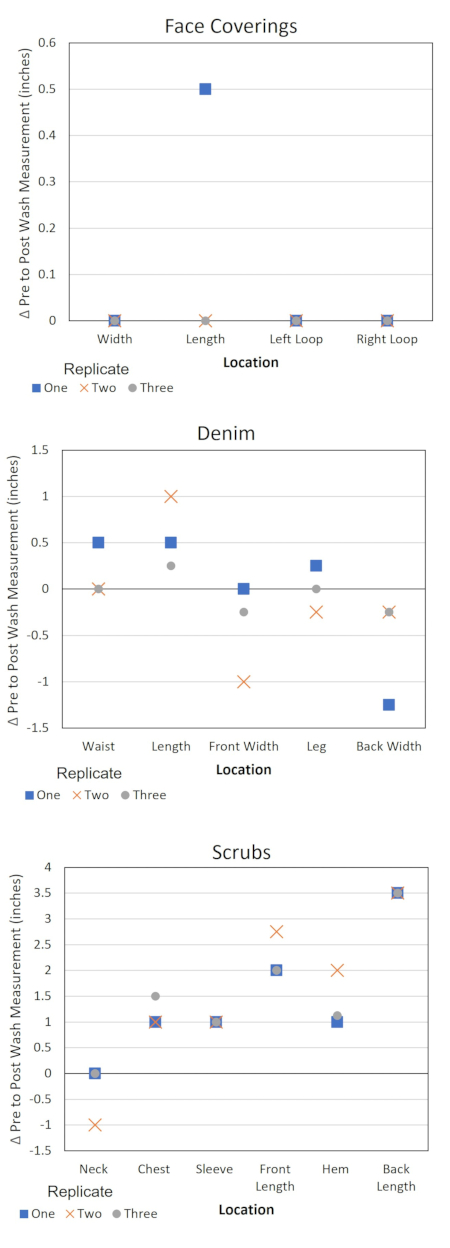
Graphique 3. Modification des dimensions de l’EPI selon l’emplacement. Δ = Mesure pré-test - mesure post-essai. Une valeur négative de Δ correspond à l’étirement de l’article à l’emplacement spécifié et une valeur positive correspond au rétrécissement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
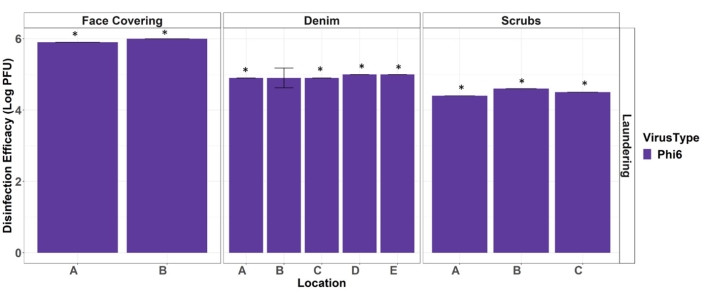
Graphique 4. Efficacité du lavage à l’eau chaude pour désinfecter les couvre-visages, le denim et les matériaux de récurage EPI de Phi6. Les étoiles indiquent une désinfection complète (non détectée sur les coupons de test). Les barres d’erreur indiquent l’écart-type (n = 3). Les lettres de localisation correspondent à l’emplacement représenté à la figure 2. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1. Recettes de solutions. Ingrédients et quantités nécessaires pour préparer des solutions de gélose au soja tryptique, de bouillon de soja tryptique et d’extrait de bœuf. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2. Exemple de partie d’une feuille de résultats de dilution/placage en série. Modèle de déclaration des données microbiennes brutes. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 3. Résultats microbiens du couvre-visage. Exemple de fiche récapitulative pour les données traitées de l’unité de formation de plaques (UFP). Veuillez cliquer ici pour télécharger ce tableau.
Tableau 4. Frotter le contrôle de la qualité et le journal d’évaluation des matériaux. Modèle pour signaler l’étalonnage de la sonde de pH, le pH de la solution détergente, les mesures avant et après le lavage et les temps de cycle de lavage. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Ce protocole a été élaboré pour effectuer des tests de laboratoire systématiques afin d’évaluer l’efficacité du blanchiment de la désinfection virale à partir d’EPI et de vêtements de taille normale. Les procédures décrivent les étapes critiques pour la préparation du virus, l’inoculation du matériel d’essai, l’évaluation des modifications apportées aux articles en raison du processus de lavage et la quantification de la réduction de la charge virale résultant du processus de lavage (lavage et séchage en machine). De plus, le protocole décrit les échantillons de contrôle de la qualité nécessaires pour s’assurer que les expériences ne sont pas biaisées par la contamination et les mesures/observations qui doivent être enregistrées pour suivre l’intégrité matérielle des articles d’EPI après plusieurs cycles de lavage. Les résultats obtenus à l’aide de Phi6 indiquent que le procédé de lavage à l’eau chaude utilisé dans ce protocole a permis une réduction de plus de 3 log de la charge virale pour tous les échantillons (couvre-visage, gommages et pantalons en jean). La réduction de la charge virale était également uniforme à différents endroits sur les articles d’EPI et de vêtements. Pour démontrer une réduction de 3 logs, ce protocole nécessite l’utilisation d’une charge virale élevée et d’un agent stabilisant (extrait de bœuf) qui peut ne pas être représentatif de la charge du sol pour toutes les situations.
Des mini-laveuses et des sécheuses compactes ont été choisies afin d’optimiser le nombre d’expériences répétées pouvant être menées dans un environnement à espace restreint et de garder la stérilisation de l’équipement et le volume d’eau utilisé pendant les expériences gérables pour le personnel de laboratoire. À la suite de l’utilisation de la mini laveuse, les étapes de rinçage étaient manuelles par rapport à la plupart des applications de lavage à domicile entièrement automatisées. Il est également important de se rappeler que le lavage en machine prédomine dans les pays développés, mais le lavage des mains est encore pratiqué partout dans le monde15. De plus, certains peuvent ne pas avoir accès à de l’eau chaude pour se laver, et d’autres sèchent manuellement les vêtements à l’air plutôt que de les sécher à la machine. Ces différences dans les pratiques de lavage n’ont pas été abordées dans le protocole actuel, mais pourraient facilement être étudiées avec des modifications mineures telles que le remplacement des étapes de lavage et de séchage par l’utilisation d’un seau et d’une ligne de fermeture.
La littérature scientifique a peu mis l’accent sur le nettoyage et la désinfection des couvre-visages et des vêtements de ville contaminés par des virus dans la littérature scientifique. Plus fréquemment, les études évaluent la performance de filtration des couvre-visages après un lavage et un séchage répétés, mais n’évaluent pas l’efficacité de la désinfection virale27,28. Par exemple, Clapp et al. ont évalué l’efficacité de filtration ajustée des masques en tissu et des masques de procédure modifiés et ont constaté une grande variation dans les performances, avec des modifications simples offrant un ajustement et une efficacité de filtration accrus29. Une autre étude a examiné l’efficacité de filtration de quatre masques en tissu de matériaux différents30, en se concentrant à nouveau sur le contrôle à la source ou la protection individuelle. Cela peut être dû à un manque de spécialisation pour la partie microbienne et les tests mécaniques dans le même laboratoire. Le protocole présenté ici fournit une évaluation de l’efficacité de la désinfection ainsi que de la dégradation des matériaux.
Un certain nombre de méthodes de décontamination/désinfection pour la protection respiratoire jetable (principalement les N95) ont été récemment publiées dans la littérature scientifique31,32,33. L’accent principal mis sur les FFR (p. ex., N95) est dû à la protection respiratoire essentielle qu’ils fournissent aux travailleurs de la santé et aux autres professions de première ligne. Les principales technologies de décontamination des respirateurs comprenaient le peroxyde d’hydrogène vaporisé (VHP), le rayonnement germicide ultraviolet (UVGI) et la chaleur humide (vapeur) pour l’inactivation du virus. Viscusi et coll. ont évalué cinq méthodes de décontamination pour les FFR et les UVGI; L’oxyde d’éthylène et le VHP se sont avérés être les méthodes de décontamination les plus prometteuses31. Fischer et coll. ont évalué quatre méthodes de décontamination différentes - lumière UV, chaleur sèche, éthanol à 70% et VHP - pour leur capacité à réduire la contamination par le SRAS-CoV-2 et leur effet sur la fonction respiratoire N9532. Il existe de nombreuses études supplémentaires sur les technologies de décontamination efficaces pour les FFR qui ont été résumées et publiées en 202033. Cependant, ces méthodes spécialisées ne sont pas accessibles ou conçues pour être utilisées en toute sécurité par le propriétaire moyen d’une maison ou d’une petite entreprise.
Ce protocole a été développé à l’aide de Phi6, un bactériophage enveloppé similaire au SRAS-CoV-2, doté de protéines de pointe et de taille similaire (80-100 nm)34, pour tous les tests. Puisque Phi6 n’est pas un agent pathogène connu, il peut être manipulé dans un laboratoire microbiologique général de niveau de biosécurité 1 (BSL-1). L’efficacité contre Phi6 peut indiquer l’efficacité d’autres virus enveloppés, cependant, une vérification empirique pour chaque virus d’intérêt est nécessaire35. En utilisant un agent viral similaire et non pathogène, on espère que ce protocole pourra être répété ailleurs et utilisé pour étudier les futures épidémies / pandémies virales. Les recherches futures pourraient inclure l’utilisation de désinfectants (p. ex. eau de Javel) en plus des détergents et un protocole normalisé pour le lavage des mains et le séchage à la ligne.
Déclarations de divulgation
Il n’y a pas de conflits d’intérêts connus à divulguer.
Remerciements
L’Environmental Protection Agency (EPA) des États-Unis, par l’entremise de son Bureau de la recherche et du développement, a dirigé la recherche décrite dans le présent document EP-C-15-008 avec Jacobs Technology Inc. Il a été examiné par l’Office, mais ne reflète pas nécessairement les points de vue de l’Office. Aucune approbation officielle ne doit être déduite. L’EPA n’approuve pas l’achat ou la vente de produits ou services commerciaux. Les auteurs tiennent à remercier les contractants de l’EPA Denise Aslett pour la supervision de la microbiologie RTP de l’EPA, Brian Ford, Rachael Baartmans et Lesley Mendez Sandoval pour leur travail sur ce projet dans le laboratoire de microbiologie RTP de l’EPA, Ramona Sherman pour avoir fourni l’examen de l’assurance qualité de l’EPA, et Worth Calfee et Shannon Serre pour avoir fourni des examens techniques de l’EPA.
matériels
| Name | Company | Catalog Number | Comments |
| Freezer (- 80 °C) | ThermoFisher Scientific | FDE30086FA | |
| Hot Plate | VWR | 97042-714 | |
| Safety Pins (steel) | Singer | 319921 | |
| Shaker | Lab-Line Instruments, Inc. | 3525 | |
| SM buffer | Teknova, Hollister, CA | S0249 | |
| Syringe filter (0.2 μm) | Corning, Corning, NY | PES syringe filters, 431229 | |
| 1X Phosphate Buffered Saline | Teknova, Hollister, CA | P0196, 10X PBS solution | |
| Agar | Becton Dickinson | 214010 | |
| Autoclavable caps | DWK Life Sciences, Millville, NJ | KIM-KAP Caps, 73663-18 | |
| Autoclave | Steris | AMSCO 250LS Steam Sterilizer Model 20VS | |
| Beef Extract | Sigma-Aldrich, Millipore Sigma, St. Louis, MO, USA | P/N B4888-100g | |
| Calcium chloride | Sigma-Aldrich | 793639 | |
| Cell spreaders | Busse Hospital Disposables | 23600894 | |
| Centrifuge | ThermoFisher Scientific | 75004271 | Heraeus MegaFuge 16R Centrifuge |
| Certified Timer | https://nist.time.gov/ | Not Applicable | |
| Conical tubes (50 mL) | Corning Life Sciences | 352098 | Falcon 50-mL high-clarity polypropylene conical centrifuge tubes |
| Cryovials | Thermo Fisher Scientific, Waltham, MA | AY509X33 | |
| Denim | Wrangler | Rustler Regular Fit Straight Leg Jean Four Pocket Jean with Scoop Front Pockets, PN:87619PW | |
| Detergent | Proctor and Gamble | Tide Original Scent Liquid Laundry Detergent Product Number (PN): 003700023068 | |
| Dextrose | Fisher | BP350 | |
| Dey-Engley neutralizing broth | Becton Dickinson | DF0819172 | |
| Dryer | Magic Chef | MCSDRY15W | |
| Face Coverings | Felina | Reusable Organic Cotton Face Masks, PN: 990121P4 | |
| Incubator (top agar) | Symphony | 414004-596 | |
| Laboratory Notebook | Scientific Notebook Company | 2001 | |
| Magnesium chloride | Sigma-Aldrich | M9272 | |
| Media sterilization and dispensing system | Integra | Media Clave/Media Jet | |
| Petri Dishes (100 mm) | VWR | 25384-342 | |
| pH Meter | Orion/Oakton | STARA1110/EW-35634-35 | |
| pH Probe | Orion | 8157BNUMD | |
| pH Standards | Oakton | 00654-(00/04/08) | |
| Phi 6 and Pseudomonas syringae | Battelle Memorial Institute, Columbus, OH | Not Applicable | |
| Pipette & Tips | Rainin | (Pipettes) 17014391, 17002921; (Pipette Tips) 30389239, 17014382 | |
| Refrigerator | True Manufacturing Co., Inc. | GDM-33 | |
| Scrubs | Gogreen cool | PN: WS19100PT | |
| Sodium chloride | Sigma-Aldrich | 57656 | |
| Stir Bar | Fisherbrand | 16-800-512 | |
| Tape Measure | Lufkin | PS3425 | |
| Test Tubes for Soft agar (14 mL) | Corning, Corning, NY | 352059 | |
| Thermometer | Fisherbrand | 14-983-19B | |
| Tryptone | Sigma-Aldrich | T9410 | |
| Vaporous hydrogen peroxide sterilization bags | STERIS | 62020TW | |
| Vortex (during the plating process) | Daigger Scientific, Inc | 3030A | Vortex Genie 2 |
| Vortex (for sample extraction) | Branson Ultrasonics | 58816-115 | Multi-Tube vortexer |
| Washer | Kuppet | KP1040600A | |
| Washer Sterilization | Steris | STERIS VHP ED1000 generator | |
| Yeast extract | Gibco | 212750 |
Références
- Emanuel, E. J., et al. Fair allocation of scarce medical resources in the time of Covid-19. The New England Journal of Medicine. 382 (21), 2049-2055 (2020).
- Cohen, J., van der Meulen Rodgers, Y. Contributing factors to personal protective equipment shortages during the COVID-19 pandemic. Preventive Medicine. 141, 106263 (2020).
- Burki, T. Global shortage of personal protective equipment. The Lancet Infectious Diseases. 20 (7), 785-786 (2020).
- Optimizing Personal Protective Equipment (PPE) Supplies. CDC Available from: https://www.cdc.gov/coronavirus/2019-ncov/hcp/ppe-strategy/index.html (2020)
- Livingston, E., Desai, A., Berkwits, M. Sourcing personal protective equipment during the COVID-19 pandemic. Jama. 323 (19), 1912-1914 (2020).
- Bloomfield, S. F., Exner, M., Signorelli, C., Nath, K. J., Scott, E. A. The infection risks associated with clothing and household linens in home and everyday life settings, and the role of laundry. International Scientific Forum on Home Hygiene. , (2011).
- Hall, C. B., Douglas, R. G., Geiman, J. M. Possible transmission by fomites of respiratory syncytial virus. Journal of Infectious Diseases. 141 (1), 98-102 (1980).
- Turner, R., Shehab, Z., Osborne, K., Hendley, J. O. Shedding and survival of herpes simplex virus from 'fever blisters'. Pediatrics. 70 (4), 547-549 (1982).
- Bean, B., et al. Survival of influenza viruses on environmental surfaces. Journal of Infectious Diseases. 146 (1), 47-51 (1982).
- Brady, M. T., Evans, J., Cuartas, J. Survival and disinfection of parainfluenza viruses on environmental surfaces. American Journal of Infection Control. 18 (1), 18-23 (1990).
- Sidwell, R. W., Dixon, G. J., Mcneil, E. Quantitative studies on fabrics as disseminators of viruses: I. Persistence of vaccinia virus on cotton and wool fabrics. Applied Microbiology. 14 (1), 55-59 (1966).
- Owen, L., Shivkumar, M., Laird, K. The stability of model human coronaviruses on textiles in the environment and during health care laundering. Msphere. 6 (2), 00316-00321 (2021).
- Sehulster, L., et al. Guidelines for environmental infection control in health-care facilities. Recommendations from CDC and the Healthcare Infection Control Practices Advisory Committee (HICPAC). American Society for Healthcare Engineering/American Hospital Association. , (2004).
- Chen, H., et al. Influence of different inactivation methods on severe acute respiratory syndrome coronavirus 2 RNA copy number. Journal of Clinical Microbiology. 58 (8), e00958 (2020).
- Abney, S. E., Ijaz, M. K., McKinney, J., Gerba, C. P. Laundry hygiene and odor control-state of the science. Applied and Environmental Microbiology. 87 (14), 0300220 (2021).
- COVID-19 Cleaning and Disinfecting Your Home. CDC Available from: https://www.cdc.gov/coronavirus/2019-ncov/prevent-getting-sick/disinfecting-you-home.html (2021)
- COVID-19 Your Guide to Masks - How to select, properly wear, clean, and store masks. CDC Available from: https://www.cdc.gov/coronavirus/2019-ncov/prevent-getting-sick/about-face-coverings.html (2021)
- Walter, W. G., Schillinger, J. E. Bacterial survival in laundered fabrics. Applied Microbiology. 29 (3), 368-373 (1975).
- Blaser, M. J., Smith, P. F., Cody, H. J., Wang, W. -. L. L., LaForce, F. M. Killing of fabric-associated bacteria in hospital laundry by low-temperature washing. Journal of Infectious Diseases. 149 (1), 48-57 (1984).
- Gerhardts, A., et al. Testing of the adhesion of herpes simplex virus on textile substrates and its inactivation by household laundry processes. Journal of Biosciences and Medicines. 4 (12), 111 (2016).
- Heinzel, M., Kyas, A., Weide, M., Breves, R., Bockmühl, D. P. Evaluation of the virucidal performance of domestic laundry procedures. International Journal of Hygiene and Environmental Health. 213 (5), 334-337 (2010).
- Casanova, L. M., Weaver, S. R. Inactivation of an enveloped surrogate virus in human sewage. Environmental Science & Technology Letters. 2 (3), 76-78 (2015).
- Aquino de Carvalho, N., Stachler, E. N., Cimabue, N., Bibby, K. Evaluation of Phi6 persistence and suitability as an enveloped virus surrogate. Environmental Science & Technology. 51 (15), 8692-8700 (2017).
- Ye, Y., Chang, P. H., Hartert, J., Wigginton, K. R. Reactivity of enveloped virus genome, proteins, and lipids with free chlorine and UV254. Environmental Science & Technology. 52 (14), 7698-7708 (2018).
- Bacteriology Culture Guide. ATCC Available from: https://www.atcc.org/resources/culture-guides/bacteriology-culture-guide (2022)
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. . Bacteriophages. , 69-76 (2009).
- Sankhyan, S., et al. Filtration performance of layering masks and face coverings and the reusability of cotton masks after repeated washing and drying. Aerosol and Air Quality Research. 21 (11), 210117 (2021).
- Kumar, A., Bhattacharjee, B., Sangeetha, D., Subramanian, V., Venkatraman, B. Evaluation of filtration effectiveness of various types of facemasks following with different sterilization methods. Journal of Industrial Textiles. , (2021).
- Clapp, P. W., et al. Evaluation of cloth masks and modified procedure masks as personal protective equipment for the public during the COVID-19 pandemic. JAMA Internal Medicine. 181 (4), 463-469 (2021).
- Lu, H., Yao, D., Yip, J., Kan, C. -. W., Guo, H. Addressing COVID-19 spread: development of reliable testing system for mask reuse. Aerosol and air quality research. 20 (11), 2309-2317 (2020).
- Viscusi, D. J., Bergman, M. S., Eimer, B. C., Shaffer, R. E. Evaluation of five decontamination methods for filtering facepiece respirators. Annals of Occupational Hygiene. 53 (8), 815-827 (2009).
- Fischer, R. J., et al. Effectiveness of N95 respirator decontamination and reuse against SARS-CoV-2 virus. Emerging Infectious Diseases. 26 (9), 2253 (2020).
- Derraik, J. G., Anderson, W. A., Connelly, E. A., Anderson, Y. C. Rapid review of SARS-CoV-1 and SARS-CoV-2 viability, susceptibility to treatment, and the disinfection and reuse of PPE, particularly filtering facepiece respirators. International Journal of Environmental Research and Public Health. 17 (17), 6117 (2020).
- Fedorenko, A., Grinberg, M., Orevi, T., Kashtan, N. Survival of the enveloped bacteriophage Phi6 (a surrogate for SARS-CoV-2) in evaporated saliva microdroplets deposited on glass surfaces. Scientific Reports. 10 (1), 1-10 (2020).
- Calfee, M. W., et al. Virucidal efficacy of antimicrobial surface coatings against the enveloped bacteriophage Φ6. Journal of Applied Microbiology. 132 (3), 1813-1824 (2022).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon