Method Article
Определение эффективности вирусной дезинфекции при отмывании горячей воды
* Эти авторы внесли равный вклад
В этой статье
Резюме
В ответ на пандемию коронавируса тяжелого острого респираторного синдрома 2 (SARS-CoV-2) был разработан лабораторный протокол для проверки эффективности вирусной дезинфекции горячей водой при стирке тканевых покрытий для лица, хлопчатобумажных скрабов и джинсовых брюк. Вирус Phi6 (бактериофаг) использовался в качестве организма для проверки эффективности дезинфекции.
Аннотация
Этот протокол является примером лабораторного процесса для проведения исследований отмывания, которые генерируют данные о вирусной дезинфекции. Хотя протокол был разработан для исследований во время пандемии коронавирусной болезни 2019 года (COVID-19), он предназначен для того, чтобы стать основой, адаптируемой к другим исследованиям по дезинфекции вирусов; в нем демонстрируются этапы подготовки тестового вируса, инокуляции исследуемого материала, оценки визуальных изменений и изменений целостности промытых предметов в результате процесса отмывания и количественной оценки снижения вирусной нагрузки. Кроме того, в протоколе изложены необходимые образцы контроля качества для обеспечения того, чтобы эксперименты не были предвзяты к загрязнению, и измерения / наблюдения, которые должны быть зарегистрированы для отслеживания материальной целостности предметов средств индивидуальной защиты (СИЗ) после нескольких циклов отмывания. Репрезентативные результаты, представленные с протоколом, используют бактериофаг Phi6, привитый к хлопковому скрабу, джинсовому и хлопковым материалам, покрывающим лицо, и указывают на то, что процесс стирки и сушки горячей водой достиг 3-логарифмического (99,9%) снижения вирусной нагрузки для всех образцов (3-логарифмическое снижение является показателем эффективности дезинфицирующего средства в Руководстве по тестированию производительности продукции Агентства по охране окружающей среды США 810.2200). Снижение вирусной нагрузки было одинаковым в разных местах на элементах СИЗ. Результаты этого протокола тестирования эффективности вирусной дезинфекции должны помочь научному сообществу изучить эффективность домашнего отмывания для других типов тестовых вирусов и процедур отмывания.
Введение
Пандемия коронавирусной болезни 2019 года (COVID-19) вызвала беспрецедентные глобальные сбои в цепочке поставок и привела к критической нехватке многих товаров, включая основные средства индивидуальной защиты (СИЗ)1,2,3. Те, кто относится к профессиям с высоким риском, должны были адаптироваться, используя рекомендуемые стратегии кризисного потенциала, и общественность приняла использование неспециализированных предметов, таких как тканевые покрытия для лица, главным образом для контроля источника, а также для обеспечения некоторой защиты органов дыхания для владельцев. В Соединенных Штатах специализированная защита органов дыхания (т.е. фильтрующие лицевые респираторы (FFR), такие как N95s) была зарезервирована для некоторых из этих профессий с высоким риском (например, здравоохранение) во время нехватки поставок4. Когда мало что было известно о передаче коронавируса 2 тяжелого острого респираторного синдрома (SARS-Cov-2), различные другие типы материалов одежды также рассматривались в качестве барьерной защиты в начале пандемии5. С разнообразием тканей, используемых для защиты владельца, возникли вопросы об использовании, повторном использовании и дезинфекции / дезактивации этих предметов. В то время как в Соединенных Штатах было общепризнано, что рутинное домашнее машинное отмывание лицевых покрытий и других предметов одежды делает вирусы на этих поверхностях неинфекционными, существует мало данных, подтверждающих это утверждение, и не было опубликованных лабораторных протоколов для тестирования. Целью протокола исследования, представленного здесь, является предоставление примера лабораторного процесса для проведения исследований отмывания, которые генерируют данные о вирусной дезинфекции. Хотя протокол был разработан для исследований во время пандемии COVID-19, он предназначен для того, чтобы стать основой, адаптируемой к другим исследованиям по дезинфекции вирусов.
Роль одежды в передаче болезней является трудной для количественной оценки концепцией. Международный научный форум по домашней гигиене попытался решить эту сложную задачу, проведя обзор роли одежды в распространении инфекционных заболеваний в сочетании с оценкой риска практики домашней гигиены6. В эту работу был включен обзор нескольких научных исследований, в которых изучалось выживание различных вирусных штаммов на разных типах тканей, таких как шерсть и хлопок 7,8,9,10,11. Каждое исследование было сосредоточено на различных типах вируса, включая вакцину, полиовирус, респираторно-синцитиальный вирус, герпесвирус и вирус гриппа. Время выживания различных вирусов на тканях варьировалось от 30 минут до 5 месяцев в зависимости от комбинации вируса и материала. Некоторые из исследований также продемонстрировали перенос вирусного загрязнения с материала на руки. В рамках публикации было обсуждено эффективное отмывание в качестве важного метода управления для сокращения передачи, но было признано, что масштабы воздействия отмывания на снижение бремени болезней зависят от конкретного вирусного загрязнителя и трудно поддаются количественной оценке 7,8,9,10,11.
Процесс стирки уничтожает микроорганизмы с помощью химических, физических и термических процессов обработки. Например, мыло и моющие средства могут разделять почвы и могут придавать некоторое химически опосредованное антимикробное действие. Физически разбавление и перемешивание могут помочь в снижении вирусной нагрузки. Исследование, изучающее персистенцию человеческого коронавируса HCoV-OC43 на образцах хлопка с использованием промышленных и бытовых циклов стирки с температурой и моющим средством и без них, не обнаружило обнаруживаемого вируса при стирке в ненагретой воде без моющего средства, но что при наличии нагрузки на почву (искусственная слюна) бытовые циклы стирки требовали моющего средства для образцов, чтобы иметь необнаружающие вирусные нагрузки12. Горячая вода сама по себе также может обеспечить эффективное средство уничтожения некоторых микроорганизмов13,14.
В недавней публикации, обобщающей состояние нынешней практики стирки, многие факторы, такие как состав ткани, условия хранения, загрузка грязи, температура и время стирки и температура сушки, были определены как изменяющиеся в мировой практике стирки15. Хотя отмывание является распространенным методом очистки для большого процента населения, это большое различие в существующей практике делает выпуск подробных рекомендаций о том, как сделать это безопасно и эффективно, когда предмет может быть заражен вирусом, сложным и редким. Во время пандемии COVID-19 Центры США по контролю и профилактике заболеваний (CDC) выпустили руководство о том, как стирать предметы для домовладельцев16,17. Большая часть этого руководства по отмыванию была основана на нескольких более старых исследованиях по бактериальной дезинфекции 18,19 и подкреплена несколькими настольными исследованиями, которые обнаружили вирусы в оболочке, инактивированные в воде с моющими средствами 20,21. Руководство можно резюмировать следующим образом: 1) следовать инструкциям производителя для моющего средства, 2) использовать самую теплую подходящую настройку воды и 3) полностью сушить предметы. Обоснование этих рекомендаций заключалось в том, что стирка на максимально теплом цикле с моющим средством в сочетании с полной сушкой (с теплом, если это возможно) убьет вирус SARS-CoV-2.
Огромное количество возможных вариаций в процессе отмывания требует единообразного протокола, такого как представленный здесь, чтобы иметь возможность изолировать переменные и проверить эффективность вирусной дезинфекции конкретных процессов. Цель этого протокола в сочетании с учебным видео состоит в том, чтобы продемонстрировать лабораторный процесс отмывания горячей воды для репликации в других научных исследованиях. Кроме того, результаты этого тестирования эффективности вирусной дезинфекции должны повысить уверенность потребителей в эффективности домашнего отмывания во время вирусных пандемий.
протокол
Phi6 был получен из лаборатории коллаборатории в виде замороженной аликвоты ~ 1 мл и хранился при -80 ° C до использования. Первоначально он использовался для распространения большего количества вирусных запасов, которые впоследствии хранились при -80 ° C до использования. Phi6 был выбран в качестве демонстрационного вируса, потому что он обычно используется в качестве вирусной оболочки модели, может распространяться до высоких титров и требует лаборатории с низким уровнем биобезопасности для проведения тестирования 22,23,24.
1. Подготовьте раствор для вирусных запасов
- Размножают бактериофаг Phi6 в бактериальном хозяине Pseudomonas syringae с использованием модифицированного препарата среды триптического соевого агара и метода мягкого наложения агара, как описано ниже.
- Приготовьте модифицированный триптический соевый агар, взвесив и смешав ингредиенты из таблицы 1 в деионизированной воде.
- Готовят ночную культуру P. syringae , добавляя 1 мл аликвоты P. syringae с оптической плотностью (OD600) от 0,9 до 1,5, до 100 мл модифицированного триптического соевого бульона (таблица 1) и инкубируя в встряхивающем инкубаторе при ~260 об/мин при комнатной температуре (20-26 °C).
- Приготовьте мягкие агаровые пробирки, поместив модифицированный триптический соевый агар (~6 мл) в пробирки и покрыв автоклавируемым колпачком. Хранить при температуре 4 °C до использования. Автоклав мягких агаровых трубок при 121 °C в течение 15 мин расплавить агар. Держите при температуре 48 °C до нанесения покрытия. Уравновешивание при 48 °C важно, иначе вирус может быть инактивирован в анализе.
- Добавьте 1 мл неразбавленной концентрированной вирусной аликвоты к мягкому агару и 100 мкл логарифмической фазы (OD600 от 0,9 до 1,5) культуры P. syringae . Налейте мягкий агар на поверхность затвердевшей пластины триптического соевого агара диаметром 100 мм. Чтобы предотвратить появление пузырьков и/или разливов, аккуратно закрутите пластины, чтобы равномерно распределить мягкий агар по твердой поверхности агара и инкубировать в течение ночи при комнатной температуре.
- Аккуратно соскоблить25 содержимое трех пластин стерильным разбрасывателем клеток в стерильную коническую трубку объемом 50 мл, содержащую 15 мл буфера СМ. Вихревые трубки при максимальной установке в течение 1-2 мин для расщепления агара, а затем центрифуги при 7000 х г в течение 15 мин.
- Удалите супернатант и процедите через шприцевой фильтр 0,2 мкм. Хранить 1 мл аликвоты в криовиалах при -80 °C до использования.
2. Выполните предварительную визуальную оценку элемента СИЗ
- Поместите каждый элемент СИЗ на чистую, гладкую поверхность (например, лабораторный стенд, покрытый одноразовым бумажным вкладышем). Оцените каждый элемент СИЗ в трех экземплярах.
- Обеспечьте правильное освещение во время обследования СИЗ. Измерьте и запишите длину и ширину немытых предметов в различных местах (рисунок 1).
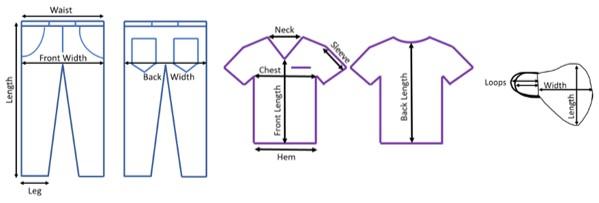
Рисунок 1. Места проведения измерений оценки СИЗ перед испытаниями. Места для джинсовой ткани, скраба и лица, где была записана длина для отслеживания существенных изменений в процессе стирки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Подготовьте купоны
- Сделайте тестовые купоны размером 2 см х 4 см, разрезав СИЗ, подготовьте два купона на покрытие лица (было протестировано три покрытия для лица), пять купонов на джинсовые брюки (три джинсовых брюки были протестированы) и три купона на рубашку скраба (было протестировано три скраба).
- Подготовьте набор процедурных пустых купонов размером 2 см х 4 см (набор для одного полноразмерного элемента СИЗ) для каждого типа материала, который не будет привит, но будет отмыт. Подготовьте два купона на каждый день экспериментов с покрытием лица, пять купонов на каждый день экспериментов с джинсовой тканью и три купона на каждый день экспериментов со скрабом.
- Подготовьте набор из положительных контрольных купонов размером 2 см х 4 см, которые будут привиты, но не отмыты. Подготовьте два купона на каждый день экспериментов по покрытию лица (было протестировано три покрытия для лица), пять купонов на каждый день экспериментов с джинсовой тканью (были протестированы три джинсовых штана) и три купона на каждый день экспериментов со скрабами (три скраба были протестированы) и три купона из нержавеющей стали.
ПРИМЕЧАНИЕ: В зависимости от размера элемента было выбрано различное количество реплик. Например, физически трудно наклеить пять купонов на покрытие лица, а два купона будут представлять ограниченную площадь джинсовых брюк. Места были выбраны для максимального покрытия и в зонах, которые могут складываться во время стирки и быть более трудными для очистки.
4. Выполните прививку
- Приготовьте 10% раствор экстракта говядины, растворив 1 г экстракта говядины в общем объеме 10 мл 1x фосфатного буферного физиологического раствора. Фильтр стерилизует весь объем с помощью шприцевого фильтра 0,2 мкм.
- Разморозить раствор вируса, приготовленный в секции 1, при комнатной температуре. В день использования добавьте 100 мкл размороженного бульона Phi6 к 900 мкл 10% раствора экстракта говядины.
- Инокулируйте тестовые купоны и положительные контрольные купоны с ~107 PFU/ образец, пипетируя каплю раствора 10 мкл на элемент PPE и распределяя каплю с помощью кончика пипетки. В зависимости от материала СИЗ, капли будут отделяться и реагрегироваться по-разному.
- Дайте привитым купонам высохнуть в шкафу для биобезопасности. Определение времени (ов) высыхания путем наблюдения за вашими конкретными материалами. Для результатов, представленных здесь, были использованы следующие сроки: скрабы = 30 мин сухого времени; покрытие лица = 60 мин сухого времени; джинсовая ткань = 30 мин сухого времени; нержавеющая сталь = 120 мин сухого времени.
- Прикрепите привитые купоны к полноразмерным СИЗ в соответствии с рисунком 2 с помощью предохранительных штифтов и асептических методов.
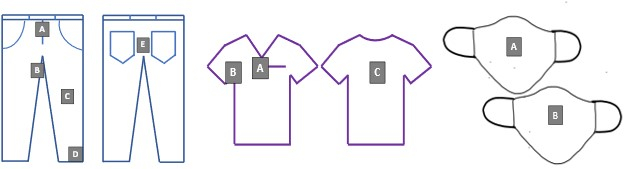
Рисунок 2. Проверьте расположение купонов на джинсовой ткани, скрабах и покрытиях для лица. Буквы A-D соответствуют уникальным идентификаторам купонов для всех экспериментов по отмыванию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Выполните стирку
- Приготовьте моющее средство для стирки следующим образом.
- Стерилизуйте водопроводную воду, которая будет использоваться в стиральной машине, и соберите 10 мл автоклавной воды для проверки стерильности. Для этого протокола автоклав 7 л водопроводной воды на 60-минутном жидком цикле.
- Приготовьте раствор для стирки в соответствии с указаниями производителя по разбавлению. Для этого протокола растворите 1,54 мл моющего средства в 3,5 л стерильной водопроводной воды. Нагрейте раствор для стирки до 50 °C с помощью конфорки и перемешивания. Измерьте и запишите pH и температуру раствора для стирки. Соберите 10 мл раствора для проверки стерильности.
- Налейте раствор для стирки в стерилизованную стиральную машину (3,25 л). Предварительно стерилизуйте шайбы с использованием цикла парообразной перекиси водорода 250 ppm-4 ч между испытаниями.
- Поместите элемент (предметы) СИЗ в стерилизованную шайбу. Добавьте один джинсовый брюк и одну рубашку-скраб на стиральную машину. Добавьте одно привитое покрытие лица и четыре незагрязненные маски для заполнения на стиральную машину; к заполненным маскам не были прикреплены купоны.
- Стирка СИЗ в течение 18 мин (два 9 мин цикла стирки при нормальном перемешивании). Процедите омыватель и трижды ополосните водопроводной водой комнатной температуры (5 л каждый раз), чтобы удалить пену. Добавьте стерилизованную водопроводную воду комнатной температуры в стиральную машину (3,25 л) и выполните 9-минутный цикл промывки.
- Переместите элемент (элементы) СИЗ в сторону отжима шайбы и вращайте в течение 5 минут. Переместите элемент (элементы) СИЗ в сушилку и высушите в течение 80 минут при высокой температуре (93 °C).
- Переместите СИЗ из сушилки в стерильное рабочее пространство и асептически извлеките купоны из каждого элемента и поместите их в конические трубки. Предварительно заполните пробирки 10 мл 10% буфера для экстракции бульона Dey-Engley и накройте алюминиевой фольгой.
6. Извлечение и перечисление вирусных нагрузок по купонам
- Извлеките купоны в 10 мл 10% нейтрализующего отвара Dey-Engley путем вихря в течение 2 мин при максимальной настройке вашего оборудования.
- Пластинчатые экстракты с использованием обычного мягкого верхнего агара накладываютспособом 26.
- Приготовьте тюбики из мягкого модифицированного триптического соевого агара и культуры P. syringae , как описано в разделе 1. В день тестирования автоклавируйте мягкие агаровые трубки при 121 °C в течение 15 мин, чтобы расплавить агар. Держите мягкий агар при температуре 48 °C до нанесения покрытия. Уравновешивание при 48 °C важно, иначе вирус может быть термически инактивирован в анализе.
- Подготовьте десятикратный ряд разбавления в 1x фосфатно-буферном физиологическом растворе для каждого исследуемого образца, используемого в исследовании отмывания. Для нанесения покрытий используйте как последовательно разбавленные (100 мкл), так и неразбавленные (1 мл и 100 мкл) аликвоты.
- Добавьте испытуемый образец аликвоты в пробирку мягкого агара, содержащую 6 мл мягкого агара и 100 мкл логарифмической фазы культуры P. syringae (OD600 между 0,9-1,5). Вылейте мягкий агар на поверхность затвердевшей модифицированной тарелки триптического соевого агара. Равномерно распределите мягкий агар по твердой поверхности агара, закрутив пластину.
- Инкубируйте пластины на ночь при комнатной температуре и вручную просчитывайте на следующий день, подсчитывая единицы формирования бляшек на каждой пластине.
7. Выполните послетестовую визуальную оценку элемента (элементов) СИЗ
- Документировать следующее в различных элементах СИЗ, используемых для тестирования: признаки выцветания, обесцвечивания и/или повреждения (например, разрыв, растяжение); Запахи; небольшие отверстия, порезы или разрывы (используйте небольшой фонарик для поиска повреждений); разделение слоев, отсутствующих нитей, участков, где поврежден переплет; повреждение швов или молний; измеряйте и записывайте растяжение резинки.
Результаты
После завершения этого протокола генерируется несколько различных типов данных и результатов контроля качества. Количество пластин блока формирования бляшек (PFU) вместе с объемом извлеченного образца позволяет рассчитать количество PFU на тестовый купон. В таблице 2 приведен пример таблицы регистрации данных для результатов последовательного разбавления/нанесения покрытий. Используя коэффициент разбавления, объем образца и количество пластин из Таблицы 1, Таблица 3 показывает репрезентативные результаты восстановления вируса для теста на покрытие лица. Обратите внимание, что эти данные включают в себя тестовые купоны и образцы контроля качества для инокулята, купоны и промывочную воду (с моющим средством и без него). Процедурные пробы для контроля качества и контроля качества стерильности важны для подтверждения того, что водные растворы и материалы СИЗ не были загрязнены Phi6. Указание на загрязнение приведет к ошибочным расчетам эффективности дезинфекции и потребует повторения теста. Положительные контрольные образцы предназначены для проверки того, что раствор вирусного запаса не разлагался экологически /естественным образом во время экспериментов, тем самым раздувая влияние процесса отмывания на снижение вирусной нагрузки. Эти образцы должны оставаться в пределах 1 лога PFU контроля инокулята, чтобы принять результаты тестового купона. Значительное снижение PFU положительных контрольных образцов также указывает на то, что все этапы прививки купона должны быть тщательно рассмотрены, чтобы убедиться, что аналитик выполняет протокол с надлежащими методами пипетирования и распространения.
Этот протокол также предоставляет информацию для оценки изменений материальных свойств предметов одежды в связи с отмыванием и информацией о контроле качества, относящейся к протоколу (таблица 4 и рисунок 3). Эти данные полезны по нескольким причинам. Регистрация тенденций в измерениях элементов СИЗ позволяет идентифицировать изделие с производственным дефектом. Эта идентификация может помочь объяснить выбросы микробных данных и контекстуализировать вариации в поведении продукта. Учет запахов или повреждений может также дать представление о том, работала ли стиральная машина или сушилка неоптимально во время эксперимента и следует ли повторить испытания или обслуживать оборудование. Кроме того, если план тестирования предусматривает несколько циклов отмывания одного и того же элемента СИЗ, данные могут помочь определить, как долго элементы СИЗ сохраняют свою целостность для использования при отмывании. Ведение учета рН моющего раствора обеспечивает оповещение об изменениях в источнике воды или моющем средстве. Ведение журнала времени этапов стирки гарантирует, что таймер на стиральной машине и сушилке не вызовет изменений в экспериментальном протоколе.
В конечном счете, эти данные используются для сообщения об эффективности дезинфекции процедуры отмывания горячей воды против суррогата вирусных патогенов. Эффективность дезинфекции при отмывании (Eqn. 1) рассчитывается путем вычитания среднего log10 выздоровлений вирусов из купона теста СИЗ из среднего log10 выздоровлений вирусов из положительных контрольных результатов СИЗ (рисунок 4). Для результатов тестового купона, которые не обнаруживаются, при расчете эффективности дезинфекции используется журнал10 предела обнаружения. Обычно эффективность дезинфекции указывается в виде значений журнала для сравнения с другими методами и стандартами вирусной дезинфекции.
Эффективность дезинфекции = Средний log10 (Положительные контрольные значения) - Средний log10 (Тестовые купоны) (Eqn. 1)
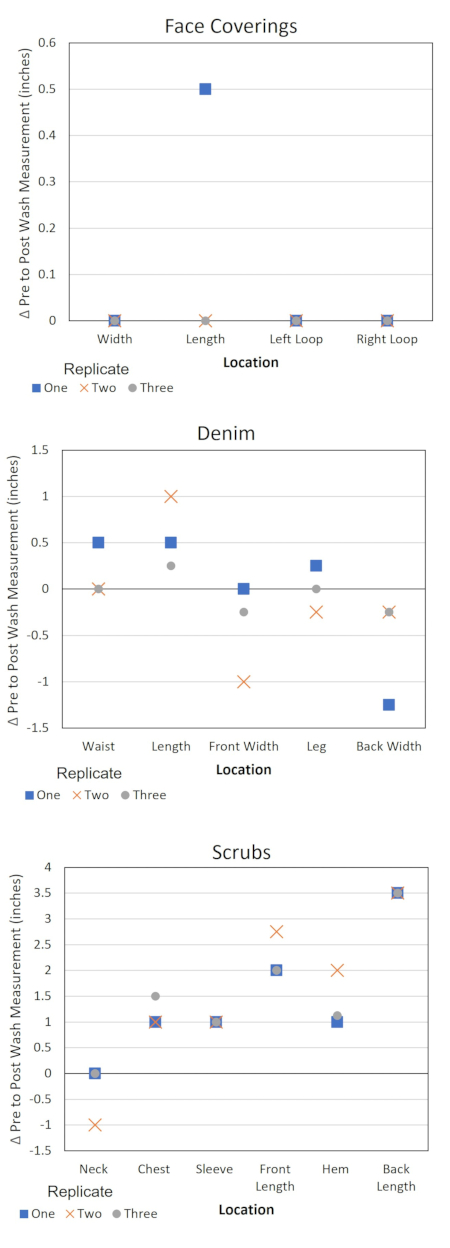
Рисунок 3. Изменение размеров СИЗ по местоположению. Δ = Предиспытательное измерение - поствыстороннее измерение. Отрицательное значение Δ соответствует растяжению элемента в указанном месте, а положительное значение соответствует усадке. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
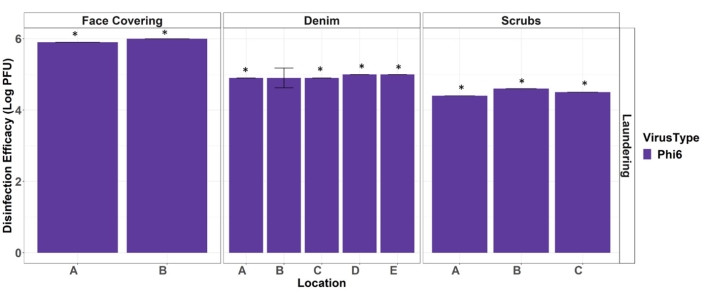
Рисунок 4. Эффективность стирки горячей водой при дезинфекции лицевых покрытий, джинсовых и скрабов СИЗ от Phi6. Звездочки обозначают полную происшедшую дезинфекцию (не обнаруживается на тестовых талонах). Полосы ошибок указывают на стандартное отклонение (n = 3). Буквы местоположения соответствуют расположению, изображенному на рисунке 2. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1. Рецепты растворов. Ингредиенты и количества, необходимые для приготовления триптического соевого агара, триптического соевого бульона и растворов экстракта говядины. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 2. Пример части последовательного листа результатов разбавления/покрытия. Шаблон для представления необработанных микробных данных. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 3. Микробные результаты, закрывающие лицо. Пример сводного листа для данных обработанного бляшечного блока (PFU). Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Таблица 4. Журнал контроля качества скрабов и оценки материалов. Шаблон для отчетности о калибровке датчика pH, pH моющего раствора, измерений до и после промывки и времени цикла стирки. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Обсуждение
Этот протокол был разработан для проведения систематического лабораторного тестирования для оценки эффективности отмывания вирусной дезинфекции от полноразмерных СИЗ / предметов одежды. В процедурах описываются критические шаги по подготовке вируса, инокуляции исследуемого материала, оценке изменений в предметах, вызванных процессом отмывания, и количественной оценке снижения вирусной нагрузки в результате процесса стирки (машинная стирка и сушка). Кроме того, в протоколе изложены необходимые образцы контроля качества для обеспечения того, чтобы эксперименты не были предвзяты к загрязнению, и измерения / наблюдения, которые должны быть зарегистрированы для отслеживания целостности материалов элементов СИЗ после нескольких циклов отмывания. Результаты с использованием Phi6 показывают, что процесс стирки горячей водой, используемый в этом протоколе, достиг более чем 3-логарифмического снижения вирусной нагрузки для всех образцов (покрытие лица, скрабы и джинсовые штаны). Снижение вирусной нагрузки также было одинаковым в разных местах на СИЗ / предметах одежды. Чтобы продемонстрировать 3-логарифмическое сокращение, этот протокол требует использования высокой вирусной нагрузки и стабилизирующего агента (экстракт говядины), который может не быть репрезентативным для нагрузки на почву для всех ситуаций.
Мини-шайбы и компактные сушилки были выбраны для оптимизации количества экспериментов с репликацией, которые могут проводиться в условиях ограниченного пространства, и для обеспечения управляемости стерилизации оборудования и объема воды, используемого во время экспериментов, для персонала лаборатории. В результате использования мини-шайбы шаги промывки были ручными по сравнению с большинством домашних приложений для стирки, которые полностью автоматизированы. Также важно помнить, что машинная стирка преобладает в развитых странах, но мытье рук по-прежнему практикуется во всем мире15. Кроме того, некоторые могут не иметь доступа к горячей воде для стирки, а другие вручную сушат одежду на воздухе, а не сушку в машине. Эти различия в методах отмывания не были рассмотрены в настоящем протоколе, но могут быть легко исследованы с незначительными изменениями, такими как замена этапов стирки и сушки с использованием ведра и близкой линии.
В научной литературе в полном масштабе минимальное внимание уделяется очистке/дезинфекции вирусно загрязненных лицевых покрытий и уличной одежды. Чаще всего исследования оценивают эффективность фильтрации лицевых покрытий после повторного мытья и сушки, но не оценивают эффективность вирусной дезинфекции27,28. Например, Clapp et al. оценили эффективность фильтрации тканевых масок и модифицированных масок и обнаружили широкие различия в производительности, с простыми модификациями, обеспечивающими повышенную посадку и эффективность фильтрации29. В другом исследовании рассматривалась эффективность фильтрации четырех тканевых масок из различных материалов30, снова сосредоточив внимание на контроле источника или индивидуальной защите. Это может быть связано с отсутствием специализации как для микробной части, так и для механических испытаний в одной и той же лаборатории. Протокол, представленный здесь, обеспечивает оценку эффективности дезинфекции, а также деградации материала.
Недавно в научной литературе был опубликован ряд методов дезактивации/дезинфекции для одноразовой защиты органов дыхания (в первую очередь N95s) 31,32,33. Основное внимание к FFR (например, N95s) связано с критической защитой органов дыхания, которую они обеспечивают работникам здравоохранения и другим профессиям на переднем крае. Основные технологии обеззараживания респираторов включали испаренную перекись водорода (VHP), ультрафиолетовое бактерицидное излучение (UVGI) и влажное тепло (пар) для инактивации вируса. Viscusi et al. оценили пять методов дезактивации для FFR и UVGI; Было установлено, что окись этилена и VHP являются наиболее перспективными методами дезактивации31. Fischer et al. оценили четыре различных метода дезактивации - ультрафиолетовый свет, сухое тепло, 70% этанол и VHP - на предмет их способности уменьшать загрязнение SARS-CoV-2 и их влияние на дыхательную функцию N9532. Существует много дополнительных исследований по эффективным технологиям дезактивации для FFR, которые были обобщены и опубликованы в 2020 году33. Тем не менее, эти специализированные методы недоступны или предназначены для безопасного использования средним владельцем дома или малого бизнеса.
Этот протокол был разработан с использованием Phi6, оболоченного бактериофага, который похож на SARS-CoV-2, имеет спайковые белки и имеет аналогичный размер (80-100 нм)34 для всех испытаний. Поскольку Phi6 не является известным патогеном, им можно манипулировать в общей микробиологической лаборатории биобезопасности уровня 1 (BSL-1). Эффективность в отношении Phi6 может указывать на эффективность других вирусов в оболочке, однако эмпирическая проверка для каждого интересующего вируса необходима35. Используя аналогичный, непатогенный вирусный агент, есть надежда, что этот протокол может быть повторен в другом месте и использован для изучения будущих вирусных эпидемий / пандемий. Будущие исследования могут включать использование дезинфицирующих средств (например, отбеливателей) в дополнение к моющим средствам и стандартизированный протокол для мытья рук и сушки на линии.
Раскрытие информации
Нет никаких известных конфликтов интересов, которые можно было бы раскрыть.
Благодарности
Агентство по охране окружающей среды США (EPA) через свое Управление по исследованиям и разработкам руководило исследованиями, описанными в настоящем документе в соответствии с EP-C-15-008, с Jacobs Technology Inc. Он был рассмотрен Агентством, но не обязательно отражает взгляды Агентства. Официальное одобрение не должно быть выведено. EPA не одобряет покупку или продажу каких-либо коммерческих продуктов или услуг. Авторы хотели бы поблагодарить подрядчиков EPA Дениз Аслетт за надзор за микробиологией EPA RTP, Брайана Форда, Рэйчел Баартманс и Лесли Мендес Сандоваль за их работу над этим проектом в микробиологической лаборатории EPA RTP, Рамону Шерман за предоставление обзора качества EPA и Уорта Калфи и Шеннона Серре за предоставление технических обзоров EPA.
Материалы
| Name | Company | Catalog Number | Comments |
| Freezer (- 80 °C) | ThermoFisher Scientific | FDE30086FA | |
| Hot Plate | VWR | 97042-714 | |
| Safety Pins (steel) | Singer | 319921 | |
| Shaker | Lab-Line Instruments, Inc. | 3525 | |
| SM buffer | Teknova, Hollister, CA | S0249 | |
| Syringe filter (0.2 μm) | Corning, Corning, NY | PES syringe filters, 431229 | |
| 1X Phosphate Buffered Saline | Teknova, Hollister, CA | P0196, 10X PBS solution | |
| Agar | Becton Dickinson | 214010 | |
| Autoclavable caps | DWK Life Sciences, Millville, NJ | KIM-KAP Caps, 73663-18 | |
| Autoclave | Steris | AMSCO 250LS Steam Sterilizer Model 20VS | |
| Beef Extract | Sigma-Aldrich, Millipore Sigma, St. Louis, MO, USA | P/N B4888-100g | |
| Calcium chloride | Sigma-Aldrich | 793639 | |
| Cell spreaders | Busse Hospital Disposables | 23600894 | |
| Centrifuge | ThermoFisher Scientific | 75004271 | Heraeus MegaFuge 16R Centrifuge |
| Certified Timer | https://nist.time.gov/ | Not Applicable | |
| Conical tubes (50 mL) | Corning Life Sciences | 352098 | Falcon 50-mL high-clarity polypropylene conical centrifuge tubes |
| Cryovials | Thermo Fisher Scientific, Waltham, MA | AY509X33 | |
| Denim | Wrangler | Rustler Regular Fit Straight Leg Jean Four Pocket Jean with Scoop Front Pockets, PN:87619PW | |
| Detergent | Proctor and Gamble | Tide Original Scent Liquid Laundry Detergent Product Number (PN): 003700023068 | |
| Dextrose | Fisher | BP350 | |
| Dey-Engley neutralizing broth | Becton Dickinson | DF0819172 | |
| Dryer | Magic Chef | MCSDRY15W | |
| Face Coverings | Felina | Reusable Organic Cotton Face Masks, PN: 990121P4 | |
| Incubator (top agar) | Symphony | 414004-596 | |
| Laboratory Notebook | Scientific Notebook Company | 2001 | |
| Magnesium chloride | Sigma-Aldrich | M9272 | |
| Media sterilization and dispensing system | Integra | Media Clave/Media Jet | |
| Petri Dishes (100 mm) | VWR | 25384-342 | |
| pH Meter | Orion/Oakton | STARA1110/EW-35634-35 | |
| pH Probe | Orion | 8157BNUMD | |
| pH Standards | Oakton | 00654-(00/04/08) | |
| Phi 6 and Pseudomonas syringae | Battelle Memorial Institute, Columbus, OH | Not Applicable | |
| Pipette & Tips | Rainin | (Pipettes) 17014391, 17002921; (Pipette Tips) 30389239, 17014382 | |
| Refrigerator | True Manufacturing Co., Inc. | GDM-33 | |
| Scrubs | Gogreen cool | PN: WS19100PT | |
| Sodium chloride | Sigma-Aldrich | 57656 | |
| Stir Bar | Fisherbrand | 16-800-512 | |
| Tape Measure | Lufkin | PS3425 | |
| Test Tubes for Soft agar (14 mL) | Corning, Corning, NY | 352059 | |
| Thermometer | Fisherbrand | 14-983-19B | |
| Tryptone | Sigma-Aldrich | T9410 | |
| Vaporous hydrogen peroxide sterilization bags | STERIS | 62020TW | |
| Vortex (during the plating process) | Daigger Scientific, Inc | 3030A | Vortex Genie 2 |
| Vortex (for sample extraction) | Branson Ultrasonics | 58816-115 | Multi-Tube vortexer |
| Washer | Kuppet | KP1040600A | |
| Washer Sterilization | Steris | STERIS VHP ED1000 generator | |
| Yeast extract | Gibco | 212750 |
Ссылки
- Emanuel, E. J., et al. Fair allocation of scarce medical resources in the time of Covid-19. The New England Journal of Medicine. 382 (21), 2049-2055 (2020).
- Cohen, J., van der Meulen Rodgers, Y. Contributing factors to personal protective equipment shortages during the COVID-19 pandemic. Preventive Medicine. 141, 106263 (2020).
- Burki, T. Global shortage of personal protective equipment. The Lancet Infectious Diseases. 20 (7), 785-786 (2020).
- Optimizing Personal Protective Equipment (PPE) Supplies. CDC Available from: https://www.cdc.gov/coronavirus/2019-ncov/hcp/ppe-strategy/index.html (2020)
- Livingston, E., Desai, A., Berkwits, M. Sourcing personal protective equipment during the COVID-19 pandemic. Jama. 323 (19), 1912-1914 (2020).
- Bloomfield, S. F., Exner, M., Signorelli, C., Nath, K. J., Scott, E. A. The infection risks associated with clothing and household linens in home and everyday life settings, and the role of laundry. International Scientific Forum on Home Hygiene. , (2011).
- Hall, C. B., Douglas, R. G., Geiman, J. M. Possible transmission by fomites of respiratory syncytial virus. Journal of Infectious Diseases. 141 (1), 98-102 (1980).
- Turner, R., Shehab, Z., Osborne, K., Hendley, J. O. Shedding and survival of herpes simplex virus from 'fever blisters'. Pediatrics. 70 (4), 547-549 (1982).
- Bean, B., et al. Survival of influenza viruses on environmental surfaces. Journal of Infectious Diseases. 146 (1), 47-51 (1982).
- Brady, M. T., Evans, J., Cuartas, J. Survival and disinfection of parainfluenza viruses on environmental surfaces. American Journal of Infection Control. 18 (1), 18-23 (1990).
- Sidwell, R. W., Dixon, G. J., Mcneil, E. Quantitative studies on fabrics as disseminators of viruses: I. Persistence of vaccinia virus on cotton and wool fabrics. Applied Microbiology. 14 (1), 55-59 (1966).
- Owen, L., Shivkumar, M., Laird, K. The stability of model human coronaviruses on textiles in the environment and during health care laundering. Msphere. 6 (2), 00316-00321 (2021).
- Sehulster, L., et al. Guidelines for environmental infection control in health-care facilities. Recommendations from CDC and the Healthcare Infection Control Practices Advisory Committee (HICPAC). American Society for Healthcare Engineering/American Hospital Association. , (2004).
- Chen, H., et al. Influence of different inactivation methods on severe acute respiratory syndrome coronavirus 2 RNA copy number. Journal of Clinical Microbiology. 58 (8), e00958 (2020).
- Abney, S. E., Ijaz, M. K., McKinney, J., Gerba, C. P. Laundry hygiene and odor control-state of the science. Applied and Environmental Microbiology. 87 (14), 0300220 (2021).
- COVID-19 Cleaning and Disinfecting Your Home. CDC Available from: https://www.cdc.gov/coronavirus/2019-ncov/prevent-getting-sick/disinfecting-you-home.html (2021)
- COVID-19 Your Guide to Masks - How to select, properly wear, clean, and store masks. CDC Available from: https://www.cdc.gov/coronavirus/2019-ncov/prevent-getting-sick/about-face-coverings.html (2021)
- Walter, W. G., Schillinger, J. E. Bacterial survival in laundered fabrics. Applied Microbiology. 29 (3), 368-373 (1975).
- Blaser, M. J., Smith, P. F., Cody, H. J., Wang, W. -. L. L., LaForce, F. M. Killing of fabric-associated bacteria in hospital laundry by low-temperature washing. Journal of Infectious Diseases. 149 (1), 48-57 (1984).
- Gerhardts, A., et al. Testing of the adhesion of herpes simplex virus on textile substrates and its inactivation by household laundry processes. Journal of Biosciences and Medicines. 4 (12), 111 (2016).
- Heinzel, M., Kyas, A., Weide, M., Breves, R., Bockmühl, D. P. Evaluation of the virucidal performance of domestic laundry procedures. International Journal of Hygiene and Environmental Health. 213 (5), 334-337 (2010).
- Casanova, L. M., Weaver, S. R. Inactivation of an enveloped surrogate virus in human sewage. Environmental Science & Technology Letters. 2 (3), 76-78 (2015).
- Aquino de Carvalho, N., Stachler, E. N., Cimabue, N., Bibby, K. Evaluation of Phi6 persistence and suitability as an enveloped virus surrogate. Environmental Science & Technology. 51 (15), 8692-8700 (2017).
- Ye, Y., Chang, P. H., Hartert, J., Wigginton, K. R. Reactivity of enveloped virus genome, proteins, and lipids with free chlorine and UV254. Environmental Science & Technology. 52 (14), 7698-7708 (2018).
- Bacteriology Culture Guide. ATCC Available from: https://www.atcc.org/resources/culture-guides/bacteriology-culture-guide (2022)
- Kropinski, A. M., Mazzocco, A., Waddell, T. E., Lingohr, E., Johnson, R. P. . Bacteriophages. , 69-76 (2009).
- Sankhyan, S., et al. Filtration performance of layering masks and face coverings and the reusability of cotton masks after repeated washing and drying. Aerosol and Air Quality Research. 21 (11), 210117 (2021).
- Kumar, A., Bhattacharjee, B., Sangeetha, D., Subramanian, V., Venkatraman, B. Evaluation of filtration effectiveness of various types of facemasks following with different sterilization methods. Journal of Industrial Textiles. , (2021).
- Clapp, P. W., et al. Evaluation of cloth masks and modified procedure masks as personal protective equipment for the public during the COVID-19 pandemic. JAMA Internal Medicine. 181 (4), 463-469 (2021).
- Lu, H., Yao, D., Yip, J., Kan, C. -. W., Guo, H. Addressing COVID-19 spread: development of reliable testing system for mask reuse. Aerosol and air quality research. 20 (11), 2309-2317 (2020).
- Viscusi, D. J., Bergman, M. S., Eimer, B. C., Shaffer, R. E. Evaluation of five decontamination methods for filtering facepiece respirators. Annals of Occupational Hygiene. 53 (8), 815-827 (2009).
- Fischer, R. J., et al. Effectiveness of N95 respirator decontamination and reuse against SARS-CoV-2 virus. Emerging Infectious Diseases. 26 (9), 2253 (2020).
- Derraik, J. G., Anderson, W. A., Connelly, E. A., Anderson, Y. C. Rapid review of SARS-CoV-1 and SARS-CoV-2 viability, susceptibility to treatment, and the disinfection and reuse of PPE, particularly filtering facepiece respirators. International Journal of Environmental Research and Public Health. 17 (17), 6117 (2020).
- Fedorenko, A., Grinberg, M., Orevi, T., Kashtan, N. Survival of the enveloped bacteriophage Phi6 (a surrogate for SARS-CoV-2) in evaporated saliva microdroplets deposited on glass surfaces. Scientific Reports. 10 (1), 1-10 (2020).
- Calfee, M. W., et al. Virucidal efficacy of antimicrobial surface coatings against the enveloped bacteriophage Φ6. Journal of Applied Microbiology. 132 (3), 1813-1824 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены