Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation et photoactivation faciles de nanoassemblages promédicament-colorant
Dans cet article
Résumé
Ce protocole décrit la fabrication et la caractérisation d’un nanoassemblage promédicament-colorant photosensible. La méthodologie de libération des nanoparticules par désassemblage déclenché par la lumière, y compris la configuration d’irradiation par la lumière, est explicitement décrite. Les médicaments libérés par les nanoparticules après irradiation lumineuse ont montré d’excellents effets anti-prolifération sur les cellules tumorales colorectales humaines.
Résumé
L’auto-assemblage est une méthode simple mais fiable pour construire des systèmes d’administration de médicaments à l’échelle nanométrique. Les promédicaments photoactivables permettent une libération contrôlable de médicaments à partir de nanotransporteurs sur des sites cibles modulés par irradiation lumineuse. Dans ce protocole, une méthode facile pour fabriquer des nanoparticules photoactivables de colorant promédicamenteux par auto-assemblage moléculaire est présentée. Les procédures de synthèse de promédicaments, de fabrication de nanoparticules, de caractérisation physique du nanoassemblage, de démonstration de photoclivage et de vérification de la cytotoxicité in vitro sont décrites en détail. Une prodrogue photoclivable bore-dipyrrométhylène-chlorambucil (BC) a d’abord été synthétisée. BC et un colorant proche infrarouge, IR-783, à un rapport optimisé, pourraient s’auto-assembler en nanoparticules (IR783 / BC NPs). Les nanoparticules synthétisées avaient une taille moyenne de 87,22 nm et une charge de surface de -29,8 mV. Les nanoparticules se sont désassemblées lors de l’irradiation lumineuse, qui a pu être observée par microscopie électronique à transmission. Le photoclivage de la Colombie-Britannique a été complété en 10 minutes, avec une efficacité de récupération de 22 % pour le chlorambucile. Les nanoparticules présentaient une cytotoxicité accrue sous irradiation lumineuse à 530 nm par rapport aux nanoparticules non irradiées et à la prodrogue BC libre irradiée. Ce protocole fournit une référence pour la construction et l’évaluation de systèmes d’administration de médicaments photosensibles.
Introduction
La chimiothérapie est un traitement courant contre le cancer qui utilise des agents cytotoxiques pour tuer les cellules cancéreuses et inhiber ainsi la croissance tumorale1. Cependant, les patients peuvent souffrir d’effets secondaires tels que cardiotoxicité et hépatotoxicité en raison de l’absorption hors cible des médicaments de chimiothérapie 2,3,4. Par conséquent, l’administration localisée de médicaments par le contrôle spatio-temporel de la libération / activation du médicament dans les tumeurs est essentielle pour minimiser l’exposition au médicament dans les tissus normaux.
Les promédicaments sont des médicaments chimiquement modifiés qui présentent une toxicité réduite dans les tissus normaux tout en conservant leur action sur les lésions malades lors de l’activation 5,6. Les promédicaments peuvent répondre à une variété de stimuli, tels que pH7,8, enzymes9,10, ultrasons 11,12, chaleur 13 et lumière14,15,1 6, et libérer leurs médicaments parents spécifiquement dans les lésions. Néanmoins, de nombreuses prodrogues présentent des inconvénients inhérents, tels qu’une faible solubilité, un taux d’absorption incorrect et une destruction métabolique précoce, ce qui peut limiter leur développement17. Dans ce contexte, la formation de nanoassemblages de prodrogue offre des avantages tels que la diminution des effets secondaires, la libération in situ du médicament, une meilleure rétention et la combinaison du traitement et de l’imagerie, ce qui indique un grand potentiel d’application pour ces nanoassemblages. De nombreux nanoassemblages de prodrogue ont été développés pour le traitement de la maladie, y compris les nanosphères de prodrogue doxorubicine, les micelles de prodrogue de curcumine et les nanofibres de prodrogue de camptothécine18.
Dans ce protocole, nous présentons une méthode simple pour la préparation de nanoassemblages promédicament-colorant qui présentent une teneur élevée en prodrogue, une bonne dispersibilité dans l’eau, une stabilité à long terme et une capacité de réponse sensible. L’IR783 est un colorant proche infrarouge soluble dans l’eau qui peut servir de stabilisateur aux nanoassemblages19. L’autre composant du nanoassemblage est le bore-dipyrrométhylène-chlorambucil (BODIPY-Cb, C.-B.), un promédicament conçu pour deux raisons principales. Comme le chlorambucil (Cb) présente une toxicité systémique in vivo, la forme prodrogue peut diminuer sa toxicité20. La prodrogue BC peut être photoclivée par irradiation lumineuse de 530 nm dirigée vers les lésions de la maladie, permettant la libération locale de Cb. D’autre part, le Cb est sujet à l’hydrolyse en milieu aqueux, et peut être protégé en le transformant en une forme de prodrogue21. Ainsi, le co-assemblage de la prodrogue BC et du colorant IR-783 devait former un nanosystème stable et efficace d’administration de médicaments (Figure 1A). Ce nanoassemblage promédicament-colorant améliore la dispersibilité et la stabilité des molécules de prodrogue, suggérant son potentiel d’application dans l’administration de médicaments contrôlables par la lumière. Le photoclivage de la prodrogue BC permet le désassemblage des nanoparticules et la libération contrôlée par la lumière de Cb dans les lésions (Figure supplémentaire 1).
Protocole
1. Synthèse de la prodrogue bore-dipyrromène-chlorambucil (BC) (figure 2)22
- Synthèse de BODIPY-OAc
- Peser 1,903 g de 2,4-diméthylpyrrole et le dissoudre dans 20 mL de dichlorométhane anhydre (DCM) dans une fiole à fond rond sous atmosphère d’azote. Peser 1,638 g de chlorure d’acétyle acétoxique et l’ajouter goutte à goutte dans la solution. Laisser agiter pendant 10 min à température ambiante, puis reflux de la solution pendant 1 h à 40 °C.
- Refroidir le mélange à température ambiante. Peser 5,170 g de N,N-diisopropyléthylamine (DIPEA) et l’ajouter goutte à goutte dans le mélange sous agitation. Après 30 min, peser 5,677 g d’étherate de diéthylétate de trifluorure de bore (BF3· OEt2), ajoutez-le goutte à goutte dans la solution et continuez à agiter pendant 30 minutes supplémentaires.
- Ajouter 10 g de gel de silice (200-400 mesh) dans le mélange et éliminer le solvant par évaporation rotative à 45 °C. Arrêtez l’évaporation lorsque le gel de silice retourne à la poudre sèche.
- Ajouter une fritte dans le fond d’une cartouche (voir le tableau des matériaux). Remplissez le gel de silice (de l’étape 1.1.3) dans la cartouche, puis ajoutez une autre fritte dans la cartouche sur le dessus du gel rempli.
- Fixez la cartouche dans le collier relié au système de chromatographie flash (voir Tableau des matériaux) et tournez-la pour la verrouiller. Installez la cartouche sur le dessus de la valve à six voies dans le système de chromatographie flash et installez une colonne flash (voir le tableau des matériaux) sous la vanne.
- Démarrez l’instrument de chromatographie et réglez 515 nm et 365 nm comme longueurs d’onde de détection. Effectuer l’élution avec 4/3 (v/v) hexane/DCM. Recueillir les fractions éluantes lorsque le signal de 515 nm apparaît.
- Retirer le solvant des fractions collectées par évaporation rotative à 40 °C jusqu’à ce qu’il n’y ait plus de solvant recueilli dans la fiole collectrice de solvant. Placez le produit solide dans une chambre de séchage sous vide pendant la nuit pour éliminer le reste du solvant.
- Synthèse de BODIPY-OH
- Peser 1,120 g de BODIPY-OAc (synthétisé à l’étape 1.1) et le dissoudre dans 70 mL de tétrahydrofurane (THF) à température ambiante, entièrement recouvert d’une feuille d’aluminium. Ajouter goutte à goutte 70 mL de solution aqueuse LiOH 0,1 M dans la solution BODIPY-OAc.
- Remuer le mélange pendant 30 min et retirer le solvant à 40 °C par évaporation rotative jusqu’à ce qu’il n’y ait plus de solvant recueilli dans la fiole collectrice de solvant. Placez le résidu dans une chambre de séchage sous vide pendant la nuit pour éliminer l’eau.
- Dissoudre le résidu sec dans 30 mL de DCM et ajouter 10 g de gel de silice dans la solution. Retirer le solvant par évaporation rotative à 40 °C. Arrêtez l’évaporation lorsque le gel de silice retourne à la poudre sèche.
- Purifier le produit BODIPY-OH par chromatographie sur colonne, en suivant les étapes 1.1.4 à 1.1.6, avec le DCM seul comme éluant.
- Comparer les fractions recueillies à différents points temporels d’élution avec une solution de THF de BODIPY-OAc sur chromatographie sur couche mince (CCM) et identifier le produit23.
- Repérer 3-4 μL de la fraction éluée et la solution BODIPY-OAc séparément sur un bord d’une plaque TLC à la même hauteur. Placez la plaque TLC dans une chambre en verre contenant 1 mL de DCM, en immergeant le bord tacheté dans le solvant DCM, mais avec les deux taches hors du solvant.
- Retirez la plaque TLC lorsque le solvant DCM atteint plus de la moitié de la hauteur de la plaque. Sélectionnez la fraction éluée avec une tache TLC à une hauteur différente de la tache BODIPY-OAc.
- Prélever le solvant par évaporation rotative à 40 °C (étape 1.1.7) pour obtenir le produit BODIPY-OH.
- Synthèse de BODIPY-(Me)2-OH
- Peser 313 mg de BODIPY-OH et le dissoudre dans 35 mL d’éther diéthylique anhydre dans l’obscurité sous atmosphère d’azote. Ajouter goutte à goutte 3,75 mL d’iodure de méthylmagnésium (3 M dans l’éther diéthylique) dans la solution et continuer à agiter pendant 3 h à température ambiante.
- Éteindre la réaction en ajoutant 3,5 mL d’eau goutte à goutte.
- Extraire le mélange avec du DCM et de l’eau.
- Transférer le mélange dans un entonnoir de séparation de 125 mL. Ajouter 20 mL de DCM dans le mélange.
- Fermez le capuchon de l’entonnoir de séparation. Inclinez l’entonnoir à environ 45° et secouez légèrement l’entonnoir. Ouvrez le bouchon pour le dégonfler. Répétez cette étape 3 fois et laissez reposer pendant 3 min.
- Ouvrez la vanne inférieure et recueillez la phase organique inférieure dans un bécher.
- Ajouter 30 mL de DCM à la phase aqueuse. Répéter l’extraction (étapes 1.3.3.2 et 1.3.3.3) 3 fois avec 30 mL de DCM à chaque fois.
- Ajouter 10 g de Na2SO4solide dans la phase organique recueillie pour sécher la phase organique pendant une nuit.
- Reliez une fiole filtrante à une pompe à vide à l’aide d’un tube en caoutchouc. Déposer un morceau de papier filtre sur l’entonnoir Büchner et insérer l’entonnoir dans le haut de la fiole. Mouillez le papier filtre avec 1 ml de DCM, transférez le mélange dans l’entonnoir et allumez la pompe à vide. Recueillir la solution organique dans la fiole.
- Ajouter 10 g de gel de silice dans la solution organique. Éliminer le solvant organique par évaporation rotative à 40 °C jusqu’à ce que le gel de silice redevienne de la poudre sèche. Purifier le produit BODIPY-(Me)2-OH par chromatographie sur colonne (étapes 1.1.4 à 1.1.6) avec de l’hexane/DCM = 1/1 (v/v) comme éluant.
- Sélectionnez les fractions éluées contenant le produit à l’aide de l’analyse CCM décrite à l’étape 1.2.5 (tache TLC à une hauteur différente de BODIPY-OH). Retirer le solvant par évaporation rotative à 40 °C pour obtenir le produit tel que décrit à l’étape 1.1.7.
- Synthèse de BODIPY-(Me)2-I 2-OH
- Peser 41 mg de BODIPY-(Me)2-OH et le dissoudre dans 2,5 mL de THF anhydre dans l’obscurité sous une atmosphère d’azote. Peser 74 mg de N-iodosuccinimide et le dissoudre dans 1 mL de THF anhydre.
- Ajouter goutte à goutte la solution de N-iodosuccinimide dans la solution BODIPY-(Me)2-OH. Après agitation pendant 3,5 h à température ambiante, retirer le solvant par évaporation rotative à 40 °C jusqu’à ce qu’il n’y ait plus de solvant recueilli dans la fiole collectrice de solvant de l’évaporateur rotatif.
- Dissoudre le résidu dans 10 mL de DCM et le laver 3 fois avec 30 mL d’eau à chaque fois, comme décrit à l’étape 1.3.3. Sécher la phase organique avecNa2SO4(étapes 1.3.4 et 1.3.5). Prélever le solvant par évaporation rotative à 40 °C (étape 1.1.7) pour obtenir le produit BODIPY-(Me)2-I 2-OH.
- Synthèse de BODIPY-Cb
- Peser 85 mg de chlorambucil et le dissoudre dans 2 mL de DCM anhydre dans l’obscurité sous atmosphère d’azote. Peser 69 mg de N,N'-dicyclohexylcarbodiimide et le dissoudre dans 1 mL de DCM anhydre. Ajoutez-le goutte à goutte dans la solution de chlorambucil en agitant pendant 10 min.
- Dissoudre 1,7 mg de 4-diméthylaminopyridine dans 0,5 mL de DCM anhydre. Ajouter cette solution dans le mélange et continuer à agiter pendant 10 min à température ambiante. Ajouter ensuite 73 mg de BODIPY-(Me)2-I 2-OH dissous dans 2 mL de DCM anhydre et continuer à agiter pendant 2 h.
- Ajouter 10 g de gel de silice dans le mélange et éliminer le solvant par évaporation rotative à 40 °C. Arrêtez l’évaporation lorsque le gel de silice retourne à la poudre sèche. Purifier le produit BODIPY-Cb par chromatographie sur colonne (étapes 1.1.4 à 1.1.6, longueur d’onde du signal 540 nm et 365 nm) avec de l’hexane/DCM = 7/3 (v/v) comme éluant.
- Sélectionner les fractions éluées contenant le produit différent de BODIPY-(Me)2-I 2-OH en utilisant l’analyse TLC (étape 1.2.5). Prélever le solvant par évaporation rotative à 40 °C (étape 1.1.7) pour obtenir le produit BODIPY-Cb.
2. Préparation des NP IR783/BC par la méthode de précipitation éclair
- Peser 10 mg du promédicament BC (BODIPY-Cb) et le dissoudre dans 1 mL de DMSO dans un microtube de 1,5 mL pour obtenir une solution mère de 10 mg/mL. Couvrir la solution BC avec du papier d’aluminium.
- Préparer 300 μL de 0,4 mg/mL d’IR-783 dans de l’eau désionisée filtrée dans un microtube de 1,5 mL. Placez ce microtube sur un mélangeur vortex à 1 500 tr / min.
- Ajouter 20 μL de la solution BC dans du DMSO à la solution IR-783 pendant 10 s à un débit constant à l’aide d’une pipette de 20 μL. L’extrémité de l’embout de la pipette doit toucher la paroi interne du microtube (figure 1B).
- Gardez le microtube sur le mélangeur vortex pendant 30 s supplémentaires pour obtenir la solution IR783/BC NP. Ensuite, placez la solution de nanoparticules sur une grille entièrement recouverte de papier d’aluminium.
- Centrifuger la solution IR783/BC NP obtenue pendant 10 min à 2 000 x g et 4 °C pour éliminer les agrégats. Recueillir le surnageant, en laissant ~20 μL dans le tube pour éviter de déranger la pastille. Jetez la pastille.
- Centrifuger le surnageant deux fois pendant 30 min à 30 000 x g et 4 °C et recueillir le précipité de nanoparticules des deux centrifugations. Resuspendre les nanoparticules dans 300 μL de 1x PBS.
REMARQUE: Lorsque la prodrogue biophobe BC dans le DMSO est dispersée dans l’eau avec vortex, le DMSO est dissous par l’eau et les molécules de prodrogue ont tendance à former des assemblages à l’échelle nanométrique pour se maintenir stables dans la situation de sursaturation locale24. - Quantifier la teneur en IR-783 et en BC par chromatographie liquide à haute performance (CLHP), en utilisant la méthode d’élution indiquée dans le tableau 1.
NOTE: L’échantillon CLHP est préparé en mélangeant des volumes égaux de solution de nanoparticules et d’acétonitrile. Le volume d’injection est de 20 μL. La longueur d’onde de détection pour le chlorambucil et la prodrogue BC est de 260 nm, et la longueur d’onde de détection pour IR783 est de 783 nm. La colonne HPLC est une colonne analytique C18 de 4,6 mm (diamètre intérieur) x 100 mm (longueur), avec une taille de particules de 2,7 μm et une taille de pores de 120 Å. - Calculer l’efficacité d’encapsulation des promédicaments (EE%) et la capacité de charge (CL%) selon les équations suivantes:

| Temps (min) | Acétonitrile (%) | Eau (%) |
| 0 | 20 | 80 |
| 5 | 20 | 80 |
| 30 | 95 | 5 |
| 35 | 95 | 5 |
Tableau 1 : Méthode CLHP pour l’analyse qualitative et quantitative de la prodrogue BC et de son photoclivage. Reproduit avec permission25. Droits d’auteur 2022, Wiley.
3. Caractérisation des NP IR783/BC
- Mesurez la taille moyenne des NP IR783/BC à l’aide d’un instrument de diffusion dynamique de la lumière (DLS) (voir le tableau des matériaux). Ajouter 200 μL de solution IR783/BC NP dans une cuvette et insérer la cuvette dans le support pour mesure. Définissez le type de mesure sur « taille » et la température de mesure sur 25 °C. Effectuer trois mesures d’une durée de 20 s pour chaque mesure.
- Mesurez la charge de surface des NP IR783/BC avec l’instrument DLS à l’aide d’une cuvette de test de potentiel zêta.
- Diluer 25 μL de solution de NP IR783/BC avec 725 μL d’eau désionisée dans un microtube de 1,5 mL et ajouter la solution dans une cuvette d’essai à potentiel zêta. Placez la cuvette dans la rainure de l’échantillon. Capsulez le sillon de l’échantillon.
- Définissez le type de mesure sur « potentiel zêta » et la température de mesure sur 25 °C. Effectuez 10 mesures.
- Préparer les échantillons pour l’imagerie par microscopie électronique à transmission (MET). Ajouter 10 μL de solution IR783/BC NP sur un morceau de film de carbone troué sur une grille de cuivre (300 mesh) et retirer 7 μL. Laisser 3 μL de solution sur le film pendant la nuit pour l’auto-évaporation.
REMARQUE : L’ajout de 10 μL de la solution NP suivi de l’élimination de 7 μL permet à la gouttelette de couvrir une zone plus large sur le film.
4. Photoactivation des NP IR783/BC
- Installez une lampe LED (530 nm; voir Tableau des matériaux) avec un support en fer de sorte que la lumière fasse directement face au plancher d’opération. Placez un photomètre à photodiode à sphère d’intégration (voir Tableau des matériaux) directement sous la lampe DEL.
REMARQUE: Pour éviter l’influence de la lumière ambiante, toutes les expériences d’irradiation de la lumière sont menées dans une chambre noire. - Allumez la lampe LED et ouvrez le capuchon du photomètre. Enregistrez l’irradiance et réglez les paramètres de la lampe à l’aide du logiciel associé (voir le tableau des matériaux). Ajustez le courant d’entrée (mA) pour régler l’éclairement énergétique sur 50 mW/cm2.
REMARQUE: L’éclairement énergétique est également affecté par la distance entre la lampe LED et le photomètre. Dans la configuration utilisée ici (Figure 3A,B), la distance est fixée à 5 cm. - Diluer la solution de NP IR783/BC avec de l’eau désionisée à 50 μM en fonction de la concentration de BC. Ajouter 200 μL de la solution IR783/BC NP dans un microtube de 1,5 mL. Placer le tube sur un bloc de mousse dont la taille du microtube est raccord à rainure et à la même hauteur que le photomètre à l’étape 4.1 (figure 3C,D).
- Ouvrez le capuchon du tube. Allumez la lampe LED et irradiez la solution de nanoparticules pendant 1, 2, 3, 5, 7 et 10 min.
- Quantifier la consommation de BC et le rejet de Cb par CLHP après irradiation lumineuse. Calculez le pourcentage de rejets restants de BC et de Cb à l’aide des équations suivantes :

5. Test de cytotoxicité des NP IR783/BC avec et sans irradiation lumineuse
- Culture de cellules HCT116 (lignée cellulaire de tumeur colorectale humaine) dans un milieu RPMI 1640 contenant 10% de sérum bovin fœtal et 1% de pénicilline-streptomycine (milieu complet) dans une atmosphère de 5% de CO2 à 37 °C (~2 x 106 cellules par boîte dans une boîte de culture cellulaire de 90 mm). Sous-culture régulière des cellules tous les 2-3 jours.
REMARQUE: HCT116 est une lignée cellulaire du côlon humain. Par rapport à d’autres cellules cancéreuses telles que les cellules HeLa, MCF7 et A549, les cellules HCT-116 expriment un niveau plus élevé de cavéoline-125, qui peut être ciblée par IR783 et améliorer l’absorption cellulaire des NP IR783 / BC. - Plaquer les cellules HCT116 dans des plaques de 96 puits avec le milieu complet RPMI 1640 à une densité de 104 cellules par puits.
- Aspirer le milieu de la boîte de culture lorsque la confluence cellulaire dépasse 50%. Lavez les cellules avec 1x PBS et retirez le PBS. Ajouter 1 mL de solution de trypsine à 0,25 % et incuber à 37 °C dans un incubateur à 5 % de CO2 .
- Après 3 min, ajouter 2 mL de milieu complet pour éteindre la digestion de la trypsine. Remettez les cellules en suspension, transférez la suspension cellulaire dans un tube de centrifugation de 15 mL et centrifugez à 300 x g pendant 3 min. Jeter le surnageant et remettre en suspension la pastille cellulaire dans 1 mL de milieu complet.
- Diluer 10 μL de la suspension cellulaire à 200 μL avec un milieu complet. Placez 10 μL sur un hémocytomètre et coiffez-le d’un couvercle.
- Observez l’hémocytomètre au microscope (oculaire : 10x ; objectif objectif : 4x). Comptez et notez les numéros de cellule aux quatre carrés d’angle et au centre. Calculez la concentration de la cellule à l’aide de la formule:
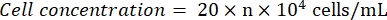
Où n = la moyenne des numéros de cellules des cinq carrés. - Diluer la suspension cellulaire à 1 x 105 cellules/mL. Ajouter 100 μL de la suspension cellulaire par puits dans une plaque de 96 puits pour ensemencer les cellules. Ajouter 100 μL de PBS par puits dans les puits non ensemencés.
- Traiter les cellules avec (1) 0,1-150 μM de BC libre, (2) 0,1-150 μM IR783/BC NPs (basé sur la concentration de BC), (3) 0,1-150 μM de BC libre avec irradiation lumineuse, ou (4) 0,1-150 μM IR783/BC NPs (basé sur la concentration BC) avec irradiation lumineuse. Incuber les cellules à 37 °C dans un incubateur à 5% de CO2 pendant 6 h.
REMARQUE: Les solutions libres BC et IR783/BC NP sont diluées à partir de leurs solutions mères respectives avec un milieu complet. - Après 6 h d’incubation, remplacer le milieu contenant des promédicaments/nanoparticules par un milieu complet frais. Incuber les groupes 1 et 2 non irradiés dans l’obscurité pendant 24 h. Pour les groupes 3 et 4, irradier les cellules avec une lampe LED de 530 nm (50 mW/cm2) pendant 5 min, et incuber pendant 24 h.
NOTE: Les plaques cellulaires sont placées sur un bloc de mousse pour assurer la même hauteur que le photomètre à l’étape 4.1. - Déterminer la viabilité cellulaire à l’aide du dosage du bromure de 3-(4,5-diméthylthiazol-2-yl)-2,5-diphényltétrazolium (MTT).
- Après le traitement BC ou nanoparticulaire, ajouter 10 μL de MTT (10 mg/mL dans PBS) à chaque puits et incuber les plaques à 37 °C pendant 3 h. Ensuite, retirez le milieu et ajoutez 100 μL de DMSO à chaque puits. Lisez l’absorbance avec un lecteur de microplaques à 490 nm, 570 nm et 630 nm.
- Calculez la viabilité de la cellule à l’aide de l’équation suivante :

NOTE: Quatre expériences indépendantes (n = 4) de chaque groupe sont menées pour analyse. OD490 peut être remplacé par OD570-OD 630 dans le calcul de la viabilité cellulaire.
Résultats
Les NP IR783/BC ont été fabriqués avec succès dans cette étude à l’aide d’une méthode de précipitation éclair. Les NP IR783/BC synthétisés se présentaient sous la forme d’une solution violette, tandis que la solution aqueuse d’IR783 était bleue (Figure 4A). Comme le montre la figure 4B, les NP IR783/BC présentaient une taille moyenne d’environ 87,22 nm avec un indice de polydispersité (PDI) de 0,089, démontrant une distribution de taill...
Discussion
Ce protocole décrit une méthode de précipitation éclair facile pour la fabrication de nanoparticules promédicament-colorant, qui offre une approche simple et pratique pour la formation de nanoparticules. Cette méthode comporte plusieurs étapes critiques. Tout d’abord, pour toutes les étapes de la synthèse, de la fabrication et de la caractérisation, les contenants comme les microtubes doivent être recouverts d’une feuille d’aluminium pour éviter le photoclivage inutile de la prodrogue BC par la lumière...
Déclarations de divulgation
Une demande PCT a été déposée auprès du n° .PCT/CN2021/081262.
Remerciements
Nous reconnaissons l’aide de l’installation principale de la faculté de médecine Li Ka Shing de l’Université de Hong Kong. Nous remercions le professeur Chi-Ming Che de l’Université de Hong Kong d’avoir fourni la lignée cellulaire HCT116 humaine. Ce travail a été soutenu par le Ming Wai Lau Centre for Reparative Medicine Associate Member Program et le Research Grants Council of Hong Kong (Early Career Scheme, No. 27115220).
matériels
| Name | Company | Catalog Number | Comments |
| 1260 Infinity II HPLC | Agilent Technologies | ||
| 2,4-Dimethyl pyrrole | J&K Scientific | 315305 | |
| 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide(MTT) | Gibco | M6494 | |
| 4-Dimethylaminopyridine (4-DMAP) | J&K Scientific | 212279 | |
| 90 mm Petri Dish Clear Treated Sterile | SPL | 11090 | |
| 96-well Tissue Culture Plate Clear Treated Sterile | SPL | 30096 | |
| Acetoxyacetyl chloride | J&K Scientific | 192001 | |
| Boron trifluoride diethyl etherate | J&K Scientific | 921076 | |
| Büchner funnel | AS ONE | 3-6466-01 | |
| Chlorambucil | J&K Scientific | 321407-1G | |
| CM100 Transmission Electron Microscope | Philips | ||
| CombiFlash RF chromatography system | Teledyne ISCO | ||
| Dichloromethane | DUKSAN Pure Chemicals | JT9315-88 | |
| Dimethyl sulfoxide | DUKSAN Pure Chemicals | 2762 | |
| Disposable cuvette | Malvern Panalytical | DTS1070 | Zeta potential measurement |
| Disposable cuvette | Malvern Panalytical | ZEN0040 | |
| Empty Disposable Sample Load Cartridges | Teledyne ISCO | 693873225 | can hold up to 65 g |
| Fetal bovine serum | Gibco | 10270106 | |
| Filtering flask | AS ONE | 3-7089-03 | |
| Hexane | DUKSAN Pure Chemicals | 4198 | |
| Holey carbon film on copper grid | Beijing Zhongjingkeyi Technology Co.,Ltd | BZ10023a | |
| HPLC column (InfinityLab Poroshell 120) | Agilent Technologies | 695975-902T | |
| Integrating sphere photodiode power sensor | Thorlabs | S142C | |
| IR783 | Tokyo Chemical Industry (TCI) Co., Ltd | I1031 | |
| LED | Mightex | LCS-0530-15-11 | |
| LED Driver Control Panel V3.2.0 (Software) | Mightex | ||
| Lithium Hydroxide Anhydrous | TCI | L0225 | |
| Methylmagnesium iodide, 3M solution in diethyl ether | Aladdin | M140783 | |
| N,N-Diisopropyl ethyl amine (DIPEA) | J&K Scientific | 203402 | |
| N,N'-Dicyclohexylcarbodiimide (DCC) | J&K Scientific | 275928 | |
| penicillin–streptomycin | Gibco | 15140122 | |
| Phosphate-buffered saline (10×) | Sigma-Aldrich | P5493 | |
| Power and energy meter | Thorlabs | PM100 USB | |
| Rotavapor | BUCHI Rotavapor R300 | ||
| RMPI 1640 | Gibco | 21870076 | |
| Separatory funnel (125 mL) | Synthware | F474125L | |
| Silver Silica Gel Disposable Flash Columns, 40 g | Teledyne ISCO | 692203340 | |
| Sodium sulfate, anhydrous | Alfa Aesar | A19890 | |
| SpectraMax M4 | Molecular Devices LLC | ||
| Tetrahydrofuran (THF), anhydrous | J&K Scientific | 943616 | |
| Trypsin-EDTA (0.25%), phenol red | Gibco | 25200056 | |
| Vortex | DLAB Scientific Co., Ltd | MX-S | |
| Zetasizer Nano ZS90 | Malvern Instrument |
Références
- Chabner, B. A., Roberts, T. G. Chemotherapy and the war on cancer. Nature Reviews Cancer. 5 (1), 65-72 (2005).
- Monsuez, J. -. J., Charniot, J. -. C., Vignat, N., Artigou, J. -. Y. Cardiac side-effects of cancer chemotherapy. International Journal of Cardiology. 144 (1), 3-15 (2010).
- Floyd, J., Mirza, I., Sachs, B., Perry, M. C. Hepatotoxicity of chemotherapy. Seminars in Oncology. 33 (1), 50-67 (2006).
- Bar-Joseph, H., Stemmer, S. M., Tsarfaty, I., Shalgi, R., Ben-Aharon, I. Chemotherapy-induced vascular toxicity-real-time in vivo imaging of vessel impairment. Journal of Visualized Experiments. (95), e51650 (2015).
- Denny, W. A. Prodrug strategies in cancer therapy. European Journal of Medicinal Chemistry. 36 (7-8), 577-595 (2001).
- Kastrati, I., Delgado-Rivera, L., Georgieva, G., Thatcher, G. R. J., Frasor, J. Synthesis and characterization of an aspirin-fumarate prodrug that inhibits NFκB activity and breast cancer stem cells. Journal of Visualized Experiments. (119), e54798 (2017).
- Mao, J., et al. A simple dual-pH responsive prodrug-based polymeric micelles for drug delivery. ACS Applied Materials & Interfaces. 8 (27), 17109-17117 (2016).
- Li, S. -. Y., et al. A pH-responsive prodrug for real-time drug release monitoring and targeted cancer therapy. Chemical Communications. 50 (80), 11852-11855 (2014).
- Andresen, T. L., Thompson, D. H., Kaasgaard, T. Enzyme-triggered nanomedicine: Drug release strategies in cancer therapy (Invited Review). Molecular Membrane Biology. 27 (7), 353-363 (2010).
- Xu, G., McLeod, H. L. Strategies for enzyme/prodrug cancer therapy. Clinical Cancer Research. 7 (11), 3314-3324 (2001).
- Luo, W., et al. Dual-targeted and pH-sensitive doxorubicin prodrug-microbubble complex with ultrasound for tumor treatment. Theranostics. 7 (2), 452 (2017).
- Gao, J., et al. Ultrasound triggered phase-change nanodroplets for doxorubicin prodrug delivery and ultrasound diagnosis: An in vitro study. Colloids and Surfaces B: Biointerfaces. 174, 416-425 (2019).
- Brade, A. M., Szmitko, P., Ngo, D., Liu, F. -. F., Klamut, H. J. Heat-directed suicide gene therapy for breast cancer. Cancer Gene Therapy. 10 (4), 294-301 (2003).
- Long, K., et al. One-photon red light-triggered disassembly of small-molecule nanoparticles for drug delivery. Journal of Nanobiotechnology. 19 (1), 357 (2021).
- Liu, Y., Long, K., Kang, W., Wang, T., Wang, W. Optochemical control of immune checkpoint blockade via light-triggered PD-L1 dimerization. Advanced NanoBiomed Research. 2 (6), 2200017 (2022).
- Wang, T., et al. Optochemical control of mTOR signaling and mTOR-dependent autophagy. ACS Pharmacology & Translational Science. 5 (3), 149-155 (2022).
- Abet, V., Filace, F., Recio, J., Alvarez-Builla, J., Burgos, C. Prodrug approach: An overview of recent cases. European Journal of Medicinal Chemistry. 127, 810-827 (2017).
- Li, G., et al. Small-molecule prodrug nanoassemblies: an emerging nanoplatform for anticancer drug delivery. Small. 17 (52), 2101460 (2021).
- Shamay, Y., et al. Quantitative self-assembly prediction yields targeted nanomedicines. Nature Materials. 17 (4), 361-368 (2018).
- Sinoway, P. A., Callen, J. P. Chlorambucil. Arthritis & Rheumatism. 36 (3), 319-324 (1993).
- Owen, W. R., Stewart, P. J. Kinetics and mechanism of chlorambucil hydrolysis. Journal of Pharmaceutical Sciences. 68 (8), 992-996 (1979).
- Lv, W., et al. Upconversion-like photolysis of BODIPY-based prodrugs via a one-photon process. Journal of the American Chemical Society. 141 (44), 17482-17486 (2019).
- Silver, J. Let us teach proper thin layer chromatography technique. Journal of Chemical Education. 97 (12), 4217-4219 (2020).
- Saad, W. S., Prud'homme, R. K. Principles of nanoparticle formation by flash nanoprecipitation. Nano Today. 11 (2), 212-227 (2016).
- Long, K., et al. Photoresponsive prodrug-dye nanoassembly for in-situ monitorable cancer therapy. Bioengineering & Translational Medicine. 7 (3), 10311 (2022).
- Zhong, T., et al. A self-assembling nanomedicine of conjugated linoleic acid-paclitaxel conjugate (CLA-PTX) with higher drug loading and carrier-free characteristic. Scientific Reports. 6 (1), 36614 (2016).
- Long, K., et al. Green light-triggered intraocular drug release for intravenous chemotherapy of retinoblastoma. Advanced Science. 8 (20), 2101754 (2021).
- Lv, W., Wang, W. One-photon upconversion-like photolysis: a new strategy to achieve long-wavelength light-excitable photolysis. Synlett. 31 (12), 1129-1134 (2020).
- Rwei, A. Y., Wang, W., Kohane, D. S. Photoresponsive nanoparticles for drug delivery. Nano Today. 10 (4), 451-467 (2015).
- Grzelczak, M., Vermant, J., Furst, E. M., Liz-Marzán, L. M. Directed self-assembly of nanoparticles. ACS Nano. 4 (7), 3591-3605 (2010).
- Gnanasammandhan, M. K., Idris, N. M., Bansal, A., Huang, K., Zhang, Y. Near-IR photoactivation using mesoporous silica-coated NaYF4:Yb,Er/Tm upconversion nanoparticles. Nature Protocols. 11 (4), 688-713 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon