Method Article
Le réseau d’anesthésie en série pour l’étude à haut débit d’agents volatils utilisant Drosophila melanogaster
Dans cet article
Résumé
La mouche des fruits (Drosophila melanogaster) est largement utilisée pour la recherche biologique et toxicologique. Pour étendre l’utilité des mouches, nous avons développé un instrument, le réseau d’anesthésie en série, qui expose simultanément plusieurs échantillons de mouches à des anesthésiques généraux volatils (AGV), ce qui permet d’étudier les effets collatéraux (toxiques et protecteurs) des VGA.
Résumé
Les anesthésiques généraux volatils (AGV) sont utilisés dans le monde entier sur des millions de personnes de tous âges et de toutes conditions médicales. Des concentrations élevées de VGA (des centaines de micromolaires à faiblement millimolaires) sont nécessaires pour obtenir une suppression profonde et non physiologique de la fonction cérébrale se présentant comme une « anesthésie » à l’observateur. Le spectre complet des effets collatéraux déclenchés par de telles concentrations élevées d’agents lipophiles n’est pas connu, mais des interactions avec le système immuno-inflammatoire ont été notées, bien que leur signification biologique ne soit pas comprise.
Pour étudier les effets biologiques des VGA chez les animaux, nous avons développé un système appelé réseau d’anesthésie en série (SAA) pour exploiter les avantages expérimentaux offerts par la mouche des fruits (Drosophila melanogaster). Le SAA se compose de huit chambres disposées en série et reliées à un flux d’entrée commun. Certaines pièces sont disponibles en laboratoire et d’autres peuvent être facilement fabriquées ou achetées. Un vaporisateur, nécessaire à l’administration calibrée des VGA, est le seul composant fabriqué commercialement. Les VGA ne constituent qu’un faible pourcentage de l’atmosphère traversant le SAA pendant le fonctionnement, car la majeure partie (généralement plus de 95%) est constituée de gaz vecteur; Le transporteur par défaut est Air. Cependant, l’oxygène et tout autre gaz peuvent être étudiés.
Le principal avantage de la SAA par rapport aux systèmes antérieurs est qu’elle permet l’exposition simultanée de plusieurs cohortes de mouches à des doses exactement titrables de VGA. Des concentrations identiques de VGA sont obtenues en quelques minutes dans toutes les chambres, fournissant ainsi des conditions expérimentales indiscernables. Chaque chambre peut contenir d’une seule mouche à des centaines de mouches. Par exemple, la SAA peut examiner simultanément huit génotypes différents ou quatre génotypes avec des variables biologiques différentes (p. ex., mâle vs femelle, vieux vs jeune). Nous avons utilisé le SAA pour étudier la pharmacodynamique des VGA et leurs interactions pharmacogénétiques dans deux modèles expérimentaux de mouches associés à la neuroinflammation-mitochondrie mutants et aux lésions cérébrales traumatiques (TBI).
Introduction
L’existence d’effets anesthésiques collatéraux (c.-à-d. des effets qui ne sont pas immédiatement observables mais qui peuvent avoir des conséquences comportementales différées) est généralement admise, mais la compréhension de leurs mécanismes et facteurs de risque reste rudimentaire 1,2. Leur manifestation tardive et leur subtilité limitent le nombre de variables potentiellement importantes qui peuvent être étudiées dans des modèles de mammifères dans des délais raisonnables et à un coût acceptable. La mouche des fruits (Drosophila melanogaster) offre des avantages uniques dans le cadre de la maladie neurodégénérative3 et pour le dépistage toxicologique4 qui, à ce jour, n’ont pas été appliqués à l’étude des effets collatéraux anesthésiques.
Nous avons développé le réseau d’anesthésie en série (SAA) pour faciliter l’utilisation des mouches des fruits dans l’étude de la pharmacodynamique anesthésique et de la pharmacogénétique. Un avantage clé de la SAA est l’exposition simultanée à des conditions expérimentales identiques de plusieurs cohortes. Associé à la flexibilité expérimentale des mouches des fruits, le débit élevé de la SAA permet l’exploration de variables biologiques et environnementales à une échelle impossible dans les modèles de mammifères.
En principe, le SAA est simplement une série d’emplacements d’anesthésie connectés (chambres constituées de flacons de 50 mL) à travers lesquels un gaz porteur délivre des agents volatils. La première chambre du système contient de l’eau distillée à travers laquelle le gaz porteur est humidifié (les mouches sont sensibles à la déshydratation), et elle se termine par un simple indicateur de débit qui indique le flux de gaz à travers le système. De fins filets placés sur les ouvertures des tubes de raccordement séparent les chambres pour empêcher la migration des mouches entre les chambres. Le nombre d’emplacements « en série » est limité par la résistance à l’écoulement de gaz non pressurisé (tubes, filets).
Nous avons caractérisé la cinétique de ce prototype SAA dans une précédente publication5. Bien que les propriétés pharmacocinétiques exactes varient d’un AAS à l’autre, les bases pertinentes qui ont été testées expérimentalement sont les suivantes : (i) un débit initial de 1,5-2 L/min équilibre toutes les chambres (volume total de ±550 mL) avec la concentration souhaitée d’anesthésique en 2 minutes ; ii) la concentration de vapeur anesthésique délivrée dans les chambres ne change pas sensiblement entre le premier et le dernier emplacement parce que la quantité d’anesthésique contenue dans le volume de gaz dans une chambre individuelle (50 mL) dépasse de loin la quantité absorbée par un nombre quelconque de mouches; et (iii) une fois que les chambres sont équilibrées, le débit de gaz porteur peut être réduit (50-100 mL/min ou moins) pour éviter le gaspillage et la contamination de l’environnement (les anesthésiques volatils ont des propriétés de gaz à effet de serre). Le débit minimal nécessaire pour maintenir une concentration de vapeur à l’état d’équilibre dépend principalement de la fuite du SAA, car l’absorption de vapeur par les mouches est négligeable. Dans ces conditions standard (2 % d’isoflurane et débit de gaz porteur de 1,5 L/min), les mouches sont anesthésiées (c.-à-d. immobiles) dans toutes les positions du réseau en 3 à 4 minutes, avec des différences imperceptibles entre les positions. Les VGA peuvent être administrés pendant quelques minutes à quelques heures, et nos paradigmes d’exposition typiques sont compris entre 15 min et 2 h. Pour rincer le système, le vaporisateur est éteint et le débit est maintenu pour échanger environ 10x les volumes du réseau (1,5 L/min pendant 5 min). La vitesse d’élimination de l’anesthésique variera avec le débit défini.
Les agents anesthésiques volatils interagissent avec de nombreuses cibles encore non identifiées, y compris le système immuno-inflammatoire6. La contribution des cibles moléculaires individuelles aux résultats primaires par rapport aux résultats collatéraux (« l’état anesthésique » par rapport aux « effets secondaires » à long et à court terme) est mal comprise. Par conséquent, un système de mouches sensible et à haut débit est précieux pour éclairer les expériences sur les animaux supérieurs, malgré les différences évidentes entre les mouches et les mammifères7. Certaines différences peuvent, en fait, être avantageuses; Par exemple, le système immunitaire de la mouche diffère de celui des animaux supérieurs en ce qu’il lui manque le bras adaptatif de la réponse8. Bien que cela puisse sembler une limitation pour comprendre la maladie chez l’homme, cela offre une occasion unique d’étudier l’interaction des VGA avec la réponse immuno-inflammatoire innée indépendamment de la réponse adaptative9. Cela permet d’étudier les effets pharmacologiques de l’AGV sur l’inflammation et leur modulation par les antécédents génétiques variés présents dans une population.
Protocole
REMARQUE : Consultez le tableau des matériaux pour plus de détails sur tous les matériaux utilisés dans le protocole.
1. Construction de la SAA
- Fabriquez le cadre en coupant du bois et en assemblant le cadre en utilisant les dimensions de la figure 1A.
- Modifier les capsules de tubes coniques de 50 mL.
- Percez deux trous dans chaque bouchon avec un foret de 9/32 po. Poncez les trous pour nettoyer le plastique déchiqueté. Poncez le haut du capuchon pour rendre la surface rugueuse (cela aide à l’adhérence de la colle).
- Couper 5 mL de pipettes sérologiques à la taille (3 po pour l’entrée et 1,5 po pour l’écoulement) en entaillant le plastique, puis en le cassant à la ligne de pointage. Poncer les extrémités des pipettes coupées/cassées.
- Collez le filet sur les tubes (laissez le temps de séchage approprié pour l’adhésif). Coupez le filet à la taille du tube après le séchage de l’adhésif.
- Insérez les tubes dans les trous des bouchons coniques avec les deux tubes s’étendant (3/4 po) au-dessus du bouchon; s’assurer que le tube d’entrée s’étend plus longtemps dans le tube que le tube sortant (figure 1B).
- Appliquez de la colle sur le dessus des bouchons autour des tubes pour fixer les pièces ensemble (laisser sécher l’adhésif avant de continuer).
- Fixez les capuchons au cadre et acheminez le tube (Figure 1C).
- Fixez les attaches de câble adhésif au cadre (3,25 po d’écart, centre à centre).
- Fixez les bouchons sur le cadre à l’aide de liens zippés; Coupez les extrémités courtes de l’étiquette de cravate zippée.
- Couper et raccorder les longueurs (9 po) des tubes Tygon aux tubes d’entrée/sortie de chaque bouchon modifié (figure 1D). En commençant par l’extrémité en amont, fixez d’abord à l’entrée, puis fixez ensuite le tube de l’écoulement sortant à l’entrée de la position suivante.
- Ajouter un indicateur de débit au « débit entrant » le plus en aval (position 10, figure 1E).
- Placez un tube conique de 50 mL en première position et remplissez-le d’eau juste en dessous du tube d’entrée (figure 1F).
- Préparez l’interface pour le vaporisateur. Retirez les pistons, découpez les encoches de deux seringues distributrices de 10 ml (1/2 po de profondeur x 1/4 po de largeur, Figure 1G) et insérez-les dans le flux entrant et sortant du vaporisateur, les encoches étant tournées directement vers l’avant du vaporisateur pour les aligner avec les trous (Figure 1H). Facultatif : Collez les seringues modifiées en place. Si c’est abordable, utilisez un collecteur commercial (voir le tableau des matériaux pour une option).
- Branchez l’ensemble du système. Utilisez le tube Tygon pour fixer les composants ensemble dans l’ordre suivant : réservoir de gaz porteur avec régulateur > débitmètre spécifique au gaz > vaporisateur > SAA (Figure 1C).
- Remplissez les positions vides sur le réseau avec des tubes coniques vides de 50 mL. Allumez le réservoir d’essence, ouvrez le débitmètre à ~2 L/min et allumez le vaporisateur à 0%. Confirmez le débit de gaz à travers le système en vérifiant le débitmètre en amont du vaporisateur et l’indicateur de débit en aval de la dernière chambre de la SAA pour le débit. Vous pouvez également insérer l’extrémité du tube en aval dans l’eau et rechercher des bulles.
REMARQUE: Comme le système n’est pas sous pression, une colonne d’eau de plus de quelques centimètres arrêtera l’écoulement. S’il n’y a pas d’écoulement à l’extrémité aval du réseau, vérifiez les points suivants : le vaporisateur doit être allumé pour permettre l’écoulement ; vérifier que le régulateur de réservoir et les débitmètres permettent le débit; vérifier les positions des matrices pour s’assurer que les tubes sont bien vissés; et vérifier s’il y a des fuites autour de l’adhésif sur les bouchons modifiés.
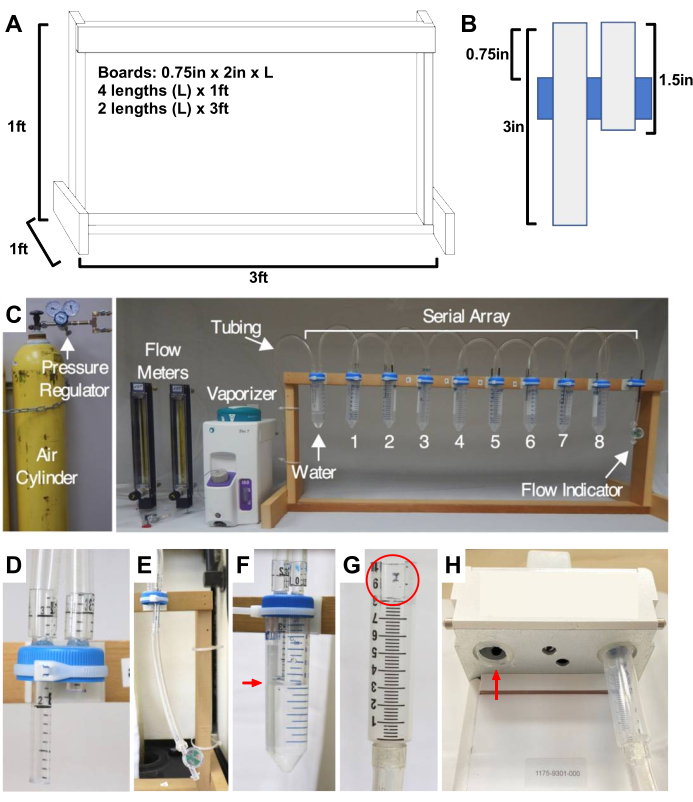
Figure 1 : Construction de la SAA. (A) Schéma, avec mesures, du cadre en bois qui supporte le SAA. (B) Coupe transversale schématisée, avec mesures, d’un bouchon modifié avec tubes d’entrée et de sortie constitués de pipettes sérologiques de 5 mL. (C) SAA assemblé (reproduit d’après Olufs et coll.5) (D) Détails d’un bouchon conique modifié de 50 mL montrant les tubes d’entrée et de sortie. E) Débit sortant en aval (position 10) avec l’indicateur de débit. F) Tube rempli d’eau en amont (position 1) pour humidifier le gaz vecteur. La flèche rouge indique le niveau d’eau. (G) Seringue de distribution modifiée de 10 mL pour le collecteur de fortune. Le cercle rouge met en évidence l’encoche de découpe située entre les marques de 8 ml et de 10 ml (ou 1/2 po x 1/4 po). H) Vue arrière du vaporisateur Tec7 montrant l’insertion et l’orientation des seringues modifiées. Une seule seringue est en place dans cette vue pour montrer, à gauche, le trou (flèche rouge) qui doit être aligné avec l’encoche de la seringue modifiée. Remarque : Un désalignement de cette encoche de découpe et de l’ouverture de sortie perturbera l’administration de l’anesthésique. Cette partie est un point faible potentiel dans ce système sur mesure. Si des fonds sont disponibles, un collecteur commercial devrait être utilisé. Abréviation : SAA = réseau d’anesthésie en série. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Avant l’exposition anesthésique
- Vingt-quatre heures ou plus avant l’exposition anesthésique, trier les cohortes de mouches au besoin pour l’expérience en utilisant la méthode préférée (p. ex. CO2 ou éther).
3. Fonctionnement de l’ASA
- Transvaser les mouches des flacons alimentaires dans des tubes coniques vides de 50 ml (sans CO2).
- Compter et noter toutes les mouches mortes avant l’exposition.
- Déboucher et visser des tubes coniques de 50 ml avec des mouches sur le SAA.
- Allumez le gaz porteur et réglez le débit souhaité.
REMARQUE: Nous utilisons généralement 1-2 L / min. - Réglez le vaporisateur anesthésique à la concentration souhaitée.
NOTE: Nous utilisons généralement 2% pour l’isoflurane et 3,5% pour le sévoflurane, qui sont des doses équipotentes chez les mammifères10. - Exposez les mouches pendant la durée souhaitée (min: 15 min).
NOTE: Un temps d’exposition minimum de 15 minutes est recommandé pour éviter une éventuelle variabilité de l’équilibrage entre les positions du SAA. Dans ce système, il faut 2 à 3 minutes pour que les anesthésiques s’équilibrent dans toutes les positions. - À la fin de l’exposition, rincer le système avec un débit de gaz frais (vaporisateur réglé à 0%) à 1,5 L/min pendant 5 min correspondant à environ 10x les volumes du volume total de SAA.
4. Liste de contrôle avant de commencer une expérience
- Ouvrez complètement le régulateur haute pression (sur le dessus du réservoir d’air), puis fermez-le un demi-tour pour assurer le débit du gaz vecteur.
- Suivez les tubes pour chaque ligne jusqu’aux i) débitmètres et ii) vaporisateur (assurez-vous que les flux entrants / sortants sont correctement connectés), et iii) vérifiez le niveau d’anesthésie dans les vaporisateurs.
- Après avoir chargé les chambres avec des sujets, vérifiez que l’air/gaz circule avec le test de bulle ou l’indicateur de débit.
REMARQUE: Certains vaporisateurs ne permettent pas la circulation de l’air lorsque le cadran est en position d’arrêt. - Lorsque le gaz circule, confirmez que le débitmètre et l’indicateur de débit en aval indiquent le débit.
- À la fin de l’expérience, prévoyez 4 à 5 minutes de débit d’air pour éliminer l’anesthésique.
Résultats
Un lien vidéo SAA est fourni ici: Perouansky Research Methods - Department of Anesthesiology - UW-Madison (wisc.edu) (https://anesthesia.wisc.edu/research/researchers/perouansky-laboratory/perouansky-research-methods/) Notre laboratoire a utilisé la SAA pour (i) étudier l’effet du génotype sur la sensibilité comportementale aux anesthésiques5; ii) dépister les effets collatéraux des anesthésiques chez les mutants mitochondriaux11; et (iii) étudier la pharmacodynamique de l’isoflurane et du sévoflurane sur les résultats des lésions cérébrales traumatiques (TCC)12,13,14,15,16,17. Les résultats publiés démontrent clairement que le fond génétique influence la pharmacodynamique des VGA utilisés cliniquement en ce qui concerne à la fois le phénotype conventionnel de l’anesthésie et les effets collatéraux de la toxicité anesthésique, ainsi que la protection tissulaire 5,11,13,14,15.
Exemple représentatif 1 (Figure 2) : Dérive génétique de la résilience à la toxicité de l’isoflurane détectée par des conditions expérimentales reproductibles fiables
La découverte d’un changement quantitatif progressif de la mortalité induite par l’AGV chez les mouches ND2360114 cultivées séparément est un exemple de l’utilité de comparaisons fiables de la pharmacodynamique anesthésique entre les groupes expérimentaux utilisant le SAA. ND23 est un gène codant pour une sous-unité au cœur du complexe I du mETC (analogue à Ndufs8 chez les mammifères)18. Les mutations dans cette sous-unité sont une cause du syndrome de Leigh, une maladie mitochondriale mortelle. Nous avons observé un affaiblissement progressif du phénotype de mortalité induite par l’isoflurane au fil du temps dans divers stocks homozygotes ND2360114 cultivés simultanément dans des conditions de laboratoire standard (c.-à-d. sans exposition aux VGA). Cette adaptation évolutive à la toxicité isoflurane s’est produite en l’absence de toute exposition aux VGA et est probablement un effet collatéral de la « survie du plus apte » au sein des stocks mutants. Ce changement graduel de la sensibilité à l’isoflurane serait resté inconnu sans notre confiance que les conditions expérimentales étaient identiques d’un essai à l’autre et au fil du temps. Nous concluons que la sélection favorise les modificateurs des effets de ND2360114, avec par coïncidence une résilience accrue à la toxicité de l’isoflurane. Comme l’inflammation du système nerveux central joue un rôle important dans la pathogenèse du syndrome de Leigh, l’évolution observée de la résistance peut être due à des changements adaptatifs dans la réponse immuno-inflammatoire innée, la résistance à la toxicité isoflurane étant un sous-produit accidentel.
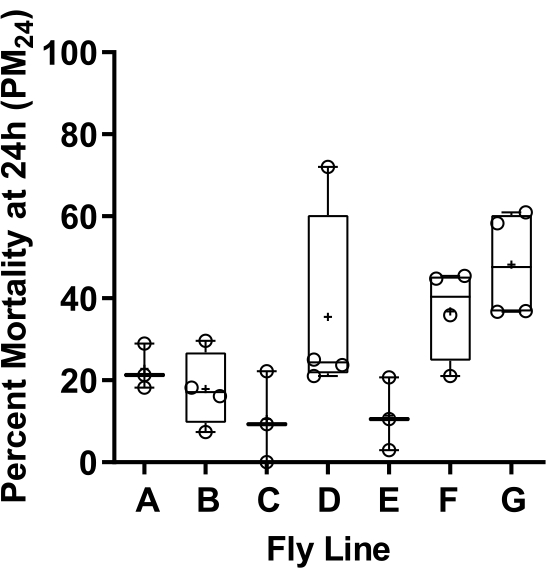
Figure 2 : Variation de la mortalité induite par la toxicité de l’isoflurane à la suite de la pression évolutive chez les mouches ND2360114. Sept lignées (A-G) isolées d’une seule population par des accouplements à une paire, élargies et testées pour la mortalité sur 24 h (PM24) après une exposition de 2 heures à 2 % d’isoflurane (à l’âge de 10-13 jours) montrent une variabilité du phénotype provenant d’une seule population. Données présentées sous forme de diagrammes en boîtes et en moustaches. Les cases représentent les deuxième et troisième quartiles des données, les moustaches s’étendant jusqu’aux points de données minimum et maximum. La moyenne et la médiane sont indiquées respectivement par « + » et horizontales. Le pourcentage de mortalité des répliques individuelles (N) est représenté sous forme de cercles. N = 3-4 flacons de 20-50 mouches/flacon. Valeur de p pour une ANOVA unidirectionnelle ordinaire; p = 0,012 indique une différence significative entre les moyennes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Exemple représentatif 2 (Figure 3) : Illustration d’une application à haut débit du SAA pour révéler les effets génétiques de base sur la pharmacodynamique de l’isoflurane
À titre d’exemple du débit élevé du système, la figure 3 illustre les effets d’expositions identiques à l’isoflurane (15 min d’isoflurane à 2 %) avant une lésion cérébrale traumatique (TCC)16, un protocole testant le préconditionnement anesthésique (AP) dans ce modèlede mouche 13,15,19. La lecture est la mortalité 24 heures après le TCC corrigé de l’attrition naturelle (IM24). Dans ce modèle, toutes les mouches ont retrouvé leur mobilité (c.-à-d. qu’elles étaient vivantes) dans les 30 minutes suivant le TCC, et la mortalité enregistrée dans l’IM24 était le résultat d’une lésion cérébrale secondaire (sBI). Dans les quatre lignées de mouches, l’AP avec de l’isoflurane a réduit le MI24 à divers degrés, indiquant que la réactivité à l’AP est un trait quantitatif. Comme la réponse inflammatoire est un facteur important de morbidité due à l’IBS, l’AP peut impliquer une modulation du système immunitaire20.
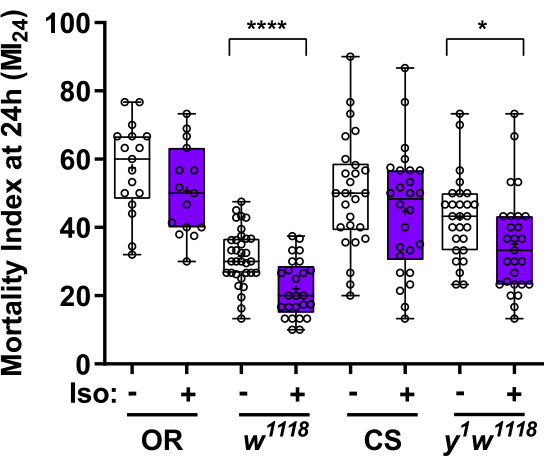
Figure 3 : Influence du fond génétique sur la suppression de la mortalité (IM24) par préconditionnement à l’isoflurane. Les mouches de préconditionnement avec 15 min d’isoflurane à 2% (violet) ont réduit l’indice de mortalité à 24 h (MI24) chez les souches w 1118 et y1w1118 (p < 0,0001 et p = 0,036, respectivement). Le MI 24 n’était pas significativement plus faible dans les raies préconditionnées Oregon R (OR) et Canton S (CS) (p = 0,16 et p =0,27, respectivement). Données présentées sous forme de diagrammes en boîtes et en moustaches. Les cases représentent les deuxième et troisième quartiles des données, les moustaches s’étendant jusqu’aux points de données minimum et maximum. La moyenne et la médiane sont indiquées respectivement par « + » et horizontales. Les valeurs MI24 des répliques individuelles (N) sont indiquées sous forme de cercles. N = 15-33 flacons de 30-40 mouches/flacon pour les mouches traitées par TBI. N = 2 à 15 flacons de 30 à 40 mouches/flacon pour les témoins non traités. Valeurs p d’un test t de Student bilatéral non apparié. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Les étapes critiques de la construction de la SAA comprennent la mise en place de raccords étanches pour éviter les fuites du mélange anesthésique de gaz. Le SAA doit être logé dans une hotte pour éviter la contamination de l’espace du laboratoire. Tous les éléments, des bouteilles de gaz vecteur à l’indicateur de débit en aval de l’ASA, doivent être vérifiés comme indiqué dans la liste de contrôle.
D’autres méthodes d’administration d’AGV aux mouches sont compliquées à utiliser (l’inébriomètre)21, ont un faible débit 22, ne permettent pas l’exposition simultanée de plusieurs populations 23, ne permettent pas un contrôle précis de la concentration anesthésique 21, ou ont une lecture difficile à traduire en termes cliniquement acceptés 24.
La version actuelle du SAA repose sur un vaporisateur commercial et, par conséquent, les études toxicologiques sont limitées aux anesthésiques volatils. S’il est utilisé avec d’autres substances volatiles, un vaporisateur peut être utilisé « hors étiquette » après avoir étalonné la sortie. Alternativement, une méthode différente de vaporisation des substances volatiles pourrait être appliquée, ce qui nécessiterait des mesures dédiées pour titrer les concentrations de médicaments, comme décrit précédemment25.
En dehors des indicateurs de débit, il n’y a pas d’alarmes (c’est-à-dire que si les réservoirs sont vides, le débit à travers la SAA sera interrompu). Selon l’intensité de l’utilisation, le SAA peut nécessiter un nettoyage, un serrage et éventuellement le remplacement du tube Tygon. Nous avons effectué une « maintenance » sur notre SAA d’origine deux fois en 7 ans d’utilisation.
Cette méthode d’anesthésie des mouches des fruits permet l’utilisation de la boîte à outils génétique à la disposition des chercheurs sur la drosophile dans un système à haut débit. Plusieurs cohortes de mouches de différentes populations (p. ex. génotype, âge, sexe) peuvent être exposées simultanément à des concentrations anesthésiques identiques et à la combinaison souhaitée de gaz vecteur (air,O2,N2O, gaz rares) adaptée à la question de recherche à l’étude.
Nous montrons ici que le SAA a été utile pour révéler des changements inattendus dans la résilience à la toxicité de l’isoflurane dans la ligne de mouche ND2360114 et que les lignées de mouches de laboratoire standard diffèrent dans leur réactivité à l’AP. L’identification de ces résultats a été possible en raison du contrôle étroit des conditions expérimentales et du débit élevé de la SAA.
Le SAA peut être adapté pour étudier les effets d’autres composés organiques volatils (COV) sur les insectes (p. ex., les abeilles). Pour les COV dont la pression de vapeur est proche de celle des anesthésiques volatils (isoflurane : 240 mmHg à 20 °C), des vaporisateurs classiques pourraient être utilisés, mais la sortie devrait être étalonnée. Le vaporisateur commercial de desflurane est chauffé, ce qui offre potentiellement une flexibilité supplémentaire.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à déclarer.
Remerciements
Nous remercions Mark G. Perkins, Pearce Laboratory, Département d’anesthésiologie, Université du Wisconsin-Madison, pour la construction du prototype de la SAA. Le travail est soutenu par le National Institute of General Medical Sciences (NIGMS) avec R01GM134107 et par le fonds de R & D du Département d’anesthésiologie de l’Université du Wisconsin-Madison.
matériels
| Name | Company | Catalog Number | Comments |
| Serial Anesthesia Array: | |||
| 5 mL Serological Pipettes | Fisher Scientific | 13-676-10C | Polystyrene, 5mL serological pipette |
| 50 mL Conical Tubes | Fisher Scientific | 1495949A | Polypropylene, 50 mL |
| Cable Tie Mounting Pad | Grainger | 6EEE6 | 1.25 inch L x 1 inch W x 0.28 inch H |
| Dispensing Syringe | Grainger | 5FVE0 | 10 mL with Luer-Lock Connection |
| Fabric Mesh Netting | 1 mm mesh | ||
| Flow Indicator | Grainger | 8RH52 | 5/16 to 1/2 inch connection size, paddle wheel style |
| Tygon Tubing | Tygon | E-3603 | ID: 5/16, OD: 7/16, wall: 1/16 |
| Wood Frame | 10 feet of 2 inch x 3/4 inch | ||
| Zip Tie | >5inch | ||
| Vaporizer Interface (Budget Alternative to Manifold): | |||
| Dispensing Syringe | Grainger | 5FVE0 | 10 mL with Luer-Lock Connection |
| Commercial Manifold and Vaporizers: | |||
| 1/4 inch Equal Barbed Y Connector | Somni Scientific | BF-9000 | |
| 1/8 inch NPT to 1/4 inch Barbed Elbow (Plastic) | Somni Scientific | BF-9004 | |
| AIR 0-4 LPM Flowmeter w/ black knob | Somni Scientific | FP-4002 | |
| Flowmeter auxiliary mounting bracket | Somni Scientific | NonInvPart | |
| Medical Air, 1/8 inch NPT Male x DISS Male | Somni Scientific | GF-11012 | |
| TT-2 Table Top Anesthesia System, built in dual diverter valve system. Includes 6' color coded tubing X2. (Vaporizer not Included) | Somni Scientific | TT-17000 | |
| Tec 7 Isoflurane Vaporizer | GE Datex-Ohmeda | 1175-9101-000 | Agent-specific vaporizer (Isoflurane) |
| Tec 7 Sevoflurane Vaporizer | GE Datex-Ohmeda | 1175-9301-000 | Agent-specific vaporizer (Sevoflurane) |
Références
- Jevtovic-Todorovic, V., et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing rat brain and persistent learning deficits. The Journal of Neuroscience. 23 (3), 876-882 (2003).
- Vutskits, L., Xie, Z. Lasting impact of general anaesthesia on the brain: Mechanisms and relevance. Nature Reviews Neuroscience. 17 (11), 705-717 (2016).
- McGurk, L., Berson, A., Bonini, N. M. Drosophila as an in vivo model for human neurodegenerative disease. Genetics. 201 (2), 377-402 (2015).
- Rand, M. D. Drosophotoxicology: The growing potential for Drosophila in neurotoxicology. Neurotoxicology and Teratology. 32 (1), 74-83 (2010).
- Olufs, Z. P. G., Loewen, C. A., Ganetzky, B., Wassarman, D. A., Perouansky, M. Genetic variability affects absolute and relative potencies and kinetics of the anesthetics isoflurane and sevoflurane in Drosophila melanogaster. Scientific Reports. 8, 2348 (2018).
- Stollings, L. M., et al. Immune modulation by volatile anesthetics. Anesthesiology. 125 (2), 399-411 (2016).
- Yamaguchi, M., Yoshida, H. . Drosophila as a model organism. In Drosophila Models for Human Diseases., edited by. , 1-10 (2018).
- Hoffmann, J. A. The immune response of Drosophila. Nature. 426 (6962), 33-38 (2003).
- Buchon, N., Silverman, N., Cherry, S. Immunity in Drosophila melanogaster-From microbial recognition to whole-organism physiology. Nature Reviews Immunology. 14 (12), 796-810 (2014).
- Shaughnessy, M. R., Hofmeister, E. H. A systematic review of sevoflurane and isoflurane minimum alveolar concentration in domestic cats. Veterinary Anaesthesia and Analgesia. 41 (1), 1-13 (2014).
- Olufs, Z. P. G., Ganetzky, B., Wassarman, D. A., Perouansky, M. Mitochondrial complex I mutations predispose Drosophila to isoflurane neurotoxicity. Anesthesiology. 133 (4), 839-851 (2020).
- Johnson-Schlitz, D., et al. Anesthetic preconditioning of traumatic brain injury is ineffective in a Drosophila model of obesity. Journal of Pharmacology and Experimental Therapeutics. 381 (3), 229-235 (2022).
- Schiffman, H. J., Olufs, Z. P. G., Lasarev, M. R., Wassarman, D. A., Perouansky, M. Ageing and genetic background influence anaesthetic effects in a D. melanogaster model of blunt trauma with brain injury. British Journal of Anaesthesia. 125 (1), 77-86 (2020).
- Scharenbrock, A. R., Schiffman, H. J., Olufs, Z. P. G., Wassarman, D. A., Perouansky, M. Interactions among genetic background, anesthetic agent, and oxygen concentration shape blunt traumatic brain injury outcomes in Drosophila melanogaster. International Journal of Molecular Sciences. 21 (18), 6926 (2020).
- Fischer, J. A., Olufs, Z. P. G., Katzenberger, R. J., Wassarman, D. A., Perouansky, M. Anesthetics influence mortality in a Drosophila model of blunt trauma with traumatic brain injury. Anesthesia & Analgesia. 126 (6), 1979-1986 (2018).
- Katzenberger, R. J., et al. A Drosophila model of closed head traumatic brain injury. Proceedings of the National Academy of Sciences of the United States of America. 110 (44), E4152-E4159 (2013).
- Katzenberger, R. J., et al. A method to inflict closed head traumatic brain injury in Drosophila. Journal of Visualized Experiments. (100), e52905 (2015).
- Loewen, C. A., Ganetzky, B. Mito-nuclear interactions affecting lifespan and neurodegeneration in a Drosophila model of Leigh syndrome. Genetics. 208 (4), 1535-1552 (2018).
- Johnson-Schlitz, D., et al. Anesthetic preconditioning of traumatic brain injury is ineffective in a Drosophila model of obesity. Journal of Pharmacology and Experimental Therapeutics. 381 (3), 229-235 (2022).
- Li, H., et al. Isoflurane postconditioning reduces ischemia-induced nuclear factor-kappaB activation and interleukin 1beta production to provide neuroprotection in rats and mice. Neurobiology of Disease. 54, 216-224 (2013).
- Leibovitch, B. A., Campbell, D. B., Krishnan, K. S., Nash, H. A. Mutations that affect ion channels change the sensitivity of Drosophila melanogaster to volatile anesthetics. Journal of Neurogenetics. 10 (1), 1-13 (1995).
- Tinklenberg, J. A., Segal, I. S., Guo, T. Z., Maze, M. Analysis of anesthetic action on the potassium channels of the Shaker mutant of Drosophila. Annals of the New York Academy of Sciences. 625, 532-539 (1991).
- Gamo, S., Ogaki, M., Nakashima-Tanaka, E. Strain differences in minimum anesthetic concentrations in Drosophila melanogaster. Anesthesiology. 54 (4), 289-293 (1981).
- Campbell, J. L., Nash, H. A. The visually-induced jump response of Drosophila melanogaster is sensitive to volatile anesthetics. Journal of Neurogenetics. 12 (4), 241-251 (1998).
- Perouansky, M., Hentschke, H., Perkins, M., Pearce, R. A. Amnesic concentrations of the nonimmobilizer 1,2-dichlorohexafluorocyclobutane (F6, 2N) and isoflurane alter hippocampal theta oscillations in vivo. Anesthesiology. 106 (6), 1168-1176 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon